Физиология человека, 2021, T. 47, № 4, стр. 26-35
Применение “космической” электромиостимуляции в земной клинической кардиологии
М. Г. Полтавская 1, *, В. П. Свириденко 1, А. В. Бранд 1, Д. А. Андреев 1, Ю. А. Коряк 2, Г. О. Велиев 1, О. Н. Дикур 1, В. М. Куликов 1, Ю. Д. Вайсман 1, Е. С. Томиловская 2
1 ФГАОУ ВО Первый московский государственный медицинский университет
имени И.М. Сеченова МЗ России
Москва, Россия
2 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: m.poltavskaya@yandex.ru
Поступила в редакцию 09.02.2021
После доработки 19.03.2021
Принята к публикации 23.03.2021
Аннотация
В статье описывается серия исследований эффективности метода электромиостимуляции, разработанного под руководством Инесы Бенедиктовны Козловской для системы профилактики негативных влияний факторов космического полета на мышечную систему, в реабилитации пациентов, госпитализированных с декомпенсированной хронической сердечной недостаточностью. Показано, что низкочастотная нервно-мышечная электростимуляция нижних конечностей благоприятно отражается на физической работоспособности и активности пациентов, их оценке качества жизни и общего самочувствия. По эффективности электростимуляция существенно превышает плацебо и сравнима с интервальными тренировками на велоэргометре низкой-средней интенсивности, хорошо переносится, не сопровождается существенными изменениями центральной гемодинамики, углеводного и липидного обмена, почечной функции и маркеров мышечного повреждения. Разработанный метод может использоваться в реабилитации пациентов с сердечной недостаточностью, которые не могут или не желают тренироваться обычными способами.
Инеса Бенедиктовна Козловская была инициатором внедрения целого ряда реабилитационных методик, разработанных для длительных космических полетов (КП), в земную медицину. Одной из таких методик явилась нейромышечная стимуляция.
Электромиостимуляция (ЭМС) основана на восстановлении нормального уровня электрической активности мышц за счет применения электрического тока с параметрами импульсации, характерными для паттерна иннервации быстрых (50–60 Гц) или медленных (10 Гц) двигательных единиц. В спортивной медицине применяются в основном высокочастотные паттерны импульсации (до 100 Гц) [1]. ЭМС применяется как напрямую (электроды накладываются на кожу и ток воздействует непосредственно на мышцу), так и косвенно, путем стимуляции нерва, иннервирующего мышцу. Это приводит к активации мышечных волокон и к их сокращению, и таким образом позволяет поддерживать активность мышцы. Нейромышечная стимуляция (НМЭС) применяется для коррекции или профилактики мышечной атрофии у различных групп пациентов [2], а также в спортивной медицине для достижения максимальных силовых и скоростных показателей [3]. Применение электростимуляции мышц в качестве меры профилактики изменений, вызываемых функциональной разгрузкой, является единственно возможной мерой профилактики для пациентов, которые по тем или иным причинам не могут выполнять физические упражнения, к примеру, находятся в бессознательном состоянии. Так, рандомизированное исследование показало эффективность высокочастотной ЭМС в предотвращении атрофии четырехглавой мышцы бедра у пациентов, находящихся в реанимации [4]. Недавние исследования показали, что стимуляция с частотой 50 Гц приводит к повышению трофики мышечных волокон “быстрого” типа в четырехглавой мышце бедра у больных раком, проходящих химиотерапию, не предотвращая снижения числа митохондрий [5]. В спортивной медицине ЭМС часто применяется при восстановлении спортсменов после травм, ортопедических операций, на фоне гипсовой иммобилизации конечности. Применение стимуляции частотой 50 Гц у атлетов после операции по восстановлению передней крестообразной связки приводило к частичному предотвращению снижения силы четырехглавой мышцы бедра, хотя и не предотвращало атрофии исследуемой мышцы [6]. Вместе с тем, сеансы ЭМС с частотой 30 Гц на протяжении 40 дней иммобилизации ноги из-за перелома голени приводили к предотвращению снижения уровня синтеза белка и атрофии четырехглавой мышцы бедра по сравнению с контралатеральной ногой [7].
В отличие от высокочастотной стимуляции, низкочастотная применяется в реабилитации пациентов с хроническим системным поражением скелетных мышц, например, в результате травмы спинного мозга. Низкочастотная ЭМС оказывает эффект, в первую очередь, на содержание митохондриальных ферментов, окислительные способности мышцы и устойчивость мышцы к утомлению. Исследования на грызунах, проведенные еще в 80-х гг. XX в., показали, что хроническая низкочастотная миостимуляция приводит к трансформации фенотипа волокон “быстрых” мышц в “медленную” сторону, к росту капилляризации, увеличению количества митохондриальных ферментов и повышению устойчивости мышц к утомлению [8]. Повышение устойчивости к утомлению при низкочастотной стимуляции наблюдалось и на передней большеберцовой мышце у человека [9, 10].
Эффекты электростимуляции мышц применительно к пратике КП начали исследовать еще в 70-х гг. прошлого века на наземных моделях – в экспериментах с длительной постельной гипокинезией. В этих экспериментах было показано, что применение высокочастотной нейромышечнной электростимуляции с помощью аппарата “Тонус-2” (Россия) предотвращает снижение площади поперечного сечения волокон камбаловидной мышцы [11]. Низкочастотная НМЭС с частотой 15 Гц у здоровых добровольцев позволяла повысить выносливость мышц, однако максимальная сила сокращения и размеры мышечных волокон мышц-разгибателей колена снижались. Этот негативный эффект можно было предотвратить, проводя стимуляцию на фоне растяжения мышц [12].
Первое экспериментальное использование электромиостимуляторов и испытание их эффективности на борту орбитальных станций было начато И.Б. Козловской совместно с австрийскими коллегами в конце 90-х гг. [13]. В дальнейшем эти исследования были продолжены, в том числе и в модельных наземных экспериментах [14–16].
В российской системе профилактики негативных эффектов КП используются различные устройства НМЭС, как высокочастотные – электростимулятор “Тонус-3” (Россия), применяющийся для 60 Гц стимуляции четырехглавой мышцы бедра, абдоминальных мышц, мышц шеи, спины и плеч, так и низкочастотные – стимулятор “Стимул-01-НЧ” (Россия), позволяющий стимулировать мышцы с частотой от 25 до 50 Гц [17]. Применение последнего возможно в течение многих часов, на фоне обычной работы космонавта (рис. 1). Оценить эффект именно НМЭС в КП непросто, поскольку по условиям полета полная отмена активных физических тренировок невозможна, поэтому исследователи всегда анализируют эффекты сочетанного применения миостимуляции и других средств профилактики. Хотя эти данные ограничены, они предполагают, что применение НМЭС во время КП возможно и потенциально способно (по крайней мере, частично) предотвратить атрофию мышц [17–19].
Физическая работоспособность при ХСН. Cнижение физической работоспособности – одно из ведущих проявлений хронической сердечной недостаточности (ХСН). Несмотря на современные методы лечения, зачастую даже у клинически стабильных пациентов при отсутствии застоя жидкости сохраняются одышка и утомляемость. Механизмы снижения толерантности к физической нагрузке при ХСН многообразны: первичным является снижение сердечного выброса, которое инициирует целый ряд сосудосуживающих и антинатрийуретических реакций. Хроническая вазоконстрикция со снижением периферического кровотока, нейрогуморальная активация, повышение уровня цитокинов и тканевых факторов роста могут приводить к снижению способности к вазодилатации в мышцах. Значительный вклад вносят патологическая активация мышечных рефлексов, участвующих в формировании дыхательного и циркуляторного ответа на нагрузку и “ответственных” за появление одышки и тахикардии, а также развитие миопатии [20, 21]. Скелетная миопатия при тяжелой ХСН проявляется апоптозом миоцитов, уменьшением числа и размеров митохондрий с сокращением поверхности крист, снижением активности окислительных ферментов, что приводит к подавлению аэробного и активации анаэробного метаболизма, повышению продукции лактата и “закислению” мышц. Истощение креатинфосфата и запасов гликогена, в сочетании со сниженной скоростью поступления и утилизации глюкозы, приводит к быстрому утомлению мышцы [22–25]. При ХСН наблюдается трансформация волокон миозина от медленных (I типа, “аэробных”) к быстрым (IIb типа, “анаэробным”) изоформам [26]. При ХСН снижается не только выносливость, но по мере нарастания тяжести заболевания – сила и масса мышц. Определенную роль в развитии миопатии играет ограничение физической активности и атрофия “от бездействия”, обусловленного длительным застоем жидкости, одышкой и другими лимитирующими симптомами, а также чрезмерно щадящим режимом. Помимо детренированности, атрофию мышц связывают с гипоперфузией, алиментарными факторами, метаболическими и гормональными нарушениями с преобладанием катаболических, прямым повреждающим действием цитокинов и предрасполагающими генетическими факторами (уменьшение содержания тяжелых цепей миозина I) [27, 28].
Нейромышечная стимуляция при ХСН. Аэробные и силовые тренировки, оказывающие благоприятное воздействие на физическую работоспособность, состояние мышц, качество жизни и даже прогноз пациентов со стабильной ХСН, являются основными компонентами программ реабилитации. В ряде случаев, например, при декомпенсации ХСН, тренировки противопоказаны, так как могут сопровождаться значительной гемодинамической перегрузкой. При тяжелой ХСН, даже в стабильном состоянии обычные тренировки не всегда возможны в связи с быстрой утомляемостью и выраженной одышкой, а примерно у 10% больных – еще и в связи с опорно-двигательными и неврологическими нарушениями [29, 30]. Для наиболее ослабленных пациентов, тех, кто не может или не желает тренироваться, ЭМС могла бы служить альтернативой, либо начальным методом реабилитации [31, 32].
Эффективность нервно-мышечной или функциональной электростимуляции как возможного альтернативного или начального метода реабилитации при ХСН исследована в ряде неконтролируемых, а также рандомизированных контролируемых исследований, в которых стимуляцию сравнивали с отсутствием тренировок или имитацией стимуляции (sham-stimulation) [33–38] и с обычными тренировками на велоэргометре [39–45]. В большинстве таких работ стимулировали мышцы бедра, в первую очередь разгибатели [32, 33], как правило, также икроножные [36–45], и в одной работе – еще и ягодичные мышцы [35]. Применяли низкочастотную миостимуляцию с частотой электрического тока от 4 до 50 Гц. Продолжительность сеансов варьировала от 30 до 240 мин, частота – от 3 до 7 раз в неделю. Различными были также использованные устройства и, соответственно, режимы стимуляции – как по интенсивности (от 30% от максимального произвольного сокращения до максимально переносимого), так и по временны́м характеристикам цикла сокращение/расслабление. Сеансы НМЭС, как правило, проводили на дому после обучения в клинических условиях.
Исследования показали, что по сравнению с обычным лечением (без тренировок) или с имитацией стимуляции, НМЭС сопровождается существенным увеличением мышечной силы и выносливости, возрастанием пиковой нагрузки и пикового потребления кислорода при нагрузочных тестах, увеличением дистанции шестиминутной ходьбы (ТШХ) и улучшением субъективной оценки здоровья и качества жизни [32, 46, 47]. При анализе биоптата мышц были выявлены положительные метаболические и ультраструктурные изменения: повышение активности окислительных и снижение гликолитических ферментов, идущие параллельно улучшение оксидативного статуса изоформ тяжелых цепей миозина и изменение композиции волокон m. vastus lateralis в “медленную” сторону [36]. Были получены данные о положительном влиянии НМЭС на нейрогормональный статус, о снижении уровня мозгового натрийуретического пептида – индикатора тяжести и прогноза ХСН, улучшении эндотелий-зависимой вазодилатации, снижении уровня провоспалительных цитокинов, повышении скорости кровотока, а также улучшении психологического статуса и уменьшении депрессии [32, 37, 38, 43, 48]. По данным метаанализа N.A. Smart [46] у больных ХСН НМЭС по эффективности сравнима с обычными физическими тренировками, причем по влиянию на пиковое потребление кислорода (VO2peak) уступает, а по влиянию на дистанцию ТШХ и показатели качества жизни не уступает им. В работе N.P. Kadoglou et al. [49] пациенты, получавшие НМЭС в дополнение к оптимальной терапии, значительно реже нуждались в повторной госпитализации, что отражает положительное влияние таких тренировок на прогноз. Кохрейновский метаанализ 2016 г. показал, что у пациентов с тяжелыми хроническими заболеваниями, включая ХСН, НМЭС позволяет увеличить массу (по данными УЗИ и КТ) и силу стимулируемых мышц [50].
Влияние НМЭС на центральную гемодинамику минимально. При тяжелой ХСН с низкой фракцией выброса левого желудочка миостимуляция не приводит к ухудшению состояния, не вызывает увеличения частоты сердечных сокращений или нарушений ритма, сопровождаясь иногда лишь умеренным снижением артериального давления. Непосредственно в процессе процедур, в связи с увеличением венозного возврата, могут несколько возрастать ударный объем, фракция выброса, скорость кровотока в аорте и скорость раннего трансмитрального диастолического наполнения [48].
О серьезных неблагоприятных явлениях не сообщалось никем из исследователей, лишь вначале могли быть жалобы на небольшие мышечные боли, которые затем самостоятельно проходили [51]. После первой недели ЭМС некоторые авторы отмечали небольшое транзиторное повышение креатинфосфокиназы (КФК) и лактатдегидрогеназы (ЛДГ) в крови, однако существенного повреждения мышц не описано [42].
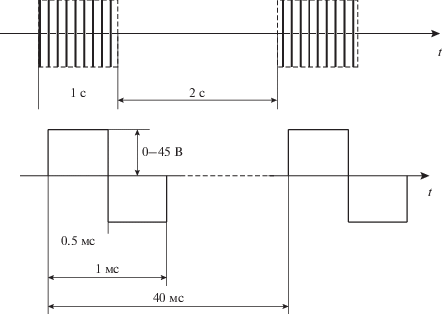
Исследования нейромышечной стимуляции при ХСН, предпринятые по инициативе И.Б. Козловской. Сотрудниками ГНЦ РФ – ИМБП РАН (г. Москва) под руководством И.Б. Козловской и предприятием “Биофизприбор” (Россия) был разработан электромиостимулятор “Стимул-01 НЧ” для низкочастотной НМЭС у космонавтов при длительных полетах. Прибор генерирует двухполярные симметричные прямоугольные электрические импульсы продолжительностью 1 ± 0.05 мс с частотой 25 ± 1 Гц в циклическом режиме (1 ± 0.1 с – стимуляция, 2 ± 0.1 с – перерыв) (рис. 2), стимулируя одновременно мышцы передней и задней поверхности бедер и голеней. Изменения мышц при детренированности и ХСН во многом сходны с теми, которые наблюдаются в условиях микрогравитации, и это позволяло предполагать, что разработанный режим миостимуляции может быть эффективным и в коррекции миопатии у кардиологических больных.
Рис. 2.
Параметры работы электромиостимулятора “Стимул-01 НЧ”. В – вольт, мс – миллисекунда, с – секунда, t – время.
По инициативе И.Б. Козловской, на кафедре профилактической и неотложной кардиологии (ныне – кардиологии, функциональной и ультразвуковой диагностики) Первого МГМУ им. И.М. Сеченова (г. Москва) был проведен целый ряд исследований НМЭС у кардиологических больных. Благодаря совместной работе претерпел изменения и сам стимулятор – он стал компактнее и удобнее в применении, была найдена оптимальная для применения в клинике модификация электродов и системы их фиксации (рис. 3).
Рис. 3.
Наложение электродов электромиостимулятора “Стимул-01 НЧ” при НМЭС нижних конечностей. Стрелками указано положение электродов.

Учитывая целесообразность как можно более раннего начала реабилитации, в отличие от предшествующих работ, в которых применяли НМЭС у пациентов в стабильном состоянии и в амбулаторных условиях, мы изучали возможности миостимуляционных тренировок в стационаре, начиная в максимально ранние сроки после поступления, когда компенсация сердечной недостаточности еще не была достигнута. Помимо раннего начала НМЭС и более тяжелого состояния больных наши исследования отличал более короткий срок проведения тренировок. Как правило, в работах, посвященных как НМЭС, так и физическим тренировкам, их продолжительность составляет не менее пяти, а чаще всего – восьми недель. Мы же оценивали скорее превентивное действие в отношении развития и прогрессирования миопатии, обусловленного декомпенсацией сердечной недостаточности и ограничением активности в стационаре. Известно, в частности, что у пациентов в критическом состоянии, находящихся в отделениях интенсивной терапии, каждый день постельного режима может приводить к снижению массы мышц на 5% [52]. При этом показано, что НМЭС может препятствовать развитию постреанимационной мышечной слабости [53]. Исходя из этих предпосылок, можно предполагать, что даже короткие курсы НМЭС, ограниченные по продолжительности пребыванием в стационаре, позволят, как минимум, затормозить прогрессирование функциональных нарушений и миопатии.
Целью одного из фрагментов программы исследования по сравнению эффективности нервно-мышечной электростимуляции и интервальных физических тренировок в ранней реабилитации пациентов, госпитализированных с декомпенсацией ХСН, была оценка влияния трехнедельных курсов НМЭС нижних конечностей на толерантность к нагрузкам и качество жизни больных, по сравнению с интервальными тренировками низкой-средней интенсивности на велоэргометре и c обычным лечением.
МЕТОДИКА
В исследование был включен 51 пациент (84.3% мужчин, средний возраст 62.5 ± 3.3 лет) с декомпенсацией ХСН. Пациенты были разделены на 3 группы: НМЭС (n = 10), физических тренировок (ФТ) (n = 20) и контрольную (n = 21). Все пациенты получали оптимальную медикаментозную терапию, которая при необходимости корректировалась. Помимо этого, пациенты группы НМЭС в течение 3 нед. получали сеансы миостимуляции, находясь в стационаре. Пациенты, вошедшие в группу ФТ, в течение 3 нед. выполняли физические тренировки на велоэргометре – в стационаре и затем в амбулаторных условиях. Пациентов контрольной группы наблюдали в течение 3-х нед. после включения – в стационаре и после выписки.
НМЭС нижних конечностей проводили с помощью электромиостимулятора “Стимул-01 НЧ”, начиная с 3-го дня от поступления в стационар, 5 дней в неделю, в течение 3-х нед. Целевая продолжительность сеанса НМЭС составляла ≥60 мин в день. Средняя продолжительность стимуляционной тренировки составляла 46.4 ± 22.3 мин, количество тренировок на одного пациента – 12.3 ± 2.1. Амплитуду импульсов подбирали индивидуально для каждого больного так, чтобы они вызывали видимое сокращение мышц, с постепенным увеличением до максимально переносимого сокращения.
В группе ФТ проводили интервальные тренировки на велоэргометре, начиная с низкой интенсивности. Режим тренировки определяли с помощью “рамп”-теста на велоэргометре. Интенсивность фазы нагрузки тренировки вначале устанавливали на уровне 40% от максимальной нагрузки, достигнутой при “рамп”-тесте. Продолжительность тренировок составляла от 5 до 30 мин в день. По мере роста физической работоспособности продолжительность и интенсивность тренировок постепенно увеличивали. Тренировки начинали после 5–7-го дня госпитализации, 4–5 дней в неделю, в течение 3-х нед. С пациентами контрольной группы после выписки из стационара поддерживали контакт по телефону, контролируя выполнение рекомендаций по образу жизни и медикаментозной терапии, при необходимости корригировали лечение.
В исходном состоянии и через 3 нед. всем пациентам проводили клинико-инструментальное обследование. Качество жизни оценивали с помощью вопросника Minnesota Living with Heart Failure Questionnaire (MLHFQ), согласно которому качество жизни тем выше, чем меньше баллов набирает пациент. Физическую работоспособность определяли с помощью теста 6-минутной ходьбы (ТШХ), при котором оценивается расстояние, пройденное пациентом с максимальным усилием за фиксированный промежуток времени (6 мин), а также симптом-лимитированного нагрузочного теста с газовым анализом (эргоспирометрии). Повседневную физическую активность оценивали по вопроснику Duke Activity Status Index (DASI), валидированному для больных с ХСН (чем выше активность, тем больше баллов).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На фоне лечения улучшилось состояние всех пациентов. Достоверное улучшение качества жизни по вопроснику наблюдалось во всех исследуемых группах, максимальное – в группе ФТ и минимальное – в группе НМЭС. Значительное влияние на качество жизни могло оказывать продолжающееся пребывание в стационаре пациентов группы НМЭС, тогда как пациенты других групп к окончанию наблюдения уже были выписаны. Вместе с тем, на фоне НМЭС и ФТ достигнуто сравнимое достоверное увеличение дистанции ТШХ на 65.0 (50.0; 112.5) и 53.0 (51.0; 78.0) м, индекса DASI – на 8.6 (5.5; 11.8) и 8.0 (4.5; 9.0) баллов, и пикового потребления кислорода (VO2peak) – на 1.9 (0.3; 3.2) и 2.2 (0.7; 3.2) мл/мин/кг, соответственно. У пациентов контрольной группы возросла лишь дистанция ТШХ на 21 м.
В связи с тем, что первичное обследование пациентов в группе НМЭС проводили раньше, чем в других группах, исходные функциональные показатели этих пациентов были наихудшими. Для того, чтобы исключить возможное влияние различий исходного состояния, были сопоставлены подгруппы больных с одинаково низким VO2peak – от 8.0 до 13 мл/мин/кг, в каждую из которых вошло по 8 чел. В выделенных подгруппах, как и в общей когорте, достоверное улучшение всех функциональных показателей наблюдалось на фоне НМЭС или ФТ, в то время как у пациентов контрольной группы достоверно улучшились только параметры качества жизни и ТШХ (табл. 1). Пациенты с НМЭС достоверно уступали пациентам с ФТ и недостоверно – пациентам без тренировок по динамике MLHFQ. По приросту DASI и дистанции ТШХ они, наоборот, существенно превосходили группу контроля и даже группу ФТ (в случае ∆DASI – достоверно). Приросты VO2peak в подгруппах НМЭС и велотренировок различались несущественно. В контрольной группе, по сравнению с исходным уровнем, было даже небольшое снижение VO2peak, однако разница динамики этого показателя между тренировавшимися и не тренировавшимися пациентами была статистически недостоверной. Более подробно результаты этого исследования описаны ранее [54].
Таблица 1.
Сравнение функциональных показателей до и после 3-недельных тренировок или наблюдения в подгруппах пациентов с одинаково низким исходным VO2peak
| Параметр | Исходно | 3 нед. | p |
|---|---|---|---|
| Группа НМЭС, n = 8 | |||
| MLHFQ, баллы | 56.0 (59.0; 68.3) | 50.0 (45.3; 52.5) | 0.012 |
| DASI, баллы | 11.58 (7.89; 13.45) | 18.95 (18.73; 22.88) | 0.012 |
| Дистанция ТШХ, м | 205.0 (170.0; 302.5) | 305.0 (285.0; 350.0) | 0.012 |
| VO2peak, мл/кг/мин | 11.00 (8.55; 11.50) | 12.30 (10.48; 13.55) | 0.012 |
| Группа ФТ, n = 8 | |||
| MLHFQ, баллы | 60.5 (56.5; 73.0) | 31.0 (23.5; 41.5) | 0.012 |
| DASI, баллы | 18.95 (16.89; 26.08) | 26.20 (23.45; 31.51) | 0.018 |
| Дистанция ТШХ, м | 327.0 (283.3; 407.3) | 381.0 (300.8; 455.8) | 0.018 |
| VO2peak, мл/кг/мин | 10.65 (9.33; 11.93) | 14.05 (10.65; 16.20) | 0.018 |
| Контрольная группа n = 8 | |||
| MLHFQ, баллы | 73.0 (61.0; 76.0) | 55.0 (45.0; 61.5) | 0.017 |
| DASI, баллы | 15.32 (13.69; 18.95) | 18.95 (12.03; 23.33) | нд |
| Дистанция ТШХ, м | 302.0 (222.5; 348.8) | 309.5 (275.0; 405.0) | 0.049 |
| VO2peak, мл/кг/мин | 11.40 (9.55; 12.05) | 10.35 (9.05; 13.33) | нд |
Примечание: НМЭС – нейромышечная электростимуляция. ФТ – физические тренировки. р – достоверность различий между показателями до и после тренировок. MLHFQ – вопросник Minnesota Living with Heart Failure Questionnaire. DASI – вопросник Duke Activity Status Index. ТШХ – тест с шестиминутной ходьбой. VO2peak – пиковое потребление кислорода.
Рандомизированное плацебо-контролируемое исследование эффективности и безопасности коротких курсов НМЭС у пациентов, госпитализированных с декомпенсацией ХСН. В следующем фрагменте исследования НМЭС применили у более тяжелых больных, начинали раньше и продолжали в течение более короткого периода, что отражало сокращение сроков госпитализации пациентов с сердечной недостаточностью в России, как и во всем мире.
В исследование было включено 45 пациентов, госпитализированных в связи с декомпенсацией ХСН. Пациенты были рандомизированы на 2 сопоставимые группы: группа эффективной ЭМС (n = 22) и группа имитации миостимуляции (Sham, n = 23). В группе эффективной ЭМС, начиная со 2-х сут госпитализации, проводили НМЭС по методике, описанной выше. Во второй группе также накладывали электроды и включали аппарат ЭМС, однако использовали минимальную субъективно ощущаемую амплитуду импульсов. Лечение продолжали до выписки из стационара, и его продолжительность составляла не более 10 дней. Максимальная продолжительность тренировки составляла 90 мин (в основном не более 60 мин), количество сеансов ЭМС – 7.8 ± 2.2 и Sham – 8.0 ± 2.0, средняя продолжительность тренировки – 52.9 ± 11.3 мин для ЭМС и 54.5 ± 10.44 мин для Sham. Переносимость физических нагрузок, самочувствие больных и качество жизни оценивали в исходном состоянии и при выписке из стационара при помощи визуально-аналоговой шкалы (ВАШ), ТШХ, опросников DASI и MLHFQ. В связи с тяжелым состоянием пациентов выполнение эргоспирометрии не представлялось возможным. Для оценки выживаемости достигнутых результатов перечисленные исследования повторяли также через 1 и 3 мес. после выписки из стационара.
В группе эффективной ЭМС отмечалось улучшение самочувствия пациентов по данным ВАШ, качества жизни по данным MLHFQ, а также увеличение уровня физической активности по данным опросника DASI и ТШХ. В группе имитации миостимуляции по данным ВАШ и MLHFQ, также отмечались улучшение состояния пациентов, однако существенно меньшее, чем в группе НМ-ЭС. Согласно опросникам DASI и ТШХ, улучшение физической работоспособности пациентов в группе Sham было недостоверным. Через 1 и 3 мес. после выписки сохранялись существенные различия между пациентами двух групп по всем исследуемым показателям (рис. 4).
Рис. 4.
Изменения самочувствия и функциональных показателей на фоне НМЭС и плацебо. А – оценка общего самочувствия по визуально-аналоговой шкале (баллы). Б – оценка качества жизни по вопроснику Minnesota Living with Heart Failure Questionnaire (баллы). В – оценка повседневной активности по вопроснику Duke Activity Status Index (баллы). Г – дистанция, пройденная при тесте шестиминутной ходьбы (метры). * – p < –0.05 (достоверность различий между группами).

Переносимость и безопасность НМЭС. В ходе исследований не было зарегистрировано серьезных сердечно-сосудистых и других неблагоприятных событий в связи с проводимыми процедурами НМЭС. Некоторые пациенты отмечали после первых процедур неприятные ощущения в мышцах, которые затем самостоятельно проходили. Лишь двое пациентов отказались от продолжения тренировок после 1-го или 2-го сеанса НМЭС, в связи с неприятными ощущениями в ногах и общим дискомфортом.
Существенного влияния НМЭС на гемодинамические показатели по клиническим и эхокардиографическим данным не было отмечено. Трансторакальная эхокардиография на фоне процедуры НМЭС выполнена у 10 пациентов. Динамики фракции выброса, конечного диастолического и систолического размеров, ударного объема по сравнению с состоянием покоя выявлено не было. Также не было отмечено влияния миостимуляции на биохимические показатели (уровень глюкозы, липидов и креатинина) через 48 ч после первой процедуры и по окончании всего курса лечения. Для исключения повреждения мышц мониторировали уровень КФК. Существенного возрастания концентрации КФК как через 48 ч после первых процедур, так и к окончанию всего курса лечения не выявлено.
ЗАКЛЮЧЕНИЕ
Применение ЭМС, с помощью разработанного под руководством И.Б. Козловской для космических станций миостимулятора “Стимул-01 НЧ”, позволяет улучшить качество жизни, повысить работоспособность и физическую активность пациентов с тяжелой/декомпенсированной хронической сердечной недостаточностью, причем по эффективности НМЭС сравнима с интервальными тренировками на велоэргометре низкой-средней интенсивности. По данным плацебо-контролируемого исследования у пациентов, госпитализированных с декомпенсацией ХСН и имеющих крайне низкую толерантность к нагрузкам, эти эффекты достигаются за срок менее 10 дней и сохраняются через 3 мес. после выписки из стационара. Низкочастотная НМЭС с помощью электромиостимулятора “Стимул-01 НЧ” хорошо переносится, не сопровождается существенными изменениями центральной гемодинамики, углеводного и липидного обмена, почечной функции и маркеров мышечного повреждения. НМЭС можно использовать на начальном этапе реабилитации у пациентов с ХСН, которые не в состоянии или не желают тренироваться обычными способами.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлений, и одобрены локальным биоэтическим комитетом Первого московского государственного медицинского университета имени И.М. Сеченова МЗ России (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана Минобрнауки России в рамках соглашения № 075-1502020-919 от 16.11.2020 г. о предоставлении гранта в форме субсидий из федерального бюджета на осуществление государственной поддержки создания и развития научного центра мирового уровня “Павловский центр “Интегративная физиология – медицине, высокотехнологичному здравоохранению и технологиям стрессоустойчивости”.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Vanderthommen M., Crielaard J.M. Muscle electric stimulation in sports medicine // Rev. Med. Liege. 2001. V. 56. № 5. P. 391.
Maffiuletti M.A., Minetto M.A., Farina D. et al. Electric stimulation for neuromuscular testing and training: State-of-the-Art and unresolved issues // Eur. J. Appl. Physiol. 2011. V. 111. № 10. P. 2391.
Filiponiv A., Kleinöder H., Dörmann U. et al. Electromyostimulation – a systematic review of the influence of training regimens and stimulation parameters on effectiveness in electromyostimulation training of selected strength parameters // J. Strength Cond. Res. 2011. V. 25. № 11. P. 3218.
Gerovasili V., Stefanidis K., Vitzilaios K. et al. Electrical muscle stimulation preserves the muscle mass of critically ill patients: a randomized study // Crit. Care. 2009. V. 13. № 5. P. 161.
Toth M.J., Voigt T.B., Tourville T.W. et al. Effect of neuromuscular electrical stimulation on skeletal muscle size and function in patients with breast cancer receiving chemotherapy // J. Appl. Physiol. 2020. V. 128. № 6. P. 1654.
Morrissey M.C., Brewster C.E., Shields C.L., Jr., Brown M. The effects of electrical stimulation on the quadriceps during postoperative knee immobilization // Am. J. Sports Med. 1985. V. 13. № 1. P. 40.
Gibson J.N., Halliday D., Morrison W.L. et al. Decrease in human quadriceps muscle protein turnover consequent upon leg immobilization // Clin. Sci. 1987. V. 72. № 4. P. 503.
Kwong W.H., Vrbova G. Effects of low-frequency electrical stimulation on fast and slow muscles of the rat // Pflugers Archiv: Eur. J. Physiol. 1981. V. 391. № 3. P. 200.
Scott O.M., Vrbova G., Hyde S.A., Dubowitz V. Effects of chronic low frequency electrical stimulation on normal human tibialis anterior muscle // J. Neurol. Neurosurg. Psychiatry. 1985. V. 48. № 8. P. 774.
Shenkman B.S., Lyubaeva E.V., Popov D.V. et al. Chronic effects of low-frequency low-intensity electrical stimulation of stretched human muscle // Acta Astronaut. 2007. V. 60. № 4–7. P. 505.
Черепахин М.А., Какурин Л.И., Ильина-Какуева Е.И., Федоренко Г.Т. Оценка эффективности электростимуляции мышц в предотвращении расстройств, связанных длительным ограничением двигательной активности у человека // Косм. биол. и авиакосм. мед. 1977. Т. 11. С. 64.
Шенкман Б.С., Любаева Е.В., Попов Д.В. и др. Хронические эффекты низкочастотной электростимуляции разгибателей коленного сустава на фоне их статического пассивного растяжения у человека // Физиология человека. 2006. Т. 32. № 1. С. 84. Shenkman B.S., Liubaeva E.V., Popov D.V. et al. Effects of chronic low-frequency electrical stimulation of human knee extensor muscles exposed to static passive stretching // Human Physiology. 2006. V. 32. № 1. P. 74.
Freilinger G., Mayr W. Electrical stimulation as a countermeasure to muscle alteration in space // J. Gravit. Physiol. 2002. V. 9. № 1. P. 319.
Козловская И.Б. Фундаментальные и прикладные задачи иммерсионных исследований // Авиакосм. и эколог. мед. 2008. Т. 42. № 5. С. 3.
Коряк Ю.А. Нервно-мышечная электрическая стимуляция в условиях опорной разгрузки и ее влияние на архитектуру и силу сокращения трехглавой мышцы голени у человека // Научное обозрение. Биол. науки. 2017. № 2. С. 93.
Амирова Л.Е., Осецкий Н.Ю., Шишкин Н.В. и др. Сравнительное исследование тонуса мышц нижних конечностей при применении различных режимов электромиостимуляции в условиях 5-суточной опорной разгрузки // Физиология человека. 2020. Т. 46. № 4. С. 52. Amirova L.E., Osetskiy N.Yu., Shishkin N.V. et al. Comparative study of the lower limb muscle tone under the conditions of five-day support unloading coupled with different regimens of electromyostimulation // Human Physiology. 2020. V. 46. № 4. P. 391.
Yarmanova E.N., Kozlovskaya I.B., Khimoroda N.N., Fomina E.V. Evolution of Russian Microgravity Countermeasures // Aerosp. Med. Hum. Perform. 2015. V. 86. № 12. P. 32.
Kozlovskaya I.B., Yarmanova E.N., Yegorov A.D. et al. Russian Countermeasure Systems for Adverse Effects of Microgravity on Long-Duration ISS Flights // Aero-sp. Med. Hum. Perform. 2015. V. 86. № 12. Section II. P. 24.
Shiba N., Matsuse H., Takano Y. et al. Electrically stimulated antagonist muscle contraction increased muscle mass and bone mineral density of one astronaut – initial verification on the international space station // PLoS One. 2015. V. 10. № 8. P. :e0134736.
Cohen-Solal A., Logeart D., Guiti C. et al. Cardiac and peripheral responses to exercise in patients with chronic heart failure // Eur. Heart. J. 1999. V. 20. № 13. P. 931.
Piepoli M.F., Crisafulli A. Pathophysiology of human heart failure: importance of skeletal muscle myopathy and reflexes // Exp. Physiol. 2014. V. 99. № 4. P. 609.
Lunde P.K., Sjaastad I., Schiotz Thorud H.-M., Sejersted O.M. Skeletal muscle disorders in heart failure // Acta Physiol. Scand. 2001. V. 171. № 3. P. 277.
Opasich C., Ambrosino N., Felicetty G. et al. Heart failure related myopathy // Eur. Heart J. 1999. V. 20. № 16. P. 1991.
Okita K., Yonezawa K., Nishijima H. et al. Skeletal muscle metabolism limits exercise capacity in patients with chronic heart failure // Circulation. 1998. V. 98. № 18. P.1886.
Dusha B.D., Shulze P.C., Robbins J.L., Forman D.E. Implications of chronic heart failure on peripheral vasculature and skeletal muscle before and after exercise training // Heart Fail. Rev. 2008. V. 13. № 1. P. 21.
Brassard P., Maltais F., Noel M. et al. Skeletal muscle endurance and muscle metabolism in patients with chronic heart failure // Can. J. Cardiol. 2006. V. 22. № 5. P. 387.
Piepoli M.F., Kaszmarek A., Francis D.P. et al. Reduced peripheral skeletal muscle mass and abnormal reflex physiology in chronic heart failure // Circulation. 2006. V. 114. № 2. P. 126.
Dilani Mendis M., Hides J.A., Wilson S.J. et al. Effect of prolonged bed rest on the anterior hip muscles // Gait Post. 2009. V. 30. № 4. P. 533.
Piepoli M.F., Davos C., Francis D.P., Coats A.J.S. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH) // BMJ. 2004. V. 328. № 7433. P. 189.
Arutiunov G.P., Kolesnikova E.A., Begrambekova Y.L. et al. Guidelines on exercise prescription for patients with chronic heart failure // J. Serd. Ned. 2017. V. 18. № 1. P. 41.
Arena R., Pinkstaff S., Wheeleret E. et al. Neuromuscular Electrical Stimulation and Inspiratory Muscle Training as Potential Adjunctive Rehabilitation Options for Patients With Heart Failure // J. Cardiopulm. Rehab. Prevent. 2010. V. 30. № 4. P. 209.
Ploesteanu R.L., Nechita A.C., Turcu D. et al. Effects of neuromuscular electrical stimulation in patients with heart failure – review // J. Med. Life. 2018. V. 11. № 2. P. 107.
Vaquero A.F., Chicharro J.L., Gil L. et al. Effects of muscle electrictrical stimulation on peak VO2 in cardiac transplant patients // Int. J. Sports Med. 1998. V. 19. № 5. P. 317.
Quittan M., Wiesinger G.F., Sturm B. et al. Improvement of thigh muscles by neuromuscular electrical stimulation in patients with refractory heart failure: a single-blind, randomized, controlled trial // Am. J. Phys. Med. Rehab. 2001. V. 80. № 3. P. 206.
Banerjee P., Caulfield B., Crowe L., Clark A.L. Prolonged electrical muscle stimulation exercise improves strength, ppeak VO2, and exercise capacity in patients with stable chronic heart failure // J. Card. Fail. 2009. V. 15. № 4. P. 319.
Nuhr M.J., Pette D., Berger R. et al. Beneficial effects of chronic low-frequency stimulation of thigh muscles in patients with advanced chronic heart failure // Eur. Heart J. 2004. V. 25. № 2. P. 136.
Karavidas A.I., Raisakis K.G., Parissis J.T. et al. Functional electrical stimulation improves endothelial function and reduces peripheral immune responses in patients with chronic heart failure // Eur. J. Cardiovasc. Prev. Rehab. 2006. V. 13. № 4. P. 592.
Karavidas A.I., Parissis J.T., Arapi S.M. et al. Effects of functional electrical stimulation on quality of life and emotional stress in patients with chronic heart failure // Eur. J. Heart Fail. 2008. V. 10. № 7. P. 709.
Deley G., Kervio G., Verges B. et al. Comparison of low-frequency electrical myostimulation and conventional aerobic exercise training in patients with chronic heart failure // Eur. J. Cardiovasc. Prev. Rehab. 2005. V. 12. № 3. P. 226.
Deley G., Eicher J.C., Verges B. Do low-frequency electrical myostimulation and aerobic training similarly improve performance in chronic heart failure patients with different exercise capacities? // J. Rehabil. Med. 2008. V. 40. № 3. P. 219.
LeMaitre J.P., Harris S., Hannan J. et al. Maximal oxygen uptake corrected for skeletal mass accurately predicts functional improvements following exercise training in chronic heart failure // Eur. J. Heart Fail. 2006. V. 8. № 3. P. 243.
Dobsak P., Novakova M., Fiser B. et al. Electrical stimulation of skeletal muscles. An alternative to aerobic exercise training in patients with chronic heart failure? // Int. Heart J. 2006. V. 47. № 3. P. 441.
Dobsak P., Novakova M., Siegelova J. et al. Low-frequency electrical stimulation increases muscle strength and improves blood supply in patients with chronic heart failure // Circ. J. 2006. V. 70. № 1. P. 75.
Eicher J.C., Dobsak P., Berteau O. et al. Rehabilitation in chronic congestive heart failure: comparison of bicycle training and muscle electrical stimulation // Scripta Med. 2004. V. 77. № 2. P. 261.
Harris S., LeMaitre J.P., Mackenzie G. et al. A randomised study of home-based electrical stimulation of the legs and conventional bicycle exercise training for patients with chronic heart failure // Eur. Heart J. 2003. V. 24. № 9. P. 871.
Smart N.A., Dieberg G., Giallauria F. Functional electrical stimulation for chronic heart failure: A meta-analysis // Int. J. Cardiol. 2013. V. 167. № 1. P. 80.
Bruzzi G., Ribeiro R.A., Schaan B.D. et al. Functional electrical stimulation in the treatment of patients with chronic heart failure: a meta-analysis of randomized controlled trials // Eur. J. Cardiovasc. Prev. Rehab. 2010. V. 17. № 3. P. 254.
Sumin A.N. Local physical training with the use of skeletal muscle electric stimulation in patients with chronic heart failure // J. Serdech. Ned. 2009. V. 10. № 1. P. 37.
Kadoglou N.P., Mandila C., Karavidas A. et al. Effect of functional electrical stimulation on cardiovascular outcomes in patients with chronic heart failure // Eur. J. Prev. Cardiol. 2017. V. 24. № 8. P. 833.
Jones S., Man W.D.C., Gao W. et al. Neuromuscular electrical stimulation for muscle weakness in adults with advanced disease // Cochrane Database Syst. Rev. 2016. V. 10. № 10. P. CD009419.
Sillen M.J.H., Speksnijder C.M., Eterman R.A. et al. Effects of Neuromuscular Electrical Stimulation of Muscles of Ambulation in Patients With Chronic Heart Failure or COPD // Chest. 2009. V. 136. № 1. P. 44.
Reid C.L., Campbell I.T., Little R.A. Muscle wasting and energy balance in critical illness // Clin Nutr. 2004. V. 23. № 2. P. 273.
Mafiuletti N.A., Roig M., Karatzanos E., Nanas S. Neuromuscular electrical stimulation for preventing skeletal-muscle weakness and wasting in critically ill patients: a systematic review // BMC Med. 2013. V. 11. P. 137.
Полтавская М.Г., Свириденко В.П., Козловская И.Б. и др. Сравнение эффективности нейромышечной электростимуляции и интервальных физических тренировок в ранней реабилитации пациентов, госпитализированных с декомпенсацией хронической сердечной недостаточности // Физиология человека. 2018. Т. 44. № 6. С. 67. Poltavskaya M.G., Sviridenko V.P., Kozlovskaya I.B. et al. Comparison of the efficacy of neuromuscular electrostimulation and interval exercise training in early rehabilitation of patients hospitalized with decompensation of chronic heart failure // Human Physiology. 2018. V. 44. № 6. P. 663.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека



