Физиология человека, 2021, T. 47, № 4, стр. 5-16
Сенсомоторные и локомоторные перестройки при хроническом посттравматическом поражении взрослого спинного мозга человека как свидетельство активность-зависимой нейропластичности
Е. Ю. Шапкова 1, 2, *, Д. В. Емельянников 1, Ю. Е. Ларионова 1
1 Центр патологии позвоночника ФГБУ “Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии” МЗ России
Санкт-Петербург, Россия
2 Институт трансляционной биомедицины Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: eyshapkova@gmail.com
Поступила в редакцию 11.02.2021
После доработки 16.02.2021
Принята к публикации 23.03.2021
Аннотация
Тренировка нарушенных двигательных функций формирует активность-зависимую пластичность, направленную на компенсацию функционального дефекта. У лиц с моторно полным травматическим поражением спинного мозга в хронической стадии наличие нейропластического потенциала и возможность его мобилизации являются дискутабельными. Цель исследования – оценить наличие, частоту и величину позитивных сдвигов в локомоторных возможностях, сенсорных и моторных характеристиках пациентов с двигательно-полными плегиями при повторных курсах комплексной нейрореабилитации. Для анализа были отобраны 37 пациентов (18 мужчин и 19 женщин, возраст 18–55 лет) с последствиями травмы грудного и поясничного отделов спинного мозга с давностью травмы более 1 года (1–32 года) и тяжестью поражения по стандарту Американской ассоциации спинальных хирургов AIS (ASIA Impairment Scale) A (30) и B (7), завершивших 3 стационарных курса комплексной реабилитации с применением тренировок ходьбы в экзоскелете (два курса по 22 дня и курс 14 дней, с перерывами 1 мес.). Каждый курс включал ходьбу в экзоскелете (40 мин/день), тренировку вертикальной позы с электростимуляцией мышц, пневмостимуляцию опорных зон стопы, общий и лимфодренажный массаж, занятия лечебной гимнастикой (суммарно не менее 3–4 ч/день); третий курс дополнительно включал чрескожную электростимуляцию спинного мозга в стационарном режиме и фазовую в ходьбе. Динамику показателей тактильной (AISLT) и болевой (AISPP) чувствительности и контроля/силы мышц ног (AISMOTOR) оценивали перед началом и по окончании каждого курса. Локомоторные возможности участников оценивали по времени и потребности во внешней помощи при выполнении тетрапедальных тестов вперед и назад. Инструментально оценивали возбудимость мотонейронов поясничного утолщения. За период наблюдения прирост AISLT выявлен у 28 пациентов (76%) в среднем на 9.4 балла, AISPP – у 22 пациента (60%) на 8.0 балла, AISMOTOR – у 15 пациентов (40.5%) на 3.9 балла. Динамика в неврологических показателях могла начаться на первом, втором или третьем курсе, позитивные сдвиги с сопоставимой частотой происходили в ходе курса и между курсами и носили накопительный характер. В отдельных случаях после перерыва в тренировках наблюдали возврат к исходному уровню, случаев существенного ухудшения показателей не выявлено. Изменения чувствительности преобладали в ходе первого и второго курсов, прогресс в силе мышц наблюдали в курсе с электростимуляцией спинного мозга. Прогресс в локомоторных возможностях, чувствительности и контроле мышц и изменения возбудимости мотонейронов поясничного утолщения, наблюдавшиеся у пациентов с полными моторными плегиями при интенсивных тренировках ходьбы в экзоскелете, расценены как результат сенсомоторных перестроек и проявление активность-зависимой пластичности. Полученные данные подтверждают возможность мобилизовать нейропластический потенциал взрослого хронически пораженного спинного мозга с помощью интенсивных стимулирующих и тренирующих воздействий, при этом тренировки ходьбы в экзоскелете в большей степени мобилизуют сенсорную, в электростимуляции спинного мозга – моторную составляющие.
В нервной системе, завершившей возрастное развитие, пластичность обеспечивает адаптацию к внешним и внутренним изменениям, в том числе к потере какой-либо функции, и реорганизацию нервной системы для компенсации этого нарушения [1–3]. Процессы нейропластичности проявляются как в головном мозге [4–6], так и в спинном мозге [7–10], и возникают на разных уровнях: от молекулярного до поведенческого [11–13]. Нейропластические перестройки можно индуцировать или направить специальными воздействиями, например, афферентной [14, 15], химической [15–18] или электрической стимуляцией [19–21]. Выделяют активность-зависимую пластичность, включающую эндогенные перестройки, обусловленные естественной или специально организованной деятельностью.
Известно, что спинной мозг млекопитающих содержит нейронные сети, генерирующие локомоторный ритм при отсутствии супраспинальных команд и афферентных сигналов с периферии [21, 22]. Представления о способности изолированного спинного мозга к ритмогенезу и возможности перевести функционально изолированные нейронные сети в активное состояние [23] стали основой для разработки реабилитационных технологий для пациентов с травматическим поражением спинного мозга. Повышение возбудимости мотонейронов и активацию локомоторных сетей обеспечивают с помощью магнитной стимуляции [5, 24] или электростимуляции спинного мозга, осуществляемой в эпидуральном [25–27] или чрескожном [25, 28, 29] режимах. Эффект усиливает дополнительная сенсорная стимуляция, например, при воздействии на опорные зоны стопы [30]. Формирование активность-зависимой нейропластичности связывают с физическими упражнениями [1, 31, 32] и тредмил-терапией – тренировками на беговой дорожке c вертикальной разгрузкой веса тела и ручной, либо роботизированной помощью в осуществлении шага [33]. Дальнейшим развитием технологии в последнее годы стали тренировки ходьбы в экзоскелетах – активных роботических устройствах, обеспечивающих вертикальную позу и передвижение парализованного человека [34–37]. Показано, что ходьба в экзоскелете увеличивает независимость [37] лиц с позвоночно-спинномозговой травмой. В недавних публикациях отмечена эффективность совмещения тренировок ходьбы в экзоскелете с функциональной электростимуляцией мышц [38–41], эпидуральной [42–44] и чрескожной (https://www.researchgate.net/publication/342131182_ Design_of_a_hybrid_FNS-exoskeleton_system_to_restore_locomotion_in_patients_with_SCI) [45–47] электростимуляцией спинного мозга. Дополнение навязанной экзоскелетом кинематики ходьбы искусственной активацией мышц представляется весьма перспективным.
В исследовании [47] мы выявили эффекты прироста силы мышц и чувствительности в ходе короткого курса тренировок ходьбы в экзоскелете в сочетании с тонической электростимуляцией спинного мозга у пациентов с полным и неполным поражением спинного мозга, тогда как в контрольной группе, при тренировках ходьбы в экзоскелете без дополнительной стимуляции, эффект наблюдался только при неполных плегиях. Эффективность реабилитационных воздействий у пациентов с клинически полным поражением спинного мозга описана в работах [27, 48–50], однако это ограниченные случаи.
В настоящем исследовании представлена серия наблюдений в ходе интенсивной реабилитации с применением тренировок ходьбы в экзоскелете, направленной на компенсацию длительной депривации локомоторной функции у пациентов с моторно полным поражением спинного мозга. Тренировки дополнены афферентной стимуляцией и электростимуляцией спинного мозга, в связи с чем оценивается не вклад каждого метода, а их кумулятивный эффект, характеризующий диапазон проявлений активность-зависимой нейропластичности. Таким образом, задача исследования – выявить наличие, частоту и величину позитивных сдвигов в локомоторных возможностях, сенсорных и моторных характеристиках пациентов с двигательно-полными плегиями при повторных курсах комплексной нейрореабилитации.
МЕТОДИКА
Проведено проспективное, одногрупповое, нерандомизированное исследование с контролем относительно исходного состояния, в ходе которого осуществляли три последовательных курса комплексной реабилитации с применением экзоскелета для ходьбы: 2 курса по 22–24 дня каждый и третий курс длительностью 14 дней с перерывом между курсами в 4 нед. Курсы 1 и 2 проводили в рамках клинической апробации Протокола 2017-7-11 [37], курс 3 – в рамках плановой научной темы. Конструкция экзоскелета и методика обучения ходьбе подробно описаны в [37, 51].
В исследование были включены пациенты с посттравматическим хроническим (давность травмы более 1 года) моторно полным (тип А и В согласно стандарту Американской ассоциации спинальных хирургов – ASIA Impairment Scale, AIS) поражением спинного мозга, завершивших три курса тренировок ходьбы в экзоскелете. Из 52 участников, вступивших в исследование, 3 курса завершили 44 чел., из анализа исключены 4 пациента с неполным моторным поражением спинного мозга (AIS тип С) и 4 – с давностью травмы менее 1 года, 1 пациент соответствовал обоим критериям исключения. Таким образом, отобрали 37 участников, из которых типу AIS А соответствовали 30 и AIS В – 7. В соответствии с классификацией Frankel эти же пациенты расценены как тип А – 17, тип В – 15, тип С – 5. В отобранную группу вошли 19 женщин и 18 мужчин с последствиями травмы грудного (Th1-Th12), грудопоясничного (Th12-L1) и верхне-поясничного (L1-L2) отделов позвоночника в возрасте от 18 до 55 лет (mean ± SD; 32.3 ± 9.5), со сроком после травмы от 1 до 32 лет (mean 6.9).
Комплексное реабилитационное лечение включало тренировку ходьбы в экзоскелете ExoAtlet®, тренировку вертикальной позы с электростимуляцией мышц, пневмостимуляцию опорных зон стопы, лечебную гимнастику, общий и лимфодренажный массаж. Сведения об объеме и кратности реабилитационных процедур представлены в табл. 1.
Таблица 1.
Содержание комплексной реабилитации с применением экзоскелета (суммарно за 3 курса)
| Реабилитационные процедуры | Длительность процедур, мин | Кратность |
|---|---|---|
| Ходьба в экзоскелете (1-ый и 2-ой курс) | 40–60 | 18 × 2 |
| Ходьба в экзоскелете с электростимуляцией спинного мозга (3-ий курс) | 40–60 | 12–14 |
| Электростимуляция спинного мозга стационарная (3-ий курс) | 40 | |
| Тренировка вертикальной позы с электростимуляцией мышц | 30 | 40 |
| Пневмостимуляция опорных зон стопы | 30 | 40 |
| Лечебная гимнастика (групповые и инд. занятия) | 50 | 40 |
| Массаж общий | 50 | 24 |
| Массаж лимфодренажный | 30 | 24 |
Чрескожную электростимуляцию спинного мозга (ЭССМ) проводили стационарно, в положении лежа на спине, и при ходьбе в экзоскелете. В стационарном режиме ЭССМ применялась как потенциирующая процедура (40 мин), предваряющая тренировку ходьбы в экзоскелете. При стационарной ЭССМ применяли двухканальный монтаж для активации локомоторных интернейронных сетей с воздействием на поясничное утолщение мозга (канал 1) и проводящие пути (канал 2) спинного мозга. Активный электрод располагали на коже над позвонками Th12-L1, индифферентный – накожно центрально на передней поверхности живота. По второму каналу (только в стационарном режиме) одновременно стимулировали проводящие пути и проприоспинальные интернейронные системы спинного мозга, с расположением пары электродов (–) – на уровне шейного утолщения (позвонки С7-Th1), (+) – на уровне предутолщения/верхней части поясничного утолщения (позвонки Th10-Th11). Электростимуляцию проводили в тоническом режиме импульсами тока прямоугольной формы длительностью 0.5 мс частотой 3 имп./с. Амплитуду стимуляции подбирали по двигательной реакции – сокращению мышц передней брюшной стенки и ног (патент РФ № 2 130 326, патент РФ № 2 142 737, патент РФ № 2 204 423). Для усиления эффекта на протяжении всей процедуры стационарной ЭССМ осуществляли пневмостимуляцию опорных зон стопы имитатором опорной нагрузки “Корвит”. ЭССМ при ходьбе в экзоскелете проводили с помощью многоканального портативного электростимулятора в соответствии с фазами ходьбы (заявка на изобретение RU 2 020 101 607, приоритет от 16.01.2020). Тренировку вертикальной позы проводили стоя с опорой рук на параллельные брусья и дополнительной опорой на уровне коленных суставов; электростимуляцию подавали на m. gluteus max. в поочередном режиме (2 с/2 с), в соответствии с ним пациент ритмично смещал вес тела с правой ноги на левую и обратно. Физические упражнения для развития силы сохранных мышц, увеличения подвижности в суставах и остальные процедуры (табл. 1) осуществляли в рутинном режиме.
Неврологический статус участников оценивали по шкалам AIS: силу произвольных движений/ напряжений ног – по 10 ключевым сегментам спинного мозга, иннервирующим ноги (max – 50 баллов AIS); болевую и тактильную чувствительность – по 28 сегментам (мах – 112 баллов каждая). Полноту поражения спинного мозга классифицировали в соответствии со стандартом ASIA, основанном на сохранности/отсутствии произвольной и рефлекторной активности ануса и чувствительности в анальной зоне, и по Frankel (1969 г.), ориентированной на сохранность или отсутствие произвольных движений и чувствительности ниже уровня поражения спинного мозга. Оценивали статическую и динамическую составляющие тонуса мышц с качественной оценкой: сниженный, физиологический, повышенный. При повышенном (спастическом) тонусе проводили оценку спастичности по шкале Ashworth (1993 г.).
Локомоторные возможности пациентов оценивали при тетрапедальной ходьбе, включающей преодоление 4 м вперед и назад [37], с контролем затраченного времени и самостоятельности выполнения задания. Все тесты документировали видеозаписью. Потребность в помощи оценивали в баллах: минимальная помощь для частичной разгрузки или облегчения движений одной ноги – 1 балл; существенная помощь одного человека – 2 балла; существенная помощь одного или двоих человек с прохождением менее 4 м – 3 балла; полностью пассивное выполнения теста – 4 балла. Улучшением считали сокращение времени самостоятельного выполнения теста более чем на 5% от исходного; для выполняющих тесты с помощью – уменьшение помощи на 1 балл [37]. Задачи максимально быстрого преодоления дистанции перед пациентами не ставили. Тестирование локомоторных возможностей проводили в начале и по окончании каждого курса.
Нейрофизиологическое тестирование. Оценивали возбудимость мотонейронов поясничного утолщения спинного мозга методом Н-рефлекса (стимуляция n. tibialis на уровне подколенной ямки с регистрацией ответов в m. gastrocnemius lat.) и амплитуду вызванных ответов m. tibialis anterior при стимуляции n. peroneus. Для подтверждения рефлекторного характера вызванных ответов при Н-рефлексе использовали амплитудное подавление [52].
Статистическая обработка данных включала оценку описательных статистик и дисперсионный анализ (ANOVA) измеряемых показателей до и после курса. Факторами анализа были полнота поражения спинного мозга (тип по Frankel) и сроки после травмы (ранги: до 2 лет, от 2 до 5 лет, свыше 5 лет). В связи с несбалансированностью выборки использовали универсальную линейнаяую модель в пакете Minitab 16. Уровень значимости различий определен как p = 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Динамика неврологических характеристик. При первичном тестировании произвольный контроль мышц ног отсутствовал полностью у 22 из 37 участников (AISMOTOR 0), суммарно сила мышц ног до 10 баллов AIS (из max 50) выявлена у 9 участников, от 11 до 20 баллов – у 6 участников (5 из них отнесены к типу С по Frankel). Тактильная чувствительность варьировала от 34 до 109, болевая от 32 до 94 баллов AIS.
В ходе реабилитации динамика неврологических показателей выявлялась как в ходе курса, так и между курсами, в связи с этим анализировали не результаты курсов, а приросты по результатам всех 6 тестирований (рис. 1). В целом позитивные сдвиги носили накопительный характер, в отдельных случаях после перерыва в тренировках наблюдался возврат к исходному уровню с последующим ростом, случаев ухудшения показателей по отношению к исходному уровню не выявлено. Индивидуальная динамика могла выявиться впервые при любом тестировании и продолжиться либо прекратиться в последующих.
Рис. 1.
Динамика частоты (А) и объема (Б) прироста силы мышц, тактильной и болевой чувствительности по отношению к исходному тестированию в ходе экзореабилитации в 6 контрольных точках (до начала и по окончании каждого курса тренировок). Штриховкой показаны случаи впервые выявленных приростов, заливкой – продолжения прироста, возникшего ранее, n – количество участников, улучшивших неврологические характеристики. Линии тренда рассчитаны по 5 (пунктирная линия) и 6 (сплошная линия) контрольным тестам.
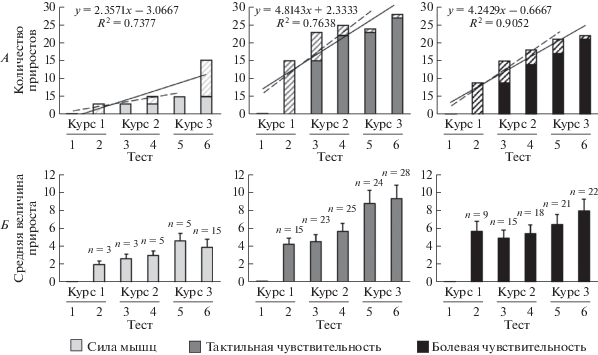
По тактильной и болевой чувствительности за первый курс позитивные сдвиги возникли у 15 и 9 пациентов соответственно, за последующие 4 нед. (перерыв в тренировках) сдвиги впервые появились еще у 8 и 6, а продолжились у 15 и 9 участников. За время второго курса впервые возникли сдвиги у 3 и 4, а продолжились у 22 и 14 пациентов, после второго и в ходе третьего курсов случаи прироста продолжали нарастать до 27 и 21 случая, а впервые выявляемые приросты сократились до 1 (рис. 1, А). Средняя величина прироста нарастала по тактильной чувствительности от 4.5 до 9.4, по болевой – от 5.5 до 8 баллов AIS (рис. 1, Б).
Изменения в силе мышц в ходе первых двух курсов выявляли редко – 3 случая после первого курса и суммарно 5 случаев к началу 3 курса. При 5 тестировании, к началу 3 курса отмечено увеличение прироста до 4.6 баллов AIS без изменения количества случаев. На третьем курсе, при дополнительном применении электростимуляции спинного мозга в стационарном режиме и в ходьбе выявлен существенный прирост (+10 случаев) увеличения силы мышц с некоторым снижением величины прироста (3.9 баллов AIS).
Таким образом, суммарно за период наблюдений прирост тактильной чувствительности выявлен у 28 чел. (9.4 ± 1.5 баллов AIS, mean ± SE), болевой – у 22 (8.0 ± 1.3 балла AIS), силы мышц – у 15 чел. (3.9 ± 0.9 балла). Динамика внутрикурсовых приростов по силе мышц и по чувствительности выявила противоположно направленные тенденции – наибольшая частота и величина приростов по обоим видам чувствительности выявлены на первом и втором курсах, на третьем курсе количество новых приростов минимально при значительной средней величине прироста. По силе мышц, напротив, приросты на протяжении 1 и 2 курсов минимальны, а наибольшее количество случаев прироста выявлено в третьем курсе, при совместном применении тренировок ходьбы в экзоскелете и ЭССМ. Электростимуляция спинного мозга (курс 3) не увеличила среднего прироста силы, но в 3 раза увеличила количество участников с положительной динамикой в контроле мышц.
Динамика локомоторных возможностей. Тетрапедальная ходьба. К выполнению локомоторных тестов допущен 31 пациент, для количественного анализа времени выполнения тестов отобраны пациенты, выполняющие тесты самостоятельно: вперед 23, назад 17 чел. Исходно время выполнения тестов сильно варьировало среди участников: вперед – от 5 до 202 с (mean 56 с), назад – от 5 до 255 с (mean 62 с), результаты последующих тестов нормировали по первичным.
Время выполнения тестов в ходе курса у большинства участников сокращалось, однако некоторые пациенты отмечали утомление к окончанию курса, либо увеличение спастичности, снижавшее результаты тестирования. После перерыва в тренировках следовало облегчение ходьбы, подтвержденное улучшением результатов в начале следующего курса. Распределение случаев сокращения/увеличения времени выполнения тестов в конце каждого курса, по отношению к его началу, представлены в табл. 2. Количество и диапазон позитивных сдвигов превосходили негативные во всех курсах по обоим тестам.
Таблица 2.
Динамика времени выполнения тетрапедальных тестов в ходе курса (распределение результатов внутри группы)
| Тетрапедальные тесты | Курс | Количество участников | Количество и диапазон сдвигов к концу курса (время выполнения теста, % от начала курса) | ||
|---|---|---|---|---|---|
| сокращение | без динамики | увеличение | |||
| Вперед | 1 | 23 | 18 (57–93%) | 1 | 4 (106–125%) |
| 2 | 23 | 11 (53–92%) | 7 | 5 (111–133%) | |
| 3 | 23 | 10 (62–92%) | 8 | 5 (106–122%) | |
| Назад | 1 | 17 | 14 (40–94%) | 3 | 0 |
| 2 | 17 | 7 (59–90%) | 4 | 6 (107–129%) | |
| 3 | 17 | 10 (54–58%) | 5 | 2 (110–159%) | |
В среднем по группе время выполнения тетрапедальных тестов сокращалось в ходе каждого курса и по его окончании, за весь период наблюдений время выполнения тетрапедальных тестов вперед сократилось на 35%, назад – на 50% (рис. 2). Наибольшее снижение времени отмечено в первом курсе, что может быть связано с научением новому навыку. У двоих участников отсутствовала существенная динамика времени выполнения тестов на протяжении всей реабилитации.
Рис. 2.
Динамика времени выполнения тетрапедальных тестов вперед (А) и назад (Б) в сравнении с исходным тестированием (групповые данные).

Дисперсионный анализ (ANOVA) времени выполнения тестов показал достоверные различия каждого последующего тестирования с исходным, вперед (p = 0.001 F = 10.2 error 129), назад (p = 0.001 F = 12.5 error 93), существенных различий между тестами 2–6 не выявлено.
В группе пациентов, нуждающихся в помощи, потребность в ней значимо сократилась (p < 0.05): при тесте вперед у 6/8, назад – у 12/14, изменений не выявлено у двоих участников. Зависимости положительной динамики в локомоторных возможностях от сохранности/отсутствия чувствительности (типы А и В) не установлено (р > 0.5).
Таким образом, улучшение локомоторных возможностей в виде снижения потребности в помощи, либо сокращения времени выполнения тестов, наблюдалось у 27 из 31 чел. (87%), у четверых динамика отсутствовала.
Динамика нейрофизиологических параметров в ходе экзореабилитации. Амплитуду вызванных ответов на электростимуляцию периферических нервов ног оценивали в каждой конечности, вне зависимости от би- или унилатеральной регистрации ответов. Из анализа исключены случаи низкоамплитудных ответов, динамика которых создает гигантские приросты (5). В анализ включены М-ответы m. gastrocnemius lat. у 24 (n = 46), в m. tibialis anterior – у 23 пациентов (n = 44), у части – унилатерально. Н-рефлекс в m. gastrocnemius lat. зарегистрирован у 20 чел., из них у 7 – унилатерально (n = 33).
Реакция нейрональных структур на тренировочную нагрузку проявлялась в виде повышения либо снижения амплитуды вызванных мышечных и/или рефлекторных ответов. При исходно низких ответах (характерно для вялых плегий) типичной реакцией было повышение возбудимости в виде увеличения амплитуды мышечного и рефлекторного ответов, либо только одного из них. При исходно высокой амплитуде вызванных ответов (характерно для спастических плегий) рефлекторный ответ мог как снижаться, так и повышаться. Выявленные изменения оценивали с учетом абсолютных значений и соотношения Н/М, считая эталонным соотношение 0.4–0.6.
Примеры регистраций с позитивным изменением соотношения амплитуд Н/М представлены на рис. 3. При первичном тестировании (рис. 3, А) амплитуды М- и Н-ответов сопоставимы, соотношение Н/М высокое (0.88), после реабилитации – заметный рост обоих потенциалов с преобладанием увеличения амплитуды М-ответа, что снижает соотношение Н/М до 0.67. На рис. 3, на панели Б пример роста обоих потенциалов в ходе реабилитации с преобладанием роста рефлекторного ответа с изменением соотношения Н/М от 0.24 до 0.52. Оба примера иллюстрируют рост амплитуды мышечных и рефлекторных ответов, расцененные как результат позитивных сенсомоторных перестроек в ответ на применявшуюся интервенцию.
Рис. 3.
Увеличение амплитуды мышечных и рефлекторных ответов в ходе реабилитации: регистрация в m. gastrocnemius lateralis при стимуляции n. tibialis (сравнение тестов 1 и 6) со снижением (А) и увеличением (Б) соотношения H/M. Инд. данные пациентов Г.А. и С.О.

Амплитуда вызванных мышечных и рефлекторных ответов на этапах реабилитации с применением тренировок ходьбы в экзоскелете и тренировок ходьбы в экзоскелете с электростимуляцией спинного мозга широко варьировала, отражая активизацию нейрональных структур и изменения их возбудимости. Данные о распределении приростов и снижений амплитуды ответов, по отношению к исходному тестированию, представлены в табл. 3.
Таблица 3.
Динамика амплитуды вызванных мышечных и рефлекторных ответов в ходе реабилитации (распределение результатов внутри группы) при контрольных тестированиях
| Параметр | Тест | Количество случаев | Количество и диапазон сдвигов (% от исходного) | ||||
|---|---|---|---|---|---|---|---|
| увеличение | без динамики | снижение | |||||
| количество случаев | величина прироста |
количество случаев | величина снижения |
||||
| М-ответ m. gastrocnemius lat. |
2 | 46 | 23 | +33% | 9 | 14 | –15% |
| 3 | 25 | +46% | 9 | 12 | –15% | ||
| 4 | 27 | +53% | 6 | 13 | –16% | ||
| 5 | 28 | +68% | 6 | 12 | –14% | ||
| 6 | 31 | +79% | 6 | 9 | –11% | ||
| Н-рефлекс m. gastrocnemius lat. |
2 | 33 | 16 | +53% | 3 | 14 | –22% |
| 3 | 16 | +38% | 3 | 14 | –20% | ||
| 4 | 13 | +51% | 8 | 1 | –20% | ||
| 5 | 19 | +44% | 0 | 14 | –28% | ||
| 6 | 16 | +78% | 3 | 14 | –28% | ||
| М-ответ m. tibialis ant. |
2 | 44 | 16 | +76% | 10 | 18 | –18% |
| 3 | 19 | +61% | 8 | 17 | –19% | ||
| 4 | 21 | +51% | 3 | 20 | –22% | ||
| 5 | 22 | +60% | 6 | 16 | –20% | ||
| 6 | 24 | +56% | 9 | 11 | –18% | ||
Количество случаев увеличения амплитуды мышечных ответов m. gastrocnemius lat. и m. tibialis ant. росло на протяжении всего периода наблюдений (тесты 2-6). Амплитуда ответов m. gastrocnemius lat. постепенно увеличивалась в ходе реабилитации, от 33% в тесте 2 до 79% в тесте 6, тогда как амплитуда m. tibialis ant. резко возросла в ходе первого курса (на 76%) и в дальнейшем несколько снизилась при одновременном увеличении случаев прироста. Амплитуда Н-рефлекса увеличилась у половины пациентов, изменения происходили скачкообразно: увеличение амплитуды ответов в ходе каждого курса реабилитации с некоторым снижением между ними при сохраняющейся тенденции к увеличению. Наибольший прирост амплитуды Н-рефлекса выявлен в ходе 3 курса, при применении ЭССМ.
Таким образом, у большинства участников исследования нейрофизиологическое тестирование выявило увеличение амплитуды вызванных ответов в мышцах голени, более выраженное в m. gastrocnemius lat., чем в m. tibialis ant. Увеличение амплитуды Н-рефлекса в m. gastrocnemius lat. было более выраженным на первом (эффект активизации в ответ на тренировки ходьбы в экзоскелете) и третьем курсах (реакция на ЭССМ). Однако достоверно разделить накопительный эффект от трех курсов (потенциирование при расширении двигательного режима) и вклад собственно ЭССМ не представляется возможным. Выявленные изменения вызванных мышечных и рефлекторных ответов, несмотря на различные типы реакций, подтверждают активную реакцию нейронных структур поясничного утолщения на комплексное тренирующее и стимулирующее воздействие.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Можно предположить, что принудительная ходьба, инициируемая экзоскелетом, обеспечивает локомоторную деятельность пациентов и этим направляет активность-зависимую пластичность. Однако при тяжелом поражении спинного мозга, с длительной депривацией ходьбы, одной ходьбы в экзоскелете недостаточно для начала пластических перестроек, поэтому локомоторные тренировки дополнены тренировками вертикальной позы и широким комплексом дополнительных стимулирующих воздействий – пневмостимуляцией опорных зон стопы, упражнениями и массажем. Прирост по одному или обоим видам чувствительности на 1 балл AIS и более зарегистрирован более чем у 80% участников, при этом средний прирост за 3 курса достиг 8 и 9 баллов, а максимальный – 23 и 16 баллов AIS. Наблюдавшийся в ходе первого и второго курсов прирост чувствительности показал, что эти воздействия достаточны для получения значимых сдвигов в чувствительности, но не в силe мышц. На третьем курсе реабилитации уже привычные пациентам воздействия дополнены ЭССМ в стационарном режиме и в ходьбе для активации локомоторных сетей спинного мозга. Эти суммарные воздействия сопровождались приростом силы мышц у пациентов с моторно-полным поражением спинного мозга в хронической стадии, причем преодолеть порог моторных пластических перестроек удалось 40% участников.
Динамика чувствительности и контроля мышц в ходе реабилитации различались, что подтверждается сравнением линий тренда, рассчитанным с помощью линейной регрессии по 5 и 6 контрольным тестам (рис. 1, табл. 4).
Таблица 4.
Линии тренда, характеризующие изменения неврологических характеристик
| Линия тренда | Тактильная чувствительность, LT | Болевая чувствительность, PP | Сила мышц, Motor |
|---|---|---|---|
| Линейная (тесты 1–5) | y = 5.78x + 0.08 R2 = 0.7632 |
y = 5.08x – 2.62 R2 = 0.9395 |
y = 1.18x – 0.32 R2 = 0.8612 |
| Линейная (тесты 1–6) | y = 4.8143x + 2.3333 R2 = 0.7638 |
y = 4.8143x + 2.3333 R2 = 0.7638 |
y = 2.3571x – 3.0667 R2 = 0.7377 |
Линия тренда по 5 контрольным точкам определяет ожидаемый по результатам двух курсов результат, по 6 точкам – фактическое изменение тренда по результатам заключительного тестирования: выявлено уменьшение угла наклона кривой по обоим видам чувствительности и увеличение по приросту силы. Связь прироста силы с применением ЭССМ представляется очень вероятной, тогда как снижение частоты прироста чувствительности может быть следствием реализации нейропластического ресурса ранее, на первых двух курсах. Очевидно, что умеренные позитивные сдвиги, наблюдавшиеся у большинства пациентов, не излечивают хронический паралич и не обеспечивают пациенту самостоятельной ходьбы, но даже минимальные сдвиги за относительно короткий период после многолетнего отсутствия позитивной динамики демонстрируют возможность мобилизовать нейропластический потенциал и расширить функциональные возможности пациентов. Об эффективности реабилитации с применением ЭССМ с локомоторными тренировками при моторно полных плегиях сообщали и другие авторы [27, 47–50]. Вероятно, традиционно применяемые методы реабилитации недостаточны для мобилизации нейропластического потенциала при хроническом поражении спинного мозга, что требует большего объема и интенсивности тренирующих воздействий.
Количественная оценка силы мышц, болевой и тактильной чувствительности в баллах AIS стандарта ASIA является достаточно точным инструментом тестирования пациентов с повреждениями спинного мозга. Этот же стандарт определяет полноту поражения спинного мозга в зависимости от наличия/отсутствия произвольного либо рефлекторного сокращения ануса и чувствительности в анальной зоне как наиболее каудальной зоны произвольного контроля мышц и чувствительности. В отличие от этого, классификации Frankel определяет полноту поражения по наличию/отсутствию движений и чувствительности ниже зоны поражения. В нашем исследовании для отбора пациентов использован стандарт ASIA, но одновременно учитывался и статус по Frankel. Оказалось, что пациенты, показавшие прогресс в силе мышц в ходе первого и второго курсов, относятся к типу С по Frankel, т.е. эти случаи могут рассматриваться как неполная плегия. Пользуясь обеими классификациями, мы пришли к мнению о неоправданно расширительной трактовке “полных” плегий в стандарте ASIA и предпочтительности использования классификации Frankel.
Локомоторные возможности, на которые непосредственно направлена тренировка ходьбы в экзоскелете, оценивали по выполнению тетрапедальной ходьбы вперед и назад, доступной большинству участников. Несмотря на то, что тренировки в экзоскелете реализовали бипедальную, а не тетрапедальную ходьбу, тестирование показало статистически значимое улучшение: выполняющие тесты самостоятельно сократили время их выполнения, а нуждающихся в помощи – потребность в ней. Суммарно прогресс зарегистрирован у 90% участников, т.е. абсолютное большинство участников расширило локомоторные возможности на доступном уровне.
Адаптивные перестройки, проявившиеся в изменении локомоторных возможностей и сенсорных и моторных характеристик, сопровождались увеличением амплитуды вызванных ответов в мышцах ног на всем протяжении реабилитации, тогда как динамика амплитуды Н-рефлекса в m. gastrocnemius lat. была более выраженной на первом (эффект активизации в ответ на тренировки ходьбы в экзоскелете) и третьем курсах (реакция на ЭССМ). Вызванные мышечные и рефлекторные изменения не были однородны, но наличие динамики подтверждает активную реакцию нейронных структур поясничного утолщения на комплексное тренирующее и стимулирующее воздействие.
Результаты исследования показали, что при интенсивных повторных курсах тренировок ходьбы в экзоскелете в апробированном режиме, сдвиги могут быть получены у значительной части пациентов. Успешность применявшейся нами технологии можно связать, в первую очередь, с сочетанием высокоэффективных методов восстановления локомоторной активности, оказывающих на спинальные локомоторные сети синергичный эффект. Экзоскелет не только обеспечивает кинематический рисунок движения, но и воздействует на рецепторы растяжения и опорных зон стопы, кроме того, при каждом шаге происходит смещение центра масс, дестабилизирующее вертикальную позу. ЭССМ активирует локомоторные структуры СМ, пневмостимуляция опорных зон стопы усиливает этот эффект и вместе они запускают активность-зависимую нейропластичность. Эффективность совмещения тренировок ходьбы в экзоскелете с функциональной электростимуляцией мышц [38–41], эпидуральной [42–44] и чрескожной [45–47] электростимуляцией спинного мозга показана и другими авторами, в том числе в систематическом обзоре [53].
Ограничения достоверности результатов обусловлены субъективным оцениванием неврологических характеристик (ASIA), несмотря на международно признанные стандарты такой оценки. Вторым ограничением является предварительный отбор пациентов по возрасту, физической готовности и мотивации, поэтому результаты не могут аппроксимироваться на всю популяцию пациентов с тяжелыми посттравматическими миелопатиями. Кроме того, тренировки ходьбы в экзоскелете дополнялись процедурами, направленными на активацию локомоторной (стимуляция опорных зон стопы) и постуральной (вертикализация с электростимуляцией мышц) активности, вследствие чего, достоверно определить вклад каждого метода при комплексной терапии от эффекта повторных курсов реабилитации не представляется возможным.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования с участием 37 пациентов с хроническим моторно-полным поражением спинного мозга посттравматической природы установлено, что комплексная реабилитация, проведенная в течение 3.5 мес. в виде 3 интенсивных курсов тренировок ходьбы в экзоскелете, пневмостимуляции опорных зон стопы и ЭССМ в стационарном режиме и в ходьбе сопровождалась приростом тактильной чувствительности у 28 (76%) чел. в среднем на 9.4 ± ± 1.5 баллов AIS (mean ± SE), болевой – у 22 (60%) на 8.0 ± 1.3 балла AIS и силы мышц – у 15 чел. (40.5%) на 3.9 ± 0.9 балла, существенным улучшением локомоторных возможностей у 27/31 (90%) чел. в виде значимого сокращения времени выполнения тестов с тетрапедальной ходьбой и снижения потребности в помощи при их выполнении, увеличением амплитуды вызванных ответов в мышцах голени, и разнонаправленными изменениями возбудимости мотонейронов (Н-рефлекса в m. gastrocnemius lat.). Изменения сенсорной и моторной составляющих имели разные тренды, прирост силы наблюдался при совместном применении тренировок в экзоскелете и ЭССМ.
Результаты рассматриваются как свидетельство сохранения потенциала пластических перестроек при хроническом посттравматическом поражении спинного мозга взрослых, который может быть реализован как функциональное восстановление при интенсивных тренирующих и стимулирующих воздействиях.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Научной проблемной комиссией и Этической комиссией Минздрава России.
Информированное согласие. В соответствии с положениями GCP каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование проведено в рамках клинической апробации Протокола 2017-7-11 при финансировании Министерством Здравоохранения России и частично грантом СПбГУ (проекты № 51134206/73025317).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Благодарности. Авторы выражают благодарность всем пациентам за доверие, сотрудничество и оптимизм, позволивших провести это исследование.
Список литературы
Hötting K., Röder B. Beneficial effects of physical exercise on neuroplasticity and cognition // Neurosci. Biobehav. Rev. 2013. V. 37. № 9. Pt. B. P. 2243.
Thompson A.K., Wolpaw J.R. Targeted neuroplasticity for rehabilitation // Prog. Brain Res. 2015. V. 218. P. 157.
Jutzeler C.R., Streijger F., Aguilar J. et al. Sensorimotor plasticity after spinal cord injury: a longitudinal and translational study // Ann. Clin. Transl. Neurol. 2018. V. 6. № 1. P. 68.
Lei Y., Perez M.A. Cortical contributions to sensory gating in the ipsilateral somatosensory cortex during voluntary activity // J. Physiol. 2017. V. 595. № 18. P. 6203.
Christiansen L., Perez M.A. Targeted-Plasticity in the Corticospinal Tract After Human Spinal Cord Injury // Neurotherapeutics. 2018. V. 15. № 3. P. 618.
Christiansen L., Chen B., Lei Y. et al. Acute intermittent hypoxia boosts spinal plasticity in humans with tetraplegia // Exp. Neurol. 2021. V. 335. P. 113483.
Schmidt R.A., Lee T.D. Motor Control and Learning: A Behavioral Emphasis. Champaign, IL: Human Kinetics, 2005. 544 p.
Wolpaw J.R. The education and re-education of the spinal cord // Prog. Brain Res. 2006. V. 157. P. 261.
Thompson A.K., Wolpaw J.R. H-reflex conditioning during locomotion in people with spinal cord injury // J. Physiol. 2019. https://doi.org/10.1113/JP278173
Chen Y., Chen L., Wang Y. et al. Why New Spinal Cord Plasticity Does Not Disrupt Old Motor Behaviors // J. Neurosci. 2017. V. 37. № 34. P. 8198.
Masugi Y., Kawashima N., Inoue D., Nakazawa K. Effects of movement-related afferent inputs on spinal reflexes evoked by transcutaneous spinal cord stimulation during robot-assisted passive stepping // Neurosci. Lett. 2016. V. 627. P. 100.
Quraishe S., Forbes L.H., Andrews M.R. The Extracellular Environment of the CNS: Influence on Plasticity, Sprouting, and Axonal Regeneration after Spinal Cord Injury // Neural. Plast. 2018. V. 2018. Article ID 2 952 386.
Hutson T.H., Di Giovanni S. The translational landscape in spinal cord injury: focus on neuroplasticity and regeneration // Nat. Rev. Neurol. 2019. V. 15. № 12. P. 732.
Militskova A., Mukhametova E., Fatykhova E. et al. Supraspinal and Afferent Signaling Facilitate Spinal Sensorimotor Network Excitability After Discomplete Spinal Cord Injury: A Case Report // Front. Neurosci. 2020. V. 14. P. 552.
Moshonkina T.R., Shapkova E.Y., Sukhotina I.A. et al. Effect of Combination of Non-Invasive Spinal Cord Electrical Stimulation and Serotonin Receptor Activation in Patients with Chronic Spinal Cord Lesion // Bull. Exp. Biol. Med. 2016. V. 161. № 6. P. 749.
Radhakrishna M., Steuer I., Prince F. et al. Double-Blind, Placebo-Controlled, Randomized Phase I/IIa Study (Safety and Efficacy) with Buspirone/Levodopa/Carbidopa (SpinalonTM) in Subjects with Complete AIS A or Motor-Complete AIS B Spinal Cord Injury // Curr. Pharm. Des. 2017. V. 23. № 12. P. 1789.
Marchionne F., Krupka A.J., Smith G.M., Lemay M.A. Intrathecal Delivery of BDNF Into the Lumbar Cistern Re-Engages Locomotor Stepping After Spinal Cord Injury // IEEE Trans. Neural. Syst. Rehabil. Eng. 2020. V. 28. № 11. P. 2459.
Pizzolato C., Gunduz M.A., Palipana D. et al. Non-invasive approaches to functional recovery after spinal cord injury: Therapeutic targets and multimodal device interventions // Exp. Neurol. 2021. V. 339. P. 113612.
Formento E., Minassian K., Wagner F. et al. Electrical spinal cord stimulation must preserve proprioception to enable locomotion in humans with spinal cord injury // Nat. Neurosci. 2018. V. 21. № 12. P. 1728.
Courtine G., Sofroniew M.V. Spinal cord repair: advances in biology and technology // Nat. Med. 2019. V. 25. № 6. P. 898.
Hofer A.S., Schwab M.E. Enhancing rehabilitation and functional recovery after brain and spinal cord trauma with electrical neuromodulation // Curr. Opin. Neurol. 2019. V. 32. № 6. P. 828.
Grillner S., Wallén P. Central pattern generators for locomotion, with special reference to vertebrate // Annu. Rev. Neurosci. 1985. V. 8. P. 233.
Edgerton V.R., Leon R.D., Harkema S.J. et al. Retraining the injured spinal cord // J. Physiol. 2001. V. 533(Pt 1). P. 15.
Tazoe T., Perez M.A. Effects of repetitive transcranial magnetic stimulation on recovery of function after spinal cord injury // Arch. Phys. Med. Rehabil. 2015. V. 96 (4 Suppl). P. S145.
Hofstoetter U.S., Freundl B., Binder H., Minassian K. Common neural structures activated by epidural and transcutaneous lumbar spinal cord stimulation: elicitation of posterior root-muscle reflexes // PLoS One. 2018. V. 13. № 1. P. e0192013.
Darrow D., Balser D., Netoff T.I. et al. Epidural Spinal Cord Stimulation Facilitates Immediate Restoration of Dormant Motor and Autonomic Supraspinal Pathways after Chronic Neurologically Complete Spinal Cord Injury // J. Neurotrauma. 2019. V. 36. № 15. P. 2325.
Beck L., Veith D., Linde M. et al. Impact of long-term epidural electrical stimulation enabled task-specific training on secondary conditions of chronic paraplegia in two humans // J. Spinal. Cord. Med. 2020. P. 1. https://doi.org/10.1080/10790268.2020.1739894
Megía García A., Serrano-Muñoz D., Taylor J. et al. Transcutaneous Spinal Cord Stimulation and Motor Rehabilitation in Spinal Cord Injury: A Systematic Review // Neurorehabil. Neural. Repair. 2020. V. 34. № 1. P. 3.
Al’joboori Y., Massey S.J., Knight S.L. et al. The Effects of Adding Transcutaneous Spinal Cord Stimulation (tSCS) to Sit-To-Stand Training in People with Spinal Cord Injury: A Pilot Study // J. Clin. Med. 2020. V. 9. № 9. P. 2765.
Григорьев А.И., Козловская И.Б., Шенкман Б.С. Роль опорной афферентации в организации тонической мышечной системы // Рос. физиол. журн. им. И.М. Сеченова. 2004. Т. 90. № 5. С. 508. Grigoryev A.I., Kozlovskaya I.B., Shenkman B.S. [The role of support afferentation in the organization of the tonic muscular system] // Russ. J. Physiol. 2004. V. 90. № 5. P. 508.
Bettio L., Thacker J.S., Hutton C., Christie B.R. Modulation of synaptic plasticity by exercise // Int. Rev. Neurobiol. 2019. V. 147. P. 295.
Sandrow-Feinberg H.R., Houlé J.D. Exercise after spinal cord injury as an agent for neuroprotection, regeneration and rehabilitation // Brain Res. 2015. V. 1619. P. 12.
Nam K.Y., Kim H.J., Kwon B.S. et al. Robot-assisted gait training (Lokomat) improves walking function and activity in people with spinal cord injury: a systematic review // J. Neuroeng. Rehabil. 2017. V. 14. № 1. P. 24.
Del-Ama A.J., Koutsou A.D., Moreno J.C. et al. Review of hybrid exoskeletons to restore gait following spinal cord injury // J. Rehabil. Res. Dev. 2012. V. 49. № 4. P. 497.
Onose G., Cârdei V., Crăciunoiu Ş.T. et al. Mechatronic Wearable Exoskeletons for Bionic Bipedal Standing and Walking: A New Synthetic Approach // Front. Neurosci. 2016. V. 10. P. 343.
Mekki M., Delgado A.D., Fry A. et al. Robotic Rehabilitation and Spinal Cord Injury: a Narrative Review // Neurotherapeutics. 2018. V. 15. № 3. P. 604.
Шапкова Е.Ю., Емельянников Д.В., Ларионова Ю.Е. и др. Динамика независимости и локомоторных возможностей при тренировках ходьбы в экзоскелете у пациентов с тяжелой хронической позвоночно-спинномозговой травмой // Хирургия позвоночника. 2020. Т. 17. № 4. С. 54. Shapkova E.Yu., Emelyannikov D.V., Larionova Yu.E. et al. Dynamics of independence and locomotor capabilities caused by powered exoskeleton-induced walk training in patients with severe chronic spinal cord injury // Hirurgiâ Pozvonočnika. 2020. V. 17. № 4. P. 54.
del-Ama A.J., Gil-Agudo A., Pons J.L., Moreno J.C. Hybrid FES-robot cooperative control of ambulatory gait rehabilitation exoskeleton // J. Neuroeng. Rehabil. 2014. V. 11. P. 27.
Zhang D., Ren Y., Gui K. et al. Cooperative Control for A Hybrid Rehabilitation System Combining Functional Electrical Stimulation and Robotic Exoskeleton // Front. Neurosci. 2017. V. 11. P. 725.
Ekelem A., Goldfarb M. Supplemental Stimulation Improves Swing Phase Kinematics During Exoskeleton Assisted Gait of SCI Subjects With Severe Muscle Spasticity // Front. Neurosci. 2018. V. 12. P. 374.
Murray S.A., Farris R.J., Golfarb M. et al. FES Coupled With A Powered Exoskeleton For Cooperative Muscle Contribution In Persons With Paraplegia // Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. 2018. V. 2018. P. 2788.
Wagner F.B., Mignardot J.B., Le Goff-Mignardot C.G. et al. Targeted neurotechnology restores walking in humans with spinal cord injury // Nature. 2018. V. 563. № 7729. P. 65.
Soloukey S., de Rooij J.D., Drenthen J. et al. Unilateral L2-Level DRG-stimulation evokes bilateral CPG-Like motor response in a patient with chronic pain // Brain Stimul. 2020. V. 13. № 6. P. 1719.
Gorgey A.S., Gill S., Holman M.E. et al. The feasibility of using exoskeletal-assisted walking with epidural stimulation: a case report study // Ann. Clin. Transl. Neurol. 2020. V. 7. № 2. P. 259.
Gad P., Gerasimenko Y., Zdunowski S. et al. Weight Bearing Over-ground Stepping in an Exoskeleton with Non-invasive Spinal Cord Neuromodulation after Motor Complete Paraplegia // Front. Neurosci. 2017. V. 11. P. 333.
Alam M., Ling Y.T., Wong A.Y.L. et al. Reversing 21 years of chronic paralysis via non-invasive spinal cord neuromodulation: a case study // Ann. Clin. Transl. Neurol. 2020. V. 7. № 5. P. 829.
Shapkova E.Y., Pismennaya E.V., Emelyannikov D.V., Ivanenko Y. Exoskeleton Walk Training in Paralyzed Individuals Benefits From Transcutaneous Lumbar Cord Tonic Electrical Stimulation // Front. Neurosci. 2020. V. 14. P. 416.
Gad P., Gerasimenko Y., Zdunowski S. et al. Weight bearing over-ground stepping in an exoskeleton with non-invasive spinal cord neuromodulation after motor complete paraplegia // Front. Neurosci. 2017. V. 11. P. 333.
Angeli C.A., Boakye M., Morton R.A. et al. Recovery of over-ground walking after chronic motor complete spinal cord injury // N. Engl. J. Med. 2018. V. 379. № 13. P. 1244.
Gill M.L., Grahn P.J., Calvert J.S. et al. Neuromodulation of lumbosacral spinal networks enables independent stepping after complete paraplegia // Nat. Med. 2018. V. 24. № 11. P. 1677.
Pais-Vieira C., Allahdad M., Neves-Amado J. et al. Method for positioning and rehabilitation training with the ExoAtlet® powered exoskeleton // MethodsX. 2020. V. 7. № 1. P. 100849.
Емельянников Д.В., Шапкова Е.Ю., Мошонкина Т.Р., Герасименко Ю.П. Оценка возбудимости мотонейронов поясничного утолщения: сравнение Н-рефлекса и метода чрескожной стимуляции спинного мозга // Физиология человека. 2016. Т. 42. № 3. С. 32. Emeliannikov D.V., Shapkova E.Y., Moshonkina T.R., Gerasimenko Y.P. [Evaluation of motor neuron excitability in lumbosacral spinal cord: transcutaneous spinal cord stimulation as compared to H-reflex] // Fiziol. Cheloveka. 2016. V. 42. № 3. P. 32.
Yu P., Zhang W., Liu Y. et al. The effects and potential mechanisms of locomotor training on improvements of functional recovery after spinal cord injury // Int. Rev. Neurobiol. 2019. V. 147. P. 199.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


