Физиология человека, 2021, T. 47, № 5, стр. 17-27
Исследование когерентности ЭЭГ у детей с расстройствами аутистического спектра: неоднородность группы
Е. А. Лущекина 1, *, В. С. Лущекин 2, В. Б. Стрелец 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ГБУЗ Научно-практический центр детской психоневрологии ДЗМ
Москва, Россия
* E-mail: elena.luschekina@yandex.ru
Поступила в редакцию 18.02.2020
После доработки 04.05.2020
Принята к публикации 30.09.2020
Аннотация
В двух подгруппах детей 4 года 5 мес.–7 лет 9 мес. (ср. возраст 6 лет 1 мес.) с расстройствами аутистического спектра (РАС), в одной из которых предполагается дальнейшее развитие по шизотипическому типу (группа ШТ), а в другой – по аутистическому типу (группа АТ) обнаружены разнонаправленные изменения когерентности парных связей коры головного мозга. Наибольшие изменения по сравнению с нормой наблюдаются в группе АТ: на большинстве исследованных ритмов увеличение межполушарной когерентности отмечается в задних и задне-центральных отделах, а ее уменьшение – в передних отделах; показатели внутриполушарной когерентности в большей степени увеличиваются в правом полушарии, а уменьшаются более выражено в левом полушарии. Наиболее значимые изменения когерентности в группе АТ обнаружены на частотах θ- и γ-ритмов в области речевой зоны (Т3–Т5). В группе ШТ более выражены изменения в сторону увеличения показателей межполушарных и внутриполушарных связей, чем в сторону их уменьшения. Изменения когерентности по сравнению с нормой в исследуемом возрасте больше выражены в группе АТ, чем в группе ШТ, видимо вследствие более раннего проявления патологии развития при аутизме, чем при шизофрении. Полученные данные обсуждаются с точки зрения теории двух альтернативных подходов – избыточных и пониженных связей как маркеров РАС.
Попытки выделить среди континуума больных расстройствами аутистического спектра (РАС) подгруппы, отличающиеся друг от друга по особенностям биоэлектрической активности, единичны [1, 2]. Однако подобные исследования представляются весьма важными, в частности, для разграничения (РАС) и ранней детской шизофрении [3, 4]. Предыдущие исследования особенностей фоновой ЭЭГ позволили выделить две подгруппы детей с РАС, в одной из которых предполагается дальнейшее развитие по шизотипическому типу (группа ШТ), а в другой – по аутистическому типу (группа АТ). В группах АТ и ШТ по сравнению с группой нормально развивающихся детей того же возраста показано наличие прогностически значимых особенностей спектральной мощности (СМ) в каждой из обследованных групп [5]. Помимо характеристик СМ важную роль в определении принадлежности больного к той или другой группе играют изменения в меж- и внутриполушарных взаимодействиях [6].
Исследование синхронности работы нейронов на основе измерения вариации фаз ЭЭГ независимо от амплитуды процесса позволяет выявить роль низкоамплитудных колебаний, которые могут не обнаруживаться при исследовании спектральной мощности [7, 8]. Известно, что для фоновой активности у взрослых больных шизофренией характерны не только уменьшение СМ основных ритмов, но и разобщенность работы полушарий, снижение синхронности в лобных и центральных отделах [8]. Показано, что нарушение межполушарных отношений при шизофрении связано с дефицитом тормозных систем головного мозга [9]. У детей и подростков, страдающих данным заболеванием, описана выраженная вариативность связей [10], а также нарушение синхронности [11] по сравнению со здоровыми испытуемыми. В целом, при анализе данных литературы относительно функциональных связей при шизофрении и РАС выявляются существенные противоречия и расхождения, по-видимому, в первую очередь связанные с условиями регистрации [12]. В настоящем исследовании изучались особенности когерентности ЭЭГ в фоне в группах АТ и ШТ в сравнении с группой нормально развивающихся детей того же возраста. Основное внимание было уделено α- и γ-диапазонам, поскольку в предыдущих исследованиях спектральной мощности именно на этих частотах были получены наиболее существенные различия [5].
МЕТОДИКА
В исследовании принимали участие мальчики-правши в возрасте от 4 лет 5 мес. до 7 лет 9 мес. Первая группа – группа контроля состояла из здоровых детей (36 чел., средний возраст 7 лет 1 мес.). Вторая группа состояла из детей с РАС и соответствовала диагнозу F. 84.0. по Международной классификации болезней (39 чел., средний возраст 6 лет 2 мес.). Эта группа была предварительно разделена с помощью дискриминантного анализа на 2 подгруппы [6]. Одна подгруппа была близка по своим характеристикам к больным с расстройствами шизофренического спектра. Ее рассматривали как группу РАС, в которой в дальнейшем предполагается развитие по шизотипическому типу (ШТ, 18 чел., средний возраст 6 лет 1 мес.); вторую подгруппу рассматривали как группу, в которой предполагается дальнейшее развитие по аутистическому типу (АТ, 21 чел., средний возраст 6 лет 2 мес.).
Испытуемые находились на этапе предварительного обследования в Детском психоневрологическом Центре (г. Москва) и еще не получали медикаментозного лечения. Дети, участвующие в исследовании понимали и выполняли речевые команды и могли воспроизвести цифровой ряд или произвести простые арифметические действия.
ЭЭГ-регистрацию проводили от 16 электродов по стандартной схеме 10–20% и объединенных ушных электродов с помощью электрофизиологического многоканального усилителя CONAN 4.5 и персонального компьютера в диапазоне 0.3–75 Гц с частотой опроса 256 Гц, постоянной времени 0.3 с и эпохой анализа 60 с. Испытуемые находились в состоянии покоя с закрытыми глазами. После стандартных процедур первичной обработки, включающей полосовую фильтрацию для удаления сетевых помех и вырезания артефактов, данные подвергали вторичной обработке с помощью программ анализа биоэлектрической активности. Спектральные характеристики вычисляли с использованием быстрого преобразования Фурье; статистическому анализу подвергали средние значения амплитуд в частотных диапазонах. Исследовали когерентность парных связей в диапазоне θ2-ритма (6–7.5 Гц), в поддиапазонах α-ритма (8–9; 9–10; 11–12 и 12–13 Гц), а также в диапазоне γ-ритма (30–45 Гц). Использовали показатели натурального логарифма когерентности (ln Ког), которые имели распределения, близкие к нормальным, что позволило исследовать их средствами параметрической статистики. При анализе значений когерентности в зависимости от размера группы определяли порог достоверности (3σ, р < 0.001) по Z-критерию. Для группы больных порог значений когерентности составил 0.482, а для группы здоровых испытуемых – 0.260. Достоверность различий средних значений независимых групп ЭЭГ-файлов для межгрупповых сравнений определяли с помощью t-теста Стьюдента. Использовали компьютерную систему анализа и топографического картирования электрической активности мозга с нейрометрическим банком ЭЭГ-данных “Brainsys” [13], которая позволяла строить карты значимых (с вероятностью ошибки p < 0.001) изменений парных связей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследовали особенности межполушарных и внутриполушарных связей в двух подгруппах детей с РАС, в группах АТ и ШТ. Практически на всех ритмах когерентность в экспериментальных группах менялась разнонаправлено по сравнению с нормой. В анализ поддиапазонов α-ритма был включен “детский” α-подобный θ-ритма (6–7.5 Гц). Во внимание принимались только те различия показателей когерентности в экспериментальных группах по сравнению с нормой, которые имели наиболее высокую степень достоверности межгрупповых различий (р < 0.001).
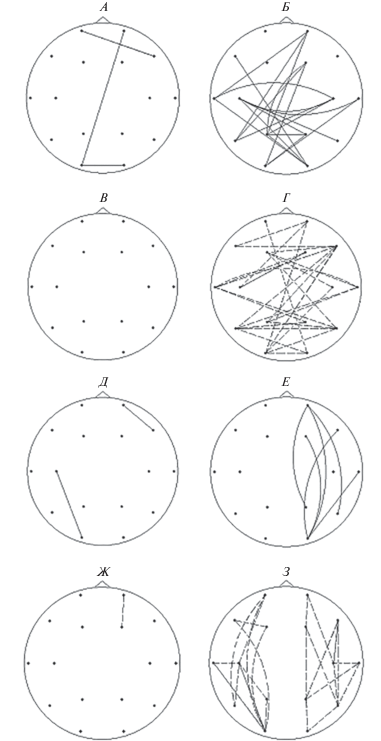
На “детском” α-подобном θ-ритме (6–7.5 Гц) в группе ШТ обнаружено слабо выраженное увеличение показателей межполушарных коротких и средних связей в лобных и затылочных отделах (рис. 1, А), изменений в сторону уменьшения не обнаружено (рис. 1, В). В группе АТ наблюдались разнонаправленные изменения межполушарных связей по сравнению с нормой. Увеличение межполушарной связанности более выражено в отведениях О1, О2, Р3, Р4, Т3, Т5, Т6, т.е. в задних и теменных отделах (рис. 1, Б); уменьшение отмечалось в отведениях Fр1, Fр2, F7, С3, С4, Т4, т.е. в передне-центральных отделах (рис. 1, Г). Изменения внутриполушарных связей в обеих группах разнонаправлены и также более выражены в группе АТ. В группе ШТ (так же, как и для межполушарных связей) преобладают незначительные изменения средних связей в сторону увеличения, в особенности, в левом лобно-височном отделе (рис. 1, Д). В группе АТ наблюдается более выраженное увеличение показателей когерентности в задних отделах (О2, Т6) правого полушария (рис. 1, Е) и преимущественный дефицит связей в левом полушарии, в особенности во фронтальной (Fр1, F3), височной (Т3), задневисочной (Т5) и теменной (Р3) зонах (рис. 1, З). В правом полушарии увеличенных показателей внутриполушарных связей в 4 раза больше, чем в левом (рис. 2).
Рис. 1.
Карты различий когерентности при сравнении контрольной группы с экспериментальными группами в 16 отведениях на частоте 6–7.5 Гц. Сплошная линия соответствует изменениям в сторону превышения показателей в экспериментальной группе по сравнению с нормой; пунктирная линия соответствует изменениям в сторону снижения показателей в экспериментальной группе по сравнению с нормой. Карты различий слева (А, В, Д, Ж) соответствуют результатам сравнения группы ШТ с нормой. Карты различий справа (Б, Г, Е, З) соответствуют результатам сравнения группы АТ с нормой. Карты различий вверху (А, Б, В, Г) отражают изменения межполушарных связей. Карты различий внизу (Д, Е, Ж, З) отражают изменения внутриполушарных связей. Во внимание принимались только те различия показателей когерентности в экспериментальных группах по сравнению с нормой, которые имели наиболее высокую степень достоверности (р < 0.001).
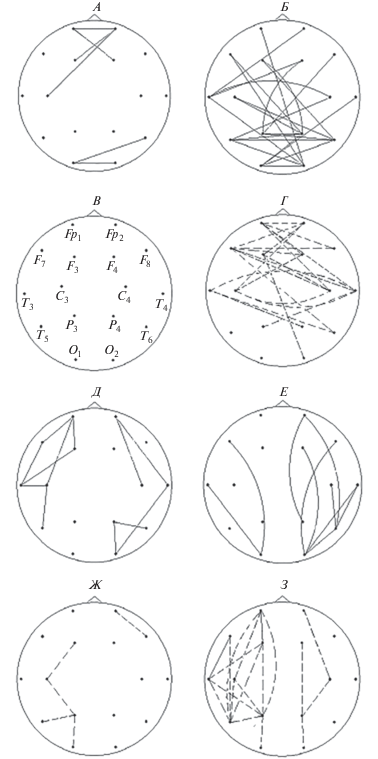
Рис. 2.
Процентное содержание достоверных изменений парных связей в θ2 и поддиапазонах α-ритма в левом (темные полоски), правом (светлые полоски) полушариях. А – группа ШТ; Б – группа АТ. Достоверные меж-групповые различия отмечены звездочками (p(t) < 0.01).
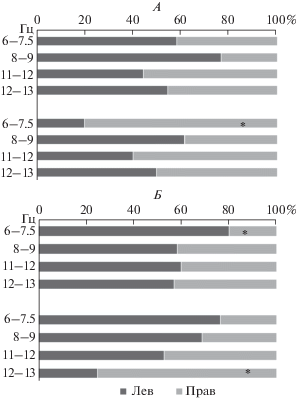
На частоте 8–9 Гц в обеих группах обнаружены незначительные разнонаправленные изменения как меж-, так и внутриполушарных связей. Различия между группами ШТ и АТ незначительны (рис. 2).
На частоте 9–10 Гц разнонаправленные изменения имели минимальную выраженность.
На частоте 11–12 Гц в группе АТ наблюдались разнонаправленные изменения межполушарных связей. Многие длинные связи имеют более высокие показатели когерентности по сравнению с нормой по отведениям F3, Т4, Т6, О1, О2, т.е. преимущественно в задних отделах, за исключением F3 (рис. 3, Б). При этом в лобных отделах в обоих полушариях выявляется выраженное уменьшение показателей когерентности на коротких и средних межэлектродных расстояниях для межполушарных связей (рис. 3, Г). В группе ШТ обнаруживается менее выраженное по сравнению с группой АТ увеличение показателей средних и длинных межполушарных связей, в которое наиболее включено отведение О1 (рис. 3, А); уменьшения межполушарной связанности не отмечается (рис. 3, В).
Рис. 3.
Карты различий когерентности при сравнении контрольной группы с экспериментальными группами в 16 отведениях на частоте 11–12 Гц. Остальные обозначения см. рис. 1.
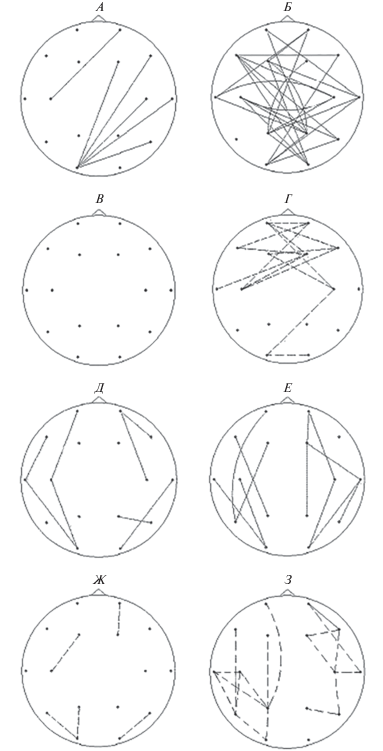
При анализе внутриполушарных связей в обеих группах обнаружены разнонаправленные изменения по сравнению с нормой. В группе ШТ в основном увеличивается количество показателей когерентности для коротких и средних связей в обоих полушариях (рис. 2, рис. 3, Д), в группе АТ – средних и длинных более выражено в правом полушарии, особенно в отведении Т4 ( рис. 2, рис. 3, Е). Уменьшение показателей когерентности для внутриполушарных связей различной длины в группе АТ отмечается в обоих полушариях практически в равной степени с небольшим преобладанием слева (рис. 5). Локализация значимых различий наиболее выражена в отведениях Т5, Р3, С3 левого полушария (рис. 3, З). В целом, уменьшение внутриполушарной связанности более выражено в группе АТ (рис. 3, З) по сравнению с группой ШТ (рис. 3, Ж). В группе ШТ, так же как и в группе АТ уменьшение показателей когерентности отмечалось с небольшим преимуществом слева (рис. 2).
Рис. 4.
Карты различий когерентности при сравнении контрольной группы с экспериментальными группами в 16 отведениях на частоте 12–13 Гц. Остальные обозначения см. рис. 1.
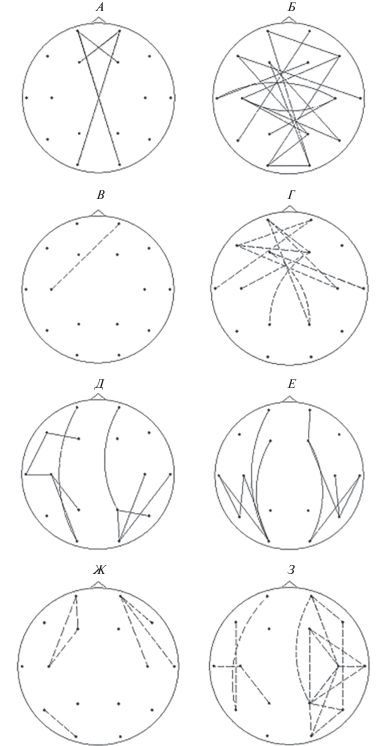
Рис. 5.
Карты различий когерентности при сравнении контрольной группы с экспериментальными группами в 16 отведениях на частоте 30–45 Гц. Остальные обозначения см. рис. 1.
На частоте 12–13 Гц в обеих группах также выявлялись разнонаправленные изменения межполушарных связей по сравнению с нормой, более выраженные в группе АТ. Увеличение показателей когерентности для межполушарных связей разной длины в группе ШТ наблюдалось преимущественно в передних отделах – Fр1, Fр2, F3, F4. Увеличение для длинных связей отмечалось симметрично между лобными и затылочными отделами (рис. 2, рис. 3, А). В группе АТ увеличение межполушарной связанности имело место по большинству исследованных отведений (рис. 4, Б). Уменьшение показателей для межполушарных связей в группе ШТ выражено незначительно (рис. 4, В). В группе АТ оно наблюдалось в передне-центральных отделах и не захватывало задневисочные и затылочные области (рис. 4, Г). Увеличение показателей для внутриполушарных связей (в том числе и длинных) отмечалось в обеих экспериментальных группах в обоих полушариях (рис. 4, Д, Е). Незначительное уменьшение внутриполушарной связанности в группе ШТ отмечено в передних отделах обоих полушарий (рис. 4, Ж). В группе АТ уменьшение показателей внутриполушарных связей почти в 4 раза более выражено в правом полушарии, чем в левом (рис. 2). Уменьшение внутриполушарной связанности более выражено для группы АТ, по сравнению с группой ШТ (рис. 4, Ж, З).
На частоте γ (30–45 Гц) в группе ШТ изменения по сравнению с нормой незначительны (рис. 5, А, В, Д, Ж). В группе АТ обнаружены разнонаправленные изменения межполушарных связей. Увеличение показателей межполушарных связей в группе АТ в основном отмечается в задних левых отделах в отведениях С3, Т5, Р3 и в правом затылочном отведении О2 (рис. 5, Б). Уменьшение наблюдается в обоих полушариях в передне-центральных отделах F4, F8, а также в височных отделах Т3, Т5, Т6, и в левом затылочном отведении О1 (рис. 5, Ж). В правом полушарии обнаружено асимметричное увеличение внутриполушарной связанности (рис. 5, Е). Уменьшение показателей внутриполушарных связей в группе АТ более выражено в задне-теменно-центральных отделах левого полушария О1, Р3, С3 (рис. 5, З).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нарушение когерентности ритмов ЭЭГ связано с большим кругом заболеваний мозга [14], в том числе, с шизофренией и аутизмом [15–18]. В научной литературе, посвященной особенностям когерентности при РАС обсуждаются генетически обусловленные нарушения [19], а также влияние измененного пранинга (pruning) [20]. Результаты исследований когерентности различных ритмов при РАС [12] и шизофрении [14, 21] весьма противоречивы, что может быть связано с различными условиями регистрации [12]. Следует обратить внимание на то, что подавляющее большинство работ сосредоточено на α-ритме [14, 22–24]. По-видимому, это не случайно. Как показали наши предыдущие исследования спектральной мощности [5], именно при анализе α-ритма по поддиапазонам, выявляются тонкие различия между ШТ и АТ группами больных РАС. В связи с этим в настоящем исследовании когерентности мы также уделили наибольшее внимание данному ритму и его поддиапазонам. Достоверные изменения в экспериментальных группах по сравнению с нормой были обнаружены также на частоте “детского” α-подобного θ-ритма (6–7.5 Гц). Этот ритм возникает в возрасте 3–6 лет и сочетает частоту θ-ритма (6–8 Гц) со свойствами α-ритма (десинхронизация на открывание глаз) [25]. Кроме того, анализировали изменения когерентности на частоте γ-ритма, играющего большую роль в нарушениях, свойственных РАС и шизофрении [26].
Имеются данные о том, что при шизофрении [14, 21] и аутизме [27, 28] в первую очередь страдают функциональные взаимосвязи между относительно удаленными отделами, при этом доля этих взаимосвязей для соседних отделов даже возрастает по сравнению с группой здоровых детей. Это значит, что процесс дезинтеграции в наибольшей степени затрагивает удаленные друг от друга области. Однако возможно, что избыток связей по сравнению с нормой оказывает не менее деструктивное влияние на работу мозга.
Избыточность межполушарных и внутриполушарных связей, обнаруженная нами в обеих экспериментальных группах (преимущественно в группе АТ), отмечена и в других работах и соответствует представлениям об избыточности анатомических и функциональных связей при РАС [29], в особенности данным о выраженном увеличении связей между фронтальной и центральной областями на частоте α-ритма как маркере группы риска по РАС [24]. В то же время в нашем исследовании в группе АТ наблюдаются избыточные связи, в большей степени, локализованные в задне-теменных и задневисочных отделах.
Наряду с представлениями об избыточности лобно-центральных связей как маркере РАС [24], существует прямо противоположная теория, так называемая теория пониженных связей, основанная на данных функциональной магнитно-резонансной томографии (фМРТ) [23, 30]. Таким образом, в литературе имеются данные не только об увеличении, но об уменьшении показателей как внутри-, так и межполушарных связей по α-ритму при РАС. Полученные нами результаты об уменьшении межполушарной связанности на частоте α-ритма, преимущественно в передних и передне-центральных отделах, более выраженным в группе АТ по сравнению с группой ШТ, подтверждают обсуждаемые в литературе тенденции, связанные с уменьшением длинных связей на частоте α-ритма между лобным отделом и другими отделами мозга при РАС. Описанные тенденции относятся и к состоянию покоя с закрытыми глазами [31] и к функциональным пробам – тестам на узнавание предмета [32] и на чтение [33]. Более слабая функциональная взаимосвязанность коры у больных РАС по сравнению с нормой на частоте α-ритма описана в литературе при исследовании механизмов внимания. Методом линейной регрессии показано, что характер ослабления функциональных связей между лобными и теменными отделами, а также лобных и теменных отделов с вентральными областями объясняет уникальную вариативность симптомов нарушения внимания не только при РАС, но и при синдроме дефицита внимания и гиперактивности (СДВГ) [34].
Обнаруженное нами уменьшение внутриполушарной когерентности, локализованное преимущественно в задних отделах, более выраженное в группе АТ, наряду с уже упоминавшимся фактом об изменении взаимосвязей левой затылочной области в группе ШТ, вносит вклад в обсуждаемый вопрос об атипичных связях затылочной коры как механизме нарушения зрительного восприятия [34], в том числе восприятия лиц [35–37]. Изменения когерентности при РАС обсуждаются также в связи с анализом нарушения эмоциональных проявлений и выполнения тестовых заданий. При исследовании такого симптома, как тревожность, также показана специфичность изменений когерентности [34]. Есть данные о том, что чем ниже согласованность лобно-теменных связей, тем хуже выполнение заданий испытуемыми [38], что может быть эффективно скорректировано при помощи тренинга по обратной связи, направленного на преодоление функциональных последствий пониженной когерентности [28]. Также показана возможность частичной компенсации специфических изменений когерентности в ходе терапии шизофрении и депрессии [39].
Уменьшение показателей когерентности описано не только на частоте α-ритма [40, 41], но и для δ- [40], θ- [38, 40] и высокочастотного β- [41] диапазонов. В литературе имеются также сведения об особой значимости изменений наиболее высокочастотного γ-ритма при шизофрении [42] и аутизме [26]. Полученные в нашем исследовании результаты о левостороннем дефиците и правосторонней избыточности внутриполушарных связей в группе АТ на частоте γ-ритма частично согласуются с данными о преимущественных изменениях высокочастотных ритмов в левом полушарии при аутизме [26] и дополняют сложную картину нарушений внутрикоркового взаимодействия при данном заболевании. Обнаруженное нами в группе АТ уменьшение межполушарных связей в левой задневисочной области подтверждает представления о механизмах нарушений речевой функции [43, 44].
Сопоставляя локализацию изменений когерентности и функциональных нарушений, характерных для аутизма, следует отметить, что изменения когерентности преимущественно описаны, как и в нашем исследовании, в лобно-теменных [38], лобно-височных [27], височных [40] и затылочных [40] областях. Указанные области относятся к специально выделенным зонам, функции которых максимально нарушены при аутизме [45]. Таким образом, изменение функционирования связей в указанных отделах могут объяснить выраженность нарушений речевых [43, 46] и зрительных [34–36] функций при РАС. Нельзя исключить, что нарушение первичного звена восприятия в корковых проекциях зрительного анализатора обоих полушарий препятствует точной идентификации лиц и эмоциональных состояний.
Поскольку все изменения когерентности, обнаруженные нами для исследованной возрастной группы оказались более выраженными в группе АТ, можно предположить, что проявления функциональных признаков заболевания в группе ШТ обнаруживается позже по сравнению с группой АТ. Распад связей, характерный для шизофрении, описан, начиная с подросткового возраста [21]. На более ранних этапах описаны только случаи инфантильного детского психоза [47]. По-видимому, обнаруженные нами изменения в экспериментальных группах по сравнению с нормой, в группе “истинных аутистов” начинают проявляться раньше, чем у детей, которые будут далее развиваться по шизотипическому варианту.
ВЫВОДЫ
1. В двух подгруппах детей 4.5–7.9 лет (ср. возраст 6.05 лет) с РАС, в одной из которых предполагается дальнейшее развитие по шизотипическому типу (группа ШТ), а в другой – по аутистическому типу (группа АТ) обнаружены разнонаправленные изменения когерентности парных связей коры головного мозга.
2. В группе АТ на частоте α-ритма увеличение показателей межполушарной когерентности преимущественно отмечается в задних и задне-центральных отделах, а ее уменьшение – в передних отделах; внутриполушарная когерентность в большей степени увеличивается на частоте θ- и γ-ритмов в правом полушарии, а уменьшается более выражено в левом полушарии. Значимые изменения когерентности в группе АТ обнаружены в области речевой зоны (Т3–Т5), в особенности на частотах θ- и γ-ритмов.
3. В группе ШТ более выражены изменения в сторону увеличения показателей межполушарных и внутриполушарных связей, чем в сторону их уменьшения.
4. Изменения когерентности по сравнению с нормой больше выражены в группе АТ, чем в группе ШТ, видимо вследствие более раннего проявления патологии развития при аутизме, чем при шизофрении.
5. Полученные данные обсуждаются с точки зрения теории двух альтернативных подходов – избыточных и пониженных связей как маркеров РАС.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института высшей нервной деятельности и нейрофизиологии РАН (Москва). Протокол заседания Комиссии по этике от 15 июля 2019 г. № 3.
Информированное согласие. Каждый родитель (законный представитель) участника исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана грантом РФФИ (№ 20-013-00395А) и средствами государственного бюджета по госзаданию на 2019–2021 гг. (№ г.р. АААА-А17-117092040004-0).
Список литературы
Duffy F.H., Shankardass A., McAnulty G.B. et al. The relationship of Asperger’s syndrome to autism: a preliminary EEG coherence study // BMC Neurol. 2013. V. 11. P. 175.
Duffy F.H., Als H. Autism, spectrum or clusters? An EEG coherence study // BMC Neurol. 2019. V. 19. № 1. P. 27.
King B.H., Lord C. Is schizophrenia on the autism spectrum? // Brain Res. 2011. V. 1380. P. 34.
Иовчук Н.М., Северный А.А. Современные проблемы диагностики аутизма // Электронный журнал “Психологическая наука и образование psyedu.ru”. E-journal “Psychological Science and Education psyedu.ru”. 2013. № 5. С. 91.
Лущекина Е.А., Лущекин В.С., Стрелец В.Б. Исследование спектральной мощности ЭЭГ у детей с расстройствами аутистического спектра: неоднородность группы // Физиология человека. 2019. Т. 45. № 3. С. 242. Lushchekina E.A., Lushchekin V.S., Strelets V.B. EEG Spectral Power in Children with Autistic Spectrum Disorders: Heterogeneity of the Group // Human Physiology. 2019. V. 45. № 3. P. 242.
Лущекина Е.А., Лущекин В.С., Стрелец В.Б. Биоэлектрическая активность мозга детей с расстройствами аутистического спектра: неоднородность группы // Физиология человека. 2018. Т. 44. № 4. С. 32. Lushchekina E.A., Lushchekin V.S., Strelets V.B. Bioelectric Brain Activity in Children with Autistic Spectrum Disorders: Population Heterogeneity // Human Physiology. 2018. V. 44. № 4. Р. 386.
Ливанов М.Н. Пространственная организация процессов головного мозга. М.: Наука, 1972. 181 с.
Стрелец В.Б., Гарах Ж.В., Новотоцкий-Власов В.Ю. и др. Соотношение между мощностью и синхронизацией ритмов ЭЭГ в норме и при когнитивной патологии // Журн. высш. нерв. деят. 2005. Т. 55. № 4. С. 496.
Изнак А.Ф. Нарушения структурно-функциональной организации головного мозга при шизофрении // Психиатрия. 2008. Т. 33. № 3. С. 25.
Arruda G.F., Costa L.F., Schubert D. et al. Structure and dynamics of functional networks in child-onset schizophrenia // Clin. Neurophysiol. 2014. V. 125. № 8. P. 1589.
Кулаичев А.П., Горбачевская Н.Л., Горюнов А.В. и др. Различия показателей биоэлектрической активности ЭЭГ у здоровых и больных шизофренией детей и подростков // Журн. неврол. и психиатр. им. С.С. Корсакова. 2012. Т. 112. № 12. С. 55.
Gurau O., Bosl W.J., Newton C.R. How Useful is electroencephalography in the Diagnosis of Autism Spectrum Disorders and the Delineation of Subtypes: A Systematic Review // Front. Psychiatry. 2017. V. 8. № 121. P. 1.
Горбачевская Н.Л., Митрофанов А.А. Роль количественных методов анализа электроэнцефалограммы в детской психиатрии // Медицинский алфавит. 2008. № 4. С. 13.
Henshall K.R., Sergejew A.A., Colette G.R. et al. Interhemispheric EEG coherence is reduced in auditory cortical regions in schizophrenia patients with auditory hallucinations // Int. J. Psychophysiol. 2013. V. 89. № 1. P. 63.
Pascual-Belda A., Díaz-Parra A., Moratal D. Evaluating Functional Connectivity Alterations in Autism Spectrum Disorder Using Network-Based Statistics // Diagnostics. 2018. V. 8. № 51. P. 1.
Boutros N.N., Lajiness-O’Neill R., Zillgitt A. et al. EEG changes associated with autistic spectrum disorders // Neuropsychiatr. Electrophysiol. 2015. V. 1. № 3. https://doi.org/10.1186/s40810-014-0001-5
Matlis S., Boric K., Chu C.J. et al. Robust disruptions in electroencephalogram cortical oscillations and large-scale functional networks in autism // BMC Neurol. 2015. V. 15. P. 95.
Shephard E., Tye C., Ashwood K.L. et al. Resting-State Neurophysiological Activity Patterns in Young People with ASD, ADHD, and ASD + ADHD // J. Autism Dev. Disord. 2018. V. 48. № 1. P. 110.
Moseley R.L., Ypma R.J.F., Holt R.J. et al. Whole-brain functional hypoconnectivity as an endophenotype of autism in adolescents // Neuro Image: Clinical. 2015. V. 9. P. 140.
Schwartz S., Kessler R., Gaughan T., Buckley A.W. Electroencephalogram Coherence Patterns in Autism: An Updated Review // Pediatr. Neurol. 2017. V. 67. P. 7.
Борисов С.В., Каплан А.Я., Горбачевская Н.Л., Козлова И.А. Анализ структурной синхронности ЭЭГ подростков, страдающих расстройствами шизофренического спектра // Физиология человека. 2005. Т. 31. № 3. С. 16. Borisov S.V., Kaplan A.Ya., Gorbachevskaya N.L., Kozlova I.A. Analysis of EEG Structural Synchrony in Adolescents with Schizophrenic Disorders // Human Physiology. 2005. V. 31. № 3. P. 255.
Lefebvre A., Delorme1 R., Delanoë K. et al. Alpha Waves as a Neuromarker of Autism Spectrum Disorder: The Challenge of Reproducibility and Heterogeneity // Front. Neurosci. 2018. V. 12. P. 662.
Dickinson A., DiStefanoa C., Lina Y.-Y., Schefflerb A.W. Interhemispheric alpha-band hypoconnectivity in children with autism spectrum disorder // Behav. Brain Res. 2018. V. 348. P. 227.
Orekhova E.V., Elsabbagh M., Jones E.J.H. et al. EEG hyper-connectivity in high-risk infants is associated with later autism // J. Neurodev. Disord. 2014. V. 6. № 1. P. 40.
Благосклонова Н.К., Новикова Л.А. Детская клиническая электроэнцефалография. М.: Медицина, 1994. 204 с.
Askari E., Setarehdan S.K., Sheikhani A. et al. Computational model for detection of abnormal brain connections in children with autism // J. Integr. Neurosci. 2018. V. 17. № 3. P. 237.
Shou G., Mosconi M.W., Wang J. et al. Electrophysiological signatures of atypical intrinsic brain connectivity networks in autism // J. Neural Eng. 2017. V. 14. № 4. P. 046010.
Pineda J.A., Juavinett A., Datko M. Self-regulation of brain oscillations as a treatment for aberrant brain connections in children with autism // Neuropsychol. 2012. V. 79. № 6. P. 790.
Herbert M.R., Ziegler D.A., Makris N. et al. Localization of white matter volume increase in autism and developmental language disorder // Ann Neurol. 2004. V. 55. № 4. P. 530.
Just M., Keller T., Malave V.L. et al. Autism as a neural systems disorder: a theory of frontal-posterior underconnectivity // Neurosci. Biobehav. Rev. 2012. V. 36. № 4. P. 1292.
Murias M., Webb S.J., Greenson J., Dawson G. Resting state cortical connectivityreflected in EEG coherence in individuals with autism // Biol. Psychiatry. 2007. V. 62. № 3. P. 270.
Catarino A., Andrade A., Churches O. et al. Task-related functional connectivity in autism spectrum conditions: an EEG study using wavelet transform coherence // Mol. Autism. 2013 V. 4. № 1. P. 1.
Carson A.M., Salowitz N.M., Scheidt R.A. et al. Electroencephalogram coherence in children with and without autism spectrum disorders: decreased interhemispheric connectivity in autism // Autism Res. 2014. V. 7. № 3. P. 334.
Yerys B.E., Birkan T., Satterthwaite T.D. et al. Functional connectivity of fronto-parietal and salience/ventral attention networks have independent associations with co-occurring ADHD symptoms in children with autism // Biol. Psychiatry. Cogn. Neurosci. Neuroimaging. 2019. № 4. № 4. P. 343.
Tye Ch., Mercure E., Ashwood K.L. et al. Neurophysiological responses to faces and gaze direction differentiate children with ASD, ADHD and ASD + ADHD Dev // Cogn. Neurosci. 2013. V. 5. P. 71.
Fishman I., Linke A., Hau J. Atypical Functional Connectivity of Amygdala Related to Reduced Symptom Severity in Children With Autism // J. Am. Acad. Child Adolesc. Psychiatry. 2018. V. 57. № 10. P. 764.
Loth E., Garrido L., Ahmad J. et al. Facial expression recognition as a candidate marker for autism spectrum // Molecular Autism. 2018. V. 9. № 7. https://doi.org/10.1186/s13229-018-0187-7
Han Y.M.Y., Chan A.S. Disordered cortical connectivity underlies the executive function deficits in children with autism spectrum disorders // Res. Dev. Disabil. 2017. V. 61. P. 19.
Изнак А.Ф., Изнак E.В., Мельникова T.C. Параметры когерентности ЭЭГ как отражение нейропластичности мозга при психической патологии (обзор литературы) // Психиатрия. 2018. Т. 78. С. 127.
Coben R., Barry R., Hudspeth W., Barry R.J. EEG power and coherence in autistic spectrum disorder // Clin. Neurophysiol. 2008. V. 119. № 5. P. 1002.
Elhabashy H., Raafat O., Afifi L. et al. Quantitative EEG in autistic children // Egyptian J. Neurol. Psychiatry Neurosurg. 2015. V. 52. № 3. P. 176.
Магомедов Р.А., Гарах Ж.В., Орехов Ю. и др. Гамма-ритм, позитивные, негативные симптомы и когнитивная дисфункция при шизофрении // Журн. неврол. и психиатр. им. С.С. Корсакова. 2010. Т. 101. № 1. C. 78.
Thai N.J., Longe O., Rippon G. Disconnected brains: What is the role of fMRI in connectivity research? // Intern. J. Psychophysiol. 2009. V. 73. № 1. P. 27.
Tang Y., Chen K., Zhou Y. et al. Neural activity changes in unaffected children of patients with schizophrenia: A resting-state fMRI study // Schizophrenia Res. 2015. V. 168. № 1. P. 360.
Hazlett H.C., Gu H., Munsell B.C. et al. Early brain development in infants at high risk for autism spectrum disorder // Nature. 2017. V. 542. № 7641. P. 348.
Горбачевская Н.Л., Мамохина У.А., Вершинина Н.В. и др. Особенности спектральных характеристик ЭЭГ у лиц с расстройствами аутистического спектра // Психиатрия. 2018. Т. 78. № 2. С. 48.
Симашкова Н.В., Клюшник Т.П. Клинико-биологические аспекты расстройств аутистического спектра. М.: Изд-во ГЭОТАР-Медиа, 2016. 286 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


