Физиология человека, 2021, T. 47, № 5, стр. 118-127
Функциональные ансамбли в мозге человека и животных
Д. Н. Берлов 1, *, Е. А. Никитина 1, 2
1 Российский государственный педагогический университет имени А.И. Герцена
Санкт-Петербург, Россия
2 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: dberlov@yandex.ru
Поступила в редакцию 16.02.2021
После доработки 23.04.2021
Принята к публикации 26.05.2021
Аннотация
В данной статье рассматривается формирование функциональных ансамблей в мозге. На основе современных данных делается вывод о важности нейрональных ансамблей как функциональных единиц в мозге и распространенности ансамблевого кодирования в мозге. Отдельно рассматривается специфика изучения нейрональных ансамблей у человека. Подчеркивается важность формирования, развития, взаимодействия и деградации ансамблей. Анализируются отдельные теоретические аспекты проблемы.
Со времен открытия Ч. Шеррингтоном синапсов, нейроны рассматривали как морфофункциональные единицы нервной системы. Этому способствовали также общий атомизм клеточной теории, исследования электрических процессов на мембране одиночной клетки как базовых актов возбуждения и торможения, а также технические ограничения, препятствующие одновременной регистрации большого числа нервных клеток.
Однако ряд теоретических подходов к организации нервной системы предполагает, что основной единицей, реализующей функции в нервной системе, является связанная группа нейронов. Само понятие рефлекторной дуги подразумевает, что рефлекс, как логическая единица поведения, обеспечивается организованной определенным образом группой нервных клеток. Важным шагом в развитии этого направления явилось понимание, что такие организованные группы нейронов могут быть не только врожденными, но и формироваться в результате индивидуального опыта, как это наблюдается в учении И.П. Павлова об условном рефлексе и А.А. Ухтомского о доминанте. Условно-рефлекторное учение И.П. Павлова задало вектор развития физиологии, генетике поведения и смежным дисциплинам в Институте физиологии им. И.П. Павлова (г. Санкт-Петербург), который сохраняется до настоящего времени [1]. А.А. Ухтомский рассматривал доминату как функциональный орган, который является распределенным, динамически формируемым, способным восстанавливаться на основе активации своих частей и взаимодействующий с другими подобными функциональными органами [2]. Эти прогрессивные концепции предвосхитили многие современные теоретические представления.
В англоязычной литературе истоки представлений о нейрональных ансамблях как единицах реализации функций в мозге, как правило, соотносят с идеями D.O. Hebb [3]. Согласно D.O. Hebb, результатом реакции мозга на воздействия окружающей среды является формирование т. н. клеточных ансамблей или сборок (cell assembly), которые ведут себя как функциональные единицы, обеспечивая кодирование информации и ее влияние на поведение. D.O. Hebb предполагал, что синаптические связи между нейронами могут изменяться в зависимости от предшествующего опыта, становясь сильнее или слабее. При этом совместное возбуждение пары нейронов усиливает синаптическую связь между ними. В современной литературе это часто обозначается как пластичность, зависимая от времени спайка (spike time dependent plasticity, STDP) [4], отражая различия во влиянии синаптических событий на долговременные изменения в синапсе, в зависимости от того, привели ли эти события к возникновению потенциала действия на постсинаптическом нейроне или нет. Поскольку предметы окружающей среды часто имеют устойчивые сочетания признаков, по мнению D.O. Hebb это приводит к возбуждению схожих наборов нейронов при повторных контактах организма с этими предметами и, в конечном счете, к возникновению устойчивых нейрональных ансамблей (рис. 1).
Рис. 1.
Условная схема формирования нейронального ансамбля и возникновения функциональной связанности на основе анатомической связанности. А – исходная сеть нейронов, морфологическая связанность, Б – сформированный нейрональный ансамбль, функциональная связанность.
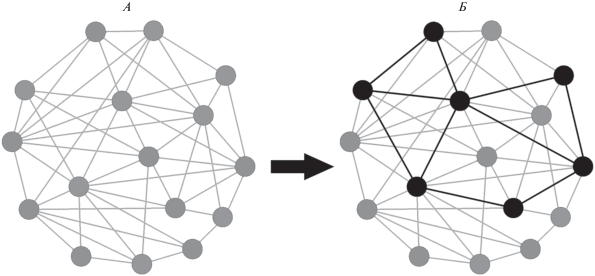
Подобные ансамблевые подходы обладают большой объяснительной силой, поскольку описывают работу мозга на мезоскопическом уровне, позволяя использовать специфические свойства такого уровня для интерпретации поведения [5, 6]. В свою очередь, попытка объяснить эти же свойства на основе альтернативных подходов (например, работы крайне специализированных нейронов-детекторов) наталкивается на многочисленные концептуальные затруднения.
Тем не менее, сложившиеся традиции, технические и вычислительные сложности еще недавно значительно ограничивали практическое экспериментальное использование ансамблевого подхода. Согласно [7, с. 219], “до недавнего времени основной подход, используемый для реконструкции как сенсорных, так и моторных репрезентаций, заключался в последовательной регистрации активности отдельных нейронов с последующей попыткой получить популяционный код”. Однако неудовлетворенность объяснением поведения на основе регистрации активности одиночных нейронов, а также прогресс в технических возможностях изменили ситуацию. Повышение интереса к исследованиям работы групп нейронов, в противовес более раннему акценту на изучение работы отдельных нейронов, по выражению R. Yuste, является переходом от нейрональной доктрины к ансамблевой [8]. В исследованиях на животных последние четверть века улучшаются возможности многоэлектродной регистрации электрической активности нейронов [7, 9]. Позднее стал доступен более широкий набор методов регистрации мультинейрональной активности, прежде всего оптической [10]. У животных со сравнительно простой нервной системой подобные методы позволяют зарегистрировать работу значительной части нервной системы [11].
Многие авторы отмечают, что, несмотря на простоту идей, высказанных D.O. Hebb, детали реализации хеббовских нейрональных ансамблей остаются неизвестными [12, 13]. В этом отношении в англоязычной литературе использование термина cell assembly обычно предполагает отсылку именно к хеббовскому пониманию нейрональных ансамблей, тогда как более общий подход, предполагающий функциональную важность нейрональных ансамблей на иных теоретических принципах или безотносительно их, может обозначаться иначе, например, как neuronal ensembles. В русском языке подобного разделения в явном виде не наблюдается. Термин популяционное кодирование предполагает, что речь идет о кодировании информации в мозге с помощью популяции нейронов, безотносительно их организации.
Колонки и микроколонки коры больших полушарий могут быть названы морфологическими нейрональными ансамблями, кортикальные модули, основанные на локальных связях, могут осуществлять сложную пространственную фильтрацию входящего сигнала [14]. В литературе часто также рассматриваются пространственно-распределенные и динамически формируемые функциональные ансамбли. В этом отношении говорят о морфологической и функциональной связанности нейронов, последняя может возникать и изменяться динамически [15]. В простейшем случае, поскольку формирование нейронального ансамбля предполагает совместную активность множества нейронов, функциональная связь между пространственно удаленными участками нейронального ансамбля может быть выявлена с помощью корреляционных показателей. В свою очередь, обнаружение совместных изменений в работе нейронов часто является практическим критерием для утверждения о принадлежности этих нейронов к одному функциональному ансамблю.
Актуальной может быть и обратная задача выявления структурной связанности на основе функциональной, например, для исследований культуры нервной ткани, где характер морфологических связей может быть априори неизвестен [16]. Морфологическая связанность не только создает основу для функциональной связанности, но и задает пределы изменчивости ансамблей. Характер локальных связей между нейронами внутри кортикальных слоев в значительной степени является врожденным, поэтому способность перестраиваться в результате опыта за счет локальных связей ограничена [17].
В настоящей статье авторы рассматривают некоторые из имеющихся свидетельств в пользу существования нейрональных ансамблей, а также исследования, связанные с изучением нейрональных ансамблей у человека, затрагивают некоторые теоретические аспекты и сложности.
Свидетельства популяционного кодирования
Обработка полученного сигнала от группы нейронов позволяет вычислять ансамблевые характеристики [18] – специфические показатели ансамбля, которые могут информативно кодировать сигнал в мозге. G. Buzsáki полагает [19], что реальные ансамблевые характеристики могут “считываться” структурами мозга. Хотя эта гипотеза требует доказательств и неизвестно, какие именно ансамблевые характеристики могли бы в действительности использоваться мозгом, практическое вычисление различных ансамблевых характеристик часто позволяет лучше “распознать”, декодировать протекающие процессы, чем анализ активности одиночных нейронов. К таковым характеристикам можно отнести показатель направленности спайков (spike directivity) [20] и коррелятивную изменчивость (correlated variability) [21].
Ансамблевое кодирование сенсорных сигналов и внимание. Обнаружен ансамблевый ответ на запахи в обонятельной доле у моли [22], при этом смешивание запахов приводит к появлению временны́х ансамблевых паттернов, которые не могли быть предсказаны из ответов на одиночные запахи. Аналогичные закономерности наблюдаются в кодировании обонятельного сигнала в пириформной коре у млекопитающих: различные запахи активируют уникальные и распределенные ансамбли нейронов [23]. Для этой же области показано, что оптическая стимуляция небольшой субпопуляции нейронов с генетически внедренным каналородопсином ChR2 в сочетании с подкрепляющим или болевым безусловным стимулом формирует адекватный поведенческий ответ [24]. При этом можно независимо активировать различные субпопуляции нейронов в пириформной коре с соответствующими различными типами условнорефлекторного поведения.
Ансамблевое декодирование в задаче, требующей привлечения внимания к одному из двух массивов движущихся точек, более эффективно, чем на основе анализа активности одиночных нейронов в латеральной префронтальной коре (ПФК) у обезьян [25]. Ансамблевые характеристики для таких нейронов, декодированные методом опорных векторов, позволяют идентифицировать направление внимания и являются устойчивыми к дистракторам, однократно обученный алгоритм остается эффективным на протяжении недель [26]. Известно, что внимание повышает стабильность вызванных потенциалов (ВП) [27], поэтому ансамблевое кодирование также позволяет объяснить изменение активности нейронов в зависимости от внимания.
Ансамблевое кодирование для задач обучения и памяти. Подход D.O. Hebb оказался особенно востребованным при исследовании памяти, поскольку позволяет связать в единой модели кратковременную память, основанную на реверберации в нейрональных ансамблях, с долговременной памятью, основанной на синаптической пластичности в нейронах тех же ансамблей. Важность группового кодирования в функционировании рабочей памяти продемонстрирована при одновременной регистрирации активности до 16 нейронов медиальной ПФК у крыс в процессе изменения условий выполняемой задачи. При этом резкая смена поведенческой стратегии сопровождалась относительно коротким переходным периодом в статистических характеристиках ответов популяции нейронов [28]. Резкое изменение групповой нейрональной активности в медиальной ПФК у крыс, в соответствии с изменением поведения, показано и в работе M.P. Karlsson et al. [29], а также наблюдается в ЭЭГ у человека [6]. Это значит, что здесь может быть задействован более быстрый, по сравнению с синаптической пластичностью, механизм.
При исследовании нейрональных ансамблей в дорзолатеральном стриатуме у крыс во время обучения в Т-образном лабиринте оказалось, что ансамблевый показатель взаимной информации (mutual information), вычисленный по активности 4 нейронов, отражает фазную динамику процесса обучения. Вначале наблюдается фаза медленного прироста обучения и показателя взаимной информации. Позже отмечается резкий прирост обеих переменных и далее – их стабилизация [30].
Состав ансамбля напрямую влияет на эффективность выполнения функции. Нейроны, не селективные для функции рабочей памяти, могут ее улучшить, когда становятся частью ансамбля [20].
Особое внимание уделяется нейрональным ансамблям в гиппокампе. Так, в зубчатой извилине ансамбль оказывается лучше одиночных нейронов для задачи декодирования позиции в пространстве при перемещении в арене у мышей [31]. Анализируя процессы синхронизации нейрональной активности в гиппокампе [32], пришли к выводу, что вариабельная и динамическая селекция нейрональных ансамблей может быть оптимальным механизмом для быстрой реорганизации функциональных сетей и саморазвития новых репрезентаций, позволяя осуществить гибкий процесс принятия решений.
Моторная функция. Показано, что траектории движений кодируются коллективной активностью тысяч нейронов в задней теменной коре [33, 34]. У обезьян с хронически имплантированными в лобную и теменную кору массивами электродов обнаружилась существенная индивидуальная вариабельность активности отдельных нейронов и значительная стабильность ансамблевой реакции при выполнении задачи непрерывного движения конечностью [35].
Приведенные примеры свидетельствуют о широкой распространенности ансамблевого кодирования при реализации различных функций в мозге. Использование нейрональных ансамблей в этих случах дает несколько преимуществ.
В первую очередь ансамбль обеспечивает устойчивость, т.е. стабильность реакции во времени. Согласно С. Гринфилд [5], одно из основных свойств нейронных ансамблей заключается в их продолжительной активности, обычно в сотни раз превышающей продолжительность единичного потенциала действия (ПД). В случае выученных ассоциаций при выполнении задачи виртуальной навигации у мыши, статистические характеристики популяции нейронов заднетеменной коры сохраняют схожие значения и отличаются стабильностью на протяжении недель, несмотря на изменение активности отдельных нейронов [36]. Стабильность ансамблевых характеристик может быть основана на реактивации. N. Matsuo [37] у трансгенных мышей, экспрессирующих токсин столбняка под контролем c-fos промотора, ингибировал активность специфического набора нейронов, активируемого во время начального обучения. Результаты эксперимента предполагают, что активность начального нейронального ансамбля преимущественно подчинена обучению той же задаче и не замещается другими нейронами. Поэтому повторное обучение усиливает память, ведь оно реактивирует тот же самый нейрональный ансамбль.
Групповое ансамблевое кодирование может также давать надежность сохранения, обеспечивая ее даже при гибели части клеток (в отличие от узкоспециализированных нейронов-детекторов) [38].
Наконец, нейрональный ансамбль может обеспечить гибкость и пластичность поведения за счет вхождения или не вхождения конкретного нейрона в определенный ансамбль и увеличения общего числа возможных комбинаций.
Таким образом, имеющиеся в литературе данные свидетельствуют о существовании ансамблевого кодирования при реализации различных функций. Необходимо, однако, помнить, что в разных работах понятие нейронального ансамбля может быть неидентичным.
Нейрональные ансамбли у человека
По объективным причинам многие из современных методов, используемых для исследования нейрональных ансамблей у животных, не могут быть применены к человеку. Однако немногочисленные сравнительные исследования, проведенные с применением мультиэлектродной регистрации в мозге, а также с использованием культуры ткани, показали, что проявления коллективной популяционной активности у человека и других млекопитающих носят в значительной степени схожий характер [39, 40]. Тем не менее, можно допустить и существование специфических особенностей в функционировании нейрональных ансамблей у человека [41].
В значительной степени применимым к человеку является развитие вычислительных методов, связанных с выделением конкретного ансамблевого сигнала из общей нейрональной активности. Особенно актуальным анализ активности популяции нейронов может быть для развития инвазивных нейроинтерфейсов, используемых у приматов и человека [42–44]. Однако развитие вычислительных методов, связанных с выделением отдельных ансамблей из общей активности, косвенно может быть полезно и для развития неинвазивных нейроинтерфейсов, поскольку формально, и в этом случае, речь идет о выделении полезного информативного сигнала (связанного с определенным нейрональным ансамблем) из общей нейрональной активности.
Для лучшего понимания применимости ансамблевой парадигмы в исследованиях мозга человека необходимым является анализ традиционных психофизиологических методов регистрации активности мозга, в частности, связанных с событиями потенциалов, а также методов транскраниальной стимуляции. Следует отметить важность разработки новых методов, вычленяющих отдельные независимые компоненты из суммарной записи биоэлектричесокй активности, таких как анализ независимых компонент для ЭЭГ и метод параллельного факторного анализа для ВП [45]. Вызванные потенциалы, основанные на усреднении специфической активности группы нейронов, могут быть наиболее простым индикатором, выделяющим работу сформированных нейрональных ансамблей из общей электрической активности мозга [46], однако это направление требует дальнейшего анализа. Согласно гипотезе [47], в ВП отражается формирование и активация нейрональных ансамблей, тогда как их поддержание скорее проявляется в высокочастотной ритмической активности ЭЭГ. Транскраниальная стимуляция постоянным током (микрополяризация) теоретически может улучшать процесс обучения не только за счет локального повышения возбудимости, но, возможно, и за счет более специфического влияния на синаптическую пластичность в нейрональных ансамблях, как это следует из анализа срезов гиппокампа крысы [48]. Однако прямая проверка этой гипотезы, с помощью оценки нейрональной пластичности с помощью методики ВП в задаче с обратной зрительной маскировкой на фоне транскраниальной стимуляции постоянным током у лиц больных шизофренией, не принесла положительного результата, поэтому вопрос остается открытым [49].
Одним из перспективных подходов к неинвазивному изучению нейрональных ансамблей у человека является отражение в характеристиках ВП долговременной потенциации, вызванной сенсорными стимулами [50]. Долговременная потенциация – известный феномен долговременной пластичности в мозге, проявляющийся в длительном увеличении веса синапса после интенсивной электростимуляции [51, 52]. Связь долговременной потенциации с процессами памяти предполагает, что схожие явления могут возникать и в естественных условиях при определенных режимах сенсорной стимуляции. В свою очередь методика ВП, отражающая коллективную и, в то же время, достаточно специфическую активность множества нейронов, позволяет обнаружить изменения в отдельных компонентах после экспериментальной процедуры.
Исходный протокол для данной процедуры был предложен T.J. Teyler et al. [53] и предполагал двухминутное высокочастотное (9 Гц) предъявление стимула (синусоидальных решеток или шахматного паттерна), обрамленное низкочастотной (1 Гц) стимуляцией. Такая экспериментальная стимуляция вызывала усиление компонента N1b. Позднее были предложены альтернативные варианты протокола [54, 55]. Эти исследования показали также изменения в более ранних (C1/N90op, P1, N1) и более поздних (P2) компонентах ВП [49], схожие эффекты в других сенсорных модальностях [56].
Уменьшение выраженности реакции компонентов ВП на долговременную потенциацию у человека, вызванную сенсорной стимуляцией, были выявлены при возрастном старении, а также при шизофрении [54, 57], депрессии [55], биполярном расстройстве второго типа [58]. В свою очередь, у лиц с аутизмом выраженность такой реакции повышена по сравнению с контрольной группой [59].
Показано, что степень модуляции ВП определяется и генетическим фактором, в частности эффективным оказался полиморфизм Val66Met гена нейротрофического фактора мозга [60].
Теоретические аспекты организации нейрональных ансамблей
Многие авторы подчеркивают, что целый ряд важных вопросов, касающийся формирования и функционирования нейрональных ансамблей, их взаимодействия остается непроясненным [12, 13]. В частности, до конца не выявлены размеры нейрональных ансамблей и срок их жизни [5, 24].
Соматостатин-содержащие тормозные интернейроны регулируют размер ансамблей в гиппокампе [61]. Регуляция ансамблей (их размера и синхронности) в зрительной коре у мышей, вероятно, возможна с помощью парвальбуминовых интернейронов. Тормозные сети могут сегрегировать нейрональные ансамбли [62]. Таким образом, процесс торможения является ключевым во время формирования следов памяти: активные нейрональные популяции тормозят неактивные нейроны. С. Гринфилд [5] рассматривает изменение размера нейрональных ансамблей как базовый механизм регуляции в работе мозга. Роль таких регуляторов могут играть химические модуляторы, например, моноаминергические медиаторы и эндорфины. Уменьшение размеров формирующихся нейрональных ансамблей в ответ на воздейстие наблюдается по мере углубления анестезии [63].
В исследовании [64] использовали мышей, у которых могли частично регулировать продукцию нейронов во время внутриутробного развития. Животные с большим числом кортикальных нейронов развивали выраженные функциональные корреляции и более различимые нейрональные ансамбли в первичной зрительной коре, а также демонстрировали более острое различение в зрительном поведении.
Не до конца остаются проясненными и механизмы, обеспечивающие интеграцию нейронов в единые ансамбли. Некоторыми авторами подчеркивается потенциальная важность объемной проводимости электрического сигнала и щелевых контактов в организации ансамблей [65, 66]. По одной из гипотез, астроциты являются резервуаром для ГАМК, организованно высвобождая ее, они могут влиять на функционирование ансамблей через экстрасинаптические рецепторы.
Некоторые авторы предполагают, что нейрональные ансамбли являются распределенными и перекрывающимися [16, 23]. Такая архитектура вызывает множество вопросов: может ли один нейрон входить одновременно в два или более разных ансамблей и как разделены (сегрегированы) перекрывающиеся ансамбли [67].
Подходы к ансамблевой организации. Представления о том, как отдельные ансамбли интегрированы в общую когнитивную архитектуру мозга также заметно различаются. Условно эти подходы можно назвать инфраструктурными и автономными.
Различные участки коры могут рассматриваться как относительно независимо работающие (функциональные) модули, объединение которых в глобальную структуру необходимо для реализации определенных функций. Когнитивная организация мозга в этом случае выглядит как включающая обязательную инфраструктуру, к которой добавляются опциональные модули, определяющие конкретное психическое содержание [68, 69]. Подобное разделение схоже с представлением Н.П. Бехтеревой о жестких и гибких звеньях в мозге [70]. При таком подходе особенности функционирования системы, в первую очередь, определяются архитектурой инфраструктуры системы. Например, если в помещении установлен датчик задымления, его роль будет зависеть от того, подключен ли он к общей противопожарной инфраструктуре [69]. Лишь в случае такого подключения, срабатывание датчика приведет к возникновению широковещательного противопожарного сигнала тревоги, реакция на который у отдельных агентов будет специфическая. Аналогично в мозге, лишь в случае присоединения модуля обработки информации к общей инфраструктуре (глобальному рабочему пространству), информация о работе этого модуля через широковещательный сигнал становится доступной для остальных участников сети (каждый из которых отвечает на этот сигнал по собственному сценарию). Отдельные ансамбли в случае инфраструктурного подхода конкурируют между собой за доступ к общей инфраструктуре и проявляют свое психическое содержание лишь через доступ к ней.
Альтернативным можно назвать подход автономных ансамблей. В его основе лежит идея формирования функциональных органов, в которых популяция пространственно распределенных нейронов временно оказывается связанной и относительно независимой от других популяций нейронов. Автономные нейрональные ансамбли непосредственно конкурируют между собой, а также репрезентируют психическое содержание. Согласно С. Гринфилд [5], при наличии двух временны́х нейронных ансамблей, один из них будет доминировать и определять текущий момент сознания. В этом случае важным является не только архитектура системы, но и специфика организации удаленных нейрональных групп в единый ансамбль, судьба активности не вошедших в основной ансамбль нейронов и конкуренции между ансамблями. Наиболее распространенной гипотезой механизма образования таких функциональных органов является пространственная синхронизация на общих частотах колебаний. Достоинством данного механизма является то, что он объясняет не только связывание, но и отделение популяции нейронов от других аналогичных популяций на основе различий частоты и фазы [71, 72]. Очевидно, что данный подход перекликается с мыслями А.А. Ухтомского о доминанте, временно формирующейся констелляции нервных центров, и о роли дистанционной пространственной синхронизации в функциональном объединении нейронов [2, 6].
Само по себе положение об ансамблевом кодировании функций еще не позволяет сделать какой-либо предпочтительный выбор относительно двух описанных моделей (к тому же не являющихся взаимоисключающими, здесь необходимо упомянуть о теории функциональных систем П.К. Анохина, постулирующую временнóе функциональное объединение нервных центров, как динамически формирующуюся инфраструктуру поведенческого акта [73]). В зависимости от принятого варианта, существенно могут отличаться требующие освещения аспекты.
Если речь идет об инфраструктурном подходе, ключевыми характеристиками становится архитектура такой единой сети, глобального пространства, например, динамического таламокортикального ядра [69, 74]. Свойства самого нейронального объединения, подключающегося к подобной глобальной структуре, могут играть второстепенную роль. Важно то, чем отличаются ситуации, когда модуль вошел в глобальную нейрональную сеть, от ситуации, когда он от нее изолирован. В качестве примера можно упомянуть модель NGWS [68], в которой вхождение в такую сеть “поджигает” длинные связи.
Если же опираться на автономный ансамблевый подход, то основным становится именно специфика формирования отдельных функциональных нейрональных ансамблей, анализ различий между ансамблями разных видов, взаимодействие между отдельными ансамблями.
Если говорить о проблеме сегрегации ансамблей, то для инфраструктурного подхода ключевым является именно присоединенность группы нейронов к глобальной сети, при этом связь данных нейронов с нейронами, не присоединенными к глобальной сети и не входящими в такой присоединенный ансамбль, не исключается. В случае же автономного ансамблевого подхода предполагается некоторая временнáя эксклюзивность, когда один функциональный ансамбль оказывается сегрегирован от другого, а нейроны в большинстве случаев являются членами только одного из таких ансамблей.
ЗАКЛЮЧЕНИЕ
Открытие в конце XIX века нейрона и синапса обострило классический физиологический вопрос о локализации функции. Где находится функция? Связана ли она с отдельными нейронами, как морфофункциональными единицами мозга? Реализуется ли функция на уровне нервных центров, рефлекторных цепочек или более сложных анатомических образований?
Представления С. Рамон-и-Кахаля о “церебральной гимнастике”, способности нейрональных систем менять функциональную активность под влиянием внешних стимулов, нашли подтверждения в последующих исследованиях. Отечественные физиологи (В.М. Бехтерев, И.П. Павлов, Л.А. Орбели) выявили высокие компенсаторные возможности мозга у человека и животных определяющиеся его пластичностью [75]. Процессы пластичности на молекулярном, синаптическом, клеточном и сетевом уровнях образуют сложную пирамиду взаимосвязанных как вертикально, так и горизонтально механизмов [76]. Исследования последних лет подтвердили провидческие идеи наших великих предшественников о том, что механизмы пластичности при различных функциональных состояниях мозга в норме и патологии связаны с реорганизацией нейрональных ансамблей.
Финансирование работы. Работа выполнена при поддержке Государственной программы РФ 47 ГП “Научно-технологическое развитие Российской Федерации” (2019–2030) (тема 63.1) и РФФИ (грант № 20-015-00300 A).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Савватеева-Попова Е.В., Никитина Е.А., Медведева А.В. От нейрогенетики к нейроэпигенетике // Генетика. 2015. Т. 51. № 5. С. 613. Savvateeva-Popova Е.V., Nikitina Е.А., Medvedeva A.V. Neurogenetics and neuroepigenetics // Russ. J. Genet. 2015. V. 51. № 5. P. 518.
Ухтомский А.А. Доминанта. СПб.: Питер, 2002. 448 с.
Hebb D.O. The organization of behavior: a neuropsychological theory. N.Y.: John Wiley and Sons, Inc., 1949. 335 p.
Ocker G.K., Doiron B. Training and spontaneous reinforcement of neuronal assemblies by spike timing plasticity // Cereb. Cortex. 2019. V. 29. № 3. P. 937.
Гринфилд С. Один день из жизни мозга. Нейробиология сознания от рассвета до заката. СПб.: Питер, 2018. 240 с.
Павлова Л.П. Доминанты деятельного мозга человека: системный психофизиологический подход к анализу ЭЭГ. СПб.: Информ-Навигатор, 2017. 432 с.
Nicolelis M.A.L., Fanselow E.E., Ghazanfar A.A. Hebb’s dream: the resurgence of cell assemblies // Neuron. 1997. V. 19. № 2. P. 219.
Yuste R. From the neuron doctrine to neural networks // Nat. Rev. Neurosci. 2015. V. 16. № 8. P. 487.
Pastore V.P., Massobrio P., Godjoski A., Martinoia S. Identification of excitatory-inhibitory links and network topology in large-scale neuronal assemblies from multi-electrode recordings // PLoS Comput. Biol. 2018. V. 14. № 8. P. e1006381.
Carrillo-Reid L., Yang W., Kang Miller J.E. et al. Imaging and optically manipulating neuronal ensembles // Annu. Rev. Biophys. 2017. V. 46. P. 271.
Awal M.R., Wirak G.S., Gabel C.V., Connor C.W. Collapse of global neuronal states in Caenorhabditis elegans under isoflurane anesthesia // Anesthesiology. 2020. V. 133. № 1. P. 133.
Palm G., Knoblauch A., Hauser F., Schüz A. Cell assemblies in the cerebral cortex // Biol. Cybern. 2014. V. 108. № 5. P. 559.
Nadel L., Maurer A.P. Recalling lashley and reconsolidating hebb // Hippocampus. 2020. V. 30. № 8. P. 776.
Kropotov J.D. Quantitative EEG, event-related potentials and neurotherapy. Academic Press, Elsevier, Amsterdam, London, 2009. 542 p.
Li M., Liu J., Tsien J.Z. Theory of connectivity: nature and nurture of cell assemblies and cognitive computation // Front. Neural Circuits. 2016. V. 10. P. 34.
Poli D., Pastore V.P., Martinoia S., Massobrio P. From functional to structural connectivity using partial correlation in neuronal assemblies // J. Neural Eng. 2016. V. 13. № 2. P. 026023.
Perin R., Berger T.K., Markram H. A synaptic organizing principle for cortical neuronal groups // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 13. P. 5419.
Diana G., Sainsbury T.T.J., Meyer M. P. Bayesian inference of neuronal assemblies // PLoS Comput. Biol. 2019. V. 15. № 10. P. 1.
Buzsáki G. Neural syntax: cell assemblies, synapsembles, and readers // Neuron. 2010. V. 68. № 3. P. 362.
Aur D. A comparative analysis of integrating visual information in local neuronal ensembles // J. Neurosci. Methods. 2012. V. 207. № 1. P. 23.
Leavitt M.L., Pieper F., Sachs A.J., Martinez-Trujillo J.C. Correlated variability modifies working memory fidelity in primate prefrontal neuronal ensembles // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 12. P. E2494.
Christensen T.A., Pawlowski V.M., Lei H., Hildebrand J.G. Multi-unit recordings reveal context-dependent modulation of synchrony in odor-specific neural ensembles // Nat. Neurosci. 2000. V. 3. № 9. P. 927.
Stettler D.D., Axel R. Representations of odor in the piriform cortex // Neuron. 2009. V. 63. № 6. P. 854.
Choi G.B., Stettler D.D., Kallman B.R. et al. Driving opposing behaviors with ensembles of piriform neurons // Cell. 2011. V. 146. № 6. P. 1004.
Backen T., Treue S., Martinez-Trujillo J.C. Encoding of spatial attention by primate prefrontal cortex neuronal ensembles // eNeuro. 2018. V. 5. № 1. ENEURO.0372-16.2017.
Tremblay S., Pieper F., Sachs A., Martinez-Trujillo J. Attentional filtering of visual information by neuronal ensembles in the primate lateral prefrontal cortex // Neuron. 2015. V. 85. № 1. P. 202.
Баранов-Крылов И.Н., Шуваев В.Т., Берлов Д.Н. Динамика вызванных потенциалов в зависимости от уровня внимания при решении зрительной задачи // Физиология человека. 2003. Т. 29. № 2. С. 11. Baranov-Krylov I.N., Shuvaev V.T., Berlov D.N. Changes in evoked potentials depending on attention level in performance of visual tasks // Human Physiology. 2003. V. 29. № 2. P. 136.
Durstewitz D., Vittoz N.M., Floresco S.B., Seamans J.K. Abrupt transitions between prefrontal neural ensemble states accompany behavioral transitions during rule learning // Neuron. 2010. V. 66. № 3. P. 438.
Karlsson M.P., Tervo D.G.R., Karpova A.Y. Network resets in medial prefrontal cortex mark the onset of behavioral uncertainty // Science. 2012. V. 338. № 6103. P. 135.
Jog M.S., Aur D., Connolly C.I. Is there a tipping point in neuronal ensembles during learning? // Neurosci. Lett. 2007. V. 412. № 1. P. 39.
Stefanini F., Kheirbek M.A., Kushnir L. et al. A distributed neural code in the dentate gyrus and in CA1 // Neuron. 2020. V. 107. № 4. P. 703.
Sasaki T. Non-structured spike sequences of hippocampal neuronal ensembles in awake animals // Neurosci. Res. 2019. V. 142. P. 1.
Whitlock J.R. Movement coding at the mesoscale in posterior parietal cortex // Neuron. 2017. V. 95. № 6. P. 1234.
Wilber A.A., Skelin I., Wu W., McNaughton B.L. Laminar organization of encoding and memory reactivation in the parietal cortex // Neuron. 2017. V. 95. № 6. P. 1406.
Carmena J.M., Lebedev M.A., Henriquez C.S., Nicolelis M.A. Stable ensemble performance with single-neuron variability during reaching movements in primates // J. Neurosci. 2005. V. 25. № 46. P. 10712.
Driscoll L.N., Pettit N.L., Minderer M. et al. Dynamic reorganization of neuronal activity patterns in parietal cortex // Cell. 2017. V. 170. № 5. P. 986.
Matsuo N. Irreplaceability of neuronal ensembles after memory allocation // Cell Rep. 2015. V. 11. № 3. P. 351.
Coltheart M. Grandmother cells and the distinction between local and distributed representation // Lang. Cogn. Neurosci. 2017. V. 32. № 3. P. 350.
Aur D. A comparative analysis of integrating visual information in local neuronal ensembles // J. Neurosci. Methods. 2012. V. 207. № 1. P. 23.
Wenzel M., Han S., Smith E.H. et al. Reduced repertoire of cortical microstates and neuronal ensembles in medically induced loss of consciousness // Cell Syst. 2019. V. 8. № 5. P. 467.
Szegedi V., Paizs M., Csakvari E. et al. Plasticity in single axon glutamatergic connection to GABAergic interneurons regulates complex events in the human neocortex // PLoS Biol. 2016. V. 14. № 11. P. e2000237.
Hochberg L.R., Serruya M.D., Friehs G.M. et al. Neuronal ensemble control of prosthetic devices by a human with tetraplegia // Nature. 2006. V. 442. № 7099. P. 164.
Ramakrishnan A., Ifft P.J., Pais-Vieira M. et al. Computing arm movements with a monkey brainet // Sci. Rep. 2015. V. 5. P. 10767.
Leinders S., Vansteensel M.J., Branco, M.P. et al. Dorsolateral prefrontal cortex-based control with an implanted brain–computer interface // Sci. Rep. 2020. V. 10. № 1. P. 15448.
Пономарев В.А., Пронина М.В., Кропотов Ю.Д. Параллельный факторный анализ в исследовании связанных с событиями потенциалов // Физиология человека. 2019. Т. 45. № 3. С. 5. Ponomarev V.A., Pronina M.V., Kropotov Yu.D. Parallel factor analysis in the study of event-related potentials // Human Physiology. 2019. V. 45. № 3. P. 233.
Karakaş S., Erzengin Ö.U., Başar E. The genesis of human event-related responses explained through the theory of oscillatory neural assemblies // Neurosci. Lett. 2000. V. 285. № 1. P. 45.
Pulvermüller F., Lutzenberger W., Preissl H. Nouns and verbs in the intact brain: Evidence from event-related potentials and high-frequency cortical responses // Cereb. Cortex. 1999. V. 9. № 5. P. 497.
Kronberg G., Rahman A., Sharma M. et al. Direct current stimulation boosts hebbian plasticity in vitro // Brain Stimul. 2020. V. 13. № 2. P. 287.
Jahshan C., Wynn J.K., Roach B.J. et al. Effects of transcranial direct current atimulation on visual neuroplasticity in schizophrenia // Clin. EEG Neurosci. 2020. V. 51. № 6. P. 382.
Sumner R.L., Spriggs M.J., Muthukumaraswamy S.D., Kirk I.J. The role of Hebbian learning in human perception: a methodological and theoretical review of the human Visual Long-Term Potentiation paradigm // Neurosci. Biobehav. Rev. 2020. V. 115. P. 220.
Bliss T.V.P., Lømo T. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path // J. Physiol. 1973. V. 232. № 2. P. 331.
Nicoll R.A. A brief history of long-term potentiation // Neuron. 2017. V. 93. № 2. P. 281.
Teyler T.J., Hamm J.P., Clapp W.C. et al. Long-term potentiation of human visual evoked responses // Eur. J. Neurosci. 2005. V. 21. № 7. P. 2045.
Çavuş I., Reinhart R.M., Roach B.J. et al. Impaired visual cortical plasticity in schizophrenia // Biol. Psychiatry. 2012. V. 71. № 6. P. 512.
Normann C., Schmitz D., Fürmaier A. et al. Long-term plasticity of visually evoked potentials in humans is altered in major depression // Biol. Psychiatry. 2007. V. 62. № 5. P. 373.
Sanders P.J., Thompson B., Corballis P.M. et al. A review of plasticity induced by auditory and visual tetanic stimulation in humans // Eur. J. Neurosci. 2018. V. 48. № 4. P. 2084.
Wynn J.K., Roach B.J., McCleery A. et al. Evaluating visual neuroplasticity with EEG in schizophrenia outpatients // Schizophr. Res. 2019. V. 212. P. 40.
Zak N., Moberget T., Bøen E. et al. Longitudinal and cross-sectional investigations of long-term potentiation-like cortical plasticity in bipolar disorder type II and healthy individuals // Transl. Psychiatry. 2018. V. 8. № 1. P. 1.
Wilson J.F., Lodhia V., Courtney D.P. et al. Evidence of hyper-plasticity in adults with Autism Spectrum Disorder // Res. Autism Spectr. Disord. 2017. V. 43. P. 40.
Spriggs M.J., Thompson C.S., Moreau D. et al. Human sensory LTP predicts memory performance and is modulated by the BDNF Val66Met polymorphism // Front. Hum. Neurosci. 2019. V. 13. P. 22.
Stefanelli T., Bertollini C., Lüscher C. et al. Hippocampal somatostatin interneurons control the size of neuronal memory ensembles // Neuron. 2016. V. 89. № 5. P. 1074.
Agetsuma M., Hamm J.P., Tao K. et al. Parvalbumin-positive interneurons regulate neuronal ensembles in visual cortex // Cereb. Cortex. 2018. V. 28. № 5. P. 1831.
Devonshire I.M., Grandy T.H., Dommett E.J., Greenfield S.A. Effects of urethane anaesthesia on sensory processing in the rat barrel cortex revealed by combined optical imaging and electrophysiology // Eur. J. Neurosci. 2010. V. 32. № 5. P. 786.
Fang W.Q., Yuste R. Overproduction of neurons is correlated with enhanced cortical ensembles and increased perceptual discrimination // Cell Rep. 2017. V. 21. № 2. P. 381.
Badin A.S., Fermani F., Greenfield S.A. The features and functions of neuronal assemblies: possible dependency on mechanisms beyond synaptic transmission // Front. Neural Circuits. 2017. V. 10. P. 114.
Traub R.D., Whittington M.A., Maier N. et al. Could electrical coupling contribute to the formation of cell assemblies? // Rev. Neurosci. 2020. V. 31. № 2. P. 121.
Wang W., Kim C.K., Ting A.Y. Molecular tools for imaging and recording neuronal activity // Nat. Chem. Biol. 2019. V. 15. № 2. P. 101.
Sergent C., Dehaene S. Neural processes underlying conscious perception: experimental findings and a global neuronal workspace framework // J. Physiol. Paris. 2004. V. 98. № 4–6. P. 374.
Baars B.J., Franklin S., Ramsøy T.Z. Global workspace dynamics: cortical “binding and propagation” enables conscious contents // Front. Psychol. 2013. V. 4. P. 200.
Бехтерева Н.П. Здоровый и больной мозг человека. Л.: Наука, 1988. 260 с.
Eckhorn R., Bauer R., Jordan W. et al. Coherent oscillations: a mechanism of feature linking in the visual cortex? // Biol. Cybern. 1988. V. 60. № 2. P. 121.
Chapeton J.I., Haque R., Wittig J.H., Jr. et al. Large-scale communication in the human brain is rhythmically modulated through alpha coherence // Curr. Biol. 2019. V. 29. № 17. P. 2801.
Анохин П.К. Очерки по физиологии функциональных систем. М.: Медицина, 1975. 448 с.
Edelman G.M., Gally J.A., Baars B.J. Biology of consciousness // Front. Psychol. 2011. V. 2. P. 4.
Угрюмов М. Компенсаторные возможности мозга // Наука в России. 2008. № 3. С. 4.
Гуляева Н.В. Физиологический континуум пластичности и патологии нервной системы // Интегративная физиология. 2020. Т. 1. № 4. С. 294. Gulyaeva N.V. Physiological continuum of plasticity and pathology of the nervous system // Integr. Physiol. 2020. V. 1. № 4. P. 294.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


