Физиология человека, 2021, T. 47, № 5, стр. 102-109
Модуляция потенциалочувствительности медленных натриевых каналов синтетическим циклическим пептидом
В. Б. Плахова 1, И. В. Рогачевский 1, В. А. Пеннияйнен 1, С. А. Подзорова 1, А. Д. Калинина 1, Б. В. Крылов 1, *, А. Д. Ноздрачев 1
1 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: krylov@infran.ru
Поступила в редакцию 27.04.2021
После доработки 25.05.2021
Принята к публикации 26.05.2021
Аннотация
Исследованы ответы первичного сенсорного нейрона на воздействие синтетического циклического пептида. Методом локальной фиксации потенциала обнаружено снижение потенциалочувствительности каналов NaV1.8 при воздействии декапептида Ac–Cys1–Leu2–Pro3–Arg4–Glu5–Arg6–Arg7–Ala8–Gly9–Cys10–NH2 (PIP10), содержащего внутримолекулярный дисульфидный мостик Cys1–Cys10. По результатам полной оптимизации геометрических параметров молекулы PIP10 полуэмпирическим методом AM1 установлено, что боковые цепи аргинильных остатков Arg4 и Arg6 оказываются стерически доступными и не вовлеченными в сильные внутримолекулярные взаимодействия. Расстояние между центральными атомами углерода гуанидиновых групп указанных аргинильных остатков составляет приблизительно 14 Å. Согласно гипотезе авторов, именно эти положительно заряженные группы ответственны за связывание молекулы РIР10 с каналом NaV1.8, благодаря ион-ионному взаимодействию с отрицательно заряженными функциональными группами аминокислотной последовательности канала. Исследуемый агент не оказывал влияния на рост нейритов сенсорных нейронов. Полученные результаты позволили высказать предположение о том, что декапептид PIP10 может претендовать на роль безопасной и эффективной анальгетической лекарственной субстанции благодаря специфической модуляции каналов NaV1.8, играющих ключевую роль в первичном сенсорном кодировании в афферентном звене ноцицептивной системы.
Изучение природы и физиологических свойств антимикробных веществ нейтрофилов животных привело к открытию в их гранулярном аппарате группы лизосомных катионных белков небольшой молекулярной массы – дефенсинов, чье основное функциональное значение заключается в способности обеспечивать защиту организма от возбудителей инфекционных болезней [1–3]. Отличительной особенностью строения молекул дефенсинов является высокое (5–10 остатков) содержание аргинильных остатков, несущих положительный заряд в боковой цепи при физиологически адекватных условиях [4], что в значительной степени определяет их большой дипольный момент [5]. Относительно высокое содержание аминокислот с гидрофобными боковыми цепями (изолейцин, пролин, лейцин, валин), по-видимому, имеет большое значение для реализации антимикробных свойств дефенсинов. Еще одна особенность их первичной структуры заключается в наличии шести остатков цистеина, участвующих в образовании трех внутримолекулярных дисульфидных мостиков. Они придают глобулоподобным молекулам дефенсинов повышенную устойчивость к гидролизному действию многочисленных протеиназ гранулярного аппарата нейтрофилов, а также стабилизируют третичную структуру указанных пептидов, которая представлена тремя антипараллельными β-тяжами, образующими β-складчатый слой [6–8]. Подобная амфипатическая (амфифильная) структура делает дефенсины способными не только к взаимодействию с фосфолипидами за счет своих электростатических свойств, но и к внедрению в липидный бислой благодаря гидрофобным взаимодействиям [9].
Как было установлено нами ранее [5, 10–12], взаимодействие эндогенных антибиотиков дефенсинов кролика NP-1 и NP-4 в наномолярных концентрациях с мембраной ноцицептивного нейрона приводит к снижению эффективного заряда (Zeff) активационной воротной системы каналов NaV1.8, ответственных за передачу ноцицептивных сигналов. Специфическое снижение потенциалочувствительности данных каналов позволяет сохранить способность передачи полимодальными ноцицепторами сигналов других модальностей (например, тактильных и температурных), избирательно выключив высокочастотную компоненту их импульсной активности, несущую в ЦНС информацию о возникновении боли.
Поскольку молекулы дефенсинов имеют циклическую структуру, в настоящей работе исследована более простая, но также циклическая молекула Ac–Cys1–Leu2–Pro3–Arg4–Glu5–Arg6–Arg7–Ala8–Gly9–Cys10–NH2 (PIP10). Данная молекула представляет собой отрезок молекулы дефенсина NP-1, содержащий два цистеиновых остатка, которые вовлечены в формирование внутримолекулярного дисульфидного мостика, а также последовательность Pro–Arg–Glu–Arg–Arg–Ala. Выбор указанной последовательности определяется тем фактом, что изученный нами ранее линейный пептид Ac–Pro–Arg–Glu–Arg–Arg–Ala–NH2 весьма эффективно модулирует активационное воротное устройство каналов NaV1.8 [13]. Благодаря своей циклической структуре PIP10 должен быть более устойчивым к действию деструктивных пептидаз, чем линейные пептиды, что позволяет этой молекуле претендовать на роль лекарственной субстанции нового пептидного анальгетика.
МЕТОДИКА
Метод локальной фиксации потенциала. Эксперименты проводили с помощью метода локальной фиксации потенциала (patch-clamp method) в конфигурации “регистрация активности целой клетки” (“whole-cell”) [14]. Объектом исследования являлись культивируемые изолированные сенсорные нейроны, выделенные из областей L5–S1 ганглиев спинного мозга новорожденных крысят линии Wistar. Культивирование изолированных нейронов в течение двух часов в стандартных питательных средах с использованием СО2-инкубатора позволяет получить интактные клетки. Подробно метод получения этих нейронов описан в наших предыдущих работах [15, 16]. Для исследования характеристик натриевых токов в работе использовали стандартные растворы (концентрации представлены в ммоль/л). Внеклеточный: NaCl – 65, CaCl2 – 2, MgCl2 – 2, Choline Cl – 90, HEPES Na – 10, тетродотоксин – 0.0003, pH 7.4. Внутриклеточный: CsF – 100, NaCl – 10, CsCl – 40, MgCl2 – 2, HEPES Na – 10, pH 7.2. Исключение из состава растворов ионов калия позволило избавиться от всех компонентов калиевого тока, а ионы фтора во внутриклеточном растворе обеспечивали блокирование кальциевых токов [17, 18]. В работе использовали реактивы фирмы “Sigma Chemical Co.” (США).
Декапептид PIP10 был получен методом классического пептидного синтеза (фирма ООО “НПФ Верта”), для чего применяли реактивы и производные аминокислот фирм “Sigma Chemical Co.” (США), “Iris Biotech GmbH” (Германия), растворители производства компаний “Экос-1” и “Криохром” (Россия). Конечный продукт характеризовали с помощью аналитической ВЭЖХ (чистота >95%) и масс-спектрометрии.
Квантовохимические расчеты. Полную оптимизацию геометрических параметров изолированной молекулы декапептида PIP10 осуществляли полуэмпирическим методом AM1 с применением программы GAMESS [19]. Гуанидиновые группы боковых цепей аргинильных остатков и карбоксильную группу боковой цепи глутаминовой кислоты рассматривали в заряженной форме. Общий заряд молекулы PIP10 составлял +2.
Метод органотипической культуры нервной ткани. Применяемый нами метод детально описан в работах [15, 20, 21]. Спинальные ганглии Е10–Е12 куриных эмбрионов выделяли из областей L5–S1. Эксплантаты культивировали в чашках Петри на подложках из коллагена в СО2-инкубаторе (Sanyo, Япония) в течение трех суток при 36.5°С и 5% СО2. Состав питательной среды был следующим: 40% среды Игла, 45% раствора Хенкса, 10% фетальной телячьей сыворотки, 0.5 ед./мл инсулина, 0.6% глюкозы, 2 мкмоль/л глютамина и 100 ед./мл гентамицина. Контрольными служили эксплантаты, культивированные только в условиях питательной среды. В культуральную среду добавляли исследуемый пептид PIP10 в широком диапазоне концентраций. Для количественной оценки роста эксплантатов применяли морфометрический метод. Индекс площади (ИП) рассчитывали как отношение площади зоны роста эксплантата к исходной центральной площади, где находились немигрирующие клетки. Контрольное значение ИП принимали за 100%. Для визуализации объектов использовали микроскоп Axio Observer Z1 (Carl Zeiss, Германия). Полученные изображения анализировали с использованием программ ImageJ и ZEN_2012. Работа выполняли на оборудовании ЦКП “Конфокальная микроскопия” Института физиологии им. И.П. Павлова РАН (г. Санкт-Петербург).
Статистическую обработку полученных результатов выполняли в программе STATISTICA 10.0 (StatSoft, США). Данные представлены в виде среднего значения ± стандартная ошибка среднего. Для сравнения между группами использовали t-критерий Стьюдента. Различия принимали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
С помощью метода локальной фиксации потенциала была исследована способность декапептида PIP10 модулировать возбудимость мембраны ноцицепторов – снижать потенциалочувствительность медленных натриевых каналов NaV1.8, ответственных за кодирование болевых сигналов.
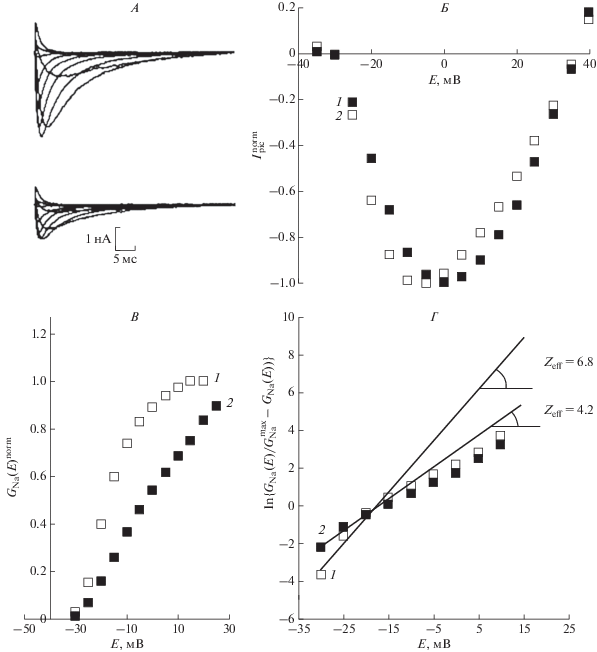
На рис. 1, A приведены характерные исходные записи активности медленных натриевых каналов NaV1.8 в контрольных экспериментах и после приложения PIP10 в концентрации 100 нмоль/л. Обычно максимальные значения амплитуд натриевых токов несколько уменьшаются в течение эксперимента, что обусловлено, главным образом, так называемым “run-down” эффектом, внутренне присущим методу локальной фиксации потенциала. Наиболее важным стационарным параметром, определяющим электровозбудимость нейрона, служит потенциалочувствительность активационной воротной системы, которая определяется количественно величиной ее эффективного заряда. Для оценки этого параметра были построены нормированные “пиковые” вольт-амперные характеристики обычным способом [22]: при подаче на мембрану последовательности ступенек напряжения (E) регистрировали амплитудные (пиковые) значения токов (Ipic), которые можно представить в виде функции Ipic(E). На рис. 1, Б показаны вольт-амперные характеристики натриевых токов в контрольном эксперименте и после приложения PIP10 в концентрации 100 нмоль/л. Основной эффект, позволяющий обнаружить количественную связь между потенциалочувствительностью активационной воротной системы натриевых каналов NaV1.8 и воздействием исследуемого агента, проявляется в изменении крутизны левой ветви вольт-амперной характеристики. В более явном виде изменение крутизны может быть представлено на графике зависимости нормированной хордовой проводимости от потенциала (рис. 1, В). Эта функция строится следующим способом. Хордовая проводимость как функция потенциала равна отношению максимальных значений токов к разности между мембранным потенциалом и потенциалом реверсии натриевого тока. Функция GNa(E) имеет начальный S-образный участок, крутизна которого отражает особенности потенциалочувствительности активационного процесса. После построения нормированной функции $G_{{{\text{Na}}}}^{{{\text{norm}}}}\left( E \right)$ (рис. 1, В) можно видеть, что изменение крутизны именно указанного участка четко проявляется при воздействии PIP10, и это связано с изменением потенциалочувствительности активационного воротного устройства медленных натриевых каналов. Потенциалочувствительность оценивалась с помощью модифицированного нами метода В. Алмерса [23], дающего удовлетворительную оценку величины эффективного заряда (Zeff) активационного воротного устройства медленных натриевых каналов. Тангенс угла наклона регрессионной прямой определяет предельную логарифмическую чувствительность воротного устройства канала к изменению потенциала. На рис. 1, Г представлены экспериментальные записи величины Zeff до и после приложения декапептида. Видно, что в данном эксперименте величина эффективного заряда снижалась с контрольного значения Zeff, равного 6.8 до 4.2 после приложения PIP10 в концентрации 100 нмоль/л.
Рис. 1.
Влияние декапептида PIP10 (100 нмоль/л) на потенциалочувствительность медленных натриевых каналов NaV1.8. А – семейства медленных натриевых токов в контрольных экспериментах (вверху) и после приложения PIP10 (внизу). Диапазон тестирующего потенциала от –35 до 45 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом. Б – нормированные значения пиковых вольт-амперных характеристик каналов NaV1.8, построенные по данным контрольного эксперимента и после приложения PIP10. В – потенциалозависимость хордовой проводимости каналов NaV1.8, полученная в контрольных экспериментах и после приложения PIP10. Г – экспоненциальная функция Алмерса, построенная в логарифмическом масштабе (ось ординат), позволяет определить величину Zeff по тангенсу угла наклона асимптот, проведенных к начальным участкам этих функций. 1 – контрольные значения, 2 – значения после приложения PIP10.
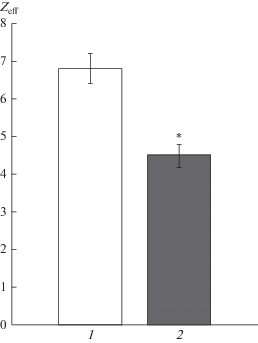
Наши результаты, полученные при воздействии PIP10 в концентрации 100 нмоль/л, свидетельствуют о статистически достоверном снижении эффективного заряда с контрольного значения Zeff = 6.8 ± 0.4 (n = 15) до Zeff = 4.5 ± 0.3 (n = 23) (рис. 2).
Рис. 2.
Значения величины эффективного заряда активационной воротной системы каналов NaV1.8 после приложения декапептида PIP10 (100 нмоль/л). 1 – контрольные значения, 2 – значения после приложения PIP10. * – различие между контрольными и экспериментальными данными статистически достоверно.
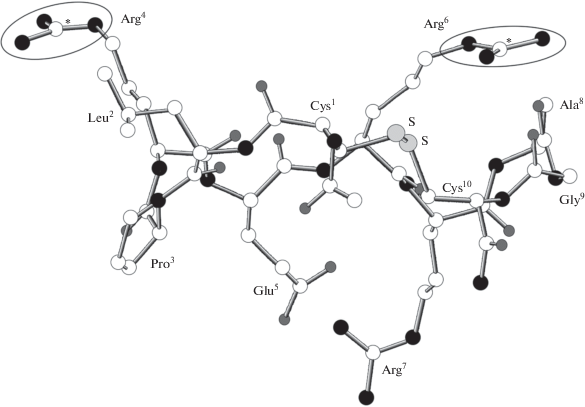
Квантовохимические расчеты показали, что конформация PIP10, полученная в рамках полной оптимизации геометрических параметров указанной молекулы полуэмпирическим методом AM1 (рис. 3), стабилизирована наличием дисульфидного мостика Cys1–Cys10 и внутримолекулярного солевого мостика Glu5–Arg7. При этом боковые цепи аргинильных остатков Arg4 и Arg6 оказываются стерически доступными и не вовлеченными в сильные внутримолекулярные взаимодействия. Расстояние между центральными атомами углерода гуанидиновых групп указанных аргинильных остатков составляет приблизительно 14 Å, и можно предположить, что именно эти группы ответственны за связывание молекулы РIР10 с каналом NaV1.8.
Рис. 3.
Пространственное строение молекулы PIP10 по результатам полной оптимизации геометрических параметров методом АМ1 и нумерация аминокислотных остатков. Белые шары – атомы углерода, светло-серые – атомы серы, темно-серые – атомы кислорода, черные – атомы азота. Центральные атомы углерода не вовлеченных во внутримолекулярные взаимодействия гуанидиновых групп отмечены звездочками, а сами группы заключены в овалы. Атомы водорода не показаны.
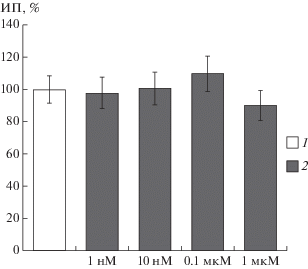
С помощью метода органотипической культуры ткани было изучено влияние декапептида PIP10 на рост нейритов сенсорных нейронов. Данная молекула была исследована в концентрациях 1 и 10 нмоль/л, 0.1 и 1 мкмоль/л. Ни в одной из рассмотренных концентраций декапептида ИП эксплантатов спинальных ганглиев не отличался от контрольного значения (рис. 4). Полученные данные свидетельствуют о том, что циклический декапептид PIP10 не оказывает влияния на рост указанной ткани, и, как следствие, не обладает нейротоксическими свойствами.
Рис. 4.
Влияние декапептида PIP10 в различных концентрациях на рост нейритов. 1 – контрольные значения, 2 – значения после приложения декапептида PIP10. По оси ординат – индекс площади эксплантатов (ИП, %).
Таким образом, этот циклический декапептид обладает способностью снижать Zeff медленных натриевых каналов, сравнимой с эффектом линейного гексапептида Ac–Pro–Arg–Glu–Arg–Arg–Ala–NH2 [13]. Полученный результат позволяет сделать важнейший вывод о том, что нами установлена близкая к минимально возможной циклическая аминокислотная последовательность атакующей молекулы, основанная на структуре нативной формы дефенсина NP-1. Эта молекула (PIP10) способна снижать эффективный заряд каналов NaV1.8 и может претендовать на роль анальгетической субстанции пептидной природы.
Тончайший механизм модуляции медленных натриевых каналов, основанный на образовании ион-ионных связей между молекулой канала NaV1.8 и двумя гуанидиновыми группами аргинильных остатков атакующей молекулы, является принципиально новым. Он отличается от рассматриваемых в мировой литературе механизмов регуляции каналов NaV1.8, причем эти каналы считаются одной из самых перспективных мишеней при создании новых анальгетических лекарственных препаратов [24]. Известны работы, в которых сообщалось об эффективных модуляторах функциональной активности каналов NaV1.8 [25, 26]. Однако в мировой литературе отсутствуют данные о проведенных клинических исследованиях указанных субстанций как анальгетиков, способных заменить опиаты. Можно предположить, что авторам этих работ не удалось на организменном уровне обнаружить специфичность и безопасность действия исследуемых ими субстанций.
На основании предложенного в настоящей работе механизма модуляции каналов NaV1.8 можно предсказать и объяснить анальгетическую активность как линейных, так и циклических пептидов. Необходимо отметить, что задача обнаружения самого короткого пептида, потенциально способного выступать в качестве анальгетической лекарственной субстанции, нами была решена ранее. Им оказался трипептид Ас–Arg–Glu–Arg–NH2 [27].
Лиганд-рецепторное связывание как линейного трипептида, так и циклического декапептида осуществляется благодаря ион-ионному взаимодействию с молекулой канала двух положительно заряженных гуанидиновых групп, входящих в состав аргинильных остатков атакующих молекул. Расстояние между ними, т.е. расстояние между центральными атомами углерода этих групп в молекуле Ас–Arg–Glu–Arg–NH2, составляет примерно 13 Å, а в молекуле PIP10 – около 14 Å. Мы предполагаем, что подобная величина расстояния между гуанидиновыми группами в атакующей молекуле является принципиально важной для осуществления эффективного лиганд-рецепторного связывания аргининсодержащих пептидов с молекулой канала NaV1.8.
ЗАКЛЮЧЕНИЕ
В настоящей работе осуществлена попытка обнаружения самого короткого циклического пептида, способного проявлять анальгетический эффект. Полученные данные указывают на то, что исследованный нами циклический декапептид PIP10 может претендовать на эту роль благодаря эффективной модуляции функциональной активности каналов NaV1.8.
Этические нормы. Эксперименты были разработаны в соответствии с Директивой Совета Европейских сообществ от 24 ноября 1986 г. (86/609/EЭC). Местный комитет по уходу и использованию животных Института физиологии имени Павлова РАН (Санкт-Петербург) утвердил все экспериментальные методики с животными, разрешение № 12/03 (20.04.2018).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Финансирование работы. Данное исследование выполнено в рамках реализации Программы НЦМУ и при финансовой поддержке Минобрнауки РФ (соглашение № 075-15-2020-921 от 13.11.2020).
Список литературы
Zeya H.I., Spitznagel J.K., Schwab J.H. Antibacterial Action of PMN Lysosomal Cationic Proteins Resolved By Density Gradient Electrophoresis // Proc. Soc. Exp. Biol. Med. 1966. V. 121. № 1. P. 250.
Kokryakov V.N., Harwig S.S.L., Panyutich E.A. et al. Protegrins: leukocyte antimicrobial peptides that combine features of corticostatic defensins and tachyplesins // FEBS Lett. 1993. V. 327. № 2. P. 231.
Harwig S.S.L., Swiderek K.M., Kokryakov V.N. et al. Gallinacins: cysteine-rich antimicrobial peptides of chicken leukocytes // FEBS Lett. 1994. V. 342. № 3. P. 281.
Fitch C.A., Platzer G., Okon M. et al. Arginine: Its pKa value revisited // Protein Sci. 2015. V. 24. № 5. P. 752.
Рогачевский И.В., Плахова В.Б., Щеголев Б.Ф. и др. Рецептор дефенсина: возможный механизм снижения возбудимости мембраны сенсорного нейрона // Доклады Академии наук. 2000. Т. 375. № 6. С. 843. Rogachevskii I.V., Plakhova V.B., Shchegolev B.F. et al. [The defensin receptor: a possible mechanism responsible for reduced excitability of the neuronal sensory membrane] // Dokl. Biol. Sci. 2000. V. 375. № 6. P. 595.
Bach A.C., Selsted M.E., Pardi A. Two-dimensional NMR studies of the antimicrobial peptide NP-5 // Biochemistry. 1987. V. 26. № 14. P. 4389.
Pardi A., Hare D.R., Selsted M.E. et al. Solution structures of the rabbit neutrophil defensin NP-5 // J. Mol. Biol. 1988. V. 201. № 3. P. 625.
Hill C.P., Yee J., Selsted M.E., Eisenberg D. Crystal structure of defensin HNP-3, an amphiphilic dimer: mechanisms of membrane permeabilization // Science. 1991. V. 251. № 5000. P. 1481.
Selsted M.E., Tang Y.Q., Morris W.L. et al. Purification, primary structures, and antibacterial activities of beta-defensins, a new family of antimicrobial peptides from bovine neutrophils. // J. Biol. Chem. 1993. V. 268. № 9. P. 6641.
Ноздрачев А.Д., Крылов Б.В., Сабанов В.С. и др. Эндогенные антибиотики дефенсины как возможные регуляторы функционирования натриевых каналов нейронов спинномозговых ганглиев // Доклады Академии наук. 1997. Т. 355. № 5. С. 705. Nozdrachev A.D., Krylov B.V., Sabanov V.S. et al. [Endogenous antibiotic defensins as a tentative regulators of sodium channels in dorsal root ganglion neurons] // Dokl. Akad. Nauk. 1997. V. 355. № 5. P. 705.
Плахова В.Б., Щеголев Б.Ф., Рогачевский И.В. и др. Возможный молекулярный механизм взаимодействия дефенсина с мембраной сенсорного нейрона // Рос. физиол. журн. им. И.М. Сеченова. 2000. Т. 86. № 11. С. 1471. Plakhova V.B., Shchegolev B.F., Rogachevskii I.V. et al. [Putative molecular mechanism of defensin interaction with the membrane of the sensory neuron] // Ross. Fiziol. Zh. Im. I. M. Sechenova. 2000. V. 86. № 11. P. 1471.
Щеголев Б.Ф., Рогачевский И.В., МакКи М.Л. и др. Квантовохимическое исследование равновесной геометрии и электронного строения молекул эндогенных пептидов NP-4 и NP-5 // Журн. общей химии. 2005. Т. 75. № 3. С. 509. Shchegolev B.F., Rogachevskii I.V., MacKee M.L. et al. A quantum-chemical study of the steric and electronic structure of the molecules of endogenic peptides NP-4 and NP-5 // Russ. J. Gen. Chem. 2005. V. 75. № 3. P. 473.
Плахова В.Б., Рогачевский И.В., Шелых Т.Н. и др. Возможный молекулярный механизм анальгетического эффекта пептидных фрагментов дефенсинов // Медицинский академический журн. 2013. T. 13. № 3. C. 78. Plakhova V.B., Rogachevskii I.V., Shelykh T.N., et al. [A possible molecular mechanism of analgesic effect of peptide fragments of defensins] // Med. Akad. Zh. 2013. V. 13. № 3. P. 78.
Hamill O.P., Marty A., Neher E. et al. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches // Pflugers Arch. 1981. V. 391. № 2. P. 85.
Plakhova V.B., Penniyaynen V.A., Yachnev I.L. et al. Src kinase controls signaling pathways in sensory neuron triggered by low-power infrared radiation // Can. J. Physiol. Pharmacol. 2019. V. 97. № 5. P. 400.
Plakhova V.B., Penniyaynen V.A., Rogachevskii I.V. et al. Dual mechanism of modulation of NaV1.8 sodium channels by ouabain // Can. J. Physiol. Pharmacol. NRC Research Press. 2020. V. 98. № 11. P. 785.
Kostyuk P.G., Krishtal O.A., Pidoplichko V.I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells // Nature. 1975. V. 257. № 5528. P. 691.
Elliott A.A., Elliott J.R. Characterization of TTX-sensitive and TTX-resistant sodium currents in small cells from adult rat dorsal root ganglia // J. Physiol. 1993. V. 463. № 1. P. 39.
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. General atomic and molecular electronic structure system // J. Comput. Chem. 1993. V. 14. № 11. P. 1347.
Lopatina E.V., Yachnev I.L., Penniyaynen V.A. et al. Modulation of signal-transducing function of neuronal membrane Na+,K+-ATPase by endogenous ouabain and low-power infrared radiation leads to pain relief // Med. Chem. 2012. V. 8. № 1. P. 33.
Penniyaynen V.A., Plakhova V.B., Rogachevskii I.V. et al. Molecular mechanisms and signaling by comenic acid in nociceptive neurons influence the pathophysiology of neuropathic pain // Pathophysiology. 2019. V. 26. № 3–4. P. 245.
Hodgkin A.L., Huxley A.F. The dual effect of membrane potential on sodium conductance in the giant axon of Loligo // J. Physiol. 1952. V. 116. № 4. P. 497.
Алмерс В. Воротные токи и движение зарядов в возбудимых мембранах / Мембраны: ионные каналы. М.: Мир, 1981. С. 129.
Bennett D.L., Clark X.A.J., Huang J. et al. The role of voltage-gated sodium channels in pain signaling // Physiol. Rev. 2019. V. 99. № 2. P. 1079.
Jarvis M.F., Honore P., Shieh C.-C. et al. A-803467, a potent and selective Nav1.8 sodium channel blocker, attenuates neuropathic and inflammatory pain in the rat // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 20. P. 8520.
Bagal S.K., Bungay P.J., Denton S.M. et al. Discovery and optimization of selective NaV1.8 modulator series that demonstrate efficacy in preclinical models of pain // ACS Med. Chem. Lett. 2015. V. 6. № 6. P. 650.
Шелых Т.Н., Рогачевский И.В., Ноздрачев А.Д. и др. Молекулярный механизм модуляции трипептидом возбудимости мембраны ноцицептивного нейрона // Доклады Академии наук. 2016. Т. 466. № 6. С. 734. Shelykh T.N., Rogachevsky I.V., Nozdrachev A.D. et al. Molecular mechanism of modulation of nociceptive neuron membrane excitability by a tripeptide // Dokl. Biochem. Biophys. 2016. V. 466. № 1. P. 77.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


