Физиология человека, 2021, T. 47, № 6, стр. 33-42
Мультипараметрический подход к оценке кожной микроциркуляции у пациентов дерматологического профиля (на примере псориаза)
Е. В. Потапова 1, *, М. А. Михайлова 1, 2, А. К. Королева 1, Д. Д. Ставцев 1, В. В. Дремин 1, 3, А. В. Дунаев 1, Н. Ю. Якушкина 1, 4, А. И. Крупаткин 5, Н. Б. Маргарянц 6
1 ФГБОУ ВО Орловский государственный университет имени И.С. Тургенева
Орeл, Россия
2 ФГБУ Национальный медицинский исследовательский центр терапии и профилактики медицины
Москва, Россия
3 Университет Астона
Бирмингем, Великобритания
4 Орловский областной кожно-венерологический диспансер
Орeл, Россия
5 ФГБУ Национальный медицинский исследовательский центр травматологии и ортопедии
имени Н.Н. Приорова
Москва, Россия
6 ФГАОУ ВО Национальный исследовательский университет ИТМО
Санкт-Петербург, Россия
* E-mail: potapova_ev_ogu@mail.ru
Поступила в редакцию 30.10.2020
После доработки 22.11.2020
Принята к публикации 20.02.2021
Аннотация
В работе описан мультипараметрический подход к оценке состояния кожной микроциркуляции у пациентов дерматологического профиля (на примере псориаза). Мультипараметрический диагностический подход заключался в проведении трех этапов последовательных измерений методами лазерной спекл-контрастной визуализации (ЛСКВ), лазерной допплеровской флоуметрии (ЛДФ) и видеокапилляроскопии (ВКС). Были проведены экспериментальные исследования гемодинамических параметров пациентов с псориазом в ходе консервативной терапии. Комплексное применение оптических неинвазивных методов диагностики позволило зарегистрировать изменения, происходящие в микроциркуляторном русле в ходе лечения. Было выявлено, что микроциркуляторные нарушения, наблюдаемые перед началом лечения в области псориатических бляшек (увеличение плотности капиллярной сети, повышение показателя микроциркуляции, нутритивного кровотока и амплитуд миогенных и сердечных осцилляций), нормализуются под действием проводимой терапии, что может быть положено в основу оценки ее эффективности. Предлагаемый подход возможно использовать для обнаружения микроциркуляторных расстройств, возникающих при псориазе на доклиническом этапе заболевания, а также при разработке и тестировании новых фармакологических средств для его лечения.
Псориаз – хроническое рецидивирующее воспалительное заболевание кожи с гиперпролиферацией эпидермальных клеток, нарушением процесса кератинизации и воспалительной реакцией в дерме, сопровождающееся изменением в различных органах и системах. Согласно данным статистики этот дерматоз встречается у 2–3% населения мира [1]. Патогенетические механизмы псориаза все еще остаются спорными. До конца остается невыясненным вопрос: является ли псориаз главным образом эпидермальным заболеванием, сопровождающимся дермальными и сосудистыми изменениями, или же начало повреждений происходит из дермы и кровеносных сосудов и вторично провоцирует гиперпролиферацию эпидермиса. Но факт того, что важная и, возможно, решающая роль в патогенезе заболевания принадлежит микрососудистым изменениям, признается практически всем медицинским научным сообществом [2–4].
Микроциркуляторные нарушения являются характерной особенностью псориаза и возникают задолго до появления клинической картины заболевания. Гистологические и капилляроскопические исследования показали, что для стационарной стадии заболевания характерны извилистость капиллярных петель в папиллярной дерме и удлинение их венозной части [2, 5–7]. Расширенное капиллярное русло и общее увеличение количества функционирующих капилляров обуславливает усиленный кровоток в области псориатических бляшек по сравнению с клинически невовлеченной кожей [8, 9]. Микрососудистые изменения происходят до или непосредственно на ранней стадии развития поражений перед эпидермальной гиперплазией и постепенно исчезают с возвращением к нормальной кожной микроциркуляции крови в процессе лечения. Повышенная кожная перфузия возвращается к нормальным значениям, капилляры с преобладанием венозной части превращаются в артериальные капилляры, подобные тем, которые существуют в здоровой коже [3, 6, 10]. Таким образом, микроциркуляторные изменения играют важную роль в патогенезе и лечении псориаза и являются надежным диагностическим параметром.
На данный момент врачи-дерматологи очень ограничены в выборе инструментальных методов для диагностики и мониторинга динамики лечения псориаза. Постановка диагноза основана на субъективном подходе: сборе анамнеза и анализе клинической картины, и зависит от квалификации и опыта врача. Необходима разработка методов, обладающих высокой информативностью и чувствительностью с возможностью получения диагностического результата в режиме реального времени, которые могли бы быть внедрены в клиническую практику для объективизации критериев выбора лечебной тактики и мониторинга динамики лечения.
Методы оптической неинвазивной диагностики: лазерная спекл-контрастная визуализация (ЛСКВ), видеокапилляроскопия (ВКС), лазерная допплеровская флоуметрия (ЛДФ), флуоресцентная спектроскопия, спектроскопия диффузного отражения, фотоплетизмография, оптическая когерентная томография и др. – находят широкое применение во многих областях медицины [11–13], в том числе в дерматологии, при диагностике микроциркуляторных нарушений при псориазе, экземе и других кожных заболеваниях [14–16]. Современным направлением развития оптической неинвазивной диагностики является мультипараметрический подход, когда в одной диагностической технологии комбинируются различные методы исследования, что позволяет получить высокоэффективные диагностические инструменты. В связи с этим предлагается использовать подход, при котором одновременно анализируются данные трех методов, позволяющих оценивать параметры микроциркуляторного кровотока: ЛДФ, ЛСКВ и ВКС.
В основу метода ЛСКВ положена регистрация случайной спекл-интерференционной картины, формирующейся на детекторе, собирающем обратно рассеянный свет от поверхности ткани и движущихся элементов крови (эритроцитов), освещенных когерентным лазерным излучением [17]. С помощью ЛСКВ можно регистрировать двумерные карты кровотока с очень высоким пространственным и временны́м разрешением [18]. Метод ЛДФ основан также на зондировании биологической ткани низкоинтенсивным лазерным излучением и регистрации в соответствии с эффектом Допплера отраженного и рассеянного излучения от движущихся в диагностическом объеме эритроцитов [19]. ЛДФ позволяет оценивать не только перфузию крови в исследуемой области, но и также дополнительно анализировать состояние различных механизмов регуляции кровотока путем спектрального анализа регистрируемого сигнала. Метод ВКС основан на регистрации и анализе перемещения эритроцитов с возможностью оценки их скорости в отдельных капиллярах путем записи серии видеокадров капиллярного кровотока [20]. Данная технология позволяет в режиме реального времени выявлять как функциональные, так и структурные изменения микроциркуляторных нарушений на уровне капилляров.
Таким образом, целью настоящей работы является исследование функционального состояния микроциркуляторного русла верхних конечностей пациентов, страдающих псориазом, с дальнейшей оценкой эффективности применяемой консервативной терапии с помощью мультипараметрического оптического подхода.
МЕТОДИКА
В исследованиях участвовали 6 пациентов дерматовенерологического отделения (3 женщины и 3 мужчины) БУЗ Орловской области “Орловский областной кожно-венерологический диспансер” (г. Орeл) в возрасте 36 ± 16 лет с диагнозом псориаз обыкновенный в стационарной стадии. С целью оценки эффективности консервативной терапии исследование функционального состояния микроциркуляторного русла верхних конечностей пациентов на основе мультипараметрического подхода проводили трижды: при поступлении больных в стационар, на 6 и 12 дни лечения. Всего в общую статистику исследований включили по 18 измерений каждым из методов оптической диагностики ЛСКВ, ЛДФ и ВКС.
В исследование включали пациентов, имеющих псориатические поражения на внутренней стороне предплечья. Выбор указанной области обусловлен минимальным риском воздействия внешних факторов на выбранную область и легким доступом к зоне исследования, что позволяет получать достоверную информацию о нутритивном микрокровотоке исследуемой ткани. В исследование не включали пациентов, в анамнезе у которых отмечался острый период заболеваний сердечно-сосудистой, бронхолегочной систем, заболевания печени, почек, крови, вен, т.е. состояния, которые могут оказывать влияние на конечный результат исследований. Основные клинико-лабораторные показатели были измерены в соответствии со стандартными лабораторными процедурами. Измерение артериального давления производили после 5-минутного отдыха пациента в сидячем положении. Основные клинико-лабораторные показатели обследованных пациентов дерматологического профиля приведены в табл. 1 (приведены средние значения показателей и стандартное отклонение (M ± σ)).
Таблица 1.
Основные клинико-лабораторные показатели обследованных пациентов с псориазом (M ± σ)
| № п/п | Наименование показателя | Значение |
|---|---|---|
| 1 | Пол (М/Ж) | 3/3 |
| 2 | Возраст, лет | 36 ± 16 |
| 3 | Индекс массы тела, кг/м2 | 25 ± 3 |
| 4 | Длительность заболевания, лет | 16 ± 13 |
| 5 | САД, мм рт. ст. | 126 ± 9 |
| 6 | ДАД, мм рт. ст. | 82 ± 7 |
| 14 | Площадь поражения кожи, % | 36 ± 14 |
Длительность стационарного пребывания больных с псориазом в дерматологическом отделении в среднем составляла 12–14 дней. Пациенты получали лечение по стандартной схеме, включающей в себя следующую медикаментозную и инструментальную терапию: внутривенно – тиосульфат натрия 30% (10.0 мл) и реополиглюкин (400.0 мл); внутримышечно – витамин В6 (2.0 мл); подкожно – алоэ (1.0 мл), перорально – эссенциале форте Н (300 мг по 2 кап. 3 раза в день), пентоксифилин (1 таблетка 2 раза в день), аевит (1 капсула 2 раза в день), фолиевая кислота (1 таблетка 2 раза в день), микстура Павлова (1 столовая ложка 3 раза в день); наружно – мазь салициловая 5%, мазь дермовейт, мазь серно-салициловая – 2 раза в день, общее ультрафиолетовое облучение.
Все измерения проводили в комнате с постоянной температурой воздуха (+23 ± 1°С) в состоянии психического и физического покоя обследуемых, в положении сидя, после 15-минутного периода адаптации пациентов к комнатным условиям. Исследуемую конечность располагали на горизонтальной поверхности на уровне сердца.
На рис. 1 показана схема проведения исследования пациентов с псориазом с применением мультипараметрического подхода, сочетающего в себе три этапа последовательных измерений: ЛСКВ, ЛДФ и ВКС.
Рис. 1.
Схема проведения исследования пациентов с псориазом с применением мультипараметрического подхода. а – первый этап исследования методом лазерной спекл-контрастной визуализации (ЛСКВ); б – второй этап исследования методом лазерной допплеровской флоуметрии (ЛДФ); в – третий этап исследования методом видеокапилляроскопии (ВКС).
Для визуализации перфузии тканей кровью в исследуемой области методом ЛСКВ на первом этапе использовали экспериментальную установку, разработанную на базе НТЦ биомедицинской фотоники (ФГБОУ ВО “Орловский государственный университет им. И.С. Тургенева”, г. Орeл). Экспериментальная установка включала в себя лазерный источник мощностью 10 мВт, работающий на длине волны 635 нм (Edmund Optics Inc., США), излучение от которого проецируется на поверхность кожи пациента с помощью расширителя пучка. Для регистрации спекл-изображений использовали КМОП-камеру DCC 3260M (разрешение 1936 × 1216 пикселей, размер пикселя 5.86, Thorlabs, США) в сочетании с объективом MVL25M23 (фокусное расстояние 25 мм, Thorlabs, США). Регистрацию спекл-картины проводили на исследуемом участке ткани внутренней стороны предплечья в течение 30 с. Частота кадров при видеорегистрации составляла 40 Гц. Полученные спекл-изображения передавали на ПК для последующего анализа с применением разработанного алгоритма в программной среде Matlab [21].
Для оценки динамических изменений микроциркуляции крови в исследуемой области использовался пространственно-временнóй алгоритм анализа статистики спеклов, расчет среднего контраста проводили по формуле:
(1)
$K = {{\left\langle {\frac{{{{\sigma }_{N}}}}{{{{{\left\langle I \right\rangle }}_{N}}}}} \right\rangle }_{k}},$При визуализации перфузии крови в исследуемой области темные оттенки серого цвета соответствуют низким значениям рассчитанного контраста и высокой скорости рассеивающих частиц, светлые участки – высокому контрасту и низкой скорости.
На втором этапе проводили исследования гемодинамических параметров с использованием канала ЛДФ комплекса “ЛАКК-M” (ООО НПП “ЛАЗМА”, Россия). В ЛДФ-канале осуществляется зондирование биоткани на длине волны 1064 нм, при этом диагностический объем, в среднем, составляет 1–3 мм3. Перфузию крови (Im, пф. ед.) регистрировали в области псориатического поражения и на участке невовлеченной (интактной) ткани, на расстоянии 1–2 см от пораженной области, в течение 10 мин на каждом участке. Для частотного анализа различных механизмов регуляции применяли программу LDF3.0.2.384 (ООО НПП “ЛАЗМА”), реализующую непрерывное вейвлет-преобразование с использованием в качестве анализирующего вейвлета комплекснозначный вейвлет Морле. Сигнал ЛДФ был разложен с помощью вейвлет-преобразования следующим образом:
Были рассчитаны амплитуды колебаний эндотелиального (Аэ, пф. ед.), нейрогенного (Ан, пф. ед.), миогенного (Ам, пф. ед.), дыхательного (Ад, пф. ед.) и сердечного (Ас, пф. ед.) генеза [19]. Для оценки вклада различных путей кровотока в общий кровоток по методике, основанной на анализе амплитудно-частотного спектра [22] с учетом преимущественно отсутствия артериоло-венулярных анастомозов в коже внутренней стороны предплечья, производился расчет показателя шунтирования, характеризующий долю кровотока в артериоло-венулярных анастомозах – (ImAVA, пф. ед.) и величины нутритивного кровотока (Imn, пф. ед.).
Показатель шунтирования рассчитывали следующим образом: ${{I}_{{mAVA}}} = {{I}_{{1mAVA}}} + {{I}_{{2mAVA}}}.$ ${{I}_{{1mAVA}}}$ рассчитывали по следующей формуле: I1mAVA = $ = {{{{A}_{{{\text{акт}}}}}} \mathord{\left/ {\vphantom {{{{A}_{{{\text{акт}}}}}} {{{A}_{{\text{м}}}}}}} \right. \kern-0em} {{{A}_{{\text{м}}}}}},$ где ${{A}_{{{\text{акт}}}}}$ – максимальная амплитуда колебаний кровотока, связанная с активными механизмами регуляции (осцилляции эндотелиального, нейрогенного и миогенного генеза), Ам – амплитуда колебаний кровотока в миогенном диапазоне.
${{I}_{{2mAVA}}}$ рассчитывали следующим образом: ${{I}_{{2mAVA}}} = {{{{A}_{{{\text{пас}}}}}} \mathord{\left/ {\vphantom {{{{A}_{{{\text{пас}}}}}} {{{A}_{{\text{м}}}}}}} \right. \kern-0em} {{{A}_{{\text{м}}}}}},$ где Aпас – максимальная амплитуда колебаний кровотока, связанная с пассивными механизмами регуляции (осцилляции пульсового или дыхательного генеза). ${{I}_{{2mAVA}}}$ учитывали при расчете показателя шунтирования, если ${{I}_{{2mAVA}}}$ ≥ 1. Нутритивный кровоток рассчитывали по следующей формуле: ${{I}_{{mn}}} = {{{{I}_{m}}} \mathord{\left/ {\vphantom {{{{I}_{m}}} {{{I}_{{mAVA}}}}}} \right. \kern-0em} {{{I}_{{mAVA}}}}}.$
Для определения числа визуализируемых капилляров в псориатической бляшке и интактной ткани, а также для анализа структурной организации капилляров, на третьем этапе применяли метод ВКС. При проведении исследований использовали установку, разработанную на базе НТЦ биомедицинской фотоники (ФГБОУ ВО “Орловский государственный университет имени И.С. Тургенева”, г. Орeл), оптическая система которой состояла из микрообъектива Mitutoyo M Plan APO 5X (Thorlab, США) с апертурой 0.14, проецирующего через длиннофокусную линзу (фокусное расстояние 200 мм) изображение капилляров на матрицу камеры. Для регистрации данных применяли высокоскоростную КМОП-камеру UI-3060-C-HQ (IDS GmbH, Германия). В ходе исследования запись вели в течение 1 мин при разрешении кадра 800 × 800 пикселей и частоте кадров 150 Гц в области псориатического поражения и на участке невовлеченной (интактной) ткани на расстоянии 1–2 см от пораженной области. Запись в течение 1 мин позволила на этапе обработки выбрать наиболее качественные анализируемые кадры. Для лучшего контраста область исследования освещалась боковой подсветкой со светодиодным источником излучения, работающего на длине волны 560 нм, соответствующей изобестической точке спектров поглощения окси- и дезоксигемоглобина. Экспериментальная установка была смонтирована на подвижном штативе, вертикальная регулировка которого обеспечивала фокусировку оптической системы на области исследования. Анализ полученных изображений методом ВКС производили по следующей методике. Для исследуемых областей производили: определение плотности капиллярной сети посредством подсчета числа функционирующих капилляров в 1 мм2 ткани, а также оценку морфологии функционирующих капилляров и их формы.
Проводили статистический анализ экспериментальных данных. Значимость статистических различий выборок была оценена с помощью критерия Манна-Уитни, p < 0.05. Часть результатов статистического анализа представлена графически в виде диаграмм размаха, где центральная линия является медианой, края бокса – нижний и верхний квартили.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При исследовании методом ЛСКВ разработанное программное обеспечение позволило зарегистрировать изображение кожного кровотока больных псориазом на основе расчета пространственно-временнóго контраста, полученного по двадцати последовательным изображениям динамической спекл-картины. На рис. 2 приведен пример изменения пространственного распределения локальных оценок контраста у одного из больных, зарегистрированных на 1, 6 и 12 дни поступления в стационар.
Рис. 2.
Спекл-контрастные изображения, полученные в ходе изучения кожного кровотока больных с псориазом на различных этапах терапии. Выделенные области соответствуют области регистрации сигналов лазерной допплеровской флоуметрии (ЛДФ) в бляшке. А – фото области исследования (внутренняя сторона предплечья); Б – результаты исследования методом лазерной спекл-контрастной визуализации (ЛСКВ) в 1-й день поступления в стационар; В – на 6-й день терапии; Г – на 12-й день терапии.

При исследовании методом ЛСКВ у больных псориазом на разных стадиях терапии наблюдали пятнистый рисунок вследствие чередования зон с усиленной и нормальной микроциркуляцией. Участки с пониженным уровнем контраста соответствовали местам расположения псориатических бляшек. В 1-й день поступления в стационар у пациентов регистрировалось большое количество кожных псориатических высыпаний, это подтверждалось и ЛСКВ. К 6 дню терапии площадь высыпаний и их количество начали уменьшаться. При проведении исследования на 12-й день лечения при визуализации кожного кровотока предплечья общий контраст и контраст выделенной области увеличивался, практически не наблюдалось областей с низкими значениями контраста.
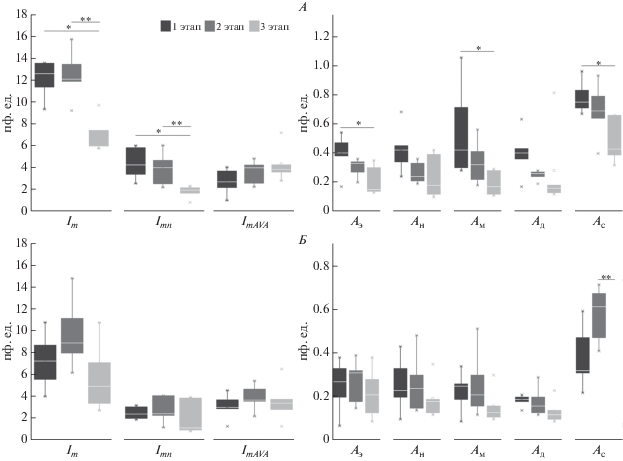
На спекл-контрастных изображениях выделена область внутренней стороны предплечья, на которой для данного больного в дальнейшем проводилась регистрация сигналов ЛДФ в бляшке. Дополнительно сигналы ЛДФ регистрировались на участке невовлеченной ткани. На рис. 3 представлены результаты статистической обработки данных, полученных методом ЛДФ на различных этапах терапии в виде диаграмм размаха, указаны статистически значимые различия параметров.
Рис. 3.
Рассчитанные параметры микроциркуляции крови по результатам исследования методом лазерной допплеровской флоуметрии (ЛДФ). А – псориатическая бляшка, Б – интактная область. * – статистическая значимость различий по отношению к первому этапу исследования с вероятностью p < 0.05; ** – статистическая значимость различий по отношению ко второму этапу исследования с вероятностью p < 0.05.
На третьем этапе методом ВКС были получены видеоизображения капилляров в псориатической бляшке и интактной ткани. Пример результатов ВКС у одного из больных, полученных на 1, 6 и 12 дни поступления в стационар представлены на рис. 4.
Рис. 4.
ВКС-записи капилляров псориатических поражений одного из пациентов на различных этапах терапии. А – результаты ВКС-исследования в 1-й день поступления в стационар; Б – на 6-й день терапии; В – на 12-й день терапии. I – псориатическая бляшка, II – интактная область.

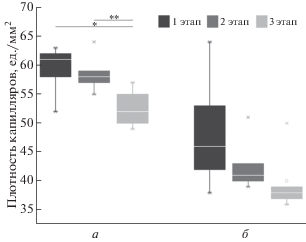
На рис. 5 представлены результаты расчета плотности капилляров в псориатической бляшке и интактной области, полученных методом ВКС, указаны статистически значимые различия параметров, зарегистрированных на различных этапах лечения.
Рис. 5.
Результаты расчета плотности капилляров по результатам исследования методом видеокапилляроскопии (ВКС). а – псориатическая бляшка, б – интактная область; * – статистическая значимость различий по отношению к первому этапу исследования с вероятностью p < 0.05; ** – статистическая значимость различий по отношению ко второму этапу исследования с вероятностью p < 0.05.
Дополнительно результаты исследований, полученных методами ЛДФ и ВКС, сведены в табл. 2. Это сделано для удобства анализа различий основных гемодинамических параметров, измеренных в псориатической бляшке и в интактной области, на каждом из этапов лечения.
Таблица 2.
Результаты расчета основных гемодинамических показателей (M ± σ)
| Показатель | 1 этап | 2 этап | 3 этап | |||
|---|---|---|---|---|---|---|
| псориатическая бляшка | интактная ткань | псориатическая бляшка | интактная ткань | псориатическая бляшка | интактная ткань | |
| Результаты исследования методом ЛДФ | ||||||
| Im, пф. ед. | 12.1 ± 1.8* | 7.2 ± 2.6 | 12.5 ± 2.4 | 9.8 ± 3.3 | 6.9 ± 1.7 | 5.8 ± 3.3 |
| Imn, пф. ед. | 4.4 ± 1.5* | 2.5 ± 0.6 | 3.9 ± 1.6 | 2.8 ± 1.3 | 1.8 ± 0.6 | 2.1 ± 1.6 |
| ImAVA, пф. ед. | 2.7 ± 1.2 | 3.1 ± 1.2 | 3.6 ± 1.1 | 3.9 ± 1.2 | 4.3 ± 1.7 | 3.5 ± 1.9 |
| А(э), пф. ед. | 0.4 ± 0.1 | 0.3 ± 0.1 | 0.3 ± 0.1 | 0.3 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 |
| А(н), пф. ед. | 0.4 ± 0.2 | 0.3 ± 0.1 | 0.3 ± 0.1 | 0.3 ± 0.1 | 0.2 ± 0.1 | 0.2 ± 0.1 |
| А(м), пф. ед. | 0.6 ± 0.3* | 0.2 ± 0.1 | 0.3 ± 0.2 | 0.3 ± 0.2 | 0.2 ± 0.1 | 0.2 ± 0.1 |
| А(д), пф. ед. | 0.4 ± 0.2 | 0.2 ± 0.03 | 0.3 ± 0.04 | 0.2 ± 0.07 | 0.3 ± 0.3 | 0.1 ± 0.06 |
| А(с), пф. ед. | 0.8 ± 0.1* | 0.4 ± 0.1 | 0.7 ± 0.2 | 0.6 ± 0.1 | 0.5 ± 0.2 | 0.3 ± 0.1 |
| Результаты исследования методом ВКС | ||||||
| Плотность капилляров | 59 ± 4 | 48 ± 10 | 58 ± 3* | 42 ± 5 | 52 ± 3* | 42 ± 5 |
Анализируя данные, полученные методами ЛДФ и ВКС (табл. 2), в области псориатического поражения и невовлеченной кожи предплечья, можно отметить, что на первом этапе исследования наблюдалась типичная, описываемая рядом исследователей [8–10, 23–27], картина микроциркуляторных нарушений при псориазе. По данным ВКС отмечалось увеличение плотности капиллярной сети, при этом капилляры в псориатической бляшке по сравнению с интактной тканью были расширены, извиты и удлинены. В зарегистрированном ЛДФ-сигнале наблюдалось статистически значимое повышение показателя микроциркуляции, нутритивного кровотока и амплитуд осцилляций, связанных с сердечными сокращениями. Также о возрастании притока крови в артериальное звено микроциркуляторного русла псориатических бляшек и о включении компенсаторных механизмов можно было судить по высоким показателям амплитуды миогенных осцилляций в псориатическом поражении, указывающих на усиление вазомоций, связанных с внутренней активностью гладкомышечных клеток. Это объясняется тем, что гемодинамика в микроциркуляторном русле, и особенно в ее капиллярном звене, определяется не только внутренними силами кровообращения, но и метаболическими потребностями окружающих капилляры тканей. Рост уровня метаболизма в очаге псориатического воспаления вследствие активного ангиогенеза вызывает усиленный приток крови в капиллярное русло.
Постепенно на фоне проведения консервативной терапии отмечалась нормализация исследуемых гемодинамических параметров (рис. 3–5). На завершающем этапе наблюдалось статистически значимое снижение среднего числа визуализируемых поверхностных капиллярных петель в псориатическом поражении. Аналогичная картина наблюдалась и в интактной ткани, однако статистически значимых различий здесь выявлено не было. Также отмечалось уменьшение показателей микроциркуляции крови, нутритивного кровотока и увеличение значения показателя шунтирования в псориатической бляшке, что указывает на перераспределение кровотока в сторону шунтовой составляющей и уменьшение капиллярной перфузии, и может косвенно свидетельствовать о снижении воспалительного процесса вследствие правильно подобранного курса лечения. Также на завершающем этапе исследования в псориатическом поражении отмечалось статистически значимое снижение амплитуд эндотелиальных, миогенных и сердечных осцилляций. Доминирование эндотелиальных ритмов наряду с миогенными и сердечными является признаком микроциркуляторных нарушений при псориазе [25], поэтому по статистически значимому снижению комплекса указанных осцилляций в динамике лечения псориаза можно также судить о положительном эффекте применявшейся медикаментозной и инструментальной терапии. В интактной ткани наблюдалась тенденция к снижению перфузии крови и амплитуд всех осцилляций кровотока к третьему этапу исследования, однако статистически это не было подтверждено.
Следует отметить, что особенность динамики показателя микроциркуляции, которая была обнаружена на втором этапе исследования, требует более детального изучения в дальнейших исследованиях. На 6-й день лечения наблюдалась тенденция к увеличению показателя микроциркуляции крови в интактной ткани, по сравнению с показателями до начала лечения, что, скорее всего, было связано преимущественно с влиянием сердечных осцилляций. Это может быть обусловлено реакцией организма пациентов на проводимое местное лечение, а также метаболическими процессами, протекающими в окружающих капилляры тканях, что требует более глубокого изучения с применением функциональных проб.
У всех участников исследования в процессе лечения в большей или меньшей степени наблюдалась положительная динамика основных микрогемодинамических параметров крови, что также согласовывалось с улучшением состояния кожных покровов и других клинических проявлений данного заболевания (таких как, например, зуд и шелушение).
Использование методов ЛСКВ, ЛДФ и ВКС по отдельности или совместно может иметь важное клиническое применение в области диагностики микроциркуляторных нарушений у пациентов с псориазом. Метод ЛСКВ имеет достаточно большие перспективы применения в дерматологии. Так, в общую статистику не вошел пример пациентки, у которой на втором этапе исследования при отсутствии видимых ухудшений были выявлены области усиленного кровообращения, в которых измеренная методом ЛДФ перфузия тоже показала тенденцию к росту. На основе этой информации врач-дерматолог скорректировал лечение, однако по субъективным причинам пациент не продолжил обследование оптическими методами диагностики. При анализе полученных данных выявили, что часть зарегистрированных снимков ЛСКВ (в том числе снимок руки представленного пациента во второй день исследования) имели неравномерную засветку изображения, поэтому для внедрения в клиническую практику методология исследования требует дальнейшей доработки. Анализ совокупности данных сигналов ЛДФ и изображений ВКС в ходе проведенных исследований позволил выявить микроциркуляторные нарушения как у пациентов с большим стажем заболевания, так и у пациентов с длительностью заболевания 1.5 года. Кроме этого, было подтверждено, что предложенный комплексный подход к диагностике микроциркуляторных нарушений позволяет оценивать эффективность проводимой медикаментозной и инструментальной терапии пациентов с псориазом, о чем также свидетельствуют результаты проведенных исследований.
ЗАКЛЮЧЕНИЕ
Изменения микроциркуляции при псориазе являются одним из ведущих факторов в патогенезе этого заболевания. Проведенные ранее исследования позволяют предположить, что сосудистые изменения в коже возникают задолго до клинических проявлений заболевания. Псориаз является системным заболеванием, сочетающимся с характерными изменениями в пораженных участках кожи, при этом, вероятнее всего, начало кожных повреждений возникает из дермы и кровеносных сосудов, а затем вторично провоцирует гиперпролиферацию эпидермиса. Направленная на улучшение общего состояния микроциркуляции и уменьшение воспаления терапия способствует нормализации состояния микроциркуляторно-тканевых систем, что подтверждается положительной динамикой в общем состоянии больного и гемодинамических параметров в псориатических высыпаниях.
Данные проведенного исследования свидетельствуют о высокой диагностической возможности предложенного комплексного подхода обнаружения микроциркуляторных нарушений у больных псориазом. Методы ЛСКВ, ЛДФ и ВКС дают возможность проанализировать пространственное распределение перфузии, выявить области с нарушением микроциркуляции и изучить механизмы, лежащие в основе этих нарушений с помощью исследования регуляции кровотока в микрососудах, оценки нутритивного кровотока и особенностей распределения капилляров в бляшке и интактной области на различных стадиях лечения заболевания.
У пациентов с псориазом перед проведением консервативной терапии в псориатических бляшках выявлено увеличение плотности капиллярной сети и перфузии в псориатической бляшке в сравнении с интактной тканью, при этом в этих областях отмечалось доминирование миогенных и сердечных колебаний и увеличение нутритивного кровотока. Описанные изменения в микроциркуляторной гемодинамике псориатических бляшек обусловлены активными воспалительными процессами в них. Под влиянием лечения отмечена нормализация микроциркуляции в очагах поражения кожи и статистически значимое снижение указанных гемодинамических параметров, измеренных в бляшке.
Введение в клиническую практику врача-дерматолога данного подхода может позволить не только оценить эффективность применяемого консервативного лечения, но также своевременно корректировать медикаментозную и инструментальную терапию, выявлять заболевания на ранних стадиях (еще до клинического проявления первых признаков), предотвращать возникновение осложнений (в том числе псориатического артрита), что существенно повысит эффективность применяемого лечения, снизит экономические и временны́е затраты пациента на лечение, как следствие, повысит качество его жизни.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Орловского государственного университета им. И.С. Тургенева (протокол № 10 от 16.11.2018 г.) (Орел).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при поддержке РФФИ в рамках научного проекта № 19-32-50 007.
Благодарности. В.В. Дремин выражает благодарность Программе Европейского Союза по развитию научных исследований и технологий “Горизонт 2020” в рамках грантового соглашения № 839 888.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Eberle F.C., Brück J., Holstein J. et al. Recent advances in understanding psoriasis // F1000 Research. 2016. V. 5. P. 770.
Micali G., Lacarrubba F., Musumeci M.L. et al. Cutaneous vascular patterns in psoriasis // Int. J. Dermatol. 2010. V. 49. № 3. P. 249.
Heidenreich R., Röcken M., Ghoreschi K. Angiogenesis drives psoriasis pathogenesis // Int. J. Exp. Pathol. 2009. V. 90. № 3. P. 232.
Zgraggen S., Ochsenbein A.M., Detmar M. An important role of blood and lymphatic vessels in inflammation and allergy // J. Allergy. 2013. V. 2013. P. 672381.
De Angelis R., Bugatti L., Del Medico P. et al. Videocapillaroscopic findings in the microcirculation of the psoriatic plaque // Dermatology. 2002. V. 204. № 3. P. 236.
Braverman I.M., Sibley J. Role of the microcirculation in the treatment and pathogenesis of psoriasis // J. Invest. Dermatol. 1982. V. 78. № 1. P. 12.
Golińska J., Sar-Pomian M., Rudnicka L. Dermoscopic features of psoriasis of the skin, scalp and nails–a systematic review // J. Eur. Acad. Dermatology Venereol. 2019. V. 33. № 4. P. 648.
Hern S., Stanton A.W.B., Mellor R.H. et al. Blood flow in psoriatic plaques before and after selective treatment of the superficial capillaries // Br. J. Dermatol. 2005. V. 152. № 1. P. 60.
Потапова Е.В., Филина М.А., Козлов И.О. и др. Особенности локальной микроциркуляции крови у пациентов с псориазом // Регионарное кровообращение и микроциркуляция. 2018. Т. 17. № 3. С. 58.
Hern S., Mortimer P.S. In vivo quantification of microvessels in clinically uninvolved psoriatic skin and in normal skin // Br. J. Dermatol. 2007. V. 156. № 6. P. 1224.
Zherebtsova A.I., Dremin V.V., Makovik I.N. et al. Multimodal optical diagnostics of the microhaemodynamics in upper and lower limbs // Front. Physiol. 2019. V. 10. P. 416.
Yun S.H., Kwok S.J.J. Light in diagnosis, therapy and surgery // Nat. Biomed. Eng. 2017. V. 1. № 1. P. 0008.
Tuchin V.V. Handbook of optical biomedical diagnostics. V. 2: Methods. USA: SPIE, 2016. 688 p.
Tkaczyk E. Innovations and developments in dermatologic non-invasive optical imaging and potential clinical applications // Acta Derm. Venereol. 2017. Suppl 218. P. 5.
Grajdeanu I.-A., Statescu L., Vata D. et al. Imaging techniques in the diagnosis and monitoring of psoriasis // Exp. Ther. Med. 2019. V. 18. № 6. P. 4974.
Lacarrubba F., Pellacani G., Gurgone S. et al. Advances in non-invasive techniques as aids to the diagnosis and monitoring of therapeutic response in plaque psoriasis: a review // Int. J. Dermatol. 2015. V. 54. № 6. P. 626.
Briers J.D. Laser Doppler, speckle and related techniques for blood perfusion mapping and imaging // Physiol. Meas. 2001. V. 22. № 4. P. R35.
Boas D.A., Dunn A.K. Laser speckle contrast imaging in biomedical optics // J. Biomed. Opt. 2010. V. 15. № 1. P. 011109.
Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем: колебания, информация, нелинейность: руководство для врачей. М.: Книжный дом “ЛИБРОКОМ”, 2013. 496 с.
Dremin V.V., Kozlov I.O., Volkov M.V. et al. Dynamic evaluation of blood flow microcirculation by combined use of the laser Doppler flowmetry and high-speed videocapillaroscopy methods // J. Biophotonics. 2019. V. 12. № 6. P. e201800317.
Потапова Е.В., Серегина Е.С., Дремин В.В. и др. Лазерная спекл-контрастная визуализация микроциркуляции крови в тканях поджелудочной железы при лапароскопических вмешательствах // Квант. электроника. 2020. Т. 50. № 1. С. 33. Potapova E.V., Seryogina E.S., Dremin V.V. et al. Laser speckle contrast imaging of blood microcirculation in pancreatic tissues during laparoscopic interventions // Quantum Electron. 2020. V. 50. № 1. P. 33.
Dunaev A.V., Sidorov V.V., Krupatkin A.I. et al. Investigating tissue respiration and skin microhaemocirculation under adaptive changes and the synchronization of blood flow and oxygen saturation rhythms // Physiol. Meas. 2014. V. 35. № 4. P. 607.
Rosina P., Zamperetti M.R., Giovannini A., Girolomoni G. Videocapillaroscopy in the differential diagnosis between psoriasis and seborrheic dermatitis of the scalp // Dermatology. 2007. V. 214. № 1. P. 21.
Rosina P., Giovannini A., Gisondi P., Girolomoni G. Microcirculatory modifications of psoriatic lesions during topical therapy // Ski. Res. Technol. 2009. V. 15. № 2. P. 135.
Адырхаева Д.А., Натарова Э.В., Рюмкина Н.А. Особенности показателей лазерной допплеровской флоуметрии при псориазе // Вестник новых медицинских технологий. 2007. Т. ХIV. № 1. С. 120.
Hendriks A.G.M., Steenbergen W., Hondebrink E. et al. Whole field laser Doppler imaging of the microcirculation in psoriasis and clinically unaffected skin // J. Dermatolog. Treat. 2014. V. 25. № 1. P. 18.
Dremin V.V., Filina M.A., Zharkikh E.V. et al. Peculiarities of local blood microcirculation in patients with psoriasis / Proc. SPIE 10685, Biophotonics: Photonic Solutions for Better Health Care VI (17 May 2018). 2018. V. 10 685. P. 1068 532.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


