Физиология человека, 2021, T. 47, № 6, стр. 65-71
Влияние эндоморфинов-1,2 на функциональную активность нейтрофилов и моноцитов периферической крови in vitro
С. В. Гейн 1, 2, *, Я. А. Кадочникова 1
1 ФГБУН Институт экологии и генетики микроорганизмов –
филиал ФГБУН Пермского федерального исследовательского центра УрО РАН
Пермь, Россия
2 Пермский государственный национальный исследовательский университет
Пермь, Россия
* E-mail: gein@iegm.ru
Поступила в редакцию 14.10.2020
После доработки 11.11.2020
Принята к публикации 16.11.2020
Аннотация
Эндоморфины являются эндогенными высокоаффинными селективными агонистами μ-рецептора, который экспрессируется на клетках иммунной системы, за счет чего эндоморфины могут обладать иммуномодулирующим действием. Цель работы – оценка влияния эндоморфина-1 и эндоморфина-2 на функциональную активность моноцитов и нейтрофилов периферической крови in vitro. Установлено, что эндоморфин-1 снижал спонтанную продукцию активных форм кислорода лейкоцитами и интенсивность респираторного взрыва в культурах стимулированных нейтрофилов. Эндоморфин-2 угнетал спонтанную выработку кислородных радикалов фракцией лейкоцитов периферической крови, стимулировал спонтанную выработку активных форм кислорода фракцией нейтрофилов, но угнетал их индуцированную продукцию. Эндоморфин-1 повышал процент фагоцитоза моноцитов, усиливал спонтанную продукцию IL-1β и угнетал стимулированную продукцию IL-10 мононуклеарами. Эндоморфин-2 также усиливал спонтанную продукцию IL-1β и снижал стимулированную выработку IL-10 мононуклеарами, стимулировал поглотительную активность как нейтрофилов, так и моноцитов. Таким образом, эндоморфины являются важными модуляторами функциональной активности эффекторных клеток врожденного иммунитета.
Эндогенная опиоидная система представляет собой совокупность опиоидных рецепторов (γ, δ, κ), широко экспрессированных не только в ЦНС, но и в различных органах, тканях, и их лигандов. Опиоидные рецепторы могут быть активированы алкалоидами растительного происхождения, такими как морфин и его полусинтетическими и синтетическими аналогами, или с помощью эндогенных лигандов этих рецепторов – опиоидных пептидов. Иммуномодулирующее действие трех основных семейств опиоидных пептидов (эндорфины, энкефалины, динорфины), которым свойственна общая N-концевая последовательность Tyr–Gly–Gly–Phe, изучено достаточно хорошо, а вот информации об эффектах эндоморфинов, не обладающих общей N-концевой последовательностью, в литературе гораздо меньше [1, 2]. К тому же, эндогенный предшественник, из которого образуются эндоморфины, до сих пор не идентифицирован [3, 4].
Эндоморфины являются эндогенными высокоаффинными селективными агонистами μ-рецептора, который экспрессируется на клетках иммунной системы [5]. В литературе представлен ряд данных о способности эндоморфинов модулировать функции клеток врожденного и адаптивного иммунитета, в частности, изменять пролиферативную активность и апоптоз лимфоцитов [6], секреторную и поглотительную активность моноцитов [7, 8] и нейтрофилов [9, 10], однако приведенные данные довольно противоречивы, получены на различных экспериментальных моделях и с использованием различных концентраций и доз. В настоящей работе важно оценить иммуномодулирующие эффекты эндоморфинов в отношении ряда параметров, характеризующих функциональную активность эффекторных клеток врожденного иммунитета, с учетом возможного влияния процессов межклеточной кооперации in vitro.
Цель работы – оценка влияния опиоидных пептидов эндогенного происхождения эндоморфина-1 и эндоморфина-2 на поглотительную активность, продукцию кислородных радикалов, а также синтез про- и противовоспалительных цитокинов IL-1β и IL-10 моноцитами и нейтрофилами периферической крови in vitro.
МЕТОДИКА
Объектом исследования были лейкоциты периферической венозной крови здоровых доноров-добровольцев в возрасте от 22 до 40 лет. В пробирки, содержащие гепарин, добавляли венозную кровь, которую затем помещали в термостат и выдерживали в течение 2 ч при 37°С для получения плазмы. Для получения лейкоцитарной фракции плазму центрифугировали 20 мин при 1500 об./мин. Полученный осадок ресуспендировали в 1 мл раствора Хенкса. Фракцию нейтрофилов выделяли центрифугированием в течение 40 мин при 1500 об./мин на одноступенчатом градиенте плотности фиколл-урографин (ρ = 1.077), далее осевшие на дно гранулоциты 2 раза по 10 мин отмывали средой RPMI 1640. Клеточную суспензию выдерживали в течение часа при 4°С в полной питательной среде для снятия активации. Эндоморфины использовали в концентрациях 10–6, 10–8, 10–10, 10–12 М (Sigma). Продукцию кислородных радикалов лейкоцитами и нейтрофилами осуществляли с помощью реакции люминолзависимой хемилюминесценции. Реакцию проводили в плоскодонных 96-луночных планшетах (“Greiner”, Германия), в каждой из которых содержалось 105 клеток в 100 мкл раствора Хенкса, в качестве индуктора добавляли опсонизированный зимозан (ОЗ) 150 мкг/мл, в качестве маркера выраженности реакции использовали люминол 10–5 М. Регистрацию активных форм кислорода проводили с помощью многофункционального спектрофотометра TECAN (Австрия).
Выделение мононуклеарных клеток проводили в пробирках с помощью наслоения гепаринизированной венозной крови на градиент плотности фиколл-урографин (ρ = 1.077), которые затем центрифугировали 40 мин при 1500 об./мин. Получившееся мононуклеарное кольцо собирали в пробирку и отмывали 2 раза средой RPMI 1640 на центрифуге по 10 мин 1500 об./мин, после чего выдерживали при 4°C 1 ч для снятия активации. Для получения моноцитов охлажденную суспензию мононуклеаров помещали на чашку Петри в полную питательную среду и выдерживали в термостате в течение 1 ч при 37°С. По истечении времени резиновым шпателем снимали адгезировавшиеся клетки, которые суспендировали в 1 мл среды RPMI 1640 с добавлением 10 мМ HEPES (Sigma), 2 мМ L-глутамина (Sigma), 100 мкг/мл гентамицина и 10% эмбриональной телячьей сыворотки (“Биолот”, Россия). В качестве индуктора продукции цитокинов использовали ОЗ 150 мкг/мл. Концентрацию IL-1β и IL-10 в супернатантах 24 ч культур определяли методом твердофазного иммуноферментного анализа с применением тест-систем “ВЕКТОР-БЕСТ” (Россия) по стандартной методике, предложенной производителем.
Для оценки влияния эндоморфинов на фагоцитарную активность моноцитов и нейтрофилов периферической крови использовали метод проточной цитометрии. Цельную гепаринизированную кровь инкубировали с эндоморфинами в течение 1 ч при температуре 37°С, затем к пробам добавляли объекты фагоцитоза FITC-меченые St. aureus (предварительно разведенные раствором Хэнкса 1 : 10) и инкубировали в термостате 30 мин при 37°С. Далее к клеткам добавляли лизирующий раствор (0.15 М NH4Cl; 0.01 М NaHCO3; 0.0001 М ЭДТА, pH 7.2) и 5 мин центрифугировали при 250 g при температуре 4°C. Образовавшийся супернатант убирали, добавляли PBS-0.02% ЭД-ТА и центрифугировали 5 мин при 250 g при 4°C. После центрифугирования снимали супернатант, добавляли к клеткам PBS-0.02% ЭДТА и проводили анализ на проточно-лазерном цитометре BD FACSCalibur (Beckman Coulter, США).
Статистическую обработку данных проводили с применением однофакторного дисперсионного анализа для парных данных и LSD-критерия для post-hoc сравнения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка влияния эндоморфинов на продукцию активных форм кислорода (АФК) фракцией лейкоцитов периферической крови показала, что внесение эндоморфина-1 в концентрациях 10–8, 10–10, 10–12 М снижало спонтанную выработку АФК лейкоцитами (F = 6,6; р = 0.001). Эндоморфин-2 во всех исследуемых концентрациях также угнетал спонтанную продукцию кислородных радикалов (F = 5,8; р = 0.001). На индуцированную зимозаном продукцию активных форм кислорода оба эндоморфина статистически значимых изменений не оказали (рис. 1).
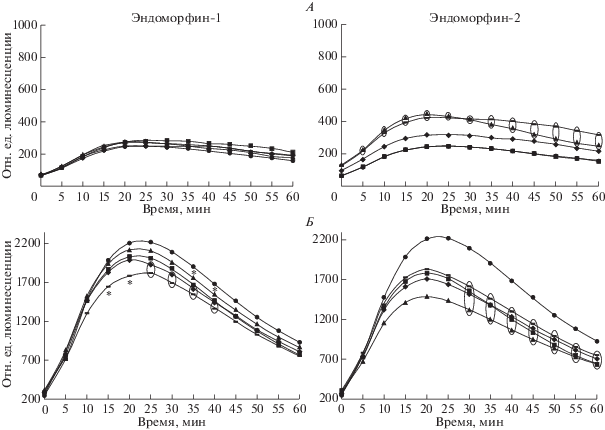
При оценке влияния эндогенных опиоидных пептидов на продукцию кислородных радикалов фракцией нейтрофилов периферической крови было установлено, что эндоморфин-1 не влиял на спонтанную продукцию АФК фракцией нейтрофилов, а эндоморфин-2, в концентрациях 10–8, 10–10 М, существенно повышал их выработку по сравнению с контролем (F = 5,6; р = 0.002). Также было установлено, что в индуцированных зимозаном пробах эндоморфин-1 (F = 3; р = 0.03) в концентрациях 10–8, 10–10, 10–12 М и эндоморфин-2 во всем диапазоне концентраций показали выраженный угнетающий эффект на бактерицидный потенциал нейтрофилов (рис. 2).
Рис. 1.
Влияние эндоморфина-1 и эндоморфина-2 на спонтанную (A) и стимулированную (Б) продукцию активных форм кислорода фракцией лейкоцитов периферической крови. ⚫ – контроль; ◼ – 10–6 М; ▲ – 10–8 М; ▬ – 10–10 М; ◆ – 10–12 М. * и 0 – обозначены значения кривых, где p < 0.05 по сравнению с контролем (n = 9).
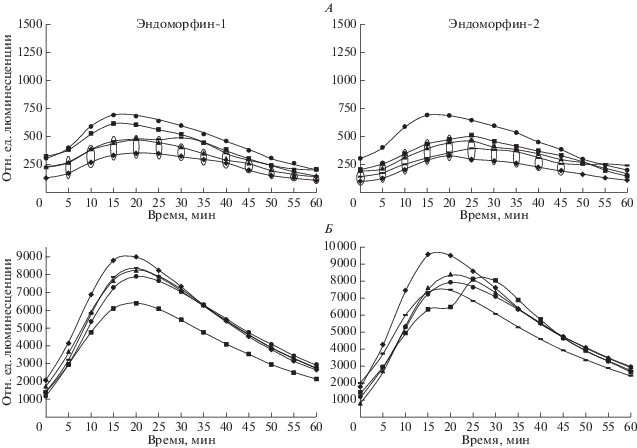
Рис. 2.
Влияние эндоморфина-1 и эндоморфина-2 на спонтанную (A) и стимулированную (Б) продукцию активных форм кислорода фракцией нейтрофилов периферической крови. Обозначения см. рис. 1.
При оценке влияния пептидов на поглотительную активность нейтрофилов и моноцитов периферической крови было установлено, что эндоморфин-1 не оказывал влияния на изменение процента фагоцитоза нейтрофилов, но повышал поглотительную активность фракции моноцитов (F = 3,16; р = 0.024) в концентрациях 10–6, 10–8 М. Оценка влияния эндоморфина-2 на поглотительную активность нейтрофилов показала, что пептид повышал процент фагоцитоза (F = = 3,87; р = 0.008) в концентрациях 10–6, 10–10 М. Такой же эффект (F = 4,6; р = 0.004) был отмечен и при внесении всех исследуемых концентраций эндоморфина-2 к моноцитам (табл. 1).
Таблица 1.
Влияние эндоморфина-1 и эндоморфина-2 на поглотительную активность нейтрофилов и моноцитов периферической крови
| Концентрация пептида | Процент фагоцитоза, % | |
|---|---|---|
| нейтрофилы | моноциты | |
| Контроль | 54.69 ± 5.47 | 47.40 ± 4.06 |
| Эндоморфин-1 | ||
| 10–6 М | 58.89 ± 5.52 | 52.99 ± 3.57* |
| 10–8 М | 55.20 ± 5.48 | 51.28 ± 3.68* |
| 10–10 М | 54.38 ± 5.43 | 49.58 ± 4.07 |
| 10–12 М | 54.76 ± 4.72 | 47.97 ± 3.21 |
| Эндоморфин-2 | ||
| 10–6 М | 60.87 ± 5.96* | 54.45 ± 3.54* |
| 10–8 М | 57.08 ± 5.52 | 51.00 ± 3.2* |
| 10–10 М | 60.39 ± 5.49* | 52.21 ± 3.56* |
| 10–12 М | 56.46 ± 5.45 | 50.93 ± 3.4 |
Оценка влияния эндоморфинов на уровень цитокинов показала, что эндоморфин-1 10–6, 10–12 М увеличивал концентрацию IL-1β в культурах мононуклеаров и не оказывал влияния на уровень IL-1β в культурах моноцитов. На уровень IL-10 в культурах моноцитов эндоморфин-1 не влиял, но в концентрации 10–12 М угнетал стимулированную секрецию цитокина мононуклеарами (табл. 2). Внесение в культуры эндоморфина-2 в концентрации 10–12 М приводило к увеличению уровня IL-1β в спонтанных культурах и снижению уровня IL-10 в стимулированных культурах мононуклеаров в концентрациях 10–6, 10–12 М (табл. 3). На уровень IL-10 и IL-1β в стимулированных и спонтанных культурах очищенных моноцитов эндоморфины не влияли.
Таблица 2.
Влияние эндоморфина-1 на уровень IL-1β и IL-10 в спонтанных и стимулированных зимозаном культурах мононуклеаров и моноцитов периферической крови
| Концентрация | Концентрация цитокина, пг/мл | |||
|---|---|---|---|---|
| мононуклеары | моноциты | |||
| без индуктора | ОЗ 150 мкг/мл | без индуктора | ОЗ 150 мкг/мл | |
| IL-1β (n = 8) | ||||
| Контроль | 182.48 ± 37.64 | 307.97 ± 11.87 | 123.12 ± 21.45 | 267.45 ± 38.14 |
| 10–6 М | 256.62 ± 36.88* | 316.66 ± 11.85 | 158.69 ± 27.69 | 266.78 ± 33.77 |
| 10–12 М | 215.39 ± 42.2* | 304.15 ± 3.15 | 148.72 ± 26.18 | 275.98 ± 37.48 |
| IL-10 (n = 6) | ||||
| Контроль | 27.47 ± 10.99 | 40.22 ± 3.99 | 6.62 ± 1.65 | 59.79 ± 19.2 |
| 10–6 М | 25.01 ± 8.09 | 32.30 ± 2.75 | 8.0 ± 2.52 | 69.97 ± 24.29 |
| 10–12 М | 23.44 ± 7.36 | 27.08 ± 2.25* | 8.37 ± 2.18 | 51.87 ± 17.7 |
Таблица 3.
Влияние эндоморфина-2 на уровень IL-1β и IL-10 в спонтанных и стимулированных зимозаном культурах мононуклеаров и моноцитов периферической крови
| Концентрация | Концентрация цитокина, пг/мл | |||
|---|---|---|---|---|
| мононуклеары | моноциты | |||
| без индуктора | ОЗ 150 мкг/мл | без индуктора | ОЗ 150 мкг/мл | |
| IL-1β (n = 8) | ||||
| Контроль | 182.48 ± 37.64 | 307.97 ± 11.87 | 123.12 ± 21.45 | 267.45 ± 38.14 |
| 10–6 М | 220.54 ± 20.91 | 316.18 ± 3.24 | 150.19 ± 30.91 | 286.34 ± 40.19 |
| 10–12 М | 228.99 ± 44.97* | 336.67 ± 9.99 | 153.95 ± 28.34 | 262.49 ± 32.69 |
| IL-10 (n = 6) | ||||
| Контроль | 27.47 ± 10.99 | 40.22 ± 3.99 | 6.62 ± 1.65 | 59.79 ± 19.2 |
| 10–6 М | 25.01 ± 7.62 | 27.92 ± 2.44* | 7.74 ± 2.04 | 53.55 ± 20.61 |
| 10–12 М | 23.31 ± 8.61 | 20.10 ± 3.15* | 7.1 ± 2.106 | 57.44 ± 22.22 |
Примечание: обозначения см. табл. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, на основе полученных результатов можно сказать, что эндоморфины модулируют функции клеток врожденного иммунитета, оказывая эффекты как угнетающей, так и стимулирующей направленности, чем отличаются от своего низкомолекулярного аналога морфина, оказывающего выраженное угнетающее воздействие практически на все параметры иммунной системы [11]. В этом плане эффекты эндоморфинов значительно ближе к эффектам другого эндогенного лиганда μ-рецепторов пептидной природы β-эндорфина, который in vitro и in vivo также оказывает разнонаправленное действие на широкий спектр иммунных реакции. Ранее нами было показано in vitro наличие аналогичного влияния у β-эндорфина, который угнетал продукцию АФК и стимулировал секрецию IL-1β [12, 13], в то же время in vivo β-эндорфин стимулировал зимозан-индуцированную секрецию активных форм кислорода и угнетал спонтанную продукцию IL-1β и IL-10 перитонеальными макрофагами мыши [14].
Иммунорегуляторные эффекты β-эндорфина и эндоморфинов можно считать защитными для организма, ведь, как известно, кислородные радикалы оказывают как положительное, так и отрицательное воздействие, с одной стороны усиливая микробицидный потенциал клеток врожденного иммунитета, но с другой – их интенсивная продукция может повреждать липидные мембраны клеток и угнетать иммунный ответ [15].
Помимо этого, направленность воздействия эндоморфинов, как и других регуляторных пептидов, зависит от концентрации, состава клеточной фракции и от наличия дополнительного активационного сигнала. Необходимо отметить, что продукцию АФК эндоморфины модулировали как в смешанной клеточной взвеси, так и во фракции нейтрофилов, а модуляция продукции цитокинов имела место только во фракции мононуклеаров и отсутствовала во фракции очищенных моноцитов, что может свидетельствовать о необходимости межклеточного взаимодействия для опиоидопосредованной регуляции цитокиновой продукции. Ранее было установлено, что β-эндорфин in vitro модулировал продукцию IL-1β мононуклеарами, но не очищенными моноцитами [13, 16]. Сравнительный анализ действия двух пептидов в общем показал их однонаправленное влияние на исследуемые параметры, однако, следует отметь, что у эндоморфина-2 спектр оказываемых эффектов был несколько шире и выражен сильнее.
Подводя итог, можно сказать, что в системе in vitro эффекты эндоморфинов по своему характеру сопоставимы с иммуномодулирующими эффектами других опиоидных пептидов, в частности эндорфинов и энкефалинов, и имеют мало общего с эффектами морфина, что, в свою очередь, доказывает имеющиеся существенные различия в механизме иммуномодулирующего действия между опиоидными агонистами пептидной и непептидной природы.
ВЫВОДЫ
1. Установлено, что эндоморфин-1 угнетал продукцию АФК фракцией лейкоцитов и нейтрофилов, стимулировал фагоцитоз моноцитов, увеличивал уровень IL-1β в спонтанных культурах и снижал концентрацию IL-10 в культурах стимулированных мононуклеаров.
2. Установлено, что эндоморфин-2 увеличивал спонтанную выработку АФК нейтрофилами, но угнетал их стимулированную продукцию, также он снижал продукцию кислородных радикалов фракцией лейкоцитов, увеличивал уровень IL-1β в спонтанных культурах и снижал концентрацию IL-10 в культурах стимулированных мононуклеаров, помимо этого пептид повышал поглотительную активность как моноцитов, так и нейтрофилов.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института экологии и генетики микроорганизмов – филиал ФГБУН Пермского федерального исследовательского центра УрО РАН (Пермь), IRB00010009.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследования проведены в рамках государственного задания, номер государственной регистрации темы № АААА-А19-119112290007-7.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Janecka A., Staniszewska R., Fichna J. Endomorphin analogs // Curr. Med. Chem. V. 14. № 30. P. 3201.
Pomorska D.K., Gach K., Janecka A. Immunomodulatory effects of endogenous and synthetic peptides activating opioid receptors // Mini-Rev. Med. Chem. 2014. V. 14. № 14. P. 1148.
Bodnar R.J. Endogenous opiates and behavior // Peptides. 2010. V. 31. P. 2325.
Fichna J., Janecka A., Costentin J., Do Rego J.C. The endomorphin system and its evolving neurophysiological role // Pharmacol. Rev. 2007. V. 59. № 1. P. 88.
Sedqi M., Roy S., Ramakrishnan S. et al. Complementary DNA cloning of a mu-opioid receptor from rat peritoneal macrophages // Biochem. Biophys. Res. Commun. 1995. V. 209. № 2. P. 563.
Lin X., Chen Q., Xue L.Y. et al. Endomorphins, endogenous opioid peptides, induce apoptosis in human leukemia HL-60 cells // Can. J. Physiol. Pharmacol. 2004. V. 82. № 11. P. 1018.
Azuma Y., Ohura K. Endomorphins 1 and 2 inhibit IL-10 and IL-12 production and innate immune functions, and potentiate NF-jB DNA binding in THP-1 differentiated to macrophage-like cells // Scand. J. Immunol. 2002. V. 56. № 3. P. 260.
Li W.Y., Yang J.J., Zhu S.H. et al. Endomorphins and ohmefentanyl in the inhibition of immunosuppressant function in rat peritoneal macrophages: An experimental in vitro study // Curr. Ther. Res. 2008. V. 69. № 1. P. 56.
Azuma Y., Ohura K., Wang P.L., Shinohara M. Endomorphins delay constitutive apoptosis and alter the innate host defense functions of neutrophils // Immunol. Lett. 2002. V. 81. № 1. P. 31.
Tseng L.F., Narita M., Suganuma C. et al. Differential antinociceptive effects of endomorphin-1 and endomorphin-2 in the mouse // J. Pharmacol. Exp. Ther. 2000. V. 292. № 2. P. 576.
Plein L.M., Rittner H.L. Opioids and the immune system – friend or foe // Br. J. Pharmacol. 2018. V. 175. № 14. P. 2717.
Гейн С.В., Гилева С.Г., Чижова Е.Г. Влияние β-эндорфина на микробицидную активность лейкоцитов у мужчин и женщин различных возрастных групп // Российский иммунологический журн. 2015. Т. 9(18). № 2(1). С. 772.
Гейн С.В., Горшкова К.Г., Тендрякова С.П. Роль β-эндорфина в регуляции продукции провоспалительных цитокинов моноцитами периферической крови in vitro // Бюллетень экспериментальной биологии и медицины. 2007. Т. 143. № 2. С. 175.
Гейн С.В., Баева Т.А., Небогатиков В.О. Влияние β-эндорфина на продукцию in vivo активных форм кислорода IL-1β, TNF-α и IL-10 перитонеальными макрофагами мышей // Доклады академии наук. 2016. Т. 469. № 6. С. 749.
Riquelme P., Tomiuk S., Kammler A. et al. IFN-γ-induced iNOS Expression in Mouse Regulatory Macrophages Prolongs Allograft Survival in Fully Immunocompetent Recipients // Mol. Ther. 2013. V. 21. № 2. P. 409.
Гейн С.В., Баева Т.А., Гейн О.Н., Черешнев В.А. Роль моноцитов в реализации эффектов β-эндорфина и селективных агонистов μ- и δ-опиатных рецепторов на пролиферативную активность лимфоцитов периферической крови // Физиология человека. 2006. Т. 32. № 3. С. 111. Gein S.V., Baeva T.A., Gein O.N., Chereshnev V.A. The role of monocytes in the effects of β-endorphin and selective agonists of μ- and δ-opiate receptors on the proliferative activity of peripheral blood lymphocytes // Human Physiology. 2006. V. 32. № 3. P. 346.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


