Физиология человека, 2022, T. 48, № 4, стр. 112-119
Влияние мирабегрона, адреналина и аскорбиновой кислоты на интенсивность железо-индуцированной биохемилюминесценции эритроцитов цельной крови мужчин
Н. С. Завалин 1, 2, *, В. И. Циркин 1, 3, **, М. А. Морозова 1, А. Н. Трухин 1, С. И. Трухина 1
1 ФГБОУ ВО Вятский государственный университет
Киров, Россия
2 ФГБОУ ВО Кировский государственный медицинский университет
Киров, Россия
3 ФГБОУ ВО Казанский государственный медицинский университет
Казань, Россия
* E-mail: zavalinkolya@gmail.com
** E-mail: esbartsirkin@list.ru
Поступила в редакцию 17.11.2021
После доработки 24.02.2022
Принята к публикации 18.03.2022
- EDN: VYIMAQ
- DOI: 10.31857/S0131164622040142
Аннотация
С учетом перспектив использования селективного агониста β3-АР мирабегрона (Бетмига) для профилактики и лечения ожирения исследовали влияние этого препарата в концентрации 10–6 г/мл раствора Кребса на железо-индуцированную биохемилюминесценцию (БХЛ) эритроцитов цельной венозной крови здоровых мужчин, используя биохемилюминометр БХЛ-07 (Medozons, Россия). Установлено, что мирабегрон в концентрации 10–6 г/мл раствора Кребса статистически значимо снижает интенсивность БХЛ эритроцитов. Подобный эффект оказывает классический антиоксидант аскорбиновая кислота (10–8, 10–6 и 10–5 г/мл), а также адреналин (10–5 г/мл). Это указывает на возможность и целесообразность применения мирабегрона для лечения ожирения, для которого характерна высокая интенсивность перекисного окисления липидов.
По определению всемирной организации здравоохранения (ВОЗ), ожирение – это ненормальное или чрезмерное скопление жира, которое может негативно повлиять на здоровье [1]. У женщин избыточное отложение жира (индекс массы тела, или ИМТ ≥ 30 кг/м2) происходит по гиноидному (глютеофеморальному или “грушевидному”) типу, а у мужчин – по андроидному типу, или “яблоковидному”. Но при этом, независимо от вида и пола, ожирение рассматривается в качестве одного из главных факторов риска развития сердечно-сосудистой патологии (гипертонии, ишемической болезни сердца, инсульта и гиперлипидемии), сахарного диабета 2 типа, метаболического синдрома, которые являются основными причинами заболеваемости и смертности в развитых странах [1, 2].
Ожирение является наиболее часто встречаемым хроническим заболеванием на сегодняшний день [1, 2]. Распространенность ожирения значительно увеличилась за последние несколько десятилетий [3]. Во всем мире частота ожирения в 2010 г. по сравнению с 1980 г. возросла в 2 раза [4].
За последние три десятилетия наблюдается рост избыточной массы тела и ожирения в мире почти на 30–50% среди взрослых и детей [5]. Ожидается, что процент лиц с ожирением удвоится или утроится в следующие 40 лет [6]. В целом, распространенность ожирения растет с огромной скоростью, что, вероятно, связано с негативным влиянием факторов окружающей среды и обилием фастфуда и других источников энергии [7].
При этом лидирующей страной остается Америка, где 34% населения имеют лишний вес, а 27% страдают ожирением [1, 5, 8]. Ожирение является растущей проблемой по всей Европе, где его уровень возрос более чем в 2 раза за последние 20 лет [9]. В Российской Федерации избыточную массу тела имеют почти 60% взрослого населения [5, 10, 11], а ожирение характерно для 24.1% людей [5]. В России в период с 2010 по 2016 гг. число людей, страдающих ожирением, выросло на 57% [11].
Поэтому методы профилактики и лечения ожирения являются важным направлением современной медицины [1–3, 5, 6]. Существуют различные подходы в этом направлении, успешность которых, однако, до настоящего времени не достигает 100%. Среди новых направлений предложено использовать агонисты β3-адренорецепторов (β3-АР), в том числе препарат мирабегрон [1, 12–16].
Как известно, активация β3-АР белых адипоцитов повышает переход белых адипоцитов в бежевые [11, 16], для которых характерно разобщение окислительного фосфорилирования под влиянием митохондриального разобщающего белка UCP1 (uncoupling protein), или термогенина, в результате чего повышается интенсивность β-окисления жирных кислот без аккумуляции энергии в аденозинтрифосфат (АТФ), а тем самым возрастает расход жирных кислот, а также уменьшается продукция активных форм кислорода (АФК) [11–15]. Одновременно активация β3-АР предшественников адипоцитов вызывает их превращение в коричневые адипоциты, в которых также повышена экспрессия разобщающего белка UCP1 и повышено использование жирных кислот для ресинтеза АТФ [11, 13, 16], что обусловлено повышением активности АМФ-зависимой киназы, или аденозинмонофосфат-активируемой про-теинкиназы (АМРК) [13], которая, как известно [17, 18], повышает чувствительность клеток к инсулину, в том числе адипоцитов.
Таким образом, все отмеченные изменения, происходящие при активации β3-АР адипоцитов, препятствуют развитию ожирения и приводят к уменьшению веса человека и животных. В частности, было показано, что таким эффектом обладает ряд селективных агонистов β3-АР, в том числе препарат мирабегрон [1, 16], который первоначально был предложен для лечения гиперактивности мочевого пузыря и в настоящее время разрешен для клинического применения [19]. Его эффективность и безопасность подтверждают результаты клинического рандомизированного двойного слепого исследования 2444 пациентов с гиперактивностью мочевого пузыря [1, 19]. Это было еще одним основанием, наряду с данными, полученными в опытах на грызунах, рекомендовать использовать мирабегрон для лечения избыточного веса и ожирения [1, 16], так как по современным представлениям [1, 11, 13, 16] наиболее перспективным способом лечения ожирения является стимуляция эндогенных механизмов расщепления липидов, обусловленная переключением метаболизма адипоцитов из режима накопления триглицеридов в режим активного липолиза.
В предклинических исследованиях, в частности в опытах на тучных инсулинорезистентных мышах, показано [13], что агонист β3-АР препарат CL-316,243 повышает толерантность к глюкозе, снижает уровень гликозилированного гемоглобина (A1c), повышает чувствительность к инсулину, повышает способность β-клеток продуцировать инсулин, повышает липолиз в белых адипоцитах подкожной WAT-жировой ткани, а в скелетных мышцах он снижает уровень триглицеридов, увеличивает экспрессию белка PGC1α (как ко-активатора рецептора PPAR–γ) и увеличивает количество волокон I типа. Таким образом, препарат CL-316,243 значительно улучшает многие показатели гомеостаза глюкозы у тучных, инсулинорезистентных мышей. Поскольку β-клетки поджелудочной железы и скелетные мышцы не экспрессируют β3-АР, эти данные предполагают, что агонист β3-АР препарат CL-316,243 снижает дисфункцию жировой ткани, что увеличивает окислительную способность мышц и улучшает функцию β-клеток. Аналогичные данные получены при использовании другого агониста β3-АР препарата BRL 35135 [1]. В опытах с изолированной бурой жировой тканью человека было показано, что мирабегрон повышает ее метаболическую активность [12]. На самцах мышей C57BL/6J было показано, что мирабегрон стимулирует термогенез в адипоцитах (за счет экспрессии гена белка UCP1), снижает массу тела за счет уменьшения жировой ткани и нормализует толерантность организма к инсулину [15].
С учетом всех этих данных было предложено приступить к клиническим исследованиям эффективности мирабегрона для борьбы с избыточным весом и с ожирением [1, 12–15]. Не исключено, что агонист β3-АР мирабегрон уже в ближайшее время найдет широкое клиническое применение, учитывая высокую потребность в снижении избыточного веса и лечении ожирения. Анализ данных литературы свидетельствует о том, что сведения о влиянии мирабегрона на организм человека малочисленны, а в отношении его влияния на производство свободных радикалов в литературе они отсутствуют. Исследуя влияние различных агентов (аскорбиновой кислоты как классического антиоксиданта, адреналина, пропранола, ницерголина, мирабегрона, а также триптофана, гистидина, тирозина и милдроната как сенсибилизаторов β-АР) на интенсивность железо-индуцированной биохемилюминесценции (БХЛ) эритроцитов цельной крови человека, т.е. на производство АФК, мы установили, что мирабегрон подавляет продукцию АФК. С учетом перспектив использования мирабегрона в клинической практике, в том числе для профилактики и лечения ожирения, цель данного исследования состояла в подтверждении способности мирабегрона как селективного агониста β3-АР (в сравнении с аскорбиновой кислотой и адреналином) снижать свободнорадикальную активность эритроцитов, лишенных, как известно, митохондрий (основных источников АФК), но богатых липидами.
МЕТОДИКА
Объектом исследования служила гепаринизированная венозная кровь 20 мужчин-доноров. Забор крови проводили по добровольному согласию в объеме 6 мл в Кировском НИИ гематологии и переливания крови (г. Киров). Для забора крови использовали вакуумные пробирки Improvacuter с натрий-гепарином (Guangzhou Improve Medical Instruments Co., Ltd., Китай). Кровь доставляли в термосумке при температуре 20–25°С и до момента исследования (4–12 ч) хранили при 4°С. Оценку интенсивности свободнорадикальной активности осуществляли методом железо-индуцированной БХЛ [20] на биохемилюминометре БХЛ-07 (Medozons, Россия).
Исследовали фоновые значения интенсивности БХЛ крови, которые служили в качестве контроля, а также оценивали влияние на эти показатели агониста β3-АР мирабегрона (10–6 г/мл), аскорбиновой кислоты (10–8, 10–7, 10–6, 10–5, 10–4 г/мл) как классического антиоксиданта и адреналина (10–9, 10–8, 10–7, 10–6, 10–5 г/мл).
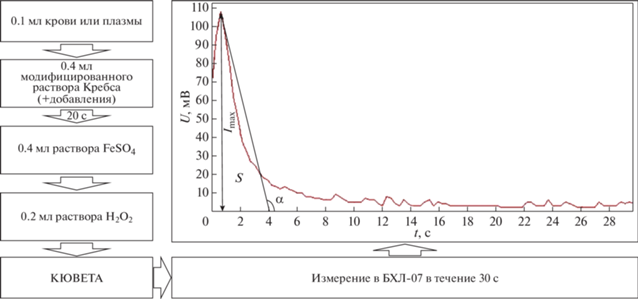
Процедура исследования и ее этапы представлены на рис. 1. Для того чтобы провести анализ исследуемой пробы в измерительную кювету прибора при комнатной температуре вносили 0.1 мл цельной крови, а затем к ней добавляли 0.4 мл модифицированного раствора Кребса (контроль) или 0.4 мл модифицированного раствора Кребса, содержащего исследуемый препарат (опыт). После 20-секундной инкубации этой смеси при комнатной температуре в кювету вносили 0.4 мл раствора сульфата железа (0.05 мМ) и кювету быстро помещали в измерительное гнездо прибора, в котором поддерживалась температура, равная 37°С, и после внесения в кювету 0.2 мл 3% перекиси водорода производили 30-секундную регистрацию хемилюминесценции (ХЛ). Компьютерная обработка кривой ХЛ позволяла рассчитать такие ее показатели как светосумма ХЛ (S, мВ/с), максимальная интенсивность ХЛ (Imax, мВ), тангенс угла α максимального наклона кривой к оси времени (tg 2) и коэффициент а = S/Imaxt, где t = 30 с.
Рис. 1.
Проведение анализа исследуемой пробы методом железо-индуцированной биохемилюминесценции (БХЛ). На графике: по оси x – время t (с), по оси y – напряжение U (мВ). S – светосумма (площадь под ХЛ кривой, мВ/с), Imax – максимальная интенсивность (мВ), a – коэффициент равный S/Imaxt, где t = 30 c, α – угол максимального наклона ХЛ кривой к оси времени.
В работе использовали модифицированный раствор Кребса, содержащий NaCl – 136 мМ, KCl – 4.7 мМ и CaCl2 – 2.52 мМ, и этот же раствор Кребса, содержащий 0.05 мМ сульфата железа, либо мирабегрон (10–6 г/мл), либо аскорбиновую кислоту или адреналин в одной из концентраций, а также 3% раствор перекиси водорода, приготовленный из расчета 2 мл стандартного пергидроля, добавленного к 28 мл модифицированного раствора Кребса. В работе применяли препараты “Бетмига” (Мирабегрон) (Astellas, США), аскорбиновой кислоты (ОАО “Дальхимфарм”, Россия) и адреналина (эпинефрина) (ФГУП “Московский эндокринный завод”, Россия).
Результаты исследования представлены в виде Me (25%; 75%), где Me – медиана, (25%; 75%) – нижний и верхний квартили. Для оценки различий между контролем и опытом использовали критерий Уилкоксона (У) для зависимых выборок, критерий U-Манна-Уитни (М-У) для независимых выборок. Различия считали статистически значимыми при p < 0.05. Все виды статистической обработки данных осуществляли с помощью программного обеспечения BioStat 2009 Professional 5.84 (AnalystSoft) и Microsoft Office 2016.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Показатели ХЛ кривой крови мужчин-доноров при действии аскорбиновой кислоты, адреналина, мирабегрона представлены на рис. 2 и в табл. 1.
Рис. 2.
Светосумма S свободнорадикальной активности цельной крови мужчин-доноров при действии мирабегрона (А), адреналина (Б), аскорбиновой кислоты (В). На диаграммах по оси x: К – фоновый уровень (контроль); М6 – мирабегрон в концентрации равной 10–6 г/мл; А9, А8, А7, А6, А5 – адреналин в концентрациях равных соответственно 10–9, 10–8, 10–7, 10–6, 10–5 г/мл; АК8, АК7, АК6, АК5, АК4 – аскорбиновая кислота в концентрациях равных соответственно 10–8, 10–7, 10–6, 10–5, 10–4 г/мл. По оси y: медианные значения светосуммы S в % к фоновому уровню. * – различия с фоновым уровнем статистически значимы (p < 0.05У).

Таблица 1.
Показатели S, Imax, a, tg2 свободнорадикальной активности цельной крови мужчин-доноров при действии аскорбиновой кислоты, адреналина, мирабегрона, в % к фоновому уровню
| Показатель | Добавление | Концентрация, г/мл | |||||
|---|---|---|---|---|---|---|---|
| 10–9 | 10–8 | 10–7 | 10–6 | 10–5 | 10–4 | ||
| цельная кровь | 100 | ||||||
| S, % | Аскорбиновая кислота | – | 86А (83; 92) |
92 (89; 97) |
88М (80; 97) |
96 (86; 101) |
80* (70; 87) |
| Адреналин | 95 (86; 107) |
108АК (102; 113) |
101 (93; 116) |
101 (88; 111) |
94* (85; 96) |
– | |
| Мирабегрон | – | – | – | 90*, АК (84;94) |
– | – | |
| Imax, % | Аскорбиновая кислота | – | 83*, А (75; 86) |
89 (78; 99) |
76*, А (71; 97) |
94 (87; 110) |
74* (61; 83) |
| Адреналин | 101 (86; 125) |
117АК (96; 134) |
106 (93; 123) |
105АК (89; 143) |
99 (87; 106) |
– | |
| Мирабегрон | – | – | – | 99 (91; 106) |
– | – | |
| a, % | Аскорбиновая кислота | – | 103 (102; 115) |
102 (92; 108) |
107 (99; 114) |
98 (92; 102) |
103 (93; 118) |
| Адреналин | 99 (81; 112) |
98 (84; 108) |
100 (90; 103) |
90 (82; 101) |
94 (85; 118) |
– | |
| Мирабегрон | – | – | – | 97 (78; 102) |
– | – | |
| tg 2, % | Аскорбиновая кислота | 87 (73; 104) |
91 (78; 103) |
80 (70; 103) |
100 (89; 109) |
69 (58; 89) |
|
| Адреналин | 103 (87; 153) |
127 (92; 173) |
106 (91; 133) |
101 (95; 142) |
101 (82; 127) |
– | |
| Мирабегрон | – | – | – | 101 (79; 136) |
– | – | |
Как видно из данных, представленных на рис. 2 и в табл. 1, аскорбиновая кислота в концентрации 10–4 г/мл статистически значимо снижает светосумму S и интенсивность Imax соответственно до 80 (84; 87) и 74 (61; 83)% от фонового уровня. В меньших концентрациях (10–8, 10–6 г/мл) аскорбиновая кислота статистически значимо снижает только Imax – соответственно до 83 (75; 86) и 76 (71; 97)% от фонового уровня. Таким образом, классический антиоксидант аскорбиновая кислота в данных концентрациях нейтрализует свободные радикалы. Для показателей а, tg 2 все различия незначимы. В целом, результаты исследования влияния аскорбиновой кислоты на интенсивность железо-индуцированной БХЛ эритроцитов цельной крови демонстрируют возможность используемой нами методики для оценки антиоксидантной активности мирабегрона и адреналина.
Аналогично аскорбиновой кислоте агонист β3-АР мирабегрон (10–6 г/мл) статистически значимо (р < 0.05) снижает светосумму S до 90 (84; 94)% от фонового уровня. Косвенно, это позволяет предположить, что эритроциты мужчин содержат β3-АР, активация которых снижает интенсивность индуцированной ионами железа продукции свободных радикалов. Кроме того, эти данные указывают на то, что применение агонистов β3-АР может повышать антиоксидантный статус, что благоприятно для лиц с избыточным весом или с ожирением.
Установлено, что адреналин лишь в высокой концентрации (10–5 г/мл) статистически значимо снижает светосумму S до 94 (85; 96)% от фонового уровня. Для показателей Imax, а, tg 2 все различия незначимы, в том числе и для его высокой концентрации (10–5 г/мл). Таким образом, адреналин как неселективный агонист β3-АР подобно селективному агонисту этих рецепторов мирабегрону проявляет антиоксидантные свойства.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Аскорбиновая кислота, как известно, является классическими антиоксидантом [21, 22]. В опытах с эритроцитами она способна уменьшать перекисное окисление липидов (ПОЛ), индуцированное перекисью водорода [23–26]. В частности, K. Czubak et al. [25] отметили, что аскорбат натрия снижает интенсивность ПОЛ и повышает общую антиоксидантную способность. Результаты наших исследований демонстрируют, что классический антиоксидант аскорбиновая кислота снижает интенсивность железо-индуцированной БХЛ эритроцитов цельной крови. Нами впервые показано, что агонист β3-АР подобно аскорбиновой кислоте снижает интенсивность железо-индуцированной БХЛ эритроцитов цельной крови. Хотя, мы в данной работе не проводили блокаду β3-АР, например, препаратом SR-6, полагаем, что эффект мирабегрона обусловлен селективной активацией β3-АР. Это позволяет нам предположить, что, во-первых, эритроциты мужчин содержат β3-АР, а во-вторых, активация этих рецепторов уменьшает интенсивность образования свободных радикалов, что является клинически важным при лечении ожирения. Вопрос о влиянии адреналина на интенсивность ПОЛ в эритроцитах активно обсуждается, в связи с тем, что для адреналина характерен процесс самоокисления [27–32], а также в связи с наличием в эритроцитах нескольких разновидностей адренорецепторов [33]. В данной нашей работе показано, что адреналин в высокой концентрации (10–5 г/мл), подобно аскорбиновой кислоте и мирабегрону снижает интенсивность железо-индуцированной БХЛ эритроцитов цельной крови. Не исключено, что этот эффект адреналина обусловлен в том числе активацией β3-АР. По нашим неопубликованным данным, полученным при исследовании эритроцитов беременных женщин, адреналин (10–5 г/мл) снижает интенсивность железо-индуцированной БХЛ эритроцитов цельной крови, и этот эффект блокируется антагонистом α-АР ницерголином (10–6 г/мл), но не блокируется антагонистом β1-АР и β2-АР пропранололом (10–6 г/мл); в этих же исследованиях мирабегрон (10–6 г/мл) также снижал железо-индуцированную БХЛ эритроцитов цельной крови.
Таким образом, мирабегрон, активируя β3-АР эритроцитов, снижает интенсивность образования свободных радикалов, индуцированных реакцией Фентона. Это указывает на то, что применение мирабегрона для лечения ожирения, вероятно, будет способствовать не только снижению интенсивности ожирения за счет воздействия на адипоциты, но одновременно будет проявлять антиоксидантную активность, что является важным компонентом лечения ожирения.
ЗАКЛЮЧЕНИЕ
Агонист β3-АР препарат мирабегрон (Бетмига) в концентрации 10–6 г/мл раствора Кребса статистически значимо снижает интенсивность железо-индуцированной БХЛ эритроцитов цельной крови мужчин. Подобный эффект оказывает классический антиоксидант аскорбиновая кислота (10–8, 10–6 и 10–5 г/мл) и адреналин (10–5 г/мл). Это указывает на возможность и целесообразность применения мирабегрона для лечения ожирения, при котором повышена интенсивность ПОЛ.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Вятского государственного университета (Киров).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Вклад авторов в публикацию. Н.С. Завалин, М.А. Морозова – непосредственное исполнение; В.И. Циркин – руководитель работы; А.Н. Трухин, С.И. Трухина – научное редактирование, оформление статьи и необходимой документации.
Список литературы
Дмитриевская М.И., Балицкий С.Е., Баландина А.Г., Глазков И.С. Мирабегрон. Современное положение препарата и его возможности как потенциального бета-3 адреномиметика против ожирения // Крымский журн. экспериментальной и клинической медицины. 2020. Т. 10. № 1. С. 55. Dmitrievskaja M.I., Balickij S.E., Balandina A.G., Glazkov I.S. [Mirabegron. Current status of the drug and the possibilities as a potential beta-3 adrenergic agonist against obesity] // Krymskij Zhurnal Jeksperimental’noj i Klinicheskoj Mediciny. 2020. V. 10. № 1. P. 55.
Циркин В.И., Трухина С.И., Трухин А.Н. Эндоканнабиноиды / Нейрофизиология: физиология ЦНС. В 2 ч. Часть 2: учебник для вузов. 2-е изд., ис-пр. и доп. М.: Издательство Юрайт, 2020. С. 414.
Yung J.H.M., Giacca A. Role of c-Jun N-terminal kinase (JNK) in obesity and type 2 diabetes // Cells. 2020. V. 9. № 3. P. 706.
Baretić M. Targets for medical therapy in obesity // Dig. Dis. 2012. V. 30. № 2. P. 168.
Полозова Э.И., Сорокина Н.Н., Пузанова Е.В., Сеськина А.А. Роль метаболических нарушений в прогрессировании ренальной дисфункции у больных метаболическим синдромом и артериальной гипертензией // Медицинский Совет. 2019. № 6. С. 170. Polozova Je.I., Sorokina N.N., Puzanova E.V., Ses’kina A.A. [The role of metabolic disorders in the progression of renal dysfunction in patients with metabolic syndrome and arterial hypertension] // Medicinskij Sovet. 2019. № 6. P. 170.
Reidy P.T., Mahmassani Z.S., McKenzie A.I. et al. Influence of exercise training on skeletal muscle insulin resistance in aging: Spotlight on muscle ceramides // Int. J. Mol. Sci. 2020. V. 21. № 4. P. 1514.
Ling C., Rönn T. Epigenetics in human obesity and type 2 diabetes // Cell. Metab. 2019. V. 29. № 5. P. 1028.
Desai M., Ferrini M.G., Han G. et al. Maternal high fat diet programs male mice offspring hyperphagia and obesity: mechanism of increased appetite neurons via altered neurogenic factors and nutrient sensor AMPK // Nutrients. 2020. V. 12. № 11. P. 3326.
Hodge S., Bunting B., Carr E. et al. Obesity, whole blood serotonin and sex differences in healthy volunteers // Obes. Facts. 2012. V. 5. № 3. P. 399.
Постоева А.В., Дворяшина И.В. Роль инсулина, лептина и адипонектина в формировании структурно-функциональных изменений миокарда при ожирении и их динамика на фоне снижения массы тела // Ожирение и метаболизм. 2015. Т. 12. № 2. С. 10. Postoeva A.V., Dvorjashina I.V. The role of insulin, leptin, adiponectin in forming of structural and functional changes of myocardium in obesity and their dynamics in weight loss // Obesity and Metabolism. 2015. V. 12. № 2. P. 10.
Тюрин-Кузьмин П.А., Арбатский М.С., Балацкий А.В. и др. Гетерологическая сенситизация адренорецепторов в мезенхимных стромальных клетках как механизм выбора направления дифференцировки / Сборник трудов конференции “Рецепторы и внутриклеточная сигнализация” // Под ред. Зинченко В.П., Бережнова А.В. Серпухов: изд-во “Библиометрические показатели”, 2019. С. 91.
Cypess A.M., Weiner L.S., Roberts-Toler C. et al. Activation of human brown adipose tissue by a β3-adrenergic receptor agonist // Cell. Metab. 2015. V. 21. № 1. P. 33.
MacPherson R.E., Dragos S.M., Ramos S. et al. Reduced ATGL-mediated lipolysis attenuates beta-adrenergic-induced AMPK signaling, but not the induction of PKA-targeted genes, in adipocytes and adipose tissue // Am. J. Physiol. Cell. Physiol. 2016. V. 311. № 2. P. 269.
Bertholet A.M., Kazak L., Chouchani E.T. et al. Mitochondrial patch clamp of beige adipocytes reveals UCP1-positive and UCP1-negative cells both exhibiting futile creatine cycling // Cell. Metab. 2017. V. 25. № 4. P. 811.
Hao L., Shan Q., Wei J. et al. Lactoferrin: Major Physiological Functions and Applications // Curr. Protein. Pept. Sci. 2019. V. 20. № 2. P. 139.
Finlin B.S., Memetimin H., Zhu B. et al. The beta3-adrenergic receptor agonist mirabegron improves glucose homeostasis in obese humans // J. Clin. Invest. 2020. V. 130. № 5. P. 2319.
Richter E.A., Ruderman N.B. AMPK and the biochemistry of exercise: implications for human health and disease // Biochem J. 2009. V. 418. № 2. P. 261.
Ferrari F., Bock P.M., Motta M.T., Helal L. Biochemical and molecular mechanisms of glucose uptake stimulated by physical exercise in insulin resistance state: Role of inflammation // Arq. Bras. Cardiol. 2019. V. 113. № 6. P. 1139.
Malik M., van Gelderen E.M., Lee J.H. et al. Proarrhythmic safety of repeat doses of mirabegron in healthy subjects: a randomized, double-blind, placebo-, and active-controlled thorough QT study // Clin. Pharmacol. Ther. 2012. V. 92. № 6. P. 696.
Кузьмина Е.И., Нелюбин А.С., Щенникова М.К. Применение индуцированной ХЛ для оценок свободнорадикальных реакций в биологических субстратах / Биохимия и биофизика микроорганизмов. Горький: Издательство Горьковского государственного медицинского института, 1983. С. 41.
Голубева М.Г. Стрессогенные нарушения эритроцитов и их коррекция с помощью регуляторных пептидов // Успехи физиологических наук. 2018. Т. 49. № 1. С. 3. Golubeva M.G. Stressogenic disorders of erythrocytes and their correction with help regulatory peptides // Advances in Physiological Sciences. 2018. V. 49. № 1. P. 3.
Gallelli C.A., Calcagnini S., Romano A. et al. Modulation of the oxidative stress and lipid peroxidation by endocannabinoids and their lipid analogues // Antioxidants (Basel). 2018. V. 7. № 7. P. 93.
Einsele H., Clemens M.R., Remmer H. Effect of ascorbate on red blood cell lipid peroxidation // Free Radic. Res. Commun. 1985. V. 1. № 1. P. 63.
Auten R.L., Davis J.M. Oxygen toxicity and reactive oxygen species: the devil is in the details // Pediatr. Res. 2009. V. 66. № 2. P. 121.
Czubak K., Antosik A., Cichon N., Zbikowska H.M. Vitamin C and Trolox decrease oxidative stress and hemolysis in cold-stored human red blood cells // Redox. Rep. 2017. V. 22. № 6. P. 445.
Delwing-de Lima D., Hennrich S.B., Delwing-Da Magro D. et al. The effect of d-galactose induced oxidative stress on in vitro redox homeostasis in rat plasma and erythrocytes // Biomed. Pharmacother. 2017. V. 86. P. 686.
Курьянова Е.В., Трясучев А.В., Ступин В.О. Адренореактивность эритроцитов и показатели свободнорадикального баланса крови нелинейных крыс // Естественные науки. 2015. Т. 51. № 2. С. 56. Kur’janova E.V., Trjasuchev A.V., Stupin V.O. Adrenoreactivity of erythrocytes and indicators of free radical balance of blood at nonlinear rats // Natural Sciences. 2015. V. 51. № 2. P. 56.
Тапбергенов С.О., Советов Б.С, Тапбергенов А.Т., Ганн Элина. Метаболические эффекты сочетанного введения адреналина и блокатора бета-адренорецепторов метопролола // Биомедицинская химия. 2017. Т. 63. № 2. С. 154. Tapbergenov S.O., Sovetov B.S., Tapbergenov A.T., Hahn Elina. [Metabolic effects of combined introduction of adrenalin and blocker of methanoprolol beta-adrenophyleters] // Biomeditsinskaya Khimiya. 2017. V. 63. № 2. P. 154.
Cassagnes L.E., Chhour M., Pério P. et al. Oxidative stress and neurodegeneration: The possible contribution of quinone reductase 2 // Free. Radic. Biol. Med. 2018. V. 120. P. 56.
Korać J., Stanković D.M., Stanić M. et al. Coordinate and redox interactions of epinephrine with ferric and ferrous iron at physiological pH // Sci. Rep. 2018. V. 8. № 1. P. 3530.
Сирота Т.В. Действие серосодержащих соединений на хиноидный процесс автоокисления адреналина; потенциальные нейропротекторы // Биомедицинская химия. 2019. Т. 65. № 4. С. 316. Sirota T.V. [Effect of sulfur-containing compounds on the quinoid process of adrenaline autooxidation; potential neuroprotectors] // Biomeditsinskaya Khimiya. 2019. V. 65. № 4. P. 316.
Djelić N., Radaković M., Borozan S. et al. Oxidative stress and DNA damage in peripheral blood mononuclear cells from normal, obese, prediabetic and diabetic persons exposed to adrenaline in vitro // Mutat. Res. Gen. Tox. En. 2019. V. 843. P. 81.
Циркин В.И., Ноздрачев А.Д., Анисимов К.Ю. и др. Фоновые и БАВ-вызванные изменения функционального состояния эритроцитов у женщин как индикаторы угрозы преждевременных родов (часть 1) // Журн. медико-биологических исследований. 2017. Т. 5. № 1. С. 48. Cirkin V.I., Nozdrachev A.D., Anisimov K.Ju. et al. Background and BAS-induced changes in erythrocyte functional state as indicators of the threat of preterm labour in women (Part 1) // J. Medical and Biological Research. 2017. V. 5. № 1. P. 48.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


