Физиология человека, 2022, T. 48, № 5, стр. 126-136
Двигательная активность и когнитивная деятельность: особенности взаимодействия и механизмы влияния
А. В. Кабачкова 1, А. Н. Захарова 1, С. Г. Кривощеков 2, Л. В. Капилевич 1, 3, *
1 Национальный исследовательский Томский государственный университет
Томск, Россия
2 ФГБНУ Научно-исследовательский институт нейронаук и медицины
Новосибирск, Россия
3 Национальный исследовательский Томский политехнический университет
Томск, Россия
* E-mail: kapil@yandex.ru
Поступила в редакцию 25.02.2022
После доработки 04.05.2022
Принята к публикации 05.05.2022
- EDN: PJKSYG
- DOI: 10.31857/S0131164622700102
Аннотация
Многочисленные исследования двигательной активности и когнитивной деятельности отражают большой теоретический и практический интерес в понимании взаимосвязи между этими процессами. Цель данного обзора – проанализировать и структурировать причинно-следственные связи влияния двигательной активности на когнитивные функции, а также рассмотреть основные механизмы такого влияния (в том числе на молекулярном уровне). В частности, описано вазо- и нейропротекторное действие физических упражнений, а также обсуждаются три гипотезы объясняющие их. Подробно рассмотрена эндокринная функция мышц на примере ряда миокинов. Представлено обсуждение двигательной активности как способа восстановления когнитивных функций при утомлении, а также как способа профилактики и коррекции когнитивных расстройств.
О тесной связи между телом и умом людям было известно еще в античности. Например, Гиппократ, Аристотель, Сенека и другие отмечали взаимосвязь психического и физического здоровья. В частности, Аристотелю приписывают такие слова – “ничто так не истощает и не разрушает человека, как продолжительное физическое бездействие”. Безусловно, когнитивная и двигательная активности имеют неразрывное единство. И.М. Сеченов одним из первых обратил внимание на взаимосвязь различных психических явлений с движениями и деятельностью человека в целом – “все бесконечное разнообразие мозговой деятельности сводится окончательно к одному лишь явлению – мышечному движению” [1]. К выводу о тесной связи между умственным и физическим развитием пришел в результате исследований П.Ф. Лесгафт, заключивший, что “умственный рост и развитие требуют соответствующего физического развития” [2]. В настоящее время доказано, что физические нагрузки стимулируют образование новых нейронных связей в головном мозге и укрепляют существующие. Например, мозг пожилых людей, которые регулярно занимаются физическими упражнениями, соответствует показателям людей значительно более молодого возраста [3]. Дети, которые лучше развиты физически, показывают более высокие результаты на важных тестах [4]. Взрослые, ведущие активный образ жизни, в меньшей степени подвержены депрессии, в отличие от их сверстников с низким уровнем двигательной активности [5]. Эти и прочие многочисленные исследования представляют большой теоретический и практический интерес в понимании взаимосвязи двигательной активности и когнитивной деятельности. Цель настоящего обзора – проанализировать и структурировать причинно-следственные связи влияния двигательной активности на когнитивные функции, а также рассмотреть основные механизмы такого влияния (в том числе на молекулярном уровне).
Двигательная активность и ее влияние на здоровье человека
Согласно C.J. Caspersen et al. двигательная активность определяется как любое движение тела, которое производится скелетными мышцами и требует расхода энергии [6]. Такая активность может оказывать как прямое, так и опосредованное влияние на все системы организма, что обуславливает ее сочетанное воздействие на состояние физического и психического здоровья человека. При этом двигательная активность в детском возрасте имеет тенденцию к “закреплению” в последующие возрастные периоды, что в дальнейшем определяет уровни заболеваемости и смертности [7]. Таким образом, двигательная активность может не только непосредственно влиять на здоровье человека, но и формировать долгосрочный эффект. Направленность и особенности такого влияния, безусловно, будут определяться выраженностью двигательной активности, которую зачастую представляют в виде континуума в зависимости от расхода энергии (рис. 1). В настоящее время определение уровня двигательной активности осуществляется с помощью разнообразных субъективных и объективных методов. При этом многочисленные рекомендации содержат различные нормативные оценки. Несмотря на отсутствие единого подхода, все авторы сходятся во мнении – двигательная активность должна быть достаточной. Недостаточная двигательная активность или физическая инертность есть независимый фактор риска развития хронических болезней сердечно-сосудистой и прочих систем организма, а также онкологических заболеваний и диабета. Тогда как избыточная активность является причиной развития синдрома перетренированности, возникновения спортивных травм и прочих ассоциированных состояний.
Когнитивная деятельность и ее нарушения
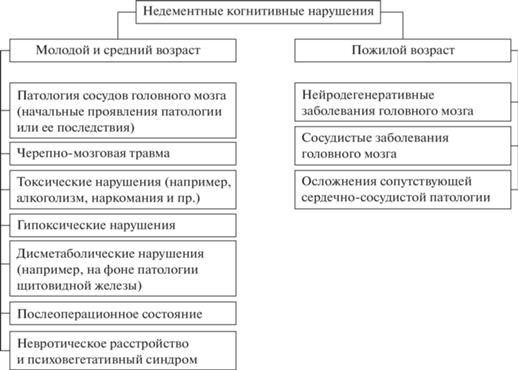
Согласно J. Anderson, когнитивная деятельность – это сознательная деятельность, которая опирается на когнитивные способности человека (например, память, гнозис, речь и т.д.) [8]. В основе когнитивного развития лежит пластичность мозга – “способность приспосабливать свою структуру и функции к изменениям внутри организма или во внешней среде” [9]. Такая адаптация происходит в течение всей жизни, а благодаря появлению новых нейронных связей реализуется способность обучаться. С возрастом происходит снижение мнестико-интеллектуальных способностей, хотя скорость и степень таких изменений у разных людей неодинакова. Если относительно исходного уровня произошло такое снижение, то говорят о “когнитивном нарушении” или “когнитивном дефиците”. Такие нарушения, например, закономерно развиваются при различных очаговых или диффузных поражениях головного мозга вследствие нейродегенеративных и сосудистых заболеваний, нейроинфекций, а также при тяжелых черепно-мозговых травмах. Классификация когнитивных нарушений в целом представлена на рис. 2.
Деменция. По данным Всемирной организации здравоохранения (2021 г.) во всем мире насчитывается 55 млн чел. с деменцией, и ежегодно регистрируют 10 млн новых случаев заболевания (www.who.int). Являясь необратимым процессом, деменция начинается с легких симптомов, постепенно развивается неадекватное поведение и все завершается личностным распадом. Этот полиэтиологический клинический синдром сопровождает различные заболевания головного мозга (например, болезнь Альцгеймера обуславливает до 60–70% случаев деменций в пожилом возрасте). Чаще всего такие патологические изменения развиваются в старости, но при этом они не являются естественным следствием старения. К факторам, повышающим риск развития деменции, относят возраст, генетическую предрасположенность, стресс, сидячий образ жизни, артериальную гипертензию, воспалительные процессы, высокий уровень холестерина и глюкозы в крови [10].
Недементные когнитивные нарушения. Встречаемость легких когнитивных расстройств еще более велика. Этиология недементных состояний очень гетерогенна (самые частые причины представлены на рис. 3). Например, заболевания сердечно-сосудистой системы, запускающие сосудистые трофические нарушения, рассматриваются как основной фактор риска их развития [11]. Профилактика недементных расстройств, в первую очередь, направлена на борьбу с причинами развития сердечно-сосудистых заболеваний, диабета, ожирения, депрессии как в зрелом, так и в пожилом возрасте. Стоит отметить, что независимо от возраста к провоцирующим факторам относят “нарушения сна (в том числе “световую загрязненность”), десинхроноз, перелеты через часовые пояса, нерациональный прием психотропных и стимулирующих медикаментов, эмоционально-личностные расстройства и “информационный невроз”” [12].
Когнитивный резерв. Известно, что степень повреждения мозга не всегда однозначно соотносится с его функциональностью. Так, у некоторых людей наблюдаются повреждения мозга, типичные для деменции, но их когнитивная деятельность не нарушена. Для объяснения такого состояния используется термин “когнитивный резерв” (степень, с которой головной мозг может компенсировать повреждения, без ущерба для интеллектуальных способностей) [13]. По мнению P. Michelon, “мозг компенсирует полученные повреждения за счет реорганизации и формирования новых связей между незатронутыми нейронами, но чтобы это произошло, нейронам необходима стимуляция в виде деятельности” [14]. Считается доказанным, что серьезная умственная деятельность и поддержание хорошей физической формы в течение всего срока жизни положительно влияет на сохранность когнитивных функций [15]. Именно двигательная активность, когнитивные нагрузки, позитивный эмоциональный настрой и дифференцированная профилактика сосудистых факторов риска оказывают нейропротекторное действие.
Связь двигательной активности и когнитивной деятельности
Влияние физических упражнений на когнитивные функции. Существующее предположение о положительном влиянии физических упражнений на когнитивные функции у людей различных возрастов нашло свое отражение в многочисленных исследовательских работах. Например, показано, что упражнения умеренной интенсивности длительностью от 20 мин до одного часа способствуют повышению продуктивности умственной деятельности. При этом выполнение аэробных и силовых упражнений в объеме семь часов в неделю позволяет не только избегать проблем с сердечно-сосудистой системой, но и сохранять крайне высокие когнитивные способности [16]. Однако механизмы, лежащие в основе этого влияния, остаются малоизученными.
Вазопротекторное действие двигательной активности. Двигательная активность системно влияет на сосудистое русло, в том числе модулируя функциональное состояние капилляров. Доказано, что физические упражнения влияют на эндотелиальную функцию сосудов [17], стимулируют ангиогенез и улучшают церебральный кровоток [18]. В частности, выполнение простых трудовых двигательных действий пожилыми людьми вызывает увеличение кровотока в средней, передней и задней мозговых артериях [19]. В исследовании H. Guiney предполагается, что двигательная активность влияет на регуляцию мозгового кровотока, способствуя контролю за когнитивной деятельностью у взрослых людей не имеющих сосудистых патологий [20].
Нейропротекторное действие двигательной активности. У пожилых людей аэробные упражнения вызывают увеличение объема головного мозга в лобной области, повышение внимания и улучшение памяти [21] (хотя с возрастом объем мозга уменьшается). Также доказано, что увеличение уровня двигательной активности обратно коррелирует со снижением объема серого и белого вещества у пожилых людей в теменной, лобной и височной областях коры головного мозга. При этом прямая корреляция обнаружена между повышенным уровнем двигательной активности, улучшением когнитивных процессов и размерами гиппокампа [22]. Гиппокамп, как известно, участвует в формировании эмоций, консолидации памяти, обработке пространственной информации и узнавании местности, чем и определяется особая значимость хорошего кровоснабжения этой области мозга для всех людей, особенно с риском когнитивного обеднения. В работе C. Latimer et al. представлена одна из моделей, отражающая влияние низкого уровня физических нагрузок на старение головного мозга [23]. Хроническая гипоперфузия в результате старения и малоподвижного образа жизни отражается на функциональной активности астроцитов, которые гипертрофируются и становятся реактивными. Такие изменения первоначально представляют собой компенсаторную реакцию для сохранения метаболической связи, однако в дальнейшем клетки приобретают дезадаптивные функции и могут еще больше нарушать целостность сосудов. Реактивные астроциты не в состоянии обеспечить адекватную метаболическую поддержку или секретировать факторы, поддерживающие миелин. В результате, гены и белки, связанные с миелином, активируются, чтобы компенсировать эти дегенеративные процессы, но ответ нарушается и может привести к утолщению миелиновой оболочки. В совокупности такие события могут способствовать нездоровому старению мозга и снижению когнитивных функций. В свою очередь, физические упражнения, начатые в среднем возрасте, способствуют целостности эндотелия и, следовательно, здоровью сосудов головного мозга. Такие изменения облегчают нагрузку на астроцит по поддержанию нервно-сосудистого взаимодействия, что отражается на его функциональной активности. В этих условиях аберрантная продукция и оборот миелина снижается, и восстанавливается его оптимальная структура и функция [24].
В настоящее время существуют три гипотезы, объясняющие, протекторное действие физических упражнений. Во-первых, физическая нагрузка стимулирует ангиогенез и способствует насыщению крови кислородом в областях мозга, активированных при выполнении когнитивных задач. Во-вторых, физические упражнения способствуют повышению уровня нейротрансмиттеров в головном мозге, тем самым облегчая обработку информации. В-третьих, физические нагрузки активируют нейротрофины – нейротрофический фактор (BDNF), инсулиноподобный фактор роста (IGF-I) и фактор роста фибробластов (bFGF), которые способствуют нейрогенезу, нейропротекции, нейрорегенерации и повышают выживаемость нейронов. Например, BDNF производится не только в центральной нервной системе, но и в других тканях, включая сосудистый эндотелий. Особенно высокий уровень экспрессии мРНК BDNF обнаружен в гиппокампе и в коре головного мозга (в частности, снижение этого уровня рассматривается как фактор развития болезни Альцгеймера и депрессии) [25]. Синаптическая сигнализация нейронов гиппокампа усиливается в течение нескольких секунд после введения BDNF крысам, а при блокировке его выработки наблюдаются нарушения памяти и обучения. При этом однократная физическая нагрузка и недельная физическая активность увеличивают его содержание в гиппокампе крыс. Эти результаты были подтверждены и другими исследованиями как на здоровых животных, так и в экспериментах с травмами головного мозга [26].
Эндокринная функция скелетных мышц
Миокины и их эффекты. Один из механизмов системного влияния физических нагрузок на организм реализуется через продукцию миокинов [27]. Эти молекулы вовлечены в межклеточную коммуникацию и выполняют разнообразные роли. Изучению их эндо-, пара- и аутокринных эффектов посвящены работы таких авторов, как J.J. Walsh [26], S.M. Barbalho [27], B. Kirk [28], B.K. Pedersen [29] и пр. Современные исследования показывают, что продуцируемые в ответ на физическую нагрузку миокины обеспечивают взаимодействие между скелетными мышцами и другими органами, включая мозг, жировую ткань, кости, печень, кишечник, поджелудочную железу, сосудистое русло и кожу. Установлено, что они влияют на жировой обмен (IL-6, иризин, LIF и BDNF), оказывают катаболическое и анаболическое действие на кости (IL-6, иризин, IGF-1, BDNF, миостатин и FGF2), способствуют ангиогенезу (IL-6, IL-8, VEGF, CXCL1 и eNOS) и миогенезу (LIF, IL-4, IL-6, IL-7 и IL-15), оказывают влияние на миобласты (CXCL1/KC, CXCL5/LIX, LIF, PGE2 и PGF2α), способствуют регенерации и гипертрофии мышечных клеток (LIF и простагландины) [28]. Соответственно, миокины могут участвовать в механизмах реализации эффектов физических нагрузок на когнитивную сферу как через влияние на энергетический обмен, так и посредством модификации церебрального кровотока [29]. В совокупности это позволяет рассматривать миокины в качестве биомаркеров, позволяющих контролировать назначение физических упражнений для людей страдающих диабетом, онкологическими или нейродегенеративными заболеваниями.
Интерлейкин 6. Тот факт, что сократительная активность является фактором, способствующим продукции IL-6 мышечными клетками, был установлен еще в 1991 г. В дальнейшем способность физических нагрузок стимулировать экспрессию этого интрелейкина была доказана в многочисленных исследованиях. IL-6 продуцируется в работающих мышцах, а уровень его экспрессии зависит от количества мышечной массы, вовлеченной в процесс физической работы. В целом IL-6 обладает системными эффектами и оказывает влияние на печень, жировую ткань и увеличение инсулиновой секреции [30]. Именно эти эффекты позволяют рассматривать IL-6 как молекулу, которая может опосредованно влиять на физиологические и метаболические реакции в головном мозге.
Белок иризин секретируется скелетными мышцами в кровоток во время физических упражнений из предшественника фибронектина типа III связанного с мембраной и содержащего домен белка 5 (FNDC5). Иризин влияет на метаболические процессы – гомеостаз глюкозы и потемнение белой жировой ткани, а также способен преодолевать гематоэнцефалический барьер и инициировать нейропротекторную генетическую программу в гиппокампе, которая завершается повышенной экспрессией BDNF. Нейропротекторный эффект иризина был показан на моделях ишемии и при нейродегенеративных заболеваниях, включая болезнь Альцгеймера. Кроме того, иризин обладает анксиолитическим и антидепрессивным действием [31].
Простагландин E2. Экспериментально было обнаружено изменение концентрации PGE2 в мышечных клетках при использовании разнообразных динамических и статических нагрузок [32]. При этом PGE2, действующий через свои четыре подтипа рецепторов (EP1, EP2, EP3 и EP4), участвует в таких реакциях на стресс, как активация симпатической нервной системы, секреция глюкокортикоидов и эмоциональное поведение [33]. Есть данные, что активация рецепторов EP1 приводит к подавлению импульсивного поведения в ответ на психологический стресс, а активация рецепторов EP2 участвует в процессах регуляции при нарушениях памяти [34]. Помимо этого PGE2 является мощным вазодилататором [35].
Циклооксигеназа, или COX – это фермент, участвующий в синтезе простаноидов, таких как простагландины, простациклины и тромбоксаны, включая PGE2. При детальном исследовании COX было установлено наличие изоформ этого фермента в различных тканях. После выполнения упражнений с преодолением сопротивления в период восстановления у мужчин выявлено увеличение уровня COX-1 и COX-2 в пять раз, по сравнению с уровнем до начала упражнения [36]. Для продуктов циклооксигеназного пути описаны как прямые эффекты на центральную нервную систему, так и многочисленные эффекты на периферический кровоток [37].
Эндотелиальная синтаза оксида азота. eNOS или NOS3 является Ca-зависимым ферментом, который локализован в сарколемме и Т-трубочках скелетных мышечных волокон. Изоформы NOS3 были также обнаружены в эндотелиальных клетках капилляров [38]. Существует предположение, что изменение метаболизма NO в скелетных мышцах при физических нагрузках может способствовать увеличению чувствительности к инсулину и митохондриальной емкости [39]. Была описана возможность взаимодействия между NO и миокинами из группы интерлейкинов (в частности, IL-6 и IL-8) [40]. Показано, что при физических нагрузках различной интенсивности и направленности NO является незаменимым триггером сигнальных процессов, приводящих к изменению структурно-метаболического профиля волокна и повышению его функциональных возможностей [41]. Наряду с этим молекула может выполнять и защитную, стабилизационную функцию, не допуская интенсификации протеолитических реакций при повышенной сократительной активности мышц. Известны также эффекты NO в качестве нейромедиатора и ключевого звена локальной регуляции кровотока. Оба этих пути могут вовлекаться в механизмы взаимодействия физической активности и когнитивных функций.
Постепенно накапливаются данные о том, что миокин катепсин В проходит через гематоэнцефалический барьер, усиливая выработку BDNF и, следовательно, влияет на нейрогенез, память и процесс обучения [29].
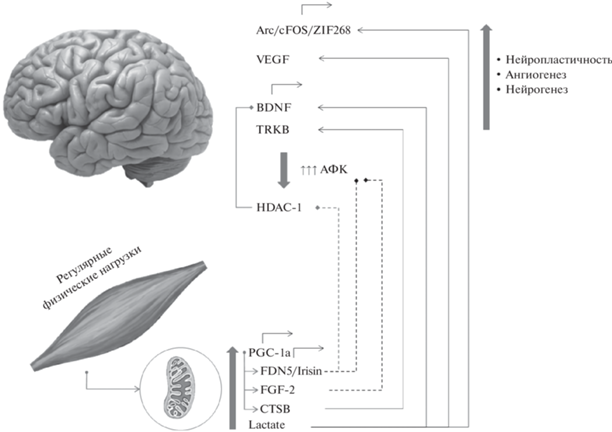
Таким образом, в настоящее время установлено, что мышечные клетки способны экспрессировать и продуцировать целый ряд регуляторных молекул. При этом их продукция индуцируется в процессе сократительной активности и зависит от режима стимуляции. Физиологические эффекты миокинов весьма разнообразны. Наряду с воздействием на клетки иммунной системы, миокины способны регулировать локальный кровоток, энергетический метаболизм, в частности – липолиз, а также модулировать процессы пролиферации и дифференцировки миобластов, в том числе оказывать непосредственное воздействие на нервную систему. В частности, J. Burtscher et al. описали один из путей, представленный на рис. 4. Было показано, что физические упражнения индуцируют повышенную экспрессию PGC-1α, активируемого пролифератором пероксисом, и поддерживают индукцию различных миокинов, таких как FDN5/Irisin, CTSB, FGF21 и лактат. FDN5/Irisin индуцирует экспрессию BDNF в головном мозге посредством непрямого ингибирования HDAC-1. Некоторые из этих факторов усиливают передачу сигналов BDNF и его рецептора TRKB или снижают избыточное производство активных форм кислорода. Кроме того, лактат увеличивает экспрессию VEGF и генов синаптической пластичности [42].
Рис. 4.
Индуцированная физическими упражнениями нейропротекция посредством циркулирующих миокинов (по [42]). PGC-1α – γ-коактиватора-1α; CTSB – катепсин B; FGF21 – фактор роста фибробластов 21; Lactate – лактат; BDNF – мозговой нейротрофический фактор; HDAC-1 – гистондеацетилаза 1; TRKB – киназа рецептора тропомиозина B; АФК – активные формы кислорода; VEGF – фактор роста эндотелия сосудов; Arc, c-FOS и ZIF268 – гены синаптической пластичности.
Двигательная активность как способ восстановления когнитивных функций при утомлении
Утомление – это “сложный процесс, затрагивающий все уровни функционирования организма” [43]. Он представляет собой совокупность изменений “под влиянием напряженной или продолжительной деятельности, которая приводит к снижению ее эффективности” [44]. На утомляемость в значительной степени влияют факторы условной зависимости (выполняемая задача, условия окружающей среды, физические и умственные способности человека) и интерактивные изменения центральных, психологических и (или) периферических факторов, вызывающих утомление [45].
Утомление вследствие физической работы проявляется мышечной усталостью, изменениями в деятельности нервной системы и пр. Ведущая роль в проявлении симптомов утомления при напряженной мышечной работе принадлежит тканевой гипоксии, которая развивается в мышцах [44]. Для объяснения механизмов утомления, в том числе физического, есть ряд локально-гуморальных теорий и центрально-нервная теория утомления И.М. Сеченова, дополненная А.А. Ухтомским [46]. В настоящее время исследователи сходятся во мнении, что “свести причины утомления к изменениям в каком-то одном органе или системе органов, в том числе в нервной”, неправомерно [46].
Умственное утомление является “функциональным состоянием организма, которое возникает вследствие напряженной умственной деятельности и проявляется в нарушении не только психических, но и физиологических функций, в снижении работоспособности, эффективности и качества деятельности” [47]. Умственное утомление, так же как и физическое сопровождается рядом субъективных и объективных признаков. Среди них выделяют сонливость, снижение внимания и мнестических способностей, развитие апатии и раздражительности. Основным фактором, вызывающим утомление, является нагрузка на афферентные системы во время работы [46].
Переутомление. В случае длительной и напряженной работы (физической или умственной) развивается хроническое утомление или переутомление. Принято выделять четыре степени переутомления (табл. 1). В основном их можно скорректировать в домашних условиях, однако четвертая степень требует назначения специального лечения и врачебного контроля. Еще И.М. Сеченовым (1903 г.) было предложено использование различных форм активного отдыха для восстановления работоспособности. Например, “при интенсивной умственной работе можно предупредить переутомление, улучшая кровоснабжение головного мозга специальными гимнастическими упражнениями” или использовать упражнения с задержкой дыхания, так как избыток CO2 вызывает расширение сосудов головного мозга” [48].
Таблица 1.
Степени переутомления и их краткая характеристика
| Симптом | I начинающееся |
II легкое |
III выраженное |
IV тяжелое |
|---|---|---|---|---|
| Снижение дееспособности | малое | заметное | выраженное | резкое |
| Появление ранее отсутствующей усталости | При усиленной нагрузкe | При обычной нагрузке | При облегченной нагрузке | Без видимой нагрузки |
| Компенсация понижения дееспособности волевым усилием | Не требуется | Полностью | Не полностью | Незначительно |
| Эмоциональные сдвиги | Временнoе снижение интереса к работе | Временнaя неустойчивость настроения | Раздражительность | Угнетение, резкая раздражительность |
| Расстройство сна | Трудно засыпать или просыпаться | Многим труднее засыпать, просыпаться | Сонливость днем | Бессонница |
| Снижение умственной работоспособности | Нет | Трудно сосредоточиться | Временами забывчивость | Заметное ослабление внимания и памяти |
| Профилактические мероприятия | Упорядочение отдыха, физкультура, культурные развлечения | Очередной отпуск или отдых | Необходимо ускорение очередного отпуска или организованного отдыха | Лечение |
Эффект физических упражнений. Выполнение физических упражнений связано с поступлением в ЦНС сигналов о состоянии мышц, степени их сокращения или расслабления, положении тела и его частей в пространстве, поддержании позы. Вследствие этого изменяется функциональное состояние коры и подкорковых центров, активизируются процессы возбуждения и торможения, увеличивается сила и подвижность нервных процессов, что способствует повышению умственной и физической работоспособности [49, 50]. Кратковременные физические упражнения способны поддерживать умственную работоспособность на протяжении длительного времени, в то время как отсроченное влияние физической нагрузки обуславливается лучшей согласованностью работы различных физиологических систем организма. Правильно дозированные физические действия (преимущественно циклические упражнения на выносливость) улучшают работу всех органов и систем, увеличивают тонус нервной системы, что приводит к увеличению уровня работоспособности [50]. В то же время количественные закономерности влияния физических нагрузок на эффективность когнитивной деятельности требуют уточнения. Исследования на здоровых людях показали, что высокий уровень двигательной активности связан с увеличением объема гиппокампа, улучшением мозгового кровотока, пространственной памяти, а также снижением числа погибших нейронов. Существуют данные о положительном влиянии двигательной активности на успеваемость школьников, так аэробные упражнения способствуют увеличению скорости обработки информации у детей. У студентов зафиксировано улучшение словесной оперативной памяти после выполнения упражнений на координацию [51]. Показано, что умеренные физические нагрузки способствуют повышению эффективности решения когнитивных задач низкого уровня сложности, причем нагрузки умеренного уровня оказывают больший эффект, чем низкого. Эффективность же решения задач высокого уровня сложности напротив, снижается после физических нагрузок, причем степень снижения так же пропорциональна уровню нагрузки [52]. Таким образом, особенности влияния физических нагрузок на когнитивные способности зависят в равной степени от интенсивности нагрузок и характера решаемых задач.
Двигательная активность как способ профилактики и коррекции когнитивных расстройств
Двигательная активность при когнитивных расстройствах. По мнению B. Dijckmans et al. “регулярная двигательная активность является многообещающей стратегией лечения и профилактики возрастного когнитивного спада” [53]. Например, двигательная активность уже зарекомендовала себя в качестве меры профилактики умеренных сосудистых когнитивных нарушений, благодаря индукции синаптогенеза и нейрогенеза, а также положительного влияния на сосудистое здоровье и здоровье мозга [54]. Хотя в настоящее время отсутствует регламент по двигательной активности для пожилых людей с когнитивными нарушениями разной степени выраженности, важность такой активности закреплена в клинических рекомендациях Минздрава (2020 г.). В частности, в рекомендациях для лиц пожилого и старческого возраста содержатся положения, касающиеся активного использования немедикаментозных мер, которые включают в себя когнитивный тренинг, физические упражнения и оптимальную (“средиземноморскую”) диету для лечения и профилактики когнитивных расстройств [55]. Эти же положения закреплены в программе профилактики, раннего выявления, диагностики и лечения когнитивных расстройств у лиц пожилого и старческого возраста [56].
Для терапии когнитивных нарушений при тревоге и депрессии у лиц молодого и среднего возраста рекомендовано увеличение объема двигательной активности [57, 58]. Еще 15 лет назад D. Reynolds et al. выявили, что шесть месяцев тренировок с использованием упражнений на координацию и совершенствование вестибулярного аппарата у детей с дислексией приводят к уменьшению проблем при чтении [51]. O. Verschuren et al. показали, что восемь месяцев тренировок (два раза в неделю по 45 мин) значительно улучшают познавательную деятельность у людей с церебральным параличом в возрасте от 7 до 20 лет. При этом в течение четырех месяцев после прекращения тренировок эффект повышения производительности мозга сохранялся [59].
Двигательная активность и “умное старение”. В 2014 г. исследователи R. Nouchi и R. Kawashima опубликовали свою работу, в которой была представлена концепция Smart Ageing или “умное старение”. Предложенная концепция демонстрирует важность изменения отношений человека к своему возрасту, что, по мнению авторов, будет способствовать предупреждению или уменьшению негативных влияний старения на здоровье. В обзорной статье А.Т. Быкова и Т.Н. Маляренко представлен анализ работ, посвященных исследованиям влияния двигательной активности на когнитивные функции пожилых людей. Например, “установлено, что пожилые и старые люди, регулярно выполняющие дыхательные упражнения, имеют лучшие результаты в когнитивных тестах, чем индивиды того же возраста с пониженным аэробным статусом” [60]. При этом в статье отмечается, что только произвольные циклические движения активируют инсулярную кору (в меньшей мере кора активируется при статических упражнениях и не активируется при пассивных движениях и электростимуляции). Такая активация инсулярной коры имеет “принципиальное значение для улучшения когнитивных функций, формирования социальных эмоций и регулирования нравственного поведения” [60]. В отличие от людей молодого возраста у пожилых уже при выполнении простых движений происходит выраженная активация кортикальных и субкортикальных областей, что объясняется возрастной пластичностью нервной системы. Наряду с этим многочисленные исследования влияния двигательной активности на ткани и структуры головного мозга людей старше 60 лет без выраженных когнитивных нарушений демонстрируют положительный эффект.
ЗАКЛЮЧЕНИЕ
Как показал анализ научно-методической литературы, интерес к изучению двигательной активности неуклонно растет. Не вызывает сомнений, что двигательная активность является обязательным условием нормального функционирования организма человека и мерой профилактики неинфекционных заболеваний, а ее надлежащий уровень рекомендуется поддерживать на протяжении всей жизни. В преклонном возрасте двигательная активность “защищает” и улучшает структуру головного мозга, в то время как физическая инертность имеет отрицательный эффект на его функционирование. В целом, независимо от возраста, двигательная активность оказывает значительное влияние на когнитивную сферу человека. Опубликованные данные подтверждают более благоприятное влияние умеренных аэробных физических нагрузок на кровоток в мозге и активацию соответствующих зон коры, которые ассоциируются с когнитивными функциями. Стоит отметить, что влияние двигательной активности на работу головного мозга выражается не только физиологическими, но и анатомическими изменениями. Так, в настоящее время разрабатываются несколько гипотез, объясняющих вазо- и нейропротекторное действие физических нагрузок. При этом их молекулярные механизмы во многом еще не определены. В свою очередь изучение продуктивности когнитивной деятельности и способов ее повышения в последнее время приобретает все большую актуальность. Однако закономерности и механизмы взаимодействия физических и когнитивных нагрузок во многом остаются не ясными. Не описаны особенности влияния двигательной активности на умственную работоспособность спортсменов в зависимости от уровня и характера спортивных тренировок. Также недостаточно изученными остаются механизмы влияния двигательной активности на умственную работоспособность и когнитивные функции. В литературе их традиционно подразделяют на две группы – рефлекторные и вегетососудистые, однако их соотношение в различных ситуациях не изучено. Практически не уделяется внимание третьему возможному механизму, связанному с эндокринной функцией скелетных мышц, с их способностью секретировать миокины. В то же время именно этот механизм видится наиболее перспективным как с точки зрения теории, так и в его практических аспектах.
Финансирование работы. Исследование выполнено при поддержке Программы развития Томского государственного университета (Приоритет-2030).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Сеченов И.М. Рефлексы головного мозга. М.: URSS, 2022. 128 с.
Лесгафт П.Ф. Задачи физического развития в школе // Здоровье человека, теория и методика физической культуры и спорта. 2018. № 2(9). С. 164.
Mendez Colmenares A., Voss M.W., Fanning J. et al. White matter plasticity in healthy older adults: The effects of aerobic exercise // Neuroimage. 2021. V. 239. P. 118305.
Visier-Alfonso M.E., Sánchez-López M., Álvarez-Bueno C. et al. Mediators between physical activity and academic achievement: A systematic review // Scand. J. Med. Sci. Sports. 2022. V. 32. № 3. P. 452.
Choi K.W., Chen C.Y., Stein M.B. et al. Major depressive disorder working group of the psychiatric genomics consortium. Assessment of bidirectional relationships between physical activity and depression among adults: a 2-sample mendelian randomization study // JAMA Psychiatry. 2019. V. 76. № 4. P. 399.
Caspersen C.J., Powell K.E., Christenson G.M. Physical activity, exercise, and physical fitness: definitions and distinctions for health-related research // Public Health Rep. 1985. V. 100. № 2. P. 126.
Kassebaum N., Kyu H.H., Zoeckler L. et al. Child and adolescent health from 1990 to 2015: findings from the global burden of diseases, injuries, and risk factors // JAMA Pediatrics. 2017. V. 171. № 6. P. 573.
Anderson J.R. The architecture of cognition. Harvard University Press, 1983. 314 p.
Гуляева Н.В. Молекулярные механизмы нейропластичности: расширяющаяся вселенная // Биохимия. 2017. Т. 82. № 3. С. 365.
Kuo C.Y., Stachiv I., Nikolai T. Association of late life depression, (non-) modifiable risk and protective factors with dementia and Alzheimer’s disease: literature review on current evidences, preventive interventions and possible future trends in prevention and treatment of dementia // Int. J. Environ. Res. Public Health. 2020. V. 17. № 20. P. 7475.
Graff-Radford J. Vascular cognitive impairment // Continuum (Minneap Minn). 2019. V. 25. № 1. P. 147.
Соколова Л.П. Додементное когнитивное расстройство. Направления терапии // Невроньюс. 2017. № 11(37). С. 6.
Stern Y., Barulli D. Cognitive reserve // Hand. Clin. Neurol. 2019. V. 167. P. 181.
Fernandez A., Goldberg E., Michelon P. The sharp brains guide to brain fitness. SharpBrains, 2013. 261 p.
Reas E.T., Laughlin G.A., Bergstrom J. et al. Lifetime physical activity and late-life cognitive function: the Rancho Bernardo study // Age Ageing. 2019. V. 48. № 2. P. 241.
Falck R.S., Davis J.C., Best J.R. et al. Impact of exercise training on physical and cognitive function among older adults: a systematic review and meta-analysis // Neurobiol. Aging. 2019. V. 79. P. 119.
Pagan L.U., Gomes M.J., Okoshi M.P. Endothelial function and physical exercise // Arq. Bras. Cardiol. 2018. V. 111. № 4. P. 540.
Smith K.J., Ainslie P.N. Regulation of cerebral blood flow and metabolism during exercise // Exp. Physiol. 2017. V. 102. № 11. P. 1356.
Kim S.-S., Lee B.-H. Measuring cerebral hemodynamic changes during action observation with functional transcranial doppler // J. Phys. Ther. Sci. 2015. V. 27. № 5. P. 1379.
Guiney H., Lucas S.J., Cotter J.D., Machado L. Evidence cerebral blood-flow regulation mediates exercise-cognition links in healthy young adults // Neuropsychology. 2015. V. 29. № 1. P. 1.
Kramer A. An overview of the beneficial effects of exercise on health and performance // Adv. Exp. Med. Biol. 2020. V. 1228. P. 3.
Haeger A., Costa A.S., Schulz J.B., Reetz K. Cerebral changes improved by physical activity during cognitive decline: A systematic review on MRI studies // NeuroImage Clin. 2019. V. 23. P. 101933.
Latimer C.S., Searcy J.L., Bridges M.T. et al. Reversal of glial and neurovascular markers of unhealthy brain aging by exercise in middle-aged female mice // PLoS One. 2011. V. 6. № 10. P. e26812.
Maugeri G., D’Agata V., Magrì B. et al. Neuroprotective effects of physical activity via the adaptation of astrocytes // Cells. 2021. V. 10. № 6. P. 1542.
Ismail N.A., Leong Abdullah M.F.I., Hami R., Ahmad Yusof H. A narrative review of brain-derived neurotrophic factor (BDNF) on cognitive performance in Alzheimer’s disease // Growth Factors. 2020. V. 38. № 3–4. P. 210.
Walsh J.J., Tschakovsky M.E. Exercise and circulating BDNF: mechanisms of release and implications for the design of exercise interventions // Appl. Physiol. Nutr. Metab. 2018. V. 43. № 11. P. 1095.
Barbalho S.M., Prado Neto E.V., De Alvares Goulart R. et al. A. myokines: a descriptive review // J. Sports Med. Phys. Fitness. 2020. V. 60. № 1. P. 1583.
Kirk B., Feehan J., Lombardi G., Duque G. Muscle, bone, and fat crosstalk: the biological role of myokines, osteokines, and adipokines // Curr. Osteoporos. Rep. 2020. V. 18. № 4. P. 388.
Pedersen B.K. Physical activity and muscle-brain crosstalk // Nat. Rev. Endocrinol. 2019. V. 15. № 7. P. 383.
Domin R., Dadej D., Pytka M. et al. Effect of various exercise regimens on selected exercise-induced cytokines in healthy people // Int. J. Environ. Res. Public Health. 2021. V. 18. № 3. P. 1261.
Jodeiri Farshbaf M., Alviña K. Multiple roles in neuroprotection for the exercise derived myokine irisin // Front. Aging Neurosci. 2021. V. 13. P. 649929.
Zhang J., Bhattacharyya S., Hickner R.C. et al. Skeletal muscle interstitial fluid metabolomics at rest and associated with an exercise bout: application in rats and humans // Am. J. Physiol. Endocrinol. Metab. 2019. V. 316. № 1. P. E43.
Furuyashiki T., Narumiya S. Stress responses: the contribution of prostaglandin E(2) and its receptors // Nat. Rev. Endocrinol. 2011. V. 7. № 3. P. 163.
Jiang C., Caskurlu A., Ganesh T., Dingledine R. Inhibition of the prostaglandin EP2 receptor prevents long-term cognitive impairment in a model of systemic inflammation // Brain. Behav. Immun. Health. 2020. V. 8. P. 100132.
Gomez I., Foudi N., Longrois D., Norel X. The role of prostaglandin E2 in human vascular inflammation // Prostaglandins Leukot. Essent. Fatty Acids. 2013. V. 89. № 2–3. P. 55.
Carroll C.C., O’Connor D.T., Steinmeyer R. et al. The influence of acute resistance exercise on cyclooxygenase-1 and -2 activity and protein levels in human skeletal muscle // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. V. 305. № 1. P. R24.
Naruse M., Fountain W.A., Claiborne A. et al. Influence of low-dose aspirin, resistance exercise, and sex on human skeletal muscle PGE2 /COX pathway activity // Physiol. Rep. 2021. V. 9. № 5. P. e14790.
Gantner B.N., LaFond K.M., Bonini M.G. Nitric oxide in cellular adaptation and disease // Redox Biol. 2020. V. 34. P. 101550.
Eghbalzadeh K., Brixius K., Bloch W. et al. Skeletal muscle nitric oxide (NO) synthases and NO-signaling in “diabesity” – what about the relevance of exercise training interventions? // Nitric Oxide. 2014. V. 37. P. 28.
Gonzalez-Gil A.M., Elizondo-Montemayor L. The role of exercise in the interplay between myokines, hepatokines, osteokines, adipokines, and modulation of inflammation for energy substrate redistribution and fat mass loss: a review // Nutrients. 2020. V. 12. № 6. P. 1899.
Sharlo K., Tyganov S.A., Tomilovskaya E. et al. Effects of various muscle disuse states and countermeasures on muscle molecular signaling // Int. J. Mol. Sci. 2021. V. 23. № 1. P. 468.
Burtscher J., Millet G.P., Place N. et al. The muscle-brain axis and neurodegenerative diseases: the key role of mitochondria in exercise-induced neuroprotection // Int. J. Mol. Sci. 2021. V. 22. № 12. P. 6479.
Платонов В.Н. Утомление и восстановление при физических нагрузках как реакции адаптации / Адаптация в спорте. Киев: Здоров’я, 1983. С. 117.
Моногаров В. Генез утомления при напряженной мышечной деятельности // Наука в олимпийском спорте. 2019. № 4. С. 4.
Rudroff T., Kindred J.H., Ketelhut N.B. fatigue in multiple sclerosis: misconceptions and future research directions // Front. Neurol. 2016. V. 7. P. 122.
Солодков А.С. Особенности утомления и восстановления спортсменов // Ученые записки университета Лесгафта. 2013. № 6(100). С. 131.
Бодров В.А. Профессиональное утомление: фундаментальные и прикладные проблемы. М.: Изд-во “Когито-Центр”, 2009. 760 с.
Нагорный В.Э. Практические рекомендации по использованию средств физической культуры в целях активного воздействия на режим людей, занятых напряженным умственным трудом / Умственный труд и физическая культура. М.: Изд-во Московского университета, 1970. С. 58.
Любаев А.В. Влияние физических упражнений на умственную деятельность студентов и их взаимосвязь // Молодой ученый. 2015. № 18. С. 423.
Стародубцева И.В. Умственное и физическое воспитание: точки соприкосновения // Вестник Башкирского университета. 2008. № 1. С. 19.
Reynolds D., Nicolson R.I. Follow-up of an exercise-based treatment for children with reading difficulties // Dyslexia. 2007. V. 13. № 2. P. 78.
Милованова К.Г., Темпест Г., Буэль Ю. и др. Влияние дозированных физических усилий на эффективность когнитивной деятельности // Теория и практика физической культуры. 2016. № 10. С. 86.
Dijckmans B., Tortosa-Martínez J., Caus N. et al. Does the diurnal cycle of cortisol explain the relationship between physical performance and cognitive function in older adults? // Eur. Rev. Aging Phys. Act. 2017. V. 14. P. 6.
Кулеш А.А., Шестаков В.В. Сосудистые недементные когнитивные нарушения: диагноз, прогноз, лечение и профилактика // Неврология, нейропсихиатрия, психосоматика. 2017. Т. 9. № 3. С. 68.
Когнитивные расстройства у лиц пожилого и старческого возраста. Клинические рекомендации. Минздрав РФ. 2020. 240 с.
Программа профилактики, раннего выявления, диагностики и лечения когнитивных расстройств у лиц пожилого и старческого возраста: Методические рекомендации / Под ред. Ткачевой О.Н. М.: Прометей, 2019. 72 с.
Громова Д.О., Вахнина Н.В. Когнитивные нарушения у больных молодого и среднего возраста: диагностика и подходы к терапии // Эффективная фармакотерапия. 2017. № 31. С. 38.
Коррекция когнитивных нарушений у детей и подростков: Методические рекомендации / сост. Т.Т. Батышева и др. М.: ГБУЗ “Научно-практический центр детской психоневрологии Департамента здравоохранения г. Москвы”, 2016. 24 с.
Verschuren O., Ketelaar M., Gorter J.W. et al. Exercise training program in children and adolescents with cerebral palsy: a randomized controlled trial // Arch. Pediatr. Adolesc. Med. 2007. V. 161. № 11. P. 1075.
Быков А.Т., Маляренко Т.Н. Влияние физической активности на когнитивные возможности человека на этапе старения // Медицинский журн. 2016. № 2(56). С. 10.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека