Цитология, 2019, T. 61, № 10, стр. 845-852
Действие ресвератрола на митохондрии проростков гороха в стрессовых условиях. Данные атомно-силовой микроскопии и флуорометрии
В. И. Бинюков 1, И. В. Жигачева 1, Е. М. Миль 1, *, А. А. Албантова 1, И. П. Генерозова 2, **
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
2 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, Россия
* E-mail: elenamil2004@mail.ru
** E-mail: igenerozova@ipp.ras.ru
Поступила в редакцию 16.04.2019
После доработки 02.07.2019
Принята к публикации 03.07.2019
Аннотация
Методом атомно-силовой микроскопии (АСМ) и флуорометрии исследовали возможности использования природного полифенола ресвератрола в качестве адаптогена. Работу проводили на митохондриях проростков гороха (Pisum sativum L., сорт Флора 2). Защитные свойства препарата изучали, используя модели “старения” митохондрий и дефицита воды. Инкубация изолированных митохондрий в гипотонической среде (процесс старения) активировала перекисное окисление липидов (ПОЛ): интенсивность флуоресценции продуктов ПОЛ увеличивалась по сравнению с контролем и приводила к увеличению объема АСМ-имиджей митохондрий, что свидетельствовало о набухании органелл. Ресвератрол в концентрации 10−6 М снижал интенсивность флуоресценции продуктов ПОЛ почти до контрольных значений, а также предотвращал набухание митохондрий. В модели дефицита воды эксперименты проводили in vivo, при этом дефициту воды подвергали семена гороха, предварительно замоченные в воде или обработанные ресвератролом. Условия дефицита воды вызывали увеличение ПОЛ мембран митохондрий проростков гороха, приводили к набуханию митохондрий и торможению биогенеза этих органелл по сравнению с контролем. Обработка семян гороха ресвератролом (3 × 10−4 М) снижала количество набухших митохондрий по отношению к контролю и активировала биогенез этих органелл, а также нормализовала ПОЛ. Делается предположение, что защитный эффект исследуемого препарата обусловлен, в том числе, его антиоксидантными свойствами, а методы АСМ и флуорометрии могут быть использованы для скрининга протекторных свойств биологически активных веществ.
Энергетический метаболизм играет важную роль в адаптации организма к изменяющимся факторам внешней среды. При этом митохондрии играют одну из главных ролей в адаптации организма к стрессовым условиям. Они представляют собой динамичные структуры, которые в большинстве клеток способны менять свою морфологию, локализацию, количество и размер в зависимости от ее энергетических потребностей и метаболического состояния (Mannella, 2006; Soubannier, McBride, 2009). Стрессовые воздействия, такие как дефицит воды, температурный стресс и др., смещают антиоксидантно-прооксидантное равновесие в сторону увеличения содержания активных форм кислорода в клетке (АФК). При этом митохондрии являются как источником, так и мишенью для АФК (Зоров и др., 2007). Взаимодействие АФК с полиненасыщенными жирными кислотами, входящими в состав липидов мембран, приводит к активации перекисного окисления липидов (ПОЛ). Весьма важным морфологическим признаком повреждения митохондрий является их набухание. Увеличение объема (набухание) матрикса митохондрий и разрыв наружной мембраны под действием давления со стороны внутренней мембраны обусловлены увеличением ионной проницаемости внутренней мембраны, что, вероятно, обусловлено пероксидацией липидов мембран. В результате набухания и высвобождения ряда апоптогенных белков из межмембранного пространства митохондрий в цитоплазму, возможна также активация апоптоза. Можно полагать, что антиоксиданты, снижая интенсивность ПОЛ, могут играть роль адаптогенов, предупреждая дисфункцию митохондрий в стрессовых ситуациях.
Ранее нами было показано, что обработка семян гороха антиоксидантами, а также стимуляторами роста растений, обладающими антиоксидантными свойствами, предотвращает морфологичекие изменения митохондрий (Миль и др., 2013; Zhigacheva et al., 2016). В настоящей работе в качестве объекта исследования был выбран природный антиоксидант ресвератрол (3,5,4'-тригидроксистилбен) – полифенол со структурой стильбена (рис. 1). Его основная структура состоит из двух фенольных колец, связанных между собой двойной стирольной связью, которая образует 3,5,4'-тригидроксистилбен (молекулярная масса 228.25 г/моль). Эта двойная связь отвечает за изометрические цис- и транс-формы ресвератрола. Стоит отметить, что транс-изомер является наиболее стабильным со стерической точки зрения (Trela, Waterhouse, 1996). Ресвератрол, как и другие полифенолы, способен захватывать пероксильные радикалы и образовывать комплексы с металлами (Cu, Fe, и др.) (Frankel et al., 1993; Belguendouz et al., 1998; Rotond et al. 1998; Gambini et al., 2015).
В животных клетках ресвератрол предупреждает агрегацию тромбоцитов и обладает антиоксидантной и противоопухолевой активностью. Растения, содержащие ресвератрол, эффективно используются в народной медицине более 2000 лет. Ресвератрол – это фитоалексин. Накопление этих веществ в растениях делает их устойчивыми к паразитам и другим неблагоприятным условиям, таким как грибковая инфекция, ультрафиолетовое излучение, химические вещества и стрессовые факторы для растения в целом (Adrian et al., 1997; Jeandet et al., 2002).
В настоящей работе исследовали действие антиоксиданта ресвератрола на митохондрии из проростков гороха при стрессовых воздействиях на моделях “старения” митохондрий в условиях гипотонии и при дефиците воды.
Гипотония митохондрий приводит к их набуханию и избыточной продукции АФК, что запускает ПОЛ и приводит к нарушению биоэнергетических функций (Тодоров, 2007). Таким образом, этот процесс моделирует эффект “старения” митохондрий по свободно-радикальному механизму, и эта модель полезна при исследовании биологически активных соединений (Жигачева и др., 2011). Эксперименты с действием гипотонии проводили in vitro на изолированных митохондриях, выделенных из этиолированных проростков гороха, используя методы флуорометрии и атомно-силовой микроскопии (АСМ). В то же время эксперименты с дефицитом воды проводили in vivo, используя обработку семян ресвератролом и изучая митохондрии проростков гороха теми же методами. Так как ресвератрол обладает низкой биодоступностью, которая может снизить его эффективность, его антистрессовые свойства исследовали, предварительно замачивая семена в водных растворах препарата, что обеспечивало его поступление к клеткам зародыша.
МАТЕРИАЛ И МЕТОДИКА
Выделение митохондрий из эпикотилей этиолированных проростков гороха (20–25 г) проводили методом дифференциального центрифугирования. После гомогенизации проростков в среде, содержащей 0.4 М сахарозы, 5 мМ ЭДТА, 20 мМ КН2РO4 (pH 7.4), 10 мМ KCL, 2 мМ дитиотриэтола и 0.1% бычьего сывороточного альбумина (БСА), смесь центрифугировали один раз при 25 000 g в течение 5 мин и второй раз после ресуспендирования осадка при 3000 g в течение 3 мин. Затем осаждали митохондрии из супернатанта центрифугированием в течение 10 мин при 11 000 g. Осадок ресуспендировали в 2–3 мл среды, содержащей 0.4 М сахарозы, 20 мМ КН2РO4 (pH 7.4), 0.1% БСА (свободный от жирных кислот) и вновь осаждали митохондрии при 11 000 g в течение 10 мин (Попов и др., 2003). Все эксперименты с проростками и митохондриями в условиях in vivo и in vi-tro проводили в весенний период.
Изолированные митохондрии в условиях гипотонии. Митохондрии проростков гороха помещали в гипотоническую среду (0.2 М сахарозы, 1 мМ КН2РO4) на 2 с для контрольной группы (чтобы исключить влияние только набухания) и на 20 мин для экспериментальной группы для активации процессов ПОЛ (старения митохондрий). Затем митохондрии обеих групп переносили в среду нормальной тоничности (0.4 М сахарозы, 20 мМ КН2РO4 pH 7.4). Ресвератрол в концентрации 10−6 или 10−4 М добавляли к митохондриям, выдерживали в гипотонической среде 20 мин и затем переводили в среду нормальной тоничности. Эксперимент проводили дважды. Контрольные и экспериментальные митохондрии разделяли на четыре подгруппы. Все процедуры с ними проводили параллельно.
Дефицит воды в эксперименте in vivo. Семена гороха сорта Флора 2 разделяли на три группы: 1) контроль, 2) дефицит воды и 3) ресвератрол и дефицит воды. Семена группы 1 и 2 замачивали на 1 ч в воде, а семена группы 3 – в растворе ресвератрола в концентрации 3 × 10−4 М, учитывая низкую биодоступность препарата. Все три группы переносили на влажную фильтровальную бумагу в закрытые кюветы, где они находились в темноте в течение 1 сут. Затем семена контрольной группы 1 доращивали на влажной фильтровальной бумаге в течение 4 сут. Для создания условий дефицита воды две группы (2 и 3) на 2 сут переносили на сухую фильтровальную бумагу, а затем на 2 сут помещали на влажную фильтровальную бумагу. На 5-е сут проростания семян выделяли митохондрии из эпикотилей проростков всех исследуемых групп. Эксперименты с проростками проводили два раза, причем указанные три группы разделялись на 4 параллельные подгруппы.
Уровень ПОЛ оценивали флуоресцентным методом. В результате процесса ПОЛ образуются продукты, токсические для клеток растений и животных: альдегиды и 4-гидрокси-2,3-ноненали. Альдегиды (в частности малоновый диальдегид) реагируют с аминогруппами с образованием оснований Шиффа (длина волны возбуждения 360 нм, испускания – 440–480 нм) (Fletcher et.al., 1973). Липиды экстрагировали из митохондрий смесью хлороформа и метанола (соотношение 2 : 1 по объему при 10°С), затем добавляли равный объем дистиллированной воды для удаления флавиновых компонентов (с максимумом флуоресценции в области 520 нм). Центрифугировали 5 мин при 600 g. Отбирали 3 мл нижнего (хлороформного) слоя и добавляли 0.3 мл метанола. Регистрацию флуоресценции проводили на спектрофлуориметре FluoroMax-HoribaYvonGmbH (Германия). Длина вол-ны возбуждения флуоресценции – 360 нм, испускания – 420–470 нм. Интенсивность флуоресценции вторичных продуктов ПОЛ выражали в усл. ед. на 1 мг белка.
АСМ митохондрий. Митохондрий фиксировали 2%-ным глутаровым альдегидом в течении 20 мин. Затем их трижды отмывали бидистиллированной водой с последующим центрифугированием. Полученные митохондрии суспендировали в малом объеме, наносили на кварцевую полированную подложку и подсушивали на воздухе. Для каждого варианта эксперимента готовили 4–5 образцов. Регистрировали АСМ имиджи на приборе Solver P47 SMENA. Использовали кантилевер NSG11 с радиусом кривизны 10 нм в полуконтактном режиме на частоте 150 кГц (Бинюков и др., 2012). Сканирование (10 × × 10 мкм) проводили на 8–12 участках подложки. Обработку результатов проводили с использованием программы Image Analysis. После суммирования полученных данных их обрабатывали с помощью Sta-tistica 6.
Совокупность данных объемов АСМ имиджей митохондрий анализировали путем сравнения кумулятивных функций экспериментальных и теоретических логнормальных распределений и разделяли на несколько выборок в соответствии с их функциями распределения для определения средних значений объемов. Логнормальные распределения каждой выборки объемов имиджей митохондрий (не менее 100) имели хорошее соответствие экспериментальных и теоретических кумулятивных функций на графиках вероятность–вероятность.
Использовали следующие реактивы: БСА (свободный от жирных кислот), глутаровый альдегид (Sigma, США), сахароза, Трис, хлороформ (Merck, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
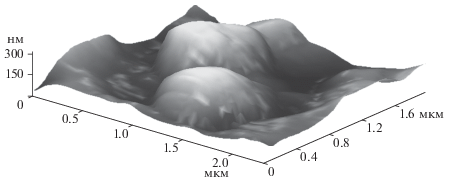
В эксперименте in vitro проведенном на изолированных митохондриях были получены данные по объемам АСМ-имиджей митохондрий, инкубированных в различных средах. На рис. 2 и 3 представлены типичные АСМ-имиджи для митохондрий в контроле (рис. 2а, рис. 3), в гипотонической среде (рис. 2б) и в присутствии ресвератрола в гипотонической среде (рис. 2в, г).
Рис. 2.
Двумерные АСМ-изображения митохондрий проростков гороха в экспериментах in vitro после инкубации в разных средах. а – В контрольной среде (0.4 М сахарозы и 20 мМ KH2PO4); б – в условиях гипотонии (0.2 М сахарозы и 1 мМ KH2-PO4); в, г – в условиях гипотонии в присутствии ресвератрола в концентрации 10−6 и 10−4 М соответственно. Справа – шкала по оси Z.

В образцах митохондрий проростков гороха были выявлены митохондрии, отличающиеся по объему АСМ-имиджа. Форма митохондрий была близка к сферической, за исключением митохондрий, находяшихся в процессе митохондриогенеза – деления митохондрий. На основании статистических данных выборок объемов АСМ-имиджей митохондрий со свойственными им функциями распределения, они были разделены на три основные группы (субпопуляции): большого, среднего и малого размера. В эксперименте с изменением осмотической активности среды регистрировали изменение объема АСМ-имиджей митохондрий в нескольких субпопуляциях (рис. 4). В гипотонической среде было зарегистрировано увеличение объема имиджей митохондрий в 1.4 раза по сравнению с контролем для субпопуляций средних (рис. 4а) и крупных (рис. 4б) митохондрий, а объем имиджей маленьких митохондрий изменялся разнонаправлено.
Рис. 4.
Изменение среднего объема АСМ-изображения митохондрий разных субпопуляций. а – Средние, б – большие, в – маленькие. Условия эксперимента in vitro: 1 – гипотония; 2 – контроль; 3, 4 – ресвератрол (в условиях гипотонии) в концентрации соответственно 10−6 и 10−4 М. Объем (V) указан в мкм3 ×103. Вертикальные отрезки – 95%-ный доверительный интервал.
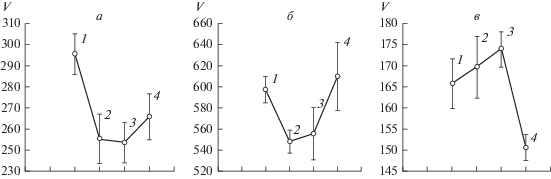
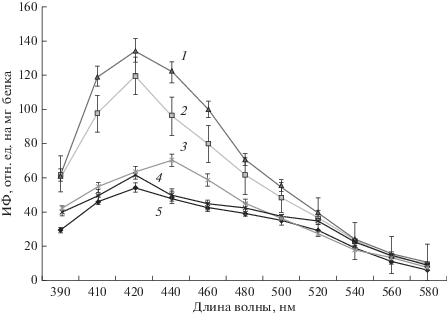
Обработка митохондрий ресвератролом (10–6 М) в условиях старения приводила к снижению набухания (рис. 4а, 4б), а также предотвращала активацию флуоресценции продуктов окисления экстрагированных липидов (ПОЛ) по сравнению с контролем (рис. 5, кривые 3, 4). Однако ресвератрол в большей концентрации (10−4 М) не влиял на набухание митохондрий в гипотонической среде и, по-видимому, не предотвращал активацию ПОЛ. Это согласуется с данными о том, что ресвератрол в большой концентрации способен оказывать прооксидантное действие. Действительно, как видно на рис. 5, ресвератрол в концентрации 10−3 М активирует ПОЛ, т.е. проявляет прооксидантный эффект (рис. 5, кривая 1), а в меньшей концентрации (10−6 и 10−9 М) ингибирует ПОЛ, т.е. действует как антиоксидант (рис. 5, кривые 3, 4).
Рис. 5.
Спектры флуоресценции продуктов ПОЛ (оснований Шиффа) митохондрий проростков гороха, находящихся в различных условиях. Эксперимент in vitro. Кривые: 1 – ресвератрол 10−3 М; 2 – гипотония; 3, 4 – ресвератрол 10−6 и 10−9 М соответственно (в условиях гипотонии), 5 –контроль. ИФ – интенсивность флуоресценции.
Таким образом, при старении митохондрий в гипотоничекой среде в эксперименте in vitro обнаружено увеличение объемов митохондрий, а при воздействии ресвератрола (10−6 М) в условиях гипотонии набухания органелл не было и предотвращалась активация ПОЛ.
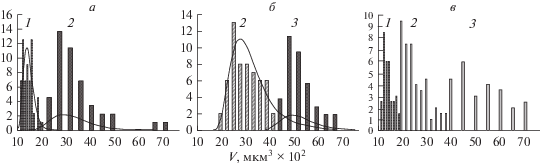
Для определения механизма возможного влияния антиоксиданта на состояние митохондрий в условиях дефицита воды, моделирующих засуху растений, были проведены эксперименты in vivo, в которых семена гороха предварительно обрабатывались ресвератролом. Анализ АСМ-имиджей митохондрий в этих условиях эксперимента обнаружил несколько субпопуляций митохондрий с логнормальным распределением их объема (гистограммы на рис. 6а–в),
Рис. 6.
Гистограммы распределения среднего объема АСМ-изображения маленьких (1), средних (2) и больших (3) митохондрий в эксперименте in vivo (при различных условиях воздействия на семена и проростки гороха). а – Контроль, б – дефицит воды, в – дефицит воды и обработка ресвератролом (3 × 10–4M). По оси X – средний объем АСМ-изображения, по оси Y – число митохондрий в заданном интервале объема.
Отдельные суперкрупные или сверхмелкие АСМ-имиджи митохондрий не учитывали. Средний объем (V) имиджей субпопуляций митохондрий и процентное содержание каждой фракции по отношению ко всей популяции митохондрий в разных условиях проведения эксперимента показаны на диаграмме (рис. 7).
Рис. 7.
Диаграмма среднего объема АСМ-изображения разных субпопуляций митохондрий в эксперименте in vivo: в контроле, при дефицит воды и в условиях дефицита воды и обработки ресвератролом (3 × 10–4 M). Указано среднее значение объема (V) АСМ-изображения (внизу) и процентное содержание (вверху).
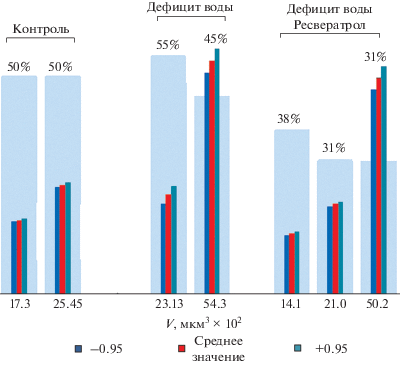
В контрольной группе наблюдали, в основном, АСМ-имиджи митохондрий малого (V = 0.17 ± ± 0.03 мкм3) и среднего (V = 0.25 ± 0.03 мкм3) размера в равных количествах (приблизительно по 50%), а также небольшое количество крупных митохондрий. В условиях дефицита воды объем имиджей митохондрий значительно отличался от контроля (рис. 7). Были обнаружены митохондрии среднего (V = 0.23 ± 0.03 мкм3, 55%) и крупного (V = 0.54 ± ± 0.03 мкм3; 45%) размера, в то время как маленькие митохондрии отсутствовали. Вероятно, это связано с торможением процесса биогенеза митохондрий в условиях стресса (Rurek et al., 2018). Предварительная обработка семян гороха ресвератролом в концентрации 3 × 10−4 М в условиях дефицита воды приводила к изменению распределения основных субпопуляций митохондрий: доля крупных митохондрий уменьшалось на 15, а средних – на 24%, и появлялась фракция (38%) маленьких митохондрий (V = 0.14 ± 0.03 мкм3), что, вероятно, свидетельствует об активации биогенеза митохондрий.
Как было показано ранее, защитный эффект ресвератрола обусловлен рядом воздействий. Как известно, этот препарат влияет на активность и работу нескольких генов, в том числе генов антиоксидантной защиты, вызывая индукцию марганцевой супероксиддисмутазы, а с другой стороны, он оказывает прямое воздействие на комплексы I–III дыхательной цепи митохондрий и усиливает биогенез митохондрий (Robb et al., 2008; Moreira et al., 2013). В то же время, защитный эффект ресвератрола, по-видимому, связан также с его антиоксидантными свойствами и стабилизацией липидов мембраны митохондрий.
Действительно, обработка семян гороха ресвератролом в условиях дефицита воды снижала более чем в 2 раза активацию ПОЛ, обусловленную, в том числе, образованием АФК в мембранах митохондрий. Так, интенсивность флуоресценции третичных продуктов ПОЛ (шиффовых оснований) на 1 мг белка в контроле (максимум при 420 нм) составляла 40, при дефиците воды – 130, а при обработке семян гороха ресвератролом в условиях дефицита воды – 60 отн. ед. Эти данные согласуются с полученными нами ранее результатами по влиянию дефицита воды на семена и проростки гороха и защитным действием синтетического антиоксиданта фенозана калия на интенсивность ПОЛ в мембранах митохондрий (Zhigacheva et al., 2016).
Считается, что митохондрии являются динамичными структурами, претерпевающими изменение формы и объема, Нами показано, что в исследуемых клетках проростков гороха существует несколько популяций митохондрий разного объема, которые могут находиться в различных функциональных состояниях. Изменение соотношения разных субпопуляций митохондрий в клетке в ответ на обработку ресвератролом, возможно, имеет значение для адаптации растений к действию стрессовых факторов. Можно предположить, что протекторный эффект ресвератрола связан также с антиоксидантной активностью препарата. Ресвератрол, предотвращая пероксидацию фосфолипидов мембран митохондрий, обеспечивает сохранение функционального состояния этих органелл, что проявляется в сохранении биогенеза митохондрий в условиях стресса, и, по-видимому, способствует активации энергетического метаболизма. Полученные данные свидетельствуют о возможности использования ресвератрола в интервале 10−6–10−9 М в качестве адаптогена, а метод АСМ может быть использован для скрининга протекторных свойств биологически активных веществ.
Список литературы
Бинюков В.И., Миль Е.М., Жигачева И.В., Албантова А.А., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г., Коновалов А.И. 2012. Недостаточное увлажнение и мелафен изменяют морфологию митохондрий проростков гороха. ДАН. 446(2) : 222–225. (Binyukov V.I., Mil E.M., Zhigacheva I.V., Albantova A.A., Generozova I.P., Shugaev A.G., Fattakhov S.G., Konovalov A.I. 2012. Water deficite and melaphen alter the morphology of the mitochondria of pea seedlings. Doklady Biochem. Biophys. 446(2) : 222–225.)
Жигачева И.В., Мишарина Т.А., Тренина М.Б., Крикунова Н.Н., Бурлакова Е.Б., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г., Коновалов А.И. 2011. Жирнокислотный состав мембран митохондрий проростков гороха в условиях недостаточного увлажнении и умеренного охлаждения. ДАН. 437(4) : 124–126. (Zhigacheva I.V., Misharina T.A., Terenina M.B., Krikunova N.N., Burlakova E.B., Generozova I.P., Shugaev A.G. Fattakhov S.G., Konovalov I. 2011. Fatty acid composition of mitochondrial membranes of pea seedlings in conditions of insufficient moisture and moderate cooling. Doklady Biochem. Biophys. 437(4) : 124–126.)
Зоров Д.Б., Исаев Н.К., Плотников Е.Ю., Зорова Л.Д., Стельмашук Е.В., Васильева А.К., Архангельская А.А., Хряпенкова Т.Г. 2007. Митохондрия как многоликий янус. Биохимия. 72(10) : 1371–1384. (Zorov D.B., Isaev N.K., Plotnikov E.Yu., Zorova L.D., Stelmashuk E.V., Vasilyeva A.K., Arkhangelskaya A.A., Khryapenkova T.G. 2007. Mitochondria as a multifaceted Janus. Biochemistry (Moscow). 72(10) : 1371–1384.)
Миль Е.М., Бинюков В.И., Жигачева И.В., Албантова A.А., Фаттахов С.Г., Коновалов А.И., Заиков Г.Е. 2013. Изучение влияния мелафена на митохондрии проростков гороха при стрессовых воздействиях методом АСМ. Вестник Казанского технол. университета. 3 : 141–145. (Mil E.E., Binyukov V.I., Zhigacheva I.V., Albantova A.A., Fattakhov S.G. Konovalov A.I., Zaikov G.E. 2013. Studying the effect of melafen on pea seedlings mitochondria under stress effects using the AFM method. Bull. Kazan Technol. University. 3 : 141–145.)
Попов В.Н., Рууге Э.К., Старков А.А. 2003. Влияние ингибиторов электронного транспорта на образование активных форм кислорода при окислении сукцината. Биохимия. 68(7) : 910–916. (Popov V.N., Ruuge E.K., Starkov A.A. 2003. Effect of electron transport inhibitors on the formation of reactive oxygen species during the oxidation of succinate. Biochemistry (Moscow). 68(7) : 910–916.)
Тодоров И.Н. 2007. Митохондрии: окислительный стресс и мутации митохондриальной ДНК в развитии патологий, процессе старения и апоптозе. Рос. хим. журн. 51(1) : 93–106. (Todorov I.N. 2007. Mitochondria: oxidative stress and mutations in mitochondrial DNA in the development of pathologies, aging and apoptosis. Russian Chem. J. 51(1) : 93–106.)
Adrian M., Jeandet P., Veneau J., Weston L.A., Bessis R. 1997. Biological activity of resveratrol a stilbenic compound from grapevines, against Botrytis cinerea, the causal agent for gray mold. J. Chem. Ecol. 23 : 1689–1702.
Belguendouz L., Fremont L., Gozzelino M.T. 1998. Interaction of transresveratrol with plasma lipoproteins. Biochem. Pharmacol. 55 : 811–816.)
Fletcher B.I., Dillard C.D., Tappel A.L. 1973. Measurement of fluorescent lipidperoxidation products in biological systems and tissues. Anal. Biochem. 52 : 1–99.
Frankel E.N., Waterhouse A.L., Kinsella J.E. 1993. Inhibition of human LDL oxidation by resveratrol. Lancet. 341 : 1103–1104.
Gambini J., Inglés M., Olaso G., Lopez-Grueso R., Bonet-Costa V., Gimeno-Mallench L., Mas-Bargues C., Abdelaziz K.M., Gomez-Cabrera M.C., Vina J., Borras C. 2015. Properties of resveratrol: In vitro and in vivo studies about metabolism, bioavailability, and biological effects in animal models and humans. Oxidative Med. Cell. Longevity. 6 : 1–13.
Gutteridge J.M.C. Lipid Peroxidation and antioxidants as biomarkers of tissue damage. Clin. Chem. 1995. 41 : 1819–1828 .
Jeandet P., Douillet-Breuil A.C., Bessis R., Debord S., Sbaghi M., Adrian M. 2002. Phytoalexins from the vitacea: Biosynthesis, phytoalexin gene expression in transgenic plants, antifungalactivity, and metabolism. J. Agricul. Food Chem. 50 : 2731–2741.
Mannella C.A. 2006. The relevance of mitochondrial membrane topology to mitochondrial function. Biochem. Biophys. Acta. 1762 : 140–147.
Moreira C., Silva A.M., Santos M.S., Sardao V.A. 2013. Resveratrol affects differently rat liver and brain mitochondrial bioenergetics and oxidative stress in vitro: Investigation of the role of gender. Food Chem.Toxicol. 53: 18–26.
Robb E.L., Page M.M., Wiens B.E., Stuart J.A. 2008. Molecular mechanismsof oxidative stress resistance induced by resveratrol: Specific and progressive induction of MnSOD. Biochem. Biophys. Res. Commun. 367 : 406–412.
Rotond S., Rajtar G., Manarini S., Celardo A., Rotillo D., de Gaetano G., Evangelista V., Cerletti C. 1998. Effect of trans-resveratrol, a natural polyphenolic compound, on human polymorphonuclear leukocyte function. Br. J. Pharmacol. 23 : 1691–1699.
Rurek M., Czołpińska M., Andrzej T., Pawłowski A., Staszak M., Nowak W., Krzesiński W., Spiżewski T. 2018. Mitochondrial biogenesis in diverse cauliflower cultivars under mild and severe drought impaired coordination of selected transcript and proteomic responses, and regulation of various multifunctional proteins. Int. J. Mol. Scie. 19 : 1130–1182.
Soubannier V., McBride H.M. 2009. Positioning mitochondrial plasticity within cellular signaling cascades. Biochim. Biophys. Acta. 1793 : 154–170.
Trela B.C., Waterhouse A.L. 1996. Resveratrol: Isomeric molar absorptivities and stability. J. Agricul. Food Chem. 44 : 1253–1257.
Zhigacheva I., Binyukov V., Mil E. 2016. Partial loss of cytochrome C by mitochondria of pea seedlings under conditions of water scarcity. Int. J. Sci. Res. Sci. Eng. Technol. 2 : 369–376.
Дополнительные материалы отсутствуют.