Цитология, 2019, T. 61, № 10, стр. 806-816
Чувствительность культивируемых нейральных стволовых клеток мыши к действию ионизирующего излучения
Г. А. Посыпанова 1, М. Г. Ратушняк 1, Ю. П. Семочкина 1, А. А. Абишева 1, Е. Ю. Москалева 1, *
1 НИЦ “Курчатовский институт”
123182 Москва, Россия
* E-mail: Moskaleva_EY@nrcki.ru
Поступила в редакцию 08.05.2019
После доработки 19.06.2019
Принята к публикации 21.06.2019
Аннотация
Из головного мозга мышей получена культура нейральных стволовых нейральных/прогениторных клеток (НСК/НПК). Гамма-облучение НСК/НПК в дозе 0.1 Гр не вызывало изменений ни клеточного циклa, ни уровня апоптоза, ни выживаемости клеток. Снижение клоногенной активности НСК/НПК на 50% наблюдали после облучения в дозе 1.2 Гр. Облучение НСК/НСП в дозе 1–4 Гр через 6 ч блокировало клеточный цикл на границе фаз G2/М, а через 24 ч вызывало уже длительный (до 72 ч) блок на границе G0/G1 и длительное повышение уровня апоптоза. Обнаружено пропорциональное дозе образование двунитевых разрывов (ДР) ДНК, регистрируемых по уровню гистона γН2АХ через 1 ч после облучения в дозе 0.1–4 Гр и их медленная репарация после облучения в диапазоне малых (0.1 Гр) и низких (1 Гр) доз, которая завершалась только через 48 ч после облучения. После облучения в дозах 1 и 2 Гр выжившие НСК/НСП сохраняли способность к дифференцировке в нейроны и астроциты. Образование нейронов снижалось на 70%, а астроцитов – на 48% после облучения НСК/НСП в дозе 4 Гр, что свидетельствует о более высокой радиочувствительности нейрогенеза по сравнению с образованием астроцитов. Одной из причин высокой радиочувствительности НСК/НСП мыши может быть медленная репарация ДР-ДНК.
Нейральные стволовые клетки (НСК) – самоподдерживающаяся популяция клеток, которые при дифференцировке способны давать нейроны, астроциты и олигодендроциты в развивающемся и взрослом мозге, а также в культуре клеток. В переднем мозге млекопитающих активный нейрогенез идет в субвентрикулярной зоне, примыкающей к боковым желудочкам, и в субгранулярной зоне зубчатой извилины в гиппокампе. В этих участках мозга обнаружены мультипотентные НСК и коммитированные к дифференцировке быстро пролиферирующие нейральные прогениторные клетки (НПК), которые постепенно мигрируют и дифференцируются в нейроны и клетки глии – астроциты и олигодендроциты (Gonçalves et al., 2016).
Чувствительность НСК и НПК к разным токсическим воздействиям стала объектом пристального изучения в связи с их важной ролью в процессах регенерации мозга. Показано, что повреждение этих клеток при лучевой и химиотерапии опухолей является одной из причин развития когнитивных нарушений у больных в отдаленный период после этих воздействий. В экспериментальных исследованиях, посвященных изучению закономерностей развития отдаленных последствий повреждений мозга, общепризнанными модельными объектами стали мыши и крысы (Yang et al., 2017), а также клеточные модели с использованием культур, полученных из головного мозга этих животных (Fike et al., 2009). Такие культуры содержат как относительно медленно пролиферирующие самообновляющиеся собственно НСК, так и ранние быстро пролиферирующие НПК, поэтому их обозначают как культуры НСК/НПК.
Результаты, полученные в радиобиологических исследованиях конца 1990-х – начала двухтысячных гг., позволили сформулировать основные представления о высокой радиочувствительности нейрогенеза (Fike et al., 2009). Однако хотя культивируемые НСК/НПК, полученные из головного мозга мыши, являются одной из активно используемых моделей в исследовании механизмов повреждающего действия излучения на ЦНС, подробная характеристика радиочувствительности этих клеток, их способности к репарации ДНК и способности выживших после облучения клеток к дифференцировке, остается неизученной.
В связи с этим цель настоящей работы заключалась в исследовании радиочувствительности культивируемых НСК/НПК мыши, их способности к репарации индуцированных облучением двунитевых разрывов (ДР) ДНК и способности выживших после облучения клеток к дифференцировке в нейроны и астроциты.
МАТЕРИАЛ И МЕТОДИКА
Материалы и реактивы. Культуральные среды DMEM/F12, Advanced DMEM/F12 и Neurobasal A, раствор аккутазы, бессывороточная добавка B27, факторы EGF и bFGF, покрытие для стекол Geltrex™ Reduced Growth Factor Basement Membrane Matrix (все от Thermo Fisher Scientific, США), фетальная бычья сыворотка (HyClone, США), гепарин (НПЦ ЭЛЬФА, Россия). Мышиные моноклональные антитела: к нестину, конъюгированные с Alexa Fluor 488; к маркеру предшественников олигодендроцитов NG2, конъюгированные с Alexa Fluor 488; к γН2АХ не конъюгированные (Merk Milliporе, США); к γH2AX, конъюгированные с Alexa Fluor 488 (BD Pharmingen, США); к β-тубулину III (клон TUJ1), конъюгированные с Alexa Fluor 488 и антитела козы, конъюгированные с Alexa Fluor 488 (BioLegend, США); к глиальному фибриллярному кислому белку GFAP, конъюгированные с аллофикоцианином (APC) и к маркеру зрелых олигодендроцитов О4, конъюгированные с APC (Miltenyi Biotec, Германия); к глиальному фибриллярному кислому протеину GFAP, конъюгированные с Cy3 (Abcam, США). Культуральные пластиковые флаконы и платы (Corning, США), 96-луночные планшеты для суспензионных культур (Eppendorf, Германия). Йодистый пропидий, тритон Х-100, ЭДТА, рибонуклеаза А, краситель 4',6-диамино-2-фенилиндол (DAPI), бычий сывороточный альбумин (BSA), фосфатно-солевой буферный раствор (PBS) (Sigma, США), мовиол (Calbiochem, США).
Выделение и культивирование НСК/НПК. Эксперименты с животными проводили в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (Приказ МЗ СССР № 755 от 12.08.1977) и требованиями этического комитета НИЦ “Курчатовский институт” по вопросам биомедицинских исследований. Клетки выделяли из головного мозга неонатальных мышат линии C57BL/6 в стерильных условиях, как описано ранее (Посыпанова и др., 2018) с некоторыми модификациями. Животных умерщвляли путем цервикальной дислокации. Головной мозг измельчали после удаления обонятельных долей, обрабатывали активированным папаином; выделенные клетки отмывали средой DMEM/F12, ресуспендировали, считали, переносили в культуральные планшеты или бактериальные чашки Петри в культуральной среде следующего состава (Посыпанова и соавт., 2018): DMEM/F12, содержащей 2.4 мг/мл NaHCO3, 0.6% глюкозы, 0.5 мМ Hepes, 60 нг/мл прогестерона, 9.6 мкг/мл путресцина, 4.2 мкг/мл инсулина, 3.8 мкг/мл трансферрина, 1 мкг/мл селенита натрия, 1.8 мкг/мл гепарина (все от Sigma-Aldrich, США), факторы роста EGF (20 нг/мл) и bFGF (10 нг/мл) (PeproTech, Великобритания), 2% бессывороточной добавки В27 (Life Technologies, США) и культивировали в СО2-инкубаторе при 37°С в увлажненной атмосфере, содержащей 5% СО2. Через 5–7 сут культивирования сформировавшиеся нейросферы размером 150–200 мкм ресуспендировали в растворе аккутазы, считали и рассевали в культуральную среду при плотности 10–20 кл./мкл. После 8-ого пассажа клетки культивировали в среде состава Neurobasal A + Advanced DMEM/F12 (1 : 1), содержащей 2% добавки B27, 20 нг/мл EGF, 10 нг/мл bFGF и 2 нг/мл гепарина.
Фенотипирование НСК/НПК. Для фенотипирования выделенных клеток использовали моноклональные антитела к нестину, конъюгированные с A-lexa Fluor 488; к β-тубулину III (клон TUJ1), конъюгированные с Alexa Fluor 488; к глиальному фибриллярному кислому белку GFAP, конъюгированные с APC; к маркеру зрелых олигодендроцитов О4, конъюгированные с APC; к маркеру предшественников олигодендроцитов NG2, конъюгированные с Alexa Fluor 488. Антителами, за исключением О4, окрашивали фиксированные клетки. НСК/НПК фиксировали в суспензии 2%-ным параформальдегидом в течение 30 мин при комнатной температуре, после чего отмывали PBS. Для анализа поверхностных антигенов НСК инкубировали с соответствующими антителами в PBS, содержащем 0.2% БСА в течение 1 ч. Прижизненное окрашивание клеток антителами к О4 проводили также в суспензии при 4°С в течение 15 мин. Далее клетки трижды отмывали PBS, содержащим 0.2% БСА, ресуспендировали в том же буфере и анализировали флуоресценцию на проточном цитофлуориметре BD FACSCalibur (BD Biosciences, США), оснащенном аргоновым лазером с длиной волны 488 нм и красным полупроводниковым лазером с длиной волны 635 нм (Ресурсный центр клеточной и молекулярной биологии НИЦ Курчатовский институт). В каждом образце анализировали 104 клеток с использованием программы CellQuestPro (BD Biosciences, США). Для окрашивания клеток антителами к внутриклеточным антигенам клетки после фиксации пермеабилизировали 0.3%-ным раствором тритона Х-100 в PBS, содержащем 2% обезжиренного БСА, в течение 60 мин при комнатной температуре. Антитела добавляли к пермеабилизованным клеткам в том же PBS и инкубировали при комнатной температуре в течение 1 ч. Далее клетки трижды отмывали PBS, содержащим 0.1% тритона и 2% БСА, осадок клеток ресуспендировали в PBS, содержащем 0.2% БСА, и анализировали флуоресценцию клеток на проточном цитофлуориметре BD FACSCalibur (BD Biosciences, США).
Облучение клеток. Клетки облучали на установке ГУТ-200М (кобальт-60) при мощности дозы 0.75 Гр/мин при комнатной температуре в культуральной среде в дозах 0.1, 1, 2 и 4 Гр. Клетки облучали либо в суспензии в плотно закрытых пробирках, либо в монослое на покровных стеклах, предварительно покрытых раствором Geltrex, в 24-луночных культуральных планшетах. Для поддержания температуры 37°С использовали термоэлементы. После облучения клетки из суспензии считали и рассевали по планшетам; клеткам в планшетах меняли среду, после чего инкубировали в СО2-инкубаторе необходимое время.
Исследование клоногенной активности НСК/НПК после облучения. Клоногенную активность НСК/НПК оценивали по формированию нейросфер. Для этого клетки высевали в 96-луночные планшеты для суспензионных культур в плотности для клонирования – 1 кл./мкл или 100 клеток на 1 лунку для контрольных клеток и клеток, облученных в дозе 0.1 Гр. После облучения в дозах 1, 2 и 4 Гр клетки рассевали по 150, 400 и 600 клеток на 1 лунку соответственно в 6 параллелях для каждой дозы. Через 7 сут считали количество сформировавшихся нейросфер с помощью инвертированного микроскопа TS-100 (Nikon, Япония) при увеличении 40×. Эффективность клонирования рассчитывали как отношение числа образовавшихся нейросфер к исходному числу клеток и выражали в процентах.
Анализ уровня апоптоза и распределения клеток по фазам клеточного цикла проводили с помощью проточной цитофлуориметрии после окрашивания ДНК клеток йодистым пропидием. Контрольные клетки и клетки после облучения собирали, промывали PBS, фиксировали 70%-ным этанолом при 4°С в течение 1ч, используя 1 мл раствора этанола на 106 клеток и хранили до исследования при –20°С в этом же фиксирующем растворе. Фиксированные клетки осаждали центрифугированием при 700 g, промывали PBS, ресуспендировали в концентрации 1 × 106 кл./мл в растворе для окрашивания ДНК (PBS pH 7.4, содержащий 0.1% тритона Х-100, 0.1 моль/л ЭДТА, 0.05 мг/мл рибонуклеазы А, 50 мкг/мл йодистого пропидия) и инкубировали 1 ч при комнатной температуре. Исходный раствор рибонуклеазы А предварительно кипятили на водяной бане в течение 10 мин для удаления возможной примеси дезоксирибонуклеаз. Анализ распределения клеток по фазам клеточного цикла и клеток, находящихся в состоянии апоптоза, проводили с помощью проточного цитофлуориметра BD FACSCalibur при длине волны возбуждения 488 нм и эмиссии 585 ± 42 нм. Долю апоптотических клеток оценивали как долю гиподиплоидных клеток.
Анализ образования ДР-ДНК и их репарации. Анализ проводили по уровню фосфорилированного гистона γН2АХ с помощью флуоресцентной микроскопии и проточной цитофлуориметрии, как описано ранее (Москалева и др., 2017). При подготовке к флуоресцентной микроскопии за 1 сут до эксперимента клетки в полной культуральной среде высевали на стекла, предварительно покрытые матригелем. Через 1 и 24 ч после облучения клетки фиксировали в течение 30 мин охлажденным до –20°С метанолом. Перед окрашиванием покровные стекла с клетками дважды промывали PBS, блокировали в течение 1 ч 2%-ным раствором обезжиренного БСА в PBS и инкубировали с моноклональными антителами к γН2АХ в этом же буфере либо в течение 2 ч при комнатной температуре, либо в течение ночи при 4°С. Далее препараты промывали промывочным буфером (PBS, содержащим 10% фетальной бычьей сыворотки и 0.1% тритона Х-100) при перемешивании на шейкере (3 раза по 10 мин) и окрашивали вторичными антителами козы, конъюгированными с Alexa Fluor 488. Отмывали промывочным буфером как указано выше, ядра окрашивали DAPI (1 мкг/мл) и монтировали на предметные стекла с помощью мовиола. Флуоресценцию анализировали с помощью микроскопа Axio Imager D2 с флуоресцентным модулем и камерой Axio Cam MRc5 (Carl Zeiss, Германия) с использованием программы AxioVision (Carl Zeiss, Германия). Фотографировали не менее 10 случайных полей зрения с использованием иммерсионного объектива 100× и подсчитывали по фотографиям общее число ядер и число фокусов, после чего рассчитывали среднее число фокусов на 1 ядро для каждой дозы облучения и для контроля.
Для анализа репарации ДР-ДНК с помощью проточной цитофлуориметрии НСК/НПК в виде суспензии единичных клеток фиксировали ледяным 70%-ным этанолом, как указано выше, отмывали PBS, блокировали 2%-ным раствором обезжиренного БСА в PBS и окрашивали мышиными моноклональными антителами к γH2AX, конъюгированными с Alexa Fluor 488 (BD Pharmingen, США) в течение 1 ч при комнатной температуре. После инкубации клетки трижды отмывали промывочным буфером (см. выше), ресуспендировали в PBS и анализировали флуоресценцию с помощью проточного цитофлуориметра, определяя процентное содержание в образце клеток положительных по γH2AX и среднюю интенсивность флуоресценции.
Индукция дифференцировки НСК/НПК. После облучения клеток в дозах 0.1, 1, 2 и 4 Гр клетки культивировали в стандартных условиях в чашках Петри в течение 3-х суток. Затем клетки ресуспендировали в аккутазе, считали и высевали в среде для культивирования на покровные стекла, покрытые матригелем, в 24-луночные планшеты при плотности 2 × 104 кл./см2. Через 2 сут для индукции дифференцировки культуральную среду заменяли на среду Neurobasal A, содержащую 2% фактора B27 и 5 нг/мл фактора bFGF. Еще через 2 сут удаляли bFGF. Каждые 2 сут половину объема среды заменяли свежей аналогичного состава. Через 6 сут дифференцировки (8 сут после посева на стекла и 11 сут после облучения) клетки фиксировали 4%-ным параформальдегидом в течение 20 мин при комнатной температуре, пермеабилизовали 0.3%-ным раствором тритона Х-100 в PBS, содержащем 5% фетальной бычьей сыворотки, в течение 1 ч при комнатной температуре и окрашивали флуоресцентно-меченными антителами к β-тубулину III (конъюгат с Alexa Fluor 488) и к GFAP (конъюгат с Cy3, Abcam, США) в течение 3 ч при комнатной температуре. После инкубации с антителами стекла с клетками трижды промывали промывочным буфером, как указано выше, ядра окрашивали DAPI (1 мкг/мл) в течение 5 мин, отмывали, монтировали на предметные стекла с помощью мовиола (Calbiochem, США) и высушивали в течение ночи. Флуоресценцию анализировали с помощью микроскопа Axio Imager D2. Фотографировали не менее 10 случайных полей зрения с использованием иммерсионного объектива 40× и оценивали по фотографиям общее число клеток (ядер) и число дифференцированных клеток, после чего рассчитывали долю дифференцированных клеток для каждой дозы облучения и для контроля.
Статистическую обработку результатов проводили по методу Стьюдента с использованием компьютерных программ OriginPro (OriginLab Corporation) и Microsoft Excel (Microsoft Corporation, США). Статистически значимыми считали результаты при Р < 0.05.
РЕЗУЛЬТАТЫ
Характеристика чувствительности клеток НСК/НПК мыши к действию γ-излучения. Культура НСК/НПК, полученная из головного мозга новорожденных мышей линии С57BL/6, была охарактеризована нами ранее и было показано, что на пятом пассаже доля клеток (%), экспрессирующих маркер стволовых клеток белок нестин, маркер дифференцировки нейронов β-тубулин III, маркер дифференцировки астроцитов GFAP, маркер дифференцировки олигодендроцитов антиген O4 и маркер дифференцировки предшественников олигодендроцитов NG2 составила соответственно 86. 0 ± 2.0 (нестин), 4.0 ± 1.5 (β-тубулин III), 4. ± 1.5 (GFAP), 4.1 ± 1.5 (О4) и 1.3 ± 0.5 (NG2) (Посыпанова и др., 2018). Таким образом, в исследуемой культуре НСК/НПК около 90% клеток экспрессируют нестин, что соответствует фенотипу НСК и ранних НПК, а небольшая часть НПК несет также дифференцировочные антигены. При дальнейшем культивировании к 25-му пассажу доля нестин-положительных клеток увеличивалась до 99% и, соответственно, снижалась доля клеток с маркерами нейроглиальной дифференцировки.
Для оценки влияния облучения на выживаемость НСК/НПК мыши in vitro считали число нейросфер, что позволяет оценить клоногенную активность НСК/НПК.
Представленные на рис. 1 результаты свидетельствуют о высокой радиочувствительности НСК/НПК. Так, при облучении НСК/НПК, как следует из представленных микрофотографий, наблюдали хорошо выраженную зависимость снижения и числа, и размера нейросфер от дозы облучения (рис. 1а).
Рис. 1.
Зависимость изменения размера и числа нейросфер (а) и клоногенной активности НСК/НПК (б) от дозы γ-облучения в диапазоне 1—4 Гр через 7 сут после воздействия. а – Микрофотографии культуры клеток НСК/НПК, культивируемых в виде нейросфер; 0 Гр – необлученный контроль; об.: 10×. б – Клоногенная активность НСК/НПК, оцениваемая по формированию нейросфер; сформировавшиеся нейросферы считали спустя 7 сут после облучения. Эффективность клонирования рассчитывали как отношение числа образовавшихся нейросфер к исходному числу клеток и выражали в процентах. В контроле этот показатель составил 12 ± 1%, от этой величины рассчитывали клоногенную активность облученных НСК/НПК. Вертикальные отрезки – ошибка среднего.
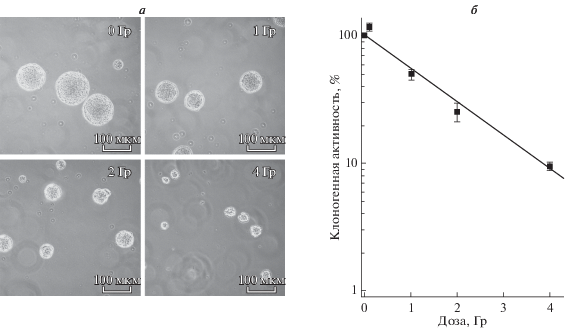
Число нейросфер и выживаемость клеток после облучения в дозе 0.1 Гр не отличались от контроля. После облучения в дозе 1, 2 и 4 Гр выживаемость НСК/НПК, оцениваемая по их клоногенной активности, снижалась соответственно до 56.6, 29.0 и 9.5% от контроля (рис. 1б), а доза, вызывающая инактивацию 50% клеток, способных образовывать нейросферы, составила 1.2 Гр.
Для анализа механизма гибели клеток НСК/НПК в культуре через 6 и 24 ч после облучения исследовали распределение клеток по фазам клеточного цикла (рис. 2) и уровень апоптоза в динамике после воздействия (рис. 3).
Рис. 2.
Примеры гистограмм распределения контрольных (а) и облученных в дозе 2 Гр (б) НСК/НПК по фазам клеточного цикла и изменение этого распределения через 6 (в) и 24 (г) ч после воздействия в зависимости от дозы облучения. Данные проточной цитометрии. Приведены средние значения из 3-x экспериментов (в, г). Отличия от контроля достоверны при *P < 0.05.
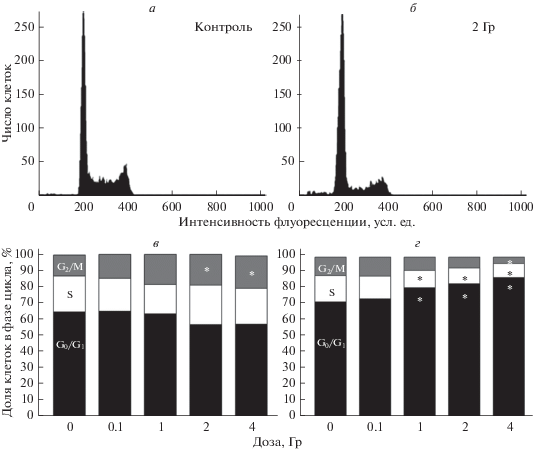
Рис. 3.
Динамика уровня апоптоза в культуре НСК/НПК в контроле и после облучения в разных дозах. Долю клеток, находящихся в состоянии апоптоза, определяли как долю гиподиплоидных клеток с помощью проточной цитофлуориметрии после окрашивания йодистым пропидием. Вертикальные отрезки – ошибка среднего. Отличия от контроля достоверны при *P < 0.05.
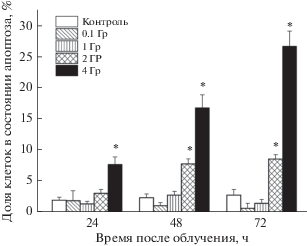
Показано, что облучение клеток в дозе 0.1 Гр не вызывает изменений ни распределения клеток по фазам цикла (рис. 2а–в), ни уровня апоптоза (рис. 3). Через 6 ч после облучения в дозе 1–4 Гр регистрируется блок клеточного цикла на границе фаз G2/M, степень которого практически не зависела от дозы облучения (рис. 2в). В контрольной культуре распределение клеток по фазам цикла G0/G1, S- и G2/M составило 64.9 ± 1.8, 22.2 ± 1.2 и 12.9 ± 1.2% соответственно. Через 6 ч после облучения в дозах 1, 2 и 4 Гр доля клеток в фазе G2/M возрастала до 18.0 ± 1.5%, 19.0 ± 1.3% и 20.0 ± 1.1% (р < 0.05 при 2 и 4 Гр). Через 24 ч после облучения, начиная с дозы 1 Гр, регистрируется блок клеточного цикла, характеризующийся пропорциональным дозе облучения накоплением клеток в фазах G0/G1, и их снижением в S- и G2/M-фазах (рис. 2г). В контроле через 24 ч распределение клеток по фазам цикла G0/G1, S- и G2/M составило 71.8 ± 1.6, 16.6 ± 0.3 и 11.6 ± 0.9% соответственно. После облучения в дозах 1, 2 и 4 Гр доля клеток в фазах G2/M снижалась, а в G0/G1 возрастала до 80.8 ± 2.9 (Р < 0.04), 83.2 ± 0.5 (Р < 0.01) и 87.2 ± 1.5% (Р < 0.005) соответственно. Блок клеточного цикла с аналогичным распределением клеток по его фазам наблюдали и через 72 ч после воздействия. Через 24 ч после облучения в дозах 2 и 4 Гр наряду с G0/G1-блоком клеточного цикла обнаружено пропорциональное дозе облучения увеличение доли клеток в состоянии апоптоза от 2.0 ± 0.5% в контроле до 3.1 ± 0.6% и 7.7 ± 1.2% соответственно (P < 0.05) (рис. 3). После облучения НСК/НСП в дозах 2 и 4 Гр уровень апоптоза оставался повышенным через 48 ч, составляя 7.8 ± 0.8% и 16.8 ± 2.1% (P < 0.05), и через 72 ч, составляя 8.6 ± 0.7% и 26.7 ± 2.4% (P < 0.05). Как следует из представленных данных, после облучения клеток в дозах 2 и 4 Гр уровень апоптоза превышал контрольный уровень соответственно в 3 и 7 раз через 48 ч и в 3.5 и 11 раз через 72 ч (рис. 3). Таким образом, облучение НСК/НСП в ранний период – через 6 ч после воздействия – вызывало блок клеточного цикла на границе фаз G2/M, который позднее (через 24 ч) сменялся длительным блоком клеточного цикла в фазах G0/G1. Через 24–72 ч регистрировали гибель части клеток, облученных в дозах 2 и 4 Гр, по механизму апоптоза.
Образование ДР-ДНК и их репарация. ДР регистрировали по уровню гистона γН2АХ после действия γ-излучения. Контрольные и облученные НСК/НПК культивировали в виде нейросфер. В указанное время, начиная с 1 ч после облучения, клетки собирали, диссоциировали, проводили окрашивание флуоресцентно мечеными антителами к гистону γН2АХ и измеряли интенсивность их флуоресценции с помощью проточной цитометрии. Полученные результаты представлены на рис. 4.
Рис. 4.
Изменение уровня гистона γН2АХ, отражающего количество двунитевых разрывов ДНК, в контрольных (кривая К) и облученных в дозах 1, 2 и 4 Гр НСК/НПК в течение 24 ч после воздействия по данным проточной цитофлуориметрии. MFI – средняя интенсивность флуоресценции комплекса меченных Alexa Fluor 488 моноклональных антител к гистону γH2AX с этим белком. Вертикальные отрезки – ошибка среднего.
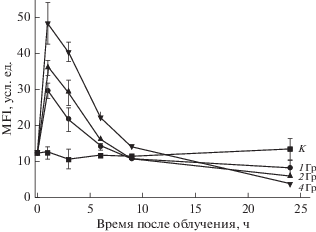
Через 1 ч после воздействия содержание γН2АХ было максимальным и пропорциональным дозе облучения. Спустя 6 ч этот показатель значительно снижался, но еще превышал уровень γН2АХ в контрольной культуре, и только через 9 ч при указанных дозах он возвращался к исходному уровню. Начальная скорость репарации ДР-ДНК после облучения в дозе 1, 2 и 4 Гр в период от 1 до 6 ч, судя по наклону кривых на рис. 4 (рис. 4), в указанных условиях возрастала с увеличением дозы облучения.
При исследовании уровня гистона γН2АХ с помощью проточной цитометрии после облучения клеток в диапазоне малых доз (0.1 Гр) оказалось, что чувствительности этого метода недостаточно для регистрации возникающих повреждений ДНК. Поэтому для анализа уровня ДР-ДНК после облучения клеток в дозе 0.1 Гр в сравнении с дозой 1 Гр для визуализации и подсчета фокусов гистона γН2АХ использовали флуоресцентную микроскопию. Полученные результаты представлены на рис. 5а–в и на рис. 6. Как следует из представленных данных, облучение НСК/НПК в дозе 0.1 Гр приводит к повышению количества фокусов гистона γН2АХ по сравнению с их спонтанным уровнем в контрольной культуре, Р < 0.05 (рис. 5а–в).
Рис. 5.
Микрофотографии фокусов гистона γH2AX в ядрах клеток контрольных (а) и облученных в дозах 0.1 (б) и 1 Гр (в) культур НСК/НПК через 1 ч после γ-облучения. Использованы моноклональные антитела к гистону γH2AX, меченные Alexa Fluor 488; цифрами показано среднее число фокусов на 1 ядро. Отличия от контроля достоверны при *P < 0.05. Об.: 40×.
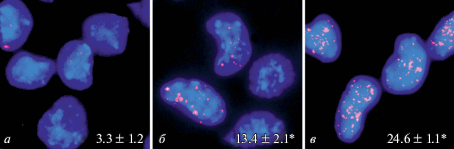
Рис. 6.
Динамика изменения количества фокусов гистона γH2AX в ядрах контрольных (1) и облученных в дозах 0.1 (2) и 1 Гр (3) культур НСК/НПК. Исходное количество фокусов в контрольных клетках принято за 100%. Вертикальные отрезки – ошибка среднего.
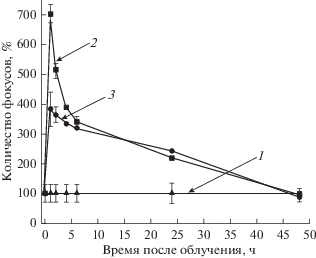
Анализ с помощью флуоресцентной микроскопии изменения количества фокусов гистона γН2АХ в динамике после облучения (рис. 6) позволяет заключить, что в первые часы после облучения в дозе 0.1 Гр скорость репарации ДР-ДНК значительно ниже чем после облучения в дозе 1 Гр. Через 6 ч культивирования скорость репарации снижается в клетках, облученных в дозе и 0.1 и 1 Гр. Через 24 ч после облучения в этих дозах репарация не завершается полностью: количество фокусов в облученных НСК/НПК в этот период еще в 2.2–2.4 раза превышает их количество в необлученном контроле. Полностью процесс репарации ДР-ДНК, регистрируемый по количеству фокусов, при этих дозах облучения завершается только к 48 ч (рис. 6). При определении числа остаточных фокусов гистона γН2АХ через 24 ч после облучения НСК/НПК в дозах 2 и 4 Гр при использовании флуоресцентной микроскопии их количество составило относительно контроля 106.7 ± 13.3 и 186.7 ± 33.3% соответственно и значимо от контроля не отличалось. Таким образом, облучение НСК/НПК в диапазоне малых (0.1 Гр) и низких (1 Гр) доз приводит к более медленной репарации ДР-ДНК, чем облучение в более высоких дозах (2 и 4 Гр).
Способность НСК/НПК, переживших действие γ-излучения, к дифференцировке в нейроны и астроциты. Для исследования способности НСК/НПК, переживших облучение, к дифференцировке суспензию контрольных клеток и облученных в дозах 0.1, 1, 2 и 4 Гр культивировали в стандартных условиях в виде нейросфер в течение 3 сут. К этому времени завершается процесс гибели части клеток, и начинается пролиферация выживших клеток. Для индукции дифференцировки клетки высевали на покровные стекла, культивировали в течение 2 сут и индуцировали их дифференцировку, как описано в разделе “Материал и методика”. Спустя 6 сут после фиксации и окрашивания соответствующими антителами, считали число нейронов и астроцитов и общее число клеток. В контрольных культурах при дифференцировке клеток в выбранных условиях в нейроны дифференцировалось 22%, а в астроциты – 10% клеток.
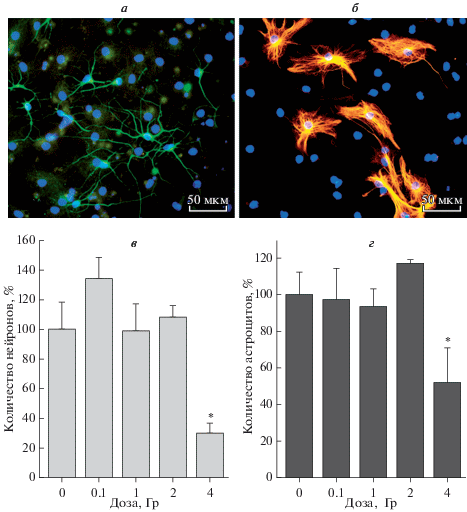
На рис. 7 показаны нейроны (рис. 7а) и астроциты (рис. 7б), дифференцировавшиеся из НСК/НПК, и дана количественная оценка способности НСК/НПК, переживших облучение, к дифференцировке в нейроны (рис. 7в) и астроциты (рис. 7г). Количественный анализ обнаружил стимуляцию дифференцировки в нейроны после облучения в дозе 0.1 Гр и ее снижение на 70% после облучения в дозе 4 Гр (рис. 7в). НСК/НПК, пережившие облучение в дозах 1 и 2 Гр, сохраняли способность к дифференцировке в нейроны на уровне контрольных клеток (рис. 7в). Способность НСК/НПК к дифференцировке в астроциты после облучения в этом диапазоне доз снижалась также только при облучении в дозе 4 Гр: доля образующихся астроцитов уменьшалась на 48% по сравнению с контролем (рис. 7г). Полученные результаты свидетельствуют о более высокой радиочувствительности способности НСК/НПК к дифференцировке в нейроны, чем в астроциты.
Рис. 7.
Микрофотографии нейронов (а) и астроцитов (б), дифференцировавшихся из НСК/НПК, и влияние γ-облучения на способность выживших НСК/НПК дифференцироваться в нейроны (в) и астроциты (г). а – Окрашивание антителами к β-тубулину III (зеленый цвет), б – окрашивание антителами к GFAP (оранжевый), ядра окрашены DAPI (синий). Вертикальные отрезки – ошибка среднего. Отличия от контроля достоверны при *P < 0.05. Об.: 40×.
ОБСУЖДЕНИЕ
При исследовании чувствительности НСК/НПК мыши к γ-излучению при культивировании in vitro в виде нейросфер, показано, что радиочувствительность этих клеток, оцениваемая по клоногенной активности НСК/НПК, образующих колонии (нейросферы), оказалась высокой: 50% клоногенных клеток погибало при дозе облучения 1.2 Гр (рис. 1). В работе использовали культуру НСК/НПК, выделенных из целого мозга. В тоже время радиочувствительность НСК из разных зон мозга может различаться. В частности, показано, что НСК субвентрикулярной зоны, которые идентифицировали как нестин+/GFAP+-клетки, характеризуются высокой радиоустойчивостью. Так, при исследовании влияния облучения головы 9-суточных крыс на нейрогенез в двух нишах – в субвентрикулярной зоне и в зубчатой извилине гиппокампа – в отдаленный период (через 9 нед после облучения) обнаружено значительно более глубокое подавление нейрогенеза в гиппокампе (Hellström et al., 2009). Однако через 1 сут. после воздействия степень подавления пролиферации клеток в обеих зонах была одинаковой, что свидетельствует об одинаковой чувствительности этих клеток к облучению, но более медленной регенерации нейрогенеза в зубчатой извилине гиппокампа, что может определяться спецификой микроокружения НСК в этих зонах. Тем не менее, данные свидетельствуют об одинаковой радиочувствительности НСК из разных зон мозга.
Известно, что радиоустойчивость НСК значительно выше, чем устойчивость быстро пролиферирующих НПК. Это обнаружено на НСК, выделенных так же, как нами в настоящей работе (из целого мозга мышей), при действии ускоренных частиц 56Fe (Tseng et al., 2014) и при действии гамма-излучения на культуру НСК, полученную из клеток субвентрикулярной зоны мозга крыс (Chen et al., 2015). В первой работе (Tseng et al., 2014) НСК идентифицировали по клоногенной активности и подсчету нейросфер, а НПК – по числу клеток. Во второй работе в качестве маркера НСК для их идентификации использовали антиген СD133. Эти авторы (Chen et al, 2015) наблюдали блок клеточного цикла НСК/НПК через 4, 24 и 48 ч на границе фаз G2/M. При этом через 30 мин и 1 ч после облучения в дозах 0.5 и 8 Гр наблюдали увеличение уровня фосфорилированного по серину белка p53 – маркера повреждения ДНК, который возвращался к исходному значению через 2 ч. В настоящей работе через 6 ч после облучения также возникал G2/M-блок клеточного цикла, который, однако, уже через 24 ч сменялся блоком в фазе G1, который сопровождался повышением уровня апоптоза (рис. 2 и 3).
При облучении НСК крыс рентгеновскими лучами в дозе 5 Гр также обнаружено повышение уровня апоптоза через 12 и 24 ч, при этом блок клеточного цикла через 6 и 12 ч после облучения наблюдали в фазах G2/M. Однако через 18 и 48 ч после облучения доля G2/M-клеток возвращалось к норме, но, как и в настоящей работе, возрастала доля клеток в фазе G1 (Limoli et al., 2004). Одновременно с этим через 2 и 6 ч после воздействия эти авторы обнаружили повышение в НСК уровня белка р53 и его фосфорилированной по серину формы, а также белка р21, что свидетельствует о развитии в НСК р53-зависимого ответа на повреждение ДНК при облучении. Аналогичные данные получены в отношении НСК человека (клетки линии ENStem-A), для которых обнаружено повышение уровня раннего (через 6–24 ч) и позднего (через 24 и 48 ч) апоптоза, а также G2/M-блок клеточного цикла через 12–28 ч после γ-облучения в дозе 5 Гр (Acharya et al., 2010).
В зависимости от типа и степени повреждения ДНК в клетке возможно развитие разных вариантов клеточного ответа. Выживание клеток после облучения достигается благодаря временной активации контрольных точек и остановки клеточного цикла. Остановка прохождения цикла при повреждении ДНК обеспечивает, во-первых, возможность осуществления процесса репарации ДНК, и, во вторых, ингибирование пролиферации клеток с повреждениями ДНК и индукции в таких клетках программированной гибели и (или) программы старения (Speidel et al., 2015). Повышение уровня экспрессии р53 в ответ на облучение может обеспечивать задержку клеток как в G1-, так и в G2-фазе (Maity et al., 1994). Механизм, с помощью которого р53 регулирует переход G2 → M, связан с ингибированием активности циклин-зависимой киназы Cdc2 (Chk1), необходимой для вступления клетки в митоз. Активация р53 после облучения может также приводить к повышению экспрессии белка р21 (ингибитора киназы Chk1) и тем самым обеспечивать блок клеточного цикла и в G1- и в G2-фазе. Важно отметить, что остановка клеточного цикла в G2-фазе, которая регистрируется в НСК/НПК в первые часы после облучения, позволяет клеткам репарировать ДР-ДНК по механизму гомологичной рекомбинации, что может приводить к более успешной репарации ДР-ДНК с меньшим числом ошибок, чем при репарации по пути негомологичного соединения концов, который функционирует во всех фазах клеточного цикла (Газиев, 2011).
При исследовании активности репарации ДР-ДНК в НСК/НПК мыши нами обнаружена очень медленная репарация этих повреждений спустя 6 ч после облучения (рис. 4). Медленное восстановление ДР-ДНК в НСК/НПК мы наблюдали даже при облучении клеток в диапазоне малых (0.1 Гр), и низких (1 Гр) доз (рис. 6). Более медленная репарация при малых дозах показана и для мезенхимных стволовых клеток человека (Osipov et al., 2015). Эту особенность связывают с низкой способностью клеток распознавать возникающие при этих дозах редкие ДР. Репарация ДР в НСК/НПК при низких дозах не заканчивалась в течение 24 ч, но завершалась через 48 ч (рис. 6).
Близкие данные получены после действия рентгеновского излучения в дозе 10 Гр на НСК/НПК, полученных из эмбриональных стволовых клеток мыши. В этих клетках также обнаружено длительное (до 3 сут.) сохранение ДР-ДНК, регистрируемых по уровню γ-H2AX (Schneider et al., 2013). В тоже время показано, что НСК человека линии ENStem-A обладали очень высокой способностью к репарации ДР-ДНК: уровень гистона γH2AX по данным проточной цитометрии достигал максимального значения через 0.3 ч, а по данным флуоресцентной микроскопии – через 0.3–1 ч после облучения и возвращался к контрольному уровню уже через 2 ч, оставаясь таким через 24 ч (Acharya et al., 2010). Блок клеточного цикла в клетках этой линии, как отмечено выше, происходил на границе фаз G2/M. Близкие результаты по способности к репарации ДР-ДНК получены в отношении эмбриональных клеток человека линии Н9 (Lan et al., 2012).
Известно, что клетки разных тканей репарируют ДР-ДНК с разной скоростью (Firsanov et al., 2011). Полученные нами результаты свидетельствуют о том, что и НСК/НПК из разных источников могут различаться по способности репарировать ДР ДНК. В частности, оказалось, что НСК/НПК мыши репарируют ДР-ДНК значительно медленнее, чем НСК/НПК человека. Длительный, сохраняющийся, по крайней мере, до 72 ч G0/G1-блок клеточного цикла в НСК/НПК мыши свидетельствует о длительном сохранении повреждений ДНК в этих клетках. Поэтому можно полагать, что медленная репарация ДР-ДНК в этих клетках может быть одной из причин их высокой радиочувствительности.
Физиологической задачей НСК является образование новых нейронов и клеток глиальной природы в мозге. Поэтому важно было оценить способность к дифференцировке тех НСК, которые выжили после облучения в исследуемых дозах. Полученные в этих экспериментах результаты (рис. 7) свидетельствуют о сохранении способности НСК, переживших действие гамма-излучения в дозах 0.1–2 Гр, к дифференцировке и в нейроны и в астроциты. Однако НСК, выжившие после γ-облучения в дозе 4 Гр, образовывали значительно меньше нейронов и астроцитов чем контрольные клетки. Доля образующихся нейронов была снижена на 70%, а астроцитов – только на 48%. В то же время, если учесть что облучение НСК/НПК уже в дозах 1 и 2 Гр снижает выживаемость клеток, оцениваемую по клоногенной активности, на 50 и 70% соответственно (рис. 1), то можно заключить, что образование новых нейронов и астроцитов после облучения НСК/НПК в этих умеренных дозах будет существенно снижено по сравнению с контрольными клетками. При дозе 4 Гр, когда выживаемость НСК/НПК снижена до 10% от контроля (рис. 1), доля новых нейронов и астроцитов составит только 3 и 5% от их образования из необлученных НСК в культуре. Полученные результаты свидетельствуют о высокой радиочувствительности и нейрогенеза и образования астроцитов при действии γ-излучения в дозах 1–4 Гр. При более высоких дозах (4 Гр) снижение образования и нейронов, и астроцитов определяется не только гибелью 90% НСК/НПК, но и снижением способности этих клеток к дифференцировке. Эти данные позволяют объяснить длительное подавление нейрогенеза, наблюдаемое у облученных мышей.
Список литературы
Газиев А.И. 2011. Низкая эффективность репарации критических повреждений ДНК, вызываемых малыми дозами радиации. Радиационная биология. Радиоэкология. 51(5) : 512–529. (Gaziev A.I. 2011. Low efficiency of critical DNA damage repair caused by low doses of radiation. Radiacionnaya biologiya. Radioekologiya. 51(5) : 512–529.)
Москалева Е.Ю., Семочкина Ю.П., Родина А.В., Чукалова А.А., Посыпанова Г.А. 2017. Влияние облучения на мезенхимальные стволовые клетки костного и головного и мозга мыши и их способность индуцировать опухоли. Радиационная биология. Радиоэкология. 57(3) : 245–256. (Moskaleva E.Yu., Semochkina Yu.P., Rodina A.V., Chukalova A.A., Posypanova G.A. 2017. Effects of γ-radiation on mesenchymal stem cells from mouse bone marrow and brain and their ability to induce tumors. Radiacionnaya biologiya. Radioekologiya. 57(3) : 245–256.)
Посыпанова Г.А., Ратушняк М.Г., Высоцкая О.В., Глухов А.И., Семочкина Ю.П., Родина А.В., Москалева Е.Ю. 2018. Защита нейральных стволовых клеток от генотоксических воздействий с помощью факторов, секретируемых МСК. Молекулярная медицина. 16(62) : 28–34. (Posypanova G.A., Ratushnyak M.G., Vysotskaya O.V., Glukhov A.I., Semochkina Yu.P., Rodina A.V., Moskaleva E.Yu. 2018. Protection of neural stem cells from genotoxic effects by factors secreted by mesenchymal stem cells. Molekulyarnaya medicina. 16(62) : 28–34.)
Acharya M.M., Lan M.L., Kan V.H., Patel N.H., Giedzinski E., Tseng B.P., Limoli C.L. 2010. Consequences of ionizing radiation-induced damage in human neural stem cells. Free Rad. Biol. Med. 49 : 1846–1855.
Chen H., Goodus M.T., de Toledo S.M., Azzam E.I., Levison S.W., Souayah N. 2015. Ionizing radiation perturbs cell cycle progression of neural precursors in the subventricular zone without affecting their long-term self-renewal. ASN Neuro. 7 : 1–16.
Fike J.R., Rosi S., Limoli C.L. 2009. Neural precursor cells and central nervous system radiation sensitivity. Semin Radiat. Oncol. 19 : 122–132.
Firsanov D.V., Solovjeva L.V., Svetlova M.P. 2011. H2AX phosphorylation at the sites of DNA double-strand breaks in cultivated mammalian cells and tissues. Clin. Epigenet. 2 : 283–297.
Gonçalves J.T., Schafer S.T., Gage F.H. 2016. Adult Neurogenesis in the Hippocampus: From Stem Cells to Behavior. Cell. 167 : 897–914.
Hellström N.A., Björk-Eriksson T., Blomgren K. Differential recovery of neural stem cells in the subventricular zone and dentate gyrus after ionizing radiation. Stem Cells 2009. 27 : 634–641.
Lan M.L., Acharya M.M., Tran K.K., Bahari-Kashani J., Patel N.H., Strnadel J., Giedzinski E., Limoli C.L. 2012. Characterizing the radioresponse of pluripotent and multipotent human stem cells. PLoS One. 7 : e50048.
Limoli C.L., Giedzinski E., Rola R., Otsuka S., Palmer T.D., Fike J.R. 2004. Radiation response of neural precursor cells: Linking cellular sensitivity to cell cycle checkpoints, apoptosis and oxidative stress. Radiat. Res. 161 : 17–27.
Maity A., McKenna W.G., Muschel R.J. 1994. The molecular basis for cell cycle delays following ionizing radiation: A review. Radiother. Oncol. 31 : 1–13.
Osipov A.N., Pustovalova M., Grekhova A., Eremin P., Vorobyova N., Pulin A., Zhavoronkov A., Roumiantsev S., Klokov D.Y., Eremin I. 2015. Low doses of X-rays induce prolonged and ATM independent persistence of γH2AX foci in human gingival mesenchymal stem cells. Oncotarget. 6 : 2775–2787.
Schneider L., Pellegatta S., Favaro R., Pisati F., Roncaglia P., Testa G., Nicolis S.K., Finocchiaro G., Fagagna F. 2013. DNA Damage in Mammalian Neural Stem Cells Leads to Astrocytic Differentiation Mediated by BMP2 Signaling through JAK-STAT. Stem Cell Reports. 1 : 123–138.
Speidel D. 2015. The role of DNA damage responses in p53 biology. Arch. Toxicol. 89 : 501–517.
Tseng B.P., Giedzinski E., Izadi A., Suarez T., Lan M.L., Tran K.K., Acharya M.M., Nelson G.A., Raber J., Parihar V.K., Limoli C.L. 2014. Functional consequences of radiation-induced oxidative stress in cultured neural stem cells and the brain exposed to charged particle irradiation. Antioxid. Redox. Signal. 20 : 1410–1422.
Yang L., Yang J., Li G., Li Y., Wu R., Cheng J., Tang Y. 2017. Pathophysiological responses in rat and mouse models of radiation-induced brain injury. Mol. Neurobiol. 54 : 1022–1032.
Дополнительные материалы отсутствуют.


