Цитология, 2019, T. 61, № 11, стр. 864-871
Сравнительная характеристика реакции клеточных элементов венозной крови человека на контакт с угольным гемосорбентом и волокнами хитозана in vitro
О. П. Киричук 1, 2, Е. Н. Маевская 1, Н. В. Буркова 2, *, Е. Н. Дресвянина 1, 3, С. И. Кузнецов 2, И. П. Добровольская 1, 4, В. Е. Юдин 1, 4
1 Кафедра медицинской физики Санкт-Петербургского политехнического университета Петра Великого
195251 Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. В.А. Алмазова
197341 Санкт-Петербург, Россия
3 Кафедра материаловедения и товарной экспертизы Санкт-Петербургского государственного университета промышленных технологий и дизайна
191186 Санкт-Петербург, Россия
4 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
* E-mail: n.burk@list.ru
Поступила в редакцию 27.06.2019
После доработки 07.08.2019
Принята к публикации 07.08.2019
Аннотация
Целью работы являлась сравнительная характеристика реакции клеточных элементов венозной крови человека in vitro на контакт с угольным сорбентом, используемым в процедуре малообъемной гемоперфузии (МОГ), и волокнами хитозана. Формование волокон хитозана осуществляли из 4%-ного раствора хитозана в 2%-ном растворе уксусной кислоты на лабораторной установке коагуляционным методом. В течение 60 мин эксперимента в пробах крови, контактировавшей с гемосорбентами в ротационном режиме, регистрировали 26 параметров на гематологическом анализаторе SySmex XT 1800i. Оптическую плотность регистрировали на спектрофотометре UNICO 280(S) на длинах волн, соответствующих максимумам поглощения молекулы гемоглобина (414 и 540 нм). Анализ полученных результатов показал, что волокна хитозана обладают большей гемосовместимостью и возможностью к модификации поверхности волокон селективными агентами. На основании полученных данных можно заключить, что волокна хитозана могут быть использованы в процедуре МОГ как самостоятельно, так и в качестве нейтральной матрицы для конструирования специфических гемоактиваторов для практического применения этого биополимера в эффективных медицинских схемах лечения.
Разработка новых биоматериалов, контактирующих с кровью, является одной из приоритетных задач современной медицины и биотехнологии. В медицинской практике для детоксикации биологических жидкостей широкое распространение получили различные сорбенты: углеродные, неорганические, ионообменные, полимерные и другие. Механизм лечебного действия сорбции связан с прямым и опосредованным эффектом через форменные элементы крови, иммунную и фагоцитарную системы, коагуляционный потенциал, реологические свойства, через гуморальную регуляцию и медиаторные вещества (Рачковская и др., 2015).
В комплексном исследовании нами установлено, что при контакте крови с угольным гемосорбентом при проведении малообъемной гемоперфузии (МОГ) происходит изменение функциональных характеристик клеток крови: усиление адгезивных свойств лейкоцитов и тромбоцитов, увеличение миграционной активности нейтрофилов и индукции активных форм кислорода (Буркова и др., 2011). В этой же работе было показано, что после МОГ пораженного региона происходит усиление кровоснабжения конечности, повышение концентрации лактоферрина и миелопероксидазы в плазме венозной крови, отмечено преобладание эйкозаноидов с вазодилятационными и антиагрегантными свойствами.
В основе МОГ лежит механизм твердофазной контактной гемомодуляции (Кузнецов, 2006) – новой медицинской технологии, которая была успешно применена для эффективного лечения некоторых видов заболеваний конечностей (Буркова и др., 2010; Кузнецов и др., 2013). Для проведения процедуры МОГ было разработано гемоконтактное устройство (шприц-колонка), в котором в качестве активационного препарата использован угольный гемосорбент (Кузнецов и др., 2003; Буркова и др., 2013), являющийся в настоящее время эталоном для исследования других гемоактиваторов.
Однако существует необходимость исследования и новых гемосорбентов для процедуры МОГ, имеющих не менее выраженные активационные свойства и гемосовместимость, а также способность к модификации (Кузнецов и др., 2017; Буркова и др., 2018, 2019). Состоящий из остатков N-ацетилглюкозамина хитин и его производное хитозан способны стимулировать иммунную систему посредством активации макрофагов, фибробластов, системы комплемента и миграции полиморфноядерных лейкоцитов. Хитозан рассматривается как один из перспективных материалов для создания полимерных матриц (Куликов и др., 2009; Dai et al., 2011; Levengood, Zhang, 2014; Venkatesan et al., 2014; Shabunin et al., 2019).
Цель настоящей работы заключалась в сравнении реакций клеточных элементов венозной крови человека in vitro на контакт с угольным сорбентом, используемым в процедуре МОГ, и волокнами хитозана для возможного использования его в клинической практике.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали донорскую кровь, полученную на станции переливания крови НМИЦ им. В.А. Алмазова МЗ РФ. Кровь в объеме 9 мл забирали у здоровых волонтеров из локтевой вены в пробирку с гепарином лития. Исследовали два сорбента: 1) СКТ-6А-ВЧ – угольный поливалентный, деминерализованный и дополнительно очищенный сорбент (высокой чистоты), разрешенный к применению в клинической практике в качестве гемосорбента и гемоактиватора МОГ; 2) волокна хитозана, полученные из креветочного хитозана (Biolog Heppe Gmbp, Германия) с молекулярной массой 164.2 ± 9.8 кДа методом мокрого формования.
Определение параметра СД. СД – отношение количества глюкозаминных звеньев к общему числу мономерных в молекуле полисахарида. Этот параметр определяет степень химической активности полимера (Islam et al., 2017), влияет на его растворимость и, следовательно, на качество дальнейшей переработки (Qin, 2008). Кроме того, СД определяет количество свободных аминогрупп, оказывающих влияние на взаимодействие хитозана с клеточными элементами крови и их активацию (Benesch, Pentti, 2002). СД хитозана определяли методом кондуктометрического титрования, основанном на связывании соляной кислоты с аминогруппами хитозана; она составила 92.4 ± 7.8%.
Получение волокон хитозана. Формование волокон осуществляли из 4%-ного раствора хитозана в 2%-ном растворе уксусной кислоты на лабораторной установке ИВС РАН по коагуляционному методу (Yudin et al., 2014; Dresvyanina et al., 2018). Раствор хитозана подавали со скоростью 0.2 мл/мин через фильеру диаметром 0.6 мм в коагуляционную ванну, наполненную спиртово-щелочной смесью (смесью 10% водного раствора NaOH и C2H5OH в соотношении 1 : 1). После осаждения волокна промывали в ваннах с дистиллированной водой, просушивали и наматывали на катушку. Для исследования влияния параметров формования на свойства получаемых волокон фильерную вытяжку, определяемую как отношение скорости ролика к скорости подачи раствора, меняли в диапазоне от 0 до 120%. Измерения механических свойств волокон проводили на разрывной машине Instron 5943 (Великобритания), базовая длина волокна составляла 100 мм, скорость нагружения – 10 мм/мин. Перед испытаниями волокна выдерживали при относительной влажности 66% не менее 24 ч.
Для изготовления гемоконтактных шприц-колонок объемом 20 мл использовали угольный сорбент и волокна хитозана. Перед началом эксперимента волокна хитозана нарезали размером 0.5–1.0 см и по 100 мг загружали в шприц-колонки, в которые затем набирали по 10 мл стерильного физиологического раствора, и оставляли на 30 мин при комнатной температуре для получения максимального набухания волокон. После этого все шприц-колонки 3 раза промывали 20 мл стерильного физиологического раствора и еще 3 раза 20 мл физиологического раствора, содержащего 20 ед/мл гепарина. В шприц-колонку забирали донорскую кровь из вакуумной пробирки, при этом соотношение сорбент : кровь составляло 1 : 4. Предварительно из этой же пробирки отбирали пробу крови до контакта. Шприц-колонки в горизонтальном положении помещали в роторную мешалку и включали вращение со скоростью 10 об./мин. Через 5, 20, 40 и 60 мин забирали пробы крови по 1.8–2.0 мл и регистрировали 26 параметров крови на гематологическом анализаторе SySmex XT 1800i (Япония). После проведения гематологического анализа пробы крови центрифугировали 10 мин при 3500 об./мин, разводили в 30 раз физиологическим раствором и определяли оптическую плотность при длинах волн 414 и 540 нм (максимумы поглощения гемоглобина) на приборе UNICO 280(S) (США). По изменению оптической плотности плазмы в видимой части спектра (300–700 нм) в постконтактных пробах по сравнению с пробой до контакта можно судить о гемолитической активности сорбентов (Буркова и др., 2018; Кривенцев и др., 2018). Всего было выполнено 6 экспериментов с волокнами хитозана и 10 экспериментов с угольным сорбентом.
Статистический анализ полученных результатов проводили с использованием прикладных пакетов Statistica 7.0 for Windows и Excel 2013. Статистически значимые изменения показателей внутри групп оценивали с помощью t-критерия Стьюдента для попарно связанных выборок и критерия Вилкоксона для парных сравнений, статистически значимые различия показателей между группами – с помощью t-критерия Стьюдента для независимых выборок и U-критерия Манна–Уитни. Статистически значимыми считали различия при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ эритроцитарного пула. Результаты данного анализа показаны на рис. 1а. В пробах 5-минутного контакта крови с исследуемыми сорбентами отмечено снижение на 20–25% (P < 0.05) концентрации эритроцитов, которое сохранялось до конца эксперимента. Подобно снижались показатели гемоглобина и гематокрита.
Рис. 1.
Изменение концентрации эритроцитов (а), тромбоцитов (б) и лейкоцитов (в) во времени при контакте крови с гемосорбентом хитозаном или угольным сорбентом in vitro. Темные столбцы – хитозан, светлые – угольный сорбент. Даны средние значения. Вертикальные отрезки показывают стандартное отклонение среднего выборочного значения (ошибка среднего).
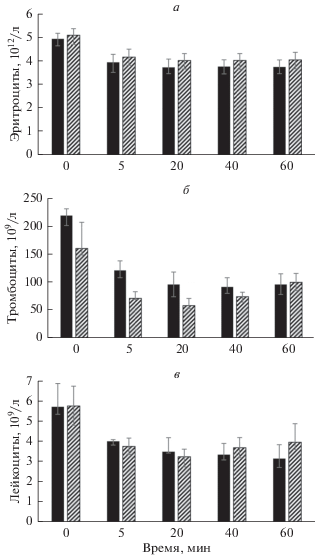
Известно, что любая колонка, загруженная гемоконтактным материалом, имеет свободный объем. После промывания колонки между и внутри гранул сорбентов остается физиологический раствор с гепарином, который и разбавляет добавленную в колонку кровь на этот объем (Буркова и др., 2013). Этим можно объяснить падение гематокрита в 5-минутной пробе и сохранение этого показателя неизменным во всех последующих пробах. Другие исследованные эритроцитарные индексы (средний объем эритроцита, средний объем содержания гемоглобина в эритроците, среднее содержание гемоглобина в эритроцитарной массе, гетерогенность эритроцитов по объему, индекс анизоцитоза), не зависящие от разведения крови, оставались неизменными на протяжении всего эксперимента, поэтому не показаны. Приведенные результаты доказывают, что контакт эритроцитов с исследуемыми гемоконтактными препаратами не влияет на количественные и функциональные характеристики этих клеток крови.
Эритроциты – инертные клетки, которые не могут индуцировать биоактивные структуры, но способны влиять на количество и спектр биоактивных молекул в плазме в результате переноса на поверхности своей клеточной мембраны молекул различных классов – гуморальных регуляторных соединений, лекарственных препаратов, токсических веществ и т.д. (Дмитриева и др., 2016).
Концентрация тромбоцитов. Этот показатель снижался в течение всего времени взаимодействия крови с гемоконтактными препаратами (рис. 1б). Следует обратить внимание на то, что уменьшение числа тромбоцитов – активный процесс. Помимо разведения крови, которое можно определить по гематокриту, происходило снижение концентрации клеток на 20–25% за счет адгезии к поверхности гемоконтактных препаратов. При контакте с волокнами хитозана в пробах “5 мин” в жидкой фазе оставалось 55% клеток, а при контакте с угольным гемосорбентом – 44%, что говорит о более активной адгезии тромбоцитов к поверхности угольного сорбента. Максимум адгезии к волокнам хитозана наблюдали в пробах “40 мин”, после чего начинал превалировать процесс отлипания клеток. При контакте с угольным гемосорбентом максимум адгезии тромбоцитов наблюдали в пробах “20 мин”.
Способность к активации – быстрому и, в большинстве случаев, необратимому переходу в новое состояние – является главным свойством тромбоцитов. Установлено, что тромбоциты в ответ на клеточную активацию быстро и устойчиво синтезируют белковые продукты с выраженной биологической активностью (Rosenwald et al., 2001). Недавние открытия показали, что тромбоциты имеют сложные посттранскрипционные механизмы, которые позволяют изменять их протеом, фенотип, функции и выполнять новый синтез белка в ответ на клеточную активацию (Weyrich et al., 2004).
Активированные тромбоциты выделяют из α-гранул различные цитокины, хемокины и факторы роста (De Maat, Maas, 2016). Тромбоциты экспрессируют многие иммуномодулирующие молекулы (P-селектин, TLRs, CD40L), секретируют ряд цитокинов (ИЛ-1β, TGF-β и регулятор активации процессов экспрессии и секреции нормальных Т-лимфоцитов RANTES (Regulated upon Activation Normally T-cell expressed and Secreted)), а также имеют способность взаимодействовать с различными типами иммунных клеток. Тромбоциты могут обмениваться друг с другом и с другими клетками всеми биологически активными веществами, секретируемыми их внутриклеточными гранулами (в том числе иммуноглобулинами IgG, IgM, IgA и IgE), которые способны выделяться в окружающую среду при активации кровяных пластинок (Weyrich, Zimmerman, 2004). Активированные тромбоциты высвобождают мириады провоспалительных медиаторов в сосудистую сеть (Stark, 2012), высвобождают ряд антибактериальных белков, в том числе тромбоцидины (ТС-1 и ТС-2), играющие центральную роль во врожденном иммунитете и первоначально обнаруженные в нейтрофилах (Jenne et al., 2013). В кровотоке тромбоциты связываются с лейкоцитами, образуя циркулирующие тромбоцитарно-лейкоцитарные агрегаты за счет быстрого обратимого взаимодействия P-селектина (CD62P) на поверхности тромбоцита с лигандом 1 гликопротеина Р-селектина (PSGL-1) на плазмолемме лейкоцитов. Это начальное связывание усиливается взаимодействием различных других рецепторов, в зависимости от подтипа лейкоцитов, что приводит к взаимной активации и локальному выделению цитокинов, которые модулируют иммунные ответы (Kral et al., 2016).
Благодаря разнообразным молекулам адгезии и хемокинов, тромбоциты способны прилипать к лейкоцитам и облегчают их вербовку в места повреждения. Связывание активированных тромбоцитов с лейкоцитами стимулирует выделение цитокинов, окислительный взрыв, фагоцитоз и образование внеклеточных ловушек нейтрофилов (NETs). Тромбоциты могут усиливать или уменьшать продукцию лейкоцитарных цитокинов, демонстрируя, что взаимодействия тромбоцитов и лейкоцитов представляют собой тонкую сбалансированную систему. Тромбоциты содержат хемокины и цитокины, в частности CXCL4 (PF-4), в концентрациях, превышающих концентрацию в плазме в 1000 раз. Показано, что PF-4 стимулирует активацию и дифференцировку моноцитов, а также адгезию нейтрофилов (Gleissner et al., 2008). Тромбоциты и микрочастицы – мембранные фрагменты тромбоцитов, высвобождаемые при стимуляции, могут непосредственно взаимодействовать с нейтрофилами и усиливать фагоцитоз (Hurley et al., 2015).
Особого внимания заслуживают контактные взаимодействия между тромбоцитами и лейкоцитами. Установлено, что тромбоциты могут взаимодействовать с нейтрофилами, эозинофилами, моноцитами и лимфоцитами (Li, 2008). Таким образом, тромбоциты, благодаря экспрессии специфических адгезионных молекул, TLRs, секреции хемокинов, цитокинов и активных форм кислорода, способны устанавливать сигнальные и адгезионные взаимосвязи с нейтрофилами, моноцитами и лимфоцитами. Полученные сведения о различных типах лейкоцитов, субпопуляциях лимфоцитов, адгезивных молекулах, принимающих участие в образовании тромбоцитарно-лейкоцитарных агрегатов, раскрывают новые возможности для изучения механизмов миграции клеток (Sviridova et al., 2018).
Реакция лейкоцитов на контакт с исследуемыми гемосорбентами схожа с реакцией тромбоцитов, но менее выражена (рис. 1в). В снижении числа лейкоцитов тоже можно выделить пассивную составляющую (разведение крови на колонке) и активный компонент (адгезия клеток на сорбентах). Необходимо отметить, что в процессе контакта крови с волокнами хитозана число лейкоцитов снижается, достигая минимума в пробе “60 мин”. При контакте крови с углеродным сорбентом происходит адгезия этих клеток, достигая максимума в 20-минутной пробе, после чего происходит их отлипание от сорбента.
Гемоконтактное взаимодействие лейкоцитов обеспечивают факторы межклеточного взаимодействия, т.е. адгезивные молекулы. Взаимодействие клетка–клетка и клетка–субстрат обеспечиваются различными семействами рецепторов, которые в большом разнообразии присутствуют и могут экспрессироваться на мембране лейкоцитов. К ним отнсятся семейство селектинов, обеспечивающих первичное контактное взаимодействие (L-, P-, E-селектины); семейство интегринов, отвечающих за прочное связывание с субстратом и распластывание лейкоцитов, которое обеспечивается связками CD11a/CD18–ICAM-1, CD11a/CD18–ICAM-2 (для всех лейкоцитов), CD11b/CD18–ICAM-1 и CD11c/CD18– CAM-1 (для гранулоцитов и моноцитов), VLA-4–VCAM-1 (для лимфоцитов, моноцитов, эозинофилов, базофилов); суперсемейство иммуноглобулинов, обеспечивающих связывание растворимых и поверхностных клеточных лигандов (ICAM-1, ICAM-2, VCAM-1 и др.); семейство кадгеринов, играющих существенную роль в эмбриологии на начальном этапе межклеточных взаимодействий на стадии морфо- и органогенеза (E-, N-, P-кадгерины) (Белоцкий и др., 2008; Кузнецов и др., 2017).
Если адгезия – феномен межклеточного и клеточно-матриксного взаимодействия, то возникает вопрос, за счет чего идет фиксация лейкоцитов на поверхности искусственных материалов? Так как лигандами адгезинов являются мембранные белки клетки-партнера, а также фиксированные на мембране такой клетки белки активированных гуморальных систем, классифицируемые как “приобретенные” рецепторы (iC3b, высокомолекулярный кининоген, фактор Х, фибриноген и др.), то можно предположить, что, как и в случае с тромбоцитами, реакцию лейкоцитов будут обеспечивать лиганды плазмы, сорбированные на поверхности пленок хитозана. Адгезия лейкоцитов – один из показателей активации клеток. Активированная клетка, в частности нейтрофил, стереотипно отвечает на внешний стимул (например, контакт с поверхностью волокон хитозана), максимально мобилизуя свой защитный потенциал.
Нейтрофилы обладают кислородозависимыми и кислородонезависимыми механизмами защиты организма от инфекции. Отличительная черта этих клеток – наличие специализированной системы продукции активных форм кислорода (Янковский, 2000). Нейтрофильные гранулоциты после активации выбрасывают во внеклеточное пространство сетеподобные структуры (NETs), в состав которых входит ДНК, гистоны, а также различные белки и ферменты гранул, такие как эластаза и миелопероксидаза. К кислороднезависимым защитным биоцидным системам относятся белки и пептиды, находящиеся в гранулах нейтрофилов в готовом к применению состоянии, которые могут функционировать как в фаголизосоме, так и в экстрацеллюлярном пространстве. К ним относится группа катионных белков и пептидов – миелопероксидаза, лактоферрин (бактерицидный протеин, увеличивающий проницаемость), эластаза, катепсин G, лизоцим, дефенсины и др. (Кокряков, 2006). Таким образом, активированные лейкоциты способны создавать взаимоусиливающие коопертивные биоцидные системы, совместная мощь которых существенно превосходит по силе составляющие их элементы. Следует отметить, что эти регуляторные и биоцидные системы могут формироваться в крови и являться результатом контактного взаимодействия лейкоцитов с поверхностью гемосорбента, изменяя профиль уже существующих в крови биоактивных молекул (Буркова и др., 2019).
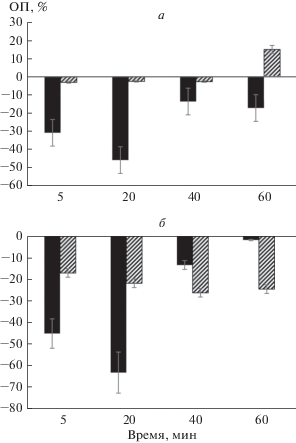
Успешное применение волокон хитозана в клинической практике возможно лишь при отсутствии гемолитической активности, которую регистрировали по спектрограмме и оценивали по изменению ОП плазмы крови (%) при длине волны 414 и 540 нм. Результаты представлены на рис. 2а, б. При контакте крови с волокнами хитозана показатели ОП во всех пробах снижались по сравнению с показателями “до контакта”. Это может быть связано с сорбцией молекул гемоглобина на препарате, так как волокна хитозана обладают выраженными сорбционными свойствами. Максимум сорбционной активности для волокон хитозана отмечали в пробах “20 мин”. Снижение процесса сорбции можно связать с частичным насыщением сорбентов и уменьшением их сорбционной емкости. При контакте крови с угольным сорбентом при длине волны 414 нм в пробах “40 мин” показатель ОП имел тенденцию к снижению (3%), в пробе “60 мин” – ОП увеличивался до 15% относительно пробы до контакта. Это может свидетельствовать о гемолизе клеток крови и выходе в плазму крови свободного гемоглобина. При длине волны 540 нм показатель ОП при контакте с обоими сорбентами был ниже ОП контрольной пробы во всех временных точках, но при этом изменение ОП плазмы в отрицательную сторону относительно контроля было меньше в случае хитозана. Следовательно, можно сделать вывод, что волокна хитозана обладают большей гемосовместимостью, чем гранулы угольного сорбента.
Рис. 2.
Изменение во времени оптической плотности (ОП) плазмы крови при контакте крови с гемосорбентом in vitro при длине волны 414 (а) и 540 (б) нм. Темные столбцы – хитозан, светлые – угольный сорбент. Даны средние значения (%). Вертикальные отрезки показывают стандартное отклонение среднего выборочного значения (ошибку среднего).
ВЫВОДЫ
Изменение концентрации клеточных элементов крови в динамике 60-минутного контакта с волокнами хитозана сравнимы с аналогичными показателями эталонного угольного сорбента. Хитозановые волокна обладают оптимальным соотношением механических характеристик, которые обеспечивают их прочность, эластичность и удобство применения. Можно предположить, что при использовании волокон хитозана в качестве гемоактиватора при проведении МОГ будет получен выраженный клинический эффект.
Таким образом, возможность использования волокон хитозана с терапевтической целью в процедуре МОГ как самостоятельно, так и в качестве нейтральной матрицы для конструирования специфических гемоактиваторов, расширяет спектр практического применения этого биополимера в эффективных медицинских схемах лечения всевозможных заболеваний у человека.
Список литературы
Белоцкий С.М., Авталион Р.Р. 2008. Воспаление. Мобилизация клеток и клинические эффекты. М.: БИНОМ, 240 с. (Belotsky S.M., Avtalion R.R. 2008. Inflammation. Cell mobilization and clinical effects. M.: BINOM. 240 p.)
Буркова Н.В., Киричук О.П., Кузнецов С.И., Юдин В.Е., Дресвянина Е.Н., Романчук Е.В. 2019. Контакт пленок хитозана с клеточными элементами венозной крови человека in vitro. Вестник Смоленской государственной медицинской академии. 18(1) : 34–42. (Burkova N.V., Kirichuk O.P., Kuznetsov S.I., Yudin V.E., Dresvjanina E.N., Romanchuk E.V. 2019. Contact of chitosan films with cellular elements of human venous blood in vitro. Bulletin of Smolensk State Med. Academy. 18(1) : 34–42.)
Буркова Н.В., Киричук О.П., Романчук Е.В., Даванков В.А., Постнов В.Н., Кузнецов С.И. 2018. Изменения спектральных характеристик плазмы при контакте венозной крови человека с гранулированными сорбентами in vitro. Альманах клинической медицины. 46(8) : 772–777. (Burkova N.V., Kirichuk O.P., Romanchuk E.V., Davankov V.A., Postnov V.N., Kuznetsov S.I. 2018. Changes in plasma spectral characteristics during the in vitro contact of human venous blood with granulated sorbents. Almanakh of Clinical Medicine. 46(8) : 772–777.)
Буркова Н.В., Кузнецов С.И., Нохрин С.П., Арсениев Н.А. 2010. Клинические эффекты малообъемной гемоперфузии при лечении критической ишемии нижних конечностей. Эфферентная терапия. 16(3) : 24–27. (Burkova N.V., Kuznetsov S.I., Nohrin S.P., Arseniev N.A. 2010. Clinical effects of small volume hemoperfusion in treatment of critical ischemia of the lower extremities. Efferent therapy. 16(3) : 24–27.)
Буркова Н.В., Кузнецов С.И., Тюкавин А.И. 2011. Эффекты малообъемной перфузии крови, активированной гемосорбентами. Вестник СПб МАПО. 3(3) : 43–51. (Burkova N.V., Kuznecov S.I., Tyukavin A.I. 2011. Effects of low-volume perfusion of blood activated by hemosorbents. Bull. Med. Academy Postgraduate Eeducation. 3(3) : 43–51.)
Буркова Н.В., Кузнецов С.И., Тюкавин А.И. 2013. Контактная твердофазная гемомодуляция. Бюллетень ФЦСКЭ им. В.А. Алмазова. 6 : 28–34. (Burkova N.V., Kuznecov S.I., Tyukavin A.I. 2013. Bulletin of Federal Almazov Med. Res. Centre. 6 : 28–34.)
Буркова Н.В., Тюкавин А.И., Давыдов А.Т. 2013. Клиническое использование метода малообъемной гемоперфузии. Эфферентная терапия. 19(1) : 36–37. (Burkova N.V., Tyukavin A.I., Davydov A.T. 2013. Clinical use of the method of low-volume hemoperfusion. Efferent Therapy. 19(1) : 36–37.)
Дмитриева Л.А., Пивоваров Ю.И., Курильская Т.Е., Сергеева А.С. 2016. Современное состояние проблемы доставки лекарственных средств с использованием эритроцитов в качестве клеток-переносчиков. Патологическая физиол. экспер. терапия. 60(3) : 88–94. (Dmitrieva L.A., Pivovarov YU.I., Kurilskaya T.E., Sergeeva A.S. 2016. Pathological Physiol. Exper. Therapy. 60(3) : 88–94.)
Кокряков В.Н. 2006. Очерки о врожденном иммунитете. СПб.: Наука. 261 c. (Kokryakov V.N. 2006. Essays on innate immunity. SPb.: Science, 261 p.
Кривенцев Ю.А., Никулина Д.М. 2018. Биохимия: строение и роль белков гемоглобинового профиля. М: Юрайт. 73 с. (Kriventsev Yu. A., Nikulina D. M. 2018. Biochemistry: structure and role of hemoglobin proteins. M: Yurayt. 73 p.)
Кузнецов С.И. 2006. Практические аспекты принципа твердофазной контактной активации крови. Успехи совр. естествознания. 2 : 31–32. (Kuznecov S.I. 2006. Advances Modern Natural Sci. 2 : 31–32.)
Кузнецов С.И., Буркова Н.В., Тюкавин А.И. 2013. Контактная твердофазная гемомодуляция. Бюллетень ФЦСКЭ им. В.А. Алмазова. 6 : 28–34 (Kuznetsov S.I., Burkova N.V., Tyukavin A.I. 2013. Solidphase contact hemomodulation. Bull. Federal Almazov Med.l Res. Centre. 6: 28–34.)
Кузнецов С.И., Буркова Н.В., Эйсмонт Ю.А.,Тюкавин А.И. 2003. Гемоконтактное устройство и набор для проведения целевой малообъемной гемоперфузии. Патент RU 33869 U1. Бюллетень 32. (Kuznetsov S.I., Burkova N.V., Eismont Y.A. Tyukavin A.I. 2003. Blood-contact device and set for carrying out the target small hemoperfusion. Patent on the application № 33869, Bulletin 32.)
Кузнецов С.И., Киричук О.П., Буркова Н.В., Даванков В.А., Постнов В.Н., Литвиненко Е.В. 2017. Реакция клеточных элементов крови на контакт с гранулированными сверхсшитым полистиролом и кремнеземами. Трансляционная медицина. 4(4) : 43–55. (Kuznetsov S.I., Kirichuk O.P., Burkova N.V., Davankov V.A., Postnov V.N., Litvinenko E.V. 2017. Reaction of the cellular elements of the blood to the contact with the granulated hypercrosslinked polystyrene and silica. Translat. Med. 4(4) : 43–55.)
Куликов С.Н., Тюрин Ю.А., Фассахов Р.С., Варламов В.П. 2009. Перспективы применения хитина и хитозана в лечении различных форм аллергических заболеваний. Практическая медицина. 3 : 92–97. (Kulikov S.N., Tyurin Yu.A., Fassakhov R.S., Varlamov V.P. 2009. Prospects for the use of chitin and chitosan in the treatment of various forms of allergic diseases. Practical Medicine. 3 : 92–97.)
Рачковская Л.Н., Летягин А.Ю., Бурмистров В.А., Королев М.А., Гельфонд Н.Е., Бородин Ю.И., Коненков В.И. 2015. Модифицированные сорбенты для практического здравоохранения, Сибирский науч. мед. журн. 35(2) : 47–54. (Rachkovskaya, L.N., Letyagin A.Yu., Burmistrov V.A., Korolev M.A., Gelfond N.E. Borodin Y.I., Konenkov V.I. 2015. Modified sorbents for practical health care. Siberian Sci. Med. J. 35(2) : 47–54.)
Янковский О.Ю. 2000. Токсичность кислорода и биологические системы (эволюционные, экологические и медико-биологические аспекты). СПб.: Игра, 294 с. (Jankowski O.Y. Toxicity of oxygen and biological systems (evolutionary, ecological and medical-biological aspects). SPb.: Game, 294 p.
Benesch J., Pentti T. 2002. Blood protein adsorption onto chitosan. Biomaterials. 23 : 2561–2568.
Dai T., Tanaka M., Huangand Y.-Y., Hamblin M.R. 2011. Chitosan preparations for wounds and burns: Antimicrobial and wound-healing effects. Expert Rev. Anti Infect. Ther. 9 : 857–879.
De Maat S., Maas C. 2016. Factor XII: Form determines function J. Thromb. Haemost. 14 : 1498–1506.
Dresvyanina E., Yudenko A., Maevskaya E., Yudin V., Yevlampieva N., Gubarev A., Slyusarenko M., Heppe K. 2018. The molecular mass effect on mechanical properties of chitosan fibers. Vlakna a Textil. 25 : 27–31.
Gleissner C.A., von Hundelshausen P., Ley K. 2008. Platelet chemokines in vascular disease. Arterioscler. Thromb. Vasc. Biol. 28 : 1920–1927.
Hurley S.M., Kahn F., Nordenfelt P., Morgelin M., Sorensen O.E., Shannon O. 2015. Platelet-dependent neutrophil function is dysregulated by M protein from Streptococcus pyogenes. Infect. Immun. 83 : 3515–3525.
Islam S., Rahman Bhuiyan M.A., Islam M.N. 2017. Chitin and chitosan: Structure, properties and applications in biomedical engineering. J. Polymers Environment. 25 : 856–866.
Jenne C.N., Urrutia R., Kubes P. 2013. Platelets: Bridging hemostasis, inflammation, and immunity. Int. J. Lab. Hematol. 35 : 254–261.
Kral J.B., Schrottmaier W.C., Salzmann M., Assinger A. 2016. Platelet Interaction with Innate Immune Cells. Transfus. Med. Hemother. 43 : 78–88.
Levengood S.L., Zhang M. 2014. Chitosan-based scaffolds for bone tissue engineering. J. Mater. Chem. B Mater. Biol. Med. 2 : 3161–3184.
Li N. 2008. Platelet – lymphocyte crosstalk. J. Leukoc. Biol. 83 : 1069–1078.
Qin Y. 2008. The Preparation and characterization of chitosan wound dressings with different degrees of acetylation. J. Applied Polymer Sci. 107 : 993–999.
Rosenwald I.B, Pechet L, Han A., Lu L., Pihan G., Woda B., Chen J.J., Szymanski I. 2001. Expression of translation initiation factors elF-4E and elF-2alpha and a potential physiologic role of continuous protein synthesis in human platelets. Thromb. Haemost. 85 : 142–151.
Shabunin A.S., Yudin V.E., Dobrovolskaya I.P., Zinovyev E.V., Zubov V., Ivan’kova E.M., Morganti P. 2019. Composite wound dressing based on chitin/chitosan nanofibers. Proc. Biomed. Appl. Cosmetics. 6 : 16.
Stark R.J., Aghakasiri N., Rumbaut R.E. 2012. Platelet-derived Toll-like receptor 4 (Tlr-4) is sufficient to promote microvascular thrombosis in endotoxemia. PLoS One. 7 : 41 254–41 267.
Sviridova S.P., Somonova O.V., Kashiya Sh.R., Obukhova O.A., Sotnikov A.V. 2018. The role of platelets in inflammation and immunity. Research’n Practical Med. J. 5 : 40–52.
Venkatesan J., Vinodhini P.A., Sudha P.N., Kim S.K. 2014. Chitin and chitosan composites for bone tissue regeneration. Adv. Food Nutr. Res. 73 : 59–81.
Weyrich A.S., Lindemann S., Tolley N.D., Kraiss L.W., Dixon D.A., Mahoney T.M. 2004. Change in protein phenotype without a nucleus: Translational control in platelets. Semin. Thromb. Hemost. 30 : 491–498.
Weyrich A.S., Zimmerman G.A. 2004. Platelets: Signaling cells in the immune continuum. Trends Immunol. 25 : 489–495.
Yudin V., Dobrovolskaya I., Neelov I., Dresvyanina E., Popryadukhin P., Ivan’kova E., Elokhovskii V., Kasatkin I., Okrugin B., Morganti P. 2014. Wet spinning of fibers made of chitosan and chitin nanofibrils. Carbohydrate Polymers. 108 : 176–182.
Дополнительные материалы отсутствуют.


