Цитология, 2019, T. 61, № 11, стр. 872-882
Экспрессия белковых маркеров адипогенеза в эндометриоидных гетеротопиях
О. В. Малышева 1, *, О. С. Коптева 1, Ю. С. Крылова 1, 2, А. С. Молотков 1, Н. С. Осиновская 1, Н. Ю. Швед 1, 3, М. И. Ярмолинская 1, 4, В. С. Баранов 1
1 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197022 Санкт-Петербург, Россия
3 Санкт-Петербургская городская больница № 40 Курортного р-на, Санкт-Петербург
197706 Сестрорецк, Россия
4 Северо-Западный государственный медицинский университет им. И.И. Мечникова
191015 Санкт-Петербург, Россия
* E-mail: omal99@mail.ru
Поступила в редакцию 19.07.2019
После доработки 16.08.2019
Принята к публикации 19.08.2019
Аннотация
Эндометриоз – широко распространенное заболевание, при котором вне полости матки наблюдаются очаги роста ткани, морфологически и физиологически подобной эндометрию. Ранее мы идентифицировали ряд генов, гиперэкспрессированных в эктопическом эндометрии по сравнению с эутопическим, среди которых особенно выделялись четыре (C7, FABP4, ADH1B и PLA2G2A) с отличием уровня экспрессии в 200–300 раз. В настоящей работе мы верифицировали полученные результаты с помощью методов ПЦР в реальном времении и иммуногистохимии, а также провели исследование экспрессии этих генов в брюшине пациенток с эндометриозом и здоровых женщин. Мы показали, что высокий уровень экспрессии исследованных генов характерен для эндометриоидных гетеротопий и клеток брюшины, но не для эутопического эндометрия. Белки, кодируемые исследованными генами, известны как маркеры адипогенеза (FABP4, PLA2G2A, ADH1B), а белок C7 вовлечен и в дифференцировку стволовых клеток жировой ткани. Одинаково высокий уровень экспрессии исследованных генов в очагах эндометриоза и подлежащей брюшине может говорить об общности происхождения этих тканей, свидетельствуя в пользу метапластической теории происхождения очагов эндометриоза. Кроме того, полученные нами данные могут быть интерпретированы как указание на возможную роль стволовых клеток адипогенного ряда в патогенезе эндометриоза.
Эндометриоз является одним из наиболее распространенных гинекологических заболеваний, уступающим по частоте только миоме матки. Он встречается у 6–10% женщин в популяции, характеризуется снижением качества жизни и является одной из ведущих причин болевого синдрома и бесплодия. Согласно определению ВОЗ под эндометриозом понимают наличие вне полости матки очагов роста ткани, по своей морфологии и физиологии подобной эндометрию. По локализации очагов эндометриоз подразделяют на наружный генитальный (НГЭ) и экстрагенитальный. Экстрагенитальный эндометриоз встречается довольно редко, однако в последнее время отмечается возрастание частоты встречаемости этой формы заболевания. Эктопический рост эндометриоподобной ткани наблюдается при этом в легких, мочевом пузыре, кишечнике и в ряде других мест. НГЭ представлен тремя основными формами: эндометриальные кисты яичника, эндометриоидные инфильтраты (преимущественно ректовагинальной локализации) и эндометриоидные гетеротопии (ЭГ), чаще всего локализующиеся на поверхности брюшины и связочном аппарате малого таза (Ярмолинская, Айламазян, 2017).
Одним из подходов к изучению патогенеза неопластических заболеваний является сравнительный анализ экспрессии генов. В мировой литературе представлено большое число работ, посвященных анализу дифференциальной экспрессии генов при НГЭ, которые значительно различаются между собой как по исследуемому материалу (например, эутопического эндометрия в норме и при эндометриозе; эутопического эндометрия и эндометриоидных кист; первичных культур эндометрия здоровых женщин и пациенток с эндометриозом; эутопического эндометрия и рака эндометрия), так и по методам анализа (ПЦР в реальном времени, транскриптомный анализ на микрочипах, секвенирование РНК).
Ранее нами в лаборатории Пренатальной диагностики НИИ АГиР им. Д.О. Отта совместно с Институтом Биоинформатики (Санкт-Петербург) с помощью метода секвенирования мРНК был проведен анализ дифференциальной экспрессии 421 гена в 8 парных образцах (гетеротопия–эндометрий), полученных от 4 пациенток с эндометриозом в секреторную фазу менструального цикла (Predeus et al., 2018). Мы обнаружили, что в перитонеальных ЭГ по сравнению с эутопическим эндометрием 79 генов гиперэкспрессированы и 84 – гипоэкспрессированы (FDR < 0.05). Среди гиперэкспрессированных особенно выделялись три гена, кодирующие компонент комплемента 7 (C7), белок 4, связывающий жирные кислоты (FABP4), и алкогольдегидрогеназу 1B (ADH1B), для которых значение FDR не превышало 10–15, а различия уровней экспрессии (RQ) были кратны 200–500. Экспрессия гена PLA2G2A, кодирующего секреторную фосфолипазу А2 группы II, также была повышена в материале эндометриоидных гетеротопий, хотя и в несколько меньшей степени (RQ = 190).
Для верификации полученных нами ранее данных и выяснения тканевой и клеточной специфичности экспрессии генов C7, FABP4, PLA2G2A и ADH1B мы проанализировали их экспрессию методом ПЦР в реальном времени в образцах перитонеальных эндометриоидных гетеротопий, эутопического эндометрия и брюшины у пациенток с эндометриозом и у женщин контрольной группы. Содержание одноименных белков (продуктов этих генов) исследовали иммуногистохимически (ИГХ) в аналогичных образцах.
МАТЕРИАЛ И МЕТОДИКА
Материал. Исследовали образцы перитонеальных эндометриоидных гетеротопий и брюшины, полученные в ходе диагностической лапароскопии в отделении оперативной гинекологии НИИ АГиР им. Д.О. Отта (Санкт-Петербург), а также полученные одновременно с ними образцы пайпель-биопсии эутопического эндометрия. Диагноз НГЭ у всех пациенток был подтвержден при визуализации в ходе оперативного вмешательства, а также при гистологическом исследовании образцов в отделе Патоморфологии НИИ АГиР им. Д.О. Отта. Группу контроля составили образцы брюшины и пайпель-биопсии эндометрия, полученные от женщин, проходивших диагностическую лапароскопию, диагноз НГЭ у этих пациенток был исключен в ходе операции. Оперативное вмешательство проводили на 20–24-сут менструального цикла, что соответствует поздней секреторной фазе. Всего в исследование включены образцы тканей от 29 женщин (18 пациенток с эндометриозом и 11 женщин группы контроля), не получавших гормональную терапию в течение 6 месяцев, предшествующих операции. Исследование одобрено Этическим комитетом НИИ АГиР им. Д.О. Отта. Все пациенты подписали информированное согласие на исследование тканей и обработку персональных данных, включая данные историй болезни.
Выделение РНК и обратная транскрипция. Образцы тканей, полученные в ходе хирургического вмешательства, сразу помещали в RNAlater (Ambion, США), и хранили при –70°С до использования. Тотальную РНК выделяли с помощью набора для выделения РНК PureLink RNA Mini kit (Thermo Fisher Scientific, США) в соответствии с инструкцией производителя. Для выделения РНК из образцов эндометрия и брюшины, полученных в ходе оперативного вмешательства, образцы ткани гомогенизировали. При работе с перитонеальными эндометриоидными гетеротопиями хорошо визуализируемую под бинокулярной лупой эндометриоидную ткань механически соскабливали с подлежащей ткани, затем из полученного материала выделяли РНК. Обратную транскрипцию РНК проводили с помощью набора cDNA First Strand Synthesis kit (Thermo Fisher Scientific, США) с обратной транскриптазой MultiScribe и 10-кратным RT (Random Primers, рассеянная затравка), в соответствии с инструкциями производителя.
ПЦР в реальном времени. ОТ-ПЦР в реальном времени проводили для следующих генов: PLA2G2A (кодирует фосфолипазу 2 группы IIА), FABP4 (кодирует белок 4, связывающий жирные кислоты), ADH1B (кодирует алкогольдегидрогеназу 1B) и С7 (кодирует компонент комплемента 7). Два ранее валидированных нами для работы с данным материалом гена MRPL19 и PUM1 использовали в качестве эндогенного контроля.
ПЦР в реальном времени проводили на амплификаторе Real-Time PCR System 7500 (ThermoFisher Scientific, США), используя наборы TaqMan Gene Expression Assay (Thermo Fisher Scientific, США): Hs00179898_m1 для PLA2G2A, Hs01086177_m1 для FABP4, Hs00605175_m1 для ADH1B, Hs00940408_m1 для С7, Hs00608519_m1 для MRPL1 (эндогенный контроль) и Hs00472881_m1 для PUM1 (эндогенный контроль). Расчеты пороговых циклов (Ct) и анализ результатов проводили с помощью программы Expression suite software version 1.1 (ThermoFisher Scientific, США). Сравнение уровней экспрессии генов в исследованных образцах проводили по методу 2–ΔΔСt (Livak, Schmittgen, 2001).
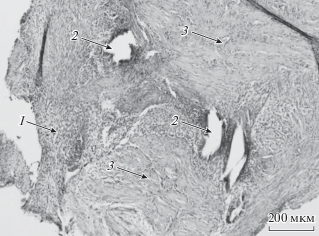
Иммуногистохимический (ИГХ) анализ. Материал фиксировали в нейтральном формалине по стандартной методике и заливали в парафин. Морфологическое исследование проводили на срезах, окрашенных гематоксилином и эозином, на которых оценивали вид патологического процесса и соответствие фазе менструального цикла (рис. 1).
Рис. 1.
Гистологические препараты перитонеальной эндометриоидной гетеротопии у женщин. Эндометриоидная ткань: 1 – строма, 2 – железы; 3 – брюшина. Окраска гематоксилин-эозином. Об.: 100×.
ИГХ-анализ эндометрия проводили на депарафинизированных и дегидратированных срезах с использованием авидин-биотинового иммунопероксидазного метода. Для верификации экспрессии использовали первичные антитела к С7 (ab126786, Abcam, 1 : 300 Великобритания), к FABP4 (ab92501, Abcam, 1 : 1000 Великобритания) и ADH1B (ab175515, Abcam, 1 : 100 Великобритания). В качестве вторичных антител использовали систему детекции EnVision Detection Systems Rabbit/Mouse (Dako, Дания). Использовали отрицательные и положительные контроли. Оценивали ИГХ-реакцию в баллах следующим образом: до 20% окрашенных клеток – 2 балла, от 20 до 40% – 4 балла, более 40% – 6 баллов.
Статистика. Статистическую обработку результатов проводили с помощью пакета GraphPad Prizm 4.0. Для анализа уровня экспрессии показатели ΔСt в каждой группе проверяли на соответствие нормальному распределению и далее проводили межгрупповые сравнения, используя тест ANOVA (дисперсионный анализ). Для попарных сравнений использовали t-критерий Стьюдента. Значимыми считали различия при значении Р > 0.05.
РЕЗУЛЬТАТЫ
Экспрессия генов PLA2G2A, FABP4, ADH1B и С7 в эндометрии и в ЭГ. Ранее мы подтвердили данные о гиперэкспрессии генов PLA2G2A, FABP4 и ADH1B в материале эндометриоидных гетеротопий, полученном на 20–24-е сут менструального цикла по сравнению с эутопическим эндометрием у этих же пациенток (Predeus et al., 2018). При анализе гена С7 мы обнаружили, что его экспрессия также достоверно повышена в материале гетеротопий по сравнению с эутопическим эндометрием (р > 0.001) (рис. 2). Экспрессия гена FABP4 в ЭГ по сравнению с эндометрием была повышена в среднем в 480 раз, гена ADH1В – в 390, гена PLA2G2A – в 190 и гена C7 – в 170 раз (Р > > 0.003) (Predeus et al., 2018).
Рис. 2.
Экспрессия генов ADH1B, PLA2G2A, FABP4 и C7 в брюшине (Бp) пациенток с эндометриозом (Бp-ЭМ), брюшине здоровых женщин (Бp-Конт), эндометриоидных гетеротопиях (Гет) и в эутопическом эндометрии пациенток с эндометриозом (Энд-ЭМ) и здоровых женщин (Энд-Конт). По данным ПЦР а реальном времени, приведены значения ΔCt.
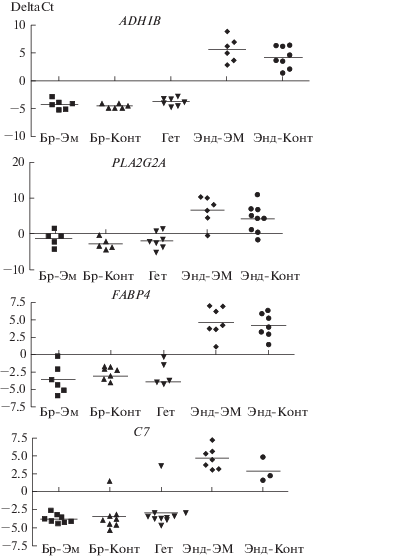
Экспрессия генов PLA2G2A, FABP4, ADH1B и С7 в брюшине у пациенток с НГЭ и у женщин контрольной группы. В процессе роста ЭГ прорастают в подлежащую брюшину (рис. 1), поэтому при выделении материала перитонеальных гетеротопий весьма вероятна контаминация образцов клетками брюшины. Для того, чтобы оценить возможное влияние подлежащих тканей на полученные результаты, мы исследовали экспрессию генов PLA2G2A, FABP4, С7 и ADH1В в 21 образце брюшины, в том числе в 9 образцах, полученных от пациенток с НГЭ и в 12 образцах брюшины здоровых женщин. Мы обнаружили (рис. 2), что экспрессия генов PLA2G2A, FABP4, С7 и ADH1В в брюшине пациенток с НГЭ повышена (Р = 0.001) по сравнению с эутопическим эндометрием, а ее уровень сопоставим и не отличается от такового в материале ЭГ. При сравнении образцов брюшины, полученных от пациенток с эндометриозом и от женщин группы контроля, мы не выявили различий уровней экспрессии генов PLA2G2A (Р = 0.569) и ADH1В (Р = 0.320), но обнаружили повышение (примерно в 5 раз) экспрессии гена FABP4 (Р = 0.015) в брюшине женщин с эндометриозом по сравнению с брюшиной пациенток контрольной группы. Таким образом, экспрессия генов PLA2G2A, FABP4, С7 и ADH1В в ЭГ и в образцах брюшины не различается, а экспрессия гена FABP4 в брюшине у пациенток с эндометриозом выше, чем у здоровых женщин.
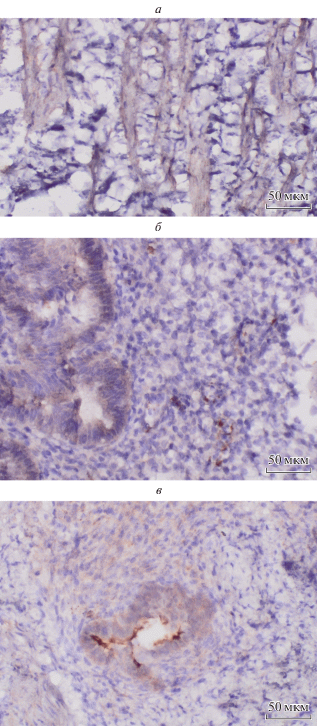
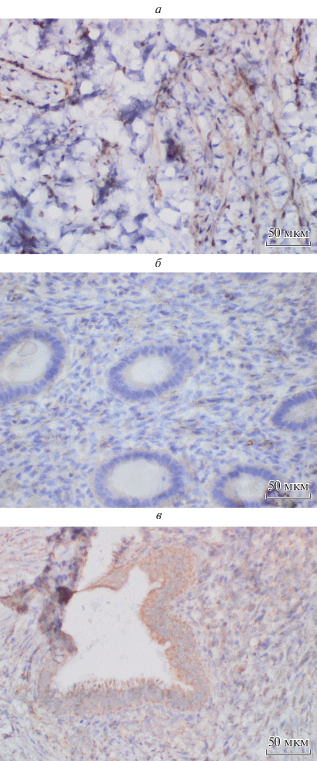
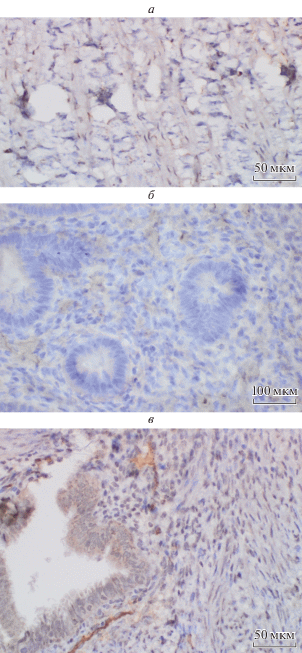
ИГХ-анализ. Для подтверждения данных, полученных нами с помощью ПЦР в реальном времени и оценки возможной контаминации исследуемых перитонеальных гетеротопий подлежащими тканями, было проведено ИГХ-исследование белков ADH1В, С7 и FABP4 в брюшине, эндометриоидных гетеротопиях и в эутопическом эндометрии. Всего в исследование были включены образцы эндометрия, перитонеальных гетеротопий и брюшины, полученные от 4 пациенток с НГЭ на 20–24-е сут менструального цикла. При морфологическом исследовании эутопический эндометрий соответствовал поздней стадии фазы пролиферации, очаги гетеротопий проявляли свойства функциональной активности. При ИГХ-исследовании экспрессии белка ADH1B были получены следующие результаты (рис. 3а–в). В эутопическом эндометрии белок ADH1B отсутствует как в железах, так и в строме (0 баллов); в брюшине отмечается умеренная перинуклеарная (4 балла) экспрессия белка; гетеротопии показали слабую экспрессию в железах (2 балла) и умеренную (4 балла) в строме. Экспрессия белка FABP4 (рис. 4) имеет следующие особенности: белок отсутствует в железах (0 баллов), но отмечается слабая очаговая экспрессия в строме эутопического эндометрия (2 балла). В эндометриоидных гетеротопиях выявили умеренную экспрессии в железах (4 балла) и сильную (6 баллов) в строме и в клетках брюшины (6 баллов) (рис. 4а–в). Белок С7 (рис. 5а–в) отсутствует в эутопическом эндометрии, а в эндометриоидных гетеротопиях уровень этого белка максимален в железистом компоненте (6 баллов) и несколько меньший – в строме (4 балла). В брюшине этот маркер экспрессировался интенсивно (6 баллов) с преимущественной локализацией периваскулярно (рис. 5). Таким образом, данные ИГХ подтвердили результаты, полученные с помощью ПЦР в реальном времени. Экспрессия изученных нами генов резко повышена в эндометриоидных гетеротопиях по сравнению с эутопическим эндометрием и сопоставима с уровнем, наблюдаемым в образцах брюшины. При этом мы показали, что данные, полученные в ходе первого этапа исследования (ПЦР в реальном времени), не являются результатом контаминации образцов эндометриоидных гетеротопий материалом брюшины, а действительно отражают высокий уровень экспрессии изученных генов в данной ткани.
Рис. 3.
Наличие белка ADH1B в брюшине (а), эутопическом эндометрии (б) и гетеротопии (в) у женщин. Иммуногистохимия.
ОБСУЖДЕНИЕ
Согласно полученным результатам, экспрессия изученных генов в эндометриоидных гетеротопиях примерно соответствует уровню, характерному для подлежащей ткани – брюшине. Интересно отметить, что ранее методом высокопроизводительного секвенирования был проведен анализ микроРНК в парных образцах эутопического эндометрия, перитонеальных ЭГ и брюшины у пациенток с НГЭ (Saare et al., 2014). Авторы работы обнаружили, что спектр микроРНК в очагах эндометриоза в значительной степени перекрывается с таковым в подлежащей ткани и значительно отличается от наблюдаемого в эутопическом эндометрии. Четыре микроРНК (miR-143-3p, miR-22-3p, miR-99a-5p и miR-100-5p) составляли 60% всех прочтений в образцах эктопического эндометрия и брюшины. Авторы интерпретировали этот результат как следствие контаминации образцов эктопического эндометрия клетками подлежащих тканей и сделали вывод о необходимости тщательной пробоподготовки при проведении анализа, например, путем микродиссекции материала гетеротопий. В настоящей работе мы также получили данные, свидетельствующие о значительном сходстве транскрипционной активности ряда генов в очагах эндометриоза и в подлежащих тканях. Для того чтобы исключить контаминацию образцов, мы проанализировали наличие соответствующих белков в материале перитонеальных ЭГ in situ и показали, что повышенный по сравнению с эутопическим эндометрием уровень экспрессии всех исследованных генов действительно характерен как для брюшины, так и для ЭГ.
Первые данные о гиперэкспрессии генов FABP4, C7 и PLA2G2A в эндометриоидной ткани по сравнению с эутопическим эндометрием были получены довольно давно (Eyster et al., 2007; Zafrakas et al., 2007; Lousse et al., 2010; Suryawanshi et al., 2014). Однако их анализу не уделяли большого внимания, в частности потому, что возможная роль продуктов этих генов в патогенезе эндометриоза оставалась малопонятной, а попытки использовать продукты этих генов в качестве биомаркеров патологического процесса – неэффективными (Kocbek еt al., 2015). Однако в последнее время были получены принципиально новые сведения о функциях данных генов, которые уместно рассмотреть подробнее.
Из всех исследованных нами генов наиболее очевидным образом с патогенезом НГЭ может быть связан ген PLA2G2A, кодирующий фермент фосфолипазу А2 – один из ключевых регуляторов биосинтеза эйкозаноидов. Этот белок катализирует гидролиз фосфолипидов клеточных мембран с последующим высвобождением арахидоновой кислоты, которая затем метаболизируется в простагландины, тромбоксаны и лейкотриены. Ген PLA2G2A преимущественно экспрессируется в кишечнике, печени, плаценте, простате и жировой ткани. Известно, что его экспрессия в некоторых тканях индуцируется провоспалительными цитокинами, такими как IL-1, IL-6, TNFα (Antonio et al., 2002). Повышенный уровень PLA2G2A в плазме крови является маркером воспаления и сердечно-сосудистой патологии (Kugivama et al., 1999). В экспериментах, проведенных на мышах с нокаутом гена PLA2G2A, было показано, что продукт этого гена необходим для формирования нормальной чувствительности к инсулину и вносит существенный вклад в регуляцию метаболических процессов (Kuefner et al., 2017).
Ген FABP4, кодирующий белок 4, связывающий жирные кислоты и называемый также адипоцитарным FABP (aFABP или aP2), относится к надсемейству FABP, члены которого способны связывать различные гидрофобные лиганды, такие как длинноцепочечные жирные кислоты, эйкозаноиды, лейкотриены и простагландины, и имеют решающее значение в некоторых клеточных процессах, включая поглощение и транспортировку жирных кислот, регуляцию экспрессии генов, связанных с этими процессами, а также пролиферацию и дифференцировку клеток (Zimmerman, Veerkamp, 2002). FABP4 был первоначально идентифицирован как специфический для адипоцитов белок и был признан маркером адипогенеза, однако множество наблюдений свидетельствует о том, что белок FABP4 локализуется в большем количестве типов тканей, чем первоначально предполагалось, и может играть дополнительную биологическую роль в клетках разных типов (Layne et al., 2001; Makowski et al., 2001; Fischer et al., 2006; Shum et al., 2006; Biron-Shental et al., 2007; Elmasri et al., 2009; Lamounier-Zepter et al., 2009; Girona et al., 2013; Kralisch, Fasshauer, 2013; Thompson et al., 2018). В частности, ранее сообщалось, что FABP4 экспрессируется в эпителиальных и стромальных клетках эндометрия, и уровень экспрессии зависит от фазы менструального цикла (Zhu et al., 2015), а также имеет важное значение в процессе децидуализации (Tian et al., 2011).
ADH1B (бета-полипептид алкогольдегидрогеназы I) ранее не обсуждался в связи с эндометриозом. Этот белок присутствует в тканях широкого диапазона, в наибольшей степени его экспрессия характерна для клеток печени и адипоцитов. ADH1B и другие белки этого семейства метаболизируют широкий спектр субстратов, в число которых входят этанол и другие алифатические спирты, а также и гидроксистероиды, и ретинол. Последний под действием алкогольдегидрогеназы I и ретинальальдегиддегидрогеназы превращается сначала в ретинальдегид, а затем в ретиноевую кислоту (РК). РК действует как регулятор дифференцировки в эмбриогенезе позвоночных, контролирует разные стороны клеточной пролиферации и апоптоза (Yang et al., 2018) и рассматривается в настоящее время как один из важных медиаторов опухолевой трансформации ткани, особенно эстрогензависимой (Kunju et al., 2011). Высокий уровень экспрессии гена ADH1B является одним из маркеров прогениторных клеток бурого жира (Tews et al., 2014). Уместно отметить, что согласно нашим данным, полученным ранее при проведении RNAseq (Predeus et al., 2018), ген ADH1C, кодирующий другой компонент алкогольдегидрогеназы 1 (гамма-полипептид алкогольдегидрогеназы I), также гиперэкспрессирован в эктопическом эндометрии.
Система комплемента, частью которой является продукт гена С7, хорошо известна как один из основных компонентов врожденного иммунитета. Однако в последние годы стало очевидно, что функции системы комплемента гораздо шире, она также вовлечена в процессы оплодотворения, миграции и адгезии клеток, морфо- и органогенеза, межклеточные взаимодействия (Hawksworth et al., 2017, 2018). Кроме секретируемой формы белка С7, описаны его мембранные варианты (Bossi et al., 2009).
Недавние исследования показали, что белок С7 может рассматриваться как антионкоген, уровень его экспрессии коррелирует с прогрессией и прогнозом опухоли (Ying et al., 2016), а нокдаун гена С7 подавляет пролиферацию клеток яичника in vitro (Suryawanshi et al., 2014). Наконец, при изучении транскриптома стволовых клеток опухолей печени, были получены неожиданные данные о том, что в число гиперэкспрессированных генов входят некоторые гены системы комплемента (в частности, C7 и CFH) и коагуляции (Seol et al., 2016). В ходе дальнейшей работы авторы подтвердили свое предположение о том, что продукты этих генов необходимы для поддержания стволовых свойств опухолевых клеток и показали, что этот процесс может осуществляться через взаимодействие с транскрипционным фактором LSF-1 (TFCP2). Интересно отметить, что по нашим данным, полученным при исследовании транскриптома эндометриоидных очагов (Predeus et al., 2018), а также по данным других авторов (Suryawanshi et al., 2014), экспрессия гена CFH и некоторых других генов системы комплемента, а также ряда генов системы коагуляции также повышена в эндометриоидных гетеротопиях по сравнению с эутопическим эндометрием, хотя и не так драматично, как экспрессия генов С7, ADH1B, FABP4 и PLA2G2A.
Можно предложить разные механизмы, которые могут связывать гиперэкспрессию изученных нами генов с формированием очагов эндометриоза. Во-первых, три из четырех генов (FABP4, ADH1B, C7) могут быть вовлечены в процессы регуляции дифференцировки клеток, по крайней мере в клетках печени и в адипоцитах. Во-вторых, три гена (FABP4, ADH1B, PLA2G2A) могут быть вовлечены в регуляцию общего метаболизма и ответа на инсулин. Кроме того, высокий уровень экспрессии этих генов характерен для жировой ткани, для которой белки FABP4 и ADH1B рассматриваются многими авторами как маркеры адипогенеза.
Следует отметить, что в литературе имеется большое число работ, посвященных ассоциации повышенного риска развития эндометриоза и таких антропометрических параметров, как низкий вес, низкий индекс массы тела, низкое значение соотношения окружности талии и бедер, уменьшение толщины кожной складки под лопаткой (Shah et al., 2013; Backonja et al., 2016, 2017; Raimondo et al., 2018). Эти результаты однозначно свидетельствуют о том, что развитие эндометриоза связано с адипогенезом и распределением периферической жировой ткани, но конкретные механизмы, ответственные за эту ассоциацию, остаются неизвестными. В частности, исследования уровня адипокинов в плазме крови пациенток с эндометриозом не дали ответа на этот вопрос (Shah et al., 2103). В своей работе мы впервые получили сведения о возможных молекулярных взаимодействиях, посредством которых может быть реализована наблюдаемая ассоциация между вероятностью образования эндометриоидных очагов и особенностями жировой ткани, часто наблюдаемых у пациенток с эндометриозом.
Теоретически эктопический эндометрий может возникать из клеток разного происхождения. Имплантационная теория развития эндометриоза, предложенная еще в 1927 г., предполагает, что вследствие ретроградной менструации фрагменты функционального слоя эндометрия могут попадать в брюшную полость, оседать на поверхности тазовых органов и прорастать в окружающие ткани, формируя эндометриоидные очаги (Sampson, 1927). Более современная версия этой теории предполагает имплантацию стволовых клеток, существование которых в менструальной крови доказано. Стволовые клетки менструальной крови могут происходить от мезенхимных стволовых клеток (МСК) эндометрия или от прогениторных клеток базального слоя эндометрия. Возможно также, что отдельные дифференцированные клетки эндометрия дедифференцируются и приобретают некоторые черты стволовых клеток.
Наиболее известной альтернативой теории ретроградной менструации является метапластическая теория, которая предполагает возможность развития эндометриоидных очагов из клеток мезотелия брюшины (Gruenwald, 1942). Источником эндометриоидных образований в этом случае могут быть МСК брюшины или метаплазировавшие клетки мезотелия. Несколько менее популярная дизонтогенетическая теория предполагает развитие очагов эндометриоза из остатков мюллеровых протоков, которые закладываются в эмбриогенезе в ходе инвагинации целомического эпителия, являющегося, в свою очередь, предшественником брюшины (Ridley, 1968; de Joliniere et al., 2012). Существование эндометриальных желез на брюшине продемонстрировано у плодов человека женского пола, у девочек, не достигших половой зрелости, а также у грызунов, что свидетельствует о возможности роста эндометриеподобной ткани за пределами матки без ретроградной менструации. Таким образом, подобная эндометрию ткань может быть сформирована как в процессе эмбриогенеза, так и в течение жизни пациентки из покоящихся до определенного момента клеток-предшественников, возможно, обладающих стволовыми свойствами.
Теория ретроградной менструации в настоящий момент имеет наибольшее количество сторонников, хотя она не может объяснить все случаи эндометриоза (например, случаи этого заболевания у мужчин, у девочек, не достигших половой зрелости и у пациентов с синдромом Рокитанского–Кюстнера–Майера), а эндометриоидная ткань в очагах заболевания не вполне соответствует представлениям об аутотрансплантате. Теории эмбриональных зачатков и метапластическая, при всей их привлекательности, являются трудно доказуемыми (Redwine, 2002).
Полученные нами данные об экспрессии ряда генов в перитонеальных эндометриоидных гетеротопиях сложно интерпретировать в рамках теории ретроградной менструации. Можно предполагать, что под влиянием подлежащих тканей имплантировавшиеся на брюшину клетки эндометриального происхождения могут приобретать некоторое сходство со своим окружением, однако более убедительной, с нашей точки зрения, выглядит другая трактовка полученных нами результатов. Мы полагаем, что высокий уровень экспрессии некоторых генов, наблюдаемый как в перитонеальных очагах эндометриоза, так и в подлежащей брюшине, может свидетельствовать об общности происхождения этих тканей. Соответственно, эндометриоидная ткань может возникать в результате аномальной дифференцировки стволовых клеток, находящихся в брюшине. Дополнительным свидетельством в пользу такой возможности является тот факт, что для брюшины характерен довольно высокий уровень экспрессии рецепторов половых гормонов, в частности, рецепторов эстрогена I и II типов (гены ESR1 и ESR2), а также рецепторов прогестерона альфа и бета (ген PGR) (собственные данные, готовятся к публикации).
Хорошо известно, что брюшина обладает большим регенеративным потенциалом и можно предполагать существование в ней активного пула стволовых (прогениторных) клеток. Обычно стволовые клетки дифференцируются в зрелые клетки в соответствии со своей нишей, соответственно в норме мультипотентные стволовые клетки брюшной полости должны дифференцироваться в клетки перитонеального типа.
В литературе большое внимание уделяется описанию различий между состоянием брюшины у пациенток с эндометриозом и здоровых женщин. Известно, что при эндометриозе имеются выраженные отклонения со стороны иммунной системы (изменения субпопуляций макрофагов, Т- и В-лимфоцитов, естественных киллерных клеток), системы апоптоза, измененные соотношения цитокинов и ангиогенных факторов и т.д. (Lagana et al., 2013, 2017). Вопрос о том, носят ли эти отклонения первичный характер, или являются реакцией организма на рост эктопической ткани, остается открытым. Мы полагаем, что какие-то из этих особенностей микроокружения брюшины могут являться пусковым механизмом аномальной дифференцировки клеток, приводящей к формированию эктопических эндометроиоидных очагов на брюшине.
Интересно отметить, что одной из характеристик МСК является их способность дифференцироваться в различные клеточные типы, а именно в адипоциты, хондроциты и миоциты. В нашей работе мы показали, что для очагов эндометриоза характерна высокая экспрессия генов, являющихся маркерами адипоцитов (FABP4, ADH1B, PLA2G2A). Ранее при анализе результатов секвенирования РНК для парных образцов эндометрия и эндометриоидных гетеротопий мы получили данные, свидетельствующие о том, что в гетеротопиях повышена экспрессия генов, относящихся к категориям “организации внеклеточного матрикса” и “организации внеклеточных структур”, а также “мышечного сокращения” (Predeus et al., 2018). Эти данные могут быть интерпретированы как проявления разнонаправленной спонтанной дифференцировки МСК при формировании очага эндометриоза. Известно, что мышечные волокна часто могут быть обнаружены в очагах глубокого инфильтративного эндометриоза, преимущественно ректовагинальной локализации. Сведения о наличии ткани с характеристиками мышечных волокон в очагах эндометриоза другой локализации были получены и другими авторами (Anaf et al., 2000). Эти данные, безусловно, нуждаются в дальнейшем уточнении, но они хорошо соответствуют версии развития эндометроиза как патологии, обусловленной аномальной дифференцировкой стволовых клеток брюшины.
Современные терапевтические схемы лечения эндометриоза обычно основаны на гормональной терапии, которая направлена на создание системной гипоэстрогенемии. Ряд препаратов могут оказывать влияние непосредственно на очаг эндометриоза, оказывая антипролиферативное, антиангиогенное и противовоспалительное действие. При этом стволовые клетки и их измененное микроокружение, являющиеся непосредственной причиной развития эндометриоза, могут не попасть под влияние данных схем лечения. Улучшение нашего понимания патогенеза эндометриоза поможет направить дальнейшую работу на более подходящие терапевтические цели, которые могут обеспечить столь необходимые способы лечения эндометриоза.
Список литературы
Ярмолинская М.И., Айламазян Э.К. 2017. Генитальный эндометриоз. Различные грани проблемы. СПб.: Эко-Вектор. 615 с.
Anaf V., Simon P., Fayt I., Noel J. 2000. Smooth muscles are frequent components of endometriotic lesions. Hum. Reprod. 15 : 767–771.
Antonio V., Brouillet A., Janvier B., Monne C., Bereziat G., Andreani M., Rayondjean M. 2002. Transcriptional regulation of the rat type IIA phospholipase A2 gene by cAMP and interleukin-1beta in vascular smooth muscle cells: Interplay of the CCAAT/enhancer binding protein (C/EBP), nuclear factor-kappaB and Ets transcription factors. Biochem J. 368 : 415–424.
Backonja U., Buck Louis G.M., Lauver D.R. 2016. Overall adiposity, adipose tissue distribution, and endometriosis: A systematic review. Nurs. Res. 65 : 151–166.
Backonja U., Hediger M.L., Chen Z., Lauver D.R., Sun L., Peterson C.M., Buck Louis G.M. 2017. Beyond body mass index: Using anthropometric measures and body composition indicators to assess odds of an endometriosis diagnosis. J. Womens Health. 26 : 941–950.
Biron-Shental T., Schaiff W.T., Ratajczak C.K., Bildirici I., Nelson D.M., Sadovsky Y. 2007. Hypoxia regulates the expression of fatty acid-binding proteins in primary term human trophoblasts. Am. J. Obstet. Gynecol. 197 : 516. e1-6. https://doi.org/10.1016/j.ajog.2007.03.066
Bossi F., Rizzi L., Bulla R., Debeus A., Tripodo C., Picotti P., Betto E., Macor P., Pucillo C., Würzner R., Tedesco F. 2009. C7 is expressed on endothelial cells as a trap for the assembling terminal complement complex and may exert anti-inflammatory function. Blood. 113 : 3640–3648.
De Joliniere J.B., Ayoubi J.M., Lesec G., Validire P., Goguin A., Gianaroli L., Dubuisson J.B., Feki A., Gogusev J. 2012. Identification of displaced endometrial glands and embryonic duct remnants in female fetal reproductive tract: Possible pathogenetic role in endometriotic and pelvic neoplastic processes. Front. Physiol. 444. PMID: . https://doi.org/10.3389/fphys.2012.0044423227010
Elmasri H., Karaaslan C., Teper Y., Ghelfi E., Weng M., Ince T.A., Kozakewich H., Bischoff J., Cataltepe S. 2009. Fatty acid binding protein 4 is a target of VEGF and a regulator of cell proliferation in endothelial cells. FASEB J. 23 : 3865–3873.
Eyster K.M., Klinkova O., Kennedy V., Hansen K.A. 2007. Whole genome deoxyribonucleic acid microarray analysis of gene expression in ectopic versus eutopic endometrium. Fertil. Steril. 88 : 1505–1533.
Fischer H., Gustafsson T., Sundberg C.J., Norrbom J., Ekman M., Johansson O., Jansson E. 2006. Fatty acid binding protein 4 in human skeletal muscle. Biochem. Biophys. Res. Commun. 346 : 125–130.
Girona J., Rosales R., Plana N., Saavedra P., Masana L., Vallvé J.C. 2013. FABP4 induces vascular smooth muscle cell proliferation and migration through a MAPK-dependent pathway. PLoS One. 8 : e81914. https://doi.org/10.1371/journal.pone.0081914
Gruenwald P. 1942. Origin of endometriosis from the mesenchyme of the celomic walls. Am. J. Obstetrics Gynecol. 44 : 470–474.
Hawksworth O.A., Coulthard L.G., Mantovani S., Woodruff T.M. 2018. Complement in stem cells and development. Semin. Immunol. 37 : 74–84.
Hawksworth O.A., Coulthard L.G., Woodruff T.M. 2017. Complement in the fundamental processes of the cell. Mol. Immunol. 84 : 17–25.
Kocbek V., Bersinger N.A., Brglez V., Mueller M.D., Petan T., Rižner T.L. 2015. Phospholipase A2 group IIA is elevated in endometriomas but not in peritoneal fluid and serum of ovarian endometriosis patients. Gynecol. Endocrinol. 31 : 214–218.
Kralisch S., Fasshauer M. 2013. Adipocyte fatty acid binding protein: A novel adipokine involved in the pathogenesis of metabolic and vascular disease? Diabetologia. 56 : 10–21.
Kuefner M.S., Pham K., Redd J.R., Stephenson E.J., Harvey I., Deng X., Bridges D., Boilard E., Elam M.B., Park E.A. 2017. Secretory phospholipase A2 group IIA modulates insulin sensitivity and metabolism. J. Lipid. Res. 58 : 1822–1833.
Kunju L.P., Cookingham C., Toy K.A., Chen W., Sabel M.S., Kleer C.G. 2011. EZH2 and ALDH-1 mark breast epithelium at risk for breast cancer development. Mod. Pathol. 24 : 786–793.
Kugiyama K., Ota Y., Takazoe K., Moriyama Y., Kawano H., Miyao Y., Sakamoto T., Soejima H., Ogawa H., Doi H., Sugiyama S., Yasue H. 1999. Circulating levels of secretory type II phospholipase A(2) predict coronary events in patients with coronary artery disease. Circulation. 100 : 1280–1284.
Laganà A.S., Sturlese E., Retto G., Sofo V., Triolo O. 2013. Interplay between misplaced müllerian-derived stem cells and peritoneal immune dysregulation in the pathogenesis of endometriosis. Obstet Gynecol. Article ID: 527041. https://doi.org/10.1155/2013/527041
Laganà A.S., Vitale S.G., Salmeri F.M., Triolo O., Ban Frangež H., Vrtačnik-Bokal E., Stojanovska L., Apostolopoulos V., Granese R., Sofo V. 2017. Unus pro omnibus, omnes pro uno: A novel, evidence-based, unifying theory for the pathogenesis of endometriosis. Med. Hypotheses. 103 : 10–20.
Lamounier-Zepter V., Look C., Alvarez J., Christ T., Ravens U., Schunck W.H., Ehrhart-Bornstein M., Bornstein S.R., Morano I. 2009. Adipocyte fatty acid-binding protein suppresses cardiomyocyte contraction: A new link between obesity and heart disease. Circ. Res. 105: 326–334.
Layne M.D., Patel A., Chen Y.H., Rebel V.I., Carvajal I.M., Pellacani A., Ith B., Zhao D., Schreiber B.M., Yet S.F., Lee M.E., Storch J., Perrella M.A. 2001. Role of macrophage-expressed adipocyte fatty acid binding protein in the development of accelerated atherosclerosis in hypercholesterolemic mice. FASEB J. 15 : 2733–2735.
Livak K.J., Schmittgen T.D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 : 402–408.
Lousse J.C., Defrère S., Colette S., Van Langendonckt A., Donnez J. 2010. Expression of eicosanoid biosynthetic and catabolic enzymes in peritoneal endometriosis. Hum. Reprod. 25 : 734–741.
Makowski L., Boord J.B., Maeda K., Babaev V.R., Uysal K.T., Morgan M.A., Parker R.A., Suttles J., Fazio S., Hotamisligil G.S., Linton M.F. 2001. Lack of macrophage fatty-acid-binding protein aP2 protects mice deficient in apolipoprotein E against atherosclerosis. Nat. Med. 7 : 699–705.
Predeus A.V., Vashukova E.S., Glotov A.S., Danilova M.M., Osinovskaya N.S., Malysheva O.V., Shved N.Yu., Ganbarli N., Yarmolinskaya M.I., Ivashchenko T.E., Baranov V.S. 2018. Next-generation sequencing of matched ectopic and eutopic endometrium identifies novel endometriosis-related genes. Russ. J. Genetics. 54 : 1358–1365.
Raimondo D., Mabrouk M., Zannoni L., Arena A., Zanello M., Benfenati A., Moro E., Paradisi R., Seracchioli R. 2018. Severe ureteral endometriosis: Frequency and risk factors. J. Obstet. Gynaecol. 38 : 257–260.
Redwine D.B. 2002. Was Sampson wrong? Fertil. Steril. 78 : 686–693.
Ridley J.H. 1968. The histogenesis of endometriosis. Obstet. Gynecol. Survey. 23 : 1–35.
Saare M., Rekker K., Laisk-Podar T., Sõritsa D., Roost A.M., Simm J., Velthut-Meikas A., Samuel K., Metsalu T., Karro H., Sõritsa A., Salumets A., Peters M. 2014. High-throughput sequencing approach uncovers the miRNome of peritoneal endometriotic lesions and adjacent healthy tissues. PLoS One. 9: e112630. https://doi.org/10.1371/journal.pone.0112630
Sampson J.A. 1927. Metastatic or embolic endometriosis, due to the menstrual dissemination of endometrial tissue into the venous circulation. Am. J. Pathol. 3 : 93–110.
Seol H.S., Lee S.E., Song J.S., Rhee J.K., Singh S.R., Chang S., Jang S.J. 2016. Complement proteins C7 and CFH control the stemness of liver cancer cells via LSF-1. Cancer Lett. 372 : 24–35.
Shah D.K., Correia K.F., Vitonis A.F., Missmer S.A. 2013. Body size and endometriosis: results from 20 years of follow-up within the Nurses’ Health Study II prospective cohort. Hum. Reprod. 28 : 1783–1792.
Shum B.O., Mackay C.R., Gorgun C.Z., Frost M.J., Kumar R.K., Hotamisligil G.S., Rolph M.S. 2006. The adipocyte fatty acid-binding protein aP2 is required in allergic airway inflammation. J. Clin. Invest. 116 : 2183–2192.
Suryawanshi S. Huang X., Elishaev E., Budiu R.A., Zhang L., Kim S., Donnellan N., Mantia-Smaldone G., Ma T., Tseng G., Lee T., Mansuria S., Edwards R.P., Vlad A.M. 2014. Complement pathway is frequently altered in endometriosis and endometriosis-associated ovarian cancer. Clin. Cancer Res. 20 : 6163–6174.
Tews D., Schwar V., Scheithauer M., Weber T., Fromme T., Klingenspor M., Barth T.F., Möller P., Holzmann K., Debatin K.M., Fischer-Posovszky P., Wabitsch M. 2014. Comparative gene array analysis of progenitor cells from human paired deep neck and subcutaneous adipose tissue. Mol. Cell Endocrinol. 395 : 41–50.
Thompson K.J., Austin R.G., Nazari S.S., Gersin K.S., Iannitti D.A., McKillop I.H. 2018. Altered fatty acid-binding protein 4 (FABP4) expression and function in human and animal models of hepatocellular carcinoma. Liver Int. 38 : 1074–1083.
Tian Z., Zhao Z.A., Liang X.H., Zhang X.H., Sha A.G., Zhang Z.R., Yu Y.S., Yang Z.M. 2011. Expression and function of fatty acid-binding protein 4 during mouse decidualization. Fertil. Steril. 95 : 2749–2752.
Zafrakas M., Tarlatzis B.C, Streichert T., Pournaropoulos F., Wölfle U., Smeets S.J., Wittek B., Grimbizis G., Brakenhoff R.H., Pantel K., Bontis J., Günes C. 2008. Genome-wide microarray gene expression, array-CGH analysis, and telomerase activity in advanced ovarian endometriosis: A high degree of differentiation rather than malignant potential. Int. J. Mol. Med. 21 : 335–344.
Zhu Q., Jin Y., Wang P., Wang H., Lu B., Wang Z., Dong M. 2015. Expression and function of fatty acid-binding protein 4 in epithelial cell of uterine endometrium. Cell Biol Int. 39(5) : 540-7.
Zimmerman A.W., Veerkamp J.H. 2002. New insights into the structure and function of fatty acid-binding proteins. Cell. Mol. Life Sci. 59 : 1096–116.
Yang Y., Luo J., Yu D., Zhang T., Lin Q., Li Q., Wu X., Su Z., Zhang Q., Xiang Q., Huang Y. 2018. Vitamin A promotes leydig cell differentiation via alcohol dehydrogenase 1. Front. Endocrinol. 9 : 644. https://doi.org/10.3389/fendo.2018.00644
Ying L., Zhang F., Pan X., Chen K., Zhang N., Jin J., Wu J., Feng J., Yu H., Jin H., Su D. 2016. Complement component 7 (C7), a potential tumor suppressor, is correlated with tumor progression and prognosis. Oncotarget. 7 : 86536–86546.
Дополнительные материалы отсутствуют.