Цитология, 2019, T. 61, № 11, стр. 883-894
Характеристика прогениторных клеток костного мозга мышей C57BL/6N после 30-суточного антиортостатического вывешивания и 12-часовой реадаптации к опорной нагрузке
Е. А. Маркина 1, *, П. И. Бобылева 1, О. Ю. Алексеева 1, И. В. Андрианова 1, Е. Р. Андреева 1, Л. Б. Буравкова 1
1 Государственный научный центр РФ – Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: goncharova-tim@list.ru
Поступила в редакцию 30.04.2019
После доработки 17.07.2019
Принята к публикации 25.07.2019
Аннотация
Функциональный статус прогениторных клеток костного мозга (КМ), обеспечивающих гемопоэз и гомеостаз костной ткани, определяет многие процессы, развивающиеся в условиях космического полета (КП) и последующей реадаптации к гравитации. Известно, что факторы КП и моделирование их эффектов не вызывают необратимого повреждения пула клеток-предшественников гемопоэтического и стромального дифферонов, при этом изменения функциональной активности прогениторных клеток КМ после моделирования эффектов КП оказались более выраженными по сравнению с реальным полетом. Целью исследования было изучение процессов восстановления функциональной активности прогениторных клеток КМ мышей в период реадаптации к опорной нагрузке после 30-суточного антиортостатического вывешивания. Исследования проводили на самцах мышей 3 групп: виварный контроль, вывешивание и реадаптация. Определяли число выделенных ядросодержащих клеток (ЯСК) КМ, иммунофенотип, пролиферативную активность стромальных клеток КМ, число гемопоэтических колониеобразующих единиц (КОЕ), КОЕ фибробластов, дифференцировочные потенции гемопоэтических и стромальных предшественников КМ. Вывешивание привело к уменьшению числа КОЕ фибробластов и гемопоэтических КОЕ, угнетению спонтанной остеодифференцировки стромальных прогениторов и снижению экспрессии стромальных маркеров. В период реадаптации происходило восстановление функциональной активности стромальных предшественников, при этом полного восстановления гемопоэза не наблюдали.
В перспективе межпланетных экспедиций изучение состояния различных физиологических систем, участвующих в адаптации организма к условиям космического полета (КП), является неотъемлемой частью медико-биологических исследований. Функциональный статус прогениторных клеток костного мозга (КМ), обеспечивающих гемопоэз и гомеостаз костной ткани, определяет многие процессы, развивающиеся в условиях опорной разгрузки и последующей реадаптации к гравитации.
Данные, полученные при изучении влияния КП и моделирования его основных факторов на нишу прогениторных клеток КМ грызунов, демонстрируют, что и в том, и другом случае не происходит необратимого повреждения пула клеток-предшественников гемопоэтического и стромального дифферонов (Маркина и др., 2015, 2017, 2018; Сотнезова и др., 2016; Markina et al., 2018).
После КП наблюдали усиление пролиферативной активности стромальных предшественников и сохранение их клоногенной и дифференцировочной потенций, при этом происходило угнетение миелопоэза. Во время 7-суточной реадаптации в КМ увеличивалась доля ранних недифференцированных предшественников и частично восстанавливался миелопоэз (Маркина и др., 2015; Сотнезова и др., 2016; Markina et al., 2018). В модели антиортостатического вывешивания происходило угнетение функциональной активности стромальных предшественников КМ, снижение клеточности КМ, а также их клоногенной активности и усиление адипопотенциала (Маркина и др., 2017, 2018).
Интересно отметить, что изменения функциональной активности прогениторных клеток КМ после моделирования эффектов КП оказались более выраженными по сравнению с реальным полетом. При сравнительном анализе результатов наземных и полетных экспериментов следует иметь в виду, что при наземном моделировании отсутствует такой существенный фактор, как перегрузки на заключительном этапе КП. Кроме того, в рамках научной программы возвращаемых беспилотных космических аппаратов, например, “Бион-М1” КМ мышей исследовали через 12 ч после приземления (Сычев и др., 2014). Это могло стать причиной наблюдаемых различий полученных полетных результатов и наземных модельных экспериментов, т.к. фактически после полета анализировали данные в период ранней реадаптации.
МАТЕРИАЛ И МЕТОДИКА
Животные. Исследования проводили на самцах мышей линии C57Bl/6N, 19–20-недельного возраста, массой 25–30 г. Животных делили на следующие группы: 1) контрольные животные, содержащиеся на стандартном пищевом рационе в условиях вивария (группа К, n = 6), 2) группа антиортостатического вывешивания в течение 30 сут (В, n = 7), 3) реадаптация, животные в период 12-часовой опорной нагрузки после 30-суточного вывешивания (А, n = 6). Программа эксперимента и все процедуры с животными были одобрены Комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН.
Моделирование эффектов микрогравитации. Экспериментальные животные были подвергнуты воздействию 30-суточного вывешивания, которое является экспериментальной наземной моделью микрогравитации для мелких лабораторных животных (Morey-Holton et al., 2005; Globus et al., 2016).
Выделение ядросодержащих клеток КМ (ЯСК-КМ), определение клеточности. После эвтаназии животных методом цервикальной дислокации из бедренной кости выделяли КМ по общепринятой методике (Meirelles, Nardi, 2003). Для подсчета клеток к клеточной суспензии добавляли лизирующий буфер в соотношении 1 : 10, инкубировали при комнатной температуре в течение 15 мин. После полного лизиса эритроцитов проводили подсчет клеток в камере Небауэра. Культивирование клеток осуществляли в среде α-МЕМ, содержащей 2 мМ глутамина (Gibco, США), 20% эмбриональной телячьей сыворотки (ЭТС) (HyClone, США), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (ПанЭко, Россия), в СО2-инкубаторе (Sanyo, Япония). В работе использовали клетки первичной культуры.
Иммунофенотип ЯСК-КМ. Иммунофенотипирование проводили непосредственно после выделения клеток из КМ мышей, используя моноклональные антитела к следующим поверхностным маркерам: CD90.2, CD44, CD157, CD45, CD106, CD34, Sca-1. Антиген CD34 экспрессируется в основном ранними гемопоэтическими предшественниками, эндотелием капилляров, стромальными клетками костного мозга, тучными клетками и представляет собой молекулу межклеточной адгезии (мукозиалин), играющую роль на ранних этапах гемопоэза (Morel et al., 1996). CD44 – гликопротеин, также известный как Hermes, Pgp1 или H-CAM, экспрессируется на всех лейкоцитах, эндотелиальных клетках, гепатоцитах, остеокластах и мезенхимных клетках (Siclari et al., 2012; Erb et al., 2014). CD45 – общий лейкоцитарный антиген, является членом семейства белковых тирозинфосфатаз, экспрессируется на всех кроветворных клетках, кроме зрелых эритроцитов и тромбоцитов (Taube et al., 2011; Sen et al., 2012).
CD90 (Thy-1) представляет собой гликопротеин, экспрессируемый клетками многих типов, включая Т-клетки, тимоциты, нейроны, эндотелиальные клетки и фибробласты. Он регулирует взаимодействия клетка–клетка и клетка–матрикc (Rege, Hagood, 2006). CD106 – трансмембранный белок, также известный как VCAM-1 или INCAM-110, конститутивно экспрессируется на стромальных клетках КМ, миелоидных предшественниках, селезеночных дендритных клетках, активированных эндотелиальных клетках, а также некоторых лимфоцитах (Yang et al., 2013). CD157 (BST-1) экспрессируется макрофагами, нейтрофилами, стромальными клетками костного мозга, эндотелиальными клетками (Morone et al., 2014). Sca-1 (Ly6A/E) – белок, экспрессируемый на гемопоэтических и стромальных стволовых клетках, периферических B- и Т-лимфоцитах (Holmes et al., 2007).
Аликвоту клеток от каждого пула использовали для выявления поверхностных антигенов с помощью соответствующих моноклональных антител к CD45, CD90.2, CD44, CD157, CD34, конъюгированных с PE (Biolegend, США), и Sca-1, конъюгированных с FITC (Biolegend, США). В качестве изотипического контроля использовали IgG, конъюгированные с PE и FITC (Biolegend, США), того же подкласса, что и специфические антитела. Анализ проводили с использованием проточного цитофлюориметра BD Accuri C6 и программного обеспечения Kaluza Analysis (Beckman Coulter, США).
Криоконсервирование ЯСК-КМ. Полученные после выделения клетки (2–3 млн) помещали в 1 мл среды для замораживания, осторожно ресуспендировали и переносили в пробирки для криоконсервации. Пробирки с суспензией клеток выдерживали 1 ч при температуре −20°С, затем помещали на длительное хранение в криобанк в парах жидкого азота.
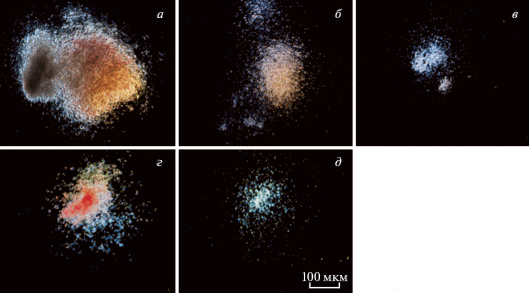
Гемопоэтические колониеобразующие единицы (КОЕ) КМ. Образцы суспензии клеток КМ мышей размораживали при 37°С до появления жидкой фазы и отмывали от криопротектора в избытке среды культивирования α-MEM, содержащей 20% ЭТС. После осаждения клетки КМ мышей ресуспендировали в среде α-MEM с 2% сыворотки и оценивали число живых ЯСК путем окрашивания трипановым синим (Gibco, Англия). Суспензию клеток вносили в полужидкую среду MethoCult (StemCell, Канада). Подготовку образцов и культивирование проводили согласно инструкции производителя. Число и состав колоний оценивали через 8–10 сут с помощью микроскопа Nikon Eclipse TiU (Nikon, Япония). Дальнейшую обработку изображений проводили, используя программное обеспечение NIS-elements (Nikon, Япония) (рис. 1).
Рис. 1.
Гемопоэтические колонии, образованные клетками костного мозга из бедренной кости мышей C57Bl/6N. а – Колониеобразующая единица (КОЕ) гранулоцитов, макрофагов, эритроцитов и мегакариоцитов, б – КОЕ гранулоцитов и макрофагов, в – КОЕ гранулоцитов, г – бурстообразующая единица эритроцитов, д – КОЕ макрофагов. Микроскопия в темном поле. Объектив: Nikon Plan Flour 4/0/13 ∞/1/2 WD16.5.
Определение числа КОЕ фибробластов КМ. Суспензию мононуклеаров КМ высевали при плотности 4 × 104 кл./см2 в чашки Петри 35 мм. Число колоний считали на 14-е сут культивирования после окраски кристаллическим фиолетовым (0.5%-ный раствор) в течение 5 мин.
Пролиферативная активность стромальных клеток КМ. Подсчет культивируемых клеток проводили под световым фазово-контрастным микроскопом (Nikon Eclipse TiU, Япония) с помощью программы Sigma Scan Pro 5 (SPSS, США). Для оценки пролиферативной активности мононуклеаров КМ определяли число удвоений популяций (PD). Расчет проводили по формуле: PD = log2(N/No), где No и N – соответственно начальное и конечное число клеток.
Оценка спонтанного остео- и адипопотенциала стромальных предшественников КМ. ЯСК-КМ высевали при плотности 22 × 105 кл./см2 в чашки Петри 35 мм. Через 7 сут культивирования выявляли активность щелочной фосфатазы в клетках (раннего маркера остеодифференцировки), используя набор Alkaline Phosphatase Kit (Sigma-Aldrich, США) согласно инструкции производителя. Активность фермента определяли по наличию образующегося окрашенного продукта и интенсивности его окраски на микрофотографиях с помощью микроскопа (Nikon Eclipse TiU, Япония). Последующую обработку цифровых изображений проводили при помощи компьютерной программы Sigma Scan Pro 5 (SPSS, США). Продукт реакции имел разные оттенки синего цвета, интенсивность которого отражала активность фермента. Для количественной оценки интенсивности окраски (по сути – активности фермента) при обработке изображений в программе Sigma Scan Pro 5 интенсивность синего цвета разделялась на 256 каналов. На основе этих данных программой строилась диаграмма распределения интенсивности окраски по площади.
Спонтанный адипогенез определяли по наличию липидных включений в цитоплазме после окраски Oil Red О (Sigma, США) на 14-е сут культивирования при помощи микроскопа (Nikon Eclipse TiU, Япония).
Статистическая обработка данных. Использовали пакет программ Microsoft Excel 2010 и Statistica 7.0, а также непараметрический критерий Манна−Уитни. Представлены значения медианы каждой выборки. Различия считали достоверными при P < 0.05.
РЕЗУЛЬТАТЫ
Клеточность. После выделения КМ в суспензии было определено количество клеток КМ. В бедренной кости в контрольной группе число выделенных мононуклеаров составило 36.25 × 106, после антиортостатического вывешивания – 29.23 × 106, а в период реадаптации к опорной нагрузке после вывешивания – 38.25 × 106 клеток. Несмотря на отсутствие достоверных отличий, прослеживается тенденция к снижению клеточности КМ после 30-суточного вывешивания и восстановление ее после возобновления опорной нагрузки (12 ч).
Иммунофенотип. Цитофлуориметрический анализ позволил выявить неоднородность кариоцитов по размеру и уровню экспрессии поверхностных маркеров. Во всех экспериментальных группах большинство клеток (89–99%) экспрессировали маркер CD45. Доля клеток CD45− не превышала 7%. При анализе субпопуляций CD45+-клеток, характерных для КМ (Borowitz et al., 1993; Fransson et al., 2007), было выявлено увеличение доли гранулоцитов, моноцитов и лимфоцитов в группе адаптации по сравнению с контролем и группой вывешивания (рис. 2а).
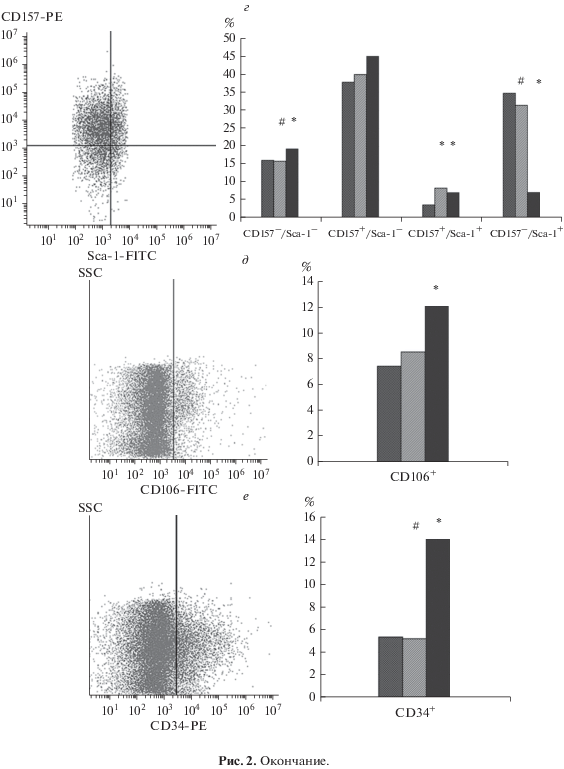
Рис. 2.
Демонстрация поверхностных антигенов клеток костного мозга мышей. Иммунофлуометрический анализ. Слева представлены репрезентативные гистограммы распределения кариоцитов из костного мозга. Справа показаны значения медианы антигенов в каждой группе: 1 – виварный контроль, 2 – 30-суточное антиортостатическое вывешивание, 3 – реадаптация к опорной нагрузке после вывешивания. Антигены: а – CD45 для гранулоцитов (Гра), моноцитов (Мон) и лимфоцтов (Лимф), б – CD90, в – CD44, г – CD157/Sca-1, д – CD106, е – CD34. Отличие от значений группы реадаптации достоверно при #Р ≤ 0.05, от контрольных значений – при *P ≤ 0.01.
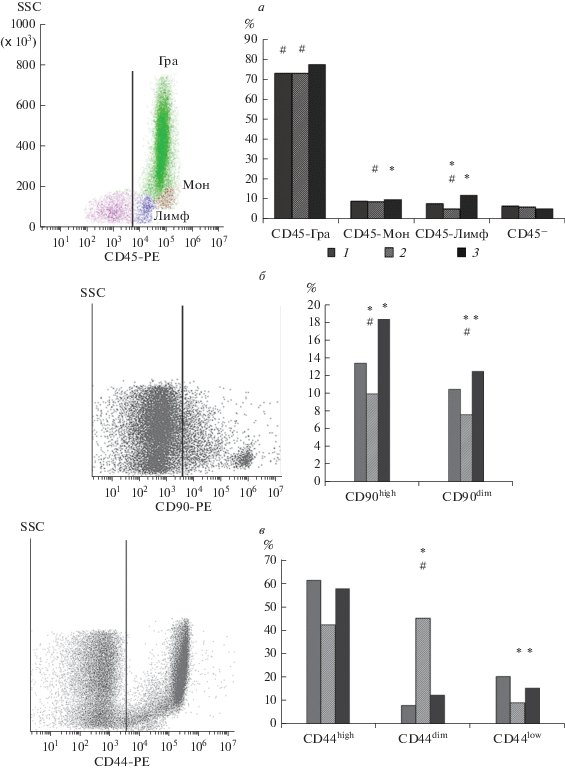
При анализе экспрессии маркера CD90 были выявлены две субпопуляции (рис. 2б): CD90high (мелкие клетки) и CD90dim (крупные клетки). Во время вывешивания происходило уменьшение доли СD90+-клеток в обеих выявленных субпопуляциях. В период острой адаптации их доля увеличивалась по сравнению с группами вывешивания и контроля.
Антиген СD44 экспрессировали клетки трех типов, отличные по размеру: мелкие – CD44low, средние – CD44dim и крупные – CD44high. Во время вывешивания снижалась доля клеток CD44low и CD44high. Через 12 ч после опорной нагрузки доля клеток CD44low, CD44dim и CD44high приближалась к значениям контрольной группы (рис. 2в).
После вывешивания увеличивалась доля CD157+-клеток за счет клеток CD157+/Sca-1+. При этом доля Sca-1+-клеток оставалось схожей с контролем. В период 12-часовой опорной нагрузки после вывешивания наблюдали обратные процессы: увеличивалась доля Sca-1–, а доля Sca-1+-клеток, независимо от экспрессии антигена СD157, уменьшалась (рис. 2г).
Доля CD106-положительных клеток не менялась после вывешивания, при этом 12-часовая опорная нагрузка после него приводила к значительному увеличению доли этих клеток по сравнению с контролем (рис. 2д). В этот период также наблюдали увеличение доли CD34+-клеток относительно контроля и группы вывешивания (рис. 2е).
Клеточный прирост. После вывешивания величина удвоения популяций (PD) клеток не изменялась. В период адаптации к опорной нагрузке происходила активация пролиферации, что демонстрирует увеличение показателя PD в группе реадаптации (2.84 ± 0.22) по сравнению с группами контроля (1.86 ± 0.34) и вывешивания (1.70 ± 0.22).
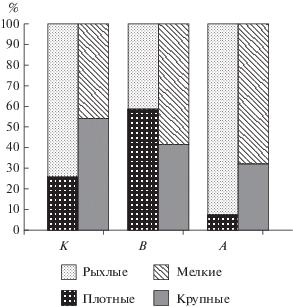
Клоногенная активность стромальных предшественников. Через 14 сут культивирования определяли число КОЕ фибробластов в первичной культуре КМ. Наблюдали уменьшение числа КОЕ в группе вывешивания (6 ± 1), а в период реадаптации (9 ± 2) клоногенная активность стромальных предшественников КМ была сопоставима с контролем (9 ± 2). Изменение опорной нагрузки привело к смещению соотношения разных типов колоний. Если в контрольной группе большинство колоний было рыхлыми, а распределение по размеру составило (%) 50 : 50, то после вывешивания увеличилась доля плотных колоний. В период адаптации практически все колонии были рыхлыми и небольшого размера (рис. 3).
Рис. 3.
Соотношение типов колоний костного мозга мышей разных экспериментальных групп: виварного контроля (К), 30-суточного антиортостатического вывешивания (В) и группы острой адаптации (12 ч) к опорной нагрузке после вывешивания (А).
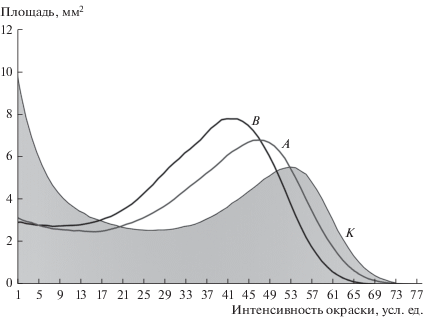
Дифференцировочный потенциал. Спонтанный остеогенный потенциал клеток КМ мышей изменился после вывешивания. Если в контрольной группе можно было наблюдать две популяции клеток – со слабой и выраженной интенсивностью окраски продукта активности фермента щелочной фосфатазы, то после опорной нагрузки преобладали клетки со средней степенью окраски (рис. 4). При этом не происходило изменения средней интенсивности окраски в группе вывешивания относительно контроля. В течение 12 ч после возобновления опорной нагрузки распределение интенсивности окраски не изменилось (рис. 4). Увеличение средней интенсивности окраски может говорить об активации щелочной фосфатазы в стромальных предшественниках в этих условиях.
Рис. 4.
Интенсивность окраски щелочной фосфатазы в стромальных предшественниках костного мозга мышей контрольных (К), группы антиортостатического вывешивания (В) и группы реадаптации к опорной нагрузке (А). Представлены усредненные кривые, построенные на основе данных, полученных при обработке более 50 рандомных полей зрения для каждого эксперимента.
При анализе адиподифференцировки наблюдали большое количество мелких липидных включений в клетках всех изучаемых групп. Отсутствие цитологически значимых различий при оценке спонтанного адипопотенциала стромальных предшественников КМ может свидетельствовать о незначительном вли-янии опорной нагрузки на процессы адипогенеза.
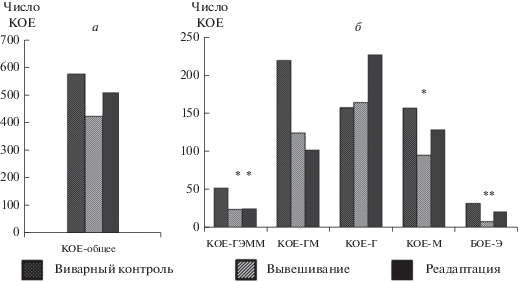
Клоногенная активность гемопоэтических предшественников. Вывешивание в течение 30 сут привело к уменьшению общего числа КОЕ миелоидного ростка (рис. 5а). Наблюдали угнетение макрофагального и эритроидного ростков как на уровне мульти-, так и на уровне унипотентных предшественников (рис. 5б). В период острой адаптации число КОЕ предшественников гранулоцитов и моноцитов (макрофагов) и их общего предшественника стало сравнимым с контрольными значениями. Число КОЕ гранулоцитов, макрофагов и эритроцитов оставалось вдвое меньше контрольных значений.
Рис. 5.
Число гемопоэтических колоний, образованных миелоидными предшественниками костного мозга мышей. а – Общее число колониеобразующих единиц (КОЕ). б – Число КОЕ, образованных различными миелоидными предшественниками: ГЭММ (гранулоциты, эритроциты, макрофаги и мегакариоциты), ГМ (гранулоциты и макрофаги), Г (гранулоциты), М (макрофаги); БОЕ-Э – бурстообразующая единица эритроцитов. Группы животных: К – виварный контроль, В – 30-суточное антиортостатическое вывешивание, А – период острой адаптации к опорной нагрузке после вывешивания. Показаны значения медианы группы. Звездочки показывают достоверность отличия от контрольной группы при *Р ≤ 0.05 или **Р ≤ 0.01.
ОБСУЖДЕНИЕ
Прогениторные клетки стромального дифферона КМ, в том числе и мезенхимные мультипотентные стволовые клетки (ММСК), являются одним из компонентов ниши гемопоэтических стволовых клеток. Они экспрессируют на своей поверхности молекулы, которые отвечают за адгезию и межклеточное взаимодействие и формируют микроокружение, влияющее на функциональный статус и дифференцировку гемопоэтических предшественников (Panaroni et al., 2014). Известно, что стромальные клетки являются механочувствительными (Буравкова и др., 2010), и угнетение их функциональной активности в результате отсутствия опорной нагрузки может стать причиной нарушения процессов кроветворения.
Данные анализа иммунофенотипа показали, что вывешивание приводит к снижению доли CD90+-клеток (рис. 2б). Как известно, Thy-1 в КМ может быть экспрессирован на предшественниках Т-клеток, гемопоэтических стволовых клетках, мезенхимных стромальных клетках, фибробластах, миофибробластах (Juniantito et al., 2013). Известно, что клетки CD90high – в большинстве своем гемопоэтические, а CD90dim – стромальные (Mahajan et al., 2015). Уменьшение доли клеток CD90high (мелких клеток) может говорить о снижении доли ранних гемопоэтических клеток в КМ. Доля крупных клеток, экспрессирующих СD90dim, также снижалась. Белок СD90 считается одним из маркеров остеодифференцировки стромальных предшественников КМ (Paine et al., 2018; Picke et al., 2018), соответственно можно предположить, что доля коммитированных в остеонаправлении клеток уменьшалась. Так как анализ иммунофенотипа проводился на фиксированном числе клеток в каждом образце, процентное содержание антигенных эпитопов коррелирует с абсолютным значением их числа. Увеличение доли клеток, несущих СD90-антиген, в период острой адаптации свидетельствует о чувствительности клеток к величине опорной нагрузки и возможном выходе клеток из лакун костной ткани бедра. Эти данные согласуются с результатами по изучению активности щелочной фосфатазы: в период адаптации наблюдали увеличение средней интенсивности окраски по сравнению с контролем и группой вывешивания.
Молекула адгезии H-CAM (CD44, рецептор к гиалуроной кислоте) играет ключевую роль в механизме взаимодействия CXCL12/CXCR4 при CXCL12-зависимой трансэндотелиальной миграции гемопоэтических стволовых клеток и их закреплении в конкретных нишах (Erb et al., 2014). Уменьшение доли мелких клеток, сопоставимых по размеру с гемопоэтическими клетками костного мозга, может свидетельствовать о снижении численности гемопоэтических клеток в КМ после вывешивания, сохраняющееся и в период 12-часовой реадаптации (рис. 2в). CD44dim-клетки по размерам и степени гранулярности цитоплазмы соответствуют остеокластам (Li et al., 2015). H-CAM участвует в регуляции дифференцировки остеокластов через сигнальный путь NF-κB (Li et al., 2015). После вывешивания наблюдали признаки остеопороза и остеомаляции в задних конечностях мышей. Увеличение доли клеток CD44dim может быть связано с усилением активности остеокластов или увеличением их числа.
BST-1 (CD157) – основной антиген стромальных клеток КМ у мышей. Он обеспечивает взаимодействие клеток с внеклеточным матриксом, в частности с фибронектином, обеспечивая адгезию и хоуминг клеток (Morone et al., 2014). Вывешивание не вызывало уменьшения доли таких клеток, но в период адаптации наблюдали тенденцию к увеличению доли стромальных клеток по сравнению с контролем (рис. 2г). Интересно отметить, что после вывешивания происходило увеличение доли клеток с фенотипом CD157+/Sca-1+, характерного для мезенхимных стволовых клеток КМ мышей (Siclari et al., 2013), сохраняющееся и в период 12-часовой адаптации (рис. 2г). Наши данные показывают, что длительная опорная разгрузка приводила к уменьшению доли остеокоммитированых стромальных клеток в КМ за счет снижения числа CD90+-клеток, но пул малодифференцированных адгезирующих клеток со стромальным фенотипом оставался интактным. В течение 12 ч опорной нагрузки после вывешивания происходит активация процессов остеогенеза в связи с изменившимися окружающими условиями. Скорее всего, этим объясняется состояние Sca-1+-популяции. Sca-1 – является маркером прогениторных клеток (Holmes et al., 2007) и экспрессируется на поверхности гемопоэтических клеток, в зависимости от степени их коммитированости и активности (Morcos et al., 2017).
Вывешивание не приводило к значимому изменению численности гемопоэтических клеток. Данные иммунофенотипирования и числа КОЕ гемопоэтических предшественников миелоидного роста демонстрируют тенденцию к снижению их числа, особенно моноцитарно-макрофагального и эритроидного ростков (рис. 5). Но в период острой адаптации происходит резкое падение доли Sca-1+-клеток (рис. 2г), при этом увеличивается число гемопоэтических КОЕ в КМ (рис. 5), т.е. мы наблюдаем активацию гемопоэза в связи с возросшими потребностями организма в этот период. Это согласуется с результатами по экспрессии CD106 и CD34 (рис. 2д, е): увеличение доли этих клеток свидетельствует об усилении трансэндотелиальной миграции гемопоэтических клеток из КМ в условиях острой адаптации.
Таким образом, анализ данных демонстрирует тенденцию к угнетению гемопоэза у мышей во время вывешивания. Кроме этого, уменьшается доля остеокоммитированных стромальных предшественников на фоне увеличения доли малодифференцированных ММСК, отвечающих за поддержания пула гемопоэтических прогениторов. В период острой адаптации происходила активация прогениторных клеток стромального и гемопоэтического дифферонов, в том числе и на уровне малодифференцированных предшественников.
Интересно сравнить результаты, полученные в ходе наземного моделирования эффектов КП с данными, полученными после реального КП на борту биоспутника “Бион-М1”. При моделировании эффектов микрогравитации во время вывешивания происходило снижение костной массы задних конечностей мышей. При этом на ранних сроках в КМ число стромальных предшественников, в том числе ММСК, с остеогенными потенциями снижалось, а число остеокластов и адипоцитов увеличивалось (Hamrick et al., 2007; Shahnazari et al., 2012). Было отмечено, что при неизменном числе КОЕ фибробластов КМ крыс после вывешивания количество КОЕ фибробластов, экспрессирующих щелочную фосфатазу, значительно снижалось. Уменьшалась и их пролиферативная активность, а также уменьшалась костная масса и число остеобластов (Basso et al., 2005). Эти негативные изменения в костной ткани происходили на фоне резкого уменьшения кровоснабжения костей задних конечностей, причем этот процесс усугублялся со временем (Colleran et al., 2000). В результате сосудистой перестройки, повреждения эндотелий-зависимого механизма вазодилятации и изменений костной структуры нарушалось кровоснабжение КМ (Stabley et al., 2013; Prisby et al., 2015). Также было обнаружено умеренное снижение общей клеточности КМ и численности основных ростков кроветворения (Зубхая, Ефимов, 1995). Снижалось число В-лимфоцитов, при этом число Т-лимфоцитов увеличивалось (Gaignier et al., 2014). В КМ происходило нарушение B-клеточного лимфопоэза и функциональной активности CD4+-лимфоцитов, в том числе лимфоцитов памяти (Nash et al., 1992; Miller, Sonnenfeld, 1994; Pecaut et al., 2000; Lescale et al., 2015).
Ранее нами были показаны негативные влияния вывешивания на функциональную активность прогениторных клеток КМ грызунов. Угнеталась пролиферативная активность ММСК, снижалось число КОЕ фибробластов (Маркина и др., 2017, 2018).
После 30-суточного КП не наблюдали выраженного нарушения функциональной активности стромальных предшественников КМ мышей на фоне резкого угнетения эритропоэза (Маркина и др., 2015; Сотнезова и др., 2016; Markina et al., 2018). Можно предположить, что на результаты могло повлиять то, что взятие биопроб проводили спустя 12 ч после посадки космического аппарата. Результаты изучения процессов восстановления функциональной активности прогениторных клеток КМ мышей в острый период адаптации к опорной нагрузке после 30-суточного антиортостатического вывешивания практически совпадают с данными, полученными после КП по сравнению с состоянием компартмента прогениторных клеток КМ сразу после вывешивания.
Полученные данные демонстрируют, что в первые 12 ч возобновления опорной нагрузки происходит активация механочувствительных клеток КМ, обеспечивающих гомеостаз костной ткани и физиологический гемопоэз. Наблюдается усиление пролиферации и дифференцировки гемопоэтических предшественников миелоидного ростка, однако, этого периода недостаточно для его полного восстановления. Таким образом, стромальные клетки, входящие в состав ниши КМ гемопоэтических клеток, восприимчивы к изменению величины опорной нагрузки, при этом компартмент гемопоэтических прогениторов остается достаточно инертным и 12 ч недостаточно для его восстановления.
Список литературы
Буравкова Л.Б., Гершович П.М., Гершович Ю.Г., Григорьев А.И. 2010. Механизмы гравитационной чувствительности остеогенных клеток-предшественников. Acta Naturae. 2(14) : 30–39. (Buravkova L.B., Gershovich P.M., Gershovich J.G., Grigor’ev A.I. 2010. Mechanisms of gravitational sensitivity of osteogenic precursor cells. Acta Naturae. 2(1) : 28–36.)
Зубхая Т.М., Ефимов В.И. 1995. Комбинированное воздействие длительной гипокинезии и ионизирующего излучения на систему кроветворения и лимфоидные органы крыс. Авиакосм. эколог. мед. 29(5) : 42–46. (Zukhbaya T.M. Efimov V.I. 1995. Combined effect of extended hypokinesia and ionizing radiation on the blood forming system and lymphatic in rats. Aerospace Enviromental Med. 29(5) : 42–46.)
Маркина Е.А., Андрианова И.В., Штемберг А.С., Буравкова Л.Б. 2018. Влияние 30-суточного антиортостатического вывешивания и перегрузки на стромальные клетки-предшественники костного мозга мышей C57Bl/6N. Клеточные технологии в биологии и медицине. 3 : 152–156. (Markina E.A., Andrianova I.V., Shtemberg A.S., Buravkova L.B. 2018. Effect of 30-day hindlimb unloading and hypergravity on bone marrow stromal progenitors in C57Bl/6N mice. Bull. Exper. Biol. Med. 166(1) : 130–134. )https://doi.org/10.1007/s10517-018-4301-9
Маркина Е.А., Бобылева П.И., Андрианова И.В., Андреева Е.Р., Буравкова Л.Б. 2015. Характеристика популяции стромальных предшественников костного мозга мышей С57Bl/6N после космического полета на биоспутнике “Бион-М1”. Авиакосм. эколог. мед. 49(6) : 41–48. (Markina E.A., Bobyleva P.I., Andrianova I.V., Andreeva E.R., Buravkova L.B. 2015. Profile of the marrow-derived stromal precursors population in С57Bl/6N mice flown on biosatellite BION-M1. Aviakosm. Ekolog. Med. 49(6) : 41–48.)
Маркина Е.А., Кохан В.С., Рое М.П., Андрианова И.В., Штемберг А.С., Буравкова Л.Б. 2017. Влияние ионизирующего излучения и антиортостатического вывешивания на прогениторные клетки костного мозга крыс. Цитология. 59(12) : 846–856. (Markina E.A., Kokhan V.S., Roe M.P., Andrianova I.V., Shtemberg A.S., Buravkova L.B. 2018. The Effects of radiation and hindlimb unloading on rat bone marrow progenitor cells. Cell Tiss. Biol. 12(3): 183–196.)
Сотнезова Е.В., Маркина Е.А., Андреева Е.Р, Буравкова Л.Б. 2016. Миелоидные предшественники в костном мозге мышей после 30-ти суточного полета на биоспутнике “Бион-М1”. Бюлл. Эксп. Биол. Мед. 162(10) : 495–499. (Sotnezova E.V., Markina E.A., Andreeva E.R., Buravkova L.B. 2017. Myeloid precursors in the bone marrow of mice after a 30-day space mission on a Bion-M1 biosatellite. Bull. Exper. Biol. Med. 162(4) : 496–500. ).https://doi.org/10.1007/s10517-017-3647-8
Сычев В.Н., Ильин Е.А., Ярманова Е.Н., Раков Д.В., Ушаков И.Б., Кирилин А.Н., Орлов О.И., Григорьев А.И. 2014. Проект “Бион-М1”: Общая характеристика и предварительные итоги. Авиакосм. эколог. мед. 48(1) : 7–14. (Sychev V.N., Ilyin E.A., Yarmanova E.N., Rakov D.V., Ushakov I.B., Kirilin A.N., Orlov O.I., Grigoriev A.I. 2014. The BION-M1 project: Overview and first results. Aviakosm. Ekolog. Med. 2014. 48(1) : 7–14.)
Basso N., Jia Y., Bellows C.G., Heersche J.N. 2005. The effect of reloading on bone volume, osteoblast number, and osteoprogenitor characteristics: Studies in hind limb unloaded rats. Bone. 37 : 370–378.
Borowitz M.J., Guenther K.L., Shults K.E., Stelzer G.T. 1993. Immunophenotyping of acute leukemia by flow cytometric analysis. Use of CD45 and right-angle light scatter to gate on leukemic blasts in three-color analysis. Am. J. Clin. Pathol. 100 : 534–540.
Colleran P.N., Wilkerson M.K., Bloomfield S.A., Suva L.J., Turner R.T., Delp M.D. 2000. Alterations in skeletal perfusion with simulated microgravity: А possible mechanism for bone remodeling. J. Appl. Physiol. 189 : 1046–1054.
Erb U., Megaptche A.P., Gu X., Büchler M.W., Zöller M. 2014. CD44 standard and CD44v10 isoform expression on leukemia cells distinctly influences niche embedding of hematopoietic stem cells. J. Hematol. Oncol. 31 : 7–29. https://doi.org/10.1186/1756-8722-7-29
Fransson M., Benson M., Erjefält J.S., Jansson L., Uddman R., Björnsson S., Cardell L.O., Adner M. 2007. Expression of Toll-like receptor 9 in nose, peripheral blood and bone marrow during symptomatic allergic rhinitis. Resp. Res. 28 : 8–17.
Gaignier F., Schenten V., De Carvalho Bittencourt M., Gauquelin-Koch G., Frippiat J.P., Legrand-Frossi C. 2014. Three weeks of murine hindlimb unloading induces shifts from B to T and from Th to Tc splenic lymphocytes in absence of stress and differentially reduces cell-specific mitogenic responses. PLoS One. 9 : e92664.
Globus R.K., Morey-Holton E.R. 2016. Hindlimb unloading: Rodent analog for microgravity. J. Appl. Physiol. jap.00997.2015. https://doi.org/10.1152/japplphysiol.00997.2015
Hamrick M., Shi X., Zhang W., Pennington C., Thakore H., Haque M., Kang B., Isales C.M., Fulzele S., Wenger K. 2007. Loss of Myostatin (GDF8) Function increases osteogenic differentiation of bone marrow-derived mesenchymal stem cells but the osteogenic effect is ablated with unloading. Bone. 40 : 1544–1553.
Holmes C. Stanford W.L. 2007. Concise review: Stem cell antigen-1: Expression, function, and enigma. Stem Cells. 25 : 1339–1347.https://doi.org/10.1634/stemcells.2006-0644
Juniantito V., Izawa T., Yuasa T., Ichikawa C., Tanaka M, Kuwamura M., Yamate J. 2013. Immunophenotypical analysis of myofibroblasts and mesenchymal cells in the bleomycin-induced rat scleroderma, with particular reference to their origin. Exp. Toxicol. Pathol. 65 : 567–577.
Lescale C., Schenten V., Djeghloul D., Bennabi M., Gaignier F., Vandamme, K., Strazielle C., Kuzniak I., Petite H., Dosquet C., Frippiat J.P., Goodhardt M. 2015. Hindlimb unloading, a model of spaceflight conditions, leads to decreased B lymphopoiesis similar to aging. FASEB J. 29 : 455–463.
Li Y., Zhong G., Sun W., Zhao C., Zhang P., Song J., Zhao D., Jin X., Li Q., Ling S., Li Y. 2015. CD44 deficiency inhibits unloading induced cortical bone loss through downregulation of osteoclast activity. Sci. Rep. 5 : 16124. https://doi.org/10.1038/srep16124
Mahajan M.M., Cheng B., Beyer A.I., Mulvaney U.S., Wilkinson M.B., Fomin M.E., Muench M.O. 2015. A quantitative assessment of the content of hematopoietic stem cells in mouse and human endosteal-bone marrow: А simple and rapid method for the isolation of mouse central bone marrow. BMC Hematol. 15 : 9. https://doi.org/10.1186/s12878-015-0031-7
Markina E., Andreeva E., Andrianova I., Sotnezova E., Buravkova L. 2018. Stromal and hematopoietic progenitors from C57/BI/6N murine bone marrow after 30-Day “BION-M1” spaceflight. Stem Cells Dev. 27 : 1268–1277. https://doi.org/10.1089/scd.2017.0264
Meirelles Lda.S., Nardi N.B. 2003. Murine marrow-derived mesenchymal stem cell: Isolation, in vitro expansion, and characterization. Br. J. Haematol. 123 : 702–711.
Miller E.S, Sonnenfeld G. 1994. Influence of antiorthostatic suspension on resistance to murine Listeria monocytogenes infection. J. Leukoc. Biol. 55 : 371–378.
Morcos M.N.F., Schoedel K.B., Hoppe A., Behrendt R., Basak O., Clevers H.C., Roers A., Gerbaulet A. 2017. SCA-1 Expression Level Identifies Quiescent Hematopoietic Stem and Progenitor Cells. Stem Cell Reports. 8 : 1472–1478. https://doi.org/10.1016/j.stemcr.2017.04.012
Morel F., Szilvassy S.J., Travis M., Chen B., Galy A. 1996. Primitive hematopoietic cells in murine bone marrow express the CD34 antigen. Blood. 88 : 3774–3784.
Morey-Holton E.R., Globus R.K., Kaplansky A., Durnova G. 2005. The hindlimb unloading rat model: Overview, technique update and comparision with space flight data. Adv. Space Biol. Med. 10 : 7–40.
Morone S., Augeri S., Cuccioloni M., Mozzicafreddo M., Angeletti M., Lo Buono N., Giacomino A., Ortolan E., Funaro A. 2014. Binding of CD157 protein to fibronectin regulates cell adhesion and spreading. J. Biol. Chem. 289 : 15 588–15 601. https://doi.org/10.1074/jbc.M113.535070
Nash P.V., Konstantinova I.V., Fuchs B.B., Rakhmilevich A.L., Lesnyak A.T., Mastro A.M. 1992. Effect of spaceflight on lymphocyte proliferation and interleukin-2 production. J. Appl. Physiol. 73 : 186–190.
Paine A., Woeller C.F., Zhang H., de la Luz Garcia-Hernandez M., Huertas N., Xing L., Phipps R.P., Ritchlin C.T. 2018. Thy1 is a positive regulator of osteoblast differentiation and modulates bone homeostasis in obese mice. FASEB J. 32 : 3174–3183. https://doi.org/10.1096/fj.201701379R
Panaroni C., Tzeng Y., Saeed H., Wu J.Y. 2014. Mesenchymal progenitors and osteoblast lineage in bone marrow hematopoietic niches. Curr. Osteoporos Rep. 12 : 22–32.
Pecaut M.J., Simske S.J., Fleshner M. 2000. Spaceflight induces changes in splenocyte subpopulations: Effectiveness of ground-based models. Am. J. Physiol. Regul. Integr. Comp. Physiol. 279 : 2072–2078.
Picke A.K., Campbell G.M., Schmidt F.N., Busse B., Rauner M., Simon J.C., Anderegg U., Hofbauer L.C., Saalbach A. 2018. Thy-1 deficiency augments bone loss in obesity by affecting bone formation and resorption. Front. Cell Dev. Biol. 6 : 127. https://doi.org/10.3389/fcell.2018.00127
Prisby R.D., Behnke B.J., Allen M.R., Delp M.D. 2015. Effects of skeletal unloading on the vasomotor properties of the rat femur principal nutrient artery. J. Appl. Physiol. 118 : 980–988.
Rege T.A., Hagood J.S. 2006. Thy-1 as a regulator of cell-cell and cell-matrix interactions in axon regeneration, apoptosis, adhesion, migration, cancer, and fibrosis. FASEB J. 20 : 1045–1054.
Sen A., Rothenberg M.E., Mukherjee G., Feng N., Kalisky T., Nair N., Johnstone I.M., Clarke M.F., Greenberg H.B. 2012. Innate immune response to homologous rotavirus infection in the small intestinal villous epithelium at single-cell resolution. Proc. Natl. Acad. Sci. USA. 109 : 20 667–20 672. https://doi.org/10.1073/pnas.1212188109
Shahnazari M., Kurimoto P., Boudignon B.M., Orwoll B.E., Bikle D.D., Halloran B.P. 2012. Simulated spaceflight produces a rapid and sustained loss of osteoprogenitors and an acute but transitory rise of osteoclast precursors in two genetic strains of mice. Am. J. Physiol. Endocrinol. Metab. 303 : 1354–1362.
Siclari V.A., Zhu J., Akiyama K., Liu F., Zhang X., Chandra A., Nah H.D., Shi S., Qin L. 2013. Mesenchymal progenitors residing close to the bone surface are functionally distinct from those in the central bone marrow. Bone. 53 : 575–586. https://doi.org/10.1016/j.bone.2012.12.013
Stabley J.N., Prisby R.D., Behnke B.J., Delp M.D. 2013. Chronic skeletal unloading of the rat femur: Mechanisms and functional consequences of vascular remodeling. Bone. 57 : 355–360.
Taube C., Tertilt C., Gyülveszi G., Dehzad N., Kreymborg K., Schneeweiss K., Michel E., Reuter S., Renauld J.C., Arnold-Schild D., Schild H., Buhl R., Becher B. 2011. IL-22 is produced by innate lymphoid cells and limits inflammation in allergic airway disease. PLoS One. 6 : e21799. https://doi.org/10.1371/journal.pone.0021799
Yang Z.X., Han Z.B., Ji Y.R., Wang Y.W., Liang L., Chi Y., Yang S.G., Li L.N., Luo W.F., Li J.P., Chen D.D., Du W.J., Cao X.C., Zhuo G.S., Wang T., Han Z.C. 2013. CD106 identifies a subpopulation of mesenchymal stem cells with unique immunomodulatory properties. PLoS One. 8 : e59354. https://doi.org/10.1371/journal.pone.0059354
Дополнительные материалы отсутствуют.


