Цитология, 2019, T. 61, № 12, стр. 1014-1022
Изменение состояния нейронов продолговатого мозга рыб Perccottus glehni во время зимовки (ультраструктурное и биохимическое исследование)
Р. Я. Гордон 1, *, И. М. Санталова 2, И. Б. Михеева 2, М. В. Каранова 1, С. С. Хуцян 1, 2
1 Институт биофизики клетки РАН
142290 Московская область, Пущино, Россия
2 Институт теоретической и экспериментальной биофизики РАН
142290 Московская область, Пущино, Россия
* E-mail: ritagordon0510@gmail.com
Поступила в редакцию 05.07.2019
После доработки 12.08.2019
Принята к публикации 26.08.2019
Аннотация
Цель данного исследования заключалась в проведении сравнительного анализа ультраструктуры нейронов продолговатого мозга (ПМ) рыб во время зимовки и выявлении роли компонент систем синтеза и распада при адаптации к неблагоприятным условиям (гипоксия, гипотермия, голодание). Маутнеровские нейроны (МН), локализованные в ПМ, обладают широким набором метаболических и функциональных возможностей. Показано, что они способны накапливать гликоген, имея собственную систему гликогенеза, гликогенолиза и депонирования гликогена, который является альтернативным источником энергии во время зимовки. Исследование нейронов ПМ, расположенных вблизи соматической части МН, показало, что одна часть этих клеток, так же как и МН, способна индуцировать аналогичный дополнительный источник энергии – гликоген, на что указывает появление полей гликогена в их цитоплазме во время зимовки. В таких клетках, как и в МН, в этот период компоненты ультраструктуры сохраняются в активном состоянии. В них шероховатый эндоплазматический ретикулум и полирибосомы сохраняют интактную структуру. При этом значительно реорганизуется АГ и активизируется катаболическая система. В другой части соседних с МН клеток, в которых отсутствуют накопления гликогена, наблюдается структурная деградация. Таким образом, особенности ультраструктуры исследованных нейронов ПМ указывают на важную роль гликогена в их функционировании в период зимовки. Можно предположить, что в продолговатом мозге МН и часть нейронов сохраняют свою активность, образуя специфические центры, которые участвуют в адаптации рыб к неблагоприятным условиям зимовки.
Продолговатый мозг (ПМ) играет важную роль в обеспечении жизнедеятельности рыб, являясь интегрирующим отделом ЦНС, обеспечивающим адекватную реакцию организма на изменение внешней среды. В состав продолговатого мозга рыб входит множество нейронов разных типов. В частности ПМ включает Маутнеровские нейроны (МН), которые управляют жизненно важными двигательными реакциями рыб (Eaton et al., 1977; Мошков, 1985; Weis et al., 2006). Эти клетки обладают широким набором метаболических возможностей и способны осуществлять специфические процессы, несвойственные для большинства нервных клеток. Адаптируясь к неблагоприятным условиям зимовки (гипоксия, гипотермия, голодание), МН для поддержания энергетического баланса индуцируют дополнительный источник энергии – систему синтеза, накопления и использования гликогена (Santalova et al., 2018).
В активно функционирующих клетках энергетические потребности в суровых условиях окружающей среды (дефицит кислорода и питательных веществ, изменения температуры) не могут быть обеспечены обычным путем (Иванов, 2004), когда в качестве субстратов энергетического обмена используются лактат, глюкоза и глутамат (Caspenter et al., 2015; Falkowska et al., 2015). В этом случае основным быстро мобилизуемым энергетическим источником может быть депо гликогена клетки, что особенно важно при дефиците пищи и кислорода как источников энергетических субстратов в период зимовки рыб.
Учитывая многочисленные связи МН с другими нейронами (Kimmel et al., 1981) и разнообразный клеточный состав ПМ, можно предположить, что в структуре ПМ существует определенная система клеток, которые, взаимодействуя с МН, участвуют в адаптации рыб к смене функционального состояния в течение годового цикла.
Для выявления таких нейронов был проведен ультраструктурный анализ ряда соседних с МН клеток. Одним из основных показателей адаптации нейронов к изменениям окружающей среды является способность к сохранению и восстановлению белкового синтеза путем поддержание баланса между системами синтеза и деградации компонентов клетки.
Целью данного исследования было проведение сравнительного анализа ультраструктуры нейронов продолговатого мозга (ПМ) во время зимовки и выявление роли компонентов систем синтеза и распада в адаптации к неблагоприятным условиям (гипоксия, гипотермия, голодание).
МАТЕРИАЛ И МЕТОДИКА
В работе использовали пресноводную рыбу ротан Percсottus glеhni. Эта рыба, представитель пресноводных пойкилотермных водных организмов, обитает в прудах, небольших озерах, водно-болотных угодьях и пойменных реках, где вода зимой замерзает до дна. Percсottus glеhni обладает низкой оксифильностью и может жить в сильно загрязненной воде без особых условий обеспечения существования, что удобно для лабораторных исследований (Santalova et al., 2018). Рыбу вылавливали в озере Тульчино (Россия, Московская область; на широте 54.5° северной широты и 37.3° восточной долготы). Половозрелые животные длиной 8–12 см с массой тела около 200 г были разделены на три группы: 1-я группа (n = 6): контроль, активное состояние (июль); 2-я группа (n = 6): начало зимовки (конец декабря); 3-я группа (n = 6): конец зимовки (март). Все экспериментальные процедуры были выполнены в соответствии с руководящими принципами по уходу и использованию экспериментальных животных, утвержденными Комитетом по этике обращения с животными в Институте теоретической и экспериментальной биофизики РАН.
Рыбы контрольной группы, выловленные летом, были немедленно взяты в эксперимент. Животные, выловленные в первой декаде декабря, содержались до марта в 5-литровых сосудах в холодильнике при температуре 1 ± 1°С. Рыб содержали в темноте без пищи с ограниченным доступом кислорода, т.е. в условиях, максимально приближенных к естественным. Для изучения эффектов, возникающих в начале зимовки, рыб 2-й группы брали в эксперимент во второй декаде декабря, для изучения эффектов, возникающих в конце зимовки, рыб 3-й группы – в первой декаде марта.
Электронная микроскопия. В день эксперимента рыб обезглавливали на льду и выделяли фрагмент продолговатого мозга (ПМ), содержащий МН. Фрагмент ПМ фиксировали в течение 12 ч в растворе 4%-ного формальдегида с 2.5%-ным глутаральдегидом на 0.1%-ном какодилатном буфере (рН 7.2). Затем этот фрагмент фиксировали в 2%-м растворе четырехокиси осмия, обезвоживали и помещали в эпоксидную смолу обычным способом (Santalova, Moshkov, 1999). Для получения серии последовательных срезов толщиной 5 мкм эпоновые блоки резали на пирамитоме (LKB, Швеция). Для ультраструктурного анализа гистологические срезы, содержащие сому, наклеивали на отдельные эпоновые блоки и резали на ультратоме ЕМ UC6 (Leika, Германия). Полученные ультратонкие срезы контрастировали уранилацетатом и цитратом свинца и исследовали с помощью электронного микроскопа JEM 100B (JEOL, Япония) в Объединенном Пущинском центре электронной микроскопии (Пущино: http://ckp-rf.ru/ckp/507648). Изображения были сняты на пленку, и негативы были проанализированы после оцифровки с использованием сканера Epson Perfection 4990 Photo (Япония).
Для морфометрического анализа проводили измерения относительной площади, занимаемой аппаратом Гольджи и элементами катаболической системы. Относительная площадь измеряемых величин определялась как отношение площади органоидов (в мкм2) к площади срезов (в мкм2). Кроме того, определяли долю рибосом, ассоциированных с мембраной шероховатого ЭР, в общем количестве рибосом в цитоплазме. Подсчет количества ассоциированных с ЭР рибосом и общего количества рибосом осуществляли на отсканированных микрофотографиях различных областей цитоплазмы нейронов (Gordon et al., 1997). Все морфометрические исследования проводились на 360 срезах ПМ рыб.
Определение концентрации аминокислот. Протеиногенные аминокислоты – это аминокислоты, которые встраиваются в белки во время трансляции. Концентрацию свободных протеиногенных аминокислот определяли в разное время (летом, в начале и в конце зимовки). Гомогенат мозга центрифугировали в течение 20 мин при 0°С и 15 000 g. Концентрацию аминокислот определяли методом ионообменной жидкостной хроматографии на автоматическом аминокислотном анализаторе LC-2000 (Biotronic, Германия) в системе, состоящей из трехступенчатого градиента натрий-цитратного буфера (Каранова, 2013). Постколоночную модификацию аминокислот проводили с использованием нингидрина; интенсивность окрашивания измеряли при 570 нм. Данные приведены в виде средних значений и их стандартных отклонений по результатам трех параллельных экспериментов, в каждом из которых использовали мозг шести животных.
Для каждой серии экспериментов получали хроматограмму стандартной смеси аминокислот. Содержание свободных аминокислот выражали в нмоль/г сырой массы.
Статистический анализ. Статистическую обработку данных проводили с использованием программы Microsoft Excel. Сравнение морфометрических данных проводили с использованием критерия Манна–Уитни (U-критерий), биохимических данных – t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
Идентификация контрольных нейронов на гистологических препаратах продолговатого мозга (гистологическое исследование). На гистологических препаратах ПМ Percсottus glehni (лето, июль) МН были идентифицированы как две симметрично расположенные гигантские клетки с типичной структурой: сома и два основных дендрита. Соседние с МН клетки, располагающиеся вентрально относительно соматической части МН на расстоянии 350–500 мкм (рис. 1), обозначались нами как контрольные.
Рис. 1.
Маутнеровский нейрон и контрольные клетки в продолговатом мозге рыб Perccottus glehn. a – Схема расположения нейронов; б – фрагмент гистологического среза ПМ, содержащего МН и контрольные клетки; в – сома с ядром МН; г – контрольные нейроны. МН – Маутнеровский нейрон, КН – контрольный нейрон, Aкс – аксон, ЛД – латеральный дендрит, ВД – вентральный дендрит, Я – ядро.

Электронно-микроскопическое исследование нейронов Маутнера и контрольных нейронов летних рыб выявило типичную для интактных нейронов картину. Отмечалось наличие шероховатого ЭР с большим количеством рибосом (рис. 2, табл. 1). Гладкий ЭР был представлен в виде анастомозирующих канальцев и цистерн. Также хорошо была представлена структура АГ с четко выраженными цис-, медиа-, транс-цистернами и транспортными везикулами, заполненными веществом различной электронной плотности. (рис. 2, табл. 1). Наблюдалась гетерогенность элементов катаболической системы (лизосомы, аутофагосомы, мультивезикулярные структуры) (рис. 2, табл. 1). Цитоплазма MН содержала диффузно распределенные гранулы гликогена (рис. 2). Мы определили электронно-плотные осмиофильные гранулы как бета-частицы гликогена размером 20–40 нм, в отличие от рибосом, размеры которых не превышают 20 нм. Гранулы имели гетерогенную структуру и отличались друг от друга осмиофильностью и размерами, что хорошо согласуется с литературными данными (Vaughn, Grieshaber, 1972; Cataldo, Broadwell, 1984, 1986; Saez et al., 2014).
Рис. 2.
Электронная микрофотография цитоплазмы МН летних рыб. Гранулы гликогена распределены диффузно в цитоплазме; наблюдаются элементы катаболической системы разного наполнения: мультивезикулярные тела (МВТ), аутофагосомы с двойной мембраной (АФС). ГГ – гранулы гликогена, АГ – аппарат Гольджи, M – митохондрия, ГЭР – гладкий эндоплазматический ретикулум, ШЭР – шероховатый эндоплазматический ретикулум, ПР – полирибосомы. Масштабный отрезок – 1 мкм.
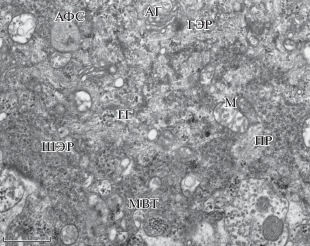
Таблица 1.
Морфологические параметры нейронов продолговатого мозга рыб Percсottus glehni
| Вид клеток | Период | Аппарат Гольджи, мкм2 | Катаболическая система, мкм2 | Доля рибосом, связанных с ретикулумом, % | |
|---|---|---|---|---|---|
| Маутнеровы нейроны | Лето | 5.0 ± 0.3 | 4.3 ± 0.5 | 36 ± 1 | |
| Начало зимовки | 6.3 ± 0.2 | 5.9 ± 0.6 | 40 ± 3 | ||
| Конец зимовки | 5.6 ± 0.4 | 8.2 ± 0.5* | 47 ± 2* | ||
| Контрольные нейроны |
Темные клетки | Лето | 5.6 ± 0.2 | 3.3 ± 0.2 | 42 ± 2 |
| Начало зимовки | 8.4 ± 0.5* | 5.2 ± 0.5* | 48 ± 3 | ||
| Конец зимовки | 4.8 ± 0.3 | 5.6 ± 0.3* | 45 ± 3 | ||
| Светлые клетки, тип 1 |
Лето | 5.6 ± 0.2 | 3.3 ± 0.2 | 42 ± 2 | |
| Начало зимовки | 4.5 ± 0.3 | 2.9 ± 0.2 | 37 ± 2 | ||
| Конец зимовки | 2.1 ± 0.1 | 2.8 ± 0.2 | 33 ± 3* | ||
| Светлые клетки, тип 2 |
Лето | 5.6 ± 0.2 | 3.3 ± 0.2 | 42 ± 2 | |
| Начало зимовки | 4.1 ± 0.2 | 2.5 ± 0.4 | 23 ± 2* | ||
| Конец зимовки | 1.4 ± 0.4 | 2.1 ± 0.5 | 23 ± 3* | ||
Структура контрольных нейронов практически не отличалась от структуры МН (рис. 3). Но, в отличие от МН, цитоплазма этих клеток не содержала гранул гликогена.
Рис. 3.
Электронная микрофотография цитоплазмы интактного (“летнего”) контрольного нейрона. Гранулы гликогена отсутствуют. ПЛ – первичные лизосомы, ВЛ – вторичные лизосомы, Я – ядро, остальные обозначения те же, что и на рис. 2.

Электронно-микроскопическое исследование МН и контрольных нейронов в начале зимовки. Ультраструктура МН частично изменилась (рис. 3). Шероховатый ЭР сохранил свою целостность и наличие рибосом на его мембранах (рис. 4, табл. 1). Основная масса рибосом была ассоциирована в полирибосомы. Структура АГ не изменилась (рис. 4), но его относительная площадь имела тенденцию к увеличению по сравнению со значениями, зарегистрированными у летних рыб (табл. 1). Наличие крупных полей гликогена и ламеллярных структур гладкого ЭР в непосредственной близости от этих полей в цитоплазме MН были основными отличительными чертами этих нейронов, как это было описано ранее (Santalova et al., 2018). Относительная площадь, занимаемая элементами катаболической системы, увеличилась, главным образом, за счет аутофагосом, мультивезикулярных структур и вторичных лизосом. Они часто располагались по периметру полей гликогена (рис. 4, табл. 1).
Рис. 4.
Электронная микрофотография цитоплазмы МН в начале зимовки. Появляются поля гликогена (ПГ). Присутствуют ШЭР, ГЭР, АГ и различные компоненты катаболической системы: АФС, ПЛ и ВЛ, МВТ. Сокращения: см. подпись к рис. 2, 3. Масштабные отрезки – 1 мкм.

В контрольных нейронах в этот период отмечены существенные изменения ультраструктуры. Эти нейроны различались по осмиофильности, что позволило нам разделить их на два пула – темные и светлые клетки (рис. 5). Структура органелл, ответственных за синтез и деградацию белков в контрольных нейронах темного цвета, мало отличалась от MН.
Рис. 5.
Электронная микрофотография цитоплазмы контрольных клеток в начале зимовки. а–д – Светлые контрольные нейроны типа 1; а – общий вид цитоплазмы; б–д – компоненты катаболической системы; е – темные контрольные нейроны; ж – светлые контрольные нейроны типа 2 с признаками дегенерации: набухшие цистерны ШЭР, снижение числа рибосом, ассоциированных с мембранами ЭПР, диссоциация полирибосом. Сокращения: см. подпись к рис. 2, 3. Масштабные отрезки – 1 мкм.

Количество рибосом, ассоциированных с мембранами шероховатого ЭР, имело тенденцию к увеличению по сравнению со значениями, характерными для летних рыб (табл. 1). Относительная площадь, занимаемая АГ, в темных нейронах также увеличилась (табл. 1). Эта тенденция наблюдалась и для компонентов катаболической системы (рис. 5б–г, е, табл. 1).
Пул светлых контрольных нейронов отличался неоднородностью. Ультраструктура некоторых клеток (мы назвали их светлыми контрольными нейронами типа 1) мало отличалась от таковой у летних рыб (рис. 5а). В других клетках (светлых контрольных нейронах типа 2), были обнаружены заметные деструктивные изменения: снизилось наполнение цитоплазмы органеллами, нарушилась целостность шероховатого ЭР, его цистерны набухали, значительно снижалось количество рибосом, ассоциированных с мембранами, отмечалась диссоциация полирибосом и редукция АГ (рис. 5г, табл. 1).
Электронно-микроскопическое исследование МН и контрольных нейронов в конце зимовки. В цитоплазме MН сохранился хорошо развитый шероховатый ЭР. Количество рибосом, ассоциированных с ЭР, значительно увеличилось (рис. 6, табл. 1). Диссоциации полирибосом не наблюдалось. Имела место редукция гладкого ЭР, однако ламеллярные структуры встречались изредка (рис. 6а). Вместе с этим одновременно достоверно уменьшалась относительная площадь, занимаемая полями гликогена, как было показано в предыдущих исследованиях (Santalova et al., 2018). Наблюдали существенные изменения в структуре АГ – диссоциацию диктиосом и формирование большого числа везикул разного размера и неоднородного содержания. При незначительном изменении относительной площади АГ в цитоплазме МН (рис. 6а, 6б, табл. 1), относительная площадь, занимаемая элементами катаболической системы, значительно увеличивалась (рис. 6в, 6г, табл. 1).
Рис. 6.
Электронная микрофотография цитоплазмы МН в конце зимовки. a – Хорошо представлен ШЭР; б – трансформация АГ; в, г – МВТ и ВЛ. Сокращения: см. подпись к рис. 2, 3. Масштабные отрезки – 1 мкм.

В контрольных темных нейронах и контрольных светлых нейронах типа 1 сформировались ламеллярные структуры гладкого ЭР, возле которых отмечалось появление заметного количество гликогена, аналогично тому, как это имело место в МН в начале зимовки. Это согласуется с литературными данными о связи гладкого ЭР с гликогеном (Vaughn, Grieshaber, 1972).
В темных контрольных нейронах сохранялась целостность шероховатого ЭР (рис. 7e). Относительная площадь, занимаемая АГ, значительно уменьшилась в отличие от начала зимовки, его структура частично диссоциировала на отдельные везикулы разных размеров, как это было в случае МН в начале зимовки (рис. 7б, в, табл. 1). Относительная площадь, занимаемая элементами катаболической системы, практически не отличалась от ее значения в начале зимовки.
Рис. 7.
Электронная микрофотография цитоплазмы контрольных клеток в конце зимовки. a – Светлые контрольные нейроны типа 1 с сохранившейся интактной структурой; б – диссоциация АГ; в – вероятно, формирование АГ de novo; г – ламеллярные структуры ГЭР и поля гликогена; д – темные контрольные нейроны с полями гликогена в цитоплазме; е – светлые контрольные нейроны типа 2 с признаками дегенерации. Сокращения: см. подпись к рис. 2, 3. Масштабные отрезки – 1 мкм.

В пуле контрольных светлых нейронов наблюдались различия в ультраструктуре клеточных органелл (рис. 7а, табл. 1). Цитоплазма светлых контрольных нейронов типа 1 оставалась интактной, а в светлых контрольных нейронах типа 2 отмечались значительные дегенеративные процессы: обеднение цитоплазмы структурами и появление больших полостей неясного генеза (рис. 7г, табл. 1). При этом относительная площадь, занимаемая элементами катаболической системы, достоверно уменьшилась (табл. 1).
Концентрация протеиногенных аминокислот. Общая концентрация протеиногенных аминокислот в мозге рыб на протяжении всего годового цикла значительно различалась. Так, летом оно составляло 8600 ± 500 нмоль/г сырой ткани, в начале зимовки – 4500 ± 250 нмоль/г, а в конце зимнего периода оно резко возрастало и составляло 14200 ± 700 нмоль/г сырой ткани.
ОБСУЖДЕНИЕ
Исследования, проведенные на нейронах ПМ рыб в разные периоды года, позволили выявить динамические изменения их синтезирующей и катаболической систем. Результаты сравнительного ультраструктурного анализа показали, что для различных нейронов ПМ характерен разный уровень метаболической активности в период зимовки.
В МН и части контрольных нейронов в этот период присутствуют компоненты систем синтеза и деградации, как и в летний период. Об этом свидетельствует ультраструктура шероховатого ЭР и наличие большого количества полирибосом, а также аутофагосом, первичных и вторичных лизосом и мультивезикулярных тел. При этом следует отметить усиление развития компонентов катаболической системы в период зимовки, особенно в конце этого периода, по сравнению с контролем. Поскольку при низких температурах активность убиквитин-протеосомной системы значительно снижается (Velickovska, van Breukelen, 2007), вероятнее всего, в исследуемых нейронах у рыб в условиях зимовки при сохранении активного белкового синтеза, деградация осуществляется благодаря аутофагии, как и у млекопитающих (Bocharova et al., 2011; Jin et al., 2015; Tang et al., 2016).
Известно, что аутофагия представляет собой консервативный процесс деградации, осуществляемый лизосомами, который играет важную роль в гомеостазе клеток как в нормальных, так и в стрессовых условиях (Lim et al., 2016; Barthet, Ryan, 2018). Предположительно, аутофагия способствует превращению клеточных структур и макромолекул в субстраты синтеза белка, которые необходимы для выживания нейронов во время зимовки и при выходе из нее. Мы полагаем, что уменьшение размеров нейронов, характерное для зимовки, должно сопровождаться активацией процесса утилизации “избыточных” клеточных компонентов. Как было показано ранее (Санталова и др., 2015), эти дегенеративные перестройки происходят в основном в редуцируемых дендритах MН. Аутофагосомные компоненты из дистальных отделов дендритов транспортируются в сому для преобразования продуктов распада в “строительный материал”, как это имело место при нейродегенеративных процессах у млекопитающих (Nixon et al., 2005; Maday, 2017).
Сравнительный анализ концентрации протеиногенных аминокислот и состояния клеточных элементов в период зимовки показал, что в начале зимовки концентрация протеиногенных аминокислот значительно снижалась по сравнению с летним периодом. При этом наблюдалась сохранность состояния шероховатого ЭР и полирибосом на фоне увеличения площади АГ и компонентов катаболической системы. Этот факт можно объяснить необходимостью использовать аминокислотный пул для синтеза ряда важных белков, необходимых для адаптации нейронов (стрессорных белков, некоторых ферментов, участвующих как в синтезе, так и в деградации клеточных элементов, и других белков). В конце зимовки концентрация протеиногенных аминокислот значительно увеличивалась на фоне усиления белкового синтеза. При этом имело место увеличение площади, занимаемой компонентами катаболической системы. Возможно, происходит включение в систему катаболизма еще одного компонента. Согласно литературным данным, в нейронах наряду с аутофагией существует дополнительный путь деградации органелл (Fernandez-Fernandez et al., 2017; Barthet, Ryan, 2018). Так, было показано, что в нейронах мозга млекопитающих секвестрация и лизис компонентов цитоплазмы наблюдается в структурных компонентах АГ (Barthet, Ryan, 2018). Эти структуры, образующиеся в результате модификации отдельных стопок АГ, состоят из нескольких концентрических двойных мембранных слоев и содержат протеолитические ферменты. Таким образом, возможно, в период зимовки наряду с функциями процессинга и транспортировки белков АГ в нейронах рыб также может выполнять катаболическую функцию.
Частичная диссоциация АГ, наблюдаемая в конце зимовки, может отражать снижение уровня метаболизма, связанного с уменьшением синтеза и транспорта новых белков из ЭР (Altan-Bonnet, Lippincott, 2005; Persico et al., 2009). Однако мы не наблюдали существенных изменений в структуре компонентов белоксинтезирующей системы. Возможно, такая диссоциация АГ в нейронах необходима для сборки АГ de novo при восстановлении жизнедеятельности рыб в весенне-летний период.
Для поддержания жизнедеятельности клетка нуждается в энергетической базе. Как показало наше предыдущее исследование на MН рыб, значительное накопление гликогена в цитоплазме во время зимовки было вызвано перестройкой энергетического баланса в нейронах и переходом на другую систему энергоснабжения (Santalova et al., 2018).
Характерно, что в начале зимовки часть контрольных клеток сохраняла свою исходную ультраструктуру. В этих клетках, по-видимому, необходимость в запуске собственной энергетической системы гликогенезиса и гликогенолиза возникла в конце зимовки, в то время как в МН этот процесс имел место в начале зимовки. Вероятно, этот факт указывает на разный уровень функциональной значимости этих клеток в адаптации рыб в начале и в конце зимовки. Другие клетки ПМ, контрольные светлые нейроны типа 2, подверглись значительной деградации. Это может быть объяснено тем фактом, что функционирование этих клеток не является необходимым для мозга во время зимовки, и поддержание их полноценного метаболизма в отсутствие внешнего источника энергии неэкономично.
Таким образом, в исследуемых нейронах ПМ рыб в период зимовки был выявлен разный уровень структурных перестроек, необходимый для адаптации животных в начале и в конце зимовки. Вероятно, MН, а также контрольные темные и светлые нейроны типа 1, благодаря наличию автономной энергетической системы и возможности регулировать процессы синтеза и деградации, образуют “активные центры” в мозгу рыб, в которых возможно переключение функциональной активности по значимости в период зимовки на те или иные нейроны ПМ для поддержания жизнедеятельность особи.
Список литературы
Иванов К.П. 2004. Основы энергетики организма. Теоретические и практические аспекты. Энергоресурсы организма и физиология выживания. СПб: Наука, 4. 254 с. (Ivanov K.P. 2004. Fundamentals of the energy of the organism. Theoretical and practical aspects. Energy resources of the body and survival physiology. St. Petersburg: Nauka, 4. 254 p.)
Мошков Д.А. 1985. Адаптация и ультраструктура нейрона. М.: Наука. 200 с. (Moshkov D.A. 1985. Adaptation and neuron ultrastructure. M.: Nauka. 200 p.)
Санталова И.М., Пенькова Н.А., Михеева И.Б., Мошков Д.А. 2015. Влияние состояния зимнего оцепения на трехмерную структуру маутнеровских нейронов у рыб Perccottus glehni. Проблемы криобиологии и криомедицины. 25 : 114–121. (Santalova I.M., Penkova N.A., Mikheeva I.B., Moshkov D.A. 2015. Effect of winter dormancy on three-dimensional structure of the Mauthner neurons in Perccottus glehni fish. Problems Cryobiol. Cryomed. 25 : 114–121.)
Altan-Bonnet, N., Lippincott J. 2005. The Golgi apparatus: Structure, function and cellular dynamics. In: Biogenesis of cellular organelles. N.Y.: Academic/Plenum. P. 96–110. https://doi.org/10.1007/b138220
Barthet V.J.A., Ryan K.M. 2018. Autophagy in neurodegeneration: Can’t digest it spit it out. Trends Cell Biol. 28 : 171–173. https://doi.org/10.1016/j.tcb.2018.01.001
Bocharova L.S., Gordon R.Ya., Rogaschevsry V.V., Ignatyev D.A., Khutzian S.S. 2011. Cyclic structural changes in endoplasmic reticulum and Golgi complex in the hippocampal neurons of ground squirrels during hibernation. Cell Tiss. Biol. 5 : 243–254. https://doi.org/10.1134/S1990519X11030023
Caspenter K.L.H., Jalloh I., Hutchinson P.J. 2015. Glycolysis and the significance of lactate in traumatic brain injury. Front. Neurosci. 9 : 1–16. https://dx.doi.org/10.3389%2Ffnins.2015.00112
Cataldo A.M., Broadwell R.D. 1984. Cytochemical staining of the endoplasmic reticulum and glycogen in mouse anterior pituitary cells. J. Histochem. Cytochem. 32 : 1285–1291.
Cataldo A.M., Broadwell R.D. 1986. Cytochemical identification of cerebral glycogen and glucose-6-phosphatase activity under normal and experimental conditions: I. Neurons and glia. J. Electron Microsc. Tech. 3 : 413–437.
Eaton R.C., Farley R.D., Kimmel C.B., Schabtach E. 1977. Functional development in the Mauthner cell system of embryos and larvae of the zebra fish. J. Neurobiol. 8 : 151–172. https://doi.org/10.1002/neu.480080207
Falkowska A., Gutowska I., Goschorska M., Nowacki P., Chlubek D., Baranowska- Bosiacka I. 2015. Energy metabolism of the brain, including the cooperation between astrocytes and neurons, especially in the context of glycogen metabolism. Int. J. Mol. Sci. 16 : 25959–25981. https://doi.org/10.3390/ijms1611259397
Fernandez-Fernandez M.R., Ruiz-Garcia D., Martin-Solana E., Chichon F.Ja., Carrascosa J.L., Fernandez J.-J. 2017. 3D electron tomography of brain tissue unveils distinct Golgi structures that sequester cytoplasmic contents in neurons. J. Cell Sci. 130 : 83–89. https://doi.org/10.1242/jcs.188060
Gordon R.Ya., Bocharova L.S., Kruman I.I., Popov V.I., Kazantsev A.P., Khutzian S.S., Karnaukhov V.N. 1997. Acridine orange as an indicator of the cytometric ribosome state. Cytometry. 29 : 215–221.
Jin Y., Lin Y., Feng J.F., Feng J., Gao G.Y., Jiang J.Y. 2015. Moderate hypothermia significantly decreases hippocampal cell death involving autophagy pathway after moderate traumatic brain injury. J. Neurotrauma. 32 : 1090–1100. https://doi.org/10.1089/neu.2014.3649
Karanova M. 2013. Influence of low temperature on the evolution of amino acids pools adaptive modifications in poikilothermic animals (review). Int. J. Biochem. Biophys. 1 : 33–40. https://doi.org/10.13189/ijbb.2013.010202
Kimmel C.B., Sessions S.K, Kimmel R.J. 1981. Morphogenesis and synaptogenesis of the zebrafish Mauthner neuron. J. Comp. Neurol. 198 : 101–120.
Lim Y., Cho H., Kim E.-K. 2016. Brain metabolism as a model of autophagy in neurodegeneration. Brain Res. 1649 : 158–165. https://doi.org/10.1016/j.brainres.2016.02.049
Maday S. 2017. Mechanisms of neuronal homeostasis autophagy in the axon. Brain Res. 1649 : 143–150. https://doi.org/10.1016/j.brainres.2016.03.047
Nixon R.A., Wegiel J., Kumar A., Yu W.H., Peterhoff C., Cataldo A. 2005. Extensive involvement of autophagy in Alzheimer disease: An immunoelectron microscopy study. J. Neurophatol. Exp. Neurol. 64 : 113–122.
Persico A., Cervigni R.I., Borretta M.L., Colanzi A. 2009. Mitotic inheritance of the Golgi complex. FEBS Lett. 583 : 3857–3862. https://doi.org/10.1016/j.febslet.2009.10.077
Saez I., Duran J., Sinadinos C., Beltran A., Yanes O., Tevy M.F., Martınez-Pons C., Milan M., Guinovar J.J. 2014. Neurons have an active glycogen metabolism that contributes to tolerance to hypoxia. J. Cerebral Blood Flow & Metabolism. 34 : 945–955. https://doi.org/10.1038/jcbfm.2014.33
Santalova I.M., Moshkov D.A. 1999. Smooth endoplasmic reticulum in fish Mauthner cells at different functional states. Neurosience. 89 : 593–602. https://doi.org/10.1016/S0306-4522(98)00305-4
Santalova I.M., Gordon R.Ya., Mikheeva I.B., Khutsian S.S., Maevsky E.I. 2018. Pecularities of the structure of glycogen as indicator of the functional state of Mauthner neurons in fish Perccottus glehni during wintering. Neurosci. Lett. 664 : 133–138. https://doi.org/10.1016/j.neulet.2017.11.024
Tang D., Wang Ch., Gao Y., Pua J., Long J., Xu W. 2016. Deep hypothermia-enhanced autophagy protects PC12 cells against oxygen glucose deprivation via a mitochondrial pathway. Neurosci. Lett. 632 : 79–85. https://doi.org/10.1038/srep27642
Vaughn J.E., Grieshaber J.A. 1972. An electron microscopic investigation of glycogen and mitochondria in developing and adult rat spinal motor neuropil. J. Neurucytol. 1 : 397–594.
Velickovska V., van Breukelen F. 2007. Ubiquitylation of proteins in livers of hibernating golden-mantled ground squirrels, Spermophilus lateralis. Cryobiology. 55 : 230–235. https://doi.org/10.1016/j.cryobiol.2007.08.003
Weis S.A., Zottoli S.J., Do S.C., Faber D.S., Preuss T. 2006. Correlation of C-start behaviors with neural activity recorded from the hindbrain of free-swimming goldfish (Carassius auratus). J. Exp. Bio. 209 : 4788–4801. https://doi.org/10.1242/jeb.02582
Дополнительные материалы отсутствуют.


