Цитология, 2019, T. 61, № 12, стр. 964-970
Повышенная миграционная способность эндометриальных мезенхимных стволовых клеток при аденомиозе
А. В. Сударикова 1, *, М. А. Шилина 1, В. И. Чубинский-Надеждин 1, Т. М. Гринчук 1, Е. А. Морачевская 1, Ю. А. Негуляев 1, 2
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: anastasia.sudarikova@gmail.com
Поступила в редакцию 02.08.2019
После доработки 30.08.2019
Принята к публикации 03.09.2019
Аннотация
Аденомиоз является одной из форм эндометриоза – гинекологического заболевания, связанного с аномальной функциональной активностью клеток эндометрия. Эндометриальные стволовые клетки могут играть ключевую роль в патогенезе этого заболевания. Несмотря на многочисленные исследования, проводимые на культурах эндометриальных мезенхимных стволовых клеток, полученных от пациентов с аденомиозом, сведения об их фенотипических и функциональных свойствах весьма противоречивы. В настоящей работе проведено сравнительное исследование морфологических и миграционных характеристик эндометриальных мезенхимных стволовых клеток человека, выделенных из менструальной крови здоровых доноров (эМСК) и донора с аденомиозом (эМСК-А). Миграцию эМСК оценивали методом “зарастания ран” с использованием прижизненной микроскопии. Установлено, что скорость зарастания раны эМСК-А значительно выше по сравнению с нормальными клетками, что свидетельствует о повышенном миграционном потенциале эМСК при аденомиозе. Однако при переводе клеток на среду без сыворотки эМСК-А мигрировали медленнее нормальных клеток. В результате оценки морфологических характеристик было выявлено, что эМСК-А имеют меньшие размеры (площадь и периметр) по сравнению с нормальными эМСК, при этом остальные морфометрические параметры, отражающие поляризацию клеток, не различались. Полученные данные позволяют использовать эМСК в культуре как модель для выяснения мембранных и внутриклеточных механизмов, лежащих в основе изменений клеточной механики, подвижности и инвазивной активности при различных патологиях, включая аденомиоз.
Аденомиоз является распространенным гинекологическим заболеванием, поражающим 6–10% женщин репродуктивного возраста. В медицинской литературе эта форма эндометриоза характеризуется патологическим прорастанием функционального слоя матки (эндометрия) в мышечный слой – миометрий (Sasson, Taylor, 2008). В миометрии клетки эндометрия образуют очаги воспаления, что может способствовать образованию опухолей и приводить к бесплодию. Несмотря на большое внимание к исследованию этиологии заболевания, клеточные механизмы аденомиоза остаются недостаточно изученными. Как известно, эндометриальная ткань обновляется на протяжении всей репродуктивной жизни женщины. Эндометрий человека содержит популяцию стволовых клеток, которая ответственна за его способность к регенерации (Nikoo et al., 2014). Поскольку аденомиоз связан с аномальной функциональной активностью клеток эндометрия, эндометриальные стволовые клетки могут играть ключевую роль в патогенезе этого заболевания (Sasson, Taylor, 2008; Dhesi, Morelli, 2015).
Судя по литературным данным, большинство экспериментальных работ проводили на эндометриальных мезенхимных стволовых клетках (эМСК), выделенных из тканей эндометрия пациентов в результате оперативного вмешательства (например: Banu et al., 2008; Chen et al., 2010). Стволовые клетки, выделенные из менструальной крови, являются относительно новым источником мезенхимных стволовых клеток и имеют перспективы для использования в клеточной терапии. Благодаря доступности и неинвазивным протоколам выделения, эМСК, полученные из десквамированного эндометрия пациенток с аденомиозом, могут быть использованы для исследования клеточных и молекулярных аспектов данного заболевания (Шилина и др., 2015; Chen et al., 2019).
Несмотря на многочисленные исследования эМСК за последние 10 лет, сведения об их морфологических и функциональных характеристиках в норме и патологии весьма противоречивы. Так, в ряде работ показано, что фенотипический профиль, способность к направленной дифференцировке, скорость пролиферации клеток при аденомиозе не отличаются от нормальных (Chen et al., 2010; Kao et al., 2011a, 2011b). В то же время обнаружены морфологические различия между эМСК, полученными от здоровых доноров и от пациенток с эндометриозом (Nikoo et al., 2014). Авторы сообщают, что при эндометриозе эМСК менее поляризованы по сравнению с нормальными фибробластоподобными эМСК. Кроме того показано, что при аденомиозе эМСК обладают более высокой пролиферацией и инвазивной активностью (Banu et al., 2008; Nikoo et al., 2014).
Ранее нами была выделена и охарактеризована клеточная линия из менструальной крови донора с аденомиозом и детально исследован кариотип этих клеток (Шилина и др., 2015). Задача настоящей работы – сравнительно исследовать морфологические и миграционные свойства клеточных культур, полученных от здоровых доноров и от пациентки с аденомиозом, в нормальных условиях культивирования и в условиях сывороточного голодания; на основе полученных данных оценить возможности использования эМСК в качестве модели для выяснения механизмов, лежащих в основе изменений механических свойств, подвижности и инвазивной активности при аденомиозе.
МАТЕРИАЛ И МЕТОДИКА
Клеточные культуры. Исследования проводили на линиях эМСК, полученных из десквамированного эндометрия в менструальной крови (Земелько и др., 2011). Клетки культивировали в среде DMEM/F12 (Gibco, США), содержащей 10% бычьей эмбриональной сыворотки (FBS) (HyClone, США), а также 1%-ный раствор антибиотика и 1%-ный раствор GlutaMAX (Gibco, USA). Клетки пересевали два раза в неделю в соотношении 1 : 3–1 : 4, используя 0.05%-ный трипсин с ЭДТА (Invitrogen, США). В работе использовали эМСК, выделенные из менструальной крови здоровых доноров (эМСК, линии 2304, 2804) и донора с аденомиозом (эМСК-А, линия 0404) (Шилина и др., 2015).
Оценка миграции эМСК по методу зарастания раны. эМСК высевали в стерильный культуральный 4-х луночный планшет (Nunc, США) со специальными силиконовыми вставками для создания экспериментальной раны (Ibidi, Германия) в полную среду. После достижения конфлюэнтного монослоя вставки вынимали, тем самым имитируя создание раны (шириной приблизительно 400–500 мкм) и промывали клетки фосфатно-солевым буферным раствором (PBS). Затем PBS заменяли на полную или бессывороточную среду в зависимости от экспериментальных задач. C помощью микроскопа Axio Observer Z1 (Zeiss, Германия), оборудованного инкубационной камерой для поддержания условий культивирования (37°С, 5% СО2), производили фотосъемку с частотой 1 кадр в 30 мин в течение 24 ч с помощью программного обеспечения AxioVision 4.8.2. Использовали объектив 10×. Далее оценивали изменение площади раны относительно начальной точки в процентах, измерения площади раны проводили в программе ImageJ (NIH, США), а полученные числовые значения обрабатывали в Exсel (Microsoft, США). Изображения в проходящем свете получали с помощью микроскопа Carl Zeiss Primovert (Carl Zeiss, Германия), оснащенного 20-кратным объективом и цифровой CCD-камерой.
Параметры морфологии клеток. С помощью программного обеспечения ImageJ с использованием встроенной функции “cell shape parameters” вычисляли площадь, периметр, соотношение диаметров и “округлость”. Клетки обводили вручную с помощью инструмента “свободное выделение” (“freehand selection tool”). Значение “соотношение диаметров” рассчитывает отношение длинного и короткого диаметра (D) виртуального эллипса, вписываемого программой в выделенную клетку. Параметр “Округлость” показывает отличие формы выделения (выделенной фигуры) от идеального круга, у которого значение округлости равно 1. Для наглядности в табл. 1 представлены примеры значений морфологических параметров выделенных клеток различной формы.
Таблица 1.
Параметры, используемые для оценки морфологии клеток
| Форма | Параметр и его значение | |
|---|---|---|
| округлость | соотношение большого и малого диаметров | |
 |
0.03 | 25.31 |
 |
0.17 | 5.656 |
 |
0.95 | 1.04 |
Параметры, полученные как минимум для 15 клеток в каждом эксперименте, сопоставляли между собой с помощью однофакторного дисперсионного анализа ANOVA. Достоверность различий данных оценивали на уровне значимости 0.05. Значения подчинялись нормальному распределению по тесту Шапиро–Уилка. Определение различий или их отсутствия между конкретными группами проводили при помощи критерия Бонферрони. Для проверки равенства дисперсий оцениваемых параметров применяли критерий Левена. Данные представлены в виде среднего значения и его стандартной ошибки.
РЕЗУЛЬТАТЫ
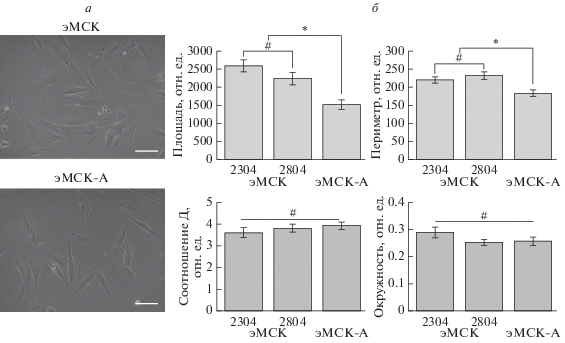
В настоящей работе исследовали морфологические различия и миграционный потенциал эМСК, выделенных из менструальной крови здоровых доноров (линии 2304, 2804) и донора с аденомиозом (эМСК-А). Световая микроскопия показала, что эМСК-А имеют меньший размер по сравнению со здоровыми (рис. 1а). Действительно, компьютерная оценка формы клеток показала, что эМСК-А имеют меньшие площадь и периметр по сравнению с нормальными эМСК, при этом остальные морфометрические параметры, отражающие фибробластоподобную форму клеток, не отличались (рис. 1б).
Рис. 1.
Морфологические характеристики эМСК от здоровых доноров (линии 2804 и 2304) и от донора с аденомиозом (эМСК-А) (а). б – Значения параметров клеток. эМСК имеют меньшие площадь и периметр чем эМСК здоровые. Об.: 20×. Д – отношение длинного и короткого диаметра. Даны средние значения и их ошибки как минимум для 15 клеток в каждой группе. Различия достоверны при *Р < 0.05. # – Различия недостоверны.
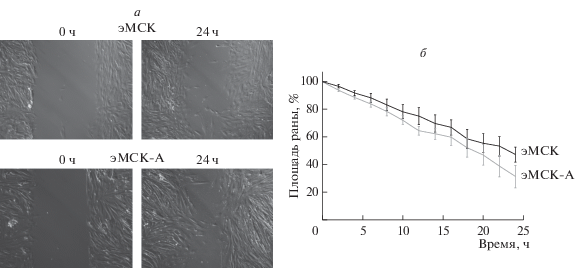
Миграционную способность здоровых МСК и эМСК-А оценивали с помощью метода зарастания экспериментальной раны и прижизненной цейтраферной съемки. На рис. 2а представлены результаты типичного (повторяющегося) эксперимента для эМСК здоровых и эМСК-А в начальный момент времени (0 ч) и через 24 ч после начала съемки. Усредненные данные, отображающие уменьшение площади раны для обеих клеточных линий в контрольных условиях (в полной среде), приведены на рис. 2б. Через 24 ч после начала опыта площадь экспериментальной раны эМСК-А составила 31.3 ± 8.1% (n = 5) относительно начальной точки, в то время как у здоровых клеток – 47.2 ± 5.4% (n = 5). Таким образом, анализ данных показал, что миграционная способность эМСК-А значительно выше, чем у нормальных. Площадь экспериментальной раны у эМСК-А уменьшалась в 1.3 раза быстрее, чем у здоровых. Кроме того, мы не выявили существенных отличий скорости пролиферации у исследуемых клеточных линий.
Рис. 2.
Миграция нормальных эМСК и эМСК-А в модели зарастания раны. а – Изображения, показывающие площадь экспериментальной раны в начальной точке (0 ч) и через 24 ч после начала эксперимента. Об.: 10×. б – Кривая скорости зарастания раны, усредненная по 5 экспериментам для каждой клеточной линии. Значения площади раны в каждый момент времени нормированы на исходную площадь в начале эксперимента. Вертикальные отрезки – ошибки среднего.
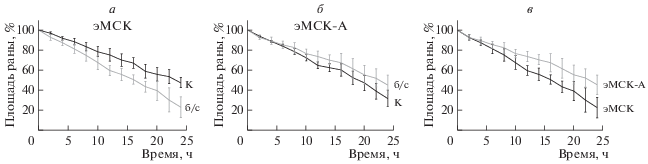
Известно, что большинство методик с использованием мезенхимных стволовых клеток в клеточной терапии требуют строгого соответствия нормативам и предписывают использование бессывороточных сред. Сыворотка в культуральной среде может повышать риск возникновения иммунных реакций и, таким образом, препятствовать использованию клеток в терапии (Yoshida et al., 2018). Кроме того, перевод клеточных культур на среду без сыворотки на длительное время (24–36 ч) используется при их синхронизации или модификации липидного состава клеточных мембран (Chubinskiy-Nadezhdin et al., 2013). Поэтому следующая задача заключалась в изучении влияния FBS на клеточную миграцию. Оказалось, что перевод клеток эМСК всех линий на среду без сыворотки влиял на их миграционную способность, но разнонаправленным образом (рис. 3а). Через 24 ч после начала эксперимента скорость зарастания экспериментальной раны для эМСК-А снизилась в 1.3 раза в среде без сыворотки по сравнению с контролем (среда с 10% FBS): площадь раны составила 45 ± 9.8% (n = 5) относительно начального значения. Миграционная способность здоровых эМСК в бессывороточной среде, наоборот, увеличилась по сравнению с контрольными условиями: площадь раны через 24 ч составила 22.4 ± 10.5% (n = 5) относительно начальной точки. Таким образом, установлено, что в среде без FBS скорость миграции эМСК-А значительно ниже (в 1.5 раза), чем эМСК здоровых.
Рис. 3.
Скорость миграции нормальных эМСК и эМСК-А в контроле (К, среда, содержащая 10% сыворотки) и в среде без сыворотки (б/с, а, б). в – Сравнение кривых миграции нормальных эМСК и эМСК-А в среде без сыворотки.
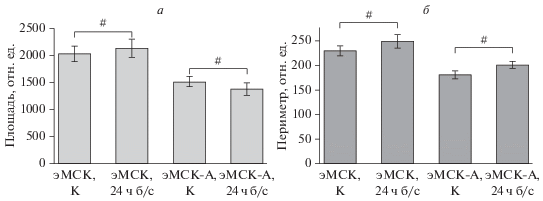
Обнаруженное действие сыворотки на динамику зарастания раны потенциально могло быть связано не только с влиянием бессывороточной среды на собственно механизм миграции эМСК, но также являться следствием изменения формы, степени распластанности и других характеристик клеток после продолжительного культивирования в бессывороточной среде. Чтобы проверить влияние бессывороточной среды на морфологию клеток, мы проанализировали изменения формы эМСК-А и здоровых эМСК через 24 ч культивирования в среде без FBS. Результаты морфометрического анализа не выявили достоверных изменений площади и периметра клеток в таких условиях. Ожидаемые изменения пролиферации клеток при переводе на среду без сыворотки вряд ли внесут существенный вклад в динамику зарастания раны в течение 24 ч наблюдения. Наиболее вероятно, что наблюдаемая динамика зарастания раны в условиях бессывороточного голодания обусловлена изменением клеточной подвижности.
ОБСУЖДЕНИЕ
В настоящей работе использованы ранее охарактеризованные по маркерам, кариотипу и способности к направленной дифференцировке линии клеток эМСК (Земелько и др., 2011; Шилина и др., 2015). Мы продемонстрировали, что здоровые эМСК отличаются от аденомиозных размерами, как в нормальных условиях, так и в среде без сыворотки. Так, площадь и периметр клеток эМСК-А меньше, чем у норальных эМСК, в то время как остальные морфологические параметры остаются без изменений. Изменения морфологии стволовых клеток, полученных из менструальной крови доноров с эндометриозом, были обнаружены в работе иранских авторов (Nikoo et al., 2014). Функциональная значимость таких изменений пока не ясна. Однако основываясь на теоретических и экспериментальных предпосылках, можно полагать, что форма клетки может модулировать передачу сигналов вследствие изменений кривизны плазматической мембраны и клеточной механики (Lloyd, 2013).
Результаты наших экспериментов показывают, что в стандартных условиях культивирования, в присутствии 10% FBS, эМСК-А обладают значительно большей миграционной способностью, чем здоровые эМСК. Выявленное различие не может быть связано со скоростью пролиферации исследуемых клеточных линий, поскольку показано, что время удвоения популяции у них практически не отличается и составляет 23–25 ч (Земелько и др., 2011; Шилина и др., 2015). В то же время повышенная пролиферативная активность наблюдалась в ряде исследований на МСК от доноров с эндометриозом (например: Nikoo et al., 2014). Сходные данные относительно повышенной подвижности эндометриальных стволовых клеток при аденомиозе сообщаются для клеточных линий, полученных с использованием различных протоколов (Chen et al., 2010; Kao et al., 2011a; Nikoo et al., 2014). Во всех случаях МСК от пациентов с эндометриозом характеризовались более высоким миграционным и инвазивным потенциалом по сравнению с МСК от здоровых доноров. Полученные данные позволяют использовать исследованные нами клеточные линии как адекватную модель для анализа механизмов, лежащих в основе изменений клеточной механики и подвижности при аденомиозе.
На культурах стволовых клеток получены данные, указывающие на вероятные изменения липидного обмена, сопутствующие эндометриозу. Показано, что циклооксигеназа-2 (COX-2) участвует в увеличении миграционной и инвазивной способности МСК, полученных из эктопической эндометриомы (Kao et al., 2011b) и из стволовых клеток, выделенных из менструальной крови пациенток с эндометриозом (Nikoo et al., 2014). Кроме того, предполагают, что высокая способность эМСК-А к инвазии может быть частично связана с более высоким уровнем индоламиновой 2.3-диоксигеназы-1 (IDO1) (Nikoo et al., 2014). Повышенный миграционный и инвазивный потенциал рассматривается как фактор, способствующий злокачественной трансформации клеток эндометрия, что обуславливает особый интерес к выявлению молекулярных детерминант эндометриоза, в частности, аденомиоза. В этой связи особенно важным представляются обнаруженные нами с помощью прижизненной микроскопии кардинальные изменения миграции эндометриальных стволовых клеток в среде без сыворотки (FBS). Перевод на среду без сыворотки существенно влиял на скорость зарастания раны нормальных эМСК и эМСК-А, причем разнонаправленным образом. Согласно полученным нами данным (рис 3в), эМСК-А в отсутствие сыворотки мигрировали значительно медленнее нормальных клеток.
Рис. 4.
Перевод нормальных эМСК и эМСК-А на среду без сыворотки (б/с, 24 ч) не влияет на их морфометрические параметры – площадь (а) и периметр (б). К – контроль (среда, содержащая 10% сыворотки). Различия не достоверны при #P < 0.05.
Использование FBS в качестве добавки для роста клеток и тканей человека широко распространено как в фундаментальных исследованиях, так и в клинических подходах. Однако известно, что FBS создает риск возникновения иммунных реакций и, таким образом, может препятствовать использованию МСК для лечения заболеваний. Влияние бессывороточной среды на скорость миграции и инвазии описано в работах на различных клетках и первичных культурах. Наличие сыворотки в среде стимулирует миграцию и инвазию различных клеточных линий HeLa, SiHa, мишиных фибробластов (Brink et al., 2005; Hegera et al., 2018). Сообщается, что бессывороточная культуральная среда может усиливать иммуносупрессорные и антифибротические способности МСК и полезна для культивирования клинически используемых МСК (Solmesky et al., 2010; Gottipamula et al., 2014; Yoshida et al., 2018). При этом авторы не обнаружили влияния безсывороточной среды на миграционную способность или скорость приживления МСК у крыс (Yoshida et al., 2018). Интересно отметить, что ни в одной работе не было описано увеличения миграционной способности клеток при сывороточном голодании. В нашей работе впервые обнаружено, что миграционная способность эМСК-А в бессывороточной среде (в течение 24 ч) уменьшалась, в то время как у нормальных эМСК, наоборот, увеличилась по сравнению с контрольными условиями. Эффект изъятия сыворотки является интересным результатом работы, но требует дальнейшего специального анализа.
Список литературы
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия: выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. 53(12) : 919–929. (Zemel’ko V.I., Grinchuk T.M., Domnina A.P., Artsybasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolskii N.N. 2011. Multipotent mesenchymal stem cells of desquamated endometrium: isolation, characterization and use as feeder layer for maintenance of human embryonic stem cell lines. Tsitologiia. 53(12) : 919–929.)
Шилина М.А., Домнина А.П., Кожухарова И.В., Зенин В.В., Анисимов С.В., Никольский Н.Н., Гринчук Т.М. 2015. Характеристика культуры эндометриальных мезенхимных стволовых клеток, полученных от пациентки с аденомиозом. Цитология. 57(11) : 771–779 (Shilina M.A., Domnina A.P., Kozhukharova I.V., Zenin V.V., Anisimov S.V., Nikolsky N.N., Grinchuk T.M. 2015. Characteristic of endometrial mesenchymal stem cells in culture obtained from patient with adenomyosis. Tsitologiia. 57(11) : 771–779.)
Banu S.K., Lee J.H., Starzinski-Powitz A., Arosh J.A. 2008. Gene expression profiles and functional characterization of human immortalized endometriotic epithelial and stromal cells. Fertil. Steril. 90 : 972–987.
Brink H.E., Stalling S.S., Nicoll S.B. 2005. Influence of serum on adult and fetal dermal fibroblast migration, adhesion, and collagen expression. In Vitro Cell. Dev. Biol. Animal. 41 : 252–257.
Chen L., Qu J., Xiang C. 2019. The multi-functional roles of menstrual blood-derived stem cells in regenerative medicine. Stem Cell Res. Ther. 10 : 1. https://doi.org/10.1186/s13287-018-1105-9
Chen Y.-J., Li H.-Y., Chang Y.-L., Yuan C.-C., Tai L.-K., Lu K.H., Chang C.-M., Chiou S.-H. 2010. Suppression of migratory/invasive ability and induction of apoptosis in adenomyosis-derived mesenchymal stem cells by cyclooxygenase-2 inhibitors. Fertil. Steril. 94 : 1972–1979.
Chubinskiy-Nadezhdin V.I., Efremova T.N., Khaitlina S.Y., Morachevskaya E.A. 2013. Functional impact of cholesterol sequestration on actin cytoskeleton in normal and transformed fibroblasts. Cell Biol. Int. 37 : 617–623.
Dhesi A.S., Morelli S.S. 2015. Endometriosis: A role for stem cells. Womens Health. 11 : 35–49.
Gottipamula S., Ashwin K.M., Muttigi M.S., Kannan S., Kolkundkar U., Seetharam R.N. 2014. Isolation, expansion and characterization of bone marrow-derived mesenchymal stromal cells in serum-free conditions. Cell Tissue Res. 356 : 123–135.
Hegera J.I., Froehlicha K., Pastuscheka J., Schmidta A., Baera C., Mrowkab R., Backschc C., Schleußnera E., Markerta U.R., Schmidta A. 2018. Human serum alters cell culture behavior and improves spheroid formationin comparison to fetal bovine serum. Exp. Cell Res. 365 : 57–65.
Kao A.P., Wang K.H., Chang C.C., Lee J.N., Long C.Y., Chen H.S., Tsai C.F., Hsieh T.H., Tsai E.M. 2011. Comparative study of human eutopic and ectopic endometrial mesenchymal stem cells and the development of an in vivo endometriotic invasion model. Fertil. Steril. 95 : 1308–1315.
Kao A.P., Wang K.H., Long C.Y., Chai C.Y., Tsai C.F., Hsieh T.H., Hsu C.Y., Chang C.C., Lee J.N., Tsai E.M. 2011. Interleukin-1beta induces cyclooxygenase-2 expression and promotes the invasive ability of human mesenchymal stem cells derived from ovarian endometrioma. Fertil. Steril. 96 : 678–684.
Lloyd A.C. 2013. The regulation of cell size. Cell. 154 : 1194–1205.
Nikoo S., Ebtekar M., Jeddi-Tehrani M., Shervin A., Bozorgmehr M., Vafaei S., Kazemnejad S., Zarnani A.-H. 2014. Menstrual blood-derived stromal stem cells from women with and without endometriosis reveal different phenotypic and functional characteristics. Mol. Hum. Reprod. 20 : 905–918.
Sasson I.E., Taylor H.S. 2008. Stem cells and the pathogenesis of endometriosis. Ann. N.Y. Acad. Sci. 1127 : 106–115.
Solmesky L., Lefler S., Jacob-Hirsch J., Bulvik S., Rechavi G., Weil M. 2010. Serum free cultured bone marrow mesenchymal stem cells as a platform to characterize the effects of specific molecules. PLoS One 5(9) : e12689. https://doi.org/10.1371/journal.pone.0012689
Yoshida K., Nakashima A., Doi S, Ueno T., Okubo T., Kawano K.-I., Kanawa M., Kato Y., Higashi Y., Masaki T. 2018. Serum-Free Medium Enhances the Immunosuppressive and Antifibrotic Abilities of Mesenchymal Stem Cells Utilized in Experimental Renal Fibrosis. Stem Cells Transl. Med. 7: 893–905.
Дополнительные материалы отсутствуют.


