Цитология, 2019, T. 61, № 12, стр. 987-997
Возможные механизмы развития токсичности местных анестетиков аминоамидного ряда: липидоопосредованное действие ропивакаина
А. А. Захарова 1, *, С. С. Ефимова 1, В. А. Корячкин 2, Д. В. Заболотский 2, О. С. Остроумова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный педиатрический медицинский университет Минздрава России
194100 Санкт-Петербург, Россия
* E-mail: zakharovaaa@incras.ru
Поступила в редакцию 12.08.2019
После доработки 06.09.2019
Принята к публикации 14.09.2019
Аннотация
Работа посвящена выявлению молекулярных механизмов действия ропивакаина и других местных анестетиков аминоамидного ряда (мепивакаина и бупивакаина) на физико-химические свойства мембран и процессы регуляции формирования и функционирования ионных каналов различной природы в модельных липидных бислоях. Исследовали граничный потенциал мембраны и его компоненты, проницаемость для флуоресцентных маркеров, температуру и кооперативность плавления мембранообразующих липидов и мозаичную организацию бислоя. Обнаружено, что ропивакаин так же, как и мепивакаин и бупивакаин, увеличивает граничный потенциал мембраны за счет изменения поверхностного заряда бислоя. Установлено, что проницаемость липидных везикул для кальцеина увеличивается при введении аминоамидов, а температура и кооперативность плавления насыщенных фосфохолинов при этом уменьшаются. Выраженность влияния анестетиков на плотность упаковки липидов в мембране коррелирует с гидрофобностью их молекул. Сравнение эффектов аминоамидов позволило говорить о трех механизмах действия анестезирующих веществ на функционирование ионных каналов, включающих увеличение поверхностного потенциала мембраны, уменьшение плотности упаковки липидов в мембране и блокирование ионных каналов.
Ропивакаин (РПК) представляет собой новый местный анестетик амидного ряда, применяющийся в качестве препарата выбора для проведения хирургических вмешательств, а также лечения острой боли различного генеза. Структурно РПК является близким аналогом бупивакаина (БПК) и мепивакаина (МПК). Основным отличием является количество углеводородных звеньев в алкильном заместителе третичного азота, которое, в случае БПК, РПК и МПК определяется бутильной, пропильной или метильной группами соответственно (рис. 1). Однако результаты исследований in vitro и in vivo показывают, что при использовании в равных концентрациях, РПК, несколько уступая МПК по скорости наступления анальгезирующего действия, сравним с БПК по продолжительности и силе анестезии (Hickey et al., 1991; Klein et al., 1998; McGlade et al., 1998). При этом РПК характеризуется меньшей токсичностью в отношении центральной нервной и сердечно-сосудистой систем. Подобные явления могут объясняться различиями во взаимодействии липида и анестетика и обусловленными ими изменениями физико-химических свойств клеточных мембран.
Известно, что в основе механизма анальгезии лежит блокирование местными анестетиками работы потенциалозависимых натриевых каналов в нервном волокне (Hille et al., 1977) путем взаимодействия этих агентов с сайтами связывания на внутренней части натриевого канала (Ragsdale et al., 1994; Wright et al., 1999; Yarov-Yarovoy et al., 2001). Помимо этого, многочисленные исследования свидетельствуют в пользу встраивания анестетика в липидную область мембраны (Seeman, 1972; Singer, 1977; Smith et al., 1991), а также влияние этого процесса на трансмембранный транспорт ионов (Lee, 1976; Kopeikina et al., 1997; Yun et al., 2002). В частности, Ли с соавторами (Lee, 1976) предположили, что местные анестетики могут способствовать переходу окружающих липидов в более жидкую фазу, что позволяет натриевому каналу закрыться. Другие авторы исследовали взаимодействие анеститиков с плазматической мембраной эритроцитов и показали, что скорость их гемолиза сильно зависит от числа молекул анестетика, находящихся в незаряженной форме, что указывает на то, что разрушающее действие этих соединений на эти мембраны является результатом связывания анестетиков с липидным бислоем мембран (Malheiros et al., 2004). Кроме того, можно предполагать их вклад в изменение электрических свойств мембран (Yokoyama, 1998; HoЕgberg et al., 2008), т. к. в физиологических условиях анестетики присутствуют в катионной и нейтральной форме.
Учитывая все вышеперечисленное, встает вопрос о том, модуляция каких физико-химических свойств мембран может быть ответственна за терапевтическое и побочное действие анестетиков; каким образом эти изменения способны отражаться на функционировании ионных каналов различной химической природы. Таким образом, целью работы являлось установление молекулярных механизмов влияния анестетиков на электрические и эластические свойства липидных бислоев и встроенныx в них порообразующих соединений различной химической природы.
В настоящей работе измеряли следующие параметры: граничный и дипольный потенциалы плоских липидных бислоев, проницаемость одноламеллярных липосом для кальцеина, температуру и кооперативность главного фазового перехода мембранообразующих липидов при адсорбции РПК. Далее сравнивали эффекты местного анестетика РПК и ранее изученных аминоамидов (МПК и БПК) и анализировали липидоопосредованные пути влияния анестетиков на функционирование ионных каналов, реконструированных в модельные мембраны. В качестве каналообразующих агентов в работе использовaли противогрибковый полиеновый антибиотик нистатин (НС), продуцируемый Streptomyces, противогрибковый циклический липопептид сирингомицин Е (СМЕ), продуцируемый Pseudоmonas syringae; антимикробные пептиды грамицидин А (ГА) из Bacillus brevis, цекропин А, выделенный из гемолимфы куколок гигантского шелкопряда Hyalophora cecropia (ЦА), и белковый токсин Staphylococcus aureus альфа-гемолизин (α-ГЛ).
МАТЕРИАЛ И МЕТОДИКА
Использованные реактивы: KCl, KOH, HEPES, ЭДТА, пентан, этанол, хлороформ, гексадекан, нонактин, тритон Х-100, сефадекс G-50, di-8-ANEPPS, кальцеин, диметилсульфоксид и нонактин (Sigma, США); ЦА, ГА, НС, α-ГЛ, гидрохлориды БПК, МПК (Sigma, США) , гидрохлорид РПК (Фрезениус КабиНордж АС, Норвегия); 1,2-дифитоноил-sn-глицеро-3-фосфохолин (ДФФХ), 1,2-диолеил-sn-глицеро-3-фосфохолин (ДОФХ), 1,2-диолеил-sn-глицеро-3-фосфосерин (ДОФС), 1,2-диолеил-sn-глицеро-3-фосфоэтаноламин (ДОФЭ), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДПФХ) и холестерина (Avanti Polar Lipids, США). Липопептид СМЕ из Pseudomonas syringae syringae был выделен, очищен и любезно предоставлен доктором Д. Такемото (Bidwai, Takemoto, 1987). Химические структуры тестируемых анестетиков представлены на рис. 1.
Оценка изменения граничного потенциала мембран (Δφb) и его компоненты дипольного потенциала (Δφd) при адсорбции РПК. Использовали метод измерения К+-ионофор-индуцированной проводимости плоских липидных бислоев, которые формировали “сухим” способом, путем сведения конденсированных липидных монослоев на отверстии в тефлоной пленке, разделяющей экспериментальную камеру на два отделения (Montall, Mueller, 1972). Для формирования бислоев использовали ДОФХ. Эксперименты проводили при одинаковом ионном составе водных растворов электролита в обоих отделениях экспериментальной кюветы (0.1 М KCl), кислотность растворов (рН 7.4) поддерживали буферной смесью 5 мМ HEPES и КОН.
Маточный спиртовый раствор ионофора нонактина (7 мкг/мл) добавляли к водной фазе обоих отделений камеры до конечной концентрации в диапазоне 10–7–10–5 М. РПК вводили в оба отделения камеры из 10 мМ водного раствора до конечной концентрации в околомембранных растворах в диапазоне от 1 мкМ до 20 мМ. Измерение и оцифровку трансмембранных токов проводили в режиме фиксации потенциала с помощью Лабораторного аппаратно-измерительного комплекса (Axopatch 200B и Digidata 1440A, Axon Instruments, США). Обработку записей трансмембранных токов осуществляли с использованием Clampfit 9.0 (Axon Instruments) и Origin 8.0 (OriginLab). При введении РПК изменение граничного потенциала липидных бислоев (Δφb) определяли с использованием статистики Больцмана (Andersen et al., 1976). Среднее значение изменения дипольного потенциала мембран при адсорбции РПК определяли как среднее арифметическое значение Δφb и ошибку среднего при измерении от четырех бислоев, как описано ранее в (Efimova, Ostroumova, 2015).
Для оценки вклада дипольной компоненты в φb были проведены измерения флуоресценции диполь-чувствительной пробы di-8-ANEPPS на длине волны 690 нм при двух различных длинах волн возбуждения 420 нм и 520 нм, в отсутствие и в присутствии РПК. Для этого использовали спектрофлуориметр Флюорат-02-Панорама производства Люмэкс (Россия). Для изготовления однослойных ДОФХ-везикул, содержащих 1 мол. % di-8-ANEPPS, использовали мини-экструдер производства Avanti Polar Lipids (США). Сухую липидную пленку с di-8-ANEPPS гидратировали буферным раствором (0.1 M KCl, 5 мМ HEPES-KOH, 1мМ EDTA, pH 7.4). Суспензию подвергали пятикратной серии замораживания–оттаивания, а затем 13 раз пропускали с помощью экструдера через 100-нанометровую поликарбонатную мембрану из нуклеопор для получения однослойных везикул. РПК добавляли к суспензии липосом до конечной концентрации 10 мМ. Коэффициент возбуждения флуоресценции при длине волны 670 нм (R) определяли как отношение интенсивности флуоресценции при длинах волн регистрации 420 и 520 нм (Clarke, Kane, 1997). Изменения дипольного потенциала бислоев из ДОФХ оценивали с использованием полученных значений R, как описано в литературе (Starke-Peterkovic et al., 2006).
Определение утечки кальцеина из липосом при адсорбции РПК. Липосомы диаметром 100 нм получали из ДОФХ методом экструзии с использованием мини-экструдера производства Avanti Polar Lipids (США) как описано ранее (Ефимова и др., 2016). Липидную пленку гидратировали буферным раствором, содержащим 35 мМ флуоресцентного красителя кальцеина 10 мМ HEPES, 1 мМ ЭДТА, pH 7.4. Липосомную суспензию разделяли на аликвоты. В экспериментальные образцы вводили 5 мМ РПК из исходного раствора в воде и инкубировали в течение 1 ч в темноте при комнатной температуре.
Проницаемость больших моноламеллярных липосом для кальцеина определяли путем измерения интенсивности флуоресценции вытекающего из везикул краситиеля с помощью спектрофлюориметра Флюорат Панорама-02 (Россия) (при длинах волн возбуждения и эмиссии 490 и 520 нм соответственно). Раствор кальцеина внутри липосом (35 мМ) имеет пренебрежимо малую флуоресценцию вследствие самотушения. Поскольку омывающий липосомы раствор не содержит кальцеина, можно зафиксировать флуоресценцию высвобождаемого из везикул красителя. После измерения флуоресценции экспериментального образца в раствор добавляли тритон X-100 до концентрации 10 мМ. Это приводило к полному разрушению липосом и высвобождению всего захваченного красителя.
Относительную величину утечки кальцеина из липосом RF (%) определяли как:
(1)
$RF = \frac{{{{I}_{i}} - {{I}_{0}}}}{{({{{{I}_{{\max }}}} \mathord{\left/ {\vphantom {{{{I}_{{\max }}}} {0.9}}} \right. \kern-0em} {0.9}}) - {{I}_{0}}}} \times 100\% ,$Дифференциальная сканирующая микрокалориметрия модифицированных везикул. Гигантские одноламеллярные липосомы изготавливали из ДПФХ методом электроформации c помощью прибора Nanion vesicle prep pro (Германия) (напряжение 3 В, частота 10 Гц, 1 ч, 55°C). Концентрация липида составляла 4 мМ. В экспериментальные образцы вводили МПК, РПК или БПК в соотношении липида и анестетика 1 : 1. Термограммы липосомных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция). Воспроизводимости температурной зависимости теплоемкости достигали путем повторного нагревания образца сразу после охлаждения с постоянной скоростью 0.2 К/мин. Пики на термограммах характеризовали температурой максимума (Tm) и шириной на полувысоте (T1/2), отвечающей кооперативности фазового перехода ДПФХ. Изменение указанных выше параметров позволяет судить о термотропном поведении липидов при адсорбции анестетика.
Электрофизиологические исследования регуляции аминоамидами реконструированных в плоские липидные мембраны ионных каналов. Плоские липидные бислои формировали по методу Монтала и Мюллера (Montall, Mueller, 1972). Монослои формировали из ДОФХ, ДФФХ, эквимолярной смеси ДОФС и ДОФЭ или смеси ДОФХ и холестерина в соотношении 67 : 33 мол. %. Эксперименты проводили при одинаковом ионном составе водных растворов электролита в обоих отделениях экспериментальной кюветы (0.1, 1 или 2 М KCl), кислотность растворов (рН 7.4) поддерживали буферной смесью 5 мМ HEPES и КОН. Каналообразующие агенты из растворов в воде, этаноле или ДМСО добавляли к водной фазе одного (НС, СМЕ, α-ГЛ) или обоих (ГА, ЦА) отделений камеры. Анестетик вводили в оба отделения камеры из миллимолярных водных растворов до конечной концентрации в околомембранных растворах 1 мМ. Электрофизиологические измерения проводили при комнатной температуре. Конечная концентрация спирта или ДМСО в камере не превышала 0.5% и не вызывала изменения стабильности проводимости мембраны.
Проводимость g одиночных каналов определяли как отношение протекающего через одиночный канал тока i к трансмембранной разности потенциалов V. Для построения гистограмм флуктуаций тока значения трансмембранных токов определяли по изменениям его амплитуды при открывании (или закрывании) одиночных каналов. Общее число событий N, использовавшихся для анализа при фиксированном значении трансмембранного потенциала, составляло от 1 до 5 тыс. Все пики на гистограммах аппроксимировали плотностью нормального распределения. В качестве критерия проверки гипотезы о законе распределения использовали критерий χ2 (P < 0.05).
Среднее отношение $\left( {{{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}}} \right)$ равновесного интегрального трансмембранного тока, индуцированного каналообразующим агентом (НС, ЦА) в присутствии (I∞) и в отсутствие анестетика $\left( {I_{\infty }^{0}} \right),$ определяли как среднее арифметическое значение ${{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}}$ при измерении от трех до девяти бислоев и его ошибка.
РЕЗУЛЬТАТЫ
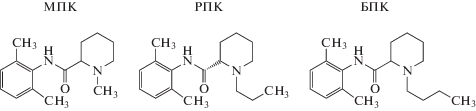
Измерены максимальные величины изменений граничного потенциала липидных бислоев, сформированных из ДОФХ и омываемых 0.1 М KCl (рН 7.4), при адсорбции РПК. На рис. 2а показаны зависимости Δφb ДОФХ-бислоев от концентрации РПК в омывающих растворах. На рис. 2а видно, что добавка в мембраноомывающие растворы РПК приводит к незначительному росту величины Δφb. Максимальное увеличение этого параметра не превышает 17 мВ, что соответствует насыщению, т.е. условиям, в которых изменение граничного потенциала уже не является функцией концентрации РПК в омывающем мембрану растворе.
Рис. 2.
Влияние анестетиков на физико-химические свойства липидных бислоев. а – Зависимость величины изменения граничного потенциала мембран (Δφb) от концентрации РПК в омывающем растворе. Мембраны сформированы из ДОФХ и омываются 0.1 М раствором КCl при рН 7.4. V = 50 мВ. б – Зависимость относительной интенсивности флуоресценции (RF, %) кальцеина, вытекшего из ДОФХ-липосом, при введении в начальный момент времени 5 мМ РПК в омывающий мембрану раствор. в – Термограммы плавления ДПФХ (Ср(Т)) в отсутствие (1, контроль) и в присутствии РПК (2) при соотношении с липидом 1 : 1.
Для оценки вклада дипольной компоненты в φb были проведены измерения флуоресценции диполь-чувствительной пробы, di-8-ANEPPS, в отсутствии и в присутствии РПК. РПК практически не влияет на дипольный потенциал мембраны. Максимальное изменение этого параметра составляет в среднем 6 мВ (табл. 1 ).
Таблица 1.
Сравнительные характеристики действия анестетиков на физико-химические свойства липидных бислоев
| анестетик | Pa | ∆φb, мВ | ∆φd, мВ | –ΔTm, °C | ΔT1/2 | RF, % | t1, мин | t2, мин |
|---|---|---|---|---|---|---|---|---|
| МПК | 90 ± 11 | 21 ± 4б | 5 ± 5б | 0.3 | 0.3 | 11 ± 2в | 2.7 ± 1.5в | 18.9 ± 7.8в |
| РПК | 775 ± 53 | 17 ± 3 | 6 ± 6 | 0.9 | 0.7 | 12 ± 3 | 1.9 ± 0.2 | 13.7 ± 5.8 |
| БПК | 2565 ± 218 | 28 ± 7б | –10 ± 10б | 3.6 | 1.0 | 23 ± 6в | 7.3 ± 3.1в | 37.7 ± 8.6в |
Примечание. ∆φb и ∆φd – изменения граничного и дипольного потенциалов ДОФХ-мембран в присутствии аминоамидов в соответствующей концентрации в околомембранном растворе; ΔTm и ΔT1/2 – изменение температуры максимума и полуширины соответствующего плавлению пика главного фазового перехода ДПФХ в присутствии аминоамидов. Соотношение липида и анестетика 1 : 1; RF – максимальная утечка кальцеина из ДОФХ липосом в присутствии 5 мМ МА, характеристические параметры двухэкспоненциальных зависимостей (t1 и t2 – времена, характеризующие быструю и медленную компоненты, соответственно). aP – коэффициент распределения нейтральной формы МА между октанолом и буфером (Strichartz et al., 1990). Цитируется по: бEfimova et al., 2016; вEfimova et al., 2018.
На рис. 2б показана временная зависимость относительной интенсивности флуоресценции кальцеина, вытекающего из ДОФХ-липосом, при введении 5 мМ РПК. На рис. 2б видно, что РПК мало влияет на высвобождение кальцеина из везикул. Процесс характеризуется быстрым достижением стационарного уровня утечки. Установлено, что в случае РПК полученная кинетическая кривая удовлетворительно описывается двухэкспоненциальной зависимостью. Асимптотический максимум функции для РПК составляет около 12% (табл. 1 ).
В отсутствии РПК температура плавления насыщенных цепей ДПФХ равна 41.3°C, полуширина соответствующего плавлению ДПФХ пика, которая характеризует кооперативность фазового перехода, составляет около 0.4°C. Установлено, что в эквимолярном соотношении с липидом РПК вызывает снижение температуры плавления ДПФХ на 0.9°С и приводит к росту полуширины соответствующего переходу пика на 0.7°С (рис. 2в). Из табл. 1 видно, что модуль снижения температуры плавления ДП-ФХ после добавки МПК меньше, а в случае БПК больше, чем при введении РПК. Сходным образом изменяется полуширина пиков, а, следовательно, кооперативность перехода в ряду МПК, РПК, БПК падает.
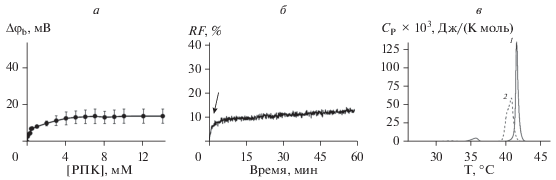
Рис. 3 демонстрирует записи флуктуаций тока, протекающего через каналы, сформированные ГА (рис. 3а) и СМЕ (рис. 3б) в ДОФХ-мембранах, омывающихся 2 M раствором KCl (pH 7.4), в отсутствии и в присутствии РПК. Добавка РПК не приводит к существенному изменению проводимости и времени жизни ГА-каналов (рис. 3а). Аналогичные выводы можно сделать и из анализа зависимости I(V) в отсутствии и в присутствии РПК (рис. 3в). В то же время введение тестируемого анестетика в мембраноомывающий раствор вызывает снижение амплитуды и времени жизни одиночных СМЕ-каналов в 2 и 10 раз соответственно при трансмембранном напряжении –150 мВ (рис. 3б, табл. 2). Сравнение вольт-амперных характеристик (рис. 3г, табл. 2) показывает, что при положительном трансмембранном напряжении РПК практически не влияет на ток, протекающий через одиночные СМЕ-каналы, однако при отрицательной трансмембранной разности потенциалов наблюдается выраженное уменьшение силы тока, протекающего через СМЕ-каналы.
Рис. 3.
Влияние РПК на свойства одиночных каналов, образованных ГА и СМЕ. Записи флуктуаций тока, протекающего через одиночные каналы, образованные ГА (а) и СМЕ (б), в отсутствие (контроль) и в присутствии 1 мМ РПК. Трансмембранное напряжение составляет –150 мВ. Вольт-амперные характеристики ГА-каналов (в) и СМЕ-каналов (г) в отсутствие (1) и в присутствии 1 мМ РПК (2). Мембраны сформированы из ДОФХ и омываются 2.0 М растворами КCl при рН 7.4.
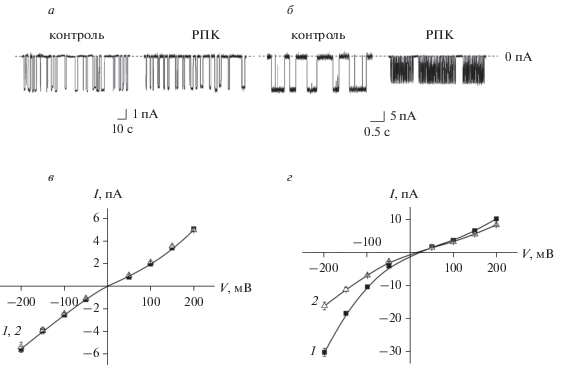
Таблица 2.
Некоторые свойства ионных каналов в отсутствие и в присутствии 1 мМ анестетиков
| анестетик | ГА | СМЕ | НС | ЦА | α-ГЛ | ||
|---|---|---|---|---|---|---|---|
| g, пСм | τ, с | g, пСм | τ, мс | I∞/$I_{\infty }^{0}$ | I∞/$I_{\infty }^{0}$ | Pon | |
| Контроль | 23 ± 1 | 1.0 ± 0.1 | 123 ± 4 | 74 ± 1 | – | – | 0.7 ± 0.1 |
| МПК | 24 ± 1 | 1.8 ± 0.8 | 71 ± 10 | 11 ± 1 | 1.0 ± 0.1а | 0.9 ± 0.4 | 0.9 ± 0.1 |
| РПК | 24 ± 2 | 1.3 ± 0.2 | 75 ± 6 | 7 ± 2 | 1.7 ± 0.2 | 0.6 ± 0.2 | 0.8 ± 0.1 |
| БПКб | – | – | – | – | 1.9 ± 0.2а | 0.2 ± 0.1в | 0.9 ± 0.1 |
Примечание. g – проводимость каналов, образованных грамицидином А или сирингомицином Е, в ДОФХ мембранах, омываемых 2 М KCl (рН 7.4) при трансмембранном напряжении −150 мВ; τ – время жизни каналов; I∞/$I_{\infty }^{0}$ – отношение трансмембранных токов, индуцированных полиеновым антибиотиком НС в ДОФХ/хол-мембранах или антимикробным пептидом ЦА в ДОФС/ДОФЭ-бислоях, после и до введения МА в мембраноомывающий 0.1 М раствор KCl (pH 7.4); Pon – вероятность нахождения α-ГЛ-поры, реконструированной в ДФФХ-мембраны и омываемой 1 М раствором KCl (pH 7.4), в открытом состоянии при V = 150 мВ. бБПК не тестировали ввиду его низкой растворимости в 2 М растворах KCl. Цитируется по: аEfimova et al., 2018; вЕфимова и др., 2018.
Примеры, демонстрирующие результаты действия РПК на макроскопический ЦА- и НС-индуцированный ток, обусловленный функционированием в мембране большого числа каналов, представлены на рис. 4а, б соответственно. РПК приводит к падению стационарного ЦА-индуцированного тока (рис. 4а). При этом добавка РПК в мембраноомывающий раствор вызывает рост проводимости мембраны, модифицированной НС (рис. 4б). Средние величины отношений макроскопических токов, индуцированных ЦА и НС в присутствии и в отсутствии МА $\left( {{{{{I}_{\infty }}} \mathord{\left/ {\vphantom {{{{I}_{\infty }}} {I_{\infty }^{0}}}} \right. \kern-0em} {I_{\infty }^{0}}}} \right),$ представлены в табл. 2. Таблица показывает, что МПК практически не влияет на ЦА-индуцированный ток, в то время как РПК снижает его в среднем на 40%. Введение РПК в мембраноомывающий раствор вызывает рост НС-индуцированного макроскопического тока примерно на 70%.
Рис. 4.
Влияние РПК на стационарный ток, индуцированный ЦА (а) и НС (б). Стрелками указаны моменты введения РПК до концентрации 1 мМ в мембраноомывающий раствор. Мембраны сформированы: а – из эквимолярной смеси ДОФС и ДОФЭ и омываются 0.1 М раствором KCl при pH 7.4; б – из смеси ДОФХ и холестерина (67 : 33 мол. %) и омываются 2.0 М раствором KCl при pH 7.4. Трансмембранное напряжение равно 50 мВ.
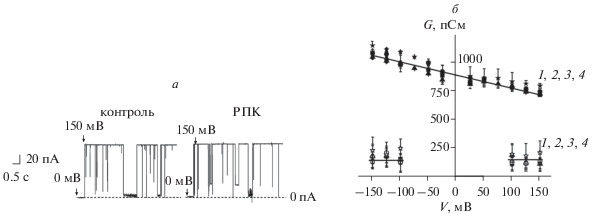
На рис. 5а представлены примеры записи флуктуаций тока, протекающего через одиночную α-ГЛ-пору, реконструированную в плоский липидный бислой из ДФФХ при V = 150 мВ. Измерения при других значениях трансмембранного потенциала показали, что в зависимости от V α-ГЛ-канал флуктуирует между открытым и частично закрытым состоянием со средней проводимостью около 1000 и 200 пСм соответственно. На рис. 5б приведены зависимости проводимостей открытого и частично закрытого состояний α-ГЛ-канала от трансмембранного напряжения в присутствии МПК, РПК и БПК. На рисунке видно, что проводимость открытого состояния α-ГЛ-канала слабо снижается с ростом V, а частично закрытого – практически не зависит от трансмембранной разности потенциалов. Добавка МПК, РПК и БПК в мембраноомывающий раствор не влияет на основные характеристики α-ГЛ-поры. Видно, что проводимость открытого и частично закрытого состояния α-ГЛ-канала не изменяется при введении тестируемых агентов. Анализ частоты переходов α-ГЛ-канала в частично закрытое состояние показал, что введение аминоамидов в омывающий мембраны раствор не влияет на вероятность нахождения канала в открытом состоянии. Она составляет 85 ± 5% как в отсутствие, так и в присутствии МПК, РПК, БПК (табл. 2).
Рис. 5.
Влияние аминоамидов на функционирование α-ГЛ канала. а – Записи флуктуаций тока, протекающего через одиночный α-ГЛ канал, в отсутствие (контроль) и в присутствии 1 мМ РПК. Стрелки указывают моменты подачи трансмембранного потенциала 150 мВ. б – Зависимость проводимости открытого (темные символы) и частично закрытых состояний (светлые символы) α-ГЛ-канала от трансмембранного напряжения в отсутствие (1) и в присутствии 1 мМ БПК (2), МПК (3) и РПК (4). Мембрана сформирована из ДФФХ и омывается 1 М раствором KCl при pH 7.4.
ОБСУЖДЕНИЕ
РПК является относительно новым местным анестетиком амидного ряда, имеющим анальгезирующее действие, сопоставимое с действием БПК, но характеризующимся более безопасным кардиотоксическим профилем (Markham, Faulds, 1996). Обладая сходной химической структурой, МПК, РПК и БПК отличаются друг от друга длиной алкильных радикалов, что может объяснять различия в их липофильности. Способность растворяться в липидной фазе увеличивается в ряду МПК < РПК < БПК. Учитывая это, можно предположить, что коэффициент распределения тестируемых анестетиков между липидной и водной фазами определяется длиной углеводородной части их молекул.
Согласно данным Ефимовой с соавторами (Efimova et al., 2018), кинетика высвобождения кальцеина из липидных везикул после добавки БПК имеет двухфазный характер: в начальный момент времени наблюдается значительный скачок флуоресценции (около 10%), а затем медленный экспоненциальный рост до 23%. Поскольку полученные в работе результаты не позволили исключить образования мицелл, также сопровождающееся высвобождением маркера из липосом, начальный скачок флуоресценции после добавки БПК был отнесен к появлению смешанных мицелл “липид−анестетик”. В случае добавки в суспензию липосом МПК и РПК (рис. 2б) такого скачка не зафиксировано, наблюдается только медленный экспоненциальный рост флуоресценции кальцеина, вытекающего из липосом.
Кинетические зависимости высвобождения кальцеина из ДОФХ-липосом под действием МПК и РПК, а также БПК без учета начального скачка, хорошо аппроксимируются двухэкспоненциальными функциями. Временные параметры свидетельствуют о наличии быстрой и медленной компонент, обусловленных видом анестезирующего агента. Предполагается, что утечка маркера из везикул связана с разупорядочивающим действием анестетика, которое заключается в увеличении площади, приходящейся на одну липидную молекулу в мембране, а также с транслокацией анестетика через мембрану.
Из табл. 1 видно, что в тестируемой липидной системе характеристические времена, относящиеся как к быстрой, так и к медленной компонентам, увеличиваются в ряду МПК ≈ РПК < БПК (Efimova et al., 2018). Бóльшая эффективность БПК может быть связана с большей глубиной погружения его молекулы в гидрофобную область мембраны вследствие наличия дополнительных звеньев в углеводородной цепи, увеличивающих липофильность БПК по сравнению с МПК и РПК, что согласуется с результатами исследования фазового поведения липидов в присутствии тестируемых анестетиков (табл. 1). Анализ термограмм плавления ДПФХ после введения в систему МПК, РПК или БПК показывает, что ΔTm и ΔT1/2 увеличиваются в ряду МПК < РПК < БПК (табл. 1), а, следовательно, наибольшим разобщающим действием на мембранные липиды обладает БПК.
Благодаря наличию амидной группы, тестируемые местные анестетики могут существовать как в заряженной, так и незаряженной форме при физиологических условиях. А значит, сорбируясь на поверхности мембраны, они способны влиять на скачок электрического потенциала на границе вода–мембрана. Как известно, граничный потенциал мембраны включает в себя две компоненты – поверхностную, формируемую собственными зарядами молекул, образующих мембрану и сорбирующихся на ней, и дипольную, возникающую вследствие определенной взаимной ориентации диполей молекул липидов и примембранной воды. При сопоставлении изменений нонактин-индуцированного тока и интенсивности флуоресценции зонда di-8-ANEPPS было установлено, что РПК влияет на граничный потенциал мембраны преимущественно за счет изменения поверхностной компоненты. Это предположение находится в согласии с выдвинутой ранее гипотезой о модуляции поверхностного потенциала липидных бислоев БПК и МПК (Efimova et al., 2016).
Для оценки влияния изменений вышеописанных физико-химических свойств бислоя на функционирование ионных каналов были выбраны хорошо охарактеризованные каналообразующие агенты различной химической природы. В частности, в качестве широко используемой потенциалочувствительной пробы был выбран антимикробный пептид ГА, формирующий в модельных липидных мембранах высокоселективные катион-проводящие поры. Ранее (Efimova et al., 2016) было показано, что МПК и БПК снижают проводимость ионных каналов, образованных ГА, за счет увеличения величины поверхностного потенциала мембраны вследствие адсорбции положительно заряженных молекул анестетика. Действительно, если липидный бислой с адсорбированными молекулами анестетика приобретает положительный заряд, концентрация катионов у поверхности мембраны снижается по сравнению с объемом водной фазы. Следовательно, способность ГА-канала пропускать катионы будет падать. В случае высокой концентрации противоионов электролита в растворе происходит экранирование поверхностного заряда мембраны, что позволяет объяснить отсутствие влияния РПК на проводимость ГА-каналов в 2 M растворах KCl.
Для выяснения полной картины влияния аминоамидов различной структуры на каналообразующую активность ЦА был проведен анализ действия МПК и РПК на индуцированный пептидом интегральный ток (рис. 4б). Полученные ранее результаты исследований мультиканальной активности ЦА продемонстрировали значительное ингибирование макроскопического ЦА-индуцированного тока при введении в систему БПК (Ефимова и др., 2018). Табл. 2 демонстрирует различия эффектов МПК, РПК и БПК, которые могут быть результатом различной глубины погружения анестетиков в бислой, которая зависит от длины углеводородного “хвоста” этих молекул.
Учитывая увеличение разобщающего действия тестируемых анестетиков, длины их углеводородной цепи и степени снижения ЦА-индуцированного тока в ряду МПК < РПК < БПК, можно предположить наличие прямой корреляции между этими явлениями. Кроме того, аминоамиды слабо модулируют граничный потенциал мембраны, поэтому можно полагать, что мультиканальная активность ЦА не определяется изменением электрических свойств мембраны в присутствии анестетика, и что в процесс регулирования стационарного трансмембранного ЦА-индуцированного тока при добавке анестетика, в основном, вовлечены изменения механических характеристик мембраны. Полученные результаты позволяют сделать предположение, что наблюдаемое снижение порообразующей активности ЦА в присутствии местного анестетика обусловлено влиянием плотности упаковки мембранообразующих липидов на олигомеризацию пептидов в бислое (Ефимова и др., 2018).
С целью исследования роли модуляции эластических свойств мембраны аминоамидами в регуляции функционирования ионных каналов в качестве механочувствительной модели был выбран полиеновый макролидный антибиотик нистатин, продуцируемый Streptomyces sp. (Chulkov, Ostroumova, 2016). Известно, что при односторонней добавке этого антибиотика пора формируется при участии липидов мембраны, вследствие чего имеет липидное устье с положительной кривизной. Модификаторы мембран, увеличивающие спонтанную кривизну липидных монослоев, могут вызывать увеличение нистатин-индуцированной проницаемости мембран для ионов (Chulkov et al., 2015; Chulkov, Ostroumova, 2016). Эффект может быть обусловлен снижением энергии искривления липидной поверхности, а, следовательно, образования липидного устья полиеновых пор в присутствии модификаторов. Таким образом, рост каналообразующей активности нистатина в присутствии РПК может быть объяснен ростом числа нистатиновых каналов за счет увеличения спонтанной кривизны монослоя при адсорбции аминоамидов.
Пора, сформированная СМЕ, является довольно удобной моделью для изучения механизмов действия местных анестетиков, так как помимо потенциалчувствительности имеет некоторое сходство с топологией водной поры с натриевым каналом. Ранее (Zakharova et al., 2018) было продемонстрировано, что в условиях, близких к физиологическим (0.1 M KCl, pH 7.4), МПК слабо увеличивает проводимость СМЕ-каналов. Наблюдаемый эффект может быть связан с увеличением поверхностной компоненты граничного потенциала мембраны при адсорбции МПК. Поэтому для проверки данного предположения нами исследована проводимость СМЕ-каналов в присутствии МПК при высокой концентрации электролита (2 M KCl), то есть в условиях существенно меньшего радиуса Дебая, что соответствует компенсации поверхностного заряда мембраны, индуцированного МПК, противоионами буферного раствора.
Оказалось, что влияние МПК на проводимость СМЕ-каналов при положительном трансмембранном напряжении действительно коррелирует с предположением о компенсации поверхностного заряда мембраны, потенцированного аминоамидами. Однако при отрицательной трансмембранной разности потенциалов наблюдается значительное изменение формы вольт-амперной кривой. СМЕ-каналы являются асимметричными, конусообразными пептид-липидными порами с диаметрами пептидного и липидного устьев 0.6 и 1.4 нм соответственно. В условиях значительно меньшего радиуса Дебая представляется возможным взаимодействие катионов аминоамидов и положительно заряженного СМЕ. Исходя из этого, было сделано предположение, что аминоамиды способны проникать в СМЕ-пору со стороны большего устья, что приводит к снижению проводимости при отрицательных трансмембранных напряжениях, соответствующих потоку катионов со стороны липидного устья к пептидному (Zakharova et al., 2018). Кроме того, было установлено, что МПК существенно снижает время жизни СМЕ-каналов, что согласуется с предположением о блокировании поры аминоамидами при существенном снижении радиуса Дебая. Результаты исследований проводимости и времени жизни СМЕ-каналов в присутствии РПК находятся в согласии с предположением о стерическом блоке СМЕ-поры молекулами аминоамидов.
В дополнении ко всему, представляла интерес возможность изучения влияния аминоамидов на свойства белкового канала, образованного α-ГЛ. Сопоставление результатов действия анестетика на физико-химические свойства мембраны и функционирования α-ГЛ-канала при добавке анестетика показало, что анестетик-индуцированные изменения липидного микроокружения вблизи одиночной α-ГЛ поры не сказываются на ее потенциалчувствительности, что указывает на отсутствие опосредованного действия тестируемых анестетиков. Это может быть связанно с тем, что большая белковая пора, образованная β-складчатой структурой (Fernandez et al., 1980), слабо реагирует на изменения свойств липидного микроокружения.
Таким образом, исходя из вышеизложенного, можно сделать вывод о том, что модуляция ионных каналов аминоамидами может осуществляться за счет изменения как электрических, так и эластических свойств бислоя, а также при их непосредственном взаимодействии с каналом. Полученные результаты подтверждают тот факт, что фармакологическая активность аминоамидов тесно связана со свойствами молекул, обуславливающими их взаимодействие с липидами мембраны.
Список литературы
Ефимова С.С., Медведев Р.Я., Чулков Е.Г., Щагина Л.В., Остроумова О.С. 2018. Регуляция порообразующей активности цекропина А местными анестетиками. Цитология. 60 : 219–227. (Efimova S.S., Medvedev R.Ya., Chulkov E G., Schagina L.V., Ostroumova O.S. 2018. Regulation of pore-forming activity of cecropins by local anesthetics. Cell Tiss. Biol. (Tsitologiya). 60 : 219–227.)
Ефимова С.С., Медведев Р.Я., Щагина Л.В., Остроумова О.С. 2016. Увеличение текучести модельных липидных мембран под действием местных анестетиков. Цитология. 58 : 378–384. (Efimova S.S., Medvedev R Ya., Schagina L.V., Ostroumova O.S. 2016. Increasing of the fluidity of model lipid membranes under the influence of local anesthetics. Cell Tiss. Biol. (Tsitologiya). 58 : 378–384.)
Andersen O.S., Finkelstein A., Katz I., Cass A. 1976. Effect of phloretin on the permeability of thin lipid membranes. J. Gen. Physiol. 67 : 749–771.
Bidwai A.P., Takemoto J.Y. 1987. Bacterial phytotoxin, syringomycin, induces a protein kinase-mediated phosphorylation of red beet plasma membrane polypeptides. Proc. Natl. Acad. Sci. USA 84 : 6755–6759.
Chulkov E.G., Ostroumova O.S. 2016. Phloretin modulates the rate of channel formation by polyenes. Biochim. Biophys. Acta. 1858 : 289–294
Chulkov E.G., Schagina L.V., Ostroumova O.S. 2015. Membrane dipole modifiers modulate single-length nystatin channels via reducing elastic stress in the vicinity of the lipid mouth of a pore. Biochim. Biophys. Acta. 1848 : 192–199.
Clarke R.J., Kane D.J. 1997. Optical detection of membrane dipole potential: Avoidance of fluidity and dye-induced effects. Biochim. Biophys. Acta. 1323 : 223–239.
Efimova S.S., Chulkov E.G., Ostroumova O.S. 2018. Lipid-mediated mode of action of local anesthetics on lipid pores induced by polyenes, peptides and lipopeptides. Colloids Surf. B: Biointerfaces. 166 : 1–8.
Efimova S.S., Ostroumova O.S. 2015. Modifiers of the dipole potential of lipid bilayers. Acta Naturae. 7 : 73–82.
Efimova S.S., Zakharova A.A., Schagina L.V., Ostroumova O.S. 2016. Local anesthetics affect gramicidin A channels via membrane electrostatic potentials. J. Membr. Biol. 249 : 781–787.
Hickey R., Hoffman J., Ramamurthy S. 1991. A comparison of 0.5% ropivacaine and 0.5% bupivacaine for brachial plexus block. Anesthesiology. 74 : 639–642.
Hille B. 1977. Local anesthetics: Hydrophilic and hydrophobic pathways for the drug-receptor reaction. J. Gen. Physiol. 69 : 497–515.
HoEgberg C.-J., Lyubartsev A.P. 2008. Effect of local anesthetic lidocaine on electrostatic properties of a lipid bilayer. Biophys. J. 94 : 525–531.
Klein S.M., Greengrass RA, Steele S.M., D’Ercole F J., Speer K P., Gleason D.H., DeLong E.R., Warner D.S. 1998. A comparison of 0.5% bupivacaine, 0.5% ropivacaine, and 0.75% ropivacaine for interscalene brachial plexus block. Anesth. Analg. 87 : 1316–1319.
Kopeikina L.T., Kamper E.F., Siafaka I., Stavridis J. 1997. Modulation of synaptosomal plasma membrane-bound enzyme activity through the perturbation of plasma membrane lipid structure by bupivacaine. Anesth. Analg. 85 : 1337–1343.
Lee A.G. 1976. Model for action of local anesthetics. Nature. 262 : 545–548.
Malheiros S.V., Pinto L.M., Gottardo L., Yokaichiya D.K., Fraceto L.F., Meirelles N.C., de Paula E. 2004. A new look at the hemolytic effect of local anesthetics, considering their real membrane/water partitioning at pH 7.4. Biophys. Chem. 110 : 213–21.
Markham A., Faulds D. 1996. Ropivacaine. A review of its pharmacology and therapeutic use in regional anaesthesia. Drugs. 52 : 429–449.
McGlade D.P., Kalpokas M.V., Mooney P.H., Chamley D., Mark A.H., Torda T.A. 1998. A comparison of 0.5% ropivacaine and 0.5% bupivacaine for axillary brachial plexus anaesthesia. Anaesth. Intensive Care. 26 : 515–520.
Montal M., Muller P. 1972. Formation of bimolecular membranes from lipid monolayers and study of their electrical properties. Proc. Natl. Acad. Sci. USA. 65 : 3561–3566.
Ragsdale D.S., McPhee J.C., Scheuer T., Catterall W. 1994. A. Molecular determinants of state-dependent block of Na+ channels by local anesthetics. Science. 265 : 1724–1728.
Seeman P. 1972. The membrane actions of anesthetics and tranquilizers. Pharmacol. Rev. 24 : 585–655.
Singer M.A. 1977. Interaction of dibucaine and propanol with phospholipid bilayer membranes-effect of alterations in fatty acyl composition. Biochem. Pharmacol. 26 : 51–57.
Smith C.P., Auger M., Jarrell H.C. 1991. Molecular details on anesthetic–lipid interaction. Ann. N.Y. Acad. Sci. 625 : 668–684.
Starke-Peterkovic T., Turner N., Vitha M.F., Waller M.P., Hibbs D.E., Clarke R.J. 2006. Electric field strength of membrane lipids from vertebrate species: Membrane lipid composition and Na+–K+ – ATPase molecular activity. Biophys. J. 90 : 4060–4070.
Strichartz G.R., Sanchez V., Arthur G.R., Chafetz R., Martin D. 1990. Fundamental properties of local anesthetics. II. Measured octanol: Buffer partition coefficients and pKa values of clinically used drugs. Anesth. Analg. 71 : 158–170.
Wright S.N., Wang S.-Y., Xiao Y.-F., Wang G.K. 1999. State-dependent cocaine block of sodium channel isoforms, chimeras, and channels coexpressed with the β1 subunit. Biophys. J. 76 : 233–245.
Yarov-Yarovoy V., Brown J., Sharp E.M., Clare J.J., Scheuer T., Catterall W.A. 2001. Molecular determinants of voltage-dependent gating and binding of pore-blocking drugs in transmembrane segment IIIS6 of the Na (+) channel α subunit. J. Biol. Chem. 276 : 20–27.
Yokoyama S. 1998. Correlation between pharmacological potency and micellar surface potential of local anesthetic. Toxicol. Lett. 100–101 : 365–368.
Yun I., Cho E.S., Jang H.O., Kim U.K., Choi C.H., Chung I.K., Kim I.S., Wood W.G. 2002. Amphiphilic effects of local anesthetics on rotational mobility in neuronal and model membranes. Biochim. Biophys. Acta. 1564 : 123–132.
Zakharova A.A., Efimova S.S., Schagina L.V., Malev V.V., Ostroumova O.S. 2018. Blocking ion channels induced by antifungal lipopeptide syringomycin E with amide-linked local anesthetics. Sci Rep. 8 : 11543.
Дополнительные материалы отсутствуют.