Цитология, 2019, T. 61, № 2, стр. 139-149
С-пептид и инсулин при совместном интраназальном введении улучшают метаболические показатели и активность аденилатциклазной системы в гипоталамусе, миокарде и эпидидимальном жире крыс с диабетом 2 типа
К. В. Деркач 1, В. М. Бондарева 1, А. А. Перминова 1, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 06.08.2018
После доработки 13.09.2018
Принята к публикации 14.09.2018
Аннотация
C-пептид, продукт протеолиза проинсулина, регулирует физиологические и биохимические процессы путем повышения биодоступности инсулина вследствие образования с ним комплексов или вследствие связывания с рецепторами С-пептида. В условиях инсулиновой недостаточности при тяжелых формах сахарного диабета (СД) 2 типа уровни С-пептида и инсулина в мозге, мишени их действия, снижаются. Этот дефицит может быть компенсирован с помощью интраназально вводимых С-пептида (ИВСП) и инсулина (ИВИ). Предполагается, что введение ИВСП и ИВИ при СД 2 типа приведет к нормализации активности аденилатциклазной сигнальной системы (АЦСС) в гипоталамусе и на периферии и обеспечит, тем самым, терапевтический эффект ИВСП и ИВИ. Целью работы было изучить влияние 9-ти дневной обработки четырехмесячных самцов крыс с неонатальной моделью СД 2 типа ИВСП (в суточной дозе 10 мкг на животное) и ИВИ (в суточной дозе 20 мкг на животное) при их совместном и раздельном введении на метаболические и гормональные показатели и на активность АЦСС в гипоталамусе, миокарде и эпидидимальном жире (ЭЖ). Обработка диабетических крыс ИВИ и ИВСП+ИВИ ослабляла гипергликемию и инсулиновую резистентность, улучшала показатели липидного обмена и снижала индекс атерогенности. В гипоталамусе восстанавливалась регуляция активности аденилатциклазы (АЦ) агонистами МК4-меланокортиновых и D2-дофаминовых рецепторов, ослабленная при СД 2 типа. В миокарде и ЭЖ отмечали восстановление стимулирующих эффектов агонистов β1/β2- и β3-адренорецепторов на активность АЦ, что свидетельствует об улучшении гормональной регуляции сердечно-сосудистой системы и липолитических процессов в жировой ткани. Совместное применение ИВСП+ИВИ было более эффективным, чем монотерапия ИВИ, что свидетельствует об усилении регуляторных эффектов инсулина в присутствии С-пептида. Обработка диабетических крыс ИВСП была мало эффективной. Полученные данные свидетельствуют о перспективах совместного применения эквимолярных количеств ИВСП и ИВИ для коррекции метаболических и функциональных нарушений при тяжелых формах СД 2 типа.
Инсулиновая система мозга играет исключительно важную роль в центральной регуляции энергетического обмена и периферической инсулиновой чувствительности, в контроле функций ЦНС, эндокринной и сердечно-сосудистой систем (Kleinridders et al., 2014; Шпаков, Деркач, 2015; Shpakov et al., 2015). Инсулин, продуцируемый β-клетками поджелудочной железы, поступает в мозг путем рецепторопосредованного эндоцитоза, и в условиях инсулинового дефицита, например при сахарном диабете (СД) 1-го типа и декомпенсированных формах СД 2-го типа, концентрация инсулина в мозге снижается. Снижение уровня инсулина в ЦНС отмечается в условиях выраженной инсулиновой резистентности (ИР), характерной для СД 2-го типа и метаболического синдрома, причиной чего является ослабление транспорта инсулина через гематоэнцефалический барьер. Одним из подходов для коррекции дефицита инсулина в ЦНС является интраназальный способ его введения, что позволяет доставлять инсулин непосредственно в мозг, в том числе к чувствительным к нему гипоталамическим нейронам (Heni et al., 2012; Shpakov et al., 2012; Novak et al., 2014). Нами было показано, что длительная обработка крыс с экспериментальными моделями СД 1-го и 2-го типов с помощью интраназально вводимого инсулина (ИВИ) улучшает углеводный и липидный обмен, нормализует периферическую инсулиновую чувствительность, восстанавливает когнитивные функции и активность тиреоидной и гонадной осей, нормализует гормональную регуляцию миокарда и жировой ткани (Чистякова и др., 2011; Shpakov et al., 2011, 2012; Шпаков и др., 2013; Derkach et al., 2015a; Сухов и др., 2016).
Однако применение ИВИ не устраняет в мозге дефицита С-пептида, который генерируется одновременно с инсулином вследствие протеолитического расщепления проинсулина в β-клетках поджелудочной железы. Ранее считали, что основной функцией С-пептида является обеспечение правильной укладки молекулы инсулина в процессе его синтеза, а также сохранение инсулина в активной форме в секреторных гранулах β-клеток. Однако, согласно современным представлениям, С-пептид продолжает влиять на биологическую активность инсулина уже после его секреции в кровоток, что обусловлено способностью С-пептида образовывать гетероолигомерные комплексы с инсулином. В результате меняются как биодоступность инсулина, так и эффективность его взаимодействия с инсулиновыми рецепторами (Shafqat et al., 2006; Landreh et al., 2013). Наряду с этим С-пептид обладает собственными сигнальными функциями, регулируя различные сигнальные каскады в клетках-мишенях, в том числе в нейронах головного мозга (Vasic, Walcher, 2012; Wahren et al., 2012; Шпаков, Гранстрем, 2013; Шпаков, 2015, 2017). Действие С-пептида направлено на активацию 3‑фосфоинозитидного и NO-синтазного путей и каскада митогенактивируемых протеинкиназ, причем часть этих эффектов реализуется через специфичный к С-пептиду рецептор GPR146 (Yosten et al., 2013; Kolar et al., 2017). Вследствие этого недос-таток С-пептида или изменение соотношения инсулин/С-пептид в мозге может приводить к нарушению центральной регуляции инсулином и С-пептидом физиологических и биохимических процессов.
На основании вышесказанного мы предположили, что интраназальное введение С-пептида (ИВСП) совместно с ИВИ будет более эффективно в сравнении с монотерапией ИВИ восстанавливать метаболические показатели при СД, что и было подтверждено при изучении влияния 7-суточной обработки крыс с мягким стрептозотоциновым СД 1-го типа и неонатальным СД 2-го типа с помощью ИВСП и ИВИ (Derkach et al., 2018). При изучении влияния ИВИ на метаболические и гормональные показатели у крыс с СД было показано, что одним из механизмов восстанавливающего действия ИВИ является нормализация активности гипоталамических сигнальных систем, в том числе аденилатциклазной сигнальной системы (АЦСС), и восстановление гормональной регуляции на периферии (Shpakov et al., 2012; Шпаков и др., 2013; Сухов и др., 2016). Необходимо отметить, что АЦСС в мозге и на периферии играет исключительно важную роль в контроле физиологических и биохимических функций организма, а нарушение ее активности в условиях СД является одной из первопричин широкого спектра осложнений этого заболевания (Shpakov et al., 2012; Shpakov, Derkach, 2013). Так, в мозге в условиях СД меняются регуляторные эффекты серотонина, дофамина, пептидов меланокортинового семейства и ряда других гормонов на активность АЦСС, и это лежит в основе развития когнитивных дисфункций, метаболических и эндокринных расстройств. Нарушение регуляции АЦСС агонистами β-адренергических рецепторов в миокарде в условиях СД 1‑го и 2-го типов приводит к развитию диабетической кардиомиопатии. Дисбаланс стимулирующих и ингибирующих эффектов гормонов на активность АЦСС в жировой ткани ведет к нарушению процессов липолиза и липогенеза, вызывая ожирение и дислипидемию. Цель исследования состояла в изучении влияния длительной обработки самцов крыс с неонатальной моделью СД 2-го типа ИВСП и ИВИ при их совместном и раздельном введении на метаболические и гормональные показатели, а также на функциональную активность АЦСС в гипоталамусе, миокарде и эпидидимальном жире (ЭЖ) диабетических животных.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали 4-месячных самцов крыс Wistar. Неонатальную модель СД 2 типа вызывали однократным внутрибрюшинным введением четырехсуточным крысятам стрептозотоцина (Sigma, США) в дозе 70 мг/кг (в 0.1 М цитратном буфере, pH 4.5), как описано ранее (Shpakov et al., 2012). В возрасте 3 мес. отмечали характерные признаки СД 2-го типа – гипергликемию (уровень глюкозы натощак выше 6 мМ), нарушенную толерантность к глюкозе (уровень глюкозы через 120 мин после глюкозной нагрузки выше 9 мМ) и умеренно выраженную дислипидемию. В дальнейшем признаки СД усиливались. Контрольным крысятам в возрасте 4 сут вместо стрептозотоцина вводили цитратный буфер. Все эксперименты проводили в строгом соответствии с правилами, принятыми Этическим комитетом ИЭФБ РАН (30 декабря 2015 г.), и требованиями Директивы 1986 Европейского парламента и “Guide for the Care and Use of Laboratory Animals, 2010”.
Инсулин (Sigma, США) перед введением растворяли в 0.1 М цитратном буфере, pH 4.5, С-пептид (Bachem, США) – в физиологическом растворе. Препараты вводили 4-месячным крысам интраназально в суточных дозах 20 и 10 мкг соответственно на животное в течение 9 сут. Дозы при раздельном и совместном введении были идентичными (объем каждого препарата составил 10 мкл). Изучали пять групп животных: контрольные (К) и диабетические (Д) крысы, которые получали физиологический раствор, и диабетические крысы, которые получали ИВСП (группа ДС), ИВИ (ДИ) и совместно ИВСП+ИВИ (ДСИ) (во всех группах n = 6). После окончания эксперимента крыс наркотизировали, забирали кровь для оценки уровня глюкозы, инсулина и показателей липидного обмена и образцы тканей для определения активности аденилатциклазы (АЦ).
Для измерения концентрации глюкозы в крови, полученной из хвостовой вены, использовали тест-полоски One Touch Ultra (США) и глюкометр Life Scan (Johnson&Johnson, Дания). Концентрацию триглицеридов, общего холестерина (ОХол) и его комплексов с липопротеидами низкой (Хол-ЛПНП) и высокой (Хол-ЛПВП) плотности определяли с помощью наборов фирмы Olvex Diagnosticum (Россия). Уровень инсулина в крови измеряли с помощью ИФА-набора Rat Insulin ELISA (Mercodia AB, Швеция). Для оценки толерантности к глюкозе и ИР использовали глюкозотолерантный тест (ГТТ), для чего крысам внутрибрюшинно вводили раствор глюкозы (2 г/кг), и инсулиноглюкозотолерантный тест (ИГТТ), для чего животным одновременно вводили глюкозу (2 г/кг, внутрибрюшинно) и инсулин (“Хумалог”, 0.8 МЕ/кг, подкожно). Концентрацию глюкозы в крови измеряли на протяжении 120 мин (через 15, 30, 60 и 120 мин после глюкозной нагрузки). Индекс ИР оценивали как произведение концентраций глюкозы и инсулина. Индекс атерогенности оценивали как соотношение Хол-ЛПНП и Хол-ЛПВП.
В экспериментах использовали дофамин, агонист дофаминовых рецепторов 1-го типа (Д1Р), 3-аллил-6-хлор-1-фенил-2,3,4,5-тетрагидро-1H-3-бензазепин-7,8-диол (SKF 82958), Д2Р-агонист бромокриптин, серотонин, селективный агонист аденозиновых рецепторов 1-го типа (Аден1Р), N6-циклопентиладенозин, Аден2Р-агонист CGS-21680, адреналин, норадреналин, агонист β-адренергических рецепторов (β‑АР) изопротеренол, β3-агонист [4-[[2-(3-хлорофенил)-2-гидроксиэтил]амино]пропил]ацетат натрия (BRL-37344), α-меланоцитстимулирующий гормон (α-МСГ), 5'-гуанилилимидодифосфат (ГИДФ), форсколин, креатинфосфат, креатинфосфокиназу из мышц кролика, АТФ, цАМФ (Sigma, США), а также агонист серотониновых рецепторов 1В-подтипа (С1BР) 5-нонилокситриптамин (5-НОТ), С6Р-агонист 5-хлор-2-метил-3-(1,2,3,6-тетрагидро-4-пиридинил)-1H-индол (EMD-386088) и селективный агонист меланокортиновых рецепторов 4-го типа (МК4Р) N-[(1R)-1-[(4-хлорофенил)метил]-2-[4-циклогексил-4-(1H-1,2,4-триазол-1-илметил)-1-пиперидинил]-2-оксоэтил]-1,2,3,4-тетрагидро-3-изохинолинкарбоксамид (THIQ) (Tocris Cookson Ltd., Великобритания). Для катализируемой АЦ реакции в качестве радиоактивно меченного субстрата использовали [α-32P]АТФ (150 ГБк/ммоль) (Изотоп, Россия).
Выделение фракций плазматических мембран из тканей осуществляли, как описано ранее (Деркач и др., 2014а, 2014б; Derkach et al., 2015b). Для этого ткани гипоталамуса, миокарда и ЭЖ при 4°C гомогенизировали в 50 мМ Tris-HCl-буфере (pH 7.4), содержащем 5 мМ MgCl2, 10%-ную сахарозу и коктейль ингибиторов протеаз (буфер А). Для получения синаптосомальных мембран гомогенат гипоталамуса центрифугировали (1000 g, 10 мин), осадок отбрасывали, супернатант повторно центрифугировали (9000 g, 20 мин), осадок ресуспендировали в буфере А без сахарозы и снова центрифугировали (35 000 g, 10 мин). Для получения мембран из миокарда гомогенат центрифугировали (480 g, 10 мин), осадок отбрасывали, супернатант центрифугировали (27 500 g, 20 мин), полученный осадок ресуспендировали в буфере А без сахарозы и повторно центрифугировали в том же режиме. При выделении фракций плазматических мембран из ЭЖ жидкую часть гомогената после отделения застывшего жира отбирали и центрифугировали (1000 g, 15 мин), осадок собирали и ресуспендировали в буфере А без сахарозы, затем центрифугировали в градиенте сахарозы (32–55%) при 200 000 g в течение 45 мин. Фракцию плазматических мембран отбирали у верхней границы градиента, растворяли в буфере А без сахарозы и центрифугировали при 50 000 g в течение 30 мин. Полученные мембраны гипоталамуса, миокарда и ЭЖ суспендировали в 50 мМ Tris-HCl-буфере (pH 7.4), содержащем 5 мМ MgCl2, и использовали для определения активности АЦ.
Активность АЦ определяли радиоизотопным методом в реакционной смеси следующего состава: 50 мМ Tris-HCl (pH 7.5), 5 мМ MgCl2, 0.1 мМ цАМФ, 1 мМ АТФ, 20–40 КБк [α-32P]-АТФ, 20 мМ креатинфосфата, 0.2 мг/мл креатинфосфокиназы и 30–80 мкг мембранного белка. Реакцию проводили при 37°C в течение 12 мин (Derkach et al., 2015b). Активность АЦ оценивали по количеству получаемого цАМФ и выражали в пмоль цАМФ/мин на 1 мг мембранного белка. Ингибирующие эффекты гормонов оценивали по их влиянию на стимулированную форсколином (10–5 М) активность АЦ.
Статистический анализ полученных данных проводили с помощью программы Microsoft Office Excel 2007. Данные представляли как среднее значение ± SD. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали различия при уровне значимости Р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
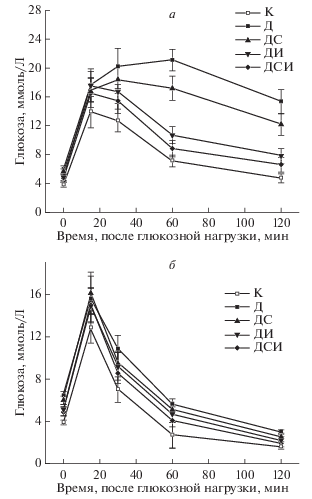
У 4-месячных крыс с СД 2-го типа, который индуцировали обработкой стрептозотоцином четырехдневных крысят, отмечали повышение уровня глюкозы и индекса ИР (табл. 1), а также нарушение толерантности к глюкозе и ее утилизации, на что указывают достоверно более высокие значения уровня глюкозы при проведении ГТТ и ИГТТ через 30, 60 и 120 мин после глюкозной нагрузки (рис. 1). Рассчитанные значения AUC0–120 (интегрированная площадь под кривой “концентрация глюкозы (ммоль/л)–время (мин)” в интервале времени от 0 до 120 мин) для глюкозных кривых в ГТТ и ИГТТ у диабетических крыс были достоверно выше, чем в контроле (табл. 1). У крыс с СД отмечали нарушения липидного обмена, на что указывают достоверное повышение уровня триглицеридов и индекса атерогенности, а также повышение соотношения массы жировой ткани к общей массе тела (табл. 1). Обработка диабетических крыс с помощью ИВИ и ИВСП+ИВИ в течение 9 сут приводила к ослаблению гипергликемии, снижению индекса ИР и частичному восстановлению толерантности к глюкозе и ее инсулининдуцированной утилизации, что демонстрирует снижение концентрации глюкозы в ГТТ и ИГТТ и значений AUC0–120 для глюкозных кривых (табл. 1; рис. 1). В группе ДСИ достоверно в сравнении с группой Д снижались уровень триглицеридов и индекс атерогенности. При совместном воздействии ИВСП и ИВИ восстанавливающий эффект на глюкозный и липидный гомеостаз был выражен сильнее, чем при воздействии одного ИВИ, в то время как обработка ИВСП была малоэффективной (табл. 1; рис. 1). Таким образом, обработка диабетических крыс совместно ИВСП и ИВИ приводила к восстановлению глюкозного и липидного гомеостаза, улучшала толерантность к глюкозе и чувствительность тканей к инсулину. Для расшифровки молекулярных механизмов эффектов ИВСП и ИВИ изучали их влияние на активность АЦСС в гипоталамусе, миокарде и ЭЖ.
Таблица 1.
Масса тела и жировой ткани, уровни глюкозы и инсулина, показатели липидограммы, значения AUC0–120 для глюкозных кривых в ГТТ и ИГТТ у самцов крыс с СД 2-го типа и влияние на них обработки ИВИ, ИВСП и ИВИ+ИВСП
| Показатель | К, n = 6 | Д, n = 6 | ДС, n = 6 | ДИ, n = 6 | ДСИ, n = 6 |
|---|---|---|---|---|---|
| Масса тела, г | 287 ± 18 | 302 ± 19 | 304 ± 20 | 298 ± 16 | 294 ± 19 |
| Абдоминальный жир, г | 4.8 ± 0.9 | 7.2 ± 1.1a | 7.1 ± 1.3a | 6.3 ± 0.9a | 6.0 ± 1.1 |
| ЭЖ, г | 3.9 ± 1.0 | 5.0 ± 0.8 | 4.7 ± 1.1 | 4.0 ± 1.2 | 3.5 ± 0.7б |
| Доля жира, % | 3.0 ± 0.4 | 4.0 ± 0.6 | 3.9 ± 0.6 | 3.4 ± 0.5 | 3.2 ± 0.5б |
| Глюкоза, мМ | 3.6 ± 0.2 | 6.4 ± 0.5a | 6.0 ± 0.5a | 5.1 ± 0.3a, б | 4.6 ± 0.6a, б |
| Инсулин, нг/мл | 0.67 ± 0.19 | 0.56 ± 0.21 | 0.53 ± 0.16 | 0.45 ± 0.14 | 0.41 ± 0.16 |
| Индекс ИР | 2.41 ± 0.82 | 3.55 ± 1.25 | 3.15 ± 0.95 | 2.29 ± 0.73 | 1.88 ± 0.76 |
| ГТТ, AUC0-120 | 972 ± 99 | 2157 ± 107a | 1841 ± 127a, б | 1378 ± 133a, б | 1214 ± 140a, б |
| ИГТТ, AUC0-120 | 542 ± 38 | 852 ± 77a | 791 ± 67a | 739 ± 92a | 687 ± 72a, б |
| Триглицериды, мМ | 0.94 ± 0.15 | 1.65 ± 0.23a | 1.53±0.23 a | 1.38 ± 0.26a | 1.22 ± 0.24б |
| ОХол, мМ | 4.03 ± 0.28 | 4.92 ± 0.27a | 4.87 ± 0.26a | 4.73 ± 0.20a | 4.69 ± 0.22a |
| Хол-ЛПВП, мМ | 2.56 ± 0.19 | 2.08 ± 0.20a | 2.15 ± 0.19a | 2.36 ± 0.21 | 2.61 ± 0.19б |
| Хол-ЛПНП, мМ | 1.35 ± 0.19 | 2.48 ± 0.31a | 2.37 ± 0.23a | 2.32 ± 0.21a | 1.97 ± 0.20a, б |
| Хол-ЛПНП/Хол-ЛПВП | 0.533 ± 0.099 | 1.204 ± 0.192a | 1.114 ± 0.196a | 0.992 ± 0.162a | 0.761 ± 0.135a, б |
Рис. 1.
Влияние ИВСП и ИВИ при раздельном и совместном введении на динамику изменений уровня глюкозы в глюкозотолерантном (а) и инсулиноглюкозотолерантном (б) тестах. Данные представлены как M ± SD.
Базальная активность АЦ в мембранах, выделенных из тканей гипоталамуса, и стимулирующие эффекты ГИДФ (10–5 М) – негидролизуемого аналога ГТФ – и форсколина (10–5 М) на активность АЦ у диабетических крыс без обработки и с обработкой ИВСП и ИВИ не отличались от таковых в контрольной группе животных. В миокардиальных мембранах диабетических и контрольных крыс статистически значимых различий базальной и стимулированной форсколином активности АЦ выявлено не было (данные не представлены), в то время как стимулирующий эффект ГИДФ в группах Д и ДС был снижен в сравнении с группой К и частично восстанавливался в группах ДИ и ДСИ. Так, вызываемый ГИДФ прирост активности АЦ в миокарде крыс групп К, Д, ДС, ДИ и ДСИ составил 72.8 ± 3.3, 54.1 ± 2.4, 58.2 ± 2.8, 64.7 ± 3.1 и 67.2 ± 1.6 пмоль цАМФ/мин на 1 мг мембранного белка соответственно. В мембранах, выделенных из ЭЖ диабетических крыс, базальная активность АЦ и ее стимуляция ГИДФ и форсколином были существенно снижены в сравнении с группой К и частично восстанавливались при обработке ИВИ и ИВИ+ИВСП, в наибольшей степени при совместном их действии (табл. 2). Таким образом, в гипоталамусе крыс с СД каталитические потенции АЦ и ее стимуляция негормональными агентами сохранялись, в то время как в ЭЖ они претерпевали существенные изменения, которые частично восстанавливались при обработке крыс ИВИ и ИВСП+ИВИ. В миокардиальных мембранах ослаблялось взаимодействие между АЦ и Gs-белками, стимулирующим способом сопряженных с АЦ, которое частично восстанавливалось в группах ДИ и ДСИ.
Таблица 2.
Базальная и стимулированная ГИДФ, форсколином и гормональными агентами активность аденилатциклазы в мембранах, выделенных из эпидидимального жира диабетических крыс, и влияние на них обработки ИВСП и ИВИ при раздельном и совместном введении
| Воздействие | Активность АЦ, пмоль цАМФ/мин на 1 мг мембранного белка, M ± SD | ||||
|---|---|---|---|---|---|
| К | Д | ДС | ДИ | ДСИ | |
| Базальная (без воздействий) | 48.3 ± 1.7 | 36.1 ± 1.7a | 37.4 ± 2.0a | 39.4 ± 1.8a | 42.6 ± 1.8a, б |
| Прирост активности АЦ над ее базальным уровнем, пмоль цАМФ/мин на 1 мг мембранного белка, M ± SD | |||||
| ГИДФ | 82.3 ± 2.1 | 56.2 ± 2.7a | 62.2 ± 3.2a | 66.2 ± 1.8a, б | 72.9 ± 2.3a, б |
| Форсколин | 155.4 ± 3.5 | 111.6 ± 2.9a | 117.1 ± 3.3a | 129.3 ± 2.1a,б | 136.7 ± 2.5a, б |
| Адреналин | 62.3 ± 1.9 | 34.9 ± 1.9a | 38.4 ± 1.7a | 46.6 ± 2.0a, б | 53.1 ± 1.0a, б |
| Изопротеренол | 39.3 ± 2.1 | 25.2 ± 1.7a | 26.5 ± 1.1a | 29.3 ± 2.5a | 34.8 ± 2.5б |
| BRL-37344 | 28.7 ± 1.6 | 10.3 ± 1.8a | 14.2 ± 1.9a | 17.6 ± 1.7a, б | 21.4 ± 1.5a, б |
| CGS-21680 | 14.9 ± 1.0 | 9.4 ± 0.9a | 10.8 ± 0.8a | 10.5 ± 1.0a | 10.8 ± 0.9a |
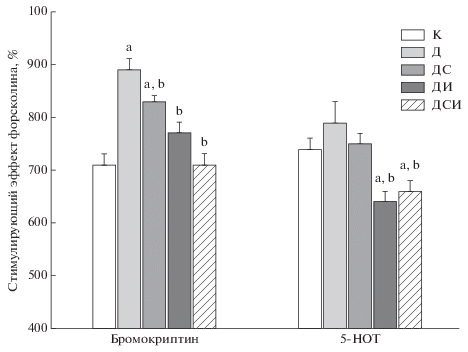
В условиях СД стимулирующие эффекты серотонина, С6Р-агониста EMD-386088, дофамина и Д1Р-агониста SKF 82958 на активность АЦ в гипоталамусе практически не менялись, в то время как стимулирующие эффекты α-МСГ – агониста меланокортиновых рецепторов (МКР) – и селективного МК4Р-агониста THIQ снижались, причем различия с контролем были статистически значимыми (табл. 3). Обработка диабетических крыс с помощью ИВСП слабо влияла на эффекты моноаминов и агонистов МКР, в то время как обработка ИВИ и ИВИ+ИВСП восстанавливала эффекты α-МСГ и THIQ и ослабляла стимуляцию АЦ дофамином и SKF 82958 (табл. 3). Ингибирующий эффект Д2Р-агониста бромокриптина в гипоталамусе крыс группы Д был снижен в сравнении с контролем и полностью восстанавливался при обработке ИВИ+ИВСП, в то время как соответствующий эффект С1BР-агониста 5-НОТ усиливался у диабетических крыс, обработанных ИВИ и ИВИ+ИВСП, и статистически значимо отличался от такового в группах К и Д (рис. 2).
Таблица 3.
Стимулирующие эффекты гормональных агентов на активность аденилатциклазы в мембранах гипоталамуса и миокарда диабетических крыс и влияние на них раздельной и совместной обработки ИВСП и ИВИ
| Гормональный агент | Прирост активности АЦ над ее базальным уровнем, пмоль цАМФ/мин на 1мг мембранного белка, M ± SD | ||||
|---|---|---|---|---|---|
| К | Д | ДС | ДИ | ДСИ | |
| Гипоталамус | |||||
| Серотонин | 43.9 ± 1.4 | 46.2 ± 1.9 | 43.7 ± 1.2 | 44.5 ± 1.8 | 43.1 ± 1.9 |
| EMD-386088 | 9.5 ± 0.7 | 8.7 ± 0.7 | 9.4 ± 1.0 | 8.5 ± 0.8 | 8.3 ± 0.7 |
| Дофамин | 24.4 ± 0.9 | 25.5 ± 1.3 | 24.5 ± 1.1 | 19.8 ± 1.0a, б | 20.4 ± 1.0a, б |
| SKF 82958 | 25.8 ± 0.6 | 26.2 ± 1.2 | 26.2 ± 1.4 | 21.1 ± 0.8a, б | 20.7 ± 1.1a, б |
| α-МСГ | 44.8 ± 1.2 | 21.6 ± 1.3a | 26.9 ± 1.2a, б | 34.0 ± 1.4a, б | 39.2 ± 1.3a, б, в |
| THIQ | 41.5 ± 1.7 | 20.1 ± 0.5a | 27.3 ± 1.0a, б | 32.2 ± 1.6a, б | 37.6 ± 0.8a, б, в |
| Миокард | |||||
| Норадреналин | 64.2 ± 2.1 | 51.8 ± 1.5a | 54.2 ± 2.1a | 58.6 ± 1.5a, б | 59.2 ± 1.4a, б |
| Изопротеренол | 67.3 ± 1.5 | 55.2 ± 2.8a | 56.8 ± 2.0a | 61.7 ± 1.9a, б | 61.1 ± 1.2a, б |
| BRL-37344 | 13.0 ± 0.9 | 19.8 ± 0.7a | 16.1 ± 0.6a, б | 12.8 ± 0.9б | 13.7 ± 1.1б |
Примечание. Гормональные агенты использовали в концентрации 10–5 М, за исключением α-МСГ и THIQ (10–7 М). a Различия между контрольной и диабетическими группами статистически значимы при Р < 0.05. б Различия между группой Д и диабетическими крысами, получавшими ИВСП, ИВИ и ИВСП+ИВИ, статистически значимы при Р < 0.05. в Различия между группами ДИ и ДСИ статистически значимы при Р < 0.05.
Рис. 2.
Ингибирующие эффекты гормональных агентов на стимулированную форсколином активность АЦ в мембранах гипоталамуса диабетических крыс и влияние на них ИВСП и ИВИ при раздельном и совместном введении. Бромокриптин и 5-НОТ в концентрации 10–5 М. По вертикали – стимулирующий эффект форсколина (10–5 М) в процентах, который в отсутствие гормонального воздействия принят за 100%. a Различия между контрольной и диабетическими группами статистически значимы при Р < 0.05, b Различия между группой Д и диабетическими крысами, обработанными ИВСП, ИВИ и ИВСП+ИВИ, статистически значимы при Р < 0.05. Данные представлены в виде M ± SD.
В миокарде диабетических крыс отмечали ослабление стимулирующих АЦ эффектов норадреналина и изопротеренола, действующих преимущественно через β1- и β2-АР, и компенсаторное усиление стимулирующего эффекта β3-агониста BRL-37344 (табл. 3). Рассчитанное соотношение стимулирующих эффектов BRL-37344 и изопротеренола в группе Д составило 0.359 и было на 86% выше такового в группе К (0.193). В результате 9-суточной обработки диабетических крыс ИВИ и ИВИ+ИВСП отмечали нормализацию соотношения стимулирующих эффектов β3- и β1/β2-агонистов (табл. 3).
В ЭЖ диабетических крыс стимулирующие эффекты адреналина, изопротеренола и BRL-37344, мощных активаторов липолиза, на активность АЦ снижались на 44, 36 и 64% соответственно. Обработка ИВИ и ИВИ+ИВСП частично их восстанавливала, в наибольшей степени в группе ДСИ, где стимуляция АЦ адреналином, изопротеренолом и BRL-37344 оставалась сниженной в сравнении с контролем лишь на 15, 11 и 25% соответственно (табл. 2). В группе Д снижался стимулирующий эффект Аден2Р-агониста CGS-21680, но в этом случае обработка с помощью ИСП и ИВИ не приводила к его восстановлению (табл. 3). Ингибирующий эффект Аден1Р-агониста N6-циклопентиладенозина, обладающего антилиполитической активностью, на стимулированную форсколином активность АЦ в мембранах, выделенных из ЭЖ диабетических крыс, существенно не отличался от такового в контроле и слабо менялся при обработке ИВСП и ИВИ (данные не представлены). Таким образом, у крыс с СД 2-го типа отмечали тканеспецифичные изменения чувствительности АЦСС к гормонам, которые в различной степени восстанавливались при обработке ИВИ и ИВСП+ИВИ. При этом совместное применение препаратов было более эффективным, чем монотерапия ИВИ, в то время как применение ИВСП слабо влияло на гормональную регуляцию АЦСС.
ОБСУЖДЕНИЕ
В условиях неонатальной модели СД 2-го типа, детально охарактеризованной нами ранее и соответствующей декомпенсированной форме этого заболевания (Shpakov et al., 2012; Шпаков и др., 2013; Деркач и др., 2016), отмечаются небольшое снижение уровня инсулина в периферическом кровотоке и сильно выраженная периферическая ИР. Оба этих фактора, действуя совместно, приводят к значительному снижению поступления инсулина в мозг. Следствием этого являются дефицит гормона в ЦНС и ослабление функционирования инсулиновой системы мозга, ответственной за контроль пищевого поведения и периферической инсулиновой чувствительности, за регуляцию функций нервной, эндокринной и сердечно-сосудистой систем (Kleinridders et al., 2014; Shpakov et al., 2015). Ранее нами было показано, что обработка крыс с неонатальным СД с помощью ИВИ, предотвращая дефицит инсулина в ЦНС, вызывает восстановление активности инсулиновой системы мозга, улучшает когнитивные функции, метаболические и гормональные показатели (Чистякова и др., 2011; Shpakov et al., 2012; Шпаков и др., 2013; Сухов и др., 2016). Положительный эффект ИВИ отмечали и у крыс с экспериментальным СД 1-го типа, который характеризуется системным дефицитом инсулина (Derkach et al., 2015a). При этом одним из механизмов положительного влияния ИВИ на гормональные и метаболические показатели являлась нормализация гормональной регуляции АЦСС в тканях мозга и на периферии (Shpakov et al., 2012; Шпаков и др., 2013).
При инсулинодефицитных состояниях отмечается снижение уровня в крови не только инсулина, но и его постоянного спутника – С-пептида проинсулина, который вовлечен в регуляцию функций нервной системы и периферических органов и тканей. С целью предотвращения негативного влияния дефицита С-пептида в крови на метаболические и физиологические процессы ранее предлагалось его системное введение в кровоток (Wahren et al., 2012). Однако такой подход не позволяет в полной мере решить проблему дефицита С-пептида в структурах мозга, являющихся одними из мишеней его регуляторного действия, а также приводит к длительному повышению уровня С-пептида в кровотоке, что может вызвать развитие резистентности к нему тканей-мишеней. Так, имеются данные о том, что длительное повышение уровня С-пептида в периферическом кровотоке при метаболическом синдроме может быть одной из причин атеросклеротических изменений в сосудах (Walcher, Marx, 2009; Pinger et al., 2017). Восполнить дефицит С-пептида в ЦНС можно путем его интрацеребровентрикулярного введения, но этот способ является травматичным, требует специального оборудования и не подходит для клинического применения. Вследствие этого нами предложен интраназальный способ доставки С-пептида в ЦНС, который ранее был успешно апробирован для инсулина (Heni et al., 2012; Shpakov et al., 2012; Novak et al., 2014).
Предпринятое исследование ставило целью решение двух основных задач. Первая состояла в оценке эффективности интраназального способа доставки С-пептида, вторая – в изучении участия АЦСС в реализации его регуляторных эффектов. Показано, что интраназальное введение только одного С-пептида диабетическим крысам является малоэффективным. Следует, однако, отметить, что и в этом случае выявляется, хотя и слабо выраженная, его способность влиять на гормональную регуляцию АЦ в гипоталамусе и миокарде. Так, в гипоталамусе крыс группы ДС отмечали частичное восстановление стимулирующих эффектов агонистов МК4Р на активность АЦ, в значительной степени ослабленных в условиях диабетической патологии, а в миокарде было обнаружено снижение стимулирующего эффекта β3‑агониста BRL-37344 на активность АЦ и соотношения стимулирующих эффектов β3- и β1/β2-агонистов, повышенных при СД 2-го типа. Известно, что компенсаторное повышение β3-адренергической сигнализации в миокарде при СД 2-го типа на фоне ослабления β1- и β2-сигнальных путей является одним из признаков развития диабетической кардиомиопатии (Altan et al., 2007).
Совместное интраназальное введение эквимолярных количеств С-пептида и инсулина диабетическим крысам по способности восстанавливать метаболические и гормональные показатели, а также положительному влиянию на гормональную регуляцию АЦСС превосходило монотерапию ИВИ. Это свидетельствует о присущей С-пептиду способности усиливать регуляторные эффекты инсулина в ЦНС. В основе этого могут лежать два механизма. Первый состоит в способности С-пептида вызывать диссоциацию прочных гексамерных, Zn2+-стабилизированных комплексов инсулина вследствие образования с молекулами инсулина менее прочного гетероолигомерного комплекса, в котором инсулин более эффективно взаимодействует с инсулиновым рецептором (Landreh et al., 2013). В этой связи следует отметить, что сравнительно слабые метаболические и гормональные эффекты, которые отмечали при введении одного С-пептида, также могут быть обусловлены его способностью повышать биодоступность инсулина для инсулиновой системы мозга, поскольку даже при инсулинодефицитных состояниях в мозге присутствует некоторое количество гормона. Второй механизм потенцирующего эффекта С-пептида на инсулиновый сигналинг может заключаться в его связывании с собственным рецептором (GPR146) и последующей за этим активации внутриклеточных сигнальных каскадов, имеющих общие звенья с инсулиновыми путями (Kolar et al., 2017). Результатом этого может быть усиление регуляторных влияний инсулина в ЦНС.
В пользу потенцирующего влияния ИВСП при его совместном использовании с ИВИ свидетельствуют следующие данные. У диабетических крыс, которым совместно вводили ИВСП и ИВИ, индекс ИР и соотношение Хол-ЛПНП/Хол-ЛПВП были на 18 и 23% ниже, чем в группе животных, получавших только один ИВИ. В группе ДИ значения AUC0–120 для глюкозных кривых в ГТТ и ИГТТ были снижены по сравнению с группой Д на 36 и 13%, а в группе ДСИ – на 44 и 19% соответственно, что свидетельствует в пользу повышения чувствительности периферических тканей к инсулину и утилизации ими глюкозы при совместном введении ИВСП и ИВИ.
В гипоталамусе диабетических крыс, получавших ИВИ+ИВСП, отмечали более выраженное восстановление стимулирующих эффектов α-МСГ и THIQ и ингибирующего эффекта бромокриптина в сравнении с животными, получавшими только ИВИ. Восстановление меланокортиновой и D2-дофаминовой сигнализации приводит к нормализации пищевого поведения и расхода энергии на периферии, улучшает глюкозный и липидный гомеостаз, улучшает функционирование тиреоидной системы и зависимый от нее термогенез, в значительной степени нарушенные при СД 2-го типа.
Установлено, что стимулирующие эффекты агонистов β-АР и негормональных агентов (форсколина и ГИДФ) в ЭЖ у крыс группы ДСИ восстанавливались в большей степени, чем в группе ДИ. Это свидетельствует о том, что липолитическая активность в жировой ткани, которая определяется функциональной активностью цАМФ-зависимых сигнальных каскадов в адипоцитах, у диабетических крыс при обработке ИВСП+ИВИ существенно повышается. Это хорошо коррелирует с более выраженным снижением удельной массы жировой ткани, восстановлением липидного обмена и снижением индекса атерогенности в группе ДСИ в сравнении с группой ДИ (табл. 1).
В миокарде различий в стимуляции активности АЦ β-агонистами между группами ДИ и ДСИ выявлено не было. Возможно, это связано с тем, что восстанавливающий эффект ИВИ был настолько значительным, что потенцирующее влияние С-пептида в этом случае уже не выявлялось. Действительно, стимулирующий эффект β3-агониста BRL-37344, повышенный при СД, в группах ДИ не отличался от такового в контроле (табл. 3). Нормализация соотношения β1/β2- и β3-сигнальных путей при обработке диабетических крыс ИВИ и ИВСП+ИВИ обусловлена мощным кардиопротекторным эффектом, вызываемым нормализацией инсулиновых путей в ЦНС, и указывают на прямую связь между этими путями и функциональным состоянием сердечно-сосудистой системы.
Таким образом, длительная обработка крыс с СД 2-го типа совместно ИВСП и ИВИ восстанавливает активность АЦСС, чувствительной к моноаминам и пептидным гормонам, в гипоталамусе, что ассоциировано с улучшением нарушенной при СД 2-го типа регуляции периферического энергетического обмена, глюкозного гомеостаза, инсулиновой чувствительности и функций сердечно-сосудистой системы. Иллюстрацией этого являются вызываемое ИВСП+ИВИ ослабление гипергликемии и ИР, улучшение показателей липидного обмена, снижение индекса атерогенности, восстановление адренергической регуляции миокарда и усиление липолитических процессов в ЭЖ, осуществляемых β-агонистами через посредство АЦСС. Полученные данные свидетельствуют о перспективности совместного применения ИВИ и ИВСП для нормализации биохимических и физиологических процессов в условиях тяжелых форм СД 2-го типа.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 18-015-00144) и частично в рамках государственного задания (рег. ЦИТИС № АААА-А18-118012290427-7).
Список литературы
Деркач К.В., Бондарева В.М., Мойсеюк И.В., Шпаков А.О. 2014а. Влияние двухмесячного лечения бромокриптином на активность аденилатциклазной сигнальной системы в миокарде и семенниках крыс с сахарным диабетом 2-го типа. Цитология. 56 (12): 907–918. (Derkach K.V., Bondareva V.M., Moiseyuk I.V., Shpakov A.O. 2015а. The effect of 2-month bromocriptine treatment on the activity of the adenylate cyclase signaling system in the myocardium and testes of rats with type 2 diabetes. Cell Tissue Biol. 9 (5): 395–405.)
Деркач К.В., Сухов И.Б., Кузнецова Л.А., Бузанаков Д.М., Шпаков А.О. 2016. Функциональная активность сигнальных систем гипоталамуса при лечении метформином крыс с неонатальным сахарным диабетом. До-кл. РАН. 467 (2): 222–225. (Derkach K.V., Sukhov I.B., Kuznetsova L.A., Buzanakov D.M., Shpakov A.O. 2016. The functional activity of hypothalamic signaling systems in rats with neonatal diabetes mellitus treated with metformin. Dokl. Biochem. Biophys. 467: 95–98.)
Деркач К.В., Чистякова О.В., Шпаков А.О. 2014б. Изменение гормональной регуляции аденилатциклазы в эпидидимальной жировой ткани крыс с экспериментальными моделями сахарного диабета. Журн. эволюц. биохим. физиол. 50 (2): 85–91. (Derkach K.V., Chistyakova O.V., Shpakov A.O. 2014b. A change of hormonal regulation of adenylyl cyclase in epididymal adipose tissue of rats with experimental models of diabetes mellitus. J. Evol. Biochem. Physiol. 50 (2): 95–102.)
Сухов И.Б., Деркач К.В., Чистякова О.В., Бондарева В.М., Шпаков А.О. 2016. Функциональное состояние гипоталамических сигнальных систем у крыс с сахарным диабетом 2-го типа, леченных интраназальным инсулином. Журн. эволюц. биохим. физиол. 52 (3): 184–194. (Sukhov I.B., Derkach K.V., Chistyakova O.V., Bondareva V.M. Shpakov A.O. 2016. Functional state of hypothalamic signaling systems in rats with type 2 diabetes mellitus treated with intranasal insulin. J. Evol. Biochem. Physiol. 52 (3): 204–216.)
Чистякова О.В., Бондарева В.М., Шипилов В.Н., Сухов И.Б., Шпаков А.О. 2011. Интраназальное введение инсулина устраняет дефицит долговременной памяти у крыс с неонатальным сахарным диабетом. Докл. РАН. 440 (2): 275–278. (Chistyakova O.V., Bondareva V.M., Shipilov V.N., Sukhov I.B., Shpakov A.O. 2011. Intranasal administration of insulin eliminates the deficit of long-term spatial memory in rats with neonatal diabetes mellitus. Dokl. Biochem. Biophys. 440: 216–218.)
Шпаков А.О. 2014. Сигнальные системы мозга, регулируемые инсулином, ИФР-1 и лептином, в условиях преддиабета и сахарного диабета 2-го типа. Цитология. 56 (11): 789–799. (Shpakov A.O. 2014. The role of alterations in the brain signaling systems regulated by insulin, IGF-1 and leptin in the transition of impaired glucose tolerance to overt type 2 diabetes mellitus. Tsitologiya. 56 (11): 789–799.)
Шпаков А.О. 2015. Новые достижения в изучении механизмов и мишеней действия С-пептида проинсулина. Цитология. 57 (6): 405–414. (Shpakov A.O. 2015. New achievements in the study of the mechanisms and targets of action of proinsulin C-peptide. Tsitologiya. 57 (6): 405–414.)
Шпаков А.О. 2017. Механизмы действия и терапевтический потенциал С-пептида проинсулина. Журн. эволюц. биохим. физиол. 53 (3): 161–169. (Shpakov A.O. 2017. Mechanisms of action and therapeutic potential of proinsulin C-peptide. J. Evol. Biochem. Physiol. 53 (3): 180–190.)
Шпаков А.О., Гранстрем О.К. 2013. С-пептид: структура, функции и молекулярные механизмы действия. Цитология. 55 (1): 16–27. (Shpakov A.O., Granstrem A.O. 2013. C-peptide structure, functions and molecular mechanisms of action. Tsitologiya. 55 (1): 16–27.)
Шпаков А.О., Деркач К.В. 2015. Гормональные системы мозга и сахарный диабет 2-го типа. СПб.: Изд-во Политехн. ун-та. 252 с. (Shpakov A.O., Derkach K.V. 2015. The brain hormonal systems and type 2 diabetes mellitus. St.Petersburg.: Polytechnic Univ. Publ. 252 p.)
Шпаков А.О., Деркач К.В., Чистякова О.В., Мойсеюк И.В., Сухов И.Б., Бондарева В.М. 2013. Влияние интраназального инсулина и серотонина на функциональную активность аденилатциклазной системы в миокарде, яичниках и матке крыс с пролонгированной неонатальной моделью сахарного диабета. Журн. эволюц. биохим. физиол. 49 (2): 118–127. (Shpakov A.O., Derkach K.V., Chistyakova O.V., Moiseyuk I.V., Sukhov I.B., Bondareva V.M. 2013. Effect of intranasal insulin and serotonin on functional activity of the adenylyl cyclase system in myocardium, ovary, and uterus of rats with prolonged neonatal model of diabetes mellitus. J. Evol. Biochem. Physiol. 49 (2): 153–164.)
Altan V.M., Arioglu E., Guner S., Ozcelikay A.T. 2007. The influence of diabetes on cardiac β-adrenoceptor subtypes. Heart Fail. Rev. 12: 58–65.
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. 2015a. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm. Metab. Res. 47: 916–924.
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. 2015b. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015: 245459.
Derkach K.V., Bondareva V.M., Shpakov A.O. 2018. Coadministration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Adv. Gerontol. 8: 139–146.
Heni M., Kullmann S., Ketterer C., Guthoff M., Linder K., Wagner R., Stingl K.T., Veit R., Staiger H., Häring H.U., Preissl H., Fritsche A. 2012. Nasal insulin changes peripheral insulin sensitivity simultaneously with altered activity in homeostatic and reward-related human brain regions. Diabetologia. 55: 1773–1782.
Kleinridders A., Ferris H.A., Cai W., Kahn C.R. 2014. Insulin action in brain regulates systemic metabolism and brain function. Diabetes. 63: 2232–2243.
Kolar G.R, Grote S.M, Yosten G.L. 2017. Targeting orphan G protein-coupled receptors for the treatment of diabetes and its complications: C-peptide and GPR146. J. Intern. Med. 281: 25–40.
Landreh M., Johansson J., Jörnvall H. 2013. C-peptide: a molecule balancing insulin states in secretion and diabetes-associated depository conditions. Horm. Metab. Res. 45: 769–773.
Novak V., Milberg W., Hao Y., Munshi M., Novak P., Galica A., Manor B., Roberson P., Craft S., Abduljalil A. 2014. Enhancement of vasoreactivity and cognition by intranasal insulin in type 2 diabetes. Diabetes Care. 37: 751–759.
Pinger C.W., Entwistle K.E., Bell T.M., Liu Y., Spence D.M. 2017. C-Peptide replacement therapy in type 1 diabetes: are we in the trough of disillusionment? Mol. Biosyst. 13: 1432–1437.
Shafqat J., Melles E., Sigmundsson K., Johansson B.L., Ekberg K., Alvelius G., Henriksson M., Johansson J., Wahren J., Jörnvall H. 2006. Proinsulin C-peptide elicits disaggregation of insulin resulting in enhanced physiological insulin effects. Cell Mol. Life Sci. 63: 1805–1811.
Shpakov A., Chistyakova O., Derkach K., Bondareva V. 2011. Hormonal signaling systems of the brain in diabetes mellitus. In: Neurodegenerative diseases (Ed. Chang R. C.-C.). Rijeka, Croatia: Intech Open Access Publ. 349–386.
Shpakov A.O., Chistyakova O.V., Derkach K.V., Moiseyuk I.V., Bondareva V.M. 2012. Intranasal insulin affects adenylyl cyclase system in rat tissues in neonatal diabetes. Central Eur. J. Biol. 7: 33–47.
Shpakov A.O., Derkach K.V. 2013. The functional state of hormone-sensitive adenylyl cyclase signaling system in diabetes mellitus. J. Signal Transduction. 2013: 594213.
Shpakov A.O., Derkach K.V., Berstein L.M. 2015. Brain signaling systems in the type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Science OA (FSO). 1 (3): FSO25.
Vasic D., Walcher D. 2012. Proinflammatory effects of C-peptide in different tissues. Int. J. Inflam. 2012: 932725.
Wahren J., Kallas A., Sima A.A. 2012. The clinical potential of C-peptide replacement in type 1 diabetes. Diabetes. 61: 761–772.
Walcher D., Marx N. 2009. C-peptide in the vessel wall. Rev. Diabet. Stud. 6: 180–186.
Yosten G.L., Kolar G.R., Redlinger L.J., Samson W.K. 2013. Evidence for an interaction between proinsulin C-peptide and GPR146. J. Endocrinol. 218: B1–B8.
Дополнительные материалы отсутствуют.


