Цитология, 2019, T. 61, № 2, стр. 119-129
Распределение некоторых функциональных молекул на Т-лимфоцитах и eстественных киллерных клетках при хроническом лимфолейкозе
Н. В. Исаева 1, *, Е. Н. Зотина 1
1 Кировский научно-исследовательский институт гематологии и переливания крови
Федерального медико-биологического агентства
610027 Киров, Россия
* E-mail: isaevanatalia@yandex.ru
Поступила в редакцию 25.06.2018
После доработки 01.11.2018
Принята к публикации 09.11.2018
Аннотация
У больных хроническим лимфолейкозом, находящихся на этапе диагностики заболевания, охарактеризованы Т-лимфоциты, их субпопуляции и естественные киллерные (ЕК) клетки по характеру распределения на них некоторых мембранных молекул межклеточного взаимодействия и сигналинга: CD45, CD3, CD4, CD8, CD16 и CD56. Использованы современные методические подходы к определению исследуемых параметров, учитывающие особенности лимфоидного пула крови пациентов с хроническим лимфолейкозом. Установлено, что популяция Т-лимфоцитов периферической крови больных характеризуется снижением содержания на поверхности рецепторов CD45 и CD3. На мембране лимфоцитов, относящихся к Т-хелперной субпопуляции, уменьшен средний уровень рецептора CD4; субпопуляция цитотоксических Т-лимфоцитов остается неизмененной по наличию рецептора CD8. Молекулы CD8 и CD16 распределены на поверхности ЕК-клеток больных хроническим лимфолейкозом на нормальном уровне, в то время как молекулы CD56 – в существенно более низком количестве. Полученные данные расширяют представления об анергии клеток иммунной системы и могут использоваться при прогнозировании течения хронического лимфолейкоза.
Хронический лимфолейкоз (ХЛЛ) – это опухолевое заболевание кроветворной ткани, которое на этапе манифестации характеризуется циркуляцией в периферической крови и наличием в костном мозге большого числа лимфоцитов, среди которых преобладают опухолевые В-лимфоциты. Механизмы патогенеза ХЛЛ интенсивно изучаются и остаются до конца не раскрытыми, поиск факторов прогноза, влияющих на течение и исход заболевания, является актуальной задачей (Волкова, 2007; Zenz et al., 2010).
По мнению ряда авторов, одной из основных причин опухолевого роста при ХЛЛ является глубокое нарушение функций иммунной системы с потерей и неэффективностью контроля над пролиферацией злокачественного клона клеток (Christopoulos et al., 2011; Зотина и др. 2012). Развитие вторичного иммунодефицита при ХЛЛ способствует возникновению инфекционных осложнений различной локализации и генеза, которые значительно отягощают течение основного заболевания и сокращают продолжительность жизни больных (Жевак и др., 2011).
Малоинформативным для оценки иммунного статуса этой категории онкогематологических пациентов является содержание иммуноглобулинов сыворотки крови в связи с известной способностью опухолевых лимфоцитов к продукции иммуноглобулинов, вызывающих патологии (Воробьев, 2007; Казанский, 2012). Абсолютное число иммунокомпетентных клеток (ИКК) – Т- и ЕК-лимфоцитов – у большинства больных ХЛЛ может находиться в пределах нормальных значений или существенно превышать таковые (Исаева и др., 2015). Поэтому общепринятые подходы к оценке состояния иммунной системы больных ХЛЛ могут оказаться неэффективными.
Результаты проведенных исследований системы иммунитета при ХЛЛ на этапе диагностики свидетельствуют о том, что иммунодефицитное состояние у больных ХЛЛ ассоциируется, вероятнее всего, с функциональной неполноценностью T- и ЕК-клеток и их подвидов, из чего делается заключение о необходимости расширенного и всестороннего научного поиска в этом направлении (Christopoulos et al., 2011; Riches et al., 2013).
К наиболее распространенным и применимым методам лабораторного подтверждения нарушений функционирования ИКК относятся определение содержания на поверхности маркеров активации, подсчет минорных популяций, оценка соотношений ИКК и оценка продукции цитокинов (Хайдуков и др., 2011). Следует отметить, что все перечисленные методы требуют специализированного дорогостоящего оборудования, реактивов и особых навыков персонала.
Обсуждая функции клеток любого типа иммунной системы, необходимо принимать во внимание в первую очередь их способность образовывать иммунные синапсы, мембранные молекулярные структуры распознавания и межклеточной сигнализации (Абакушина и др. 2012). Характер распределения функциональных молекул и их комплексов на мембране ИКК в настоящее время является важным элементом функционирования клеток иммунной системы. Известно, что отсутствие или пониженный уровень функционально значимых молекул на поверхности иммуноцитов при различных патологиях ведет к ослаблению процессов формирования иммунного синапса, передачи сигнала внутрь клетки и к снижению интенсивности иммунного ответа на чужеродный антиген. Такие отклонения могут трактоваться как признаки функциональной неполноценности ИКК (Зурочка и др., 2013).
На мембране Т-лимфоцитов и их субпопуляций в большом количестве представлены молекулы Т-клеточного рецептора (TCR). Такие маркеры как CD3, CD4, CD8, являются ключевыми участниками распознавания антигенов (Бурместер, Пецутто, 2007). Другим важным мембранным маркером Т-лимфоцитов является CD45, который проводит позитивную антиген-рецепторную сигнализацию через дефосфорилирование Src-киназ (Tchilian, Tchilian, 2006).
Естественные киллерные клетки (ЕК-клетки) относятся к компонентам врожденного иммунитета, поскольку не несут антиген-специфических рецепторов подобно тем, которые содержатся на мембране Т- и В-лимфоцитов. ЕК-клетки вносят существенный вклад в формирование противоопухолевого и противовирусного иммунитета в организме. Уникальным маркером цитотоксических ЕК-клеток является молекула CD16, ответственная за межклеточную сигнализацию. Цитокинпродуцирующие ЕК-клетки характеризуются наличием на мембране рецептора адгезии CD56 (Абакушина и др. 2012; Зурочка и др., 2013; Таширева и др. 2016). Однако в периферической крови человека существует относительно небольшая популяция ЕК-клеток, имеющих многократные цитотоксические свойства против измененного “своего”; эту популяцию характеризует наличие на мембране αα-гомодимера молекулы CD8 (Addison et al., 2005).
В экспериментальных работах подтверждено, что воздействие некоторых экзогенных и эндогенных факторов способно изменить содержание рецепторов межклеточной сигнализации на ИКК в сторону как снижения, так и повышения (Борисов и др. 2009; Артюхов и др., 2012, 2013; Путинцева и др., 2014; Блинова и др., 2017). Следует отметить, что в настоящее время практическое значение оценки содержания мембранных молекул на клетках ограничивается только областью диагностического иммунофенотипирования опухолевых заболеваний кроветворной ткани (Hallek et al., 2008; Куртова и др., 2008; Исаева и др., 2013; Худолеева, Воробьев, 2015).
Уровень различных маркеров на иммунокомпетентных клетках у больных ХЛЛ и другими лимфопролиферативными заболеваниями находится под пристальным вниманием исследователей (Riches et al., 2013; Zenz, 2013; Бадмажапова и др., 2017).
Адекватная оценка и интерпретация иммунологических показателей при ХЛЛ важна, поскольку в отношении таких пациентов может потребоваться применение иммунотерапии. Вполне очевидно, что анализ популяций, субпопуляций и подвидов Т- и ЕК-клеток станет надежным методом для их характеристики. Не исключено, что исходное функциональное состояние ИКК у больных ХЛЛ, регистрируемое уже на этапе диагностики, целесообразно учитывать при прогнозировании течения заболевания.
Цель данного исследования: провести сравнительный анализ распределения мембранных молекул межклеточного взаимодействия и сигналинга на поверхности Т-лимфоцитов, ЕК-клеток и их субпопуляций у пациентов с впервые выявленным ХЛЛ.
МАТЕРИАЛ И МЕТОДИКА
Группу наблюдения составили 130 больных ХЛЛ (69 мужчин и 61 женщина) на этапе диагностики заболевания. Возраст больных варьировал от 35 до 65 лет (медиана возраста – 58 лет). Стадию заболевания определяли по принятой классификации (Rai et al., 1975). I cтадию диагностировали у 31 пациента (23.9%), II – у 90 (69.2%), III – у 6 (4.6%), IV – у 3-х (2.3%) пациентов. Диагноз ХЛЛ верифицировали согласно общепринятым критериям (Hallek et al., 2008). Все пациенты ранее не получали никакой специфической терапии.
Одновременно с обследованием больных ХЛЛ подбирали лиц для группы сравнения, при этом использовали контингент доноров, сопоставимый с группой наблюдения по возрасту и полу. В группу сравнения вошли 30 таких доноров, допущенных к сдаче крови и ее компонентов. Перед началом исследования лицам обеих групп была предоставлена информация о планирующемся исследовании, и они дали информированное согласие на участие в нем.
У обследуемых лиц забирали венозную кровь с применением вакутейнеров с антикоагулянтом – трехзамещенной калиевой солью этилендиаминтетрауксусной кислоты. В образцах крови определяли содержание лейкоцитов, производили кратное разведение образцов раствором фосфатно-солевого буфера для достижения концентрации лейкоцитов 5 × 109 кл/л. Это было необходимо для обеспечения стандартного соотношения между эпитопами антигенов и коммерческих моноклональных антител. Затем выполняли иммунологическое связывание клеток c конъюгатами моноклональных антител, содержащих следующие флуорохромы: флуоресцеинизотиоционат (FITC), фикоэритрин (PE), перидинхлорофиллпротеинцианин 5.5 (PerCP-Cy5.5), аллофикоцианин (APC), фикоэритринцианином 7 (PE-Cy7) и аллофикоцианин 7 (APC-Cy7). Неукоснительно соблюдали рекомендуемые производителем световой и температурный режимы хранения конъюгатов моноклональных антител.
Использовали следующие комбинации моноклональных антител: СD3-FITC/CD19-PE/CD45-PerCP-Cy5.5, CD3-FITC/CD(16+56)-PE/CD45-PerCP-Cy5.5/ CD19-APC/CD4-PE-Cy7/CD8-APC-Cy7, CD16-FITC/ CD3-PE/CD45-PerCP-Cy5.5/CD56-PE-Cy7. Проводили инкубацию разбавленных образцов крови с моноклональными антителами в течение 20 мин в темноте при температуре от 20 до 24°C. По истечении времени эритроциты образца лизировали при помощи коммерческого реактива FACS Lysing Solution, содержащего фиксирующий агент, образцы отмывали фосфатно-солевым буфером.
Образцы тестировали на проточном цитофлуориметре BD FACSCantoTMII (BD Biosciences, США), оборудованном двухлазерной оптической системой (488 и 633 нм). Анализ завершали не позднее, чем через 24 ч после взятия биологического материала. Число клеток в каждом образце составляло не менее 5000. Базовую линию и проверку текущего состояния цитофлуориметра выполняли, применяя частицы Cytometer Setup & Tracking Beads Kit. Цветовые компенсации прибора настраивали по частицам CompBeads. Анализ проводили в программном модуле Diva (BD Biosciences, США).
Использовали следующие реактивы и расходные материалы: вакутейнеры (Becton Dickinson, США), конъюгаты моноклональных антител с флуорохромами для лазерной проточной цитофлуориметрии (BD Biosciences, США), реактив для лизирования эритроцитов в образцах FACS Lysing Solution (BD Biosciences, США), фосфатно-солевой буферный раствор (Биолот, Россия), частицы для настройки базовой линии прибора и проверки его текущего состояния Cytometer Setup & Tracking Beads Kit и частицы для компенсации световых сигналов CompBeads (BD Biosciences, США).
Для исследуемых мембранных молекул определяли среднее значение интенсивности флуоресценции (ось Х графика-гистограммы MnX; Куртова и др., 2008). Исходили из положения, что при использованных методах пробоподготовки и настройках прибора содержание рецепторных молекул на клетках пропорционально средней интенсивности флуоресценции (СИФ, усл. ед.). Рассчитывали относительный уровень содержания каждого рецептора на клетках у больных, принимая за 100% значения СИФ этих маркеров в группе сравнения.
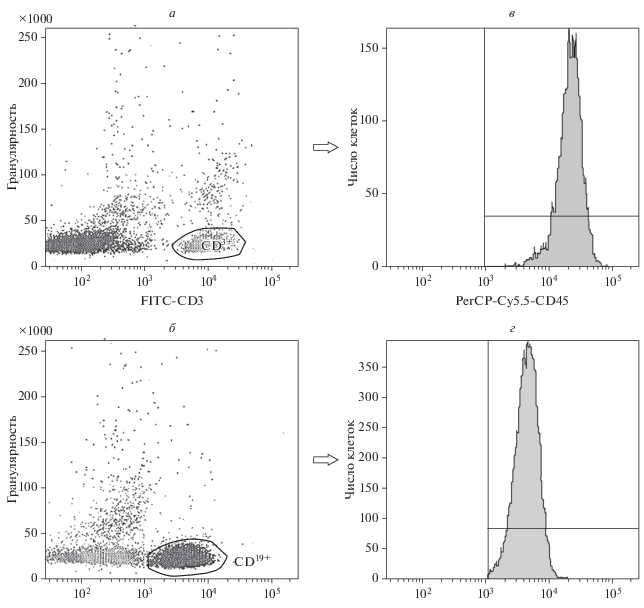
Проводили последовательное гейтирование клеточных популяций таким образом, чтобы оценить СИФ для молекулы CD45 на мембране всех лимфоцитов и прицельно – Т- и В-лимфоцитов (рис. 1). СИФ молекулы CD3 регистрировали на CD3-позитивных лимфоцитах, CD4 – в пределах популяции лимфоцитов, позитивных одновременно по CD3 и CD4. СИФ молекулы СD8 определяли на двух популяциях: CD3+CD8+ и CD3−CD8+. СИФ молекулы CD16 оценивали на CD3-негативных лимфоцитах, характеризующихся выраженной позитивностью по маркеру CD16; аналогичный показатель молекулы CD56 определяли в регионе лимфоцитов, которые были негативными по CD3 и позитивными по CD56.
Рис. 1.
Гейтирование лимфоцитов, позитивных по CD3+ (а) и CD19+ (б), при оценке содержания маркера CD45 на мембране лимфоцитов Т (в) и В (г) образца крови больного ХЛЛ. Проточная цитометрия.
Статистическую обработку полученных результатов выполняли с применением пакета программ STATISTICA 6.0. Оценка соответствия распределения количественных данных закону нормальности проводили по критерию Шапиро−Уилка. Поскольку изучаемые количественные признаки имели нормальное распределение, данные представляли в виде среднего арифметического значения и его ошибки; статистическую значимость различия оценивали по t-критерию Стьюдента. Критическим уровнем различия выборочных данных считали статистически значимыми при P < 0.05.
РЕЗУЛЬТАТЫ
Маркер CD45. При окрашивании образцов крови, взятых от лиц группы сравнения, с помощью конъюгатов моноклональных антител СD3-FITC/ CD19-PE/CD45PerCP-Cy5.5 число CD45-позитивных лимфоцитов соответствовало 99.5 ± 0.2%. В образцах больных ХЛЛ этот параметр составил 96.6 ± 0.4% (P > 0.05).
У лиц референтной группы на графиках распределения PerCP-Сy5.5 против числа клеток, отражающих наличие молекулы CD45 на мембране клеток лимфоцитарного полигона, всегда регистрировали узкий симметричный пик флуоресценции (рис. 2а); СИФ оказалась достаточно стабильным показателем. Таким образом, клетки лимфоцитарного полигона всех лиц группы сравнения характеризовались однородностью распределения рецептора CD45 на мембране.
Рис. 2.
Характер распределения маркера CD45 на лимфоцитах периферической крови в виде симметричного пика в группе сравнения (а) и у больных ХЛЛ (б–г). Проточная цитометрия.
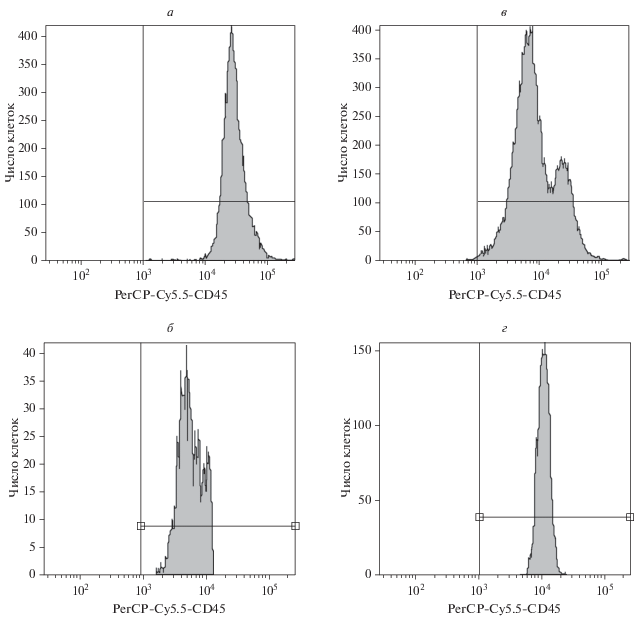
При аналогичном окрашивание образцов крови больных ХЛЛ в пределах клеток лимфоцитарного полигона наблюдали существенную вариабельность распределение маркера CD45. У 75 больных (57.7%) график флуоресценции характеризовался выраженной асимметрией (рис. 2б). У 21 больного (16.2%) на графике, отражающем распределения CD45, отчетливо визуализировались два пика флуоресценции (рис. 2в), что указывало на присутствие в лимфоцитарном полигоне двух популяций клеток, различающихся по присутствию на мембране маркера CD45. У этих больных СИФ молекулы CD45 на клетках лимфоцитарного полигона не определяли, относительную степень экспрессии не рассчитывали. Отмечено, что наиболее многочисленной была популяция лимфоидных клеток с пониженным содержанием рецептора CD45 (CD45low) на мембране, а малочисленной – с присутствием CD45 на уровне “от среднего к высокому” (CD45dim-high).
Только у 34 больных ХЛЛ (26.2%) график, характеризующий содержание рецептора CD45 в пределах лимфоцитарного полигона, имел симметричный вид (рис. 2г). Лимфоциты характеризовались существенно более низкими значениями СИФ рецептора CD45 при сопоставлении с аналогичным показателем, полученным у лиц референтной группы (16.1 ± 0.1 против 29.6 ± 0.2 усл. ед., Р < 0.001); относительный уровень содержания рецептора CD45 на лимфоцитах у этих больных ХЛЛ составил 54.4%.
На точечных графиках распределения “CD45‑Per-CP-Cy7” всей лимфоидной популяции больных ХЛЛ клетки с CD45low и с CD45dim-high в большинстве случаев не визуализировались как отдельные кластеры. При примерном их разделении и дальнейшем иммунофенотипировании установили, что на долю CD45low в образцах крови пациентов приходилась большая часть клеток, среди которых преобладали CD19-позитивные лимфоциты. Регион CD45dim-high был преимущественно представлен CD3-позитивными лимфоцитами.
Нами проведен прицельный анализ СИФ рецептора CD45 в пределах Т- и В-лифоидных популяций. При таком последовательном гейтировании лимфоцитов всех больных ХЛЛ графики, характеризующие содержание рецептора CD45 в пределах этих лимфоидных популяций, имели симметричный вид (рис. 1). Установлено, что Т-лимфоциты у больных ХЛЛ в начале заболевания имели существенно сниженную плотность экспрессии рецептора CD45 по сравнению с нормальными Т-лимфоцитами; на В-лимфоцитах интенсивность экспрессии CD45 также оказалась значимо более низкой (табл. 1).
Таблица 1.
Интенсивность экспрессии клеточных маркеров на лимфоцитах доноров и больных ХЛЛ
| Клеточный маркер | Популяция (субпопуляция) лимфоцитов (фенотип) |
Интенсивность экспрессии клеточного маркера, усл. ед. | |
|---|---|---|---|
| лица группы сравнения | больные | ||
| CD45 | Т-лимфоциты (CD3+/CD19−) | 32.5 ± 0.5 | 20.0 ± 0.2 p < 0.001 |
| CD45 | В-лимфоциты (CD3−/CD19+) | 27.0 ± 0.5 | 7.9 ± 0.3 P < 0.001 |
| CD3 | Т-лимфоциты (CD3+/CD19−) | 7.3 ± 0.1 | 5.8 ± 0.03 P < 0.05 |
| CD4 | Т-хелперы (CD3+/CD4+) | 10.2 ± 0.1 | 7.4 ± 0.02 P < 0.05 |
| СD8 | Цитотоксические Т-лимфоциты (CD3+/CD8+) | 30.8 ± 0.3 | 27.7 ± 0.1 P > 0.05 |
| ЕК-лимфоциты с многократным цитотоксическим эффектом (CD3−/CD8+) | 6.4 ± 0.1 | 5.2 ± 0.03 P > 0.05 |
|
| CD16 | Цитотоксические ЕК-клетки (CD3−CD16+ ) | 4.3 ± 0.1 | 4.6 ± 0.04 P > 0.05 |
| CD56 | Цитокинсекретирующие ЕК-клетки (CD3−CD56+) | 2.6 ± 0.04 | 1.8 ± 0.01 P < 0.001 |
Маркеры CD3 и CD4. Мы сравнили вид графиков флуоресценции, отражающих распределение молекулы CD3 на Т-лимфоцитах и молекулы CD4 в пределах региона лимфоцитов с фенотипом CD3+CD4+ у больных ХЛЛ и у лиц группы сравнения. Установлено, что изучаемые лимфоидные популяции характеризовались однородностью распределения на них маркеров CD3 и CD4, асимметричные и двухпиковые графики экспрессии этих маркеров не были зарегистрированы, что было показано как для образцов крови, полученных от больных ХЛЛ, так и от доноров. Сравнение СИФ рецепторов CD3 и CD4 у больных ХЛЛ с таковыми в референтной группе показало, что у пациентов оба эти параметра существенно снижены (рис. 3, табл. 1).
Рис. 3.
Характер распределения маркеров CD3, CD4, CD8 на Т-лимфоидных элементах у больных ХЛЛ (верхний ряд) и в группе сравнения (нижний ряд). Проточная цитометрия.
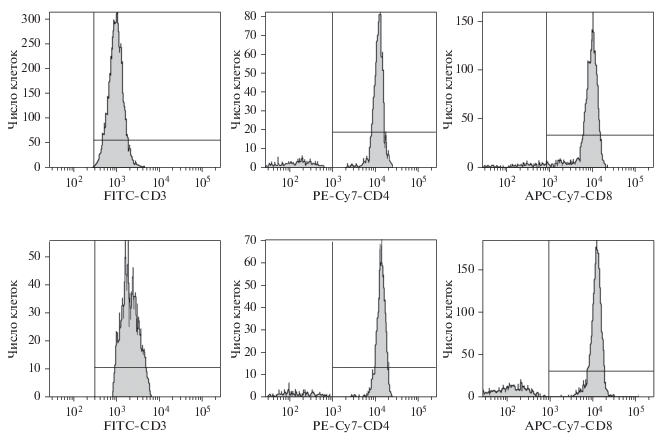
Маркер CD8. Проанализировали графики распределения рецептора CD8 в пределах Т-лимфоцитов, в результате чего было показано, что популяция Т-лимфоидных клеточных элементов крови больных и доноров является неоднородной по наличию на мембране CD8. Симметричные графики флуоресценции, отражающие распределение CD8 на лимфоцитах, были получены только при последовательном ограничении CD3-позитивной и CD3-негативной популяций и их последующем анализе. Обнаружено, что СИФ молекул CD8 на CD3-позитивных и CD3-негативных лимфоцитах у больных ХЛЛ значимо не отличался от такового в референтной группе (рис. 3, табл. 1).
Относительный уровень содержания молекул CD45, CD3, CD4 и СD8 на изучаемых Т-клеточных популяциях больных ХЛЛ составил 61.5, 79.5, 72.6 и 89.9% cоответственно.
Маркеры CD16 и CD56. Не установлено статистически значимого различия содержания рецептора CD16 на лимфоидных элементах с фенотипом CD3− CD16+ у больных ХЛЛ и лиц группы сравнения. Аналогичный параметр для рецептора CD56 в пределах лимфоидных элементов с фенотипом CD3−CD56+ у пациентов оказался более низким (табл. 1). ЕК-клетки больных характеризовались следующим относительным уровнем содержания маркеров CD8, CD16 и CD56: 81.3, 107.0 и 69.2% соответственно.
ОБСУЖДЕНИЕ
Оценка относительного числа CD45-позитивных клеток на всей популяции лимфоцитов имеет очевидную ценность, так как позволяет наиболее правильно выделять для анализа лимфоцитарный полигон (Хайдуков и др., 2011). Полученные относительные значения содержания СD45-позитивых лимфоцитов в образцах лиц группы сравнения и группы больных ХЛЛ находились в диапазоне от 95 до 100%, что свидетельствует о корректности цитометрирования, проведенного в рамках данной работы.
Выявлено понижение среднего уровня содержания рецептора CD45 на всей популяции лимфоцитов при ХЛЛ, что согласуется с ранее опубликованными данными (Селиванова и др., 2005). Результатом выполненной работы является подробный анализ гетерогенности больных ХЛЛ по распределению CD45 на лимфоцитах крови. Для оценки содержания рецептора CD45 на мембране нетрансформированных Т-лимфоцитов так же, как и опухолевых В-лимфоцитов, информативным может быть только многоцветное окрашивание с прицельным ограничением основных популяций. Необходимо отметить, что этот подход применим для всех без исключения образцов крови, взятых для исследования от больных ХЛЛ.
Рецептор CD45 является панлейкоцитарной молекулой, существующей в виде трех изоформ (CD45RO, CD45RA и CD45RB), каждая из которых присутствует на определенных типах лимфоидных ИКК. Моноклональные антитела к CD45 распознают все 3 изоформы. Молекула CD45, обладая внутриклеточной тирозинфосфатазной активностью, играет важную роль в передаче сигнала внутрь клетки. Исследования показали, что мутации в гене, кодирующем CD45, и отклонения экспрессии CD45-сплайса приводят к развитию тяжелого комбинированного иммунодефицита (Юрова и др., 2014; Tchilian, Tchilian, 2006). Выявленная недостаточность маркера CD45 на циркулирующей в крови Т-лимфоидной популяции ИКК у больных ХЛЛ, возможно, негативно отражается на функциональной активности всей этой популяции. Вполне вероятно, что перспективным направлением при ХЛЛ может оказаться изучение плотности разных изоформ рецептора CD45 на иммунокомпетентных клетках.
Более низкое содержания рецептора CD45 в пределах региона CD19-позитивных клеток крови у больных ХЛЛ уже показан нами ранее (Исаева и др., 2010). Эта особенность В-клеточного опухолевого клона при ХЛЛ в ряде случаев может служить важной характеристикой, отличающей ХЛЛ от других В-клеточных хронических лимфопролиферативных заболеваний, что необходимо учитывать при иммунофенотипической диагностике.
CD3 представляет собой мультипротеиновый комплекс на поверхности Т-лимфоцитов, являющийся основным корецептором TCR. У млекопитающих он образован 4 субъединицами: CD3γ, CD3δ и двумя CD3ε. Молекула CD3 стабилизирует весь ТCR-комплекс. Кроме того, CD3 выполняет функцию передачи основного сигнала активации, несущего информацию об антигене и усиливающегося при участии других Т-клеточных корецепторов (CD4 или CD8).
Известно, что рецепторная молекула CD3 экспрессируется с разной плотностью на поверхностной мембране субпопуляций Т-лимфоцитов. Так, среди всех лимфоцитов периферической крови цитотоксические Т-клетки имеют самый низкий уровень CD3, Т-хелперы – средний, гамма/дельта-позитивные Т-клетки – наивысший (Бурместер, Пецутто, 2007; Хайдуков и др., 2011; Зурочка и др., 2013). В более ранних наших исследованиях у больных ХЛЛ на этапе первичной диагностики заболевания показаны особенности количественного содержания субпопуляций Т-лимфоцитов, при этом существенного отклонения соотношения CD4/CD8 от такового в группе сравнения не обнаружили (Исаева и др., 2015). Учитывая эти данные, предпринятое сопоставление СИФ молекулы CD3 на Т-лимфоцитах у больных ХЛЛ в момент постановки диагноза с таковой в группе сравнения может считаться вполне допустимым.
Рецептор CD4 на мембране Т-хелперов играет важную роль в связывании молекул главного комплекса гистосовместимости (MHC) класса II. Полученные результаты, касающиеся сниженного уровня CD3 и CD4 на ИКК при ХЛЛ, совпадают со сведениями литературы. Предполагается, что эти клетки проходят неклассический путь Т-клеточного развития и являются анергичными (Dianzani еt al., 1994). Выявленные количественные характеристики рецепторного аппарата Т-хелперов согласуются также с результатами других исследований, свидетельствующих о существенном “истощении” Т-клеток при ХЛЛ (Zenz, 2013). Учитывая функциональную роль молекул CD3 и CD4 в межклеточном взаимодействии, становится понятным угнетение как клеточного, так и гуморального иммунного ответа на большинство бактериальных антигенов у пациентов с ХЛЛ.
Мембранная молекула CD8 отвечает за связывание молекул MHC класса I и представлена на лимфоцитах с выраженными цитотоксическими свойствами. Это не только лимфоциты тимического происхождения, но и популяция ЕК-клеток. ЕК-клетки содержат на своей поверхности α-цепь CD8, но с более низкой плотностью, чем цитотоксические Т-лимфоциты; цитотоксические свойства у CD8-позитивных ЕК-клеток являются более сильными, чем у CD8-негативных ЕК-клеток. Соединение CD8α-цепей в гомодимер индуцирует быстрое повышение внутриклеточного Ca2+, защищающего ЕК-клетки от апоптоза, вызываемого секрецией цитолитических ферментов. CD8-позитивные ЕК-клетки носят название “серийные убийцы”, так как сохраняют жизнеспособность и принимают участие в многократном лизисе клеток-мишеней (Addison et al., 2005; Зурочка и др., 2013).
В настоящей работе установлено, что уровень молекулы CD8 на обоих видах ИКК (Т-лимфоцитах и ЕК-клетках) у больных ХЛЛ существенно не угнетен. Полученные данные несколько расходятся с опубликованными ранее результатами о снижении плотности молекулы CD8 на Т-лимфоцитах у больных ХЛЛ (Dianzani, 1994). В то же время отсутствие нарушений со стороны корецепторных молекул Т-лимфоцитов, взаимодействующих с МНС-I, у больных ХЛЛ согласуется с результатами работ, выполненных на таких экспериментальных моделях, как клеточные культуры. Было показано, что Т-лимфоциты больных ХЛЛ способны реагировать как на собственные опухолевые клетки, так и на чужеродные, а цитотоксические Т-клетки от пациентов с ХЛЛ являются функционально неповрежденными (Krackhardt et al., 2002). В настоящее время описан опухоль-ассоциированный антиген ХЛЛ фибромодулин, который оказывает существенное стимулирующее влияние на цитотоксические опухоль-специфические лимфоциты больного и способен вызвать их экспансию (Mayr et al., 2005).
Рутинный метод оценки числа ЕК-клеток в крови включает в себя подсчет CD16- и CD56-позитивных клеток при подтверждении негативности по маркеру CD3. Для более подробной дифференцировки ЕК-клеток принято выделять их субпопопуляции: цитотоксические и цитокин-продуцирующие ЕК-клетки. CD16 представляет собой мембранный гликопротеин и является низкоаффинным рецептором для IgG (Fcγ RIIIA), связанного с опухолевой клеткой. Наличие рецептора CD16 – одна из характерных черт ЕК-клеток с цитотоксической активностью; через эту молекулу цитотоксические ЕК-клетки могут оказывать антителозависимое клеточно-опосредованное лизирование клеток-мишеней. CD56 является адгезионной молекулой, представленной на небольшой популяции ЕК-клеток, специализирующихся на синтезе интерферона-γ и других цитокинов (Абакушина и др., 2012; Таширева и др., 2016).
У больных ХЛЛ среднее содержание экспрессии рецептора CD16 на цитотоксических ЕК-клетках и CD8 на цитотоксических ЕК-клетках c многократным цитотоксическим эффектом находилось на приемлемом уровне. Нами обнаружено, что у больных ХЛЛ цитокинсекретирующие ЕК-клетки характеризуются более низким содержанием молекулы CD56. К сожалению, анализ данных параметров не представлен в доступной литературе. В то же время выявленное понижение уровня одной из функциональных молекул у цитокинсекретирующей субпопуляции ЕК-клеток у больных ХЛЛ сочетается со сведениями, указывающими на глобальное понижение способности ИКК к секреции цитокинов у этой категории онкогематологических больных (Christopoulos et al., 2011).
Учитывая в целом низкую информативность традиционных методов оценки состояния иммунной системы у больных ХЛЛ, предлагаемый подход оценки распределения функциональных молекул на мембране может оказаться применимым. Представляет интерес дальнейшее изучение показателей полноценности рецепторного аппарата Т-лимфоцитов, ЕК-клеток и их субпопуляций с точки зрения их связи с клиническими характеристиками пациентов. В совокупности с количественными нарушениями рассматриваемых иммунокомпетентных клеток содержание на этих клетках сигнальных молекул, в частности, CD45, CD3, CD4, CD8, CD16, CD56, может быть полезным в прогнозировании течения ХЛЛ и развития иммуноопосредованных осложнений.
Список литературы
Абакушина Е.В., Кузьмина Е.Г., Коваленко Е.И. 2012. Основные свойства и функции NK-клеток человека. Иммунология. 4 (33): 220–224. (Abakushina E.V., Kuzmina E.G., Kovalenko E.I. 2012. The main characteristics of human natural killer cells. Immunology. 4 (33): 220–224.)
Артюхов В.Г., Путинцева О.В., Брагина В.А. 2013. Изменение уровня экспрессии ряда поверхностных молекул лимфоцитов крови человека в условиях УФ-облучения их суспензий. Медицинская иммунология. 15 (4): 361–368. (Artyukhov V.G., Putinseva O.V., Dubova S.M., Bragina V.A. 2013. Changing expression of some molecules on the surface of human blood T-lymphocytes upon UV-irradiation of cell suspensions. Med. Immunol. 15 (4): 361–368.)
Артюхов В.Г., Путинцева О.В., Дубова С.М., Костенко С.М. 2012. Изменение уровня экспрессии CD2-рецепторов Т-лимфоцитами крови человека под действием УФ-света. Иммунология. 33 (1): 6–10. (Artyukhov V.G., Putinseva O.V., Dubova S.M., Kostenko S.M. Variations in the levels of expression of CD2-receptors by human blood T-lymphocytes under the action of UV-light. Immunology. 33 (1): 6–10.)
Бадмажапова Д.С., Гальцева И.В., Давыдова Ю.О., Капранов Н.М., Звонков Е.Е., Паровичникова Е.Н. 2017. Исследование CD80, CD86, PD-1, PD-L1, FAS и FASL на В- и Т-клетках у больных хроническим лимфолейкозом. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 4 (10): 522–523. (Badmazhapova D.S., Gal’tseva I.V., Davydova Yu.O., Kapranov N.M., Zvonkov E.E., Parovnikikova E.N. 2017. CD80, CD86, PD-1, PD-L1, FAS and FASL in B- and T-cells in patients with chronic lymphocytic leukemia. Clinical oncohematology. (Fundamental research and clinical practice). 4 (10): 522–523.)
Блинова Е.А., Пашкина Е.А., Тевс А.Е., Непомнящих В.М., Леонова М.И., Демина Д.В., Козлов В.А. 2017. Уро-вень экспрессии эрготопассоциированных маркеров Т-лимфоцитов при атопическом дерматите в условиях поликлональной активации in vitro. Цитология. 59 (6): 428–433. (Blinova E.A., Pashkina E.A., Tevs A.E. Nepomnyashchikh V.M., Leonova M.I., Demina D.V., Kozlov V.A. 2017. The expression of ergotop-associated markers on T-cells under the polyclonal activation in vitro in patients with atopic dermatitis. Tsitologyia. 59 (6): 428–433.)
Борисов В.И., Блинова Е.А., Кожевников В.С. 2009. Изменение экспрессии СD4, CD8, CD25 и CD28 маркеров на Т-лимфоцитах после поликлональной активации в динамике клеточных делений in vitro. Российский иммунологический журн. 12 (3–4): 273–279. (Borisov V.I., Blinova E.A., Кozhevnikov V.S. 2009. An expression of CD4, CD8, CD25 and CD28 T-cell antigens changing in the cell division dynamics in vitro after polyclonal activation. Russ. Immunol. J. 12 (3–4): 273–279.)
Бурместер Г.-Р., Пецутто А. 2007. Наглядная иммунология. М.: БИНОМ. 320 с. (Burmester G.-R., Petsutto A. 2007. Visual immunology. Мoscow: BINOM. 320 p.)
Волкова М.А. 2007. Клиническая онкогематология: руководство для врачей. М.: Медицина. 1120 с. (Volkova M.A. 2007. Clinical oncohematology: а guide for physicians. Мoscow: Medicine. 1120 p.)
Воробьев А.И. 2007. Руководство по гематологии. М: Ньюдиамед. 1275 с. (Vorobiev А.И. 2007. Guide to hematology. Мoscow: Nyudiamed. 1275 p.)
Жевак Т.Н., Чеснокова Н.П., Шелехова Т.В. 2011. Хронический лимфолейкоз: современные концепции этиологии, патогенеза и особенностей клинического течения (обзор). Саратовский научно-медицинский журнал. 2 (7): 377–385. (Zhevak T.N., Chesnokova N.P., Shelekhova T.V. 2011. Chronic lymphocytic leukaemia: contemporary conceptions of etiology, pathogenesis and peculiarities of clinical manifestations (review). Saratov J. Med. Sci. Res. 2 (7): 377–385.)
Зотина Е.Н., Загоскина Т.П., Малых О.В., Гришина И.В. 2012. Нарушения естественных киллерных клеток при хроническом лимфолейкозе. Фундаментальные исследования. 1–4: 57–62. (Zotina E.N., Zagoskina T.P., Malykh O.V., Grishina I.V. 2012. Impairment of natural killer cells in chronic lymphocytic leukemia. Fundamental Study. 1–4: 57–62.)
Зурочка А.В., Хайдуков С.В., Кудрявцев С.В., Черешнев В.А. 2013. Проточная цитометрия в медицине и биологии. Екатеринбург: РИО УрО РАН. 552 стр. (Zurochka A.V., Khaidukov S.V., Kudryavtsev S.V., Chereshnev V.A. 2013. Flow cytometry in medicine and biology. Ekaterinburg: RIO UrO RAN. 552 p.)
Исаева Н.В., Загоскина Т.П., Сенькина Е.А., Федоровская Н.С. 2010. Показатели экспрессии антигена CD45 лимфоидными элементами при В-клеточных лимфомах. Вестник гематологии. 2 (4): 43–45. (Isaeva N.V., Zagoskina T.P., Sen’kina E.A., Fedorovskaya N.S. 2010. Indicators of CD45 antigen expression by lymphoid elements in B-cell lymphomas. Bulletin of hematology. 2 (4): 43–45.)
Исаева Н.В., Зайцева Г.А., Докшина И.А. 2015. Характеристики иммунокомпетентных клеток у больных хроническим лимфолейкозом на этапе диагностики. Медицинская иммунология. 17 (6): 573–578. (Isaeva N.V., Zaitseva G.A., Dokshina I.A. 2015. Fearures of immunocompetent cells in the patients with chronic lymphocytic leykemia at the patients with chronic lymphocytic leukemia at primary diagnosis. Med. Immunol. 17 (6): 573–578.)
Исаева Н.В., Зайцева Г.А., Загоскина Т.П. 2013. Интерпретация результатов иммунофенотипирования. Клиническая лабораторная диагностика. 2: 30–33. (Isayeva N.V., Zaytseva G.A., Zagoskina T.P. 2013. The interpretation of results of immune phenotyping during diagnostic of lymphatic proliferanive disease accounting the immune phenotyping count. Clinical lab. diagnostics. 2 : 30–33.)
Казанский Д.Б. 2012. Т-лимфоциты в развитии хронического лимфолейкоза. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2 (5): 85–95. (Kazansky D.B. 2012. T-lymphocytes in development of chronic lymphocytic leukemia. Clinical oncohematology. Fundamental research and clinical practice. 2 (5): 85–95.)
Куртова А.В., Русанова Е.Б., Зуева Е.Е. 2008. Оценка интенсивности флюоресценции методом проточной цитометрии: методические аспекты внедрения в диагностику онкогематологических заболеваний. Клиническая онкогематология. 4 (1): 312–314. (Kurtova A.V., Rusanova Ye.B., Zueva Ye.E. 2008. Flourescence intensity assessment in flow cytometry: practical guidelines for diagnostics in oncohematology. Clinical Oncohematol. 4 (1): 312–314.)
Путинцева О.В., Артюхов В.Г., Колтаков И.А., Домнина Е.В. 2014. О роли активных форм кислорода в регуляции процессов интерферон-индуцированного изменения антигенного профиля мембран Т-лимфоцитов крови человека. Вестник Воронежского гос. университета. 4: 96–101. (Putintseva O.V., Artyukhov V.G., Koltakov I.A., Domnina E.V. About a role reactive oxygene species in interferon-dependent regulation of the antigenic profile changes of membranes in human T-lymphocytes. Bulletin Voronezh State University. 4: 96–101.)
Селиванова Е.И., Виноградова Ю.Е., Замулаева И.А., Саенко А.С. 2005. Индивидуальная вариабельность и клиническое значение плотности иммунофенотипических маркеров В клеточного хронического лимфолейкоза. Гематология и трансфузиология. 50 (3): 25–28. (Selivanova E.L., Vinogradova Yu.E., Zamulaeva I.A., Saenko A.S. 2005. Individual variability and clinical significance of the count of immunophenotypical markers on the cells of B-cell chronic lymphoid leukemia. Hematol. Transfusiol. (50) 3: 25–28.)
Таширева Л.А., Завгородская К.О., Перельмутер В.М. 2016. Роль лимфоидных клеток врожденного иммунитета в течении опухолевой болезни. Цитология. 58 (12): 901–907. (Tashireva L.A., Zavgorodskaya K.O., Perelmuter V.M. 2016. Role of innate lymphoid cells during cancer. Tsitologiya. 12 (58): 901–907.)
Хайдуков С.В., Зурочка А.В., Черешнев В.А. 2011. Цитометрический анализ в клинической иммунологии. Екатеринбург: УрО РАН. 220 с. (Khaidukov S.V., Zurochka A.V., Chereshnev V.A. 2011. Cytometric analysis of clinical immunology. Ekaterinburg: UrO RAN. 220 p.
Худолеева О.А., Воробьев И.А. 2015. Экспрессия легких цепей иммуноглобулинов в нормальных (реактивных) и опухолевых В-клетках. Цитология. 10 (57): 679–688. (Khudoleeva O.A., Vorobjev I.A. 2015. Expression of the light chains of immunoglobulins in normal B-cells and some B-cell lymphomas. Tsitologiya. 10 (57): 679–688.)
Юрова К.А., Хазиахматова О.Г., Сохоневич Н.А., Гончаров А.Г., Литвинова Л.С. 2014. Альтернативный сплайсинг молекулы CD45 в механизмах молекулярно-генетического контроля дифференцировки Т-клеток. Российский иммунол. журнал. 2 (18): 186–193. (Yurova K.A., Khaxiakhmatova O.G., Sokhonevich N.A., Goncharov A.G., Litvinova L.S. 2014. Alternative splicing CD45 in the process of differentiation of T memory cells. (Russian Immunological Journal). 2 (18): 186–193.)
Addison E.G., North J., Bakhsh I., Marden C., Haq S., Al-Sarraj S., Malayeri R., Wickremasinghe R.G., Davies J.K., Lowdell M.W. 2005. Ligation of CD8α on human natural killer cells prevents activation-induced apoptosis and enhances cytolytic activity. Immunol. 3: 354–361.
Hallek M., Cheson B.D., Catovsky D., Caligaris-Cappio F., Dighiero G., Döhner H., Hillmen P., Keating M.J., Montserrat E., Rai K.R., Kipps T.J. 2008. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on chronic lymphocytic leukemia updating the National Cancer Institute Working Group 1996 Guidelines. Blood. 111: 5446–5456.
Christopoulos P., Pfeifer D., Bartholomé K. 2011. Definition and characterization of the systemic T-cell dysregulation in untreated indolent B-cell lymphoma and very early CLL. Blood. 117: 3836–3846.
Dianzani P., Marmont F. 1994. Expans ion of T cells expressing low CD4 or CD8 levels in B-cell chronic lymphocytic leukemia: correlation with disease status and neoplastic phenotype. Blood. 83: 2198–2205.
Krackhardt A., Harig S., Witzens M., Broderick R., Barrett P., Gribben J.G. 2002. T-cell responses against chronic lymphocytic leukemia cells: implications for immunotherapy. Blood. 100: 167–173.
Mayr C., Bund D., Schlee M., Moosmann A., Kofler D.M., Hallek M., Wendtner C.-M. 2005. Fibromodulin as a novel tumor associated antigen (TAA) in chronic lymphocytic leukemia (CLL), which allows expansion of specific CD8+ autologous T-lymphocytes. Blood. 105: 1566–1573.
Rai K.R., Savitsky A., Cronkite E.P., Chanana A.D., Levy E.P., Pasternack B.S. 1975. Clinical staging of chronic lymphocytic leukemia. Blood. 46: 219–234.
Riches J.C., Davies J.K., McClanahan F., Fatah R., Iqbal S., Agrawal S., Ramsay A.G., Gribben J.G. 2013. T-cells from CLL patients exhibit features of T-cell exhaustion but retain capacity for cytokine production. Blood. 121: 1612–1621.
Tchilian E., Tchilian P. 2006. Beverley altered CD45 expression and disease. Trends in Immunol. 3: 146–153.
Zenz T. 2013. Exhausting T-cells in CLL Blood. 121: 1485–1486.
Дополнительные материалы отсутствуют.


