Цитология, 2019, T. 61, № 2, стр. 130-138
Получение и характеристика клеток из нативных тканей легких и диафрагмы крыс для рецеллюляризации тканеинженерных конструкций
Е. В. Куевда 1, *, Е. А. Губарева 1, Р. З. Накохов 1, А. А. Веревкин 1, Д. П. Пузанов 1
1 Кубанский государственный медицинский университет
350063 Краснодар, Россия
* E-mail: elenakuevda@yandex.ru
Поступила в редакцию 09.07.2018
После доработки 03.10.2018
Принята к публикации 05.10.2018
Аннотация
Выбор клеточных ресурсов для рецеллюляризации биологических каркасов и синтетических матриксов остается актуальной проблемой регенеративной медицины. Выделение стромальных клеток из нативных органов и использование их для рецеллюляризации биологических матриксов представляется перспективной альтернативой применению мезенхимных стромальных клеток. В настоящей работе модифицированы протоколы получения стромальных клеток из гомогенизированных тканей легких и диафрагмы крыс. После типирования культур и оценки жизнеспособности клеток на каркасах выполняли ортотопическую трансплантацию тканеинженерной конструкции диафрагмы крысам с гистологической характеристикой эксплантатов через 24 и 45 сут. Каркасы, рецеллюляризированные стромальными клетками из нативных тканей, при прочих равных свойствах, вызывали менее выраженную воспалительную реакцию, чем каркасы, рецеллюляризированные мезенхимными стромальными клетками (МСК), выраженность фиброза также была ниже, чем при использовании МСК для заселения каркасов.
Вопрос выбора оптимальных клеточных ресурсов для рецеллюляризации ацеллюлярных биологических и синтетических матриксов остается актуальной проблемой регенеративной медицины. Для создания ТИК и оценки свойств полученных матриксов в условиях in vitro и in vivo широко применяются МСК, способные возобновлять собственный клеточный пул и дифференцироваться в специализированные клетки тех тканей, из которых они были получены (Шахпазян и др., 2012; Marquez-Curtis et al., 2015; Qomi, Sheykhhasan, 2017). Наряду с МСК костно-мозгового происхождения все большее значение приобретают стромальные клетки жировой ткани, выделенные из стромально-васкулярной фракции и используемые для лечения заболеваний толстого кишечника, сахарного диабета, дефектов мягких тканей и костей скелета, печеночной недостаточности, алопеции, рассеянного склероза (Ullah et al., 2015).
Комплекс стволовых и прогениторных клеток жировой ткани обладает рядом преимуществ: легкостью выделения, большим количеством полученных клеток из одинакового объема использованного материала, возможностью использования клеточных фракций без стадии культивирования (Qomi, Sheykhhasan, 2017). В то же время, ни один из предлагаемых ресурсов не способен в полной мере воспроизвести клеточный состав нативных органов, имеющих сложную трехмерную структуру (Weiss et al., 2008; Matthay et al., 2010). В связи с этим ряд авторов (Hoffman et al., 2011) предложили использовать стромальные клетки, выделенные из нативных тканей легких взрослых мышей в качестве альтернативы использованию МСК, фибробластов кожи и эмбриональных клеточных линий (Hegab et al., 2010; Hoffman et al., 2011). Однако в настоящее время нет достаточной информации о характере взаимодействия мезенхимных стромальных легочных клеток с ацеллюлярными матриксами и перспективах их использования для нужд регенеративной медицины. Что касается мышечных органов, например, диафрагмы, имеются протоколы выделения и характеристики миосателлитоцитов (Redshaw et al., 2010), но также мало сведений о возможности их использования для рецеллюляризации матриксов, а информация об иных клеточных линиях, получаемых из тканей нативной диафрагмы, отсутствует вовсе.
Целью настоящего исследования явилась разработка протоколов получения и характеристики клеток, выделенных из нативной ткани легких и диафрагмы крыс, а также экспериментальная рецеллюляризация биологических каркасов диафрагмы крыс с последующим использованием полученной ТИК для ортотопических трансплантаций.
МАТЕРИАЛ И МЕТОДИКА
Исследования выполнены на базе лаборатории фундаментальных исследований в области регенеративной медицины Кубанского государственного медицинского университета (г. Краснодар) в соответствии с “Правилами проведения работ с использованием экспериментальных животных” (приказ МЗ СССР № 755 от 12.08.1972 г.) и “Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей” (Страсбург, 1986). Протокол исследования одобрен локальным этическим комитетом (протокол № 21/1). Изъятие нативных органов у 20 крыс-самцов линии Wistar для выделения культур клеток и проведения децеллюляризации выполняли после введения летальной дозы барбитуратов (150 мг/кг). Децеллюляризацию легких и диафрагмы крыс проводили по модифицированным авторским протоколам (Куевда и др., 2016; Gubareva et al., 2016).
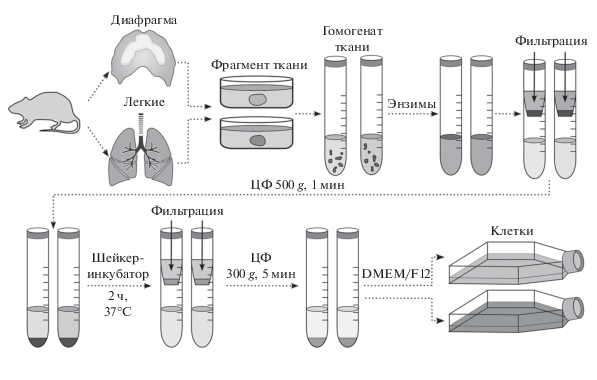
Выделение и характеристика клеток легких и диафрагмы. Нативные органы сразу после извлечения трижды промывали от крови охлажденным фосфатным солевым буфером, фрагментировали и диспергировали с использованием роторного гомогенизатора SilentCrusher S (Heidolph, Германия) в растворе Хэнкса (Thermo Fisher Scientific Inc., США) в стерильных условиях. Использовали опубликованные разработки (Redshaw et. al., 2010; Hoffman et al., 2011) в собственной модификации (увеличено время экспозиции и изменен состав ферментов). Во флакон с гомогенизированной тканью нативных легких были добавлены 2.5%-ный раствор трипсина и 150 Ед/мл коллагеназы I типа (все от Thermo Fisher Scientific Inc., США), для диспергированной ткани диафрагмы количество коллагеназы было удвоено. Полученные образцы инкубировали во флаконах в шейкере Excella E24 (New Brunswick Scientific, США) при 37°С в течение 1.5 ч при 400 об./мин. После завершения процесса клеточную взвесь фильтровали через Millex-GS с диаметром пор 0.22 мкм (Merсk, Millipore, Франция) и помещали в культуральные флаконы (рис. 1). Чистоту полученных культур оценивали при проведении иммунофенотипирования и цитохимического окрашивания на определение экспрессии поверхностных маркеров CD34, CD45, CD90, CD105 на пассажах 2–3 (клеточные ядра дополнительно окрашивали DAPI).
Рис. 1.
Схематическое изображение последовательности выделения стромальных мезенхимных клеток из тканей нативных легких и диафрагмы крыс. ЦФ – центрифугирование.
Оценку свойств полученных культур in vitro проводили путем определения способности к направленной дифференцировке в производные трех зародышевых листков с последующей качественной оценкой. Детекцию дифференцировки оценивали с помощью антител от фирмы Abcam (США). Дифференцировку в эктодермальном направлении оценивали с помощью иммуноцитохимического окрашивания на содержание βIII-тубулина с помощью кроличьих поликлональных антител в разведении 1 : 500. В качестве маркеров мезенхимной дифференцировки использовали антитела моноклональные мышиные против актина (разведение 1 : 100) и виментина (разведение 1 : 250). Экспрессию маркеров дифференцированной скелетной мышечной ткани оценивали c помощью первичных кроличьих поликлональных антител против десмина (разведение 1 : 200), тропомиозина (разведение 1 : 250) и мышиных моноклональных антител против MyoD1 (разведение 1 : 200). Эпителиальный фенотип оценивали по панцитокератину (используя мышиные моноклональные антитела в разведении 1 : 250) и цитокератину-5 (кроличьи поликлональные антитела в разведении 1 : 250). Экспрессию VEGF оценивали с помощью первичных мышиных моноклональных антител в разведении 1 : 100. Пролиферативный потенциал оценивали по цитохимическому окрашиванию на содержание Ki-67 с помощью кроличьих моноклональных антител в разведении 1 : 50. В качестве вторичных антител выбраны козьи антитела против иммуноглобулинов кролика Alexa Fluor® 488 (разведение 1 : 500) и козьи антитела против иммуноглобулинов мыши Alexa Fluor® 555 (разведение 1 : 500) с последующей детекцией флуоресценции. Клеточные ядра дополнительно визуализировали окрашиванием DAPI.
Жизнеспособность клеток в культуре и на каркасах, а также биосовместимость каркасов при рецеллюляризации in vitro оценивали при проведении колориметрических XTT-тестов после выполнения статической рецеллюляризации ацеллюлярных матриксов диафрагмы и легких (30 тыс. клеток на 100 мкл культуральной среды). Для каждого из образцов легких и диафрагмы использовали триплеты экспериментальных ячеек (биологические каркасы, рецеллюляризированные стромальными клетками из нативных легких и диафрагмы, а также биологические каркасы, рецеллюляризированные МСК) и контрольных ячеек (клетки, полученные из соответствующих нативных органов, и МСК, культивированные в стандартных условиях). Через 72 ч культивирования в каждую лунку планшета добавляли рабочий раствор ХТТ, который готовили в соответствии с рекомендациями фирмы-производителя (Cell proliferation assay XTT, AphliChem GmbH, Германия). Методика определения жизнеспособности клеток заключалась в регистрации оптической плотности, возрастающей при протекании реакции восстановления бесцветной соли тетразолия в водорастворимую оранжевую форму в присутствии НАДФ-H-зависимых клеточных оксидоредуктаз метаболически активных клеток. Регистрацию оптической плотности проводили на многофункциональном ридере FilterMax F5 (Molecular Devices, США) при длине волны 450 нм (референс 620 нм) с количественным расчетом процентной доли метаболически активных клеток на каркасе.
Ортотопические трансплантации диафрагмы крыс и оценка эксплантатов. Заселение клетками ацеллюлярных матриксов диафрагмы проводили путем нанесения 50 мкл суспензии (100 000 клеток) на поверхность образцов площадью 1.5 × 2 см2. Ортотопические трансплантации и последующие эксплантации образцов выполняли на 12 крысах-самцах Wistar под комбинированным наркозом: 2%-ный раствор ксилазина (Intervet, Нидерланды) в сочетании с золетилом 100 (Virbac, Франция) внутримышечно и 0.1%-ный раствор атропина сульфата (ООО Опытный завод “ГНЦЛС, Харьков, Украина) подкожно. В послеоперационном периоде проводили антибиотикопрофилактику 2.5%-ным раствором байтрила (ФГУ ВНИИЗЖ, Владимирская область, Россия) без иммуносупрессии. При выполнении косой паракостальной лапаротомии слева иссекали около 70% левого купола диафрагмы с замещением ТИК на основе децеллюляризированных каркасов диафрагмы, заселенных культурой клеток из ткани нативной диафрагмы (экспериментальная группа животных, n = 6) и МСК (контрольная группа, n = 6). Импланты фиксировали к перикостальной части диафрагмы непрерывными швами монофиламентной нитью из пролена (6/0), а лапаратомную рану ушивали послойно непрерывным швом такой же нитью (4/0) (Ethicon, США). Эксплантацию графтов выполняли на 24 и 45 сут после операции с последующей морфологической оценкой качества ТИК при проведении окрашивания гематоксилином и эозином, а также трихромом по Массону и по Ван Гизону. Сроки проведения эксплантации ТИК выбраны с учетом времени развития хронического воспалительного процесса (24 сут) и оценки течения отдаленного послеоперационного периода (45 сут).
Статистическую обработку результатов исследования выполняли с помощью пакета GraphPad Prism version 6.04. (www.graphpad.com). Данные представлены как среднее арифметическое и его стандартное отклонение. Вероятность возможной ошибки определяли по таблице t-критерия Стьюдента для парных сравнений. Для выборок, отличных от нормального распределения сравниваемых совокупностей, использован критерий Манна–Уитни. Достоверными признавали различия при значениях Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
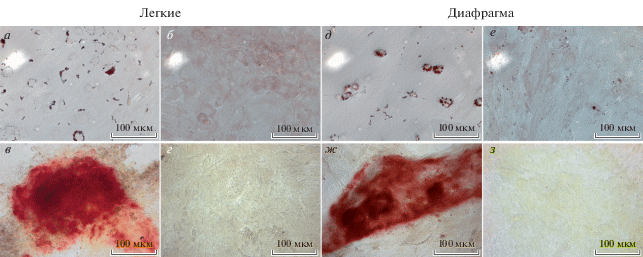
При культивировании на пластике клетки, полученные при гомогенизации тканей нативной ткани диафрагмы и легких, приобретали вытянутую фибробластоподобную форму с выраженными ламеллоподиями через 4 сут (рис. 2). Часть клеток в популяции, выделенной из гомогенизированной ткани нативных легких, в течение 7 сут культивирования сохраняла более округлую форму без выраженных цитоплазматических выпячиваний (рис. 2). Полученные данные о клеточной морфологии согласуются с работами других исследователей (Wong et al., 2009). На 10 сут культивирования обе клеточные линии образовывали монослой при 90%-ной конфлуэнтности (рис. 2). Клеточные культуры, выделенные из гомогенизированных тканей легких и диафрагмы, при индукции оказались способны к дифференцировке в адипоциты на 7 сут и в остеобласты на 21 сут (рис. 3а–3з), признаков хондрогенной дифференцировки не наблюдали в обоих случаях (данные не представлены).
Рис. 2.
Микрофотографии культур клеток через 1, 4, 7 и 14 сут после выделения. Фазово-контрастная микроскопия, увел. об.: 10×.
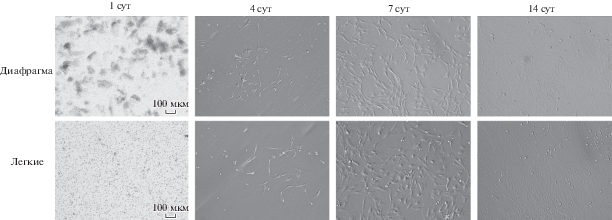
Рис. 3.
Адипогенная и остеогенная дифференцировка стромальных клеток из гомогенизированной нативной ткани легких и диафрагмы крыс. Пассаж 3. а, д – липидные включения окрашены красителем Oil Red O в красно-коричневый цвет; в, ж – кальциевые отложения, окраска ализариновым красным. Контроль спонтанной дифференцировки в адипоциты (б, е) и остеобласты (г, з). Световая микроскопия, увел. об.: 40×.
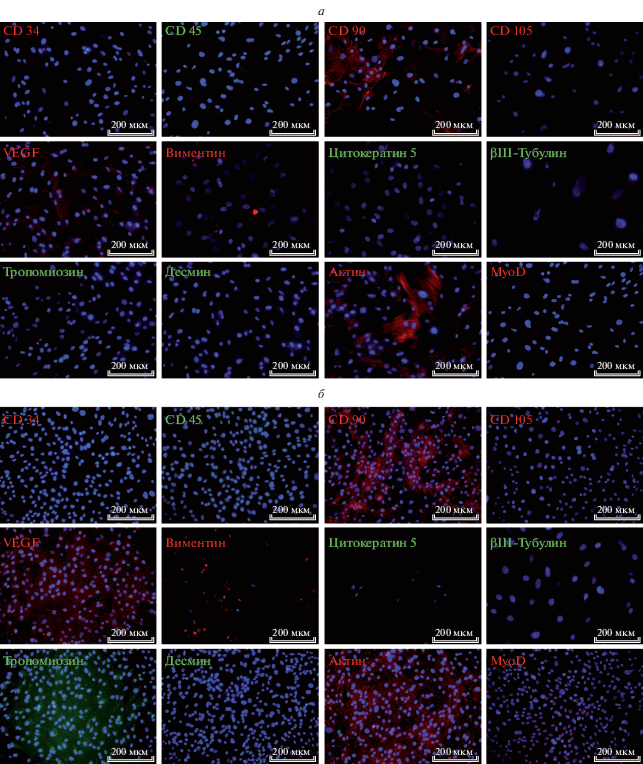
При культивировании в стандартных условиях клетки, полученные из гомогенизированной ткани нативной диафрагмы, характеризовались отсутствием экспрессии CD34 и CD105, экспрессировали CD45 (в незначительном количестве) и CD 90. Эта же клеточная линия характеризовалась положительной экспрессией гладкомышечного актина, фактора VEGF, частичной экспрессией тропомиозина, виментина и мышечного белка MyoD (рис. 4а). Клеточные культуры, выделенные из ткани нативных легких, имели фенотип CD34−, CD45±, CD90+, CD105−. При проведении цитохимических исследований МСК-подобные клетки легких экспрессировали тропомиозин, актин, виментин, VEGF и цитокератин 5 (невысокая степень экспрессии) (рис. 4б). Экспрессия пан-гемопоэтического маркера CD45± в культуре клеток, полученных при гомогенизации ткани диафрагмы крысы, может быть связана с гетерогенностью популяции и наличием пула резидентных макрофагов (Saclier et al., 2013), а в культуре клеток, выделенных при гомогенизации легких – наличием клеток, морфологически подобных клеткам Клара (Wong et al., 2009).
Рис. 4.
Экспрессия поверхностных маркеров и маркеров дифференцировки стромальных клеток, выделенных из нативной диафрагмы (а) и нативной ткани легких (б) крыс. Иммуноцитохимическое окрашивание с дополнительным окрашиванием клеточных ядер флуорофором DAPI. Видно, что клетки, полученные из гомогенизированной ткани нативной диафрагмы, имели фенотип CD34−, CD45±, CD 90+ CD105−, экспрессировали гладкомышечный актин, VEGF, частично экспрессировали тропомиозин, виментин и MyoD. Клеточные культуры, полученные при гомогенизации ткани нативных легких, имели фенотип CD34−, CD45±, CD90+, CD105−, экспрессировали тропомиозин, актин, виментин, VEGF и незначительно – цитокератин 5. Флуоресцентная микроскопия, увел. об.: 20×.
После рецеллюляризации биологических каркасов легких крысы клетками, полученными в результате гомогенизации нативных органов, жизнеспособность составила 75.91%, при рецеллюляризации каркасов культурой МСК – 21.36%. Аналогичные показатели для ацеллюлярных матриксов диафрагмы составили 57.18% при рецеллюляризации клетками из гомогенизированной диафрагмы и 32.97% при заселении каркасов МСК. Полученные данные позволяли перейти к следующему этапу исследования – рецеллюляризации ацеллюлярных матриксов для ортотопической трансплантации диафрагмы крысам.
Оперативные вмешательства с целью ортотопической имплантации рецеллюляризированных матриксов проводили только для ТИК диафрагмы ввиду невозможности получения функционирующего органа при трансплантации рецеллюляризированных легких в настоящее время и некоторой преждевременности проведения подобных операций (Balestrini, Niklason, 2015). Несмотря на значительные успехи в разработке технологий получения ацеллюлярных матриксов легких, не существует оптимальных клеточных ресурсов для рецеллюляризации полученных биологических каркасов (Tsuchiya et al., 2014; Balestrini, Niklason, 2015). Предлагаемые культуры эндотелиальных клеток, эмбриональных стволовых клеток, МСК, индуцированных плюрипотентных стволовых клеток при заселении децеллюляризированных легких не позволяют получить ТИК, функционирующую более 6 ч, даже на модели мелких лабораторных животных (Petersen et al., 2010). Наиболее рациональным решением указанной проблемы представляется отказ от бесперспективных методов рецеллюляризации легких и разработка оптимальных способов заселения ацеллюлярных матриксов, чему должен предшествовать поиск клеточных линий, в большей степени соответствующих сложной трехмерной архитектоники рецеллюляризируемого органа, чем используемые в настоящее время культуры клеток.
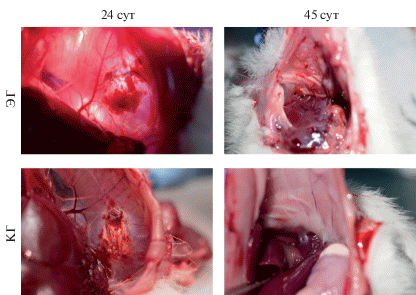
При эксплантации образцов диафрагмы в экспериментальной группе крыс через 24 сут после проведения ортотопической трансплантации отмечали выраженные фибриновые тяжи между имплантированной ТИК и диафрагмальной поверхностью печени. Область имплантации отличалась от интактной диафрагмы светло-розовым цветом, на поверхности имелись отложения фибрина; выраженного неоангиогенеза не отмечали. При эксплантации образцов контрольной группы выраженность спаечного процесса была значительно меньше, имплантированная ТИК отличалась бледным цветом от окружающих тканей, была покрыта фибриновыми напластованиями, отмечали наличие небольшого числа гиалинизированных сосудов. При эксплантации образцов экспериментальной и контрольной групп через 45 сут от момента имплантации выраженность спаечного процесса была одинакова, в обоих случаях отмечали выраженные фибриновые напластования и тяжи между диафрагмой и диафрагмальной поверхностью печени (рис. 5).
Рис. 5.
Макрофотографии эксплантатов ТИК диафрагмы крысы в экспериментальной (ЭГ) и контрольной (КГ) группах животных через 24 и 45 сут после ортотопической трансплантации. ЭГ – ацеллюлярные матриксы диафрагмы, рецеллюляризированные клетками, полученными из гомогенизированной ткани нативной диафрагмы крыс; КГ – ацеллюлярные матриксы диафрагмы, рецеллюляризированные МСК.
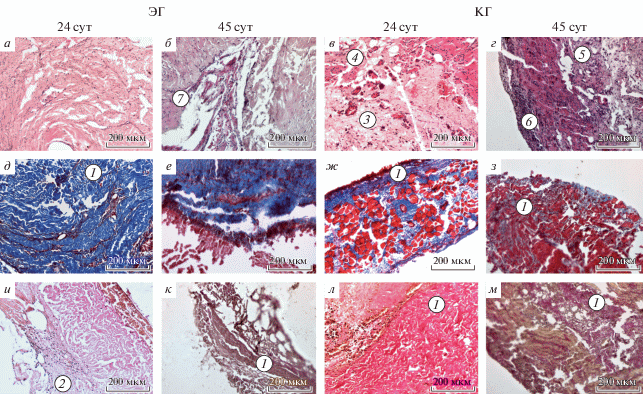
На гистологических препаратах эксплантированных образцов в экспериментальной группе на 24 сут отмечено большое количество коллагеновых волокон, гиалиноз мелких сосудов, фрагментированные миофибриллы на периферии полей зрения; клеточный компонент представлен слабо (рис. 6а, 6д, 6и). В контрольной группе на 24 сут наблюдали мелкие очаги склероза, умеренное количество соединительнотканных волокон, очаговую лимфомакрофагальную инфильтрацию (рис. 6в, 6ж, 6л). На 45 сут в контрольной группе регистрировали очаги вакуольного повреждения клеток, диффузную лимфомакрофагальную инфильтрацию, малое количество коллагеновых волокон (рис. 6б, 6г, 6е, 6з, 6к, 6м). Дегенеративные изменения в экспериментальной группе были менее выражены: единичные макрофаги и лимфоциты, большое количество коллагеновых волокон, плотное сращение с капсулой печени. В целом, течение воспалительного процесса было типичным в обеих группах и, с большой долей вероятности, обуславливалось влиянием поврежденных процессом децеллюляризации компонентов внеклеточного матрикса и неизбежно возникающей деградацией каркаса.
Рис. 6.
Микрофотографии ТИК диафрагмы экспериментальной (ЭГ) и контрольной (КГ) групп животных через 24 и 45 сут после ортотопической трансплантации. Окраска гематоксилином и эозином (а–г), трихромом по Массону (д–з) и по Ван Гизону (и–м). Световая микроскопия, увел. об.: 20×. ЭГ – Ацеллюлярные матриксы диафрагмы, рецеллюляризированные клетками, полученными из гомогенизированной ткани нативной диафрагмы крыс; КГ – ацеллюлярные матриксы диафрагмы, рецеллюляризированные МСК. 1 – Соединительнотканные волокна; 2 – фрагментированные миофибриллы; 3 – очаги склероза; 4 – очаговая лимфомакрофагальная инфильтрация; 5 – очаги вакуольного повреждения клеток; 6 – диффузная лимфомакрофагальная инфильтрация; 7 – единичные макрофаги и лимфоциты.
Таким образом, в результате сравнительного анализа клеточных ресурсов, привлеченных для заселения биологических каркасов нативной диафрагмы крыс, воспалительные изменения при использовании клеток, полученных при гомогенизации нативной ткани диафрагмы, были выражены в меньшей степени, чем при использовании МСК для рецеллюляризации каркасов. Для каркасов, рецеллюляризированных клетками, полученными при гомогенизации ткани нативной диафрагмы, были менее характерны дегенеративные и фибротические изменения, по сравнению с каркасами, заселенными МСК. Жизнеспособность стромальных клеток из нативных тканей на каркасах статистически выше (P ≤ 0.05), чем при рецеллюляризации МСК. Использование клеточной культуры, полученной в результате гомогенизации нативных тканей, является перспективным для создания ТИК с целью профилактики воспалительных изменений имплантируемых каркасов и последующего замещения их соединительной тканью. Эти клетки представляют собой промежуточное звено между дифференцированными клеточными культурами, рецеллюляризация которыми неэффективна, и МСК, применение которых может способствовать развитию более выраженных соединительнотканных изменений каркасов. В то же время не стоит исключать возможность использования сокультуры МСК и стромальных клеток из нативных тканей для улучшения функциональных свойств ТИК.
Авторский коллектив выражает благодарность И.С. Гуменюку (Кубанский государственный медицинский университет, г. Краснодар) за помощь в подготовке иллюстративного материала статьи.
Работа выполнена при поддержке комплексной НИР (“Клеточные механизмы регенерации интраторакальных органов и тканей. Разработка тканеинженерных конструкций с использованием биологических и синтетических каркасов”) и госзадания Минздрава РФ (от 28.01.2015 г. ч. 1, раздел 1).
Список литературы
Куевда Е.В., Губарева Е.А., Сотниченко А.С., Гуменюк И.С., Гилевич И.В., Поляков И.С., Порханов В.А., Алексеенко С.Н., Маккиарини П. 2016. Опыт перфузионной рецеллюляризации биологического каркаса легких крысы. Вестник трансплантологии и искусственных органов. 18: 38–44. (Kuevda E.V., Gubareva E.A., Sotnichenko A.S., Gumenyuk I.S., Gilevich I.V., Polyakov I.S., Porhanov V.A., Alekseenko S.N., Macchiarini P. 2016. Experience of perfusion recellularization of biological lung scaffold in rats. Russ. J. Transplantol. Art. Organs. 18 (1): 38–44.)
Шахпазян Н.К., Астрелина Т.А., Яковлева М.В. 2012. Мезенхимальные стволовые клетки из различных тканей человека: биологические свойства качества и безопасности для клинического применения. Клеточная трансплантология и тканевая инженерия. 7 (1): 23–33. (Shachpazyan N.R., Astrelina T.A., Yakovleva M.V. 2012. Mesenchymal stem cells from various human tissues: biological properties, assessment of quality and safety for clinical use. Cell. Transplanta. Tiss. Eng. 7 (1): 23–33).
Balestrini J.L., Niklason L.E. 2015. Extracellular matrix as a driver for lung regeneration. Ann. Biomed. Eng. 43: 568–576.
Gubareva E.A., Sjöqvist S., Gilevich I.V. Sotnichenko A.S., Kuevda E.V., Lim M.L., Feliu N., Lemon G., Danilenko K.A., Nakokhov R.Z., Gumenyuk I.S., Grigoriev T.E., Krasheninnikov S.V., Pokhotko A.G., Basov A.A., Dzhimak S.S., Gustafsson Y., Bautista G., Rodríguez A.B., Pokrovsky V.M., Jungebluth P., Chvalun S.N., Holterman M.J., Taylor D.A., Macchiarini P. 2016. Orthotopic transplantation of a tissue engineered diaphragm in rats. Biomaterials. 77: 320–335.
Hegab A.E., Kubo H., Fujino N., Suzuki T., He M., Kato H., Yamaya M. 2010. Isolation and characterization of murine multipotent lung stem cells. Stem Cells Dev. 19: 523–536.
Hoffman A.M., Paxson J.A., Mazan M.R., Davis A.M., Tyagi S., Murthy S., Ingenito E.P. 2011. Lung-derived mesenchymal stromal cell post-transplantation survival, persistence, paracrine expression, and repair of elastase-injured lung. Stem cells and development. 20: 1779–1792.
Marquez-Curtis L.A., Janowska-Wieczorek A., McGann L.E., Elliott J.A. 2015. Mesenchymal stromal cells derived from various tissues: Biological, clinical and cryopreservation aspects. Cryobiology. 71: 181–197.
Matthay M.A., Goolaerts A., Howard J.P., Lee J.W. 2010. Mesenchymal stem cells for acute lung injury: preclinical evidence. Crit. Care Med. 38: 569–573.
Petersen T.H., Calle E.A., Zhao L., Lee E.J., Gui L., Raredon M.B., Gavrilov K., Yi T., Zhuang Z.W., Breuer C., Herzog E, Niklason L.E. 2010. Tissue-engineered lungs for in vivo implantation. Science. 329: 538–541.
Qomi R.T., Sheykhhasan M. 2017. Adipose-derived stromal cell in regenerative medicine: A review. World J. Stem Cells. 9: 107–117.
Redshaw Z., McOrist S., Loughna P. 2010. Muscle origin of porcine satellite cells affects in vitro differentiation potential. Cell Biochem. Funct. 28: 403–411.
Saclier M., Cuvellier S., Magnan M., Mounier R., Chazaud B. 2013. Monocyte/macrophage interactions with myogenic precursor cells during skeletal muscle regeneration. FEBS J. 280: 4118–4130.
Tsuchiya T., Sivarapatna A., Rocco K., Nanashima A., Nagayasu T., Niklason.L.E. 2014. Future prospects for tissue engineered lung transplantation. Decellularization and recellularization-based whole lung regeneration. Organogenesis. 10: 196–207.
Ullah I., Subbarao R.B., Rho G.J. 2015. Human mesenchymal stem cells – current trends and future prospective. Biosci. Rep. 35: 1–19.
Weiss D.J., Kolls J.K., Ortiz L.A., Panoskaltsis-Mortari A., Prockop D.J. 2008. Stem cells and cell therapies in lung biology and lung diseases. Proc. Am. Thorac. Soc. 5: 637–667.
Wong A.P., Keating A., Lu W.-Y., Duchesneau P., Wang X., Sacher A., Hu J., Waddell Th.K. 2009. Identification of a bone marrow–derived epithelial-like population capable of repopulating injured mouse airway epithelium. J. Clin. Invest. 119: 336–348.
Дополнительные материалы отсутствуют.


