Цитология, 2019, T. 61, № 2, стр. 106-118
ЭЛИМИНАЦИЯ МИКРОЯДЕР В КЛЕТКАХ КУЛЬТУРЫ АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА MCF-7
О. И. Сутягина 1, *, О. П. Кисурина-Евгеньева 1, Г. Е. Онищенко 1
1 Кафедра клеточной биологии и гистологии, биологический факультет, Московский государственный университет
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: oksanasutyagina@yandex.ru
Поступила в редакцию 08.10.2018
После доработки 29.10.2018
Принята к публикации 31.10.2018
Аннотация
В последнее время в литературе появляются данные о возможности элиминации клеткой отдельных микроядер. Индукция образования микроядер посредством воздействия антитубулиновых агентов широко используется в противоопухолевой терапии, и элиминация микроядер предположительно может приводить к выживанию опухолевых клеток при терапии. Пути и механизмы элиминации микроядер в настоящее время изучены недостаточно. В связи с этим изучение особенностей элиминации микроядер имеет как фундаментальное, так и потенциальное прикладное значение. В представленной работе показано присутствие в клетках культуры MCF-7 (аденокарцинома молочной железы человека, р53+) как в контроле, так и при воздействии паклитаксела, двух субпопуляций микроядер: одиночных мелких и множественных крупных, предположительно имеющих различные пути формирования. Показана возможность элиминации микроядер с участием лизосомного компартмента (для мелких микроядер). Установлено, что элиминация микроядра – редкое явление, основная часть микроядер сохраняется, однако для них могут быть характерны морфологические дефекты. Описаны дефекты оболочки микроядра: отсутствие пристеночного гетерохроматина, разрывы оболочки, набухание перинуклеарного пространства, полное или частичное отсутствие ядерной ламины. Показано наличие среди микроядер р53-отрицательных, установлено, что отсутствие активации белка р53 характерно преимущественно для мелких одиночных микроядер. Полученные данные позволяют заключить, что элиминация микроядер существенного воздействия на результаты терапии оказывать не может. Однако существует опасность продвижения микроядерных клеток по клеточному циклу, наибольшую угрозу представляют клетки с одиночными мелкими микроядрами.
Микроядра представляют собой небольшие ДНК-содержащие структуры, лежащие отдельно от основного ядра клетки. Микроядра образуются в ответ на разнообразные воздействия, приводящие к повреждению генома, их наличие в клетках служит маркером генотоксического стресса и генетической нестабильности (Fenech et al., 2011). Микроядра могут возникать в клетках различными путями: в интерфазе путем ядерного блеббинга (Shimizu et al., 2000; Utani et al., 2011) и в процессе митотического деления клетки при нарушении сегрегации хромосом (Fenech et al., 2011), в том числе через стадию анафазного моста (Hoffelder et al., 2004). В зависимости от способа образования в состав микроядер могут входить как целые хромосомы (Catalán et al., 2000), так и хромосомные фрагменты (O’Donovan et al., 2010). Возможно также формирование микроядер на основе участков поврежденной ДНК (Asare et al., 2012), амплифицированных генов (Shimizu et al., 2000; Huang et al., 2012).
Наличие микроядер в нормальных и р53-положительных опухолевых клетках вызывает р53-опосредованную остановку клеточного цикла и включение программы апоптотической гибели (Чумаков, 2007). Однако опухолевые клетки часто содержат мутации гена р53 и избегают апоптоза (Kopnin, 2000), что приводит к повышению генетической нестабильности. Для клетки, уклонившейся от апоптотической гибели, возможно ре-инкорпорирование генетического материала микроядра в основное ядро клетки в ходе последующего митотического деления (Crasta et al., 2012), сохранение микроядра в цитоплазме в качестве экстраядерного объекта, со случайным распределением генетического материала микроядер между дочерними клетками при делении (Rao et al., 2008). Кроме того, в последнее время в литературе появляются данные о возможности элиминации отдельных микроядер в опухолевых клетках. Среди описываемых в литературе путей элиминации микроядер: коллапс оболочки микроядра с последующей деструкцией ДНК (Hatch et al., 2013), фрагментация и деградация микроядерной ДНК при сохранении интактной оболочки микроядра (Gernand et al., 2005; Terradas et al., 2016), удаление путем прямой экструзии за счет блеббинга (Baptista-Giacomelli et al., 2000; Shimizu et al., 2000; Sagona et al., 2014), аутофагическая деградация (Erenpreisa et al., 2012; Rello-Varona et al., 2012; Sagona et al., 2014). Удаление микроядра предположительно может помочь клетке избежать р53-опосредованной гибели и стимулировать опухолевую прогрессию. Возможность элиминации микроядер на настоящий момент показана для ограниченного числа клеточных линий. При этом механизмы элиминации экспериментально не рассматриваются, предлагаемые теоретические модели в ряде случаев вступают в противоречие (Asare et al., 2012; Кисурина-Евгеньева и др., 2016).
В настоящей работе представлены данные о способах элиминации микроядер в клетках культуры MCF-7 (клетки аденокарциномы молочной железы человека, р53+), полученные с использованием методов световой, флуоресцентной, электронной микроскопии, рассматривается связь процессов элиминации микроядер с апоптотической гибелью клеток и активностью белка р53.
МАТЕРИАЛ И МЕТОДИКА
Культура клеток и постановка эксперимента. Клетки культуры MCF-7 (аденокарцинома молочной железы человека) (Коллекция клеточных культур Института цитологии РАН, Санкт-Петербург, Россия) выращивали на среде DMEM (Панэко, Россия) с добавлением 10% фетальной сыворотки теленка (PAA Laboratories, Австрия), 40 мкг/мл глютамина (Панеко, Россия) и 40 мкг/мл гентамицина (Панеко, Россия) при температуре 37°С и концентрации СО2 5%. Посадку клеток производили за 3 сут до проведения экспериментов.
Для стимуляции образования микроядер клетки подвергали воздействию паклитаксела (125 нМ, Sigma, США) в течение 48 ч с последующим удалением агента и культивированием в течение 24 ч на чистой среде. Для блокирования апоптотического пути гибели клеток использовали панкаспазный ингибитор ZVAD-fmk (20 нМ) (Sigma, США). Добавление ZVAD-fmk производили после удаления паклитаксела, воздействие продолжалось в течение 24 ч.
Световая микроскопия. Метод световой микроскопии использовали для определения эффективности используемых экспериментальных воздействий и получения данных для статистической обработки. Клетки фиксировали 96%-ным этиловым спиртом при температуре –20°С в течение 30 мин. Препараты окрашивали гематоксилином и эозином по стандартной методике и изучали с помощью светового микроскопа LEYKA DM 1000.
Цитохимия и иммуноцитохимия. Клетки фиксировали 4%-ным формалином на PBS (Панэко, Россия) в течение 30 мин. После фиксации препараты обрабатывали раствором пермеабилизирующего агента Triton X-100 (Sigma, США) на PBS (Панэко, Россия) (0.5%, 5 мин) и окрашивали следующими антителами: моноклональные мышиные антитела к белку р53 (Sigma, США), разведение 1 : 200; моноклональные кроличьи антитела к ламину A и ламину В1 (Abcam, UK), разведение 1 : 200. В качестве вторых антител использовали антитела к иммуноглобулинам мыши, конъюгированные с Alexa 488 (Invitrogen, США), разведение 1 : 800 и антитела к иммуноглобулинам кролика, конъюгированные с Alexa 568 (Invitrogen, США), разведение 1 : 800. Инкубацию с антителами осуществляли при комнатной температуре, время инкубации составляло 1 ч для первых антител и 45 мин для вторых антител. Для предотвращения неспецифического окрашивания осуществляли инкубацию с 3%-ным раствором бычьего сывороточного альбумина на PBS 30 мин при комнатной температуре. После завершения иммуноцитохимического окрашивания препараты окрашивали ядерным красителем DAPI (0.1 мкг/мл, 15 мин) для визуализации ДНК-содержащих структур.
Для выявления везикул кислого компартмента проводили прижизненное окрашивание клеток Lys-oTracer® Red DND-99 (LifeTechnology, США) (300 нМ) в течение 30 мин с последующей фиксацией 4%-ным раствором формалина на PBS и докрашиванием ядерным красителем Hoechst 33 142 (5 мг/мл, 15 мин) (Sigma, США).
Препараты исследовали на флуоресцентном микроскопе Axiovert 200М (объектив PlanApochromat 63×/1.4 oil Ph3, камера AxioСаm HR ч/б).
Электронная микроскопия. Клетки фиксировали 2.5%-ным глутаровым альдегидом (Sigma, США) на PBS (Панэко, Россия) в течении 30 мин. Далее производили отмывку фиксатора PBS в течение 20 мин и осмирование 1%-ным раствором OsO4 (TedPella, США) в течение 30 мин в темноте. Затем препараты обезвоживали по стандартной методике и заключали в эпон 828 (Sigma, США). Изготовление ультратонких срезов производили сотрудники межфакультетской лаборатории электронной микроскопии МГУ. Ультратонкие срезы контрастировали раствором уранилацетата (20 мин в темноте) и цитратом свинца по Рейнольдсу (5 мин в темноте). Ультраструктурный анализ проводили с помощью трансмиссионной микроскопии (трансмиссионный электронный микроскоп JEM-1011). Всего исследовано 96 клеток, из них 59 микроядерных.
Морфометрический анализ. Измерение площадей микроядер производили с помощью программы “Vision Bio” (“West Medica”, Россия).
Статистический анализ. Определяли: апоптотический индекс, микроядерный индекс (отношение клеток с микроядрами к общему числу рассмотренных клеток), отношение клеток с вакуолизированными микроядрами к общему числу клеток. Показатели рассчитывали на 1000 клеток, выполнено 3 повторности. Достоверность результатов оценивали с использованием критерия Манна–Уитни. Рассмотрено распределение площадей микроядер разных групп (измерены площади 304 микроядер), результат представлен в виде графика эмипирической плотности распределения, интервал разбиения определен по формуле Стерджеса. Статистическую обработку данных проводили с использованием программы Microsoft Excel 2010.
РЕЗУЛЬТАТЫ
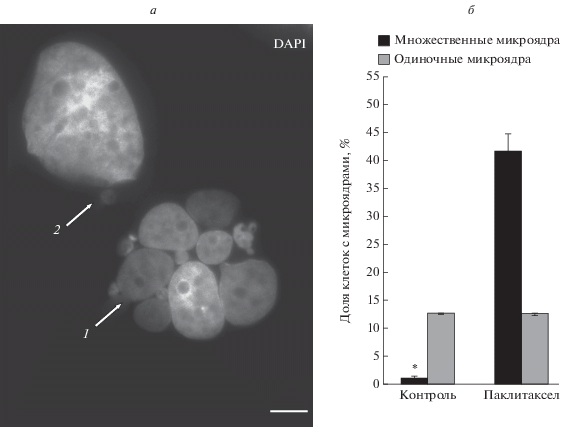
Анализ морфологических особенностей микроядер в клетках культуры MCF-7. В клетках культуры MCF-7, как в контроле, так и после воздействия паклитаксела, наблюдается две группы микроядер: крупные множественные (средний размер 40 ± 5 мкм2) и одиночные мелкие (0.3 ± 0.05 мкм2) (рис. 1а). Доля клеток с крупными множественными микроядрами составляет 1.2 ± 0.4% в контроле и возрастает до 41.7 ± 3.1% при воздействии паклитаксела. Доля клеток с одиночными мелкими микроядрами составляет 12.7 ± 0.06% в контроле и не изменяется при воздействии паклитаксела: 12.7 ± 0.1% (рис. 1, б).
Рис. 1.
Два типа микроядер в клетках культуры MCF-7. а – флуоресцентная микроскопия, окрашивание ядер DAPI, масштабный отрезок – 10 мкм; крупные множественные микроядра (стрелка 1) и одиночное мелкое микроядро (стрелка 2); б – доля крупных множественных и одиночных мелких микроядер в клетках культуры MCF-7 в контроле и при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. * ‒ Различия между группами достоверны для Р < 0.01.
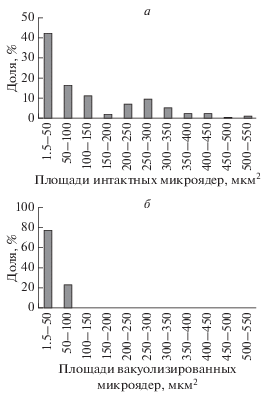
Вакуолизированные микроядра. Среди крупных множественных микроядер в клетках MCF-7 присутствует группа морфологически измененных: “вакуолизированных” микроядер (рис. 2). Описание подобного способа деградации микроядер в литературе не встречается, механизм процесса неизвестен. Вакуолизированные микроядра выявляются как при воздействии паклитаксела, так и в контроле. Доля клеток с вакуолизированными микроядрами (среди всех клеток с микроядрами) составляет 14 ± 1.8%. Морфометрический анализ площадей вакуолизированных и невакуолизированных микроядер показал, что тенденцию к вакуолизации проявляют более мелкие микроядра (рис. 3). Так, площади вакуолизированных микроядер не превышают 100 мкм2 (от 1.5 до 100 мкм2, преобладают значения от 1.5 до 40 мкм2), в то время как площади невакуолизированных микроядер распределены в интервале от 1.5 до 550 мкм2.
Рис. 2.
Вакуолизированное микроядро (стрелка) в клетке культуры MCF-7. МЯ – микроядро, Я – основное клеточное ядро. Фазово-контрастная микроскопия, масштабный отрезок – 10 мкм.
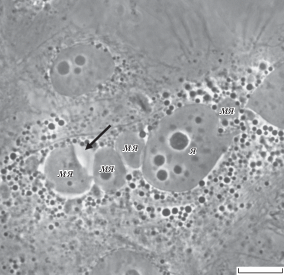
Рис. 3.
Распределение площадей интактных (а) и вакуолизированных (б) микроядер в клетках культуры MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. Данные представлены в виде графика эмпирической плотности распределения.
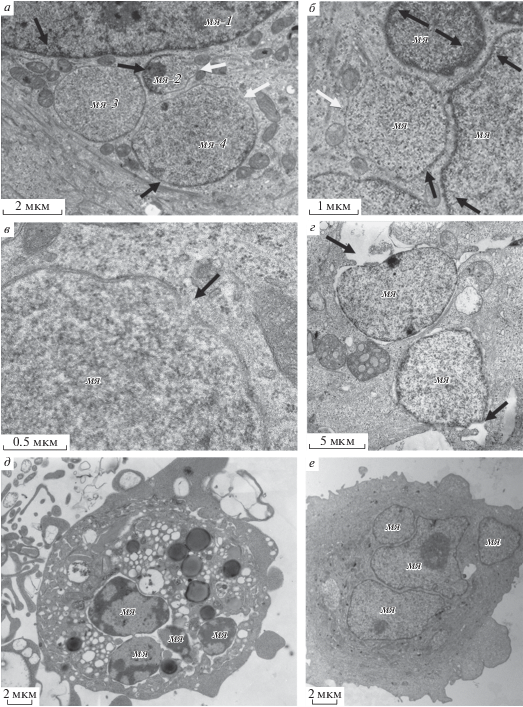
Структурные дефекты микроядер. Ультраструктурный анализ показал, что в микроядерной клетке могут присутствовать как микроядра, имеющие нормальную морфологию, сходную с морфологией основного ядра (рис. 4а, мя-1), так и микроядра, имеющие ряд дефектов (рис. 4, а, мя-2, мя-3, мя-4). Одним из наиболее часто встречающихся нарушений является отсутствие пристеночного гетерохроматина на значительном протяжении ядерной оболочки (рис. 4а, 4б). Встречаются также микроядра, имеющие разрывы ядерной оболочки, как единичные, так и множественные. Разрывы наблюдаются на участках микроядер, лишенных пристеночного гетерохроматина (рис. 4в). Кроме того, в микроядрах в ряде случаев обнаруживается набухание перинуклеарного пространства (рис. 4г). Наблюдаемые структурные дефекты отличаются от ультраструктурных изменений ядра, наблюдаемых при индукции апоптоза и выражающихся в неравномерной конденсации хроматина по всему объему ядра с последующей фрагментацией. Кроме того, в большинстве микроядерных клеток не наблюдается перехода митохондрий в конденсированное состояние, деградации органелл, блеббинга плазматической мембраны, характерных для апоптотической клетки (рис. 4д, 4е).
Рис. 4.
Структурные дефекты в микроядрах клеток MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. а – микроядро, имеющее нормальную морфологию, сходную с морфологией основного ядра (МЯ-1) и микроядра, имеющие ряд дефектов (МЯ-2, МЯ-3, МЯ-4); черными стрелками отмечены участки с выраженным пристеночным гетерохроматином, белыми стрелками – участки, на которых отсутствует пристеночный гетерохроматин; б – микроядро с участком, лишенным пристеночного гетерохроматина (белая стрелка), участки выраженного пристеночного гетерохроматина указаны черными стрелками; в – разрыв микроядерной оболочки (отмечен стрелкой); г – набухание перинуклеарного пространства; д – апоптотическая клетка с микроядрами; е – неапоптотическая клетка с микроядрами. МЯ – микроядро. Трансмиссионная электронная микроскопия. Масштабные отрезки: а – 2 мкм, б – 1 мкм, в – 0.5 мкм, г – 5 мкм, д, е – 2 мкм.
Дефекты ламины в ядерной оболочке микроядер. Иммуноцитохимическое окрашивание ядерной ламины показало, что в контроле популяция микроядер является гетерогенной по строению ядерной оболочки. Встречаются микроядра, ядерная оболочка которых содержит ламины А и В1 по всему периметру. Однако ряд микроядер характеризуется полным отсутствием ядерной ламины (рис. 5), выявлены как ламин А-отрицательные, так и ламин В1-отрицательные микроядра. После воздействия паклитаксела также встречаются микроядра со всеми перечисленными вариантами строения ядерной оболочки.
Рис. 5.
Ламин В1-отрицательные микроядра (стрелки) в клетках культуры MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. а–б – ламин В1-отрицательное микроядро из группы одиночных мелких микроядер; в–г – ламин В1-отрицательное микроядро из группы крупных множественных микроядер. Окрашивание ядер DAPI (а, в), иммуноцитохимическое окрашивание ламина В1 (б, г). Флуоресцентная микроскопия; масштабный отрезок – 10 мкм.
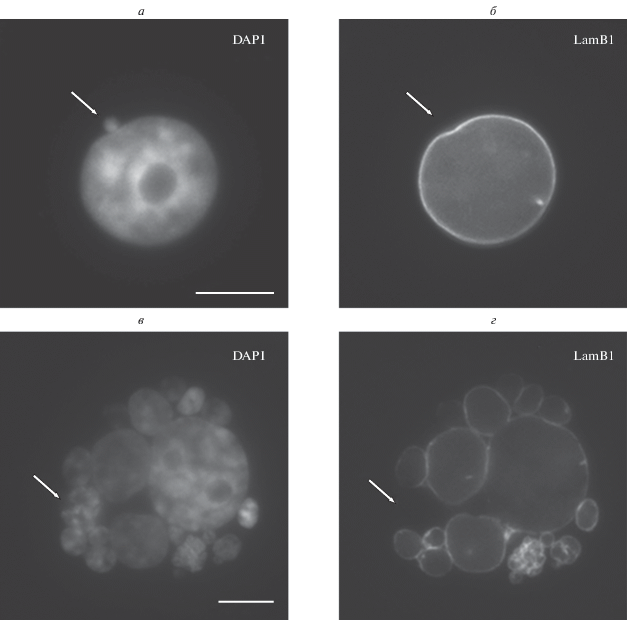
Определение частоты встречаемости ламин-отрицательных микроядер произведено на основе рассмотрения локализации ламина В1. Среди одиночных мелких микроядер ламин В1-отрицательные встречаются достаточно часто: 27.1% (55 микроядер из 203) и выявляются как в контроле, так и при воздействии паклитаксела. Большинство крупных множественных микроядер являются ламин В1-позитивными; доля ламин В1-отрицательных микроядер среди них невелика: 1.4% (3 микроядра из 219). Среди крупных множественных микроядер зафиксированы также микроядра, лишенные ламины лишь на определенном участке – 3.7% (8 микроядер из 218).
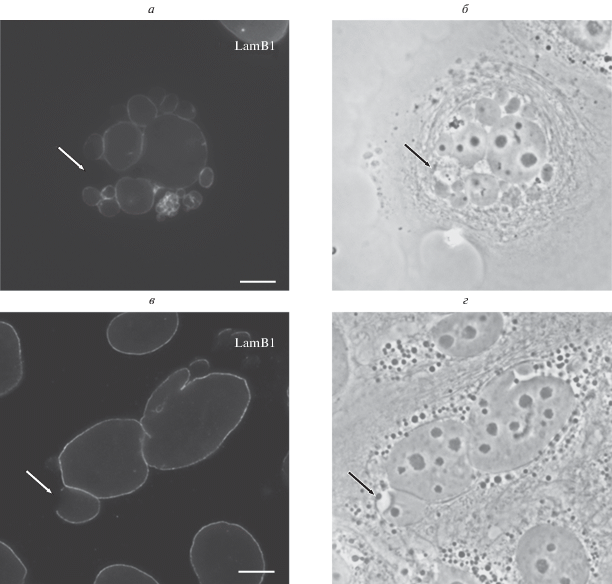
Отсутствие ламины часто сопряжено с наличием морфологических дефектов. Микроядра, лишенные ламины, при сохранении округлой формы содержат неравномерно конденсированный хроматин. Микроядра, содержащие нормально конденсированный хроматин, имеют нормальную ламину (рис. 6а–6б). Отсутствие ламины на отдельном участке может сочетаться с вакуолизированным состоянием микроядра (рис. 6в–6г).
Рис. 6.
Корреляция отсутствия ламины с морфологическими дефектами микроядер. Клетки культуры MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента: а, б – корреляция отсутствия ламины на отдельном участке оболочки микроядра с вакуолизацией микроядра; в, г – неравномерная конденсация хроматина в микроядре, лишенном ядерной ламины; а, в – флуоресцентная микроскопия, иммуноцитохимическое окрашивание ламина В1, б, г – фазово-контрастная микроскопия. Масштабный отрезок – 10 мкм.
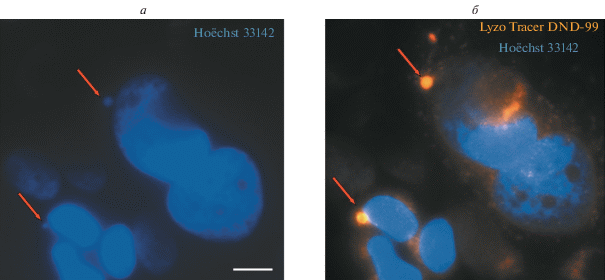
Исследование роли компонентов кислого компартмента в элиминации микроядер. Для выявления возможности лизосомной деградации микроядер анализировали случаи солокализации окрашивания микроядра (Hoechst 33142) и компонентов кислого компартмента (LysoTracer® Red DND-99). Такая картина свидетельствует о слиянии микроядра с везикулами кислого компартмента.
Случаи лизосомной деградации показаны только для одиночных мелких микроядер (рис. 7). Эти случаи, как в контроле, так и при воздействии паклитаксела единичны (0.13 ± 0.15%), однако из выборки выпадает значительная доля клеток с микроядрами, вступивших в апоптоз. Для того, чтобы рассмотреть возможную судьбу микроядер в этой группе клеток, осуществляли экспериментальное подавление апоптотической гибели с помощью панкаспазного ингибитора ZVAD-fmk в течение 1 сут после воздействия паклитаксела. Апоптотический индекс в эксперименте без добавления ZVAD-fmk составил 7.5 ± 1.1%. При добавлении ZVAD-fmk случаи апоптотической гибели единичны (0.06 ± 0.11%). Полученные данные свидетельствуют о “срабатывании” агента. При действии панкаспазного ингибитора ZVAD-fmk число регистрируемых случаев лизосомной деградации мелких одиночных микроядер возрастает до 6.3 ± 0.4% клеточной популяции. Солокализация крупных множественных микроядер с компонентами кислого компартмента выявлена не была. Солокализованные с везикулами кислого компартмента одиночные мелкие микроядра в большинстве случаев расположены в непосредственной близости от основного клеточного ядра.
Рис. 7.
Опосредованная лизосомами деградация одиночных мелких микроядер в клетках культуры MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. Стрелками показаны случаи солокализации окрашивания микроядер и везикул кислого компартмента. Окрашивание ядер Hoechst (синий цвет) и везикул кислого компартмента LysoTracer® Red DND-99 (оранжевый цвет). Флуоресцентная микроскопия; масштабный отрезок – 10 мкм.
Локализация белка р53. Наличие в клетке микроядра является одним из факторов, инициирующих апоптоз по ядерному пути посредством белка р53. На активацию р53 указывает перемещение данного белка в микроядро (Чумаков, 2007). Окрашивание с помощью антител к белку р53 действительно выявило его перемещение в микроядра как при воздействии паклитаксела, так и в контроле. Зафиксировано поступление белка р53 как в крупные множественные, так и в мелкие одиночные микроядра. В каждой группе присутствуют также р53-отрицательные микроядра (рис. 8).
Рис. 8.
Локализация белка р53 в клетках MCF-7 при воздействии паклитаксела (125 нМ, 48 ч), 1 сут после удаления агента. На рисунке белыми стрелками обозначены случаи активации белка р53: 1 – в одноядерных клетках, 2 – в клетках с одиночным мелким микроядером, 3 – в клетке с крупными множественными микроядрами. Красные стрелки – белок р53 не активируется: 1 – в одноядерной клетке, 2 – в клетке с единичным мелким микроядром, 3 – в клетке с крупными множественными микроядрами (нет поступления белка р53 ни в одно из микроядер). Окрашивание ядер DAPI (синий цвет), иммуноцитохимическое окрашивание белка р53 (зеленый цвет). Флуоресцентная микроскопия; масштабный отрезок – 10 мкм.
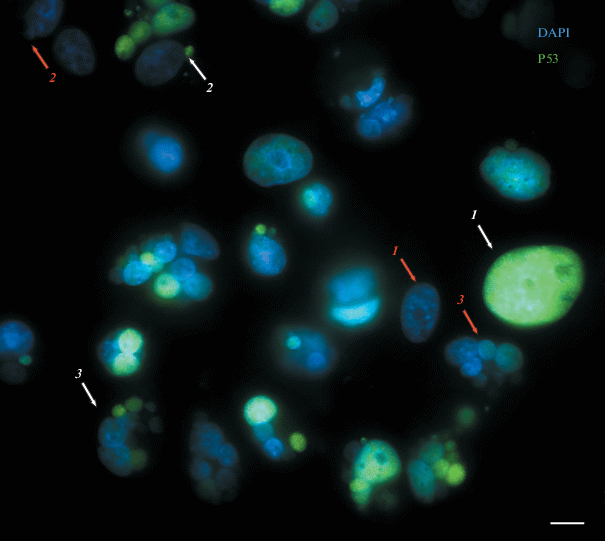
Подсчет числа р53-положительных микроядер показал, что в контроле в большинстве клеток с крупными множественными микроядрами наблюдается перемещение р53 в микроядра (72%: 168 из 234 микроядер), в то время как в клетках с одиночными мелкими микроядрами более чем в половине клеток активации р53 не происходит (39% р53-положительных микроядер: 97 из 249 одиночных мелких). При воздействии паклитаксела вероятность перемещения белка р53 в микроядро для крупных множественных и одиночных мелких микроядер примерно одинакова: 40% (109 из 273) р53-положительных микроядер среди крупных множественных и 41% (101 из 246) среди одиночных мелких. Распределение р53 в клетках с множественными микроядрами крайне разнообразно. В клетке могут окрашиваться все микроядра, несколько из присутствующих микроядер, только одно микроядро, окрашивание может отсутствовать вовсе (до 25 ± 1.6% микроядерных клеток при воздействии паклитаксела).
ОБСУЖДЕНИЕ
Две группы микроядер. Проведенное исследование показало, что в культуре клеток MCF-7 существуют две популяции микроядер – одиночные мелкие и крупные множественные. Тот факт, что формирование крупных множественных микроядер может быть инициировано воздействием паклитаксела, а формирование мелких одиночных микроядер протекает независимо от воздействия данного агента, указывает на их различные независимые пути формирования.
В литературе имеются данные о том, что одиночные микроядра могут формироваться при отставании в митозе отдельной хромосомы или фрагмента хромосомы (Catalán et al., 2000; Hoffelder et al., 2004; Fenech et al., 2011). Однако на основе целой хромосомы образуются довольно крупные микроядра, кроме того, отставание хромосом и хромосомных фрагментов – достаточно редкое явление, поэтому не может служить причиной формирования микроядер в 13% клеток. Еще одним возможным механизмом образования одиночных мелких микроядер может стать ядерный блеббинг (Shimizu et al., 2000; Utani et al., 2011). Генетический материал микроядер при блеббинге может быть представлен поврежденной ДНК основного клеточного ядра (Erenpreisa et al., 2012) или амплифицированными участками ДНК, содержащими протоонкогены (Shimizu et al., 2000; Huang et al., 2012). В пользу этого пути формирования свидетельствует, в частности, преимущественная локализация микроядер этого типа в непосредственной близости от основного ядра или вплотную к нему. Кроме того, в клетках линии MCF-7 действительно амплифицированы протоонкогены семейства ras, их количество увеличено в 20 раз (Попков и др., 2012), они могут стать субстратом для формирования микроядер путем блеббинга. Таким образом, мы предполагаем, что основная часть одиночных мелких микроядер в культуре клеток MCF-7 образовалась путем блеббинга на основе амплифицированных участков ДНК или поврежденных фрагментов ДНК.
Формирование крупных множественных микроядер, как правило, происходит в результате многополюсных митозов. В литературе содержатся данные о различных центросомных аномалиях в опухолевых клетках, в частности в клетках аденокарциномы молочной железы человека, приводящих к многополюсным митозам и образованию клеток с микроядрами (Lingle et al., 1998). По-видимому, именно этот механизм может реализовываться в контроле. При воздействии паклитаксела формирование крупных множественных микроядер происходит при нарушении сегрегации хромосом в ходе К-митоза, вызванном стабилизацией микротрубочек веретена деления (Кисурина-Евгеньева и др., 2006). Вокруг каждой из групп отдельно лежащих в цитоплазме хромосом формируется индивидуальная ядерная оболочка. В составе множественных крупных микроядер присутствуют либо одиночные хромосомы, либо группы хромосом.
Таким образом, можно говорить о присутствии в клетках MCF-7 двух субпопуляций микроядер, различающихся по пути формирования и генетическому материалу.
Особенности деградации микроядер. В настоящее время известно, что элиминация микроядер может осуществляться разными способами (Shimizu et al., 2000; Gernand et al., 2005; Rello-Varona et al., 2012; Hatch et al., 2013). Для выявленных нами двух групп микроядер существуют как общие пути деградации, так и присущие каждой группе. Общие пути деградации связаны с нарушением строения ядерной оболочки и последующим ее полным распадом. В клетках культуры MCF-7 присутствуют как одиночные, так и множественные микроядра с частичным или полным отсутствием ядерной ламины. Электронно-микроскопические исследования показывают наличие разрывов оболочки микроядра, отсутствие самой ядерной оболочки в ряде микроядер. Встречается также свободно лежащий в цитоплазме хроматин.
Наблюдаемые морфологические дефекты оболочки микроядер связаны, скорее всего, с состоянием ядерной ламины, и нарушения в ее строении являются первичными. Отсутствие ламины (ламина В1) приводит к образованию разрывов ядерной оболочки (Vergnes et al., 2004; Vargas et al., 2012). Именно ядерная ламина играет решающую роль во взаимодействии хроматина с ядерной оболочкой (Gonzalo, 2014). Причины формирования ламин-отрицательных микроядер могут быть различны и зависят от способа образования микроядра. В случае микроядер, формирующихся при нарушении сегрегации хромосом (крупные множественные, мелкие одиночные, сформировавшиеся на основе отстающей хромосомы), причиной дефектности формирующейся микроядерной оболочки может быть различная способность отдельных хромосом взаимодействовать с ядерной оболочкой (Кисурина-Евгеньева и др., 2016). Так, мелкие хромосомы, которые в норме локализуются в центре интерфазного ядра, могут иметь меньшее по сравнению с крупными хромосомами число ламин-связывающих последовательностей. Кроме того, они характеризуются более низкой способностью к взаимодействию с белками, участвующими в постмитотическом формировании ядерной оболочки (Sun et al., 2000; Foster et al., 2012). Соответственно, при образовании отдельных микроядер на основе таких хромосом, они оказываются неспособными к формированию полноценной ядерной оболочки. Интересно отметить, что в областях нарушения ядерной оболочки мы отмечаем отсутствие гетерохроматина. Как правило, участки хроматина, взаимодействующие с ядерной оболочкой, представляют собой гетерохроматиновые области. Отсутствие гетерохроматина, описанное нами, может указывать на отсутствие участков, способных связываться с ядерной оболочкой.
Если формирование микроядра происходит путем ядерного блеббинга (мелкие одиночные микроядра), данный процесс протекает в областях ядра с нарушенной организацией ламины. Кроме того, при ядерном блеббинге показано неравномерное распределение ламины: сосредоточение ламины наблюдается в “стебле”, соединяющем формирующееся микроядро с основным ядром, сама ядерная почка (основа будущего микроядра) ламины практически лишена (Utani et al., 2011).
Таким образом, в зависимости от способа формирования микроядра, строение ядерной оболочки может отличаться. Одиночные мелкие микроядра, формирующиеся путем ядерного блеббинга, либо же на основе единичной хромосомы, чаще имеют дефектную ядерную оболочку. Оболочка микроядер из группы крупных множественных формируется вокруг несколько хромосом, и вероятность того, что все попавшие в микроядро хромосомы окажутся неспособны к нормальному формированию ядерной оболочки, невелика.
Специфическим способом элиминации одиночных мелких микроядер, выявленным нами, является лизосом-опосредованная деградация. Показанная нами картина, по-видимому, указывает на слияние с микроядром везикул кислого компартмента. В литературе (Rello-Varona et al., 2012) описан случай такой же колокализации микроядер и везикул кислого компартмента, дальнейшие исследования авторов показали аутофагическую природу данного явления. В упомянутой работе различные группы микроядер не выделяются, однако приведенный иллюстративный материал позволяет отнести аутофагические микроядра, так же как и в нашем случае, к группе одиночных мелких микроядер. Некоторые авторы предполагают, что путем аутофагии элиминируются микроядра, образовавшиеся путем блеббинга и содержащие нерепарируемый генетический материал (Erenpreisa et al., 2012), что может объяснить специфичность данного пути для одиночных мелких микроядер.
Фиксируемые случаи лизосом-опосредованной деградации единичны, однако при блокировании апоптотического пути их число значительно возрастает. Возможным объяснением может быть поддержание в клетках баланса процессов апоптоз-аутофагия (Gozuacik, Kimchi, 2004). Предположительно в микроядерных клетках MCF-7 (р53+) преимущественно индуцируется апоптоз, а аутофагический сценарий реализоваться не успевает. Блокирование апоптоза смещает баланс в сторону аутофагии. Таким образом, можно утверждать, что лизосом-опосредованная деградация мелких одиночных микроядер – реально существующий путь элиминации, однако он реализуется крайне редко.
Специфическая деградация крупных множественных микроядер осуществляется через их “вакуолизацию”. Этот способ деградации, по-видимому, также связан с нарушением строения ядерной оболочки. Нами показана связь признаков вакуолизации с отсутствием ламины на определенном участке оболочки микроядра. Электронно-микроскопические исследования показывают расширение перинуклеарного пространства в ряде микроядер. Как упоминалось выше, правильное формирование ядерной оболочки может быть нарушено у микроядер, сформировавшихся постмитотически на основе мелких хромосом. Проявляемая микроядрами меньшей площади тенденция к вакуолизации так же подтверждает данное предположение.
Таким образом, нами описаны разные способы деградации различных групп микроядер. Однако следует отметить, что элиминация микроядра – процесс редкий, в большинстве случаев элиминации микроядра в микроядерной клетке не происходит, микроядро сохраняется, но может при этом характеризоваться наличием морфологических дефектов.
Поступление в микроядра белка р53. В норме наличие в клетке микроядра должно сопровождаться активацией белка р53, последующей остановкой в клеточном цикле и р53-опосредованной апоптотической гибелью клетки (Weaver, 2014). Однако нами показано, что р53 поступает не во все микроядра. Встает вопрос, чем обусловлено накопление р53 в конкретных микроядрах. Известно, что мишенями р53 является широкий спектр генов, отвечающих за остановку клеточного цикла и активацию программы апоптоза. Кроме того, показано, что р53 может связываться с участками поврежденной ДНК (Чумаков, 2007), поэтому р53 должен накапливаться во многих микроядрах. Действительно, большинство крупных множественных микроядер являются р53-положительными. В то же время многие одиночные мелкие микроядра не содержат р53. Препятствием для поступления р53 может служить нарушение ядерно-цитоплазматического транспорта, вызванное дефектами ядерной оболочки (Medvedeva et al., 2007). К таким дефектам относится отсутствие ламины приводящее к нарушению формирования поровых комплексов (Shimizu et al., 2000; Hoffelder et al., 2004; Terradas et al., 2016). Действительно, дефекты ядерной оболочки в большей степени характерны для одиночных микроядер. Кроме того, амплифицированные протоонкогены, которые могут являться субстратом для формирования ряда микроядер (Shimizu et al., 2000; Huang et al., 2012) не являются мишенями белка р53. Эти два фактора могут служить причиной отсутствия р53 в одиночных мелких микроядрах. С другой стороны, р53-позитивными могут являться микроядра, содержащие двунитевые разрывы ДНК (Kopnin, 2000). Таким образом, накопление р53 в микроядрах и дальнейшая судьба клетки может определяться генетическим материалом, содержащимся в микроядрах.
Таким образом, ряд методов современной противоопухолевой терапии направлен на индукцию гибели клеток через образование микроядер, однако известно, что отдельные микроядра могут быть элиминированы клеткой. В связи с этим встает вопрос, может ли процесс элиминации микроядер оказывать значительное влияние на результаты противоопухолевой терапии. Проведенное нами исследование показывает, что наблюдаемые случаи элиминации микроядер единичны, или же наблюдается элиминация одного микроядра при наличии в клетке нескольких. Гораздо больший потенциальный риск представляет сохранение в клетке микроядра, дефекты оболочки которого препятствуют поступлению в него белка р53, что наиболее характерно для одиночных мелких микроядер. В клетке с микроядром, в которой не произошло активации белка р53, не происходит индукции апоптотической гибели, и такая клетка может продолжать продвижение по клеточному циклу. В то же самое время дефекты микроядерной оболочки могут стать причиной нарушения протекания в микроядре нормальных процессов репарации и репликации. В случае если клетка, содержащая такое микроядро, вступает в митоз, в ядро дочерней клетки может быть привнесен генетический материал, содержащий множественные локальные мутации (Crasta et al., 2012) (явление, в статьях последних лет получившее название хромотрипсиса). Данный процесс, предположительно, может являться причиной озлокачествления опухоли (Terradas et al., 2010; Zhang et al., 2015) и требует дополнительного рассмотрения. Внимания заслуживает также формирующаяся при воздействии паклитаксела группа клеток с множественными крупными микроядрами, ни одно из микроядер которых не включает белок р53. Дальнейшая судьба таких клеток неизвестна, возможно, они также представляют потенциальный риск.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 14-50-00029).
Список литературы
Кисурина-Евгеньева О.П., Брянцева С.А., Штиль А.А., Онищенко Г.Е. 2006. Антитубулиновые агенты могут инициировать различные пути апоптоза. Биофизика. Биофизика клетки. 51 (5): 875–879. (Kisurina-Evgenieva O.P., Bryantseva S.A., Shtil’ A.A., Onishchenko G.E. 2006. Antitubulin agents can initiate different apoptotic pathways. Biophysics. 51 (5): 771–775.)
Кисурина-Евгеньева О.П., Сутягина О.И., Онищенко Г.Е. 2016. Биогенез микроядер. Биохимия. 81 (5): 612–624. (Kisurina-Evgenieva O.P., Sutiagina O.I., Onishchenko G.E. 2016. Biogenesis of micronuclei. Biochemistry. 81 (5): 453–464.)
Попков В.М., Чеснокова Н.П., Ледванов М.Ю. 2012. Активация липопероксидации как ведущий патогенетический фактор развития типовых патологических процессов и заболеваний различной этиологии. Саратов: Изд-во СГМУ. 366 с. (Popkov V.M., Chesnokova N.P., Ledvanov M.U. 2012. Activation of lipoperoxidation as a leading pathogenetic factor in the development of typical pathological processes and diseases of various etiology. Saratov: PH SMSU. 366 р.)
Чумаков П.М. 2007. Белок р53 и его универсальные функции в многоклеточном организме. Успехи биологической химии. 47: 3–52. (Chumakov P.M. 2007. Protein p53 and its universal functions in the multicellular organism. Usp. Biol. Khim. 47: 3–52.)
Asare N., Instanes C., Sandberg W.J., Refsnes M., Schwarze P., Kruszewski M., Brunborg G. 2012. Cytotoxic potential of silver nanoparticles. Toxicology. 291: 65–72.
Baptista-Giacomelli F.R., Pagliarini M.S., de Almeida J.L. 2000. Elimination of micronuclei from microspores in a Brazilian oat (Avena sativa L.) variety. Genet. Mol. Biol. 23: 681–684.
Catalán J., Falck G.C.-M., Norppa H. 2000. The X chromosome frequently lags behind in female lymphocyte anaphase. Am. J. Hum. Genet. 66: 687–691.
Crasta K., Ganem N.J., Dagher R., Lantermann A.B., Ivanova E.V., Pan Y., Nezi L., Protopopov A., Chowdhury D., Pellman D. 2012. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482: 53–58.
Erenpreisa J., Huna A., Salmina K., Jackson T.R., Cragg M.S. 2012. Macroautophagy-aided elimination of chromatin: sorting of waste, sorting of fate? Autophagy. 8: 1877–1881.
Fenech M., Kirsch-Volders M., Natarajan A.T., Surralles J., Crott J.W., Parry J., Norppa H., Eastomond D.A., Tucker J.D., Thomas P. 2011. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26: 125–132.
Foster H.A., Griffin D.K., Bridger J.M. 2012. Interphase chromosome positioning in in vitro porcine cells and ex vivo porcine tissues. BMC Cell Biol. 13: 30.
Gernand D., Rutten T., Varshney A., Rubtsova M., Prodanovic S., Brüss C., Kumlehn J., Matzk F., Houben A. 2005. Uniparental chromosome elimination at mitosis and interphase in wheat and pearl millet crosses involves micronucleus formation, progressive heterochromatinization, and DNA fragmentation. Plant Cell. 17: 2431–2438.
Gonzalo S. 2014. DNA damage and lamins. Adv. Exp. Med. Biol. 773: 377–399.
Gozuacik D., Kimchi A. 2004. Autophagy as a cell death and tumor suppressor mechanism. Oncogene. 23: 2891–2906.
Hatch E.M., Fischer A.H., Deerinck T.J., Hetzer M.W. 2013. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154: 47–60.
Hoffelder D.R., Luo L., Burke N.A., Watkins S.C., Gollin S.M, Saunders W.S. 2004. Resolution of anaphase bridges in cancer cells. Chromosoma. 112: 389–397.
Huang Y., Jiang L., Yi Q., Lv L., Wang L., Zhao X., Zhong L., Jiang H., Rasool S., Hao Q., Guo Z., Cooke H.J., Fenech M., Shi Q. 2012. Lagging chromosomes entrapped in micronuclei are not 'lost' by cells. Cell Research. 22: 932–935.
Kopnin B.P. 2000. Targets of oncogenes and tumor suppressors: key for understanding basic mechanisms of carcinogenesis. Biochemistry 5: 2–27.
Lingle W.L., Ingle J.N., Maihle N.J., Salisbury J.L. 1998. Centrosome hypertrophy in human breast tumors: implications for genomic stability and cell polarity. Proc. Natl. Acad. Sci. USA. 95: 2950–2955.
Medvedeva N.G., Panyutin I.V., Panyutin I.G., Neumann R.D. 2007. Phosphorylation of histone H2AX in radiation-induced micronuclei. Radiat. Res. 168: 493–498.
O’Donovan P., Livingston D.M. 2010. BRCA1 and BRCA2: breast/ovarian cancer susceptibility gene products and participants in DNA double strand break repair. Carcinogenesis. 31: 961–967.
Rao X., Zhang Y., Yi Q., Hou H., Xu B., Chu L., Huang Y., Zhang W., Fenech M., Shi Q. 2008. Multiple origins of spontaneously arising micronuclei in HeLa cells: direct evidence from long-term live cell imaging. Mutat. Res. 646: 41–49.
Rello-Varona S., Lissa D., Shen S., Niso-Santano M., Senovilla L., Mariño G., Vitale I., Jemaá M., Harper F., Pierron G., Castedo M., Kroemer G. 2012. Autophagic removal of micronuclei. J. Cell Cycle. 11: 170–176.
Sagona A.P., Nezis I.P., Stenmark H. 2014. Association of CHMP4B and autophagy with micronuclei: implications for cataract formation. Biomed. Res. Int. 974393.
Shimizu N., Shimura N., Tanaka T. 2000. Selective elimination of acentric double minutes from cancer cells through the extrusion of micronuclei. Mutat. Res. 448: 81–90.
Sun H.B., Shen J., Yokota H. 2000. Size-dependent positioning of human chromosomes in interphase nuclei. Biophys J. 79: 184–190.
Terradas M., Martin M., Tusell L., Genesca A. 2010. Genetic activities in micronuclei: is the DNA entrapped in micronuclei lost for the cell? Mutat. Res.705: 60–67.
Terradas M., Martín M., Genescà A. 2016. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90: 2657–2667.
Utani K., Okamoto A., Shimizu N. 2011. Generation of micronuclei during interphase by coupling between cytoplasmic membrane blebbing and nuclear budding. PLoS One 6: e27233.
Vargas J.D., Hatch E.M., Anderson D.J., Hetzer M.W. 2012. Transient nuclear envelope rupturing during interphase in human cancer cells. Nucleus. 3: 88–100.
Vergnes L., Peterfy M., Bergo M.O., Young S.G., Reue K. 2004. Lamin B1 is required for mouse development and nuclear integrity. Proc. Natl. Acad. Sci. USA. 101: 10428–10433.
Weaver B.A. 2014. How Taxol/paclitaxel kills cancer cells. Mol. Biol. Cell. 25: 2677–2681.
Zhang C.Z., Spektor A., Cornils H., Francis J.M., Jackson E.K., Liu S., Meyerson M., Pellman D. 2015. Chromothripsis from DNA damage in micronuclei. Nature. 522: 179–184.
Дополнительные материалы отсутствуют.


