Цитология, 2019, T. 61, № 2, стр. 98-105
Пренатальное введение дексаметазона вызывает уменьшение степени ацетилирования гистона Н3 по лизину 24 в неокортексе и гиппокампе взрослых крыс
Е. И. Тюлькова 1, *, Л. А. Ватаева 2, О. В. Ветровой 1, 3, К. В. Сариева 1, В. А. Стратилов 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, Россия
3 Биологический факультет Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
* E-mail: etyulkova@yandex.ru
Поступила в редакцию 05.09.2018
После доработки 25.10.2018
Принята к публикации 29.10.2018
Аннотация
Дексаметазон, как и другие искусственные глюкокортикоиды, широко применяется в повседневной акушерской практике. Показанием для использования глюкокортикоидов является угроза прерывания беременности. Однако имеются данные, свидетельствующие о том, что введение глюкокортикоидов в период беременности может привести к нарушению развития мозга и поведения потомства. Современные исследования показывают, что эпигенетические механизмы могут играть ключевую роль в развитии таких патологий. Целью настоящего исследования явилось изучение особенностей ацетилирования лизина 24 в гистоне Н3 (асН3К24) в нейронах гиппокампа и неокортекса взрослых крыс вследствие введения дексаметазона (0.8 мг/кг) в начале и конце третьей недели их пренатального развития. С использованием иммуногистохимического метода были выявлены особенности изменения содержания асН3К24 в клетках гиппокампа и неокортекса взрослых крыс после введения дексаметазона на 14–16-е или 17–19-е сут пренатального онтогенеза. Основные изменения касались количества клеток, интенсивно окрашенных на асН3К24. Так, в области СА1 и зубчатой извилине (ЗИ) гиппокампа введение дексаметазона приводило к снижению количества клеток с высоким содержанием асН3К24. При введении дексаметазона на 14–16-е и 17–19-е сут пренатального развития это снижение составило 53.5 и 76% в СА1 и 39.7 и 87.8% в ЗИ соответственно. В 5-м слое неокортекса обнаружено уменьшение количества асН3К24 (до 55% от контроля) при введении дексаметазона на 17–19-е, но не на 14–16-е сут пренатального онтогенеза. Обнаруженные модификации эпигенетического статуса клеток мозга крыс, переживших введение дексаметазона, могут лежать в основе ранее показанных нами длительных изменений поведения и способности к обучению.
К настоящему времени накоплено большое число экспериментальных и клинических данных о связи между воздействием стресса во время беременности и повышением риска развития различных форм патологий у потомства. Последствия действия стресса, перенесенного в пренатальном периоде, могут проявляться, в частности, в задержке развития головного мозга и нейронных связей, нарушении поведения и когнитивных функций, а также способствовать развитию нейродегенеративных заболеваний (Dudley et al., 2011; Buss et al., 2012; Xiong, Zhang, 2013).
Факторы стресса опосредуют свое влияние на плод через организм матери и плаценту (Hompes et al., 2012), запуская каскад событий, включающий выброс стрессовых гормонов в кровь матери и структурно-функциональные изменения в материнской и фетальной частях плаценты, что может являться причиной патологических процессов и изменений состояния плода, ассоциированных с пренатальным стрессом (Pryce, 2008; Buss et al., 2012; Miranda, Sousa, 2018). В какой степени стресс-индуцированные изменения в развитии плода обусловлены собственно патологическим действием гормонов стресса, глюкокортикоидов, а в какой – неспецифической стрессовой реакцией матери, до сих пор остается неясным. Для того чтобы прояснить этот вопрос, целесообразно провести эксперименты с введением беременным самкам синтетического глюкокортикоида дексаметазона, который легко проходит через гистогематические барьеры (в том числе, через гемато-энцефалический и плацентарный).
Дексаметазон – это препарат длительного действия, не поддающийся инактивирующему действию ферментных систем плаценты и оказывающий продолжительное воздействие на органы и ткани-мишени (Matthews et al., 2002). Эксперименты с введением дексаметазона, таким образом, позволяют смоделировать и оценить непосредственный эффект воздействия на плод глюкокортикоидных гормонов, секреция которых у беременных самок во время стресса резко повышается. Изучение эффектов дексаметазона на пренатальное развитие актуально еще и по той причине, что этот глюкокортикоид интенсивно применяется в медицинской практике, например, дексаметазон вводится беременным женщинам при угрозе прерывания беременности (Matthews et al., 2002; Crowther, Harding, 2003). В то же время у специалистов нет единого мнения относительно безопасности применения глюкокортикоидных препаратов при беременности.
В экспериментах на животных показано, что введение беременным самкам глюкокортикоидов стимулирует созревание сурфактанта и ускоряет созревание легких плода, что может рассматриваться как адаптивная реакция, направленная на подготовку плода к преждевременным родам при попадании матери в условия стресса (Dammann, Matthews, 2001). Кроме того, при некоторых заболеваниях во время беременности используются противовоспалительные, иммунодепрессивные, противоаллергические свойства глюкокортикоидов. Однако в целом ряде исследований было обнаружено, что глюкокортикоиды могут отрицательно влиять на рост и развитие плода животных, особенно неблагоприятное действие они оказывают на головной мозг и нервную систему (Dygalo et al., 1999; Shishkina et al., 2002; Wan et al., 2005; González-Ochoa et al., 2018). Предполагается, что глюкокортикоиды обладают разносторонним действием на головной мозг, многие аспекты которого до конца не выяснены. Исследуя возможные последствия применения в акушерской практике глюкокортикоидов, необходимо принимать во внимание и то, что их введение во время беременности может повлиять на заболеваемость потомков во взрослом возрасте. Именно отдаленные последствия вызывают наибольший интерес клиницистов и исследователей, проводящих свои эксперименты на животных.
Ранее нами были обнаружены длительные модификации работы систем внутриклеточной сигнализации, нейроэндокринных систем, вызываемые пренатальными воздействиями тяжелой гипобарической гипоксии или введением дексаметазона (Ватаева и др., 2010; Тюлькова и др., 2013; Тюлькова и др., 2015, Тюлькова, 2015). Можно предположить, что эти нарушения связаны и с эпигенетическими регуляторными механизмами, влияющими на характер экспрессии генов и дифференцировки клеток. Эпигенетические модификации являются важными механизмами в программировании здорового развития и болезней (Egger et al., 2004; Gluckman et al., 2008; Chen, Zhang, 2011; Ma, Zhang, 2015). Последующие наши исследования выявили связь ацетилирования гистона Н3 по лизину 24 (асН3К24) с развитием патологических реакций мозга на воздействие гипоксии в различные периоды пренатального онтогенеза (Тюлькова и др. 2017).
Целью настоящего исследования явилось изучение особенностей ацетилирования лизина 24 в гистоне Н3 (асН3К24) в нейронах гиппокампа и неокортекса взрослых трехмесячных крыс вследствие введения дексаметазона (0.8 мг/кг) в начале и конце третьей недели их пренатального развития. Выбор сроков обусловлен тем, что у крыс критическим периодом в развитии головного мозга является последняя неделя беременности, продолжительность которой 21–23 сут. В течение этого периода происходит активный нейрогенез в различных структурах мозга, обнаруживается миграция клеток к месту новой коры, обособление основных корковых областей, начало дифференцировки корковых слоев (Rice, Barone, 2000). Этот период (период позднего пренатального онтогенеза) является так же критическим для формирования центральных нейроэндокринных механизмов и различных форм адаптивного поведения (Науменко и др. 1990; Угрюмов, 1999).
МАТЕРИАЛ И МЕТОДИКА
Работа с животными. Использовали крыс линии Вистар из “Коллекции лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. При проведении экспериментов соблюдали требования, сформулированные в Директивах Совета Европейского сообщества (86/609/ЕЕС) об использовании животных для экспериментальных исследований. Протоколы экспериментов были утверждены Комиссией по гуманному обращению с животными Института Физиологии им. И.П. Павлова РАН.
Животные были рождены интактными самками и самками, которым на 14–16-е или 17–19-е сут беременности вводили синтетический гормон дексаметазон (в дозе 0.8 мг/кг внутрибрюшинно однократно в течение 3-х сут). При выборе дозы дексаметазона мы учитывали данные других авторов и наши более ранние исследования (Slotkin et al., 2006; Vilaca et al., 2008.)
Крысят отлучали от кормившей их матери в возрасте 30 сут. После отлучения крысы находились в клетках размером 60 × 30 × 20 см по 6 животных в каждой. В течение всего периода проведения экспериментов крысы содержались при режиме свет–темнота 12 : 12 ч, температуре 20–23°С и при постоянном доступе к воде и пище. Крысы достигают половой зрелости в возрасте 3–4 мес. Именно этот возраст мы считаем оптимальным для исследования отдаленных последствий влияния пренатального стресса. В настоящей работе эксперименты были поставлены на 3-месячных крысах – молодых половозрелых самцах с активным сперматогенезом.
Иммуногистохимические исследования проведены на трехмесячных половозрелых животных. Декапитацию крыс каждой из экспериментальных групп (по 6 крыс) для взятия головного мозга осуществляли гильотиной. После декапитации вскрывали череп, извлекали мозг, отрезали мозжечок и помещали мозг в фиксатор. Далее образцы ткани мозга обрабатывали согласно стандартному гистологическому протоколу: фиксировали в молекулярном фиксаторе FineFix (разведение: 28 мл фиксатора + 72 мл 96° этанола; Milestone, Italy) в течение 24 ч при температуре 4°C. Затем образцы промывали в проточной воде в течение 2 ч и обезвоживали, проводя через этанол возрастающих концентраций (50 → 70 → 80 → 96 → 96° по 1 ч в каждом). На ночь оставляли в бутаноле. Затем материал проводили через 2 порции ксилола (по 30–40 мин), помещали в парафин (2 смены парафина, по 1 ч в каждой) в термостате при температуре 56°C и изготавливали парафиновые блоки. На ротационном микротоме (Reichert, Austria) изготавливали серийные срезы мозга во фронтальной плоскости толщиной 7 мкм на уровне 2.8–3.6 мм от брегмы. Полученные срезы монтировали на предметные стекла, обработанные полилизином.
Далее срезы депарафинизировали в ксилоле (2 смены по 5 мин) и подвергали регидратации в спиртах (96 → 96 → 96 → 70°) по 5 мин в каждом. Для оценки степени ацетилирования гистона Н3 по лизину 24 использовали иммуногистохимический метод. Основные этапы метода: 1) инкубация с поликлональными кроличьими антителами к асН3К24 (Santa Cruz Biotechnology, Inc, США, разведение в фосфатном буфере 1:50) или к общему ацетилированию лизинов белков ((C4)-R: sc-8663-R, Santa Cruz Biotechnology, Inc., США, разведение в фосфатном буфере 1 : 500); 2) инкубация с вторичными биотинилированными противокроличьими антителами (Vectastein ABC kit, Vector Laboratories, Inc., США, разведение в фосфатном буфере 1 : 200); 3) инкубация с комплексом авидина и биотинилированной пероксидазы (ABC, Vector Laboratories, Inc., США, разведение реагентов А и В 1 : 100); 4) визуализация реакции с помощью диаминобензидинового набора (DAB substrate kit for peroxidase, Vector Laboratories, Inc., США, буфер (1 капля), 3,3-диаминобензидин (2 капли), Н2О2 (1 капля) на 2.5 мл Н2О).
Анализ препаратов проводили с помощью морфометрической установки, состоящей из светового микроскопа Jenaval (Carl Zeiss, Германия), цифровой камеры Baumer CX05c (Baumer Optronic, Германия) и компьютера IBM PC с программным обеспечением ВидеоТест Мастер Морфология (разработка ООО Видео Тест, Санкт-Петербург). Клетки подсчитывали в поле зрения площадью 460 × 340 мкм при увеличении объектива 40×). Определяли величину средней оптической плотности каждой клетки в усл. ед. уровня серого, обратно пропорциональных единицам яркости. Иммунопозитивными автоматически считали клетки, оптическая плотность которых превышала показатель фона на 2 усл. ед. На основании заданных нами параметров, исходя из показателей оптической плотности, все иммунопозитивные клетки автоматически разделяли на интенсивно и слабо окрашенные. Анализировали общее число иммунопозитивных клеток и число интенсивно окрашенных клеток (на снимке 450 × 300 мкм). Для анализа общего ацетилирования лизинов белков и асН3К24 проводили иммуногистохимическую реакцию на 4-х гистологических препаратах от каждого животного, усредняя значения для каждой области мозга c одного поля зрения конкретной области мозга на срезе. Результаты обрабатывали с помощью пакетов анализа данных STATISTICA 7.0 Stat Soft, Inc и Microsoft Excel’2003, использовали непараметрический критерий Манна–Уитни (Mann–Whitney U-test). Изменения считали достоверными при P ≤ 0.05. Все результаты представлены в виде среднего арифметического и его ошибки. Результаты выражены в процентах от контроля, принятого за 100%.
РЕЗУЛЬТАТЫ
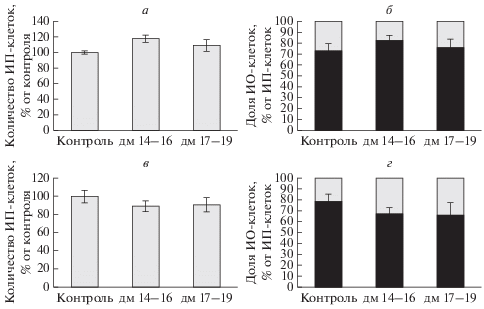
На рис. 1 (I) представлены репрезентативные микрофотографии клеток, иммунопозитивных к общему ацетилированию лизина, в поле СА1 гиппокампа и 5-м слое неокортекса контрольных крыс и крыс, которым вводили дексаметазон на 14–16-е и 17–19-е сут пренатального онтогенеза. Общее ацетилирование лизинов белков у контрольных животных в исследуемых структурах мозга было ярко выражено. При подсчете общего количества клеток (рис. 2), иммунопозитивных к общему ацетилированию лизина в поле СА1 гиппокампа и ЗИ взрослых крыс, подвергавшихся действию дексаметазона на 14–16-е сут пренатального онтогенеза, обнаружено увеличение иммунопозитивных клеток на 18.6 ± 8.1% (Р ≤ 0.05, n = 6) по сравнению с контролем (рис. 2а) без изменений доли интенсивно окрашенных клеток (рис. 2б). В 5-м слое неокортекса не выявлено статистически значимых изменений ни по общему количеству иммунореактивных клеток, ни по доле интенсивно окрашенных клеток в данной экспериментальной группе (рис. 2в, 2г). Ни в гиппокампе, ни в неокортексе крыс, переживших пренатальную гипоксию на 17–19-е сут пренатального онтогенеза, не выявлено отличий от контроля ни общего количества иммунопозитивных к ацетилированию лизина клеток, ни интенсивно окрашенных клеток.
Рис. 1.
Микрофотографии поля СА1 гиппокампа (а, б, в) и 5-го слоя неокортекса (г, д, е) контрольных крыс (а, г) и крыс, переживших введение дексаметазона (0.8 мг/кг) на 14–16-е (б, д) и 17–19-е (в, е) сут пренатального развития. I – иммуногистохимическая реакция на общее ацетилирование лизинов белков, II – иммуногистохимическая реакция на асН3К24. Увел. об.: 40×. Масштабная линейка: 100 мкм (для всех фотографий).
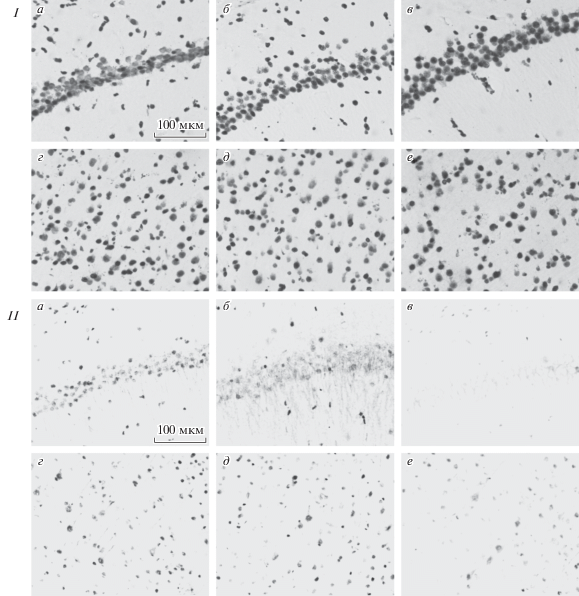
Рис. 2.
Влияние введения дексаметазона (ДМ) на 14−16-е и 17−19-е сут пренатального развития на общее количество клеток, иммунопозитивных (ИП) к общему ацетилированию лизинов белков, по отношению к контролю (а, в) и на долю интенсивно окрашенных (ИО) клеток от общего количества ИП-клеток (б, г) в поле СА1 гиппокампа (а, б) и 5 м слое неокортекса (в, г) взрослых крыс. По вертикали – количество ИП-клеток в % от контроля (а, в) и доля ИО-клеток (черный цвет) от общего количества ИП-клеток, принятого за 100% (б, г).
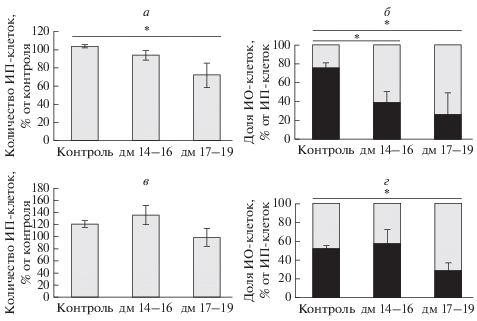
С использованием иммуногистохимического метода были выявлены особенности изменения содержания асН3К24 в клетках гиппокампа и неокортекса взрослых крыс после введения дексаметазона на 14–16-е или 17–19-е сут пренатального онтогенеза по сравнению с контрольной группой (рис. 1, II, рис. 3). Исследуемая модификация гистонов присутствовала во всех клетках мозга контрольных животных, и при общей тенденции к снижению общее количество иммунореактивных нейронов по асН3К24 уменьшалось только в области СА1 гиппокампа после введения дексаметазона на 17–19-е сут гестации (на 30.6 ± 12.9% , Р ≤ 0.05, n = 6) (рис. 3а). Основные изменения касались количества интенсивно окрашенных клеток по асН3К24. Так, в областях СА1 и ЗИ гиппокампа введение дексаметазона на 14–16-е и 17–19-е сут пренатального развития приводило к значимому снижению в обеих группах количества интенсивно окрашенных клеток по асН3К24: соответственно на 53.5 ± 14.1 и 76 ± 21.2% в СА1 и на 39.7 ± 13.5 и 87.8 ± 6.9% в ЗИ (для каждой группы Р ≤ ≤ 0.05, n = 6) (рис. 3б). В 5-м слое неокортекса обнаружено некоторое снижение уровня общего количества иммунопозитивных клеток (на 18.3 ± 12.2% по сравнению с контролем), а также значительное уменьшение количества интенсивно окрашенных клеток (на 55.1 ± 12.8%, Р ≤ 0.05, n = 6) при введении дексаметазона на 17–19-е, но не на 14–16-е сут пренатального онтогенеза (рис. 3в, 3г).
Рис. 3.
Влияние введения дексаметазона (ДМ) на 14−16-е и 17−19-е сут пренатального развития на изменения количества клеток, иммунопозитивных (ИП) к ацетилированию лизина 24 в гистоне Н3 (асН3К24) по сравнению с контролем (а, в) и на долю интенсивно окрашенных (ИО) клеток от общего количества ИП-клеток (б, г) в поле СА1 гиппокампа (а, б) и 5 м слое неокортекса (в, г) взрослых крыс. По вертикали – то же, что и на рис. 2. Зездочка показывает достоверность различия с контролем при Р ≤ 0.05.
ОБСУЖДЕНИЕ
Важную роль в регуляции транскрипции генов, отвечающих за развитие организма в норме и в условиях воздействия неблагоприятных факторов, играют эпигенетические механизмы, включающие: метилирование собственно ДНК и ковалентные посттрансляционные модификации гистонов – их ацетилирование, фосфорилирование, метилирование, убиквитинирование, сумоилирование. В период раннего онтогенеза эпигенетические факторы контролируют множество процессов, таких как пролиферация и дифференциация нейронов (Ma, Zhang, 2015), нейрогенез и специализация клеток (Rosset et al., 2003; Wegner, Stolt, 2005). Однако мало известно о молекулярных механизмах, опосредующих внешние и внутренние сигналы, приводящие к модификации хроматина в ходе развития центральной нервной системы.
Имеются данные, свидетельствующие, что стресс-индуцированное повышение уровня гормонов надпочечников (катехоламинов и глюкокортикоидов) в материнском организме во время беременности вызывает у потомков длительные нейрохимические и поведенческие эффекты, опосредованные эпигенетическими механизмами (Darnaudery, Maccari, 2008). Как было показано в наших исследованиях, введение синтетического гормона дексаметазона на 14–16-е и 17–19-е сут пренатального онтогенеза приводит к длительному (до 3-х мес) снижению уровня ацетилирования гистона асН3К24 в гиппокампе и неокортексе крыс. При этом было отмечено, что в области СА1 и ЗИ гиппокампа воздействие дексаметазона приводит к более выраженным изменениям количества иммунопозитивных и интенсивно иммунореактивных клеток по асН3К24, чем в 5-м слое неокортекса, что может быть объяснено несовпадением “временных окон” повышенной чувствительности этих областей мозга к действию дексаметазона.
Уменьшение асН3К24 согласуется с показанными нами ранее нарушениями экспрессии глюко- и минералокортикоидных рецепторов в тех же областях мозга крыс после введения дексаметазона на 14–16-е и 17–19-е сут гестации (Тюлькова, 2015), указывающими на изменение их активности в качестве транскрипционных факторов (Kodama et al., 2003).
Вызываемые введением дексаметазона изменения количества клеток с высоким содержанием асН3К24 в неокортексе и гиппокампе по степени и направленности отличаются от обнаруженных нами ранее модификаций ацетилирования гистонов Н3, вызываемых действием гипоксии (Тюлькова и др., 2017). Такие нарушения эпигенетической регуляции могут быть причиной выявленных нами ранее модификаций нейроэндокринной регуляции, глутаматергической сигнальной трансдукции и связанной с ней фосфоионозитидной и кальциевой сигнальными системами в гиппокампе и неокортексе взрослых крыс вследствие гипоксии или введения дексаметазона в те же сроки пренатального онтогенеза, которые также отличаются по степени выраженности и направленности (Тюлькова, 2015). Следует отметить, что и гипоксия, и введение дексаметазона в течение последней трети беременности приводят в конечном итоге к различным нарушениям поведения и способности к обучению (Ватаева и др., 2018).
Полученные данные могут иметь значение для клинической практики, поскольку способствуют выявлению механизмов нарушения формирования когнитивных расстройств, связанных с применением глюкокортикоидной терапии в период беременности, в частности, для предотвращения преждевременных родов.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2014–2020 годы (ГП-14, раздел 65), Российского фонда фундаментальных исследований (проект 17-04-01118-а), а также Программы поддержки биоресурсных коллекций ФАНО.
Вклад авторов: Е.И. Тюлькова, Л.А. Ватаева, О.В. Ветровой ответственны за разработку гипотезы, планирование экспериментов и написание статьи. О.В. Ветровой, В.А. Стратилов и К.В. Сариева осуществляли эксперименты. В.А. Стратилов и К.В. Сариева осуществляли статистический анализ.
Список литературы
Ватаева Л.А., Тюлькова Е.И., Алехин А.Н., Стратилов В.А. 2018. Влияние гипоксии или дексаметазона в различные сроки гестации на проявление условнорефлекторного страха у взрослых крыс. Журн. эволюц. биохим. и физиол. им. И.М.Сеченова. 54 (6): 404–410. (Vataeva L.A., Tyulkova E.I., Alehin A.N., Stratilov V.A. 2018. Influence of hypoxia or dexametezone in various terms of gestation on the conditional refractory fear application in adalt rats. J. Evol. Bichem. Physiol. 54 (6): 404–410.)
Науменко Е.В., Дыгало Н.Н., Маслова Л.Н. 1990. Длительная модификация стрессорной реактивности воздействиями в пренатальном онтогенезе: онтогенетические и генетико-эволюционные аспекты нейроэндокринной регуляции стресса. В кн.: Онтогенетические и генетико-эволюционные аспекты нейроэндокринной регуляции стресса. Новосибирск: Наука. 40–55. (Naumenko E.V., Dygalo N.N., Maslova L.N. 1990. Long modification of stressorny reactivity influences in prenatal ontogenesis: ontogenetichesky and genetiko-evolutionary aspects of neuroendocrine regulation of a stress. In: Ontogenetic and genetic-evolutionary aspects of neuroendocrine stress regulation. Novosibirsk: Nauka. 40–55 (in Russian.)
Тюлькова Е.И., Ватаева Л.А., Ветровой О.В., Романовский Д.Ю. 2015. Пренатальная гипоксия модифицирует рабочую память и активности полифосфоинозитидной системы гиппокампа крыс. Журн. эволюц. биохим. физиол. им. И.М. Сеченова. 51 (2): 115–121. (Tyulkova E.I., Vataeva L.A., Vetrovoi O.V., Romanovskii D.Y. 2015. Prenatal hypoxia modifies working memory and the activity of hippocampal polyphosphoinositides system in rats. J. Evol. Bichem. Physiol. 51 (2): 131–138.)
Тюлькова Е.И. 2015. Механизмы формирования патологических состояний мозга в ответ на воздействие гипоксии в пренатальном онтогенезе. Автореф. ... докт. дис. СПб. 40 с. (Tyulkova E.I. 2015. Mechanisms of formation of pathological conditions of a brain in response to influence of a hypoxia in prenatal ontogenesis. Abstract Doct. Thesis. St.-Petersburg. 40 p. (in Russian).)
Тюлькова Е.И., Ватаева Л.А. 2017. Формирование патологических реакций мозга при действии экстремальных факторов среды в различные сроки пренатального онтогенеза. Педиатр. 8 (S1): М332–М333. (Tulkova E.I., Vataeva L.A. 2018. Formation of the brain pathologic reactions to extreme environmental factors during different prenatal periods. Pediatrician. 8 (S1): M332–V333. (in Russian).)
Тюлькова Е.И., Ватаева Л.А., Глущенко Т.С., Пивина С.Г. 2013. Влияние пренатальной гипоксии на функцию гипофизарно-адренокортикальной системы и рабочую память у крыс. Фiзiологiчний журнал НАН Украiни. 59 (6): 117–124. (Tyulkova E.I., Vataeva L.A., Gluschenko T.S., Pivina S.G. 2013. Influence of a prenatal hypoxia on function pituitary-adrenal systems and working memory at rats. Int. J. Physiol.Pathophysiol. 6 (1): 1–11.)
Тюлькова Е.И., Ватаева Л.А., Самойлов М.О., Отеллин В.А. 2010. Механизмы формирования реакций мозга на действие гипобарической гипоксии в различные сроки пренатального периода развития крыс. Журнал акушерства и женских болезней. 59(4): 99–110. (Tyulkova E.I., Vataeva L.A., Samoilov M.O., Otellin V.A. 2010. The mechanisms of hypobaric hypoxia-induaed alteration in brain development. Influence of gestational age at exposure. J. Obstetrics Women’s Diseases. 59 (4): 99–110 (in Russian).)
Тюлькова Е.И., Ветровой О.В., Сариева К.В., Ватаева Л.А., Глущенко Т.С. 2017. Особенности ацетилирования гистона Н3 по Lys24 в гиппокампе и неокортексе крыс, переживших гипоксический стресс в различные сроки пренатального развития. Нейрохимия. 34(4): 310–316. (Tyulkova E.I, Vetrovoy O.V., Sarieva K.V., Vataeva L.A., Gluschenko T.S. 2017. The Characteristics of acetylation of histone H3 at Lys24 in the hippocampus and neocortex of rats that were exposed to hypoxic stress at different stages of prenatal development. Neurochem. J. 11: 309–314.)
Угрюмов М.В. 1999. Механизмы нейроэндокринной регуляции. М.: Наука. 299 с. (Ugrumov M.V. 1999. The mechanisms of neuroendocrine regulation. Moscow: Nauka. 299 p.)
Buss C., Davis E.P., Shahbaba B., Pruessner J., Head K., Sandman C.F. 2012. Maternal cortisol over the course of pregnancy and subsequent child amygdala and hippocampus volumes and affective problems. Proc. Natl. Acad. Sci. USA. 109: E1312–E319.
Chen M., Zhang L. 2011. Epigenetyc mechanisms in developmental programming of adalt disease. Drug Discov. Today. 16: 1007–1018.
Crowther C.A., Harding J. 2003. Repeat doses of prenatal corticosteroids for women at risk of preterm birth for preventing neonatal respiratory disease. Cochrane Database Systemat Rev. 1: CD003935.
Dammann O., Matthews S.G. 2001. Repeated antenatal glucocorticoid exposure and the developing brain. Pediatr. Res. 50: 563–564.
Darnaudery M., Maccari S. 2008. Epigenetic programming of the stress response in male and female rats by prenatal restraint stress. Brain Res. Rev. 57: 571–585.
Dudley K.J., Li X., Kobor M.S., Kippin T.E., Bredy T.W. 2011. Epigenetic mechanisms mediating vulnerability resilience to psychiatric disordes. Neurosci. Biobehav. Rev. 35: 1544–1551.
Dygalo N.N., Saharov D.G., Kalinina T.S., Shishkina G.T. 1999. Behavioral effects of single adverse exposure in a number of rat generations: the role of maternal glucocorticoids. Zhurnal Vysshey Nervnoy Deiatelnosti (Rus.; Neurosci. Behav. Physiol.). 49 (3): 489–494.
Egger G., Liang G., Aparicio A., Jones P.A. 2004. Epigenetics in human disease and prospects for epigenetic terapy. Nature. 429: 457–463.
Gluckman P.D., Yanson M.A., Cooper C., Thornburg K.I. 2008. Effect of in utero and early-life conditions on adalt health and desease. N. Engl. J. Med. 359: 61–73.
González-Ochoa R., Sánchez-Rodríguez E.N., Chavarría A., Gutiérrez-Ospina G., Romo-González T. 2018. Evaluating stress during pregnancy: do we have the right conceptions and the correct tools to assess it? J. Pregnancy. 2018: 4857065. doi 10.1155/2018/4857065
Hompes T., Vrieze E., Simons A., Jaspers L., Van Bussel J., Schops G., Gellens E., Van Bree R., Verhaeghe J., Spitz B., Demyttenaere K., Allegaert K., Van den Bergh B., Claes S. 2012. The influence of maternal cortisol and emotional state during pregnancy on fetal intrauterine growth. Pediatric Res. 72: 305–315.
Howerton C.L., Bale T.L. 2012. Prenatal programing: at the intersection of maternal stress and immune activation. Hormones Behavior. 62: 237–242.
Kodama T., Shimizu N., Yoshikawa N., Makino Y., Ouchida R., Okamoto K., Hisada T., Nakamura H., Morimoto C., Tanaka H. 2003. Role of the glucocorticoid receptor for regulation of hypoxia-dependent gene expression. J. Biol. Chem. 278: 33 384–33 391.
Ma Q., Zhang L. 2015. Epigenetic programming of hypoxic-ischemic encephalopathy in response to fetal hypoxia. Progr. Neurobiol. 124: 28–48.
Matthews S.G., Owen D., Banjanin S., Andrews M.H. 2002. Glucocorticoids, hypothalamo–pituitary–adrenal (HPA) development, and life after birth. Endocr. Res. 28: 709–718.
Miranda A., Sousa N. 2018 Maternal hormonal milieu influence on fetal brain development. Brain Behav. 8: e00920. doi 10.1002/brb3.920
Pryce C.R. 2008.Postnatal ontogeny of expression of the corticosteroid receptor genes in mammalian brains: inter-species and intra-species differences. Brain Res. Reviews. 57: 596–605.
Rice D., Barone S. 2000. Critical periods of vulnerability for the developing nervous system: evidence from humans and animal models. Envir. Health Persp. 108 : 511–533.
Ross S.E., Greenberg M.E., Stiles C.D. 2003. Basic helix-loop-helix factors in cortical development. Neuron. 39: 13–25.
Shishkina G.T., Kalinina T.S., Sournina N.Yu., Saharov D.G., Kobzev V.F., Dygalo N.N. 2002. Effects of antisense oligodeoxynucleotide to the alfa2A-adrenoreceptors on the plasma corticosterone level and on elevated plus-maze behavior in rats. Psychoneuroendocrinol. 27: 593–601.
Slotkin T.A., Kreider M.L., Tate C.A., Seidler F.J. 2006. Critical prenatal and postnatal periods for persistent effects of dexamethasone on serotonergic and dopaminergic systems. Neuropsychopharmacol. 31: 904–911.
Vilaca Junior P.E.A., Teixeira A.A.C., Wanderley-Teixeira V., Moraes E.F., Araujo A.C.C., Maia C.S. Morphological analysis of neonates of rats treated with dexamethasone in the initial phase of pregnancy. 2008. Int. J. Morphol. 26: 523–527.
Wan S., Hao R., Sun K. 2005. Repeated maternal dexamethasone treatments in late gestation increases 11beta-hydroxysteroid dehydrogenase type 1 expression in the hippocampus of the newborn rat. Neurosci Lett. 382: 96–101.
Wegner M., Stolt C.C. 2005. From stem cells to neurons and glia: a Soxist’s view of neural development. Trends Neurosci. 28: 583–588.
Xiong F., Zhang Y. 2013. Epigenetic programming of hypoxic-ischemic encephalopathy in response to fetal hypoxia. Front. Neuroendocrinol. 34: 27–46.
Дополнительные материалы отсутствуют.


