Цитология, 2019, T. 61, № 2, стр. 150-162
Характеристика опухолей, развившихся у бестимусных мышей после введения им злокачественно трансформированных ex vivo CD4+-Т-лимфоцитов человека
Д. Д. Жданов 1, 2, *, А. Н. Габашвили 1, 3, Ю. А. Гладилина 1, Д. В. Гришин 1, В. С. Покровский 1, 2, 4, М. В. Покровская 1, С. С. Александрова 2, А. А. Плясова 1, Н. Н. Соколов 2
1 Институт биомедицинской химии им. В.Н. Ореховича
119121 Москва, Россия
2 Российский университет дружбы народов
117198 Москва, Россия
3 Институт общей генетики им. Н.И. Вавилова РАН
119991 Москва, Россия
4 Российский онкологический научный центр им. Н.Н. Блохина Министерства здравоохраниения России
115478 Москва, Россия
* E-mail: zhdanovdd@mail.ru
Поступила в редакцию 05.09.2018
После доработки 18.09.2018
Принята к публикации 21.09.2018
Аннотация
Нормальные CD4+-Т-лимфоциты человека способны претерпевать злокачественную трансформацию при длительном культивировании в условиях повышенной экспрессии эндонуклеазы G (EndoG) и при воздействиях, повреждающих ДНК. Цель настоящей работы – биохимическая и цитогенетическая характеристика трансформированных ex vivo CD4+-Т-лимфоцитов человека, а также биохимическая и морфологическая характеристика опухолей, развившихся у бестимусных мышей после трансплантации им таких лимфоцитов. Активность теломеразы была значительно выше в образцах развившихся опухолей, при этом длина теломер в них была снижена по сравнению с контрольными нормальными клетками. В злокачественно трансформированных клетках обнаружен высокий уровень хромосомных аберраций. Злокачественная трансформация CD4+-Т-лимфоцитов и процессы опухолевого образования сопровождались изменением экспрессии генов белков, регулирующих клеточный цикл. По гистологическому строению новообразования соответствовали многокомпонентным Т-клеточным лимфомам и панникулитоподобным лимфомам. Таким образом, трансформированные CD4+-Т-лимфоциты способны образовывать злокачественные опухоли различной гистогенетической принадлежности.
В настоящее время функционирование системы теломер и теломеразы рассматривается как один из основных процессов, сопровождающих злокачественную трансформацию клеток. С одной стороны, активная теломераза большинства опухолевых клеток поддерживает длину теломер на достаточном для неограниченной пролиферации уровне (Blackburn, 2005). С другой стороны, укорочение теломер до критических значений в нормальных соматических клетках (без активной теломеразы) способствует их репликативному старению, развитию апоптоза или злокачественной трансформации (Hanahan, Weinberg, 2000; Zhdanov et al., 2017b). Накапливаются данные, подтверждающие взаимосвязь теломер-связанного репликативного старения и злокачественной трансформации клеток (Dimri, 2005; Campisi, 2013), вызванной в большинстве случаев факторами, повреждающими ДНК (Chen et al., 2007; d’Adda di Fagagna, 2008).
Ранее мы показали, что нормальные активированные CD4+-Т-лимфоциты человека способны претерпевать злокачественную трансформацию после длительного культивирования ex vivo в условиях постоянного нелетального повреждения ДНК, вызванного сверхэкспрессией апоптотической эндонуклеазы EndoG при трансфекции клеток геном эндонуклеазы G (EndoG) (Васина и др., 2017) или в результате постоянного действия повреждающего ДНК агента цисплатина (Жданов и др., 2017). Злокачественно трансформированные CD4+-Т-лимфоциты обладали иммунофенотипом Т-клеточной лимфомы и были способны образовывать опухоли у бестимусных мышей.
Цель настоящей работы – биохимическая и цитогенетическая характеристика трансформированных ex vivo CD4+-Т-лимфоцитов человека, а также биохимическая и морфологическая характеристика опухолей, развившихся у бестимусных мышей после трансплантации им таких лимфоцитов.
МАТЕРИАЛ И МЕТОДИКА
Материалы. В работе использовали: пробирки с антикоагулянтом K3EDTA (Greiner Bio-One, Австрия); фиколл Lympholite-H (Cedarlane, Канада); CD4+-Isolation Kit (human) (Miltenyi Biotec, Германия); культуральные флаконы 25 см2 (Corning, США); культуральную среду RPMI-1640 (Life technologies, США); IL-2, (R&D Systems, США); антитела анти-CD3 (МедБиоСпектр, Россия); антитела анти-CD28 (eBiosciences, США); плазмиду pEndoG-GFP (Clontech, США); цисплатин (цис-диаммин-дихлороплатина(II)) (Sigma, США); набор реагентов для выделения РНК PureLink RNA Mini Kit (Life Technologies, США); набор реагентов для реакционной смеси обратной транскрипции MMLV RT kit и смесь для ПЦР в реальном времени qPCRmix-HS SYBR (Evrogen, Россия); синтезированные на заказ праймеры (Синтол, Россия); набор реагентов для анализа экспрессии генов, вовлеченных в развитие опухолевого процесса RT2 Profiler Human Cell Cycle PCR Array (SA Biosciences, США); набор реагентов для выделения геномной ДНК PureLink Genomic DNA Mini Kit (Thermo Fisher Scientific Inc., США); конковалин А и гематоксилин (ПанЭко, Россия); колхицин и стекла для цитогенетического теста (Merck, Германия); реагент для криоблоков Tissue Tek O.C.T. Compound (Sakura Finetek, США); эозин (Биовитрум, Россия).
Получение злокачественно трансформированных ex vivo CD4+-Т-лимфоцитов человека. Исследование выполнено на клетках здоровых доноров и одобрено этическим комитетом Института биомедицинской химии им. В.Н. Ореховича. Письменное согласие получено от всех доноров, участвовавших в исследовании. Образцы венозной крови забирали в пробирки с антикоагулянтом K3EDTA. Из крови выделяли мононуклеарные клетки методом градиентного центрифугирования на фиколле Lympholite-H. Фракцию CD4+-Т-лимфоцитов получали методом магнитной селекции с использованием CD4+-Isolation Kit (human), по протоколу компании-производителя. Полученные клетки высевали в культуральные флаконы 25 см2 в концентрации 5 × 105 клеток на 1 мл среды. В работе использовали культуральную среду RPMI-1640, содержащую 10% эмбриональной телячьей сыворотки, IL-2 (100 Ед/мл), а также антитела анти-CD3 (5 мкг/мл) и антитела анти-CD28 (2 мкг/мл). Клетки культивировали в СО2-инкубаторе при 37°С, 5% СО2 и влажности 90% (Васина и др., 2017). Культивированные в течение 24 ч CD4+-Т-лимфоциты использовали в качестве контрольных клеток.
Злокачественную трансформацию свежевыделенных активированных CD4+-Т-лимфоцитов индуцировали путем длительного культивирования (35–61 сут) в условиях сверхэкспрессии EndoG после трансфекции плазмиды pEndoG-GFP или в присутствии 2 мкМ цисплатина по описанным ранее протоколам (Васина и др., 2017; Жданов и др., 2017).
Анализ экспрессии генов. Тотальную РНК из опухолевой ткани выделяли с помощью PureLink RNA mini kit по протоколу компании-производителя. Обратную транскрипцию (ОТ) и ПЦР в реальном времени проводили по методике, описанной нами (Zhdanov et al., 2017a). Для этого 5 мкг тотальной РНК подвергали реакции ОТ в 25 мкл реакционной смеси MMLV RT по протоколу компании-производителя. В качестве реакционной смеси для ПЦР в реальном времени использовали qPCRmix-HS SYBR с применением синтезированных на заказ праймеров. Для амплификации применяли систему детектирования ПЦР в реальном времени DTprime 5 и двухтемпературный режим реакции (отжиг праймеров и элонгация). Количество амплификатов определяли по флуоресценции в конце цикла элонгации. Стандартные кривые эффективности ПЦР строили по серийным разведениям (1 : 40, 1 : 80, 1 : 160 и 1 : 320) суммарных кДНК. Данные представляли в виде нормализованных уровней мРНК изучаемых генов по 18S рРНК, использовавшегося в качестве референсного гена с конститутивной экспрессией.
Анализ экспрессии генов, вовлеченных в развитие опухолевого процесса, изучали при помощи RT2 profiler human cell cycle PCR array в соответствии с рекомендацией компании-производителя при помощи системы детектирования ABI 7900HT (Applied Biosystems, США). Анализ полученных данных осуществляли при помощи программы SA Biosciences PCR array data analysis software (SA Bioscience», США). Тепловую карту уровней экспрессии генов строили при помощи программы интернет-ресурса ClustVis (Metsalu, Vilo, 2015).
Вестерн блотинг и определение активности теломеразы. Использовали метод TRAP (telomeric repeat amplification protocol), пользуясь описанным ранее протоколом (Жданов и др., 2016; Васина и др., 2017).
Абсолютную длину теломер определяли, используя методику ПЦР в реальном времени (Cawthon, 2002). Геномную ДНК выделяли при помощи PureLink genomic DNA mini kit (Thermo Fisher Scientific Inc., США). Длину теломер в каждом образце измеряли трижды. Для дальнейших расчетов брали усредненное значение. ДНК из контрольных клеток CD4+-T-клеток использовали как референсную.
Цитогенетический анализ. Злокачественно трансформированные клетки и нормальные, свежевыделенные из периферической крови CD4+-Т-лимфоциты культивировали в течение 24 ч в среде RPMI-1640 (Life Technologies, США), содержащей 20% эмбриональной телячьей сыворотки крупного рогатого скота (Gibco, США), 25 мкг/мл конковалина А и 0.004 мкг/мл колхицина. Для получения метафазных пластинок использовали стандартную методику инкубации в растворе 0.56%-ного KCl в течение 30 мин при 37°С. Хромосомы фиксировали смесью метанола и ледяной уксусной кислоты в соотношении 3 : 1, трижды меняя фиксирующий раствор. Препараты наносили на холодные влажные стекла и высушивали в течение 24 ч при 60°С. Дифференциальную окраску хромосом на G-полосы проводили красителем Гимзы после предварительной обработки препаратов трипсином (Ворсанова и др., 2010). Визуализацию препаратов осуществляли при помощи микроскопа Nikon Eclipse Ci-E (США) при увеличении объектива 75×. Анализ хромосомы проводили в соответствии с международной номенклатурой хромосом человека с использованием системы распознавания кариограммы ВидеоТесТ-Карио 3.1 (АргусСофт, Россия) в соответствии с правилами Международной цитогенетической номенклатуры (Shaffer et al., 2013). Анализировали морфологию хромосом, для отдельных метафазных пластинок составляли кариограммы. Анеуплоидии в настоящей работе не учитывали, так как для получения большого количества метафазных пластинок высокого качества использовали длительное (более 2 ч) культивирование клеток в присутствии колхицина. Для каждого образца анализировали 100 метафазных пластинок с целью оценки частоты хромосомных аберраций.
Гистологическое исследование. Самцы мышей линии Balb/c nude были разделены на две группы по 14 особей в каждой. Каждой мыши в группе вводили злокачественные EndoG-трансформированные клетки или клетки, трансформированные цисплатином (Жданов и др., 2016; Васина и др., 2017) подкожно в область бедра в количестве 1 × 106. Уже на 5-е сут после введения клеток формировались опухолевые узлы. Через 25 сут опухоль достигла размера 2006 ± 638 мм3 в группе мышей с введенными EndoG-трансформированными клетками и 2056 ± 269 мм3 в группе мышей с введенными клетками, трансформированными цисплатином. После развития опухолей до размера не менее 1 см в диаметре, четырех мышей из экспериментальных групп умерщвляли передозировкой эфирного наркоза, вскрывали и извлекали опухоли. Для гистологического исследования образцы опухолевой ткани заключали в реагент Tissue Tek O.C.T. Compound Sakura по протоколу компании-производителя (Finetek, США). Криосрезы толщиной 12–14 мкм получали на приборе Cryostat Microm HM 525 (Thermo Fisher Scientific Inc., США) и окрашивали гематоксилином и эозином. Микроскопию выполняли на микроскопе Carl Zeiss AxioVert.40 CFL (США).
Статистический анализ результатов проводили при помощи программы Statistica 9.0 (StatSoft Inc., США) с использованием t-критерия Стьюдента. Результаты представляли в виде средних значений и их стандартных отклонений. Значения считали статистически достоверными при P ≤ 0.05.
РЕЗУЛЬТАТЫ
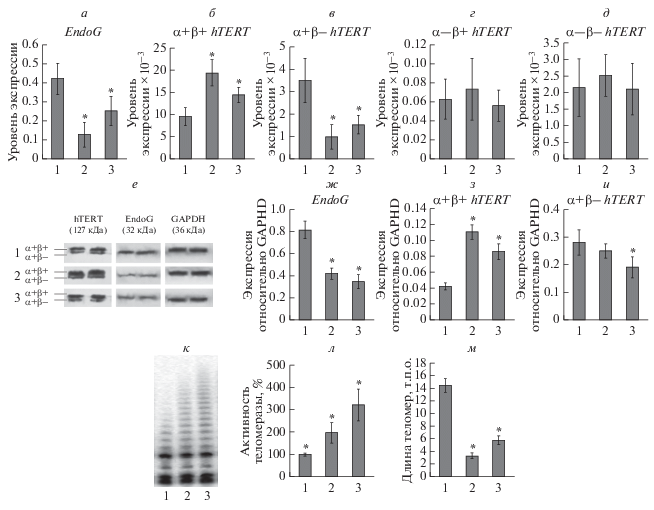
Повышенная активность теломеразы в опухолях, развившихся из злокачественно трансформированных клеток. Мы сравнили экспрессию EndoG и сплайс-варианты hTERT в контрольных (культивированных в течение 24 ч) CD4+-Т-клетках и в опухолях, развившихся из злокачественно трансформированных клеток. Методом ОТ-ПЦР в реальном времени установлено, что уровень экспрессии EndoG в опухолях животных обеих групп был ниже, чем в контрольных клетках (рис. 1а). Уровень экспрессии полноразмерного сплайс-варианта (α+β+hTERT) был выше (рис. 1б), в то время как экспрессия варианта (α+β–) была понижена (рис. 1в). Изменения экспрессии минорных сплайс-вариантов (α–β+) и (α–β–) не обнаружено (рис. 1г, 1д). Изменение количества исследуемых белков в развившихся опухолях подтверждено методом Вестерн-блотинга (рис. 1е–1и). Методом TRAP установлено, что в опухолях теломеразная активность примерно в 2–4 раза выше, чем в контрольных CD4+-Т-клетках (рис. 1к, 1л). Увеличенная активность теломеразы согласуется с повышенным уровнем экспрессии (α+β+)-сплайс-варианта hTERT, поскольку именно этот сплайс-вариант обладает каталитической активностью (Saebøe-Larssen et al., 2006). Длина теломер в опухолях была в 4–7 раз ниже, чем в контрольных клетках (рис. 1м).
Рис. 1.
Повышенная активность теломеразы в контрольных клетках CD4+-Т-клетках и в опухолях, развившихся из злокачественно трансформированных клеток. Уровни экспрессии EndoG (a) и сплайс-вариантов hTERT (б–д). CD4+-Т-клетки трансформированы в результате длительной культивации в условиях сверхэкспрессии EndoG или в присутствии цисплатина. Уровни экспрессии нормализованы к экспрессии референсного гена, кодирующего 18S рРНК. е – Вестерн-блот EndoG и сплайс-вариантов hTERT в контрольных клетках и образцах опухолей; ж–и – результаты определения количеств EndoG и сплайс-вариантов hTERT по отношению к GAPDH; к – гель-электрофорез TRAP в 0.5 мкг общего белка; л – результаты определения активности теломеразы методом TRAP; м – абсолютная длина теломер, измеренная методом ПЦР в реальном времени. Столбцы: 1 – контрольные клетки; 2, 3 – опухоли, развившиеся соответственно из злокачественно трансформированных CD4+-Т-клеток или в результате культивирования с цисплатином. Звездочка – достоверность отличия от контрольных клеток (P ≤ 0.05; n = 4).
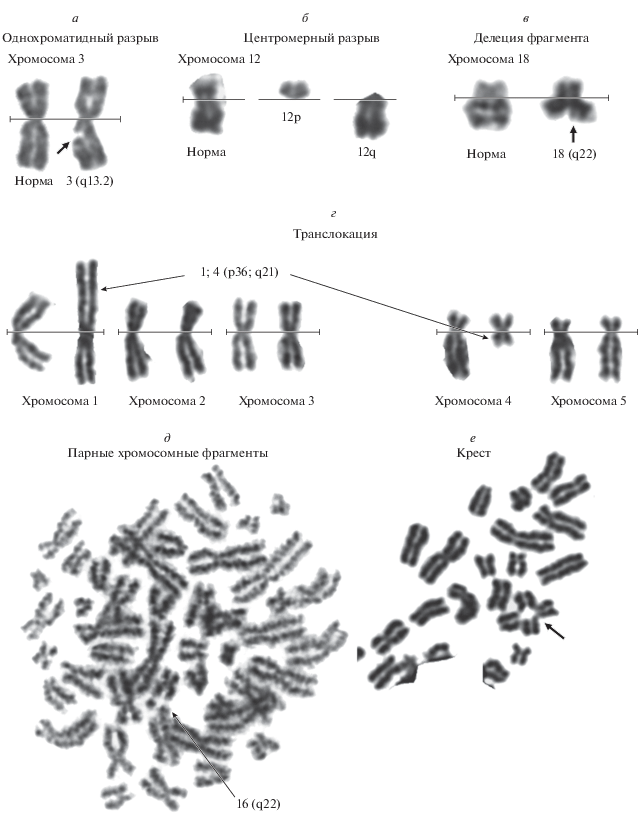
Хромосомные аберрации в злокачественно трансформированных клетках. Известно, что злокачественная трансформация клеток сопровождается множественными хромосомными аберрациями (Solomon et al., 1991). Мы провели цитогенетический анализ и определили количество и характер хромосомных аберраций в злокачественно трансформированных клетках. Как видно из табл. 1, общий уровень хромосомных нарушений был значительно выше в злокачественно трансформированных клетках. Наиболее часто наблюдались однонитевые разрывы хромосом, при этом таких хромосомных образований, как дицентрики и кольца, обнаружено не было (рис. 2). Доля клеток с хромосомными перестройками в контрольных CD4+-Т-лимфоцитах соответствовал популяционной норме и не превышала 1% (DeVore, 2001). Данные результаты указывают на множественные хромосомные изменения в злокачественно трансформированных клетках.
Таблица 1.
Хромосомные нарушения в контрольных CD4-Т-лимфоцитах и злокачественно трансформированных
| Хромосомные аберрации | Доля клеток с аберрациями хромосом, % (n = 4) | ||
|---|---|---|---|
| контрольные | злокачественно трансформированные клетки | ||
| EndoG | цисплатин | ||
| Все аберрации | 1.0 | 79.2 | 68.4 |
| Однохроматидные разрывы | 0.3 | 20.0 | 19.0 |
| Парные хромосомные фрагменты | 0.1 | 7.5 | 12.6 |
| Разрывы по центромере | 0.2 | 17.1 | 10.8 |
| Делеции | 0.1 | 12.3 | 4.3 |
| Дицентрики | 0 | 0 | 0 |
| Транслокации | 0.1 | 12.8 | 11.6 |
| Инверсии | 0.2 | 0 | 1.0 |
| Кольца | 0 | 0 | 0 |
| Кресты | 0 | 9.5 | 9.1 |
Рис. 2.
Репрезентативные изображения хромосомных аберраций в злокачественно трансформированных клетках. а – однохроматидный разрыв хромосомы 3; б – центромерный разрыв хромосомы 12; в – делеция фрагмента длинного плеча хромосомы 18; г –транслокация между хромосомами 1 и 4; д – парные хромосомные фрагменты хромосомы 16; е – крест.
Изменение экспрессии генов белков регуляции клеточного цикла в трансформированных клетках и опухолях. Поскольку злокачественно трансформированные CD4+-Т-клетки оказались способными образовывать быстроразвивающиеся опухоли, мы попытались определить белки, участвующие в регуляции клеточного цикла. Уровни экспрессии 28 генов в злокачественно трансформированных клетках и образованных ими опухолях определяли при помощи Human cell cycle RT2 Profiler PCR array. Результаты данного исследования показали, что экспрессия генов в материале опухолей аналогична экспрессии в трансформированных клетках (рис. 3а, 3б). Были обнаружены значительные изменения уровней экспрессии генов циклинов, ответственных за переход клеток между фазами клеточного цикла S и G2/M.
Рис. 3.
Уровни экспрессии генов белков, регулирующих клеточный цикл, в злокачественно трансформированных клетках и в развившихся их них опухолях. Тепловая карта уровней экспрессии генов в злокачественно трансформированных CD4+-Т-клетках в результате сверхэкспрессии EndoG или культивирования с цисплатином (а) и опухолях, развившиеся из злокачественно трансформированных CD4+ Т-клеток в результате сверхэкспрессии EndoG или культивирования с цисплатином (б). Уровни экспрессии генов нормализованы по отношению к усредненной экспрессии четырех референсных генов – 18S, GAPDH, HPRT1 и GUSB; n = 4. Результаты подвергнуты цветовому кодированию и представлены в виде уровней экспрессии относительно контрольных CD4+-Т-лимфоцитов.
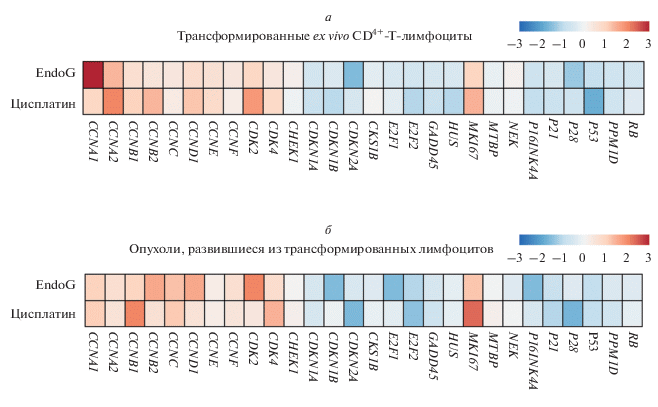
Экспрессия генов CCNA1, CCNA2, CCNB1, СCNB2, CCND1 и CCNE была повышена, в то время как экспрессии генов циклина CCNC, определяющего переход клеток между фазами G1/S, и белка семейства F-box CCNF оставалась неизменной (Satyanarayana, Kaldis, 2009). Экспрессия генов двух циклин-зависимых киназ CDK2 и CDK4 была увеличена, что сопровождалось снижением экспрессии генов ингибиторных белков CDKN1A, CDKN1B и CDKN2A. Также обнаружено уменьшение экспрессии генов белков-ингибиторов циклинов P16INK4A и P21, что характерно для активно пролиферирующих клеток (Ye et al., 2012). Выявлено повышение экспрессии гена ядерного белка, маркера и стимулятора клеточной пролиферации MKI67 (Sun, Kaufman, 2018). Известно, что злокачественная трансформация и опухолевый рост сопровождаются ингибированием функций противоопухолевых белков Р53 и RB (Campisi, 2005). Мы обнаружили значительное снижение экспрессии генов данных белков в клетках и опухолях. Наряду с пониженной экспрессией генa RB наблюдалась пониженная экспрессия генов его транскрипционных факторов E2F1 и E2F2.
Известно, что белок Р38 участвует в активации Р21-зависимой супрессии клеточного цикла (Todd et al., 2004). Мы обнаружили значительное уменьшение экспрессии Р38 и его активатора GADD45, а также гена Р21. Экспрессия регулятора клеточного цикла, вызывающего арест и блокировку репликации в ответ на множественные повреждения ДНК Hus1 (Balmus et al., 2016), была также снижена. Экспрессия генов серин/треониновых киназ NEK и CHEK1, участвующих в регуляции митоза (Pelegrini et al., 2010; Reissig et al., 2017), и MTBP, регулятора перехода клеток между фазами цикла, оставалась неизменной. Полученные результаты показали, что злокачественная трансформация CD4+-Т-лимфоцитов in vitro и процессы образования опухолей сопровождаются изменением экспрессии генов белков, регулирующих клеточный цикл.
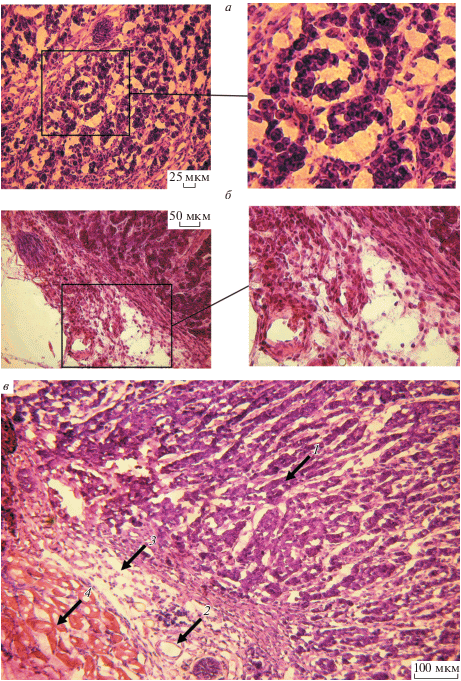
Гистологическая характеристика опухолей. Результаты гистологического исследования показали, что ксенографтные опухоли, развившиеся из клеток, трансформированных EndoG, и клеток, претерпевших злокачественную трансформацию в результате культивирования с цисплатином, кардинально различаются по своему строению.
На панорамных снимках срезов опухолевого узла, развившегося из клеток, культивировавшихся с цисплатином (рис. 4а), видна плотная структура опухоли – листы (плотные скопления, на срезе выглядящие как продолговатые структуры, образованные клетками, ограниченными друг от друга фиброзной тканью) Т-клеток, отделенные друг от друга хаотично пронизывающими опухолевую массу тяжами фиброзной ткани различной толщины (рис. 4б, 4д). Кроме того, в образцах можно обнаружить участки, представляющие собой сосудистую сеть (рис. 4в); внутри узла определяются участки кровоизлияний (рис. 4г). У клеток, составляющих опухолевый узел (рис. 5а), видны крупные ядра с одним или несколькими ядрышками. Фиброзная ткань состоит из веретеновидных, тонких, вытянутых клеток, по морфологии напоминающих фибробласты, и имеет в своей структуре коллаген. Сеть патологических сосудов (рис. 5б) дезорганизована, сами сосуды имеют различный диаметр, в некоторых сосудах прослеживается инвазия опухолевых клеток. На рис. 5в видно, как по мере своего развития опухолевые клетки постепенно инфильтрируют жировую ткань на периферии узла, а также проникают в мелкие сосуды. Таким образом, совокупность морфологических признаков позволяет классифицировать данный тип опухолей как многокомпонентные Т-клеточные лимфомы.
Рис. 4.
Строение опухолевого узла, развившегося из клеток, культивированных в присутствии цисплатина. а – панорамный снимок срезов опухолевого узла; б, в – гетерогенная структура узла, состоящая из плотной фиброзной ткани (б) и сосудистой сети (в); г – участок кровоизлияний; д – плотные скопления Т-клеток (звездочки), разграниченные рыхлыми волокнами фиброзной ткани различной толщины (стрелки). Об.: 10× (а) и 20× (б–д).
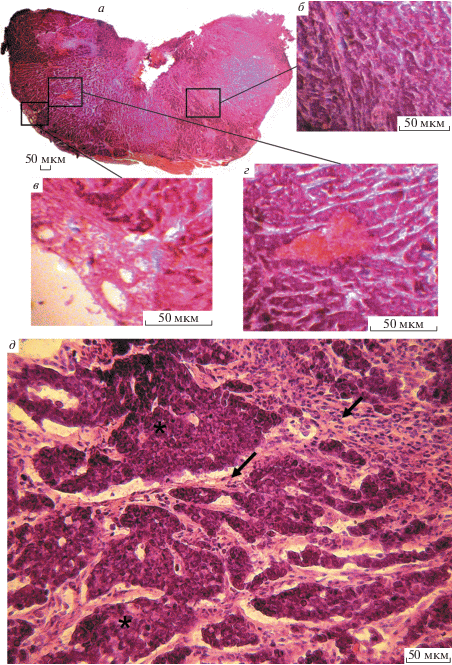
Рис. 5.
Признаки малигнизации опухоли, развившейся из клеток, культивированных в присутствии цисплатина. а – крупные опухолевые клетки с ядрами различных форм и размеров, окружены рыхлыми тонкими тяжами фиброзной ткани; б – рыхлая сеть полых патологических сосудов на периферии опухолевого узла; в – инфильтрация опухолевыми клетками жировой ткани и проникновение в мелкие сосуды: 1 – опухолевая ткань; 2 – кровеносные сосуды; 3 – включения жировой ткани; 4 – мышечные волокна. Об.: 40× (а, справа), 20× (б, справа) и 10× (в).
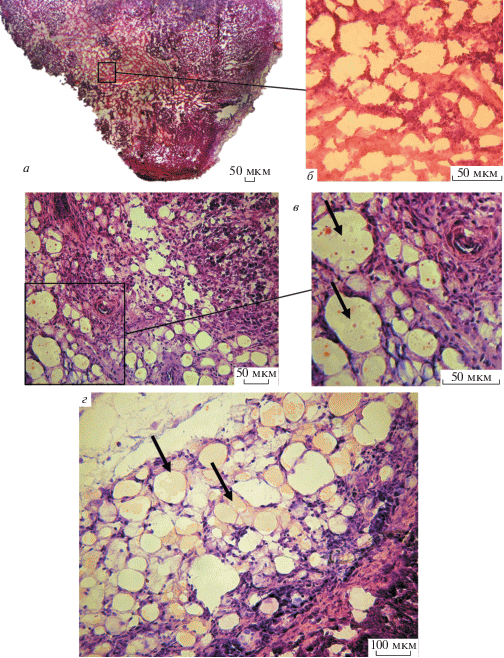
На панорамных снимках опухолей, развившихся из Т-клеток, трансформированных в результате сверхэкспрессии EndoG (рис. 6), обращает на себя внимание рыхлая структура опухолевого узла. Видно, что опухолевые клетки располагаются не так плотно и что волокна фиброзной ткани намного более тонкие (рис. 6а, 6б), чем в опухолях, происходящих из клеток, культивированных в присутствии цисплатина. При более детальном рассмотрении срезов становится очевидным, что по своей морфологии опухоль напоминает Т-клеточную панникулитоподобную лимфому (рис. 6в) (Jiang et al., 2015; Sugeeth et al., 2017). Для такой опухоли типичен диффузный инфильтрат в жировой ткани, который напоминает лобулярный панникулит. Отличительной чертой является расположение опухолевых клеток – они окаймляют адипоциты кольцами. Жировой компонент опухолей представлен скоплениями жировых клеток или их вкраплениями. Помимо этого, опухолевые узлы сильно васкуляризированы, сосуды также различны по своему диаметру и в своем большинстве заполнены эритроцитами (рис. 6г).
Рис. 6.
Строение опухолевого узла, развившегося из клеток, культивировавшихся в условиях сверхэкспрессии EndoG. а – панорамный снимок срезов опухолевого узла; б – рыхлая структура опухолевого узла, сформированного тонкими волокнами фиброзной ткани; в – лимфоидные клетки мелкого и среднего размеров, располагающиеся вокруг адипоцитов характерными кольцами (стрелки); г – рыхлая опухолевая ткань с сетью патологических кровеносных сосудов, эритроциты в просветах сосудов показаны стрелками. Об.: 20× (б, в, справа) и 10× (г).
ОБСУЖДЕНИЕ
В настоящее время механизмы злокачественной трансформации нормальных клеток и развития опухолей являются предметом особого внимания. Согласно современным представлениям, нормальная клетка превращается в опухолевую в результате мутаций, при нарушении регуляции генной активности или же в результате привнесения в ее генетический материал новой генетической информации онкогенными вирусами (Vineis et al., 2010). Большое внимание уделяется роли процессов повреждения ДНК и оксидативного стресса при канцерогенезе (Kryston et al., 2011). Ранее мы показали, что нормальные CD4+-Т-лимфоциты человека способны претерпевать злокачественную трансформацию при длительном культивировании в условиях нелетального повреждения ДНК, которые способны формировать быстроразвивающиеся опухоли и вызывать гибель бестимусных мышей (Васина и др., 2017; Жданов и др., 2017).
Активность теломеразы является одним из статистически наиболее достоверных маркеров злокачественной трансформации клеток и агрессивности опухолевого процесса (Hiyama, Hiyama, 2004). Поэтому активная теломераза, обнаруженная в опухолях, свидетельствует об их злокачественности. С другой стороны, теломераза активна как в контрольных CD4+-Т-лимфоцитах (Васина и др., 2017), так и в злокачественно трансформированных клетках, поэтому присутствие теломеразы в опухолях может быть связано и с этой особенностью лимфоцитов. Известно, что активность фермента регулируется уровнем синтеза ее каталитической субъединицы hTERT (Meyerson et al., 1997), а также процессом альтернативного сплайсинга мРНК hTERT (Жданов и др., 2016). Только полноразмерный сплайс-вариант обладает каталитической активностью.
Большинство сплайс-вариантов, а их в настоящее время обнаружено около двух десятков (Saebøe-Larssen et al., 2006), экспрессируются в минорных количествах, и их функция остается неизученной. Два сплайс-варианта составляют большую часть общей мРНК hTERT. Для α-варианта характерна делеция 36 нуклеотидов в экзоне 6, что вызывает удаление части обратно-транскриптазного домена белковой молекулы. В случае β-варианта наблюдается делеция экзонов 7 и 8, что приводит к появлению стоп-кодона в экзоне 10 и синтезу укороченной цепи молекулы hTERT (Ulaner et al., 1998). Мы обнаружили увеличение экспрессии полноразмерного сплайс-варианта hTERT в развившихся опухолях, что соотносится с увеличенной активностью теломеразы.
Апоптотическая эндонуклеаза EndoG способна инактивировать теломеразу, индуцируя АС hTERT и образование β-варианта, который функционирует как доминантно-негативный (Жданов и др., 2016). В изученных опухолях экспрессия EndoG была понижена, что также соотносится с повышенной активностью теломеразы. Активная теломераза в опухолевых клетках не восстанавливает длину теломер до уровня нормальных клеток, но постоянно поддерживает ее на уровне, достаточном для неограниченной пролиферации (Kim et al., 1994). Длина теломер в образцах развившихся опухолей была в 2.5–5 раз меньше, чем в контрольных клетках.
Мы не обнаружили каких-либо принципиальных различий молекулярно-биологических характеристик между группами опухолей, происходящих из клеток, трансформированных EndoG и цисплатином. Основные различия были обнаружены в морфологическом строении опухолей. Клетки, трансформированные цисплатином, образовывали Т-клеточные лимфомы, в то время как из клеток, трансформированных сверхэкспрессией EndoG, развивались панникулитоподобные лимфомы.
Результаты настоящей работы не позволяют дать ответ на вопрос о том, почему из клеток с фенотипом Т-клеточной лимфомы развились столь многокомпонентные солидные опухолевые образования. Вероятно участие стволовых клеток или раковых стволовых клеток в данном процессе. Накапливается все больше данных, подтверждающих способность мезенхимных стволовых клеток костного мозга к спонтанной и индуцированной злокачественной трансформации (Miura et al., 2006; Попов и др., 2009; Михайлов и др., 2010; Москалева и др., 2017). Накопление хромосомных нарушений является одной из причин злокачественной трансформации клеток (Miura et al., 2006). Мы обнаружили большое количество клеток с разнообразными хромосомными аберрациями в популяции клеток, трансформированных и EndoG, и цисплатином. В соответствии с предложенной моделью (Rodriguez et al., 2012), в клетках сначала образуются мутации, которые вызывают злокачественную трансформацию, а потом мутации, изменяющие способность клетки к дифференцировке и пролиферации. Это приводит к развитию сарком с клетками различных степеней и видов дифференцировки. Данная модель наилучшим образом способна объяснить появление многокомпонентных образований после введения злокачественных лимфоцитов.
Таким образом, полученные нами результаты свидетельствуют о том, что нормальные CD4+-Т-лимфоциты в стрессовых условиях, сопровождающихся увеличенной экспрессией EndoG или повреждением ДНК, способны претерпевать злокачественную трансформацию и формировать быстроразвивающиеся многокомпонентные лимфомы и панникулитоподобные лимфомы.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013–2020 гг.
Список литературы
Васина Д.А., Жданов Д.Д., Орлова Е.В., Орлова В.С., Покровская М.В., Александрова С.С., Соколов Н.Н. 2017. Апоптотическая эндонуклеаза EndoG вызывает ингибирование активности теломеразы и злокачественную трансформацию CD4+ Т клеток человека. Биохимия. 82 (1): 76–91. (Vasina D.A., Zhdanov D.D., Orlova E.V., Orlova V.S., Pokrovskaya M.V., Aleksandrova S.S., Sokolov N.N. 2017. Apoptotic endonuclease EndoG inhibits telomerase activity and induces malignant transformation of human CD4+ T cells. Biochemistry (Moscow). 82: 24–37.)
Ворсанова С.Г., Юров И.Ю., Колотий А.Д., Берешева А.К., Демидова И.А., Куринная О.С., Кравец B.C., Монахов В.В., Соловьев И.В., Юров Ю.Б. 2010. Хромосомный мозаицизм в материале спонтанных абортов: интерфазный молекулярно-цитогенетический анализ 650 случаев. Генетика. 46 (10): 1356–1359. (Vorsanova S.G., Iourov I.Y., Kolotii A.D., Beresheva A.K., Demidova I.A., Kurinnaya O.S., Kravets V.S., Monakhov V.V., Soloviev I.V., Yurov Y.B. 2010. Chromosomal mosaicism in spontaneous abortions: analysis of 650 cases. Russ. J. Genet. 46: 1197–1200.
Жданов Д.Д., Васина Д.А., Орлова Е.В., Орлова В.С., Покровская М.В., Александрова С.С., Соколов Н.Н. 2016. Регуляция альтернативного сплайсинга каталитической субъединицы теломеразы hTERT апоптотической эндонуклеазой EndoG. Биомедицинская химия. 62 (5): 544–554. (Zhdanov D.D., Vasina D.A., Orlova E.V., Orlova V.S., Pokrovskaya M.V., Aleksandrova S.S., Sokolov N.N. 2017. Apoptotic endonuclease EndoG regulates alternative splicing of human telomerase catalytic subunit hTERT. Biochemistry (Moscow), Suppl. Ser. B Biomed. Chem. 11: 154–165.)
Жданов Д.Д., Васина Д.А., Орлова Е.В., Орлова В.С., Покровский В.С., Покровская М.В., Александрова С.С., Соколов Н.Н. 2017. Индуцированная цисплатином экспрессия апоптотической эндонуклеазы EndoG вызывает ингибирование активности теломеразы и злокачественную трансформацию CD4+ Т-лимфоцитов человека, Биомед. химия. 63 (1): 13–26. (Zhdanov D.D., Vasina D.A., Orlova E.V., Orlova V.S., Pokrovsky V.S., Pokrovskaya M.V., Aleksandrova S.S., Sokolov N.N. 2017. Cisplatin-induced apoptotic endonuclease EndoG inhibits telomerase activity and causes malignant transformation of human CD4+ T lymphocytes. Biochemistry (Moscow). Suppl. Ser. B. Biomed. Chem. 11: 251–264.)
Михайлов В.М., Каминская Е.В., Попов Б.В., Кузоватов С.Н., Скрипкина Н.С., Косякова Г.П., Зайчик А.М., Гричук Т.М., Никольский Н.Н. 2010. Характеристика опухолей, развившихся после введения мышам mdx культивируемых мезенхимных стволовых клеток костного мозга мышей C57BL/6, экспрессирующих белок GFP. Цитология. 52 (10): 853–857. (Mikhailov V.M., Kaminskaya E.V., Popov B.V., Kuzovatov S.N., Skripkina N.S., Kosyakova G.P., Zaichik A.M., Grinchuk T.M., Nikolsky N.N. 2010. Characteristics of tumors developed in mdx mice after transplantation of GFP-positive mesenchymal stem cells isolated from bone marrow of transgenic C57BL/6 mice. Cell Tiss. Biol. (Tsitologiya). 4: 419–423.)
Москалева Е.Ю., Жорова Е.С., Семочкина Ю.П., Родина А.В., Высоцкая О.В., Глухов А.И., Чукалова А.А., Посыпанова Г.А., Сапрыкин В.П. 2017. Характеристика опухолей, развившихся у мышей после введения сингенных облученных мезенхимных стволовых клеток костного мозга. Цитология. 59 (4): 271–278. (Moskaleva E.Y., Zhorova E.S., Semochkina Yu.P., Rodina A.V., Vysotskaya O.V., Glukhov A.I., Chukalova A.A., Posypanova G.A., Saprykin V.P. 2017. Characteristics of tumors that have developed in mice injected with syngenic irradiated mesenchymal stem cells of bone marrow. Cell Tiss. Biol. (Tsitologiia). 11: 381–388.)
Попов Б.В., Петров Н.С., Михайлов В.М., Томилин А.Н., Алексеенко Л.Л., Гринчук Т.М., Зайчик А.М. 2009. Спонтанная трансформация и иммортализация мезенхимных стволовых клеток в культуре in vitro. Цитология. 51 (2): 91–102. (Popov B.V., Petrov N.S., Mikhailov V.M., Tomilin A.N., Alekseenko L.L., Grinchuk T.M., Zaichik A.M. 2009. Spontaneous transformation and immortalization of mesenchymal stem cells in vitro. Cell Tiss. Biol. (Tsitologiya). 3: 110–120.)
Balmus G., Lim P.X., Oswald A., Hume K.R., Cassano A., Pierre J., Hill A., Huang W., August A., Stokol T., Southard T., Weiss R.S. 2016. HUS1 regulates in vivo responses to genotoxic chemotherapies. Oncogene. 35: 662–669.
Blackburn E.H. 2005. Telomeres and telomerase: their mechanisms of action and the effects of altering their functions. FEBS Lett. 579: 859–862.
Campisi J. 2005. Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors. Cell. 120: 513–522.
Campisi J. 2013. Aging, cellular senescence, and cancer. Annu. Rev. Physiol. 75: 685–705.
Cawthon R.M. 2002. Telomere measurement by quantitative PCR. Nucleic Acids Res. 30: e47.
Chen J.-H., Hales C.N., Ozanne S.E. 2007. DNA damage, cellular senescence and organismal ageing: causal or correlative? Nucleic Acids Res. 35: 7417–7428.
d’Adda di Fagagna F. 2008. Living on a break: cellular senescence as a DNA-damage response. Nat. Rev. Cancer 8: 512–522.
DeVore G.R. 2001. The genetic sonogram: its use in the detection of chromosomal abnormalities in fetuses of women of advanced maternal age. Prenat. Diagn. 21: 40–55.
Dimri G.P. 2005. What has senescence got to do with cancer? Cancer Cell. 7: 505–12.
Hanahan D., Weinberg R.A. 2000. The hallmarks of cancer. Cell. 100: 57–70.
Hiyama E., Hiyama K. 2004. Telomerase detection in the diagnosis and prognosis of cancer. Cytotechnol. 45: 61–74.
Jiang Q., Xu Y., Li X., Peng Q., Cai H., Wang J. 2015. Progressive and painful wound as a feature of subcutaneous panniculitis-like T-cell lymphoma (SPTCL): report of a case and review of literature. Int. J. Clin. Exp. Pathol. 8: 735–742.
Kim N.W., Piatyszek M.A., Prowse K.R., Harley C.B., West M.D., Ho P.L., Coviello G.M., Wright W.E., Weinrich S.L., Shay J.W. 1994. Specific association of human telomerase activity with immortal cells and cancer. Science. 266: 2011–2015.
Kryston T.B., Georgiev A.B., Pissis P., Georgakilas A.G. 2011. Role of oxidative stress and DNA damage in human carcinogenesis. Mutat. Res. Mol. Mech. Mutagen. 711: 193–201.
Metsalu T., Vilo J. 2015. ClustVis: a web tool for visualizing clustering of multivariate data using principal component analysis and heatmap. Nucleic Acids Res. 43: W566–W570.
Meyerson M., Counter C.M., Eaton E.N., Ellisen L.W., Steiner P., Caddle S.D., Ziaugra L., Beijersbergen R.L., Davidoff M.J., Liu Q., Bacchetti S., Haber D.A., Weinberg R.A. 1997. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell. 90: 785–795.
Miura M., Miura Y., Padilla-Nash H.M., Molinolo A.A., Fu B., Patel V., Seo B.-M., Sonoyama W., Zheng J.J., Baker C.C., Chen W., Ried T., Shi S. 2006. Accumulated chromosomal instability in murine bone marrow mesenchymal stem cells leads to malignant transformation. Stem Cells. 24: 1095–1103.
Pelegrini A.L., Moura D.J., Brenner B.L., Ledur P.F., Maques G.P., Henriques J.A.P., Saffi J., Lenz G. 2010. Nek1 silencing slows down DNA repair and blocks DNA damage-induced cell cycle arrest. Mutagenesis. 25: 447–454.
Reissig K., Silver A., Hartig R., Schinlauer A., Walluscheck D., Guenther T., Siedentopf S., Ross J., Vo D.-K., Roessner A., Poehlmann-Nitsche A. 2017. Chk1 promotes DNA damage response bypass following oxidative stress in a model of hydrogen peroxide-associated ulcerative colitis through JNK inactivation and chromatin binding. Oxid. Med. Cell. Longev. 2017: 1–20. doi 10.1155/2017/9303158
Rodriguez R., Rubio R., Menendez P. 2012. Modeling sarcomagenesis using multipotent mesenchymal stem cells. Cell Res. 22: 62–77. doi 10.1038/cr.2011.157
Saebøe-Larssen S., Fossberg E., Gaudernack G. 2006. Characterization of novel alternative splicing sites in human telomerase reverse transcriptase (hTERT): analysis of expression and mutual correlation in mRNA isoforms from normal and tumour tissues. BMC Mol. Biol. 7: 26. doi 10.1186/1471-2199-7-26
Satyanarayana A., Kaldis P. 2009. Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms. Oncogene. 28: 2925–2939.
Shaffer L.G., McGowan-Jordan J., Schmid M. (Eds). 2013. ISCN. International Standing Committee on Human Cytogenetic Nomenclature. Karger. 140 p.
Solomon E., Borrow J., Goddard A.D. 1991. Chromosome aberrations and cancer. Science. 254: 1153–1160.
Sugeeth M.T., Narayanan G., Jayasudha A.V., Nair R.A. 2017. Subcutaneous panniculitis-like T-cell lymphoma. Proc. (Bayl. Univ. Med. Cent). 30: 76–77.
Sun X., Kaufman P.D. 2018. Ki-67: more than a proliferation marker. Chromosoma 127, 175–186. doi 10.1007/s00412-018-0659-8
Todd D.E., Densham R.M., Molton S.A., Balmanno K., Newson C., Weston C.R., Garner A.P., Scott L., Cook S.J. 2004. ERK1/2 and p38 cooperate to induce a p21CIP1-dependent G1 cell cycle arrest. Oncogene. 23: 3284–3295.
Ulaner G.A., Hu J.F., Vu T.H., Giudice L.C., Hoffman A.R. 1998. Telomerase activity in human development is regulated by human telomerase reverse transcriptase (hTERT) transcription and by alternate splicing of hTERT transcripts. Cancer Res. 58: 4168–4172.
Vineis P., Schatzkin A., Potter J.D. 2010. Models of carcinogenesis: an overview. Carcinogen. 31: 1703–1709.
Ye J., Huang X., Hsueh E. C., Zhang Q., Ma C., Zhang Y., Varvares M. A., Hoft D.F., Peng G. 2012. Human regulatory T- cells induce T-lymphocyte senescence. Blood. 120: 2021–2031.
Zhdanov D.D., Pokrovsky V.S., Pokrovskaya M.V., Alexandrova S.S., Eldarov M.A., Grishin D.V., Basharov M.M., Gladilina Y.A., Podobed O.V., Sokolov N.N. 2017a. Rhodospirillum rubrum L-asparaginase targets tumor growth by a dual mechanism involving telomerase inhibition. Biochem. Biophys. Res. Commun. 492. 282–288 doi 10.1016/j.bbrc.2017.08.078
Zhdanov D.D., Vasina D.A., Grachev V.A., Orlova E.V., Orlova V.S., Pokrovskaya M.V., Alexandrova S.S., Sokolov N.N. 2017b. Alternative splicing of telomerase catalytic subunit hTERT generated by apoptotic endonuclease EndoG induces human CD4+ T cell death. Eur. J. Cell Biol. 96: 653–664.
Дополнительные материалы отсутствуют.


