Цитология, 2019, T. 61, № 3, стр. 247-256
Механизмы регуляции амилоид-индуцированной проницаемости модельных липидных мембран полифенолами
С. С. Ефимова 1, *, О. С. Остроумова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: efimova@incras.ru
Поступила в редакцию 05.11.2018
После доработки 06.12.2018
Принята к публикации 10.12.2018
Аннотация
Работа посвящена изучению процессов формирования и функционирования амилоидогенными пептидами ионных каналов, патологическая агрегация и накопление которых является причиной различных нейродегенеративных расстройств. Исследовано влияние растительных полифенолов флоретина, бутеина, ресвератрола, изоликуритигенина, 4'-гидроксихалкона и кардамонина на порообразующую активность фрагмента 25-35 β-амилоидного пептида в бислойных липидных мембранах из пальмитоилфосфохолина. Показано, что введение в мембраноомывающие растворы флоретина, бутеина или изоликуритигенина до концентрации 20 мкМ приводит к росту макроскопического трансмембранного тока, индуцированного пептидом. При этом кардамонин, 4'-гидроксихалкон и ресвератрол не оказывают влияния на активность фрагмента 25-35 β-амилоидного пептида. Сопоставление результатов изучения влияния тестируемых полифенолов на электрические и эластические свойства модельных мембран и порообразующую способность фрагмента 25-35 β-амилоидного пептида позволило сделать вывод об отсутствии связи потенцирующего действия флоретина, бутеина и изоликуритигенина с изменениями физико-химических свойств липидных бислоев. Результаты, полученные с помощью конфокальной флуоресцентной микроскопии, указывают на возможную роль доменной организации липидного бислоя в порообразующей активности амилоидогенного пептида. Результаты электрофизиологических измерений, полученные для α-синуклеина (другого белка, формирующего β-склачатые ион-проницаемые поры), не противоречат предположению о связывании гидроксилированных в 7 положении А-цикла и в 4'-положении B-цикла полифенолов с открытым пропановым фрагментом с β-слоями, образованными амилоидными пептидами.
Распространенной гипотезой, связывающей нейротоксичность β-амилоидов и их мембранное действие, является предположение о формировании пептидами олигомерных ионных каналов (Arispe et al., 1993a, 1993b; Mirzabekov et al., 1994, 1996; Hirakura et al., 2000; Prangkio et al., 2012). Кольцевые структуры β-амилоидных агрегатов, обнаруженные с помощью атомно-силовой микроскопии, также свидетельствуют в пользу возможности формирования трансмембранных пор (Lin et al., 2001; Lal et al., 2007; Jang et al., 2009). Электрофизиологическими методами показано, что различные фрагменты β-амилоидного пептида способны формировать в модельных липидных мембранах потенциал-независимые ионные каналы преимущественно катионной селективности (Arispe et al., 1993a, 1993b; Mirzabekov et al., 1994, 1996; Hirakura et al., 2000; Quist et al., 2005; Zakharov et al., 2007; Nelson et al., 2007; Demuro et al., 2011). Считается, что наибольшей порообразующей и токсической активностью обладают олигомеры среднего размера, около 3–5 нм (Kayed et al., 2004; Prangkio et al., 2012). Компьютерное моделирование предполагает большое разнообразие каналов, которые могут быть образованы β-структурами (Tofoleanu, Buchete, 2012). Данные молекулярной динамики указывают на формирование подсостояний проводимости каналов за счет изменения степени олигомеризации амилоидных пептидов (Durell et al., 1994). Многообразие размеров таких структур (Lashuel et al., 2003; Kayed et al., 2004; Diociaiuti et al., 2006) может определять многоуровневую проводимость и различную катионную селективность β-амилоидных каналов (Arispe et al., 1993a, 1993b; Mirzabekov et al., 1994; Hirakura et al., 1999; Kourie et al., 2002). Теоретическое моделирование допускает и участие мембранных липидов в формировании трансмембранных пор β-амилоидами (Durell et al., 1994; Tofoleanu, Buchete, 2012).
Установление молекулярных механизмов образования амилоидами ионных каналов может стать недостающим ключом к пониманию патофизиологической роли порообразования этими пептидами. Первоочередным вопросом, который может быть решен в рамках работы с модельными липидными системами, является выявление механизмов регуляции мембранной активности амилоидных пептидов, в частности, фрагмента 25-35 β-амилоидного пептида (Aβ25-35). Удобным и успешно применяемым инструментом для изучения формирования и функционирования различных каналов являются растительные полифенолы (Rokitskaya et al., 2002; Hwang et al., 2003; Luchian, Mereuta, 2006; Ostroumova et al., 2010, 2011, 2012a, 2012b, 2014; Mereuta et al., 2008, 2011; Lundbaek et al., 2010; Efimova et al., 2014, 2016, 2018a, 2018b). Их использование позволило определить роль липидного микроокружения в функционировании различных каналов и выдвинуть предположение об их строении.
Ранее (Ефимова и др., 2015) было показано, что введение полифенола флоретина в мембраноомывающие растворы до концентрации 20 мкМ вызывает рост стационарного трансмембранного тока, индуцированного Aβ25-35, в бислоях из эквимолярной смеси диолеилфосфосерина и диолеилфосфоэтаноламина. При этом флорицин, генистеин и кверцетин не оказывают эффекта, подобного флоретину, Сравнение химических структур использованных полифенолов и результатов их действия на порообразующую активность Aβ25-35 позволило установить, что важную роль во взаимодействии Aβ25-35 и растительных полифенолов играет заряд пептида и наличие открытого пропанового фрагмента в молекуле полифенола.
Целью настоящей работы являлось исследование влияния растительных полифенолов с открытым пропановым фрагментом – бутеина, изоликуритигенина, 4'-гидроксихалкона, кардамонина и ресвератрола – на порообразующую активность Aβ25-35 в модельных липидных мембранах. Были поставлены следующие задачи: определить величины изменений количественных характеристик физико-химических свойств модельных липидных мембран при адсорбции полифенолов (дипольного потенциала мембран, фазового разделения компонентов липосом и термотропного поведения липидов); установить механизмы влияния полифенолов на порообразующую способность Aβ25-35.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали следующие реагенты: 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин (ПОФХ), 1,2-диолеил-sn-глицеро-3-фосхолин (ДОФХ), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДПФХ), сфингомиелин из мозга свиней (СМ) и 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-(лиззамин родамин) (ЛР-ДПФЭ) (Avanti Polar Lipids, США); флоретин, бутеин, ресвератрол, изоликуритигенин, 4'-гидроксихалкон, кардамонин, KCl, KOH, HEPES, пентан, этанол, гексадекан, нонактин, сорбитол, фрагмент 25-35 β-амилоидного пептида (Aβ25-35), α‑синуклеин (Sigma, США). Химические структуры полифенолов представлены в табл. 1.
Таблица 1.
Основные характеристики влияния полифенолов на свойства модельных липидных мембран и порообразующую активность амилоидогенных пептидов и белков
| Полифенол | Химическая структура | I∞/$I_{\infty }^{0}$ | I∞/$I_{\infty }^{0}$ | –Δφd, мВ | –ΔTm, °C | ΔT1/2, °C |
|---|---|---|---|---|---|---|
| Aβ25-35 | α-синуклеин | |||||
| Флоретин | 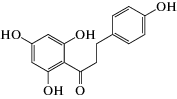 |
3.1 ± 0.7 | 4.6 ± 0.8 | 140 ± 7а | 4.4 ± 0.4 | 0.9 ± 0.2 |
| Бутеин | 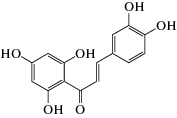 |
1.7 ± 0.5 | 1.6 ± 0.4 | 150 ± 12а | 4.8 ± 0.5 | 2.5 ± 0.3 |
| Изоликуритигенин | 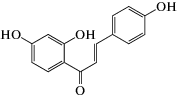 |
2.1 ± 0.1 | 1.7 ± 0.3 | 41 ± 12 | 6.2 ± 0.3 | 1.1 ± 0.2 |
| Кардамонин | 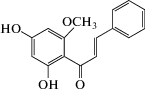 |
1.3 ± 0.2 | 1.0 ± 0.2 | 38 ± 9а | 5.2 ± 0.3 | 0.9 ± 0.1 |
| 4'-Гидроксихалкон | 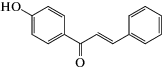 |
1.0 ± 0.1 | 1.1 ± 0.1 | 35 ± 10а | 5.7 ± 0.2 | 2.5 ± 0.1 |
| Ресвератрол | 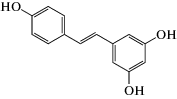 |
1.0 ± 0.1 | 0.9 ± 0.1 | 9 ± 7а | 3.3 ± 0.4 | 1.5 ± 0.1 |
Примечание. Для каждой из экспериментальных систем представлено среднее значение и его ошибка. С вероятностью 0.68 среднее значение генеральной совокупности находится в указанном интервале. I∞/$I_{\infty }^{0}$ – отношение стационарного трансмембранного тока, индуцированного Aβ25-35 или α-синуклеином в ПОФХ-мембранах, после (I∞) и до ($I_{\infty }^{0}$) введения полифенола в конечной концентрации концентрации 20 мкМ; Δφd – изменение дипольного потенциала мембран в присутствии 20 мкМ полифенола в растворах, омывающих ДОФХ-мембраны; ΔTm, ΔT1/2 – изменение температуры максимума и полуширины пика, соответствующего главному фазовому переходу ДПФХ при соотношении липид : полифенол 2 : 1. а по: Efimova et al., 2018.
Реконструкция ионных каналов в липидные бислои. Формирование мембран проводили по методу Монтала и Мюллера путем сведения конденсированных липидных монослоев на отверстии в тефлоной пленке, разделяющей экспериментальную камеру на два отделения (Montal, Mueller, 1972). Монослои формировали из ПОФХ в 0.1 M KCl (рН 7.4). Aβ25-35 и α‑синуклеин добавляли к водной фазе одного отделения камеры из водного раствора до определенной концентрации в диапазоне 30–60 и 1–3 мкМ соответственно. Полифенолы (флоретин, бутеин, изоликуритигенин, 4'-гидроксихалкон, ресвератрол, кардамонин) вводили в оба отделения камеры, используя маточные (20 мМ) растворы в диметилсульфоксиде, до конечной концентрации 20 мкМ. В условиях эксперимента часть молекул (от 16 до 55%) всех тестируемых полифенолов имеет отрицательный заряд. Поскольку действие полифенола на Aβ25--35-индуцированный ток не зависит от состава мембраны, вместо эквимолярной смеси диолеилфосфосерина и диолеилфосфоэтаноламина (Ефимова и др., 2015) в настоящей работе использовали однокомпонентные мембраны из ПОФХ. Электрофизиологические измерения проводили при комнатной температуре.
Измерения и оцифровку трансмембранных токов проводили в режиме фиксации потенциала с помощью Axopatch 200B и Digidata 1440A (Axon Instruments, США). Обработку записей трансмембранных токов осуществляли с применением программного пакета Clampfit 9.0 (Axon Instruments, США). Использовали 8-полярный фильтр Бесселя (Model 9002, Frequency Devices, США) и частоту фильтрации 1 кГц. Статистический анализ полученных данных проводили при помощи программы Origin 8.0 (OriginLab, США).
Среднее отношение (I∞/$I_{\infty }^{0}$) стационарного интегрального трансмембранного тока, индуцированного каналообразующим пептидом в присутствии (I∞) и отсутствие полифенола ($I_{\infty }^{0}$), определяли как среднее арифметическое значение и стандартное отклонение от среднего. Усреднение I∞/$I_{\infty }^{0}$ проведено для 3–5 независимых экспериментов.
В каждой из экспериментальных систем в случае всех методов результат выражали как среднее значение и его ошибка. С вероятностью 0.68 среднее значение генеральной совокупности находится в указанном интервале.
Определение изменения дипольного потенциала мембран (Δφd). При измерении Δφd мембраны формировали из ДОФХ в 0.1 М растворах KCl при рН 7.4 (5 мМ HEPES). Изоликуритигенин вводили в оба отделения камеры до конечной концентрации 20 мкМ. Поскольку при нейтральных значениях рН доля заряженных молекул изоликуритигенина составляет менее 16%, то считали, что рост нонактин-индуцированного тока обусловлен падением дипольной компоненты граничного потенциала мембран.
При введении изоликуритигенина Δφd определяли с использованием статистики Больцмана (Andersen et al., 1976). Среднее значение изменения дипольного потенциала мембран при адсорбции изоликуритигенина определяли как среднее арифметическое значение Δφd и ошибку среднего при измерении от 4 бислоев, как описано ранее в (Ефимова и Остроумова, 2015; Ефимова и др., 2017; Efimova et al., 2018b).
Конфокальная флуоресцентная микроскопия липосом. Гигантские одноламеллярные липосомы формировали из смеси ПОФХ/СМ (80/20 мол. %) с введенным в нее флуоресцентным липидным зондом ЛР-ДПФЭ (0.1 мол. %) в электрическом поле c помощью прибора “Nanion vesicle prep pro” (Германия), как описано ранее (Ефимова и Остроумова, 2017). В экспериментальные аликвотированные образцы вводили фрагмент Aβ25-35 до концентрации 7 мкМ без или вместе с полифенолами (400 мкМ флоретина, 4'-гидроксихалкона или ресвератрола). Липосомы наблюдали через иммерсионный объектив 100×/1.4 HCX PL микроскопа Leica TCS SP5 конфокальной лазерной системы Apo (Leica Microsystems, Германия) при комнатной температуре. Свечение ЛР-ДПФЭ регистрировали при длине волны возбуждения 543 нм (гелий-неоновый лазер). Согласно данным из литературы, ЛР-ДПФЭ в бислое с фазовым разделением встраивается в жидкую неупорядоченную фазу (ld), формируемую ПОФХ (Juhasz et al., 2010). При этом твердая упорядоченная фаза (so), обогащенная СМ, остается неокрашенной (Muddana et al., 2012).
Образец характеризовали частотой встречаемости (pi, %) гомогенных и гетерогенных везикул:
где i – тип фазового разделения липосом (ld или ld + so); Ni – число везикул в образце с определенным сценарием фазового разделения (0–50), N – общее число липосом в образце (не менее 50 в каждой системе). Для каждой системы проводили 5 независимых экспериментов.Сильное тушение флуоресценции ЛР-ДПФЭ в присутствии бутеина, изоликуритигенина и кардамонина не позволило исследовать влияние полифенолов на доменную организацию везикул.
Дифференциальная сканирующая микрокалориметрия модифицированных везикул. Гигантские одноламеллярные липосомы изготавливали из ДПФХ методом электроформации c помощью “Nanion vesicle prep pro” (напряжение 3 В, частота 10 Гц, 1 ч, 55°C). Концентрация липида составляла 3 мМ. В экспериментальные образцы вводили полифенолы в соотношении липид : полифенол равном 2 : 1. Термограммы липосомных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция). Воспроизводимости температурной зависимости теплоемкости достигали путем повторного нагревания образца сразу после охлаждения с постоянной скоростью 0.2 K/мин. Пики на термограммах характеризовали температурой максимума (Tm) и шириной на полувысоте (T1/2), отвечающей кооперативности фазового перехода ДПФХ. Измерение указанных выше параметров позволяет судить о термотропном поведении липидов при адсорбции растительных полифенолов.
РЕЗУЛЬТАТЫ
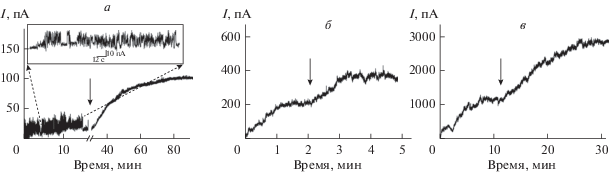
Рис. 1 демонстрирует действие флоретина, бутеина и изоликуритигенина на стационарный трансмембранный ток, индуцированный фрагментом Аβ25-35 (I∞) в ПОФХ-бислоях при трансмембранном напряжении 50 мВ. Видно, что указанные полифенолы вызывают рост I∞. В табл. 1 представлены средние отношения трансмембранного тока, индуцированного Аβ25-35, после и до введения различных полифенолов (I∞/$I_{\infty }^{0}$). Можно заключить, что флоретин, бутеин и изоликуритигенин потенцируют мультиканальную активность фрагмента Аβ25-35 (трансмембранный ток, протекающий через бислой, увеличивается более чем в два раза), в то время как другие протестированные полифенолы (4'-гидроксихалкон, кардамонин и ресвератрол) практически не влияют на индуцированный фрагментом трансмембранный ток (табл. 1).
Рис. 1.
Влияние полифенолов флоретина (а), бутеина (б) и изоликуритигенина (в) на стационарный ток I, индуцированный фрагментом Aβ25-35 в липидных бислоях из ПОФХ. Мембраны омываются 0.1 М KCl (pH 7.4). Моменты введения полифенолов в мембраноомывающие растворы до концентрации 20 мкМ указаны стрелками. Трансмембранное напряжение составляет 50 мВ. На вставке (а): пример записи трансмембранных токов, протекающих через Aβ25-35 каналы.
В табл. 1 также представлены средние значения падения дипольного потенциала (Δφd) фосфохолиновых мембран, вызванного адсорбцией изоликуритигенина. Для остальных тестируемых полифенолов показаны величины, полученные нами ранее (Efimova et al., 2018b). Можно заметить, что флоретин и бутеин вызывают значительное снижение дипольного потенциала мембран (около 150 мВ), уменьшение φd вследствие добавки изоликуритигенина, кардамонина и 4'-гидроксихалкона составляет не более 40 мВ, при этом ресвератрол диполь-модифицирующим действием в отношении фосфохолиновых бислоев не обладает.
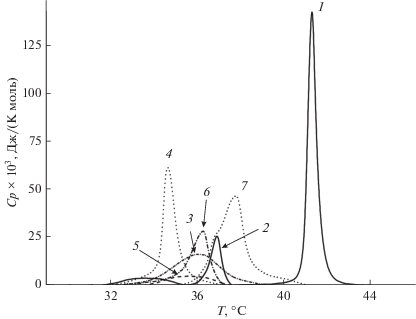
Рис. 2 показывает термограммы липосом из ДПФХ в отсутствие (контроль) и в присутствии флоретина, бутеина, изоликуритигенина, 4'-гидроксихалкона, кардамонина и ресвератрола при соотношении липид : полифенол, равном 2 : 1. Изменения термотропного поведения насыщенного фосфохолина можно оценить на основании параметров, характеризующих главный фазовый переход, в частности, температуры плавления (Tm) и ширины соответствующего пика на полувысоте, которая отвечает кооперативности фазового перехода (T1/2). В отсутствие модификаторов Tm ДПФХ составляет 41.4°C, а T1/2 равна 0.5°С. В табл. 1 представлены соответствующие величины изменения температуры и полуширины пика при фазовом переходе ДПФХ в липосомах, модифицированных полифенолами. Можно заметить, что все тестируемые полифенолы вызывают падение Tm и рост T1/2. Способность вызывать падение Tm возрастает в ряду ресвератрол ≤ флоретин ≤ бутеин ≈ кардамонин ≤ 4'-гидроксихалкон ≤ изоликуритигенин. Кооперативность перехода падает в ряду флоретин ≈ ≈ кардамонин ≈ изоликуритигенин ≤ ресвератрол < < бутеин ≈ 4'-гидроксихалкон.
Рис. 2.
Термограммы плавления ДПФХ (Ср(Т)) в отсутствие (1, контроль) и в присутствии флоретина (2), бутеина (3), изоликуритигенина (4), 4'-гидроксихалкона (5), кардамонина (6) и ресвератрола (7) при соотношении с липидом 1 : 2.
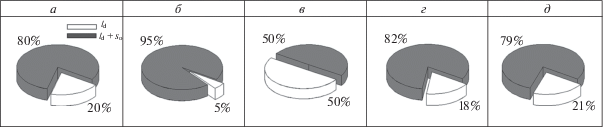
На рис. 3 представлены круговые диаграммы, построенные согласно формуле 1, которые демонстрируют вероятность обнаружения липосом с фазовым разделением в суспензии в отсутствие каких-либо агентов, в присутствии 7 мкМ Aβ25-35 или при одновременном введении того же количества Aβ25-35 и флоретина, 4'-гидроксихалкона или ресвератрола в конечной концентрации 400 мкМ. В отсутствие мембраноактивных соединений число везикул с твердыми упорядоченными доменами, обогащенными СМ (ld + so), равно 80% (рис. 3, а). Из сравнения рис. 3, а и 3, б видно, что инкубация ПОФХ/СМ (80/20 мол. %) липосом с Aβ25-35 (7 мкМ) приводит к 15%-ному росту числа везикул с доменами so. Введение флоретина к липосомам, обработанным амилоидным пептидом, вызывает 45%-ное уменьшение числа липосом с видимым фазовым разделением (рис. 3, в). При этом добавка 4'-гидроксихалкона (рис. 3, г) или ресвератрола (рис. 3, д) к везикулам, модифицированным Aβ25-35, не оказывает влияния на сценарий фазового разделения в мембранах липосом.
Рис. 3.
Круговые диаграммы, демонстрирующие вероятность обнаружения в суспензии липидных везикул с фазовым разделением: в отсутствие каких-либо мембраноактивных агентов (а), в присутствии 7 мкМ Aβ25-35 (б) или при одновременной добавке 7 мкМ Aβ25-35 и флоретина (в), 4'-гидроксихалкона (г) или ресвератрола (д) в концентрации 400 мкМ. На каждой диаграмме сектор, отвечающий процентному соотношению везикул с твердыми упорядоченными доменами (ld + so), окрашен в темно-серый цвет, сектор белого цвета характеризует относительное число гомогенно окрашенных липосом, пребывающих в жидком неупорядоченном состоянии (ld) и не демонстрирующих видимого фазового разделения. Липосомы сформированы из ПОФХ/СМ (80/20 мол. %) методом электроформации.
В табл. 1 представлены результаты влияния полифенолов на порообразующую активность α-синуклеина в ПОФХ-мембранах. Из табл. 1 видно, что, как и в случае Aβ25-35, флоретин, бутеин и изоликуритигенин вызывают рост I∞ приблизительно в 5, 1.5 и 2 раза соответственно. Добавка кардамонина, 4'-гидроксихалкона или ресвератрола практически не влияет на I∞ (табл. 1).
ОБСУЖДЕНИЕ
Растительные полифенолы известны своей способностью уменьшать дипольный потенциал мембран (Efimova, Ostroumova, 2012; Остроумова и др., 2013; Efimova et al., 2018b). На основании сравнения приведенных в табл. 1 величин I∞/$I_{\infty }^{0}$ и –∆φd при адсорбции тестируемых полифенолов можно говорить о том, что потенцирование порообразующей способности Аβ25-35 флоретином, бутеином и изоликуритигенином не является результатом изменения дипольного потенциала мембран этими полифенолами.
Согласно литературным данным некоторые полифенолы способны влиять на порообразующую способность антимикробных агентов посредством изменения трансмембранного распределения латеральной компоненты давления (Hwang et al., 2003; Chulkov, Ostroumova, 2016; Efimova et al., 2018a, 2018b). О модификации профиля латерального давления можно судить по изменению термотропного поведения мембранообразующих липидов, в частности, величин Tm и T1/2 в присутствии полифенолов. Наблюдаемое уменьшение Tm и увеличение T1/2 при введении полифенолов (табл. 1) можно объяснить их встраиванием между полярными “головками” ДПФХ. В результате увеличения площади, приходящейся на одну молекулу липида, подвижность углеводородных цепей липидов возрастает, T1/2 возрастает, а Tm падает. Отсутствие корреляции между способностью полифенолов потенцировать порообразующую активность Аβ25-35 и влиять на термотропное поведение ДПФХ (табл. 1) свидетельствует о том, что эффект флоретина, бутеина и изоликуритигенина не связан с модификацией эластических свойств мембраны этими полифенолами.
Результаты, полученные методом флуоресцентной конфокальной микроскопии липосом (рис. 3), указывают на существенную роль доменной организации липидного бислоя в мембранной активности амилоидных пептидов. Считается, что липидные упорядоченные домены могут выступать точками концентрации и нуклеации амилоидных пептидов (Sasahara et al., 2013). Как показано нами ранее, растительные полифенолы способны влиять на величину несоответствия толщины углеводородного кора между доменами, находящимися в упорядоченном и неупорядоченном состоянии (Ефимова, Остроумова, 2017). Можно думать, что под действием флоретина изменяется размер амилоид-индуцированных упорядоченных доменов: домены макроскопических размеров трансформируются в более мелкие, имеющие нанометровый размер и не определяемые методом конфокальной флуоресцентной микроскопии. Благодаря разделению в присутствии полифенолов крупных обогащенных амилоидами доменов на более мелкие, может увеличиваться длина границы между упорядоченной и неупорядоченной фазой. Если предположить, что амилоидные каналы локализуются на границе упорядоченных доменов, в зоне несоответствия толщины углеводородного остова мембраны в упорядоченном и неупорядоченном состоянии, то введение полифенола приведет к росту интегрального Аβ25-35-индуцированного трансмембранного тока в виду увеличения возможности встраивания амилоидных каналов в область раздела липидных фаз.
Ранее в работе было показано, что добавка флоретина до концентрации 20 мкМ в мембраноомывающие растворы вызывает рост стационарного трансмембранного тока, индуцированного Аβ25-35 (Ефимова и др., 2015). При этом флорицин, генистеин и кверцетин подобного флоретину эффекта не оказывают. С использованием других амилоидогенных пептидов, характеризующихся различным интегральным зарядом, было установлено, что одним из механизмов, ответственным за рост амилоид-индуцированного тока, является электростатическое взаимодействие между положительно заряженным каналообразующим агентом и отрицательно заряженным полифенолом. Учитывая что кверцетин и генистеин, несмотря на отрицательный заряд, не оказывали действия на Аβ25-35-индуцированный трансмембранный ток, было сделано заключение, что это условие необходимо, но недостаточно для наблюдаемого эффекта. Важным фактором оказалось наличие открытого пропанового фрагмента у молекул полифенола, то есть его конформация.
Это может свидетельствовать в пользу того, что наблюдаемый рост стационарного трансмембранного тока, индуцированного Аβ25-35, в присутствии флоретина, бутеина и изоликуритигенина, может быть результатом непосредственного взаимодействия молекул полифенола с β-структурами. Сравнительный анализ структур тестируемых полифенолов и их эффектов в отношении Аβ25-35-индуцированного трансмембранного тока, позволяет предположить существование определенного структурного мотива в молекулах полифенолов, который ответственен за взаимодействие полифенолов с β-структурами. Все полифенолы, потенцирующие активность амилоидов, имеют ОН-группы в 7 положении А-цикла и в 4'-положении B-цикла и открытый трехуглеродный фрагмент, связывающий кольца А и В. Оценка расстояния между ОН-группами в положениях 7- и 4' молекул флоретина, бутеина и изоликуритигенина была проведена нами путем геометрической оптимизации эллипсоидами с использованием HyperChem 7.0. Полученные результаты указывают на то, расстояние между указанными гидроксильными группами в молекулах флоретина, бутеина и изоликуритигенина составляет порядка 1.0–1.1 нм. При этом аппроксимация эллипсоидом молекул других тестируемых полифенолов (кардамонина и 4'-гидроксихалкона), не имеющих ОН-группы в 4'-положении кольца В или характеризующимися меньшим размером углеродного фрагмента между кольцами А и В, в частности, ресвератрола, дает максимальный размер молекул 0.7–0.8 нм. Согласно литературным данным расстояние между соседними β-листами равно 1.0–1.2 нм (Hamley, 2007; Groenning, 2010). Вероятно, благодаря открытому углеродному фрагменту гидроксилированных в положениях 7 и 4' молекул полифенолов и их высокой конформационной подвижности обеспечивается тонкая подстройка при их встраивании и связывании с соседними β-листами.
Для проверки предположения о специфическом взаимодействии некоторых полифенолов с β-структурами в работе был использован другой амилоидогенный белок α-синуклеин, N-концевой домен которого положительно заряжен. Согласно литературным данным, α-синуклеин способен образовывать небольшие олигомеры, характеризующиеся высоким процентом β-складчатости (Pfefferkorn et al., 2012) и способные формировать в модельных и клеточных мембранах ион-проницаемые поры (Zakharov et al., 2007; van Rooijen et al., 2010). Результаты наших измерений показали, что в присутствии флоретина, бутеина и изоликуритигенина, аналогично случаю с Аβ25-35, наблюдается рост α-синуклеин-индуцированного трансмембранного тока, в то время как другие тестируемые полифенолы величину I∞ не изменяют (табл. 1). Таким образом, полученные результаты не противоречат предположению о непосредственном взаимодействии молекул полифенолов с β-структурами.
Таким образом, полученные в работе результаты позволяют сделать вывод о связывании гидроксилированных в положении 7 А-цикла и в положении 4' B-цикла полифенолов с открытым пропановым фрагментом с β-структурами амилоидогенных белков и пептидов. Вызываемый флоретином, бутеином и изоликуритигенином рост порообразующей активности амилоидогенных пептидов и белков с одной стороны, и нейропротекторное действие полифенолов с другой, ставят под сомнение участие амилоидных пор в патогенезе нейродегенеративных расстройств.
Авторы выражают благодарность Ф.А. Гурневу за предоставление α-синуклеина и обсуждение результатов работы.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект 16-04-00806) (результаты по влиянию халконов на мембранную активность амилоидогенных пептидов) и Российского научного фонда (проект 17-74-10137) (результаты по влиянию полифенолов на термотропное поведение липидов). С.С. Ефимова отмечена именной стипендией Президента РФ (СП-484.2018.4).
Список литературы
Ефимова С.С., Захаров В.В., Остроумова О.С. 2015. Влияние дипольных модификаторов на каналообразующую активность амилоидных и амилоидоподобных пептидов в липидных бислоях. Цитология. 57 (2) : 144–152. (Efimova S.S., Zakharov V.V., Ostroumova O.S. 2015. Effects of dipole modifiers on the channel-forming activity of amyloid and amyloid-like peptides in lipid bilayers. Cell Tiss. Biol. 9 (3) : 250–259.)
Ефимова С.С., Остроумова О.С. 2017. Дипольные модификаторы – регуляторы латеральной гетерогенности липидных мембран. Акта Натура. 9 (2) : 67–75. (Efimova S.S., Ostroumova O.S. 2017. Dipole modifiers are regulators of the lateral heterogeneity of lipid membranes. Acta Naturae. 9 (2) : 67–74.)
Ефимова С.С., Остроумова О.С. 2015. Модификаторы дипольного потенциала липидных бислоев. Акта Натура. 7 (4) : 73–82. (Efimova S.S., Ostroumova O.S. 2015. Modifiers of the dipole potential of lipid bilayers. Acta Naturae. 7 (4) : 70–79.)
Ефимова С.С., Щагина Л.В., Остроумова О.С. 2017. Диполь-модифицирующее действие стирилпиридиновых красителей и флавоноидов на модельные мембраны различного состава. Цитология. 59 (3) : 229–235. (Efimova S.S., Schagina L.V., Ostroumova O.S. 2017. Dipole-modifying effect of styrylpyridinium dyes and flavonoids on the model membranes of different lipid compositions. Cell Tiss. Biol. 11 (4) : 335–341.)
Остроумова О.С., Ефимова С.С., Щагина Л.В. 2013. Изменения дипольного потенциала фосфолипидных мембран при адсорбции флавоноидов. Биофизика. 58 (3) : 474–480. (Ostroumova O.S., Efimova S.S., Schagina L.V. 2013. Changes of dipole potential of phospholipid membranes resulted from flavonoid adsorption. Biophysics (Moscow). 58 (3) : 366–372.)
Arispe N., Pollard H.B., Rojas E. 1993a. Giant multilevel cation channels formed by Alzheimer disease amyloid beta-protein [A beta P-(1-40)] in bilayer membranes. Proc. Nat. Acad. Sci. USA. 90 : 10573–10577.
Arispe N., Rojas E., Pollard H.B. 1993b. Alzheimer disease amyloid beta protein forms calcium channels in bilayer membranes: blockade by tromethamine and aluminum. Proc. Nat. Acad. Sci. USA. 90 : 567–571.
Chulkov E.G., Ostroumova O.S. 2016. Phloretin modulates the rate of channel formation by polyenes. Biochim. Biophys. Acta. 1858 (2) : 289–294.
Demuro A., Smith M., Parker I. 2011. Single-channel Ca(2+) imaging implicates Aβ1-42 amyloid pores in Alzheimer’s disease pathology. J. Cell. Biol. 195 : 515–524.
Diociaiuti M., Polzi L.Z., Valvo L., Malchiodi-Albedi F., Bombelli C., Gaudiano M.C. 2006. Calcitonin forms oligomeric pore-like structures in lipid membranes. Biophys. J. 91 : 2275–2281.
Durell S.R., Guy H.R., Arispe N., Rojas E., Pollard H.B. 1994. Theoretical models of the ion channel structure of amyloid beta-protein. Biophys. J. 67 : 2137–2145.
Efimova S.S., Ostroumova O.S. 2012. Effect of dipole modifiers on the magnitude of the dipole potential of sterol-containing bilayers. Langmuir. 28: 9908–9914.
Efimova S.S., Schagina L.V., Ostroumova O.S. 2014. Channel forming activity of cecropins in lipid bilayers. Effect of agents modifying the membrane dipole potential. Langmuir. 30 : 7884–7892.
Efimova S.S., Zakharova A.A., Ismagilov A.A., Schagina L.V., Malev V.V., Bashkoriv P.V., Ostroumova O.S. 2018a. Lipid-mediated regulation of pore-forming activity of syringomycin E by thyroid hormones and xanthene dyes. Biochim. Biophys. Acta.-Biomembr. 1860 : 691–699.
Efimova S.S., Zakharova A.A., Medvedev R.Ya., Ostroumova O.S. 2018b. Ion channels induced by antimicrobial agents in model lipid membranes are modulated by plant polyphenols through surrounding lipid media. J. Membr. Biol. 251 : 551–562.
Efimova S.S., Zakharova A.A., Schagina L.V., Ostroumova O.S. 2016. Two types of syringomycin E channels in sphingomyelin-containing bilayers. Eur. Biophys. J. 45 : 91–98.
Groenning M. 2010. Binding mode of Thioflavin T and other molecular probes in the context of amyloid fibrils-current status. J. Chem. Biol. 3 : 1–18.
Hamley I.W. 2007. Peptide fibrillization. Angew. Chem. Int. Ed. Engl. 46 : 8128–8147.
Hirakura Y., Lin M.C., Kagan B.L. 1999. Alzheimer amyloid abeta1-42 channels: effects of solvent, pH, and Congo Red. J. Neurosci. Res. 57 : 458–466.
Hirakura Y., Yiu W.W., Yamamoto A., Kagan B.L. 2000. Amyloid peptide channels: blockade by zinc and inhibition by Congo red (amyloid channel block). Amyloid. 7 : 194–199.
Hwang T.C., Koeppe R.E., Andersen O.S. 2003. Genistein can modulate channel function by a phosphorylation-independent mechanism: importance of hydrophobic mismatch and bilayer mechanics. Biochemistry. 42 : 13646–13658.
Jang H., Arce F.T., Capone R., Ramachandran S., Lal R., Nussinov R. 2009. Misfolded amyloid ion channels present mobile beta-sheet subunits in contrast to conventional ion channels. Biophys. J. 97 : 3029–3037.
Juhasz J., Davis J.H., Sharom F.J. 2010. Fluorescent probe partitioning in giant unilamellar vesicles of ‘lipid raft’ mixtures. Biochem. J. 430 : 415–423.
Kayed R., Sokolov Y., Edmonds B., McIntire T.M., Milton S.C., Hall J.E., Glabe C.G. 2004. Permeabilization of lipid bilayers is a common conformation-dependent activity of soluble amyloid oligomers in protein misfolding diseases. J. Biol. Chem. 279 : 46363–46366.
Kourie J.I., Culverson A.L., Farrelly P.V., Henry C.L., Laohachai K.N. 2002. Heterogeneous amyloid-formed ion channels as a common cytotoxic mechanism: implications for therapeutic strategies against amyloidosis. Cell Biochem. Biophys. 36 : 191–207.
Lal R., Lin H., Quist A.P. 2007. Amyloid beta ion channel: 3D structure and relevance to amyloid channel paradigm. Biochim. Biophys. Acta. 1768 : 1966–1975.
Lashuel H.A., Hartley D.M., Petre B.M., Wall J.S., Simon M.N., Walz T., Lansbury P.T. 2003. Mixtures of wild-type and a pathogenic (E22G) form of Abeta40 in vitro accumulate protofibrils, including amyloid pores. J. Mol. Biol. 332 : 795–808.
Lin H.A.I., Bhatia R., Lal R. 2001. Amyloid beta protein forms ion channels: implications for Alzheimer’s disease pathophysiology. FASEB J. 13 : 2433–2444.
Luchian T., Mereuta L. 2006. Phlorizin- and 6-ketocholestanol-mediated antagonistic modulation of alamethicin activity in phospholipid planar membranes. Langmuir. 22 : 8452–8457.
Lundbaek J.A., Koeppe R.E., Andersen O.S. 2010. Amphiphile regulation of ion channel function by changes in the bilayer spring constant. Proc. Nat. Acad. Sci. USA. 107 : 15427–15430.
Mereuta L., Asandei A., Luchian T. 2011. Meet me on the other side: trans-bilayer modulation of a model voltage-gated ion channel activity by membrane electrostatics asymmetry. PLoS One. 6: e25276.
Mereuta L., Luchian T., Park Y., Hahm K.S. 2008. Single-molecule investigation of the interactions between reconstituted planar lipid membranes and an analogue of the HP(2-20) antimicrobial peptide. Biochem. Biophys. Res. Commun. 373 : 467–472.
Mirzabekov T.A., Lin M.C., Kagan B.L. 1996. Pore formation by the cytotoxic islet amyloid peptide amylin. J. Biol. Chem. 271 : 1988–1992.
Mirzabekov T., Lin M.C., Yuan W.L., Marshall P.J., Carman M., Tomaselli K., Lieberburg I., Kagan B.L. 1994. Channel formation in planar lipid bilayers by a neurotoxic fragment of the beta-amyloid peptide. Biochem. Biophys. Res. Commun. 202 : 1142–1148.
Montal M., Muller P. 1972. Formation of bimolecular membranes from lipid monolayers and study of their electrical properties. PNAS USA. 65 : 3561–3566.
Muddana H.S., Chiang H.H., Butler P.J. 2012. Tuning membrane phase separation using nonlipid amphiphilies. Biophys. J. 102 : 489–497.
Nelson O., Tu H., Lei T., Bentahir M., de Strooper B., Bezprozvanny I. 2007. Familial Alzheimer disease-linked muta-tions specifically disrupt Ca2+ leak function of presenilin 1. J. Clin. Invest. 117 : 1230–1239.
Ostroumova O.S., Efimova S.S., Mikhailova E.V., Schagina L.V. 2014. The interaction of dipole modifiers with amphotericin-ergosterol complexes. Effects of phospholipid and sphingolipid membrane composition. Eur. Biophys. J. 43 : 207–215.
Ostroumova O.S., Efimova S.S., Schagina L.V. 2012a. Probing amphotericin B single channel activity by membrane dipole modifiers. PLoS One. 7: e30261. doi 10.1371/journal.pone.0030261
Ostroumova O.S., Efimova S.S., Chulkov E.G., Schagina L.V. 2012b. The interaction of dipole modifiers with polyene-sterol complexes. PLoS One. 7, e45135. doi 10.1371/journal.pone.0045135
Ostroumova O.S., Efimova S.S., Schagina L.V. 2011. 5- and 4'-hydroxylated flavonoids affect voltage gating of single alpha-hemolysin pore. Biochim. Biophys. Acta. Biomembr. 1808 : 2051–2058.
Ostroumova O.S., Malev V.V., Ilin M.G., Schagina L.V. 2010. Surfactin activity depends on the membrane dipole potential. Langmuir. 26 : 15092–15097.
Pfefferkorn C.M., Jiang Z., Lee J.C. 2012. Biophysics of α-synuclein membrane interactions. Biochim. Biophys. Acta. 1818 : 162–171.
Prangkio P., Yusko E.C., Sept D., Yang J., Mayer M. 2012. Multivariate analyses of amyloid-beta oligomer populations indicate a connection between pore formation and cytotoxicity. PLoS One. 7 : e47261. doi 10.1371/journal.pone.0047261
Quist A., Doudevski I., Lin H., Azimova R., Ng D., Frangione B., Kagan B., Ghiso J., Lal R. 2005. Amyloid ion channels: a common structural link for protein-misfolding disease. Proc. Nat. Acad. Sci. USA. 102 : 10427–10432.
Rokitskaya T.I., Kotova E.A., Antonenko Y.N. 2002. Membrane dipole potential modulates proton conductance through gramicidin channel: movement of negative ionic defects inside the channel. Biophys. J. 82 (2) : 865–873.
Sasahara K., Morigaki K., Shinya K. 2013. Effects of membrane interaction and aggregation of amyloid β-peptide on lipid mobility and membrane domain structure. Phys. Chem. Chem. Phys. 15 : 8929–8939.
Tofoleanu F., Buchete N.V. 2012. Alzheimer Aβ peptide interactions with lipid membranes: fibrils, oligomers and polymorphic amyloid channels. Prion. 6: 339–345.
Van Rooijen B.D., Claessens M.M.A.E., Subramaniam V. 2010. Membrane permeabilization by oligomeric a-synuclein: in search of the mechanism. PLoS One. 5 : e14292. doi 10.1371/journal.pone.0014292
Zakharov S.D., Hulleman J.D., Dutseva E.A., Antonenko Y.N., Rochet J.C., Cramer W.A. 2007. Helical alpha-synuclein forms highly conductive ion channels. Biochem. 46 : 14 369–14 379.
Дополнительные материалы отсутствуют.


