Цитология, 2019, T. 61, № 3, стр. 198-207
Стрекательные клетки Polypodium hydriforme (Cnidaria, Polypodiozoa)
Е. В. Райкова 1, *, О. И. Райкова 2, 3
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Зоологический институт РАН
199034 Санкт-Петербург, Россия
3 Кафедра зоологии беспозвоночных С.-Петербургского государственного университета
199034 Санкт-Петербург, Россия
* E-mail: ekaterina.raikova@gmail.com
Поступила в редакцию 30.08.2018
После доработки 23.11.2018
Принята к публикации 25.11.2018
Аннотация
Представлен обзор результатов изучения стрекательных клеток (книдоцитов) паразитической книдарии Polypodium hydriforme Ussov, 1885. Книдоциты P. hydriforme относятся к глютинантам и представлены двумя категориями: atrichous и holotrichous isorhiza. Обсуждаются их уникальные особенности: монаксонная симметрия книдоцильного аппарата у обеих категорий, вариации формы и величины книдоцилей у holotrichous isorhiza в сенсорных щупальцах, ранее не известная для глютинант дополнительная пенетрантная функция и наличие двух рядов шипов на стрекательной нити. Проводится сравнение книдоцитов полиподия со стрекательными клетками свободноживущих книдарий и с полярными капсулами миксоспоридий – облигатных паразитов, причисленных теперь к типу Cnidaria. Впервые сопоставляются результаты изучения книдоцитов P. hydriforme методом электронной микроскопии, с одной стороны, и методами конфокальной микроскопии и иммуноцитохимии с антителами к α-тубулину и окраской фаллоидином, с другой стороны. Показано, что поперечно-исчерченные опорные палочки книдоцитов содержат тубулин и, вероятно, состоят из плотно спрессованных микротрубочек. Стрекательные клетки P. hydriforme предлагается рассматривать как ступень эволюции стрекательных клеток при переходе от свободного образа жизни книдарий к паразитизму.
В предлагаемой обзорной статье внимание фокусируется на стрекательных клетках Polypodium hydriforme как на основном признаке животных типа Cnidaria. Цель работы – обобщить современные данные об их особенностях, функционировании, сравнить их с похожими книдоцитами у свободноживущих книдарий и с полярными капсулами миксоспоридий, чтобы привлечь внимание исследователей к нашему объекту для решения проблемы эволюции стрекательных клеток.
ОБЩАЯ ХАРАКТЕРИСТИКА СТРЕКАТЕЛЬНЫХ КЛЕТОК КНИДАРИЙ
Стрекательные клетки (книдоциты или нематоциты) характеризуют животных типа Cnidaria (стрекающих). Они обеспечивают основные жизненные функции этих беспозвоночных и служат для ловли добычи, защиты и передвижения по субстрату. В настоящее время книдоциты считаются элементами нервной системы. Стрекательные клетки издавна привлекали к себе внимание исследователей как самые сложные, изящно и разнообразно устроенные клетки низших двухслойных животных. Имеется огромная литература по их строению и функциям (см., например, обзоры: Weill, 1934; Mariscal, 1974; Fautin, 2009). Поскольку книдарии в подавляющем большинстве – морские свободноживущие организмы, то многочисленные исследования стрекательных клеток относятся, прежде всего, к книдоцитам обитателей морей. Немало работ посвящено и стрекательным клеткам пресноводной гидры, обычного лабораторного объекта.
Стрекательные клетки книдарий классифицируются как по анатомическим особенностям, таким как форма и величина капсул, строение стрекательной нити, наличие или отсутствие стилетов, шипов и т.п., так и по функциональным признакам, где различаются пенетранты – пронзающие покровы, вольвенты, опутывающие участки жертвы, и клейкие глютинанты (Schultze, 1917). Описано более 30 разновидностей выстреливших нитей (Weill, 1934; Werner, 1965; Боженова, 1988). Поэтому особенности стрекательных клеток часто помогают установить систематическое положение отдельных видов книдарий.
РАСПРОСТРАНЕНИЕ, ЭКОНОМИЧЕСКОЕ И ТЕОРЕТИЧЕСКОЕ ЗНАЧЕНИЕ POLYPODIUM HYDRIFORME
P. hydriforme – паразит ооцитов осетровых рыб (черной икры), наносящий вред воспроизводительной системе осетровых и снижающий численность их стада. Поэтому он наносит урон рыбному хозяйству, и его изучение имеет большое экономическое значение. Действительно, на реке Кама нам встречались стерляди с тотальным заражением икры полиподием (при среднем заражении 78%), а на Северной Двине стерлядь заражена им почти на 100% (Ибрагимов, 2003). Крупные осетровые – осетр, севрюга, белуга (анадромные мигранты в отличие от пресноводной стерляди) – основные поставщики черной икры в бассейне Волги, были заражены в меньшей степени (Raikova, 1994). Изучение P. hydriforme также имеет важное теоретическое значение, так как до недавнего включения в тип Cnidaria группы Myxozoa, насчитывающей около 2200 видов (Okamura, Grul, 2015), полиподий был единственным эндопаразитом среди книдарий. Он представлял собой единственный среди них пример многоклеточного организма, приспособившегося к длительному развитию внутри одной, также развивающейся клетки. Благодаря такому образу жизни у него выработались уникальные адаптации к паразитизму. А в свободноживущей фазе цикла полиподий, покинув во время нереста осетровых своего хозяина, целое лето живет в пресной воде как типичная книдария, и в этот период его жизненные функции обеспечиваются стрекательными клетками (Raikova, 2002). В этом случае, однако, эти клетки по сравнению с книдоцитами других книдарий играют более существенную роль при передвижении животного и решающую роль при заражении нового хозяина.
На основании цитоморфологических признаков, резко отличающих этот вид от остальных книдарий (Райкова, 1988), P. hydriforme выделен в отдельный класс Polypodiozoa (Raikova, 1988). Позже обоснованность такого решения была подтверждена новыми цитоморфологическими (Райкова, 2005) и молекулярными данными (Evans et al., 2008) и поддержана в зоологической литературе (Bouillon, Boero, 2000; Zapata et al., 2015; Kayal et al., 2018).
СХОДСТВО P. HYDRIFORME С МИКСОСПОРИДИЯМИ
Наряду с уникальными признаками организации P. hydriforme нами были отмечены поразительные черты сходства ранних (эмбриональных) стадий его развития, которые приходятся на паразитическую фазу его цикла, с миксоспоридиями (Myxozoa) – облигатными паразитами водных животных, до недавнего времени считавшимися простейшими (Raikova, 1987; Успенская, Райкова, 2001; Райкова, 2005). Однако уже издавна основным (хрестоматийным) сходством миксоспоридий с книдариями считается как раз наличие у них экструзивных органоидов, которые называются полярными капсулами. Так, Вейл (Weill, 1934, 1938) первым высказал мнение о сходстве полярных капсул именно со стрекательными капсулами полиподия и о возможном родстве миксоспоридий с книдариями. После множества молекулярно-биологических исследований в поисках подтверждения родства этих животных было показано (Siddall et al., 1995), что P. hydriforme приходится сестринской группой Myxozoa, и что класс Myxozoa следует удалить из типа Protozoa. Далее было установлено, что миксоспоридии относятся к книдариям (см. обзор: Okamura, Grul, 2015). Таким образом, паразитических книдарий cразу стало очень много, и представление о книдариях как в основном о свободноживущих организмах было скорректировано, поскольку теперь на 11 000 свободноживущих видов книдарий приходится 2200 паразитических.
По сходству ряда морфологических признаков и по результатам молекулярно-филогенетических исследований выяснилось, что класс Polypodiozoa представляет собой связующее звено между свободноживущими книдариями и Myxozoa. (Райкова, 2005; Zrzavý, 2013; Foox, Siddall, 2015; Okamura, Grul, 2015). Поэтому интерес к Polypodiozoa сильно возрос. В 2015 г. был расшифрован геном и транскриптомы P. hydriforme и двух не близко родственных между собой миксоспоридий – Kudoa iwatai и Myxobolus cerebralis (Chang et al., 2015). Авторы подтвердили вывод, что P. hydriforme – это сестринский таксон по отношению к Myxozoa и установили, что внутри самого типа книдарий ветвь Myxozoa вместе с P. hydriforme оказывается сестринской по отношению к ветви Medusozoa. Особенно важным для нас в их работе оказалось, что P. hydriforme по размеру генома (561 Mb) и составу генов сравним с другими книдариями, (например, у гидры Hydra magnipapillata размер генома 1005 Mb, а у другого модельного объекта книдарий Nematostella vectensis – 450 Mb). В то же время у исследованных этими же авторами видов миксоспоридий геном крайне редуцирован (у Kudoa iwatai – 22.5 Mb, самый маленький из ныне известных геномов животных) и в нем отсутствуют основные гены, ответственные за многоклеточность. Таким образом, P. hydriforme, хотя и демонстрирует признаки редукции (например, отсутствие настоящих яиц и спермиев, дегенерацию женской гонады и сменy пола исходно мужской гонады), по размеру генома все же вполне вписывается в тип Cnidaria, будучи ближе к их свободноживущим видам, чем к Myxozoa.
ХАРАКТЕРИСТИКА СТРЕКАТЕЛЬНЫХ КЛЕТОК P. HYDRIFORME
Стрекательные клетки у P. hydriforme образуются задолго до начала функционирования, еще на паразитической фазе цикла. Они дифференцируются из интерстициальных клеток в эктодерме столона сразу после закладки в нем щупалец (начиная с августа), а используются только свободноживущими особями на протяжении всей их жизни в реке (с мая до конца лета). У свободноживущиx полиподиев (рис. 1а) стрекательные клетки располагаются вокруг рта (рис. 1а, 1б) и на щупальцах (рис. 1а, 1в). На сенсорных щупальцах и по краю рта они служат для ловли и удержания добычи, а концы опорных (локомоторных) щупалец покрывают сплошным слоем (рис. 1а, 1в) и выстреливают при передвижении полиподия по субстрату (Ибрагимов, 1999, 2002; Ibragimov, Raikova, 2004). У половозрелых особей стрекательные клетки закупоривают гонады-гаметофоры, наполненные двуядерными клетками – инвазивной стадией развития полиподия, заражающей рыбу (рис. 1г). Стрекательные клетки служат для прикрепления гаметофоров к хозяину (Смольянов, Райкова, 1961).
Рис. 1.
Общий вид свободноживущего Polypodium hydriforme и стрекательные клетки в разных отделах тела. а – Общий вид живой 24-х щупальцевой особи, из: Raikova, 2002 с изменениями, публикуется по лицензи John Wiley and Sons № 4 412 061 166 599. б – Стрекательные клетки вокруг рта, дифференциальный контраст по Номарскому; из: Raikova, Raikova, 2016 с изменениями, публикуется по лицензии ELSEVIER № 4412051007103. в – Стрекательные клетки в опорном щупальце; дифференциальный контраст по Номарскому. г – Гистологический срез через половозрелую особь с гонадами-гаметофорами. Фиксация сулемой с уксусной кислотой, окраска гемалауном Майера. Врезка: внизу слева – двуядерные клетки, справа – участок крышечки гаметофора. Обозначения: гп – гастральная полость, дк – двуядерные клетки, к – крышечка гаметофора, кн – книдоциль, ощ – опорные (локомоторные) щупальцы, р – рот, ск – стрекательные клетки, сн – стрекательная нить, cщ – осязательные (сенсорные) щупальцы.
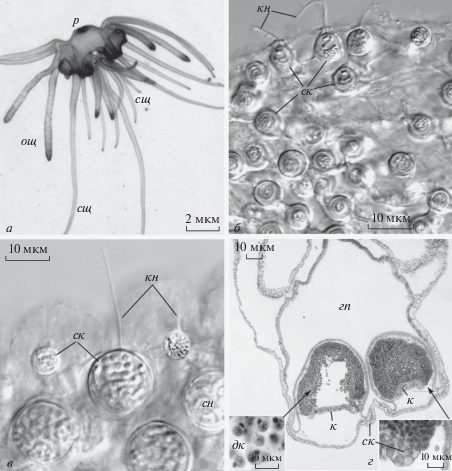
У P. hydriforme обнаружены три размерных категории стрекательных капсул (книдоцист или нематоцист) с диаметром 12, 7 и 5 мкм (в среднем). Капсулы размером 7 мкм сосредоточены в области рта и на сенсорных щупальцах (рис. 1а, 1б), а капсулы размером 12 и 5 мкм в основном усеивают концы опорных щупалец (рис. 1а, 1в). Поскольку свободноживущие особи активно расходуют стрекательные клетки, образование новых капсул (книдогенез) не прекращается, и развивающиеся книдобласты мигрируют к местам их использования (Lipin, 1911). Развитие всех стрекательных капсул сходно (Lipin, 1911; Райкова, 1978) и типично для книдарий. Будущая капсула развивается из последней большой цистерны аппарата Гольджи. Стрекательная нить закладывается внекапсулярно и состоит из чередующихся светлых и темных фрагментов одинакового размера. Затем нить втягивается внутрь капсулы, в стенке которой к этому времени различаются внутренний и внешний слои, и капсула замыкается крышечкой, к которой крепится стрекательная нить (Raikova, 1990).
ТИПЫ СТРЕКАТЕЛЬНЫХ КАПСУЛ P. HYDRIFORME
Зрелые стрекательные капсулы P. hydriforme по классификации Шульце (Schultze, 1917) относятся к большим и малым глютинантам, а по классификации Вейла (Weill,1934) – к типу atrichous и holotrichous isorhiza.
Atrichous isorhiza (атрихи) – большие капсулы диаметром около 12 мкм – устилают концы опорных щупалец (рис. 1а, 1в, 2а). Свернутая стрекательная нить в них занимает все пространство капсулы (рис. 1в). Нить уложена по принципу двойной складки и на срезах демонстрирует сложные профили (Raikova, 1990), но не “профиль пропеллера”, как в капсулах большинства книдарий, где прослеживается трехскладчатость (Mariscal, 1974). Все книдоцили таких капсул прямые и одинаковой длины (рис. 1в, 2а). Эти капсулы используются при передвижении полиподия по субстрату и при заякоривании на нем. При этом выстреливающая стрекательная нить приклеивается к песчинкам, а капсула может легко отделяться от щупальца полиподия. Выстрелившая стрекательная нить длинная и ровная, на ней часто заметен обвивающий ее слизистый тяж (рис. 3в, 3г) (Ибрагимов, 1999, 2002; Ibragimov, Raikova, 2004).
Рис. 2.
Стрекательные клетки в щупальцах. Двойное окрашивание фаллоидином (красный) и антителами к α-тубулину (зеленый). а – Кончик опорного щупальца, покрытый стрекательными клетками с книдоцилями (кн); б, в – разнообразие форм книдоцилей на поверхности сенсорного щупальца; г – книдоцильный аппарат, макс-проекция нескольких оптических срезов. Видны зеленые тубулин-иммунореактивные (ИР) книдоцили (кн), окруженные у основания красными (окрашенными фаллоидином) колечками стереоцилей (сц), и внешние зеленые колечки, состоящие из тубулин-ИР опорных палочек (оп). Из: Raikova, Raikova, 2016 с изменениями, публикуется по лицензии ELSEVIER № 4 412 051 007 103; д – схема книдоцильного аппарата на основе данных иммуноцитохимических реакций и электронной микроскопии (объяснения в тексте) из: Raikova, 1990 с существенными изменениями и дополнениями, публикуется по лицензии John Wiley and Sons № 4 380 961 298 041; к – стрекательная капсула со свернутой внутри стрекательной нитью, кр – крышечка стрекательной капсулы, мт – микротрубочки.
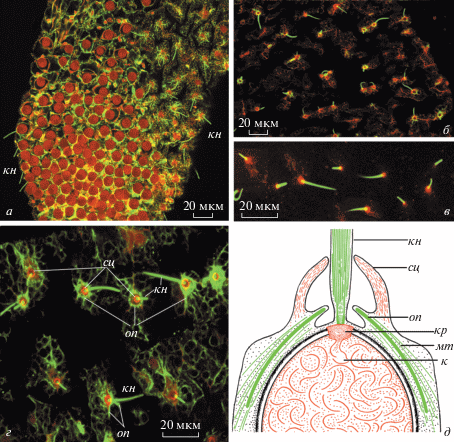
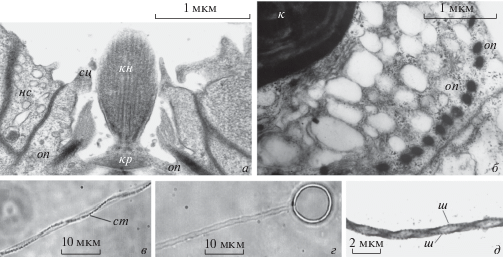
Рис. 3.
Электронограммы стрекательных клеток и выстреливших стрекательных нитей. а – Верхняя часть стрекательной клетки на сенсорном щупальце; книдоциль (кн) над крышечкой (кр) стрекателной капсулы; слева виден отросток нейросекреторной клетки (нс); оп – опорная палочка; сц – стереоцилия. б – Часть клетки книдобласта, в верхнем левом углу – развивающаяся стрекательная капсула (к), по кругу – развивающиеся опорные палочки (оп). в – Участок выстрелившей нити atrichous isorhiza cо слизистым тяжом (ст). г – Выстрелившая капсула (atrichous isorhiza) с гладкой нитью. д – Участок выстрелившей нити holotrichous isorhiza с двумя рядами мелких шипов (ш). a, б – Из Raikova, 1990 с изменениями, публикуются по лицензии John Wiley and Sons № 4 380 961 298 041. в, г, д – Из: Ibragimov, Raikova, 2004 с изменениями, публикуются по лицензии Springer Nature and Copyright Clearance Center № 4380960138477.
Holotrichous isorhiza (холотрихи) – средние и мелкие капсулы, диаметром соответственно 7 и 5 мкм, локализуются вокруг ротового отверстия и на сенсорных щупальцах, а также единично встречаются на поверхности опорных щупалец. Капсулы диаметром 7 мкм окрашиваются гистологическими красителями. В капсулах вокруг рта (7 мкм) стрекательная нить отходит от крышечки капсулы под прямым углом, делает 2–3 витка, а затем укладывается на дне капсулы (рис. 1б). На электронограммах нить в капсуле демонcтрирует S-образные профили, т.е. двухскладчатость (Ibragimov, Raikova, 2004). Капсулы же размером 5 мкм при гистологической окраске обычно остаются бесцветными, а нить в них, как и у атрих, заполняет все пространство капсулы (рис. 1в).
Выстрелившие нити капсул холотрих отличаются друг от друга длиной, они покрыты мелкими шипами, расположенными в два ряда (рис. 3д), что является их основной характеристикой, тогда как у других книдарий стрекательные нити имеют три ряда шипов. Некоторые нити суживаются к концу, поэтому их предлагается именовать holotrichous anisorhiza. Но внешне капсулы, ещe не выстрелившие, неразличимы (Ибрагимов, 1999). Главное же отличие холотрих от атрих состоит в том, что холотрихи у полиподия обладают уникальными пенетрантными свойствами: их нить пронзает покровы тубифекса и парамеции (Raikova, 1990; Ibragimov, Raikova, 2004).
Стрекательные клетки у P. hydriforme (и атрихи, и холотрихи) относятся к самому примитивному типу нематоцист (Werner, 1965; Боженова, 1988; Östman, 1999, 2000; David et al., 2008; Fautin, 2009). Эволюция стрекательных клеток в настоящее время интенсивно разрабатывается, но книдоциты нашего объекта изучаются очень слабо, хотя благодаря своим необычным признакам интересны как определенная ступень эволюции стрекательных клеток, как возможное связующее звено между книдоцитами свободноживущих книдарий и полярными капсулами миксоспоридий.
ТОНКОЕ СТРОЕНИЕ СТРЕКАТЕЛЬНОЙ КЛЕТКИ И КНИДОЦИЛЬНОГО АППАРАТА
Каждая зрелая стрекательная клетка P. hydriforme имеет книдоцильный аппарат (рис. 1б, 1в; 2а–2д; 3а), состоящий из книдоциля – чувствительного механосенсорного неподвижного жгутика, окруженного кольцом выростов апикальной поверхности стрекательной клетки, называемых стереоцилиями (рис. 2д; 3а). Все стрекательные капсулы у полиподия имеют округлую форму, что не типично ни для глютинант, описанных в литературе (обычно продолговатых капсул) (Fautin, 2009), ни для других категорий книдоцитов большинства книдарий. Вторая их особенность – положение книдоциля непосредственно над крышечкой капсулы (рис. 1б, 1в; 2а–2д; 3а). Эта особенность уникальная, известная только для книдоцитов полиподия. Кинетосома книдоцильного жгутика закреплена на крышечке капсулы (рис. 2д; 3а), и он, в отличие от книдоцилей других книдарий, лишен корневой нити. Третья особенность, вытекающая из центрального положения книдоциля – монаксонная радиальная симметрия всего книдоцильного комплекса, а не билатеральная симметрия, как у других книдарий (Hausmann, Holstein, 1985).
Само строение книдоциля полиподия (Raikova, 1990) также оригинальное: обычные для жгути-ков 9 периферических дублетов микротрубочек оттеснены на периферию книдоциля, а его середина заполнена множеством синглетов микротрубочек (рис. 3а). Существенное отличие книдоциля полиподия от таковых многих других книдарий – отсутствие плотного стержня в центре (Raikova, 1990). Плотный стержень, рассматриваемый как важный элемент, отвечающий за ригидность книдоциля (Hwang et al., 2008) также отсутствует в книдоцилях у Anthozoa и некоторых Hydrozoa. У гидры, многих Hydrozoa и Cubozoa плотный стержень присутствует. В нем обнаружен новый белок нематоцилин, гомологичный промежуточным филаментам, видимым под электронным микроскопом (Hwang et al., 2008).
Интересно, что книдоцили капсул вокруг рта и на опорных щупальцах все одинаковые, прямые (рис. 1б, 1в; 2а), иногда чуть отклоняющиеся от вертикали, что наблюдается и на живом материале (Ибрагимов, 1999). В осязательных же щупальцах не все книдоцили одинаковые. Среди них есть заостренные, как кинжал, есть и короткие тупоконечные, а есть даже изогнутые (рис. 2б–2г), что, по-видимому, объясняется как раз отсутствием центрального стержня. Такого разнообразия книдоцилей у капсул на одном и том же щупальце до сих пор в литературе не отмечалось.
Строение cтрекательной клетки Polypodium hydriforme представлено на схеме (рис. 2д). Стрекательная капсула лежит в вакуоли, краевая цитоплазма изобилует микротрубочками и поэтому ярко красится на альфа-тубулин (зеленый цвет на рис. 2). Содержимое капсулы – стрекательная нить – крепится к крышечке капсулы и обычно окрашивается фаллоидином (красный цвет), что указывает на содержание фибриллярного актина. Над крышечкой находится книдоциль, он предсказуемо ярко красится на тубулин и отходит от кинетосомы, сидящей на крышечке капсулы. Его основание находится в полости, образованной апикальными выростами цитоплазмы клетки, которые называются стереоцилиями. Они ярко окрашиваются фаллоидином, т.к. укреплены актиновыми микрофиламентами, и образуют плотный воротничок, окружающий основание книдоциля (рис. 2б–2д). Под кольцом стереоцилей располагается другое, уже тубулин-иммунореактивное (зеленое) кольцо, образованное многочисленными опорными (поддерживающими) палочками (supporting rods) (рис. 2г, 2д). Их насчитывается более 30, и под световым микроскопом при виде сверху они напоминают спицы зонтика, расходящиеся в стороны от книдоциля. Вдоль опорных палочек располагаются сопровождающие их микротрубочки (рис. 2д), подстилающие границы клетки. На электроннограммах опорные палочки демонстрируют периодическую исчерченность (рис. 3а, 3б). Интересно отметить, что иммуноцитохимические исследования доказывают, что эти структуры состоят из тубулина (Raikova, Raikova, 2016), видимо представляя собой плотно упакованные микротрубочки. Это напоминает строение стилетов некоторых представителей Acoela, также состоящих из плотно спрессованных микротрубочек и демонстрирующих выраженную периодическую исчерченность (Tekle et al., 2007).
ИННЕРВАЦИЯ СТРЕКАТЕЛЬНЫХ КЛЕТОК POLYPODIUM HYDRIFORME
При иммуногистохимическом исследовании материала (Raikova, Raikova, 2016) оказалось, что стрекательные клетки у полиподия иннервируются нейронами FMRF-амид иммунореактивной субэпителиальной сети. Книдоциты не объединены в батареи вместе с другими клетками, как у гидры, но каждый из них вмонтирован в тубулиновый цитоскелет (рис. 2а, 2г), что объясняется наличием огромного количества микротрубочек в цитоплазме таких клеток (Raikova, 1990). А холотрихи сенсорных щупалец еще и связаны между собой тубулиновой цитоскелетной сетью (рис. 2г), образованной микротрубочками, выстилающими границы эпидермальных клеток (Raikova, Raikova, 2016).
ФУНКЦИИ СТРЕКАТЕЛЬНЫХ КЛЕТОК P. HYDRIFORME
Что касается функций стрекательных клеток у нашего объекта, то именно способность приклеиваться, вытекающая из их названия (глютинанты), несомненна только для книдоцитов, устилающих концы опорных щупалец, так как на дне аквариума среди песчинок часто попадаются выстрелившие нити, отходящие от опустевших капсул (рис. 3в, 3г).
У холотрих с пенетрантной функцией, окружающих рот полиподия, стрекательная нить имеет два ряда шипов (рис. 3д). Во время экспериментального кормления полиподиев олигохетами Tubifex tubifex, выстрелившая стрекательная нить проникает в покровы червя и, по-видимому, распрямляется не сразу, так как на электронограммах наряду с пустыми фрагментами нити различимы ее еще не распрямившиеся спиральные витки (Ibragimov, Raikova, 2004). Околоротовые холотрихи еще и очень крепко удерживают добычу: полиподии буквально впиваются в червя ртом, втягивая его тело в гастральную полость, иногда даже лопаются от переедания. Они долго сидят на червяке щупальцами кверху, как бы напоминая, что их рот образовался в месте отрыва от столона, т.е. что он – бывшая подошва.
Как функционируют книдоциты осязательных щупалец с книдоцилями разной формы (изогнутыми и по-разному заостренными), пока не ясно.
Что касается стрекательных клеток на гонадах-гаметофорах, то они изучались только под световым микроскопом. Различаются две их размерные категории: более крупные (7 мкм) находятся в крышечке, а мелкие (5 мкм) – по краям гаметофора (рис. 1г). Более мелкие книдоциты первыми соприкасаются с поверхностью заражаемого объекта и, по-видимому, закрепляют гаметофор на покровах нового хозяина (Смольянов, Райкова, 1961), а крышечка при выстреливании ее стрекательных капсул разрушается, открывая доступ двуядерным клеткам гаметофора. После выстреливания и те, и другие книдоциты оставляют опустевшие круглые капсулы.
В научной литературе стрекательные клетки книдарий часто рассматриваются как предшественники механорецепторов (Holstein, Hausmann, 1988). Мы вполне разделяем эту точку зрения и считаем, что книдоциты P. hydriforme как раз благодаря уникальному книдоцильному аппарату морфологически наиболее близки к механорецепторам (Raikova, 1990).
СРАВНЕНИЕ КНИДОЦИТОВ ПОЛИПОДИЯ С ПОЛЯРНЫМИ КАПСУЛАМИ МИКСОСПОРИДИЙ
Развитие полярных капсул Myxozoa даже в деталях ультраструктуры сходно с развитием нематоцист книдарий. Они также берут начало от большой цистерны аппарата Гольджи, далее также образуeтся наружная стрекательная нить, которая втягивается в капсулу (Успенская, 1984; Okamura, Gruhl, 2015). В последние годы показано, что белки (микроколлагены), формирующие стенку полярной капсулы миксоспоридий, те же, что и в капсулах книдарий, только менее разнообразны (Shpirer et al., 2014). Поэтому многие специалисты пришли к общему мнению о гомологии стрекательных капсул книдарий и полярных капсул Myxozoa (подробнее см.: Okamura, Gruhl, 2015). Сравнение структуры капсул у Myxozoa и P. hydriforme показало, что два из трех миниколлагенов у них общие, а 11 транскриптомов миниколлагенов у P. hydriforme уникальны (Shpirer et al., 2014).
Считается, что полярные капсулы Myxozoa не имеют книдоциля, видимого под световым микроскопом. Однако возможно, что иммунореактивный к тубулину книдоциль, находящийся над крышечкой всех разновидностей книдоцитов у P. hydriforme, мог бы быть гомологичен также иммунореактивной к тубулину полярной шапочке над протоками полярной капсулы Myxozoa (Успенская, Райкова, 2004).
Недавняя работа по полярным капсулам Myxozoa (Ben-David et al., 2016) подтвердила сходство их выстреливающих нитей именно со стрекательными нитями книдоцитов (холотрих) P. hydriforme, поскольку и те, и другие снабжены двумя рядами шипов. К тому же выстрелившие нити полярных капсул могут на какой-то момент сокращаться в длине перед полным распрямлением. Это напоминает наблюдавшийся нами случай нахождения скрученного участка нити в покровах тубифекса (Ibragimov, Raikova, 2004).
Мы полагаем, что по целому ряду признаков ближе всего к классу Polypodiozoa находится более примитивная группа Myxozoa – Malacosporea (паразиты мшанок). Это также признано в литературе (Zrzavý, Hypša, 2003; Okamura, Gruhl, 2015) и, вдобавок, именно у этой группы полярные капсулы сферические, как у полиподия.
Однако стрекательные клетки P. hydriforme при большом сходстве с полярными капсулами Myxozoa имеют лишь одну общую с ними функцию – заражение нового хозяина. Вероятно, с утратой миксоспоридиями свойственного книдариям образа жизни, их полярные капсулы утратили также все свойственные книдоцитам функции, связанные со свободной жизнью. Так, например, они не обладают пенетрантной функцией (Fiala et al., 2013).
ЗАКЛЮЧЕНИЕ
Все сказанное выше свидетельствует о том, что всестороннее изучение стрекательных клеток P. hydriforme, особенно типа holotrichous isorhiza с разнообразными выстрелившими нитями (Ибрагимов, 1999) и неодинаковыми книдоцилями (Raikova, Raikova, 2016) заслуживает продолжения. В частности, необходима точная идентификация функций этих клеток. Это важно также и для решения проблемы эволюции книдоциля. По нашему мнению, совокупность полученных данных по стрекательным клеткам P. hydriforme дает нам право рассматривать их как важную ступень в эволюции нематоцист.
Работа выполнена по государственному заданию № 0124-2018-0003 (рег. ЦИТиС № AAAA-A17-117032350035-4 и № АААА-А17-117030110029–3) при финансовой поддержке Российского фонда фундаментальных исследований (проекты 15-29-02650 и 16-04-00593). Работа проводилась с использованием оборудования Центра коллективного пользования “Таксон” Зоологического института РАН (www.ckp-rf.ru/ckp/3038/?sphrase_id=8879024).
Список литературы
Боженова О.В. 1988. Современные представления о классификации стрекательных капсул Cnidaria. В кн.: Губки и книдарии. Современное состояние и перспективы исследования. Л.: Зоол. ин-т АН СССР. 57–71. (Bozhenova O.V. 1988. Modern ideas on classification of cnidarian stinging capsules. In: Sponges and Cnidaria. Contemporal state and perspectives of investigations. Leningrad: Zool. Inst. Acad. Sci. USSR. 57–71.)
Ибрагимов А.Ю. 1999. Стрекательные клетки книдарии Polypodium hydriforme – паразита ооцитов осетрообразных рыб. Цитология. 41 (2) : 200–209. (Ibragimov A.Yu. 1999. Stinging cells of cnindarian Polypodium hydriforme, a parasite from eggs of acipenseriform fishes. Tsitologiya. 41 (2) : 200–209.)
Ибрагимов А.Ю. 2002. Особенности строения стрекательных нитей нематоцист паразитической книдарии Polypodium hydriforme. Цитология. 44 (1) : 24–32. (Ibragimov A.Yu. 2002. Peculiarities of stinging tubules in nematocysts from parasitic cnidarian Polypodium hydriforme. Tsitologiya. 44 (1) : 24–32.)
Ибрагимов А.Ю. 2003. Polypodium hydriforme в ооцитах стерляди из реки Северная Двина. Паразитология. 37 (2) : 134–138. (Ibragimov A.Yu. 2003. Polypodium hydriforme in sterlet oocytes in the Severnaya Dvina river. Parasitologiya. 37 (2) : 134–138.)
Райкова Е.В. 1978. Электронномикроскопическое исследование развития стрекательных капсул у паразитического столона Polypodium hydriforme. Цитология. 20 (4) : 384–390. (Raikova E.V. 1978. Electron microscopic investigation of the nematocyst development in the parasitic stolon of Polypodium hydriforme Ussov (Coelenterata). Tsitologiya. 20 (4) : 384–390.)
Райкова E.В. 1988. O систематическом положении Polypodium hydriforme Ussov (Cnidaria). В кн.: Губки и книдарии. Современное состояние и перспективы исследования. Л.: Зоол. ин-т АН СССР. C.: 116–122. (Raikova E.V. 1988. On the systematic position of Polypodium hydriforme Ussov (Coelenterata). In: Sponges and Cnidaria. Contemporary state and perspectives of investigations. Leningrad: Zool. Inst Acad. Sci. USSR. P. 116–122.)
Райкова E.В. 2005. Цитоморфологические особенности Polypodium hydriforme и проблема филогении Myxozoa и Cnidaria. Цитология. 47 (10) : 933–939. (Raikova E.V. 2005. Cytomorphological characters of Polypodium hydriforme and the problems of Myxozoan and Cnidarian phylogeny. Tsitologya. 47 (10) : 933–939.)
Смольянов И.И., Райкова Е.В. 1961. Нахождение половозрелых Polypodium hydriforme Ussov (Coelenterata) на личинках осетровых рыб. Докл. АН СССР. 141 (5) : 1271–1274. (Smolyanov I.I. Raikova E.V. 1961. Finding of sexually mature Polypodium hydriforme Ussov (Coelenterata) on larvae of acipenserid fish. Doklady Akademii Nauk USSR. 141 : 1271–1274.)
Успенская А.В. 1984. Цитология миксоспоридий. Л.: Наука. 112 с. (Uspenskaya A.V. 1984. Cytology of Myxosporidia. Nauka: Leningrad. 112 p.)
Успенская А.В., Райкова Е.В. 2001. Цитологические аспекты сходства и различия миксоспоридий и книдарий. Цитология. 43 (3) : 284–309. (Uspenskaya A.V., Raikova E.V. 2001. Cytological aspects of similarity and difference of Myxozoa and Cnidaria. Tsitologiya. 43 (3) : 284–309.)
Успенская А.В., Райкова О.И. 2004. Локализация F-актина и бета-тубулина в стрекательном аппарате миксоспоры Myxobolus pseudodispar Gorbunova, 1936 (Myxozoa, Myxosporea). Цитология 46 (8) : 748–754. (Uspenskaya A.V., Raikova O.I. 2004. F-actin and beta-tubulin localization in the myxospore stinging apparatus of Myxobolus pseudodispar Gorbunova, 1936 (Myxozoa, Myxosporea). Tsitologiia 46 (8) : 748–754.)
Ben-David J., Atkinson S.D., Pollak Y., Yossifon G.,Shavit U., Bartholomew J.L., Lotan T. 2016. Myxosoan polar tubules display structural and functional variation. Parasites Vectors. 9 : 549. doi 10.1186/s13071-016-1819-4
Bouillon J., Boero F. 2000. The Hydrozoa: a new classification in the light of old knowledge. Thalassia Salientina, Universita degli Studi di Lecce, Dipartimento di biologia, Porto Cesario (Lecce). 24 : 3–296.
Chang E., Neuhof M., Rubinstein N.D., Diamant A., Philippe H., Huchon D., Cartwright P. 2015. Genomic insights into the evolutionary origin of Myxozoa within Cnidaria. Proc. Nat. Acad. Sci. USA. 112 (48) : 14912–14917.
David C.N., Özbek S., Adamczyk P., Meier S., Pauly B., Chapman J., Hwang J.S., Gojobori T., Holstein T.W. 2008. Evolution of complex structures: minicollagens shape the cnidarian nematocyst. Trends Genet. 24 : 431–438.
Evans N.M., Lindner A., Raikova E.V., Collins A.G., Cartwright P. 2008. Phylogenetic placement of the enigmatic parasite, Polypodium hydriforme, within the phylum Cnidaria. BMC Evol. Biol. 8 : 139–150.
Fautin D.G. 2009. Structural diversity, systematics, and evolution of cnidae. Toxicon. 54 : 1054–1064.
Fiala I., Kyslík J., Cinková M., Bartošová P. 2013. Analysis of mitochondrial genomic data reveals the phylogenetic placement of Myxozoa and Polypodium hydriforme within the medusozoan cnidarians. In: Abstract of the 16th International conference on diseases of fish and shellfish. Tampere, Finland. 2–6 Sept. 2013. 2–6.
Foox J., Siddall M.E. 2015. The road to Cnidaria: history of phylogeny of the Myxozoa. J. Parasitol. 101 : 269–274.
Hausmann K., Holstein T.W. 1985. Bilateral symmetry in the cnidocil-nematocyst complex of the freshwater medusa Craspedacusta sowerbii Lankester (Hydrozoa, Limnomedusae). J. Ultrastruct. Res. 90 : 89–104.
Holstein T.W., Hausniann K. 1988. The cnidocil apparatus of Hydrozoans: a progenitor of higher metazoan mechanorcceptors? In: The biology of' nematocysts. Academic Press, San Diego: P. 53–73.
Hwang J.S., Takaku Y., Chapman J., Ikeo K., David C.N., Gojobori T. 2008. Cilium evolution: identification of a novel protein, nematocilin, in the mechanosensory cilium of Hydra nematocytes. Mol. Biol. Evol. 25 : 2009–2017.
Ibragimov A.Yu., Raikova E.V. 2004. Nematocysts of Polypodium hydriforme, a cnidarian parasite of acipenseriform fishes. Hydrobiol. 530 : 165–171.
Kayal E., Bentlage B., Pankey M.S., Ohdera A.H., Medina M., David C.N., Plachetzki C., Collins A., Ryan J.F. 2018. Phylogenomics provides a robust topology of the major cnidarian lineages and insights on the origins of key organismal traits. BMC Evol. Biol. 18 (1) : 68.
Lipin A.N. 1911. Die Morphologie und Biologie von Polypodium hydriforme Uss. Zool. Jahrb. (Anat.). 31 : 317–426.
Mariscal R.N. 1974. Nematocysts. In: Colenterate biology: reviews and new perspectives. New York: Acad. Press. 129–166.
Okamura B., Gruhl A. 2015. Myxozoan affinities and route to endoparasitism. In: Myxozoan evolution, ecology and development. Berlin: Springer. 23–44.
Östman C. 1999. Nematocysts and their value as taxonomic parameters within the Campanulariidae (Hydrozoa). A review based on light and scanning electron microscopy. Zoosyst. Rossica. 1 : 17–28.
Östman C. 2000. A guideline to nematocyst nomenclature and classification, and some notes on the systematic value of nematocysts. Sci. Mar. 64 : 31–46.
Raikova E.V. 1987. Peculiarities of the embryonic development of Polypodium hydriforme Ussov (Coelenterata), a parasite of acipenserid oocytes. Gegenbaurs Morphol. Jahrb. 133 : 99–121.
Raikova E.V. 1990. Fine structure of the nematocytes of Polypodium hydriforme Ussov (Cnidaria). Zool. Scr. 19 : 1–11.
Raikova E.V. 1994. Life cycle, cytology, and morphology of Polypodium hydriforme, a coelenterate parasite of the eggs of Acipenseriform fishes. J. Parasitol. 80 : 1–22.
Raikova E.V. 2002. Polypodium hydriforme infection in the eggs of acipenseriform fishes. J. Appl. Ichthyol. 18 : 405–415.
Raikova E.V., Raikova O.I. 2016. Nervous system immunocytochemistry of the parasitic cnidarian Polypodium hydruforme at its free-living stage. Zoology. 119 : 143–152.
Schultze P. 1917. Neue Beitraege zu einer Monographie der Gattung Hydra. Arch. Biontol. 4 (2) : 33–119.
Siddall M.E., Martin D.S., Bridge D., Desser S.S., Cone D.K. 1995. The demise of a phylum of protists : phylogeny of Myxozoa and other parasitic Cnidaria. J. Parasitol. 81 : 961–967.
Shpirer E., Chang E.S., Diamant A., Rubinstei N., Cartwrigh P., Huchon D. 2014. Diversity and evolution of myxozoan minicollagens and nematogalectins. BMC Evol. Biol. 14 : 205.
Tekle Y.I., Raikova O.I., Justine J.-L., Jondelius U. 2007. Ultrastructure and tubulin immunocytochemistry of the copulatory stylet-like structure in Childia species (Acoela). J. Morphol. 268 : 166–180.
Weill R. 1934. Contribution á l’étude des cnidaires et de leurs nématocystes. Trav. Stat. Zool. Wimereux. 10–11 : 1–701.
Weill R. 1938. L’interprétation des Cnidosporidies et la valeur taxonomique de leur cnidome. Leur cycle comparée á la phase larvaire des Narcoméduses Cuninides. Trav. Stat. Zool. Wimereux. 13 : 727–744.
Werner B. 1965. Die Ncsselkapscln der Cnidaria mit besondcrer Bcruecksichtigung der Hydroida. I. Klassifikation und Bcdeutung fuer die Systcmatik und Evolution. Helgolaender wiss. Meeresunters. 12 : 1–39.
Zapata F., Goetz F.E., Smith S.A., Howison M., Siebert S., Church S.H., Sanders S.M., Ames C.L., McFadden C.S., France S.C., Daly M., Collins A.G., Haddock S.H., Dunn C.W., Cartwright P. 2015. Phylogenomic analyses support traditional relationships within Cnidaria. PLoS One. 10 : e0139068.
Zrzavý J. 2013. The interrelationships of metazoan parasites: a review of phylum-and higher-level hypotheses from recent morphological and molecular phylogenetic analyses. Folia Parasitol. 48 (2) : 81–103.
Zrzavý J., Hypša V. 2003. Myxozoa, Polypodium, and the origin of the Bilateria: the phylogenetic position of “Endocnidozoa” in light of the rediscovery of Buddenbrockia. Cladistics. 19 : 164–169.
Дополнительные материалы отсутствуют.


