Цитология, 2019, T. 61, № 4, стр. 326-335
ГОМОЛОГИ БЕЛКА p48 ИЗ МОРУЛЯРНЫХ КЛЕТОК АСЦИДИИ STYELA RUSTICA У ПРЕДСТАВИТЕЛЕЙ ОТРЯДА STOLIDOBRANCHIA
М. И. Тылец 1, *, М. А. Даугавет 2, А. В. Савельева 3, О. И. Подгорная 1, 2, 4, Т. Г. Шапошникова 1
1 Кафедра цитологии и гистологии С.-Петербургского государственного университета
199034 Санкт-Петербург, Россия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
3 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
4 Дальневосточный федеральный университет
690922 Владивосток, Россия
* E-mail: Masana97@yandex.ru
Поступила в редакцию 30.11.2018
После доработки 29.01.2019
Принята к публикации 30.01.2019
Аннотация
Оболочники (Tunicata) являются интересной с точки зрения эволюции группой, находясь у основания ветви хордовых. Морулярные клетки крови асцидий (Tunicata, Ascidiacea) участвуют в защитных реакциях и в формировании внеклеточного матрикса туники. Укрепление туники асцидий происходит благодаря склеротизации белков за счет работы фермента фенолоксидазы, который содержится в морулярных клетках. Морулярные клетки асцидии Styela rustica содержат два мажорных белка, функция которых до сих пор неизвестна. Один из них имеет молекулярную массу 48 кДа (белок р48). Задачей настоящей работы стал поиск возможных гомологов p48 у асцидий отряда Stolidobranchia: Styela coriacea (сем. Styelidae), Molgula citrina (сем. Molgulidae), Boltenia echinata, Halocynthia aurantium (сем. Pyuridae) и определение их локализации в тканях этих асцидий. Чтобы показать присутствие p48 в тканях асцидий, использовали метод непрямого иммуномечения на парафиновых срезах. Показано связывание антител с морулярными клетками S. rustica, S. coriacea, B. echinata, c матриксом туники у всех исследованных видов и с тестальными клетками S. rustica, S. coriacea, B. echinata, M. citrina. Это дает возможность предполагать наличие гомологов белка p48 у всех изученных асцидий и сходство механизмов их участия в процессах формирования туники, как возможных субстратов фенолоксидазной системы.
Оболочники (Tunicata) являются группой животных, находящейся на эволюционном древе у основания ветви хордовых. Оболочникам присущи необычные для хордовых черты организации: переход многих представителей этого подтипа к сидячему образу жизни; наличие хорды и нервной трубки только на личиночной стадии, за исключением аппендикулярий, сохраняющих эти структуры на протяжении всего онтогенеза; покровы, образованные туникой из волокон целлюлозы и белков (Исаева, 2017). Сравнение секвенированного генома аппендикулярии Oikopleura dioica и геномов других хордовых показало, что именно оболочники, а не головохордовые, как считалось ранее, являются группой, ближайшей к позвоночным животным (Delsuc et al., 2006).
Традиционно оболочники были разделены на три класса: Ascidiacea (sea squirts), Thaliacea (сальпы Salpida, боченочники Doliolida и огнетелки Pyrosomida, (Berrill, 1936)) и Appendicularia (Larvacea), которые отличаются набором морфологических признаков и особенностями жизненного цикла. Растущее количество данных секвенирования геномов и сравнения 18S РНК свидетельствуют о том, что Appendicularia является сестринским таксоном по отношению ко всем другим оболочникам (Kocot et al., 2018) и определяет положение Thaliacea в составе ветви асцидий. Таким образом, в настоящее время Ascidiacea – формальное таксономическое название, поскольку под ним подразумевают парафилитическую группу бентосных оболочников (Swalla et al., 2000; Stach, Turbeville, 2002; Winchell et al., 2002; Zeng et al., 2006; Kocot et al., 2018).
Асцидии – самая большая группа оболочников, ее представители населяют морские бентосные сообщества (Burighel, Cloney, 1997). Классификация Ascidiacea основана, главным образом, на морфологических характеристиках жаберного мешка – органа, используемого для фильтрации пищевых частиц из водной толщи. На основании строения жаберного мешка асцидий разделяют на три отряда (Lahille, 1886): Aplousobranchia (простой жаберный мешок), Phlebobranchia (сосудистый жаберный мешок) и Stolidobranchia (сложный жаберный мешок). Отношения между этими кладами не до конца определены. Согласно последним данным молекулярной филогении Phlebobranchia (включает род Ciona) и Aplousobranchia скорее всего монофилетичны, что согласуется с большинством традиционных представлений на основе их морфологии. Stolidobranchia является монофилетическим и сестринским таксоном для всех других оболочников, кроме Appendicularia (Kocot et al., 2018).
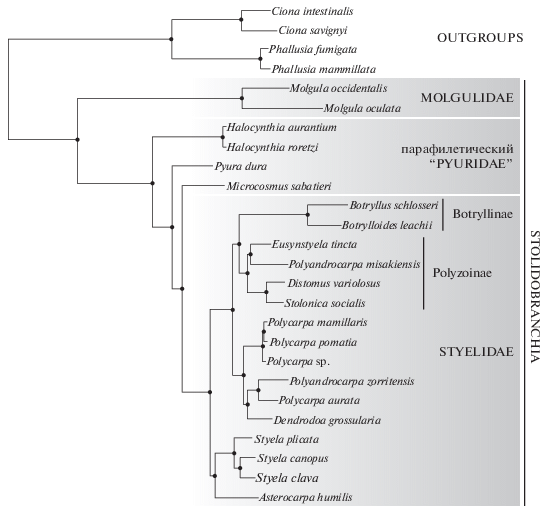
На основании анализа транскриптомов внутри группы Stolidobranchia базальное положение занимает Molgulidae, тогда как Pyuridae оказывается парафилитической группой, занимающей промежуточное положение между Styelidae и Molgulidae (рис. 1) (Alié et al., 2018).
Рис. 1.
Филогенетические отношения внутри отряда Stolidobranchia. Публикуется с разрешения автора (Alié et al., 2018).
В крови асцидий описывают от 4 до 9 типов клеток, выполняющих различные функции (Rowley, 1982; Smith, Peddie, 1992; Shirae, Saito, 2000; Hirose et al., 2003; Parrinello et al., 2003, 2007). Один из наиболее многочисленных типов клеток – это морулярные клетки (30–40% от общей популяции всех клеток крови) (Чага, 1998). Морулярные клетки описаны у представителей всех подгрупп, входящих в отряд Stolidobranchia (Чага, 1980а, 1998; Hirose et al., 2003; Сукачев и др., 2013). Они выполняют защитные функции (Hirose et al., 2003; Cammarata, Parrinello, 2009; Ballarin et al., 2012), а так же участвуют в процессах задубливания и репарации туники – развитого внеклеточного матрикса, образующего покровы этих животных. Укрепление туники асцидий происходит благодаря фенольному задубливанию – склеротизации белков хинонами, которые образуются из фенолов благодаря ферменту фенолоксидазе (Smith, 1970; Hirose, 2009).
Фенолоксидаза привносится в тунику взрослых асцидий морулярными клетками (Чага, 1980б), в составе которых присутствуют тунихромы – небольшие пептиды, обладающие способностью связывать тяжелые металлы и содержащие субстрат фенолоксидазы диоксифенилаланин (ДОФА) (Smith, 1970; Чага, 1998; Cima et al., 2017). Вероятно, тунихромы являются структурными белками, которые участвуют в формировании туники и ее задубливании (Abebe et al., 2017). Морулярные клетки асцидии Phallusia mammilata синтезируют олигопептид морулин, содержащий 6-бромтриптофан и тригидроксифенилаланин (ТОФА), который, возможно, является предшественником тунихромов (Taylor et al., 1997).
Исследования клеток крови Styela rustica показали, что в морулярных клетках содержатся два мажорных белка, одним из которых является белок р48 с молекулярной массой 48 кДа (Podgornaya, Shaposhnikova, 1998). При этом известно, что морулярные клетки участвуют в образовании туники, в которую они выделяют содержащиеся в них белки, в том числе фермент фенолоксидазу (Чага, 1980б). Однако описанные до настоящего времени белки-субстраты фенолоксидазы асцидий не превосходили по молекулярной массе 4 кДа (Lee et al., 1997; Taylor et al., 1997; Abebe et al., 2017). В то же время из туники асцидии Styela plicata было выделено два белка St‑C и St‑D (Bella et al., 2009), относящихся к промежуточным филаментам (Wang et al., 2000). Их молекулярная масса составляет 58 (St-C) и 45 (St-D) кДа (Bella et al., 2009). Таким образом, можно предполагать, что белок р48 является одним из высокомолекулярных компонентов туники и входит в состав фенолоксидазной системы, возможно, выполняя функцию субстрата для фермента при дегрануляции морулярных клеток. С другой стороны, его молекулярная масса соответствует молекулярной массе (48–50 кДа) белков туники S. plicata, которые относятся к промежуточным филаментам (Bella et al., 2009). Можно сделать предположение о том, что р48 входит в состав филаментов туники, часть которых может являться промежуточными филаментами матрикса согласно гипотезе Белла с соавторами (Bella et al., 2009).
Однако последовательность р48 и его функции пока неизвестны. Задачей настоящего исследования стал поиск возможных гомологов p48 и определение их локализации в тканях у нескольких видов асцидий из отряда Stolidobranchia. Для этого были получены поликлональные антитела против р48 из морулярных клеток асцидии S. rustica, названные GPaP48Sr.
МАТЕРИАЛ И МЕТОДИКА
Объекты исследования. Исследовали пять видов асцидий : Styela rustica и Styela coriacea (Styelidae), Molgula citrina (Molgulidae), Boltenia echinata и Halocynthia aurantium (Pyuridae). Первые четыре вида собраны в губе Чупа Кандалакшского залива Белого моря вблизи Беломорской биологической станции Картеш ЗИН РАН. Асцидий собирали либо в сублиторальной части моря (глубина до 10 м), либо с искусственных субстратов (3–5 м) в июле–августе 2017 г. До начала работы животных содержали в специально отведенных садках на глубине 5–7 м от поверхности воды. Halocynthia aurantium из Японского моря собраны в водной акватории морской биологической станции Восток ННЦМБ им. А.В. Жирмунского ДВО РАН (Японское море, залив Восток) в ноябре 2017 г. Для забора крови или фиксации животных из садков отбирали необходимое количество асцидий и содержали их в аквариумах с аэрируемой морской водой в изотермической комнате (при 10°С).
Сбор крови. У S. rustica тунику предварительно очищали от обрастаний, тщательно промывали фильтрованной морской водой и обсушивали фильтровальной бумагой. Тунику надрезали лезвием бритвы до уровня мышц без повреждения внутренних органов. Вытекающую из разреза кровь собирали пипеткой и смешивали с охлажденным антикоагулирующим раствором (АР: 0.3 М NaCl, 20 мМ KCl, 15 мМ ЭДТА, 10 мМ HEPES, pH 7.6) (Podgornaya, Shaposhnikova, 1998) в соотношении 1 : 1. Полученную суспензию клеток центрифугировали при 869 g в течение 5 мин. Супернатант удаляли, полученный клеточный осадок замораживали или лиофилизировали и в дальнейшем использовали для приготовления электрофоретических проб.
Получение фракций клеток крови. Часть собранной крови использовали для разделения клеток в ступенчатом градиенте Перколла (100% Percoll, Sigma), который смешивали с соответствующими объемами AР до конечных концентраций Перколла 65, 50 и 35%. По два мл каждой смеси наслаивали последовательно в стеклянную центрифужную пробирку. Собранную кровь (иногда объединяли кровь из нескольких животных) смешивали с AР в соотношении 1 : 1. Три мл смеси наносили на градиент Перколла и центрифугировали при 800 g в течение 30 мин. Слой клеток на границах фаз собирали шприцем путем бережной аспирации и отмывали в AР. Жизнеспособность клеток (распластывание на субстрате, амебоидную подвижность) и состав клеточных фракций оценивали с помощью микроскопа Микмед (ЛОМО, Россия), используя фазовый контраст.
Получение первичных антител (АТ). Белки из фракции, содержащей морулярные клетки, разделяли в условиях SDS-электрофореза по Лэммли (Laemmli, 1970) в 12%-ном полиакриламидном геле, окрашивали Кумасси бриллиантовым синим, вырезали полосу с молекулярной массой 48 кДа, отмывали от красителя в растворе 10% уксусной кислоты и 40% этанола, вымачивали в однократном фосфатном буферном растворе (pH 7.4) для удаления спирта, после чего гомогенизировали и смешивали с полным адъювантом Фрейнда. Полученной смесью иммунизировали морскую свинку подкожно. Повторную иммунизацию проводили внутримышечно через 4 нед. Через 1 нед. после второй иммунизации из сердца морских свинок забирали около 5 мл крови. Для получения сыворотки кровь центрифугировали при следующих условиях: 1073 g – 5 мин, 6708 g – 5 мин, 14 300 g – 10 мин. В полученную сыворотку добавляли 0.01% азид натрия и хранили при –20°С.
Электрофорез и иммуноблот белков клеток крови. Белки клеток цельной крови и клеток из фракций, полученных в градиенте Перколла, разделяли в условиях SDS-электрофореза по Лэммли, а затем переносили на нитроцеллюлозную мембрану, используя метод полусухого переноса (Towbin et al., 1979). В качестве маркера молекулярных весов использовали Prestained protein MW marker (Thermo Scientific, США). Проводили инактивацию сайтов неспецифического связывания 3%-ным раствором бычьего сывороточного альбумина (BSA) в трис-солевом буферном растворе, содержащем Tween 20 (TBST: 25 мM Tris-HCl pH 7.5; 130 мM NaCl; 0.05% Tween 20) в течение 1.5 ч. В растворе первых АТ (GPαp48Sr) в разведении 1 : 20 000 инкубировали блоты в течение 1 ч, после отмывки инкубировали со вторыми антителами RαGP-HRP, конъюгированными с пероксидазой хрена (Sigma, США). Сязывание АТ проявляли в растворе диаминобензидина (DAB, Sigma, США). В контрольном эксперименте вместо первых антител использовали буфер TBST. Электрофорез и иммуноблот проводили при комнатной температуре.
Фиксация животных. Использовали жидкость Буэна (Пирс, 1962). Мелких животных помещали в фиксатор целиком, более крупных асцидий разрезали на две части. Длительность фиксации составляла 2–3 сут, затем объекты отмывали от фиксатора в нескольких порциях 70%-ного этанола. Фиксированный материал хранили в 70%-ном этиловом спирте при 4°С, далее объекты заливали в парафин и изготавливали срезы толщиной 5–7 мкм на микротоме Leica SM 2000R (Германия).
Иммуногистохимическая окраска. Локализацию антигенов выявляли с помощью метода непрямого иммуномечения. После депарафинирования срезов блокировку сайтов неспецифического связывания антител проводили 2%-ным BSA в TBST в течение 2 ч. В растворе первых антител GPαP48Sr (разведение 1 : 300) срезы оставляли на 2 ч, затем связывали со вторыми антителами RαGP-HRP (Sigma), проявление связывания проводили в растворе DAB. Контрольные срезы инкубировали в буферном растворе, не содержащем первых АТ. Парафиновые срезы дополнительно окрашивали гематоксилином по Майеру и эозином, обезвоживали и заключали в даммаровую смолу. Полученные препараты анализировали при помощи светового микроскопа Leica DM6000 (Германия). Все операции по непрямому иммуномечению проводили при комнатной температуре во влажной камере.
Оценка интенсивности связывания АТ. Для оценки интенсивности связывания антител с тканями разных видов асцидий проводили измерение интенстивности окраски (оптической плотности) областей препарата, связывающих антитела. Фотографировали препараты под микроскопом Zeiss Axioplan (Германия), используя фильтр 450 нм. Интенсивность окрашивания рассчитывали по 10 окрашенным областям на каждой фотографии препарата с помощью программы PhotoM 1.21. Достоверность различия выборок считали, используя тест Манна– Уитни (Mann, Whitney, 1947) при Р = 0.05.
РЕЗУЛЬТАТЫ
В результате разделения клеток крови S. rustica в ступенчатом градиенте плотности Перколла получены три фракции клеток. Фракция I (собранная на границе плазмы и ступени с плотностью Перколла 35%) содержит преимущественно гиалиновые амебоциты (до 50%), гемоцитобласты (от 5 до 15%) и в небольшом количестве клетки других типов (Чага, 1998). Фракция II (на границе ступеней Перколла с плотностью 35 и 45%) содержит клетки разных типов, около половины которых приходится на гиалиноциты и молодые морулярные клетки. Фракция III (на границе ступеней Перколла с плотностью 45 и 60%) состоит на 95–97% из зрелых морулярных клеток. Эти результаты согласуются с результатами, описанными ранее (Podgornaya, Shaposhnikova, 1998).
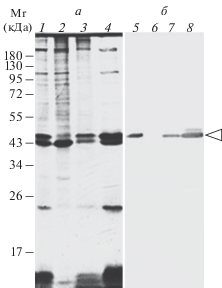
При определении белкового состава в пробе фракции морулярных клеток крови (фракция III) выявляется несколько мажорных белков, один из которых белок с молекулярной массой 48 кДа, т.е. белок p48 (рис. 2а, дорожка 4). При разведении сыворотки 1 : 20000 антитела специфически взаимодействуют с полосой, содержащей белок p48 (рис. 2б, дорожка 8). Во фракции гиалиноцитов антитела не связываются с имеющимися там белками (рис. 2б, дорожка 6). Таким образом, специфичность антител к р48 высока и их титр достаточен для выявления антигенов в тканях.
Рис. 2.
Взаимодействие антител GPαP48Sr к белку р48 морулярных клеток асцидии Styela rustica с белками клеток крови асцидии S. rustica, разделенными на фракции в градиенте плотностей Перколла. а – Результаты SDS-электрофореза по Леммли, гель окрашен Кумасси бриллиантовым синим; б – иммуноблот с использованием антител GPαP48Sr. Дорожки: 1, 5 – клетки цельной крови, 2, 6 – клетки фракции крови I (гиалиноцитов), 3, 7 – клетки фракции II, 4, 8 – фракция III (морулярные клетки). Стрелкой указана полоса 48 кДа. Слева указаны маркеры мол. массы (Mr). В контрольном эксперименте вместо первых антител использовали буферный раствор TBST (не показано).
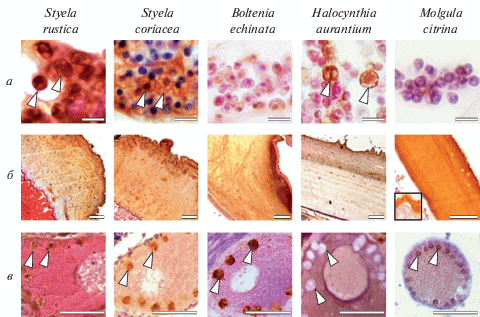
По результатам немпрямого иммуномечения на парафиновых срезах Styela rustica (Styelidae) поликлональные антитела из сыворотки GPαP48Sr взаимодействуют с морулярными клетками крови (рис. 3а), компонентами туники (рис. 3б), и тестальными клетками (рис. 3в). Среди клеток крови иммуномечению на гистологических препаратах подвергаются только зрелые морулярные клетки, содержащие гранулы, которые, после докрашивания эозином имеют характерную золотисто-желтую окраску. Во внеклеточном матриксе туники максимальная интенсивность связывания наблюдается в его поверхностных слоях. Антитела также связывают тестальные клетки, окружающие ооцит.
Рис. 3.
Непрямое иммуномечение антителами (GPαP48Sr к белку р48 морулярных клеток асцидии Styela rustica) морулярных клеток (а, стрелки), туники (б) и окружающих ооциты тестальных клеток (в, стрелки) на парафиновых срезах Styela rustica, Styela coriacea, Boltenia echinata, Halocynthia aurantium и Molgula citrina. На врезке в левом нижнем углу (б) – туника личинки M. citrina. Фиксация жидкостью Буэна. Масштабный отрезок: 10 (а) и 50 (б, в) мкм, для Halocynthia aurantium (б) – 200 мкм.
Полученные антитела использовали для дальнейшего выявления гомологов белка p48 у представителей других семейств отряда Stolidobranchia. Поиск гомологов проводили у беломорских видов Styela coriacea (Styelidae), Boltenia echinata (Pyuridae), Molgula citrina (Molgulidae), и асцидии из Японского моря Halocynthia aurantium (Pyuridae).
На рис. 4 представлены результаты измерения интенсивности связывания антител по степени окрашивания препарата. Морулярные клетки S. coriacea, представителя рода Styela, так же, как и клетки S. rustica, взаимодействуют с антителами GPαP48Sr (рис. 4а). Кроме того, иммуномечение выявило связывание антител в морулярных клетках вида H. aurantium, однако его интенсивность намного слабее, чем у видов рода Styela (рис. 3а, 4а). Тогда как у асцидий M. citrinа и B. echinata мы не наблюдаем достоверных отличий интенсивности окрашивания от контрольных препаратов.
Рис. 4.
Средняя интенсивность окрашивания, оптическая плотность, тканей асцидий (светло-серые столбцы), связывающих антитела GPαP48Sr (к белку р48 морулярных клеток асцидии Styela rustica): морулярные клетки крови (а), туника (б), тестальные клетки (в). В контрольном эксперименте (темно-серые столбцы) использовали гистологические препараты тканей, инкубированные в буферном растворе TBST вместо раствора антител GPαP48Sr. Звездочкой показана достоверность отличия от контроля при Р = 0.05. Интенсивность окрашивания определяли в программе PhotoM 1.21. Показаны средние значения с доверительными интервалами.
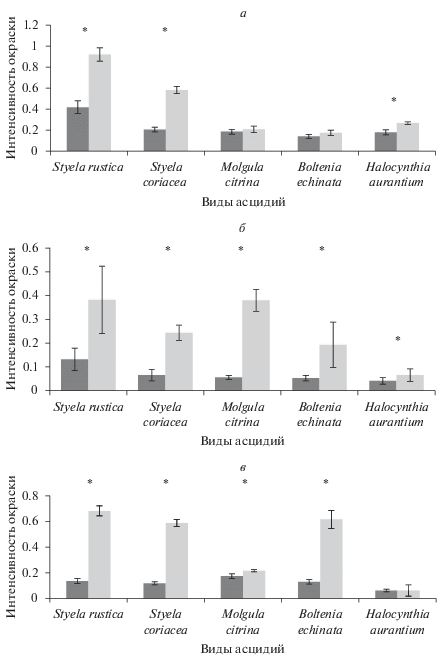
Антитела GPαP48Sr связывают антигены в тунике у всех исследованных видов асцидий (рис. 3б, 4б). Во всех случаях связывание с антителами во внутренних слоях туники происходит в меньшей степени, чем в периферических, более плотных слоях. При этом становятся заметны неоднородная плотность и волокна матрикса. Антитела связывают материал туники не только у взрослой асцидии, но и в личиночной тунике, что удается проследить на примере M. citrinа, живородящей асцидии, личинки которой развиваются в материнском организме (рис. 3б, врезка).
Антитела GPαP48Sr взаимодействуют также с тестальными клетками – одним из типов вспомогательных клеток, окружающих ооциты и эмбрионы асцидий (рис. 3в). Связывание выявляется у видов S. coriacea, B. echinata, менее интенсивно антитела связываются с содержимым тестальнык клеток M. citrinа и связывание отсутствует у H. aurantium (рис. 3в, 4в).
ОБСУЖДЕНИЕ
Проверка взаимодействия полученных антител с белками из фракций клеток крови в условиях иммуноблота показала специфичность взаимодействия антител с белком p48. Учитывая, что белок p48 является мажорным белком морулярных клеток, основная деятельность которых связана с работой фенолоксидазной системы (Чага, 1980б), можно предположить, что он относится к этой системе. Так же, как у ракообразных и насекомых, система фенолоксидазы асцидий активируется в месте повреждения или инфекции, тем самым играя роль в защитных реакциях и заживлении ран (Amparyup et al., 2013). Для модельного вида асцидий Ciona intestinalis выявлены и секвенированы две различные фенолоксидазы (по базе данных GenBank/EMBL) CinPO-1 и CinPO-2: AJ547813 (CinPO-1) и AJ547814 (CinPO-2) (Immesberger, Burmester, 2004). CinPO-2 участвует в реакциях врожденного иммунитета и экспрессируется воспалительными гемоцитами, которые заполняют сосудистый эпителий глотки и выходят в матрикс туники в ответ на введение животным липополисахаридов клеточной стенки бактерий (Cammarata et al., 2008).
Экспрессия гена и синтез белка CinPO-2 происходит и в окружающих ооцит и зародыш тестальных клетках, начиная со стадии вителлогенеза до стадии гаструлы. Более того, на этих стадиях ооплазма содержит множество мелких вакуолей, с которыми связывается рибонуклеотидный зонд к транскрипту CinPO-2 (Parrinello et al., 2018).
В то же время фенолоксидазная система асцидий участвует в образовании туники (Чага, 1980б). Туника асцидий подвергается фенольному задубливанию – склеротизации белков хинонами. Хиноны образуются из фенолов в результате действия фенолоксидазы. Известно, что морулярные клетки крови содержат фенолоксидазу, мигрируют в тунику и секретируют там свое содержимое (Hirose, 2009; Smith, 1970). В составе морулярных клеток также присутствуют тунихромы – небольшие пептиды, содержащие один из субстратов фенолоксидазы ДОФА. Вероятно, тунихромы являются структурными белками, которые участвуют в задубливании туники (Abebe et al., 2017). Нами показано, что антитела против белка р48 связываются как с материалом туники, так и с содержимым морулярных клеток. Однако белок р48 сильно превосходит тунихромы по значению молекулярной массы. Можно предположить, что р48 может являться высокомолекулярным предшественником тунихромов, как было показано для других белков-субстратов фенолоксидазы (Lee et al., 1997; Taylor et al., 2000), или же являться собственно ферментом, однако масса известных фенолоксидаз асцидий (Immesberger, Burmester, 2004; Cammarata et al., 2008) превышает значение 48 кДа.
Тунихромы асцидий являются аналогами соединений, которые участвуют в склеротизации и упрочнении кутикулы насекомых (Sugumaran, 1998; Andersen, 2010). Структурные белки и углеводный полимер хитин при ковалентном взаимодействии с реакционноспособными соединениями (аналогами тунихромов асцидий) неферментативно реагируют, в результате образуются белок-белковые, белково-хитиновые и хитин-хитиновые аддукты и поперечные связи, которые необходимы для формирования и задубливания кутикулы (Sugumaran, 1998). Таким образом, белок р48 может являться высокомолекулярным структурным компонентом, который подвергается сшивке под действием тунихромов. Такими высокомолекулярными компонентами могут являться, в частности, описанные ранее промежуточные филаменты туники асцидий (Wang et al., 2000; Bella et al., 2009).
Тестальные клетки асцидий окружают ооцит, располагаясь под хорионом (Cloney, 1982; Cloney, Hansson, 1996; Sato et al., 1997). Одной из основных функций тестальных клеток считается участие их в формировании личиночной туники. Продемонстрировано, что тестальные клетки у ряда асцидий (Сем. Ascidiidae и Cionidae) наносят содержимое своих вакуолей на внешний кутикулярный слой (Cl) личиночной туники во время позднего эмбриогенеза (Cloney, 1982; Cloney, Hansson, 1996; Sato et al., 1997). Секреторные компоненты в вакуолях тестальных клеток, содержащие кислые мукополисахариды и гликопротеины, могут выполнять подобную функцию и у представителей других семейств асцидий (Шапошникова и др., 2011).
Полученные нами данные демонстрируют, что антитела против белка р48 взаимодействуют не только с туникой взрослой асцидии, но и с личиночной туникой и тестальными клетками. Локализация белка р48 в тестальных клетках подтверждает возможность его участия в формировании личиночной туники.
Связывание антителами одинаковых структур у всех изученных представителей разных семейств отряда Stolidobranchia дает возможность предполагать наличие гомолога белка p48 у асцидий S. coriacea, M. citrina, B. echinata, H. aurantium и сходство механизмов его участия в процессах формирования туники, по крайней мере, в пределах отряда. Получены транскриптомы как минимум 18 видов асцидий, входящих в состав отряда Stolidobranchia, в их числе транскриптомы некоторых видов рода Styela. Так же доступны геномы таких асцидий, как H. aurantium, Halocynthia roretzi, Molgula oculata (Alié et al., 2018). Таким образом, геном или транскриптом любого из этих видов может быть использован для поиска последовательности гомологов р48.
У исследованных нами видов степень связывания антител с морулярными и тестальными клетками различна. Доказано, что оболочники образовались как обособленная филогенетическая группа ~450–350 млн лет назад в отличие от 40 млн лет в случае позвоночных. При этом скорость молекулярной эволюции оболочников оказалась выше чем у позвоночных и головохордовых соответственно в 6.25 и в 2.08 раза (Delsuc et al., 2018). Та же тенденция к высокой скорости дивергенции наблюдается в пределах самого таксона Оболочники (Tunicata) (рис. 1). Например, сходство аминокислотных последовательностей между двумя видами асцидий M. occidentalis и M. tectiformis составляет 88.1%, тогда как сходство между разными родами черепах Phrynops и Chrysemys составляет 98.0%. Таким образом, могут существовать значительные расхождения в нуклеотидной и аминокислотной последовательностях между модельными видами, несмотря на их принадлежность к одному и тому же роду (Delsuc et al., 2018) (рис. 1). Поэтому различия интенсивности и тканеспецифичности связывания антител могут объясняться видоспецифичными отличиями в аминокислотной последовательности белка р48.
Различия интенсивности связывания антител между разными видами могут также объясняться отличиями посттрансляционной модификации гомологов р48. Продемонстрированное в нашей работе связывание антител с тестальными клетками S. coreacea и B. echinata, содержащими большое количество полисахаридов (Шапошникова и др., 2011), может свидетельствовать в пользу того, что исследуемый белок является гликопротеином, и антитела узнают гликозилированные участки белка. С этим согласуется слабое связывание антител с тестальными клетками M. citrina, у которой содержание полисахаридов в тестальных клетках намного ниже, чем у остальных видов (Шапошникова и др., 2011). Наиболее интенсивное связывание антител в тунике происходит на периферических слоях, что вероятно обусловлено сильной степенью задубливания в этих районах (Чага, 1980б; Burighel, Cloney, 1997).
Таким образом, в проделанной работе показано связывание антител с морулярными клетками асцидий S. rustica, S. coreacea, B. echinata, а также c матриксом туники у всех исследованных видов и с тестальными клетками S. rustica, S. coreacea, B. echinata, M. citrina. Это дает возможность предполагать наличие гомолога белка p48 у всех изученных асцидий и сходство механизмов его участия в процессах формирования туники.
Список литературы
Исаева В.В., Голубев А.Г. 2017. Оболочники – наши ближайшие беспозвоночные родственники. Биосфера. 9(3) : 242–260. (Isaeva V.V., Golubev A.G. 2017. Tunicates: our closest invertebrate relatives. Biosfera. 99(3) : 242–260.)
Сукачев А.Н., Дьячков И.С., Романюк Д.С., Куймейко В.В., Синицына В.Ф., Королькова Е.Д, Харазова А.Д., Полевщиков А.В. 2013. Морфологический анализ гемоцитов асцидии Halocynthia aurantium. Цитология. 55(№ 12) : 901–906. (Sukhachev A.N., Dyatchkov I.S., Romanyuk D.S., Kumeyko V.V., Sinitsina V.F., Korolkova E.D., Kharazova A.D, Polevschikov A.V. 2013. Morphological analysis of hemocytes of ascidian Halocynthia aurantium. Tsitologiya. 55(12) : 901–906.)
Чага О.Ю. 1980a. Морфология и гистохимия клеток крови асцидии Molgula citrina. Цитология. 22(3) : 287–295. (Chaga O.Yu. 1980a. Morphology and histochemistry of blood cells of an ascidian Molgula citrina Alder and Hancook. Tsitologiya. 55(3) : 287–295.)
Чага О.Ю. 1980б. Орто-дифенолоксидазная система асцидий. Цитология. 22(6): 619–625. (Chaga O.Yu. 1980b. Ortho-diphenoloxidase system of ascidians. Tsitologiya. 22(6) : 619–625.)
Чага О.Ю. 1998. Клетки крови асцидии Styela (Goniocarpa) rustica. Цитология. 40(1): 31–44. (Chaga O.Yu. 1998. Blood cells of the ascidian Styela (Goniocarpa) rustica. Tsitologiya. 40(1) : 31–44.)
Шапошникова Т.Г., Столбовая А.Ю., Пономарцев П.В., Подгорная О.И. 2011. Иммуно- и гистохимические характеристики морулярных и тестальных клеток трех видов асцидий. Цитология. 53(12) : 986–991. (Shaposhnikova T.G., Stolbovaya A. Yu., Ponomartsev N.V., Podgornaya O.I. 2011. Immuno- and histochemistry characteristics of morula and test cells in three ascidian species. Tsitologiya. 53(12) : 986–991.)
Abebe A., Kuang Q.F., Evans J., Robinson W.E., Sugumaran M. 2017. Oxidative transformation of a tunichrome model compound provides new insight into the crosslinking and defense reaction of tunichromes. Bioorg. Chem. 71 : 219–229.
Alié A., Hiebert L.S., Simion P., Scelzo M., Prünster M.M., Lotito S., Delsuc F., Douzery E.J.P., Dantec C., Lemaire P., Darras S., Kawamura K., Brown F.D., Tiozzo S. 2018. Convergent acquisition of nonembryonic development in Styelid ascidians. Mol. Biol. Evol. 35 : 1728–1743.
Amparyup P., Charoensapsri W., and Tassanakajon A. 2013. Prophenoloxidase system and its role in shrimp immune responses against major pathogens. Fish Shellfish Immunol. 34 : 990–1001.
Andersen, S.O. 2010. Insect cuticular sclerotization: a review. Insect Biochem. Mol. Biol. 40 : 166–178.
Ballarin L., Franchi N., Schiavon F., Tosatto S.C.E., Mičetić I., Kawamura K. 2012. Looking for putative phenoloxidases of compound ascidians: Haemocyanin-like proteins in Polyandrocarpa misakiensis and Botryllus schlosseri. Devel. Compar. Immunol. 38 : 232–242.
Bella. M.A., Carbone M.C., D’Amato M., Alessandro R., De Leo G. 2009. The identification and localization of two intermediate filament proteins in the tunic of Styela plicata (Tunicata, Styelidae). Tissue Cell. 41 : 381–389.
Berrill N.J. 1936. II – Studies in Tunicate development. Part V – The evolution and classification of Ascidians. Phil. Trans. R. Soc. Lond. B. 226 : 43–70.
Burighel P., Cloney R.A. 1997. Hemichordata, Chaetognatha, and the invertebrate chordates. In: Microscopic Anatomy of Invertebrates. N.Y.: Wiley-Liss. P. 221–347.
Cammarata M., Arizza V., Cianciolo C., Parrinello D., Vazzana M., Vizzini A., Salerno G., Parrinello N. 2008. The prophenoloxidase system is activated during the tunic inflammatory reaction of Ciona intestinalis. Cell Tiss. Res. 333 : 481–492.
Cammarata M., Parrinello N. 2009. The ascidian prophenoloxidase activating system. Invertebr Survival J. 6 : 67–76.
Cloney R.A. 1982. Ascidian larvae and the events of metamorphosis. Integ. Comp. Biol. 22 : 817–826.
Cloney R.A., Hansson L.J. 1996. Ascidian larvae: The Role of test cells in preventing hydrophobicity. Acta Zoologica. 77 : 73–78.
Delsuc F., Brinkmann H., Chourrout D., Philippe H. 2006. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 : 965–968.
Delsuc F., Philippe H., Tsagkogeorga G., Simion P., Tilak M.-K., Turon X., López-Legentil S., Piette J., Lemaire P., Douzery E.J.P. 2018. A phylogenomic framework and timescale for comparative studies of tunicates. BMC Biol. 16 : 39.
Hirose E. 2009. Ascidian tunic cells: Morphology and functional diversity of free cells outside the epidermis. Invert. Biol. 128 : 83–96.
Hirose E., Shirae M., Saito Y. 2003. Ultrastructures and classification of circulating hemocytes in 9 botryllid ascidians (Chordata: Ascidiacea). Zool. Sci. 20 : 647–656.
Immesberger A., Burmester T. 2004. Putative phenoloxidases in the tunicate Ciona intestinalis and the origin of the arthropod hemocyanin superfamily. J. Comp. Physiol. B. 174 : 169–180.
Kocot K.M., Tassia M.G., Halanych K.M., Swalla B.J. 2018. Phylogenomics offers resolution of major tunicate relationships. Mol. Phylogenet. Evol. 121 : 166–173.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 : 680–685.
Lahille F. 1886. Sur la classification des Tuniciers. P. 446–448. цит. пo: Kocot et al., 2018.
Lee I.H., Cho Y., Lehrer R.I. 1997. Styelins, broad-spectrum antimicrobial peptides from the solitary tunicate, Styela clava. Comp. Biochem. Physiol. B. Biochem. Mol. Biol. 118 : 515–521.
Lehmann E.L. 1992. Introduction to student (1908) the probable error of a mean. In Breakthroughs in Statistics: Methodology and Distribution. N.Y: Springer. P. 29–32.
Mann H.B., Whitney D.R. 1947. On a test of whether one of two random variables is stochastically larger than the other. Ann. Math. Statist. 18 : 50–60.
Parrinello D., Sanfratello M.A., Parisi M.G., Vizzini A., Cammarata M. 2018. In the ovary of Ciona intestinalis (Type A), immune-related galectin and phenoloxidase genes are differentially expressed by the follicle accessory cells. Fish Shellfish Immunol. 72 : 452–458.
Parrinello N., Arizza V., Chinnici C., Parrinello D., Cammarata M. 2003. Phenoloxidases in ascidian hemocytes: characterization of the pro-phenoloxidase activating system. Comp. Biochem. Physiol. B: Biochem. Mol. Biol. 135 : 583–591.
Parrinello N., Arizza V., Cammarata M., Giaramita F.T., Pergolizzi M., Vazzana M., Vizzini A., Parrinello D. 2007. Inducible lectins with galectin properties and human IL1α epitopes opsonize yeast during the inflammatory response of the ascidian Ciona intestinalis. Cell Tiss. Res. 329 : 379–390.
Podgornaya O.I., Shaposhnikova T.G. 1998. Antibodies with the cell-type specificity to the morula cells of the solitary ascidians Styela rustica and Boltenia echinata. Cell Struct. Funct. 23 : 349–355.
Rowley A.F. 1982. Ultrastructural and cytochemical studies on the blood cells of the sea squirt, Ciona intestinalis. Cell Tiss. Res. 223 : 403–414.
Sato Y., Terakado K., Morisawa M. 1997. Test cell migration and tunic formation during post-hatching development of the larva of the ascidian, Ciona intestinalis. Dev. Growth Differ. 39 : 117–126.
Shirae M., Saito Y. 2000. A comparison of hemocytes and their phenoloxidase activity among botryllid ascidians. Zoo. Sci. 17 : 881–891.
Smith M.J. 1970. The blood cells and tunic of the ascidian halocynthia aurantium (pallas). I. hematology, tunic morphology, and partition of cells between blood and tunic. Biol. Bull. 138 : 354–378.
Smith V.J., Peddie C.M. 1992. Cell cooperation during host defense in the solitary Tunicate Ciona intestinalis (L). Biol. Bull. 183 : 211–219.
Stach T., Turbeville J.M. 2002. Phylogeny of Tunicata inferred from molecular and morphological characters. Mol. Phylogenet. Evol. 25: 408–428.
Sugumaran M. 1998. Unified mechanism for sclerotization of insect cuticle. In: Advances in insect physiology. N.Y.: Academic Press. P. 229–334.
Swalla B.J., Cameron C.B., Corley L.S., Garey J.R. 2000. Urochordates are monophyletic within the deuterostomes. Syst. Biol. 49 : 52–64.
Taylor S.W., Craig A.G., Fischer W.H., Park M., Lehrer R.I. 2000. Styelin D, an extensively modified antimicrobial peptide from ascidian hemocytes. J. Biol. Chem. 275 : 38 417–38 426.
Taylor S.W., Kammerer B., Nicholson G.J., Pusecker K., Walk T., Bayer E., Scippa S., de Vincentiis M. 1997. Morulin Pm: a modified polypeptide containing TOPA and 6-bromotryptophan from the morula cells of the ascidian, Phallusia mammillata. Arch. Biochem. Biophys. 348 : 278–288.
Towbin H., Staehelin T. Gordon J. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Nat. Acad. Sci. USA 76 : 4350–4354.
Winchell C.J., Sullivan J., Cameron C.B., Swalla B.J., Mallatt J. 2002. Evaluating hypotheses of deuterostome phylogeny and chordate evolution with new LSU and SSU ribosomal DNA data. Mol. Biol. Evol. 19 : 762–776.
Zeng L., Jacobs M.W., Swalla B.J. 2006. Coloniality has evolved once in Stolidobranch ascidians. Integr. Comp. Biol. 46 : 255–268.
Дополнительные материалы отсутствуют.


