Цитология, 2019, T. 61, № 5, стр. 385-392
Оптимизация механических свойств и биоактивности композитных матриц на основе хитозана и нанофибрилл хитина для тканевой инженерии
Н. В. Смирнова 1, 2, *, К. А. Колбе 2, Е. Н. Дресвянина 1, 3, И. П. Добровольская 1, 2, В. Е. Юдин 1, 2
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет промышленных технологий и дизайна
191186 Санкт-Петербург, Россия
* E-mail: nvsmirnoff@yandex.ru
Поступила в редакцию 13.12.2018
После доработки 30.01.2019
Принята к публикации 01.02.2019
Аннотация
В настоящей работе рассматриваются механические свойства пленочных матриц на основе хитозана, а также возможность оптимизации этих свойств путем добавления нанофибрилл хитина. Показано, что при введении наполнителя механические свойства композитного материала стабилизируются. Изменяя концентрацию нанофибрилл хитина, можно получить матрицы с различными биоактивными свойствами по отношению к культуре дермальных фибробластов человека. Оптимальным балансом механических свойств и биоактивности по отношению к культуре дермальных фибробластов человека обладают пленочные матрицы на основе нанокомпозита хитозана с добавлением 5% нанофибрилл хитина.
В реальном секторе тканевой инженерии основная технология использования матриц предусматривает заселение их клетками непосредственно перед имплантацией или во время нее. В этом случае процесс восстановления ткани зависит от позитивного или негативного отбора клеток, заселяющих матрицу, эффективности их адгезии, процессов миграции и позиционирования на матрице, последующего выживания, пролиферации и дифференцировки клеток. Другой важной стороной восстановительного процесса становится эффективный синтез de novo внеклеточного матрикса параллельно с постепенной биодеградацией вещества матрицы и безопасной утилизацией олигомеров. Все это предполагает необходимость единовременного управления данными событиями, которое можно осуществлять за счет подбора матрицы, обладающей химическими, топографическими и механическими свойствами, адекватными для конкретного клинического применения (Wong et al., 2004).
Несмотря на значительные успехи в разработке биоматериалов, до настоящего времени для регенеративных технологий актуальна потребность в полимерных материалах, характеризующихся экологичностью переработки, биосовместимостью, биоактивностью и способностью к безопасной биорезорбции. В полной мере этим требованиям отвечают хитин (CN) и хитозан (CS), обладающие, кроме перечисленных свойств, дополнительными преимуществами – антибактериальной и фунгицидной активностью, обезболивающим, ранозаживляющим и гемостатическим свойствами (Панарин и др., 2009).
CS является линейным, полукристаллическим полисахаридом, который получают из натурального полимерного CN после частичного дезацетилирования химическим гидролизом в щелочных условиях или путем ферментативного гидролиза. Макромолекулы CN и CS имеют гетероцепное строение и построены из остатков D-глюкозамина и N-ацетил-глюкозамина, связанных β-1,4-гликозидными связями. В CN преобладают остатки N-ацетил-глюкозамина, а в CS – D-глюкозамина. CS может находиться в двух химических формах: солевой (С-форма) и основной (О-форма). CS в форме поликатиона хорошо растворяется в воде, а в форме полиоснования, наоборот, проявляет гидрофобные свойства (Aranaz et al., 2009).
Двумя главными физико-химическими характеристиками CS являются степень дезацетилирования и молекулярная масса (Лопатин, 2010). Эти характеристики оказывают большое влияние на свойства и, следовательно, особенности биомедицинского применения материалов на основе CS (Kumirska et al., 2011). В ряде областей применение CS с высокой молекулярной массой и, как следствие, низкой растворимостью в воде и разбавленных кислотах, а также высокой вязкостью растворов даже при низких концентрациях, ограничено. Биомедицинское применение нашли CS низкого молекулярного веса с высокой растворимостью и низкой вязкостью водных растворов при физиологических значениях рН (Enescu, Olteanu, 2008).
Степень деацетилирования влияет на биосовместимость, биоразлагаемость, растворимость в кислых растворах, гидрофильность, набухание в воде, и, как следствие, биологическую активность CS (Romanova et al., 2015). Поскольку матриксы, использующиеся для различных технологий регенерации тканей, требуют разной скорости деградации, гибкая регуляция скорости биорезорбции делает CS применимым для восстановления почти всех типов тканей.
CS – линейный полиэлектролит с высокой плотностью положительного заряда, способный эффективно взаимодействовать с отрицательно заряженными молекулами, в том числе молекулами клеточной поверхности (Скрябин и др., 2002). Катионный характер CS помогает в образовании полиэлектролитных комплексов с широким спектром анионных гликозаминогликанов, включая гепарин, гепарансульфат и хондроитинсульфат. Гликозаминогликаны, в частности гепарин и гепарансульфат, обладают способностью связывать ростовые факторы и цитокины, а также инициировать или индуцировать их синтез. Таким образом, конструкции, содержащие комплексы хитозан-гликозаминогликан, могут использоваться в качестве систем, способных к удержанию и накоплению необходимых факторов, выделяемых колонизирующимися клетками и ростовых факторов из окружающих биологических жидкостей. Показана роль таких комплексов в технологиях регенерации костной и хрящевой ткани (Muzzarelli et al., 2012).
Функциональные группы CS обеспечивают его конъюгацию с биологически активными молекулами, такими, как ламининовые пептиды, RGD-содержащие пептиды/белки, γ-полиглутаминовая кислота и т.д. Таким образом, на матрице могут быть стабилизированы биологически активные молекулы, принимающие участие в адгезии, пролиферации, дифференцировке клеток и других, существенных для восстановления тканей процессах (Rao et al., 2009).
Изучение физико-химических и механических свойств CS позволило разработать многочисленные технологии переработки, модификации и формования на его основе различных типов матриц для регенеративной медицины. Выбор из нескольких типов матриц, включая волокна, пленки, губки и гидрогели, позволяет лучше имитировать свойства поверхности и механические характеристики принимающей имплантат ткани.
При всех перечисленных преимуществах применение CS имеет некоторые ограничения, такие как отсутствие соответствующего биологического ответа, частично вызванное неподходящими для многих применений механическими свойствами CS и его сильным набуханием в жидкости. Кроме того, трудность использования чистого CS в качестве основы матрицы для культивирования клеток может быть связана с электростатическими взаимодействиями положительно заряженных аминогрупп CS с клеточной поверхностью, что нарушает активность трансмембранных клеточных рецепторов. Это, в свою очередь отрицательно влияет как на адгезию клеток к поверхности, так и на их пролиферацию (Pinheiro et al., 2012). Снижение поверхностного заряда уменьшает данный эффект.
В этой связи одним из способов оптимизации свойств матриц на основе CS является введение минеральных или органических наноразмерных наполнителей. Для успешного применения нанокомпозитов решающее значение имеет большая удельная площадь наночастиц, которая обеспечивает высокое отношение площади поверхности к объему. Это сказывается в виде увеличения прочности взаимодействия между полимером и нанонаполнителем. При устойчивом межфазном взаимодействии превосходные свойства наночастиц переносятся в композит (Hussain et al., 2006; Кербер, 2008). Изготовление нанокомпозитов позволяет регулировать свойства природных полимеров, таких как CS (например, их пористость, морфологию поверхности и механическую прочность) в широких пределах и придавать новые функциональные свойства нативным макромолекулам (Dufresne et al., 2013).
Для целого ряда биомедицинских технологий необходимы материалы, которые обладают способностью к биорезорбции как матрицы, так и наполнителя. Одним из биосовместимых, биоактивных и биорезорбируемых полимеров, который с успехом может быть использован в качестве наполнителя, является CN. Основным структурным элементом CN являются нанофибриллы, которые представляют собой высокоориентированные агрегаты макромолекул с поперечным размером 15–20 нм и продольным 400–500 нм (Добровольская и др., 2015). В природе такая структура обеспечивает высокую механическую прочность содержащих CN тканей. Для кристаллической структуры CN характерен полиморфизм – существование двух кристаллических модификаций, в которых макромолекулы расположены анти-(α-CN) или параллельно (β-CN).
В ряде биомедицинских исследований показана возможность модифицировать CS и другие биополимеры путем введения наполнителя, состоящего из нанофибрилл (нановискерсов) хитина (CNWs) (Sriupayo et al., 2005). Исследования in vitro демонстрируют, что CNWs, обладая большой площадью поверхности, эффективно взаимодействуют с ферментами, белковыми и клеточными компонентами крови, иммунными клетками, фибробластами и другими клетками, задействованными в тканевой регенерации. Таким образом, при применении CNWs в регенеративных технологиях происходит модуляция грануляционных процессов, в поврежденных участках стимулируется ангиогенез и регулярное отложение коллагеновых волокон, эффективнее происходит реэпителизация (Morganti et al., 2013). При этом важную роль играет антисептическое действие CNWs, вследствие чего снижается вероятность гипертрофии рубцовой ткани и контракции.
В настоящем исследовании для получения нанокомпозита на основе CS использовали наполнитель из нанофибрилл α-CN. Целью работы стало получение пленочных матриц с необходимыми механическими свойствами для стерилизации, культивирования и других манипуляций в жидких средах. Кроме того, выявлены соответствия между механическими и биоактивными свойствами матриц на примере взаимодействия экспериментальных субстратов с культурой дермальных фибробластов человека. Анализ пролиферативных особенностей (эффективности адгезии, распластывания, распределения по поверхности, отсутствия отслаивания и др.) клеток, культивируемых на модифицированных субстратах, позволил подобрать композицию полимеров, оптимальную для формования тканеинженерных матриц.
МАТЕРИАЛ И МЕТОДИКА
Синтез биоматериалов. Для получения пленок использовали CS с молекулярной массой 140 кДа и степенью деацетилирования 80% (Sigma-Aldrich, США). В качестве наполнителя вводили CNWs с поперечным размером 15–20 нм и продольным 400–500 нм (SRL “Mavi Sud”, Италия). Концентрация CNWs в водной дисперсии при pH 4.87 составляла 31.9 мг/мл, электропроводность – 116 мкСм/см.
Для получения пленок сначала готовили растворы CS с CNWs. К водной среде, содержащей CNWs, добавляли CS до конечной концентрации 2% в растворе. Содержание CNWs по отношению к CS составляло 0, 0.5, 1, 5, 10, 20%. Перед добавлением CS суспензию, содержащую CNWs, диспергировали для равномерного распределения частиц по всему объему с помощью ультразвукового генератора ИЛ10-0.63 (30 мин на частоте 23 кГц). Полученный раствор перемешивали в течение 40 мин со скоростью 1000 об./мин, после чего добавляли уксусную кислоту до концентрации в растворе 2%. Раствор дополнительно перемешивали на лабораторном высокоскоростном турбулентном смесителе L5M (Silverson, Великобритания) 10 мин, со скоростью 6000 об./мин и фильтровали. После этого из раствора CS с CNWs удаляли воздух в вакуумном шкафу UT-4630V (Ulab, Китай) в течение 24 ч при давлении 0.8 атм.
Для приготовления пленок раствор отливали на обезжиренную стеклянную поверхность и выдерживали в течение 1 сут на воздухе. Для удаления уксусной кислоты из полученного материала, после снятия со стекла пленки промывали в смеси 10%-ного водного раствора NaOH и 96%-ного C2H5OH в соотношении объемов 30 : 70. Затем пленки отмывали дистиллированной водой, сушили с фиксацией для сохранения формы и хранили при комнатной температуре.
Механические испытания материалов. Определение механических свойств полученных пленок проводили на электродинамической системе ElectroPuls E1000 (Instron, США) в режиме одноосного растяжения образцов в виде полос с шириной 2 мм и длиной базы 20 мм. Растяжение проводили со скоростью 5 мм/мин при комнатной температуре, в ходе испытания регистрировали диаграмму растяжения образца (n = 10), по которой затем определяли необходимые характеристики. Для исследуемых материалов рассчитывали модуль упругости, разрывную прочность и деформацию – основные характеристики, необходимые для описания механических свойств материала.
Оценка биосовместимости и биоактивности матриц. Использовали культуру дермальных фибробластов человека, полученную в ходе стандартных процедур в Институте цитологии РАН. Клетки культивировали в питательной среде DMEM (Панэко, Россия) с добавлением 1% L-глютамина, 1% антибиотиков (100 ед./мл пенициллина, 100 мкг/мл стрептомицина), 1% фунгизона (25 мкг/мл амфотерицин В), 12% эмбриональной сыворотки телят (Gibco, США). Клетки культивировали в CO2-инкубаторе при 37°C, в атмосфере 5%-ного CO2 и повышенной влажности.
Экспериментальные образцы пленок стерилизовали автоклавированием (40 мин при давлении 1.5 атм и температуре 121°С) (2540MK, Tuttnauer, Израиль). Круглые фрагменты пленок помещали в лунки 24-луночного культурального планшета и добавляли суспензию клеток (25 × 103) в полной культуральной среде. В качестве контроля использовали клетки, посеянные на культуральном пластике.
Контроль адгезии, роста и морфологии клеток осуществляли методами световой микроскопии с использованием инвертированного микроскопа Primo Vert (Carl Zeiss, Германия). Микрофотографии клеток получены с использованием цифровой видеокамеры Axiocam 105 color (Carl Zeiss, Германия) и программного обеспечения ZEN 2012 (blue edition) (Carl Zeiss Microscopy GmbH, Германия).
После инкубации клеток в течение 1 или 4 сут в лунки добавляли 100 мкл рабочего раствора МТТ и инкубировали образцы 2 ч. Затем аккуратно удаляли раствор, а образовавшиеся кристаллы формазана экстрагировали, добавляя в лунки по 1 мл ДМСО. Тщательно перемешав получившийся раствор семплером и при помощи термошейкера, разносили его по лункам 96-луночного культурального планшета. Регистрировали оптическую плотность раствора с использованием спектрофотометра SPECTROstar (Nan-o, США) при длине волны 570 нм. Оптическая плотность растворов коррелирует с количеством жизнеспособных клеток.
Статистическая обработка данных. Воспроизводимость данных была продемонстрирована путем анализа всех экспериментальные и контрольных групп в трех повторностях. Данные представлены как среднее значение ± его стандартная ошибка (SEM). Для статистического анализа использовали t-критерий Стьюдента, различия считали достоверными при Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на то, что во многих странах CS одобрен регуляторами для наружного применения как компонент раневых покрытий, перевязочных материалов, тканеинженерных матриц и др., для тканевой инженерии определяющее значение имеет выбор производителя CS. Необходимыми условиями является соответствие сырья заявленным характеристикам, воспроизводимость свойств в разных партиях, отсутствие значительных низкомолекулярных и белковых примесей. При сравнении свойств CS различных производителей (неопубликованные данные) мы определили, что необходимыми для формования тканеинженерных пленочных матриц физико-химическими свойствами при отсутствии цитотоксичности обладает CS (Sigma-Aldrich, США) с молекулярной массой 140 кДа и степенью деацетилирования 80%.
В качестве наполнителя использовали CNWs с поперечным размером 15–20 нм и продольным 400–500 нм (SRL “Mavi Sud”, Италия). Ранее показано, что данный вид CNWs обладает физико-химическими свойствами, оптимальными для их введения в состав нанокомпозитных материалов на основе CS и воспроизводимыми в разных партиях. При этом фибриллы не имеют большой дисперсии по размеру, эффективно диспергируются и ориентируются в CS, повышая эффективность спиннингования волокон из раствора CS (Yudin et al., 2014). Также в исследованиях in vivo нами показано, что применение раневых покрытий из нетканого материала на основе нанокомпозита CS−CNWs существенно снижало вероятность гнойных осложнений и увеличивало скорость и эффективность заживления экспериментальных скальпированных ран у крыс, а также улучшало показатели заживления при сложных раневых патологиях у крупных домашних животных (Smirnova et al., 2016).
Выбранное сырье позволяет получить отливкой из раствора прозрачные и тонкие (30–50 мкм) пленки, в состав которых введено 0, 0.5, 1, 5, 10, 20% CNWs. Диапазон концентраций наполнителя определяли анализом публикаций, в которых описаны схожие технологические подходы формования матриц (Sri-upayo et al., 2005; Ma et al., 2014).
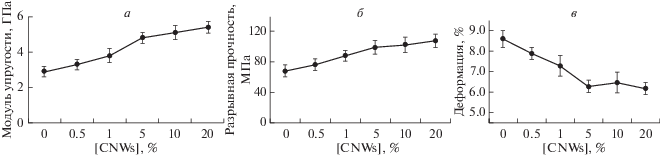
При проведении механических испытаний образцов путем одноосного растяжения с использованием электродинамической системы ElectroPuls E1000 (Instron, США) показано, что введение CNWs в количестве до 5% улучшает механические свойства матриц (рис. 1). При дальнейшем увеличении до 20% количества наполнителя улучшение механических свойств менее выражено. Представляется вероятным, что при оптимальной концентрации наполнителя происходит наиболее эффективная ориентация и установление регулярной кластерной структуры на базе CNWs, что позволяет нанофибриллам передать свои механические свойства в композит (Добровольская и др., 2015).
При концентрации наполнителя выше 20% механические свойства нанокомпозитных пленок не только не улучшаются, но даже снижаются (Sriupayo et al., 2005). Вероятным объяснением снижения механических свойств при превышении предельной концентрации наполнителя являются нарушения ориентации, кластерной структуры и образование нерегулярных конгломератов CNWs в структуре матрицы, которые ведут к нарушению передачи механических характеристик наполнителя в нанокомпозит (Добровольская и др., 2015).
Провели оценку эффективности адгезии, жизнеспособности, пролиферации и морфологии дермальных фибробластов человека при культивировании на экспериментальных пленочных матрицах на основе CS с добавлением 0, 0.5, 1, 5, 10, 20% CNWs по сравнению с культивированием на поверхности пластика. Эффективность адгезии клеток к субстрату, их жизнеспособность и активность пролиферации при контакте с экспериментальными матрицами оценивали с использованием МТТ теста, стабильность адгезии к субстрату, морфологию и структуру роста – с помощью световой микроскопии.
Рис. 1.
Значения модуля упругости (а), разрывной прочности (б) и деформации (в) экспериментальных пленочных матриц на основе хитозана с добавлением разного количества нанофибрилл хитина (CNWs).
Установлено, что через 1 сут инкубации количество и жизнеспособность прикрепленных клеток на матрицах CS + 5% CNWs выше, чем на CS, CS + 0.5% CNWs, CS + 1% CNWs (рис. 2). На 4-ые сут культивирования клетки на матрицах CS + 5% CNWs и CS + 10% CNWs демонстрируют типичную для фибробластов морфологию и равномерно распределены по субстрату (рис. 3г, 3д).
Рис. 2.
Результаты МТТ теста дермальных фибробластов человека, культивированных на поверхности нанокомпозитной матрицы на основе хитозана с добавлением 0, 0.5, 1, 5, 10 и 20% CNWs в течение 1 и 4 сут. Контроль – культивирование на пластике. Оптическая плотность коррелирует с числом жизнеспособных клеток. *P < 0.05.
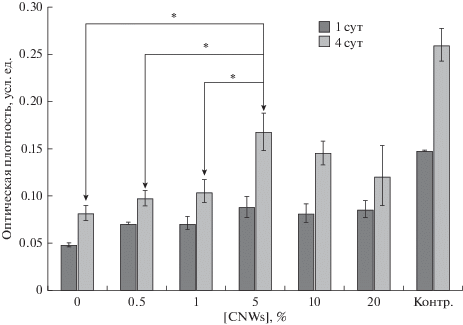
Рис. 3.
Микрофотографии дермальных фибробластов человека через 4 сут культивирования на поверхности пленочной матрицы на основе хитозана, содержащей 0 (а), 0.5 (б), 1 (в), 5 (г), 10 (д) и 20 (е) % CNWs. Контроль – культивирование на пластике (ж). Масштабная линейка: 100 мкм.
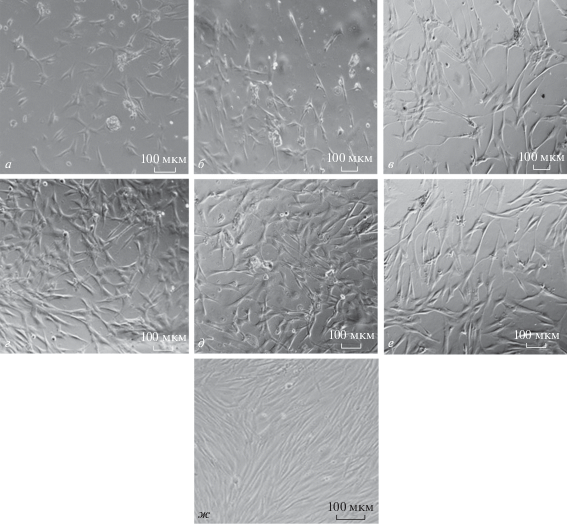
Клетки на матрицах CS + 1% CNWs и CS + + 20% CNWs имели поляризованную вдоль длинной оси форму (рис. 3в, 3е). Часть клеток на матрицах CS и CS + 0.5% CNWs образовывали слабо прикрепленные к субстрату сфероиды; адгезированные к субстрату клетки были распределены по поверхности матриц неравномерно (рис. 3а, 3б). Скорость пролиферации клеток на 4 сут культивирования была выше на CS + 5% CNWs, чем на CS, CS + 0.5% CNWs и CS + 1% CNWs (рис. 2).
Таким образом, ориентируясь на механические свойства и биоактивность экспериментальных матриц, можно предположить, что продуктивно использование композиции CS + 5% CNWs для формования пленочных, блочных пористых и волокнистых матриц для тканевой инженерии. Вероятно, такие продукты будут обладать не только оптимальными механическими свойствами, но также необходимыми параметрами нанорельефа, смачиваемости и заряда поверхности, а также показателями пористости и сорбции влаги. Возможно применение таких матриц для стимуляции регенерации кожи и мягких тканей, травмах связок и сухожилий, пластике дефектов роговицы и др.
ФИНАНСИРОВАНИЕ
Работа выполнена в рамках плановой темы № 4 на 2019 г. Института высокомолекулярных соединений РАН.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все процедуры, выполненные в исследовании с участием человека соответствуют стандартами по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям. От участника, участвующего в исследовании, было получено информированное добровольное согласие.
Список литературы
Добровольская И.П., Юдин В.Е., Иванькова Е.М., Касаткин И.А., Елоховский В.Ю. 2015. Надмолекулярная структура нанофибрилл хитина. Высокомолек. соед. 57(1) : 56–61.
Кербер М.Л. 2008. Полимерные композиционные материалы. Структура. Свойства. Технологии. СПб.: Профессия. 560 с.
Лопатин С.А. 2010. Проблемы определения молекулярно-массовых характеристик хитозана. Рыбпром. Технологии и оборудование для переработки водных биоресурсов. 2 : 82–85.
Панарин Е.Ф., Нудьга П.А., Петрова В.А., Бочек А.М., Гофман И.В., Лебедева М.Ф., Блинова М.И., Спичкина О.Г., Юдинцева Н.М., Пинаев Г.П. 2009. Матрицы для культивирования клеток кожи человека на основе природных полисахаридов – хитина и хитозана. Клеточная трансплантология и тканевая инженерия 4 : 42–46.
Скрябин К.Г., Вихорева Г.А., Варламов В.П. 2002. Хитин и хитозан: получение, свойства и применение. М.: Наука. 360 с.
Aranaz I., Mengíbar M., Harris R., Paños I., Miralles B., Acosta-Baena N., Galed G., Heras A. 2009. Functional characterization of chitin and chitosan. Curr. Chem. Biol. 3 : 203–230.
Dufresne A., Sabu T., Laly A.P. 2013. Biopolymer nanocomposites: Processing, properties, and applications. San Francisco: Wiley. 686 p.
Enescu D., Olteanu C.E. 2008. Functionalized chitosan and its use in pharmaceutical, biomedical, and biotechnological research. Chemical Engineering Communications. 195 : 1269–1291.
Hussain F., Hojjati M., Okamoto M., Gorga R.E. 2006. Review article. Polymer-matrix nanocomposites, processing, manufacturing, and application. Overview J. Composite Materials. 40 : 1511–1575.
Kumirska J., Weinhold M.X., Thöming J., Stepnowski P. 2011. Biomedical activity of chitin/chitosan based materials–influence of physicochemical properties apart from molecular weight and degree of N-acetylation. Polymer. 3 : 1875–1901.
Morganti P., Tishchenko G., Palombo M., Kelnar L., Brozova L., Spirkova M., Pavlova E., Kobera L., Carezzi F. 2013. Chitin nanofibrils for biomimetic products: nanoparticles and nanocomposite chitosan films in health-care. In: SK Kim Ed Marine Biomaterials: Isolation, Characterization and Application. N.Y.: CRC-Press. 681–715 p.
Ma B., Qin A., Li X., Zhao X., He Ch. 2014. Structure and properties of chitin whisker reinforced chitosan membranes. J. Biol. Macromol. 64 : 341–346.
Muzzarelli R.A.A., Greco F., Busilacchi A., Sollazzo V., Gigante A. 2012. Chitosan, hyaluronan and chondroitin sulfate in tissue engineering for cartilage regeneration: A review. Carbohydrate Polymers. 89 : 723–739.
Pinheiro A.C., Bourbon A.I., Quintas M.A.C., Coimbra M.A., Vicente A.A. 2012. K-carrageenan/chitosan nanolayered coating for controlled release of a model bioactive compound. Innovative Food Science and Emerging Technologies. 16 : 227–232.
Rao S.S., Winter J.O. 2009. Adhesion molecule-modified biomaterials for neural tissue engineering. Front. Neuroeng. 2 : 6. https://doi.org/10.3389/neuro.16.006.2009
Romanova O.A., Grigor’ev T.E., Goncharov M.E., Rudyak S.G., Solov’yova E.V., Krasheninnikov S.T., Saprykin V.P., Sytina E.V., Chvalun S.N., Pal’tsev M.A., Panteleev A.A. 2015. Chitosan as a modifying component of artificial scaffold for human skin tissue engineering. Cell Technologies in Biology and Medicine. 2 : 557–566.
Smirnova N.V., Petrova N.O., Lebedeva I.O., Popryadukhin P.V., Dobrovalskaya I.P., Yudin V.E. 2016. Tissue reconstruction of skin failures and soft-tissue injuries using regenerative medicine methods. St. Petersburg Polytechnical University Journal: Physics and Mathematics. 2 : 322–328.
Sriupayo J., Supaphol P., Rujiravanit R. 2005. Preparation and characterization of á-chitin whiskers reinforced chitosan nanocomposite films with or without heat treatment. Carbohydr. Polym. 62 : 130–136.
Wong J.Y., Leach J.B., Brown X.Q. 2004. Balance of chemistry, topography, and mechanics at the cell–biomaterial interface: Issues and challenges for assessing the role of substrate mechanics on cell response. Surface Science. 570 : 119–133.
Yudin V.E., Dobrovolskaya I.P., Neelov I.M., Dresvyanina E.N., Popryadukhin P.V., Ivan’kova E.M., Elokhovskii V.Yu., Kasatkin I.A., Okrugin B.M., Morganti P. 2014. Wet spinning of fibers made of chitosan and chitin nanofibrils. Carbohydrate Polymers. 108 : 176–182.
Дополнительные материалы отсутствуют.


