Цитология, 2019, T. 61, № 5, стр. 412-424
Жирнокислотный состав мембранных липидов в почках березы повислой в зимне-весенний период в условиях криолитозоны
Л. В. Ветчинникова 1, *, Т. Д. Татаринова 2, О. С. Серебрякова 1, А. А. Перк 2, А. Г. Пономарев 2, М. К. Ильинова 1, Н. Е. Петрова 1, И. В. Васильева 2
1 Институт леса КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, Россия
2 Институт биологических проблем криолитозоны СО РАН
677980 Якутск, Россия
* E-mail: vetchin@krc.karelia.ru
Поступила в редакцию 08.02.2019
После доработки 20.02.2019
Принята к публикации 20.02.2019
Аннотация
Впервые изучен жирнокислотный состав полярных липидов, являющихся структурно-функциональной основой клеточных мембран в почках березы Betula pendula Roth, произрастающей в условиях криолитозоны. Установлена важная роль липидного обмена в зимне-весенний период, когда апикальная (верхушечная) меристема находится на стадии внутрипочечного развития. Показано, что в данный период в фосфо- и гликолипидах в почках березы повислой ненасыщенные жирные кислоты преобладают над насыщенными. Однако в условиях экстремально низких температур воздуха (–40°С и ниже) зафиксированы наименьшие значения показателей индекса двойной связи (DBI) и коэффициента ненасыщенности жирных кислот (U/S). Подъем отрицательных температур в условиях криолитозоны (в марте) до значений, которые обычно наблюдаются в зимний период на всем протяжении ареала березы повислой (–20°С и выше), способствует возрастанию уровня ненасыщенности мембранных липидов. Обнаружено, что в фосфолипидах преобладают диеновые жирные кислоты, а в гликолипидах – диеновые и триеновые, причем последние достигают максимальных значений (80.7% от суммы ненасыщенных жирных кислот) к началу распускания почек. Предполагается, что для сохранения жизнеспособности апикальной (верхушечной) меристемы в почках березы повислой в специфических условиях криолитозоны сформировались разные взаимосвязанные адаптивные механизмы, направленные не только на предохранение зачаточных органов от воздействия резких колебаний суточных температур в весенний период, но и на их защиту зимой в условиях экстремально низких температур (до –60°С), которые не встречаются в других частях ее ареала. Один из этих механизмов, по-видимому, является неспецифическим и связан с повышением ненасыщенности жирнокислотного состава, соответствующего жидкокристаллическому состоянию липидов мембран. Другой адаптивный механизм, вероятно, направлен на защиту клеток от обезвоживания с участием белков-дегидринов, а также ряда других гидрофильных криопротекторных соединений на фоне повышенной вязкости мембранных липидов.
В связи с климатическими изменениями, а также возросшим антропогенным воздействием на природные объекты, в последние годы все более актуальной становится проблема выживания организмов в экстремальных условиях среды, требующая изучения. Следует подчеркнуть, что выживаемость в экстремальных условиях древесных растений, по сравнению с травянистыми, изучена гораздо слабее, хотя из всех жизненных форм они наиболее требовательны к внешней среде, поскольку имеют многолетний и продолжительный онтогенез (от десятков лет до сотен и даже тысяч). Более того, у древесных растений особо чувствительным органом к воздействию неблагоприятных факторов (в том числе температурного) являются почки, несущие зачаточные листовые пластинки и апикальную (верхушечную) меристему.
Изучение адаптационной пластичности древесных видов приобретает особую остроту в регионах, расположенных в пограничной зоне произрастания древесно-кустарниковой растительности, к которым относится, например, территория Республики Саха (Якутия). Здесь, в природно-климатических условиях Центральной Якутии, главными факторами, определяющими жизнедеятельность и видовой состав аборигенной флоры, являются экстремально низкие температуры (до –60°С) без возвратных потеплений в зимний период, а также резкий контраст дневных и ночных температур в межсезонье. Вместе с тем, произрастая в условиях многолетней мерзлоты (криолитозона), древесные растения Якутии приобрели необычайно высокую морозоустойчивость (Бубякина и др., 2011; Татаринова и др., 2017).
В условиях действия низкотемпературного стресса (особенно в случае продолжительного по времени и экстремального по значениям) первичной мишенью у растений, как известно, выступают клеточные мембраны. Ответная реакция мембран на действие факторов внешней среды определяется сдвигами их структурной организации и функциональной активности благодаря наличию в них рецепторов белковой природы (Чиркова, 2002; Войников и др., 2004; Титов и др., 2006; Kim et al., 2009; Zhao et al., 2017; Filek et al., 2017 и др.). Изучение ультраструктурных изменений, происходящих в растительных клетках преимущественно у травянистых растений при действии низких температур позволило обнаружить рост размеров хлоропластов и модификацию формы митохондрий. Зафиксированы также изменения в тилакоидной системе в виде увеличения высоты гран и числа тилакоидов (Трунова, 2007; Титов, Таланова, 2011; Yu et al., 2011; Попов и др., 2016; Венжик и др., 2017; Бабенко и др., 2018). Структурные перестройки в мембранах под воздействием отрицательных температур существенным образом затрагивают и липиды, и их наиболее лабильные компоненты, к которым относятся жирные кислоты (ЖК). В частности, увеличение доли ненасыщенных ЖК в фосфолипидах (ФЛ) и гликолипидах (ГЛ) обуславливает более рыхлую упаковку полиеновых ЖК в липидном бислое, что влечет за собой изменение физических свойств мембранных липидов, улучшая условия для их функционирования путем повышения пластичности и текучести (Harwood, 1994; Чиркова, 2002; Theocharis et al., 2012; Лось, 2014).
Резко континентальный климат Республики Саха (Якутия), по всей вероятности, способствовал тому, что в процессе длительной эволюции древесные растения здесь выработали сложные механизмы биохимической адаптации к экстремально низким температурам, среди которых существенная роль отводится и метаболизму липидов (Петров и др., 2011; Петров, 2016; Petrov et al., 2016; Нохсоров, 2017).
Как известно, в Сибири северная граница распространения древесной растительности образована лиственницей (Крючков, 1976; Ветчинникова и др., 2013). Береза повислая (Betula pendula Roth), произрастающая в условиях криолитозоны, также находится у своих климатических пределов, в связи с чем данная древесная порода может выступать в качестве природной функциональной модели для изучения особенностей ее холодовой адаптации.
Цель настоящей работы – изучение жирнокислотного состава мембранных липидов в почках березы повислой, произрастающей в условиях криолитозоны, в зимне-весенний период.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования были 30–40-летние деревья восточно-азиатской географической расы березы повислой Betula pendula Roth, которая рядом авторов (Скворцов, 1977; Schenk et al., 2008; Выводцев, Тютрин, 2012 и др.) рассматривается в качестве самостоятельного вида – березы плосколистной B. platyphylla Sukacz. Материалом для исследований служили почки, несущие зачаточные гофрированные листовые пластинки и апикальную (верхушечную) меристему. Сбор почек осуществляли раздельно с типичных для данного вида деревьев в 2008–2013 гг., произрастающих в окрестностях г. Якутска, (62°15′ с. ш., 129°37′ в. д.) в зимне-весенний период, когда их развитие – от вынужденного покоя до начала распускания почек – напрямую зависело от действия факторов внешней среды и, в первую очередь, температуры. В настоящей работе представлены результаты изучения жирнокислотного состава липидов в почках березы повислой, сформированных в 2012–2013 гг., которые по погодно-климатическим условиям были типичными для региона. В табл. 1 приведены температурные параметры погоды за период 2012–2013 гг. (см.: https://rp5.ru/Архив_погоды_в_Якутске).
Таблица 1.
Изменение значений средней месячной температуры воздуха в окрестностях г. Якутска (2012–2013 гг.) в соответствии с годичным циклом развития березы повислой: от начала заложения почек до их распускания
| Год, месяц | Температура воздуха, °С | ||
|---|---|---|---|
| среднемесячная | минимальная (дата) | максимальная (дата) | |
| 2012 | |||
| Июнь | 19.3 | 4.5 (21.06) | 31.8 (18.06) |
| Июль | 21.0 | 6.0 (24.07) | 31.7 (14.07) |
| Август | 14.7 | 2.8 (21.08; 24.08) | 32.2 (02.08) |
| Сентябрь | 8.2 | −6.0 (25.09) | 23.1 (04.09) |
| Октябрь | −7.3 | −23.5 (28.10) | 7.1 (01.10) |
| Ноябрь | −28.6 | −40.7 (30.11) | 3.7 (01.11) |
| Декабрь | −35.4 | −44.2 (24.12; 25.12) | −24.1 (06.12) |
| 2013 | |||
| Январь | −39.8 | −47.2 (04.01) | −26.9 (31.01) |
| Февраль | −33.7 | −41.6 (03.02) | −20.9 (27.02) |
| Март | −20.0 | −35.6 (02.03; 11.03) | −1.4 (27.03) |
| Апрель | −3.0 | −28.3 (02.04) | 12.9 (29.04) |
| Май | 10.2 | −2.2 (23.05) | 22.9 (15.05) |
Примечание. Источник данных: https://rp5.ru/Архив_погоды_в_Якутске
Экстракция липидов. Липиды из меристемы почек экстрагировали смесью хлороформа и метанола в соотношении 2 : 1 по объему с добавлением воды (Folch et al., 1957). Разделение липидов на фракции проводили методом колоночной хроматографии с использованием силикагеля (Bio-Sil A100-200 меш) (Кузнецова и др., 2008). В качестве колонки служили пипетки Пастера длиной 145 мм (Simola, Koskimies-Soininen, 1984). Фракции липидов извлекали последовательно и раздельно: нейтральные липиды – хлороформом, гликолипиды – ацетоном, фосфолипиды – метанолом (Piispanen, Saranpää, 2002; Ветчинникова и др., 2017). Полноту экстракции отдельных фракций контролировали путем их порционного сбора и индивидуального сжигания в концентрированной серной кислоте с последующим спектрофотометрированием растворов при длине волны 375 нм (Marsh, Weinstein, 1966).
Метиловые эфиры ЖК получали в результате переэтерификации липидов метанолом в присутствии ацетилхлорида и анализировали на газожидкостном хроматографе “Хроматэк – Кристалл-5000 М.1” (Йошкар-Ола, Россия) с использованием капиллярной колонки HP-INNOWAX (30 м × 0.32 мм) при температурах (°С) термостата (180, изотерма), пламенно-ионизационного детектора (240) и испарителя (220), а также при скорости газа-носителя (азот) 50 мл/мин.
Идентификация индивидуальных ЖК. ЖК идентифицировали сравнением хроматографических подвижностей со стандартными ЖК (Supelco 37 component Fame Mix, Германия), а также сопоставлением эквивалентной длины цепи экспериментально полученных компонентов с известными длинами (Сиймер и др., 1971; Nakamura et al., 2014). Количественное определение ЖК проводили методом внутреннего стандарта (маргариновая кислота).
Содержание индивидуальных ЖК. Вычисляли содержание индивидуальных ЖК и их групп, объединенных по числу двойных связей в углеродной цепочке: моноеновые, диеновые, триеновые. Индекс двойной связи, или DBI (double bond index), характеризующий степень ненасыщенности липидов и коэффициент ненасыщенности, или U/S, отражающий соотношение сумм ненасыщенных ЖК (U – unsaturated) к насыщенным (S – saturated), рассчитывали по формулам, предложенным Лайонсом и др. (Ly-ons et al., 1964).
Активность ацил-липидных десатураз ω9, ω6 и ω3, катализирующих последовательно введение двойной связи в углеводородные цепи олеиновой (С18:1), линолевой (С18:2) и линоленовой (С18:3) кислот, определяли как стероил-(SRD), олеил-(ORD) и линолеил-(LRD) десатуразные отношения, рассчитанные на основании содержания (% от суммы ЖК) компонентов типа С18: SRD = (С18:1)/(С18:0 + С18:1); ORD = = (С18:2 + С18:3)/(С18:1 + С18:2 + С18:3); LRD = = (С18:3)/(С18:2 + С18:3) (Jaworski, Stumpf, 1974; Cartea et al., 1998; Алаудинова, Миронов, 2009; Розенцвет и др., 2012).
Содержание воды в почках. После сбора определяли взвешиванием свежую массу (FW). Сухую массу (DW) оценивали после высушивания тканей при температуре 105°C до постоянных значений. Содержание воды вычисляли по формуле: [(FW − DW)/FW] × 100%.
Математическую обработку данных осуществляли с помощью общепринятых методов вариационной статистики с использованием пакета программ Microsoft Excel. Данные трех и более независимых измерений представлены в виде средних арифметических значений и их стандартных отклонений. В работе обсуждаются величины, достоверные при Р ≤ 0.05.
В работе использовали: метанол, хлороформ (ООО НТК Диаэм, Россия), ацетон, гексан (ООО НеваРеактив, Россия), силикагель Bio-Sil A100-200 меш (ООО НеваРеактив, Sigma/Aldrich, США), смесь метиловых эфиров ЖК Supelco 37 сomponent FAME Mix (ООО НТК Диаэм, Supelco/Sigma-Aldrich/Германия).
РЕЗУЛЬТАТЫ
Результаты изучения жирнокислотного состава мембранных липидов в почках березы повислой, произрастающей в экстремально-климатических условиях криолитозоны, приведены в табл. 2. Согласно полученным данным, полярные липиды ФЛ и ГЛ, выполняющие важнейшую структурно-функциональную роль в мембранах, в зимне-весенний период в почках березы имеют определенные различия как по составу ЖК, так и по их содержанию. Всего в ФЛ обнаружено шесть ЖК с длиной цепи 16 и 18 атомов углерода с разным числом двойных связей или их отсутствием. Состав ГЛ отличался большим разнообразием: от 7 до 11 компонентов с числом углеродных атомов от 16 до 20, включая как насыщенные, так и ненасыщенные ЖК, но доля каждой из них зависела от фазы развития растений в зимне-весенний период.
Таблица 2.
Доля ЖК в мембранных ФЛ и ГЛ в почках березы повислой, произрастающей в условиях криолитозоны, в зимне-весенний период
| Жирные кислоты | Доля, % от суммы ЖК | |||||||
|---|---|---|---|---|---|---|---|---|
| февраль | март | апрель | май | |||||
| ФЛ | ГЛ | ФЛ | ГЛ | ФЛ | ГЛ | ФЛ | ГЛ | |
| Насыщенные: | ||||||||
| гексадекановая (пальмитиновая); | 27.51 | 26.05 | 18.63 | 16.81 | 21.53 | 22.94 | 25.53 | 20.93 |
| октадекановая (стеариновая); | 3.89 | 9.51 | 1.32 | 4.76 | 1.18 | 5.92 | 1.98 | 3.73 |
| эйкозановая (арахиновая) | 0.20 | 0.64 | 0 | 0 | 0 | 0.85 | 0 | 0.65 |
| Ненасыщенные: | ||||||||
| цис-9-гексадекановая (пальмитоолеиновая); | 0.54 | 1.08 | 1.84 | 2.06 | 0.70 | 1.05 | 1.84 | 0.84 |
| неидентифицированная; 16:1(n-5) | 0 | 0 | 0.41 | 0 | 0 | 0 | 0 | 0 |
| гексадекадиеновая; | 0 | 0 | 0 | 2.32 | 0 | 0 | 0 | 0.88 |
| цис-7,10,13-гексадекатриеновая; | 0 | 0 | 0 | 3.94 | 0 | 0 | 0 | 0 |
| цис-6-октадеценовая; | 0 | 0 | 0 | 9.16 | 0 | 0 | 0 | 0 |
| цис-9-октадеценовая (олеиновая); | 9.17 | 10.74 | 6.84 | 6.64 | 7.79 | 11.88 | 5.22 | 4.52 |
| 9,12-октадекадиеновая (α-линолевая); | 49.63 | 35.33 | 58.62 | 30.49 | 55.81 | 33.83 | 39.15 | 9.04 |
| 9,12,15-октадекатриеновая (α-линоленовая) | 9.05 | 16.65 | 12.34 | 23.82 | 13.01 | 23.53 | 26.28 | 59.42 |
Примечание. В табл. 2–4 приводятся средние значения трех и более независимых измерений.
В обоих классах липидов основной уровень насыщенных ЖК определяла пальмитиновая кислота (С16:0), доля которой варьировала от 16.8 до 27.5% от суммы ЖК. В ГЛ, кроме пальмитиновой, отмечено довольно высокое содержание стеариновой кислоты (С18:0) (до 9.5% от суммы ЖК), а также небольшое, но стабильное присутствие арахиновой кислоты (С20:0) (около 1% от суммы ЖК). Ненасыщенные ЖК в почках березы повислой, произрастающей в условиях криолитозоны, как в ФЛ, так и ГЛ, содержали только 16 и 18 атомов в углеродной цепи. Преобладающими среди них (по убыванию) были линолевая (С18:2), линоленовая (С18:3) и олеиновая (С18:1) ЖК, но их содержания в изученный период были различны. Например, в ФЛ устойчиво преобладала линолевая кислота, максимальное содержание которой зафиксировано в марте (58.6% от суммы ЖК). Позднее, к началу распускания почек, в мае, в ФЛ содержание линолевой кислоты снизилось статистически значимо в 1.5 раза (до 39.2% от суммы ЖК). ГЛ, наоборот, характеризовались повышенным содержанием линоленовой кислоты, наибольшее количество которой обнаружено также к началу распускания почек в мае (59.4% от суммы ЖК). В этот же период в ГЛ зафиксированы наименьшие значения олеиновой и линолевой ЖК (4.5 и 9.0% от суммы ЖК соответственно). В целом, содержание и соотношение ненасыщенных ЖК в ГЛ по сравнению с ФЛ в бóльшей степени зависело от фенофазы развития березы повислой (период покоя или начало вегетации). Дополнительно заметим, что в зимне-весенний период (февраль-апрель) содержание воды в почках было минимальным и варьировало в пределах 32–34%. В дальнейшем к началу вегетации (май) ее количество в тканях статистически значимо увеличивалось почти в два раза (до 61%).
Исследования показали, что в изученных классах липидов в почках березы доля ненасыщенных ЖК преобладала над насыщенными независимо от фазы их развития в зимне-весенний период (рис. 1). Особенно заметно это проявилось в марте, когда доля ненасыщенных ЖК составила 80% и более от суммы ЖК и в четыре раза превышала сумму насыщенных ЖК. В свою очередь, высокое содержание ненасыщенных ЖК привело к повышению вдвое коэффициента U/S в обоих группах липидов. Об этом же свидетельствуют данные табл. 3. Следует заметить, что по сравнению с ФЛ в ГЛ значения U/S оказались несколько ниже (за исключением фазы распускания почек в мае), а величина DBI, наоборот, выше во все изученные месяцы.
Рис. 1.
Содержание насыщенных и ненасыщенных ЖК в фосфолипидах (а) и гликолипидах (б) в почках березы повислой в зимне-весенний период в условиях криолитозоны. Здесь и на рис. 2 приведены средние арифметические значения трех и более независимых измерений и их стандартные отклонения.
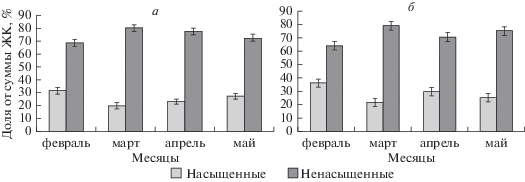
Таблица 3.
Значения коэффициентa ненасыщенности жирных кислот (U/S) и индексa двойной связи (DBI) отдельных групп липидов, содержащихся в почках березы повислой в зимне-весенний период в условиях криолитозоны
| Группа липидов |
Месяцы | |||||||
|---|---|---|---|---|---|---|---|---|
| февраль | март | апрель | май | |||||
| U/S | DBI | U/S | DBI | U/S | DBI | U/S | DBI | |
| Фосфолипиды | 2.16 | 1.99 | 4.01 | 2.04 | 3.41 | 2.06 | 2.63 | 2.27 |
| Гликолипиды | 1.76 | 2.08 | 3.64 | 2.13 | 2.37 | 2.15 | 2.95 | 2.74 |
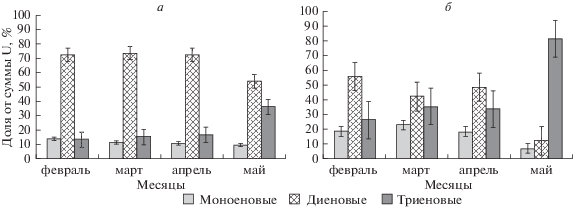
Существенные различия в составе ФЛ и ГЛ в почках березы повислой, произрастающей в условиях криолитозоны, выявлены также в соотношении моно-, ди- и триеновых ЖК (рис. 2). Например, моноеновые ЖК присутствовали в обоих классах мембранных липидов во все фазы зимне-весеннего развития растений, но к началу распускания почек (май) их доля достоверно снизилась в 1.5 и даже в 3 раза в ФЛ и ГЛ соответственно. Диеновые ЖК устойчиво преобладали в ФЛ (от 54 до 73% от суммы U) (рис. 2а), а в ГЛ – только в феврале (42–55% от суммы U). Обращает на себя внимание факт, что в ГЛ в мае доля диеновых ЖК резко уменьшилась (в 4 раза) на фоне возрастания триеновых ЖК (в 2.5 раза), которые к началу распускания почек достигли максимальных значений (80.7% от суммы U) относительно всего периода наблюдений (рис. 2б).
Рис. 2.
Динамика моно-, ди- и триеновых ЖК в фосфолипидах (а) и гликолипидах (б) в почках березы повислой в зимне-весенний период в условиях криолитозоны.
Из полученных данных также следует, что постепенный выход растений из состояния вынужденного покоя сопровождался изменениями в активности ацил-липидных десатураз (табл. 4), которые обеспечивают последовательное образование двойной связи в углеводородных цепях ЖК типа С18 (Лось, 2014; Алаудинова, Миронов, 2009) и, соответственно, отражают динамику в соотношении олеиновой, линолевой и линоленовой ЖК. Так, в период экстремально низких температур (февраль) активность ацил-липидной ω-9-десатуразы, ответственной за биосинтез олеиновой кислоты в ФЛ соответствовала 0.7, а в ГЛ – 0.53. В последующие месяцы ее активность в обоих классах липидов статистически значимо возрастала, но к началу распускания почек в мае снизилась и достигла значений, зафиксированных в феврале. В течение всего изученного периода в почках березы повислой наибольшей активностью характеризовалась ω-6-десатураза, ответственная за превращение олеиновой кислоты в линолевую: в ФЛ она варьировала от 0.86 до 0.93, а в ГЛ – от 0.83 до 0.94, достигая максимальных значений к маю.
Таблица 4.
Изменение сезонной активности ацил-липидных десатураз отдельных классов липидов в почках березы повислой в зимне-весенний период в условиях криолитозоны
| Ацил-липидные десатуразы |
Месяцы | |||||||
|---|---|---|---|---|---|---|---|---|
| февраль | март | апрель | май | |||||
| ФЛ | ГЛ | ФЛ | ГЛ | ФЛ | ГЛ | ФЛ | ГЛ | |
| ω-9 (SRD) | 0.70 | 0.53 | 0.84 | 0.58 | 0.87 | 0.67 | 0.72 | 0.55 |
| ω-6 (ORD) | 0.86 | 0.83 | 0.91 | 0.89 | 0.90 | 0.83 | 0.93 | 0.94 |
| ω-3 (LRD) | 0.15 | 0.32 | 0.17 | 0.44 | 0.19 | 0.41 | 0.40 | 0.87 |
Интересные данные получены для ω-3-десатуразы, ответственной за введение второй двойной связи: будучи минимальной по значениям в период экстремально низких температур (0.15 и 0.32 в ФЛ и ГЛ соответственно), ее величина к началу распускания почек березы возросла в 2.7 раза независимо от класса мембранных липидов и составила, например, в ГЛ 0.87.
ОБСУЖДЕНИЕ
Для поддержания в зимний период оптимального уровня жизнеспособности древесных растений, произрастающих в условиях экстремального климата, и обеспечения их дальнейшей вегетации существенное значение имеет формирование устойчивой структуры клеточных мембран. Значительная роль в этих процессах отводится жирнокислотному составу мембранных липидов зимующих органов и особенно почек, поскольку именно в них эмбриональные органы и ткани длительное время находятся в условиях сверхнизких отрицательных температур (до –60°С и ниже).
Исследования показали, что в условиях Республики Саха (Якутия) у березы повислой вегетативные почки закладываются в начале лета в год, предшествующий их вегетации, и полностью формируются к началу наступления периода глубокого покоя в сентябре. Зимний период зачаточные листовые пластинки и апикальная меристема переносят во внутрипочечном состоянии, а их распускание происходит следующей весной, в условиях криолитозоны – в первой половине мая. Наблюдаемые здесь сезонные изменения погодных условий, включающие низкие температуры в зимний период и (или) их резкие суточные перепады весной (см. табл. 1), как правило, оказывают негативное воздействие на листовые пластинки и апикальную меристему побегов в период их внутрипочечного развития.
Известно, что адаптация растений к гипотермии зависит от способности растений сохранять жидкостные свойства мембран, в том числе, за счет увеличения доли ненасыщенных ЖК. При снижении температуры происходит фазовый переход липидов мембран из жидкокристаллического состояния в гелеобразное и сопутствующее этому переходу возрастание вязкости бислоя. Помимо этого, у морозоустойчивых растений активируется синтез криопротекторов – гидрофильных белков, моно- и олигосахаров (Kosova et al., 2010).
Нами показано, что в мембранных липидах в почках березы повислой в зимне-весенний период (вплоть до начала их распускания) доля ненасыщенных ЖК преобладала над насыщенными (см. рис. 1). В их составе как в ФЛ, так и ГЛ, преобладали полиненасыщенные ЖК линолевая и линоленовая, которые обусловили высокие значения DBI и U/S (см. табл. 3), что свидетельствует о значительном потенциале морозоустойчивости березы повислой. Приведенные данные позволяют полагать, что биосинтез полиненасыщенных ЖК в составе мембранных липидов в природных условиях Центральной Якутии является одним из адаптационных механизмов, формирующих высокую криоустойчивость древесных растений. Вместе с тем, исследования показали, что в феврале, когда здесь наблюдаются устойчиво низкие отрицательные температуры воздуха, в мембранных липидах обнаружены наиболее низкие за изученный период значения суммы ненасыщенных ЖК (в среднем около 65% от суммы ЖК), которые лишь вдвое превышали сумму насыщенных. При этом также зафиксированы минимальные значения не только отношения U/S (2.16 и 1.76 – в ФЛ и ГЛ соответственно), но и индекса DBI (1.99 и 2.08 – в ФЛ и ГЛ соответственно). Это в определенной мере противоречит утвердившемуся к настоящему времени мнению о том, что низкотемпературная устойчивость растений в значительной степени обусловлена жидкокристаллическим состоянием липидных мембран, для которого характерна повышенная концентрация ненасыщенных ЖК (Трунова, 2007; Демин и др., 2008; Theocharis et al., 2012). Вероятно, в условиях криолитозоны в период экстремального низких отрицательных температур, начиная уже с ноября, в почках березы повислой происходят физико-химические модификации молекулярной организации мембран, при которых механизмы компенсации, связанные с низкотемпературной индукцией экспрессии генов десатураз, не включаются.
Известно, что температура фазового перехода липидов от гелеобразного состояния к жидкокристаллическому зависит также от содержания воды в системе: при минимальной оводненности тканей липиды могут находиться в упорядоченном состоянии даже при критически низкой температуре. В литературе имеются сведения о том, что в зимний период береза может терять до 80% воды (Колупаев, 2016), тогда как, например, озимые злаки при замораживании менее устойчивы к обезвоживанию (не более 50%) (Трунова, 2007). Добавим, что одним из путей адаптации растений к низким температурам является такое изменение состояния воды в клетках, при котором обеспечивается минимизация опасных для клетки последствий ее внутри- и внеклеточной кристаллизации, в том числе, и связанного с этими процессами обезвоживания клеток и клеточных структур. В частности, по данным Алаудиновой и соавторов (Алаудиновa и др., 2007; Алаудинова, 2011), у ряда хвойных пород в условиях Сибири при определенном уровне обезвоживания клеток структура биомембран становится нечувствительной к температурному воздействию в зимний период, причем снижение оводненности, как правило, начинается уже в середине сентября, т.е. задолго до наступления холодов. Кроме того, вплоть до –40°С в клетках меристематических тканей хвойных в условиях внеклеточного и внеорганного льдообразования сохраняется жидкая фаза воды. Возможно, в период подготовки древесных растений к зиме в их тканях снижается уровень содержания воды, который приводит к формированию сигнала, индуцирующего экспрессию генов, участвующих в других разнообразных биохимических механизмах защиты клеток (Karlson et al., 2003). Например, в почках березы повислой в условиях экстремального климата криолитозоны синтезируются стрессовые белки-дегидрины, что позволяет использовать их даже в качестве непрямых маркеров морозоустойчивости (Kosova et al., 2010; Бубякина и др., 2011; Татаринова и др., 2011, 2013, 2018; Пономарев и др., 2014).
Дальнейший подъем температуры от экстремально низких значений до тех, которые обычно наблюдаются практически на всем протяжении ареала березы повислой в зимний период (в среднем около –20°С), способствует возрастанию ненасыщенности жирнокислотного состава липидов и восстановлению жидкостных свойств мембран. В условиях криолитозоны такие значения температуры, как правило, наблюдаются только в марте. К этому периоду в наших исследованиях значение величин U/S и DBI достигли максимальных: в ФЛ они составляли соответственно 4.01 и 2.04, а в ГЛ – 3.64 и 2.13 соответственно. При этом ненасыщенные ЖК, по всей вероятности, определяли уровень вязкости мембран, а насыщенные – выполняли субстратную и (или) энергетическую роль.
Согласно нашим данным, увеличение содержания воды в тканях почек березы повислой в условиях Центральной Якутии обычно наблюдается при минимальной температуре воздуха около 0°С. С ее повышением в среднем до 5°С (к началу распускания почек в мае) уровень воды в клетках может превышать зимний уже в вдвое (Пономарев и др., 2014). Вместе с тем, в апреле меристемы почек еще обладают определенной устойчивостью, достаточной для того, чтобы выдержать понижение температуры примерно до –20°С (Татаринова и др., 2011). Скорость накопления двойных связей ЖК на этом этапе происходила менее интенсивно, но значимо увеличивалась к началу распускания почек, что особенно наблюдалось для ГЛ.
Анализ динамики отдельных ЖК обнаружил различия в содержании олеиновой кислоты (С18:1), которая может оказывать влияние на функциональное состояние мембран растений, поскольку является субстратом для синтеза ди- и триеновых (линолевой и линоленовой) ЖК (Лось, 2005). Структурно-функциональная роль и локализация мембранных липидов в клетках, как известно, значительно различаются. Так, ФЛ являются ключевыми компонентами плазмалеммы и других непластидных эндомембран, а из ГЛ построены мембраны хлоропластов. Наибольшие количества олеиновой кислоты наблюдали во фракции ГЛ, где она достигла 11.9% от суммы ЖК. И это неслучайно, поскольку образование олеиновой кислоты происходит в строме хлоропластов (Лось, 2001). У березы повислой с началом распускания почек, сопровождающегося разворачиванием ранее гофрированной листовой пластинки, в ГЛ наблюдалось резкое снижение содержания олеиновой кислоты на фоне значительного возрастания линоленовой. Десатурация линолевой кислоты в линоленовую обусловлена, вероятно, мембранными механизмами, обеспечивающими повышение устойчивости меристематических тканей к резким суточным колебаниям температуры в условиях криолитозоны. Не исключено также, что подобные структурные перестройки могут происходить в тилакоидных мембранах хлоропластов при формировании зачаточных листьев в связи с их аттрагирующей активностью перед началом распускания почек (Hugly, Somerville, 1992; Венжик и др., 2017).
Снижение доли олеиновой кислоты в ФЛ по мере весеннего развития почек березы повислой свидетельствует о повышении активности ацил-липидных мембранных десатураз ω6 и ω3, ответственных за введение в углеводородную цепь ЖК второй и третьей двойной связи (Лось, 2005; Чиркова, 1997). В результате, к началу вегетации в почках березы повислой в ФЛ и ГЛ индекс LRD увеличился в 2.6 и 2.7 раза соответственно, олеиновая кислота не накапливалась, а превращалась в линолевую, а в мае – в линоленовую кислоту, придавая биологическим мембранам бóльшую текучесть и устойчивость к воздействию низких температур (Демин и др., 2008). По мнению ряда авторов, это может быть обусловлено высокой активностью ряда ферментов, ингибирующих синтез олеиновой кислоты при формировании листовой пластинки (Kannangara et al., 1973).
Сравнительный анализ олеил-(ORD: 0.83–0.94) и линолеил-(LRD: 0.32–0.87) десатуразных отношений показал, что при экстремально низких температурах воздуха в феврале в почках березы повислой по значениям активность ω6-ацил-липидная десатуразы выше по сравнению с ω3-ацил-липидной десатуразой, особенно ярко это заметно в ФЛ. Однако весной экспрессия генов ω3-ацил-липидной десатуразы усиливается, о чем свидетельствует значительное увеличение LRD и накопление линоленовой кислоты в обоих классах полярных липидов и особенно в ГЛ. Наряду с этим в процессе развития почек березы повислой в изученных классах липидов сохранялась высокая активность ω9 (SRD) (до 0.87 и 0.67 в ФЛ и ГЛ соответственно) даже в апреле, при этом наименьшие ее значения зафиксированы в феврале (0.70 и 0.53 в ФЛ и ГЛ соответственно). Очевидно, в условиях криолитозоны такая динамика SRD может свидетельствовать о наличии взаимосвязи между экспрессией генов ацил-липидной ω9-десатуразы, участвующей в биосинтезе олеиновой кислоты, и механизмами низкотемпературной устойчивости. В природно-климатических условиях Якутии такой уровень устойчивости обеспечивает сохранение жизнеспособности меристематических тканей почек к действию отрицательных или низких положительных температур, которые часто наблюдаются здесь в весенний период.
Избирательность действия десатураз, по всей вероятности, обусловлена особенностями развития меристематических тканей при формировании фотосинтетического аппарата в почках в весенний период. В условиях Якутии к середине мая дневная температура воздуха, как правило, достигает 5°С, а в последние дни месяца может превышать 20°С. Однако ночью бывают заморозки до –10°С. Повышенное содержание линоленовой кислоты в ГЛ почек березы повислой перед началом их распускания было обнаружено нами ранее в условиях Республики Карелия (Ветчинникова, 2005).
Таким образом, в условиях климата криолитозоны у березы повислой выявлены особенности в жирнокислотном составе мембранных липидов в почках в зимне-весенний период. Высказано предположение, что в специфических условиях произрастания для сохранения жизнеспособности апикальной (верхушечной) меристемы в почках у данного вида в липидном обмене сформировались разные, но взаимосвязанные адаптивные механизмы, направленные как на предохранение зачаточных органов от воздействия низких температур (–20°С) весной в марте–апреле, и возвратных заморозков в мае–июне, но и на их защиту от экстремально низких температур (–40°С и ниже), которые наблюдаются здесь в зимний период и не встречаются в других частях ее ареала. Показано, что один из механизмов носит неспецифический характер и связан с повышенным уровнем ненасыщенности состава ЖК, обеспечивающего жидкокристаллическое состояние мембранных липидов. Он способствует успешному прохождению вынужденного покоя и подготовке зачаточных органов к внепочечному развитию. Другой возможный механизм направлен на защиту клеток от обезвоживания путем стабилизации водного баланса в тканях за счет, например, возрастания уровня гидрофильных белков-дегидринов (Бубякина и др., 2011; Татаринова и др., 2011, 2013, 2018; Пономарев и др., 2014) на фоне повышенной вязкости мембранных липидов. Наличие жидкокристаллического состояния за счет повышенной степени ненасыщенности ЖК липидов обеспечивает функционирование мембран в период, предшествующий вегетации, стимулируя активизацию работы ферментов. Тогда как транспортные процессы, возможно, могут протекать и при гелеобразном состоянии мембран во время покоя растений, поддерживая жизнеспособность березы повислой при экстремально низких температурах воздуха в условиях криолитозоны в зимний период. Такие биохимические механизмы, по-видимому, позволили березе повислой приспособиться к экстремальным условиям криолитозоны и расширить ареал мест ее произрастания до северных границ распространения древесной растительности, которая от Урала до Чукотки образована лиственницей.
БЛАГОДАРНОСТИ
В знак признательности авторы посвящают свою работу памяти Виктории Витальевны Бубякиной, стоявшей у истоков совместных исследований по березе в условиях Якутии. Работа выполнена на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Список литературы
Алаудинова Е.В. 2011. Экологические особенности низкотемпературной адаптации лесообразующих хвойных видов Сибири: структурно-химические изменения меристем почек. Автореф. докт. дис. Красноярск. 36 с. (Alaudinova E.V. 2011. Ecological features of the low-temperature adaptation of forest-forming conifers of Siberia: Structural and chemical changes in the meristem of the buds. Dr. (Sci) Thesis. Krasnoyarsk. 36 p.)
Алаудинова Е.В., Миронов П.В. 2009. Липиды меристем лесообразующих хвойных пород Центральной Сибири в условиях низкотемпературной адаптации. 2. Особенности метаболизма жирных кислот фосфолипидов меристем Larix sibirica Ledeb., Picea obovata L. и Pinus sylvestris L. Химия растительного сырья. 2 : 71–76. (Alaudinova E.V., Mironov P.V. 2009. Lipids of the meristems of the main coniferous edificators from Central Siberia under low-temperature adaptation: 2. Features of the fatty acid metabolism of phospholipids from winter meristems of Larix sibirica Ledeb., Picea obovata L., and Pinus sylvestris L. Chemistry of Plant Raw Material (Himija rastitel’nogo syr’ja). 2 : 71–76.)
Алаудинова Е.В., Симкина С.Ю., Миронов П.В. 2007. Сезонные изменения содержания воды в меристиматических тканях почек Picea obobata L. и Pinus sylvestris L. и ее распределение в клетках. Хвойные бореальной зоны. 24(4/5) : 487–491. (Alaudinova E.V., Simkina S.Yu., Mironov P.V. 2007. Seasonal changes in the content of water in meristematic tissue buds Picea obovata L. and Pinus sylvestris L. and its distribution in cells. Conifers of the boreal area. 24(4/5) : 487–491.)
Бабенко Л.М., Щербатюк Н.Н., Климчук Д.А., Косаковская И.В. 2018. Структурно-функциональные особенности клеток мезофилла листьев контрастных по термоустойчивости сортов Triticum aestivum при действии кратковременных температурных стрессов. Цитология. 60(2) : 128–135. (Babenko L.M., Scherbatiuk N.N., Klimchuk D.A., Kosakovskaya I.V. 2018. Structural-functional peculiarities of leaf mesophyll cells of Triticum aestivum cultivars with different cold/heat tolerance under short-term temperature stresses. Tsitologiya. 60(2) : 128–135.)
Бубякина В.В., Татаринова Т.Д., Пономарев А.Г., Перк А.А., Соломонов Н.Г. 2011. Особенности сезонной динамики дегидринов Betula platyphylla Sukacz., ассоциированные с формированием морозоустойчивости в условиях криолитозоны. Доклады академии наук. 439(6) : 844–847. (Bubyakina V.V., Tatarinova T.D., Ponomarev A.G., Perk A.A., Solomonov N.G. 2011. Characteristics of seasonal dynamics of Betula platyphylla Sukacz. Dehydrins associated with frost hardiness development under the cryolitic zone conditions. Doklady Biol. Sci. (Dokladyi akademii nauk. 439(1) : 258–261). https://doi.org/10.1134/S0012496611040193
Венжик Ю.В., Титов А.Ф., Таланова В.В. 2017. Кратковременное охлаждение проростков или корней пшеницы вызывает изменения в ультраструктуре клеток мезофилла листа. Труды Карельского научного центра РАН. 5 : 66–78. (Venzhik Yu.V., Titov A.F., Talanova V.V. 2017. Short-term chilling of wheat seedlings or roots affects the ultrastructure of mesophyll cells. Transactions of the Karelian Research Centre of RAS. Exper. Biol. series. 5 : 66–78). https://doi.org/10.17076/eb516
Ветчинникова Л.В. 2005. Карельская береза и другие редкие представители рода Betula L. М.: Наука. 269 с. (Vetchinnikova L.V. 2005. Karelian birch and other rare members of the genus Betula L. M.: Nauka. 269 p.)
Ветчинникова Л.В., Титов А.Ф., Кузнецова Т.Ю. 2013. Карельская береза: биологические особенности, динамика ресурсов и воспроизводство. Петрозаводск: КарНЦ РАН. 312 с. (Vetchinnikova L., Titov A., Kuznetsova T. 2013. Karelian birch: Biological characteristics, resource dynamics, and reproduction. Petrozavodsk.: KarNC RAS. 312 p.)
Ветчинникова Л.В., Титов А.Ф., Кузнецова Т.Ю. 2017. Влияние бензиламинопурина на жирнокислотный состав мембранных липидов в побегах карельской березы in vitro. Цитология. 59(7) : 498–504. (Vetchinnikova L.V., Titov A.F., Kuznetsova T.U. 2017. The effect of benzylaminopurin on fatty-acid composition of membrane lipids in shoots of Karelian birch in vitro. Cell Tiss. Biol. (Tsitologiya). 11(6) : 489–495. https://doi.org/10.1134/S1990519X17060116
Войников В.К., Боровский Г.Б., Колесниченко А.В., Рихванов Е.Г. 2004. Стрессовые белки растений. Иркутск. 129 с. (Voinikov V.K., Borovsky G.B., Kolesnichenko A.V., Rikhvanov E.G. 2004. Stress proteins of plants. Irkutsk. 129 p.)
Выводцев Н.В., Тютрин С.А. 2012. Изучение роста березы плосколистной (Betula platyphylla Suk.). Ученые заметки ТОГУ. 3(1) : 18–28. (Vivodcev N.V., Tyutrin S.A. 2012. Management-volume inventory of asian white birch (Betula platyphylla Suk.). Electronic Sci. J. “Scientists notes PNU”. 3(1) : 18–28.)
Демин И.Н., Дерябин А.Н., Синькевич М.С., Трунова Т.И. 2008. Введение гена desA ацил-липидной десатуразы цианобактерии повышает устойчивость растений картофеля к окислительному стрессу, вызванному гипотермией. Физиология растений. 55(5) : 710–720. (Demin I.N., Deryabin A.N., Sinkevich M.S., Trunova T.I. 2008. Insertion of cyanobacterial desA gene coding for des-Acyl-lipid desaturase increases potato plant resistance to oxidative stress induced by hypothermia. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 55(5) : 639–648.) https://doi.org/10.1134/S1021443708050075
Колупаев Ю.Е. 2016. Антиоксиданты растительной клетки, их роль в АФК-сигналинге и устойчивости растений. Успехи современной биологии. 136(2) : 181–198. (Kolupaev Yu.E. 2016. Plant cell antioxidants and their role in ROS Signaling and plant resistance. Uspekhi Sovremennoi Biologii. 136(2) : 181–198.)
Крючков В.В. 1976. Чуткая Субарктика. М.: Наука. 137 с. (Kryuchkov V.V. 1976. Sensitive Subarctic. M.: Nauka. 137 p.)
Кузнецова Т.Ю., Ветчинникова Л.В., Титов А.Ф., Ильинова М.К. 2008. Влияние кадмия на состав жирных кислот липидов в побегах карельской березы in vitro. Физиология растений. 55(5): 731–737. (Kuznetsova T.Yu., Vetchinnikova L.V., Titov A.F., Il’inova M.K. 2008. Effect of cadmium on fatty acid composition of lipids in the shoots of Karelian birch cultured in vitro. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 55(5): 657–662.)
Лось Д.А. 2001. Структура, регуляция экспрессии и функционирование десатураз жирных кислот. Успехи биол. химии. 41 : 163–198. (Los D.A. 2001. Structure, regulation of expression and functioning of fatty acid desaturases. Uspekhi Biol. Khimii. 41 : 163–198.)
Лось Д.А. 2005. Молекулярные механизмы холодоустойчивости растений. Вестник РАН. 75(4) : 338–345. (Los’ D.A. 2005. Molecular mechanisms of cold tolerance in plants. Ak-ademiia Nauk SSSR, Vestnik. 75(4) : 338–345.)
Лось Д.А. 2014. Десатуразы жирных кислот. М.: Научный мир. 372 с. (Los Dm. A. 2014. Fatty acid desaturases. Moscow: Scientific World. 372 p.)
Нохсоров В.В. 2017. Адаптивные изменения состава и содержания липидов растений криолитозоны Якутии при гипотермии. Автореф. канд. дис. Иркутск. 24 с. (Nokhsorov V.V. 2017. Adaptive changes in the composition and content of plant lipids in the cryolithozone of Yakutia during hypothermia. PhD Thesis. Irkutsk. 24 p.)
Петров К.А. 2016. Криорезистентность растений: эколого-физиологические и биохимичекие аспекты. Новосибирск: Изд-во СО РАН. 276 с. (Petrov K.А. 2016. Cryoresistance of plants: Ecological-physiological and biochemical aspects. Novosibirsk: Siberian Branch RAS. 276 p.)
Петров К.А., Софронова В.Е., Бубякина В.В., Перк А.А., Татаринова Т.Д., Пономарев А.Г., Чепалов В.А., Охлопкова Ж.М., Васильева И.В., Максимов Т.Х. 2011. Древесные растения Якутии и низкотемпературный стресс. Физиология растений. 58(6). 866–874. (Petrov K.A., Sofronova V.E., Bubyakina V.V., Perk A.A., Tatarinova T.D., Ponomarev A.G., Chepalov V.A., Vasilieva I.V., Maximov T.C., Okhlopkova Z.M. 2011. Woody plants of Yakutia and low-temperature stress. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 58(6) : 1011–1019.)
Пономарев А.Г., Татаринова Т.Д., Перк А.А., Васильева И.В., Бубякина В.В. 2014. Дегидрины, ассоциированные с морозоустойчивостью березы плосколистной Восточной Сибири. Физиология растений. 61(1) : 114–120. (Ponomarev A.G., Tatarinova T.D., Perk A.A., Vasilyeva I.V., Bubyakina V.V. 2014. Dehydrin associated with frost Betula platyphylla Eastern Siberia. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 61(1) : 114–120.) https://doi.org/10.7868/S0015330313060092
Попов В.Н., Антипина Н.В., Астахова Н.В. 2016. Изменения ультраструктуры хлоропластов растений табака в процессе защиты от окислительного стресса при гипотермии. Физиология растений. 63(3) : 319–326. (Popov V.N., Antipina O.V., Astakhova N.V. 2016. Changes in chloroplast ultrastructure of tobacco plants in the course of protection from oxidative stress under hypothermia. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 63(3) : 301–307.) https://doi.org/10.7868/S0015330316030118
Розенцвет О.А., Нестеров В.Н., Богданова Е.С., Гребенкина Т.М., Головко Т.К. 2012. Влияние кратковременных и продолжительных колебаний факторов среды на состав липидов Plantago media (L.) в условиях Южного Тимана. Известия Самарского научного центра Российской академии наук. 14(1/3) : 791–799. (Rozentsvet О.А., Nesterov V.N., Bogdanova Е.S., Grebenkina Т.M., Golovko Т.К. 2012. Influence of short-term and long fluctuations of factors of environment on the content of lipids Plantago media L. in the conditions of southern Timan. Izvestia of Samara Scientific Center of the RAS. 14(1/3) : 791–799.)
Сиймер Э.Х., Таутс О.В., Мейстер К.Э. 1971. Рассчитанные значения ЭДЦ cis-полиеновых метилен-разделенных жирных кислот. В кн.: Труды Таллинского политех. ин-та. А (300) : 73–78. (Seimer E.Kh., Tauts O.V., Meister K.E. 1971. Calculated EDC values of cis-polyene methylene-separated fatty acids. In.: Trudi Tallinn Polytechnic. Inst. A (300) : 73–78.)
Скворцов А.К. 1977. Род Betula L. В кн.: Ареалы деревьев и кустарников СССР. Л.: Наука. 1 : 89–100. (Skvortsov A.K. 1977. The genus Betula L. In.: Areas of trees and shrubs of the USSR. Leningrad: Nauka. 1 : 89–100.)
Татаринова Т.Д., Бубякина В.В., Ветчинникова Л.В., Перк А.А., Пономарев А.Г., Васильева И.В. 2017. Стресссовые белки-дегидрины в почках березы в контрастных по климату регионах. Цитология. 59(2) : 156–160. (Tatarinova T.D., Bubyakina V.V., Vetchinnikova L.V., Perk A.A., Ponomarev A.G., Vasilieva I.V. 2017. Dehydrin stress proteins in birch buds in regions with contrasting climate. Cell Tiss. Biol. 11(6) : 483–488.) doi https://doi.org/10.1134/S1990519X17060098
Татаринова Т.Д., Ветчинникова Л.В., Бубякина В.В., Перк А.А., Пономарев А.Г., Васильева И.В., Серебряко-ва О.С., Петрова Н.Е. 2018. Дегидрины в почках основных видов березы в условиях Карелии. Физиология растений. 65(2) : 153–160. doi: 10.7868/ S0015330318020070 (Tata-rinova T.D., Vetchinnikova L.V., Bubyakina V.V., Perk A.A., Ponomarev A.G., Vasilieva I.V., Serebryakova O.S., Petrova N.E. 2018. Dehydrins in buds of main birch species under conditions of Karelia. Russ. J. Plant Physiol. (Fiziologiya Rastenii). 65(2) : 295–301.) doi https://doi.org/10.1134/ S1021443718010090
Татаринова Т.Д., Перк А.А., Бубякина В.В., Васильева И.В., Пономарев А.Г., Максимов Т.Х. 2017. Стрессовые белки-дегидрины в хвое Pinus sylvestris L. в условиях экстремального климата Якутии. Доклады академии наук. 473(2) : 233–236. (Tatarinova T.D., Perk A.A., Bubyakina V.V., Vasilieva I.V., Ponomarev A.G., Maximov T.C. 2017. Dehydrin stress proteins in Pinus sylvestris L. needles under conditions of extreme climate of Yakutia. Doklady Biochem. Biophys. 473(1) : 98–101.) https://doi.org/10.1134/S160767291702003X
Татаринова Т.Д., Перк А.А., Бубякина В.В., Пономарев А.Г., Ветчинникова Л.В., Васильева И.В. 2013. Дегидрины в почках Betula pendula Roth: особенности сезонной динамики. Известия Самарского научного центра Российской академии наук. 15(3/2) : 799–801. (Tatarinova T.D., Perk A.A., Bubyakina V.V., Ponomarev A.G., Vetchinnikova L.V., Vasilieva I.V. 2013. Dehydrins of Betula pendula Roth buds: characteristics of seasonal dynamics. Izvestia of Samara Scientific Center of the RAS. 15(3/2) : 799–801.)
Татаринова Т.Д., Пономарев А.Г., Перк А.А., Васильева И.В., Бубякина В.В. 2011. Сезонные изменения дегидринов почек Betula platyphylla Sukacz., связанных с формированием устойчивости к экстремальному климату Якутии. Вестник Санкт-Петербургского государственного университета. Серия Биология. 4 : 107–114. (Tatarinova T.D., Ponomarev A.G., Perk A.A., Vasilieva I.V., Bubyakina V.V. 2011. Seasonal changes of bud dehydrins of Betula platyphylla Sukacz., associated with development of resistance to extreme climate of Yakutia. Vestnik of St. Petersburg University. “Biology” series. 4 : 107–114.)
Титов А.Ф., Акимова Т.В., Таланова В.В., Топчиева Л.В. 2006. Устойчивость растений в начальный период действия неблагоприятных температур. М.: Наука. 143 с. (Titov A.F., Akimova T.V., Talanova V.V., Topchieva L.V. 2006. Plant resistance in the initial period of unfavorable temperatures effects. M.: Nauka. 143 p.)
Титов А.Ф., Таланова В.В. 2011. Локальное действие высоких и низких температур на растения. Петрозаводск: Карельский научный центр РАН. 166 с. (Titov A.F., Talanova V.V. 2011. Local effect of high and low temperatures on plants. Petrozavodsk: KarNC RAS. 312 p.)
Трунова Т.И. 2007. Растение и низкотемпературный стресс. М.: Наука. 54 с. (Trunova T.I. 2007. Plant and low temperature stress. M.: Nauka. 54 p.)
Чиркова Т.В. 1997. Клеточные мембраны и устойчивость растений к стрессовым воздействиям. Соросовский образовательный журн. 9 : 12–17. (Chirkova T.V. 1997. Cell membranes and plant resistance to stress conditions. Sorosovskiy Obrazovatel’nyy Zhurnal. 9 : 12–17.)
Чиркова Т.В. 2002. Физиологические основы устойчивости растений. СПб.: Изд-во СПб. ун-та. 244 с. (Chirkova T.V. 2002. Fiziologicheskiye osnovy ustoychivosti rasteniy. SPb.: St.Peterburg university. 244 p.)
Cartea M.E., Migdal M., Galle A.M., Pelletier G., Guerche P. 1998. Comparison of sense and antisense methodologies for modifying the fatty acid composition of Arabidopsis thaliana oilseed. Plant Science. 136 : 181–194.
Filek M., Rudolphi-Skórska E., Sieprawska A., Kvasnica M., Janeczko A. 2017. Regulation of the membrane structure by brassinosteroids and progesterone in winter wheat seedlings exposed to low temperature. Steroids. 128 : 37–45. doi https://doi.org/10.1016/j.steroids.2017.102
Folch J., Lees M., Stanley G. H. 1957. A simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226 : 497–509.
Harwood J.L. 1994. Environmental effects on plant lipid metabolism. Inform. 5(7) : 835–838.
Hugly S., Somerville C.R. 1992. A role of membrane lipid polyunsaturation in chloroplast biogenesis at low temperature. Plant Physiol. 99 : 197–202.
Jaworski J.G., Stumpf P.K. 1974. Fat metabolism in higher plants. Properties of a soluble stearyl-acyl carrier protein desaturase from maturing Carthamus tinctorius. Arch. Biochem. Biophys. 162 : 158–165.
Kannangara C.G., Jacobson B.S., Stumpf P.K. 1973. Fat Metabolism in higher plants: LVII. A comparison of fatty acid-synthesizing enzymes in chloroplasts isolated from mature and immature leaves of spinach. Plant Physiol. 52 : 156–161.
Karlson D.T., Zeng Y.V.E., Stirm R., Joly J., Ashworth E.N. 2003. Photoperiodic regulation of a 24-kDa dehydrin-like protein in red-osier dogwood (Cornus sericea L.) in relation to freeze-tolerance. Plant Cell Physiol. 44 : 25–34.
Kim M.H., Sasaki K., Imai R. 2009. Cold shock domain protein 3 regulates freezing tolerance in Arabidopsis thaliana. J. Biol. Chem. 284 : 23 454–23 460. https://doi.org/10.1074/jbc.M109.025791
Kosova K., Prasil I.T., Vitamvas P. 2010. Role of dehydrins in plant stress response. In: Handbook of plant and crop stress. Tucson, Arizona: CRC Press. 239–285.
Lyons J.M., Wheaton T.A., Pratt H.K. 1964. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants. Plant Physiol. 39 : 262–268.
Marsh J.B., Weinstein D.B. 1966. Simple charring method for determination of lipids. J. Lipid Res. 7 : 574–579.
Nakamura Yu., Shimizu K., Ando Ya. 2014. Gas chromatographic equivalent chain length (ECL) values of fatty acid methyl esters on a highly polar ionic liquid column, SLB-IL111. Bull. Fish. Sci. Hokkaido Univ. 64 : 9–16.
Petrov K.A., Dudareva L.V., Nokhsorov V.V., Perk A.A., Chepalov V.A., Sophronova V.E., Voinikov V.K., Zulfugarov I.S., Lee C.-H. 2016. The role of plant fatty acids in regulation of the adaptation of organisms to the cold climate in cryolithic zone of Yakutia. J. Life Sci. (Korea). 26 : 519–530. doi https://doi.org/10.5352/JLS.2016.26.5.519
Piispanen R., Saranpää P. 2002. Neutral lipids and phospholipids in Scots pine (Pinus sylvestris) sapwood and heartwood. Tree Physiol. 22 : 661–666.
Schenk M.F., Thienpont C.-H., Koopman W.J.M., Gilissen L.J.W.J., Smulders M.J.M.S. 2008. Phylogenetic relationships in Betula (Betulceae) based on AFLP markers. Tree Genet. Genomes. 4 : 911–924. https://doi.org/10.1007/s11295-008-0162-0
Simola L.K., Koskimies-Soininen K. 1984. Comparison of glycolipids and plastids in callus cells and leaves of Alnus and Betula. Plant Cell Physiol. 25 : 1329–1340.
Theocharis A., Clément Ch., Barka E.A. 2012. Physiological and molecular changes in plants grown at low temperature. Planta. 235 : 1091–1105.
Yu J., Cang J., Zhou Z., Liu L. 2011. Anatomical structure composition between leaves of two winter wheat cultivars with different cold/freezing tolerance under low temperature stress. J. Northeast Agr. University. 18 : 1–3. https://doi.org/10.1016/S1006-8104(13)60091-4
Zhao C., Wang P., Si T., Hsu C.C., Wang L., Zayed O., Yu Z., Zhu Y., Dong J., Tao W.A., Zhu J.K. 2017. MAP Kinase Cascades Regulate the Cold Response by Modulating ICE1 Protein Stability. Devel. Cell. 43 : 618–629. https://doi.org/10.1016/j.devcel.2017.09.024
Дополнительные материалы отсутствуют.


