Цитология, 2019, T. 61, № 6, стр. 461-468
Пролиферативная активность метапластического эпителия слизистой оболочки бронхов при фиброзно-кавернозном туберкулезе
Е. П. Голубинская 1, *, М. А. Кальфа 1, Ю. А. Ермола 1, А. В. Геращенко 1, Т. В. Крамарь 1, Е. Ю. Бессалова 1
1 Медицинская академия им. С.И. Георгиевского Крымского федерального университета им. В.И. Вернадского
295051 г. Симферополь, Россия
* E-mail: missive@mail.ru
Поступила в редакцию 06.02.2019
После доработки 07.03.2019
Принята к публикации 11.03.2019
Аннотация
Проведена оценка пролиферативной активности метапластического эпителия слизистой оболочки бронхов у пациентов с фиброзно-кавернозным туберкулезом легких с целью определения прогностических критериев малигнизации и патогенетического обоснования применения альтернативных видов таргетной терапии. В ходе анализа морфологических изменений слизистой оболочки бронхов макроскопически интактной легочной ткани верифицировано наличие хронического рецидивирующего неспецифического бронхита, по мере прогрессирования которого нарастают гиперпластические и диспластические изменения эпителиальной выстилки. Для оценки злокачественного потенциала метапластического эпителия проведено иммуногистохимическое выявление маркера Ki‑67 и выделено четыре типа метапластических изменений эпителия слизистой оболочки бронхов, характеризующихся статистически значимым усилением экспрессии Ki-67 в сравнении с контрольной группой. Максимальная пролиферативная активность, свидетельствующая о высоком злокачественном потенциале, зафиксирована в бронхах с морфологическими признаками дисплазии в виде неравномерной стратификации эпителия, гиперхромии ядер, повышения ядерно-цитоплазматического соотношения, а также явлениями паракератоза или гиперкератоза. Изолированное повышение пролиферативной активности клеток слизистой оболочки бронхов не может являться однозначным диагностическим критерием процесса малигнизации, так как определяется не только в диспластическом, но и в гиперпластически измененном и метапластическом эпителии. Повышение пролиферативной активности в абсолютном большинстве крупных и мелких бронхов интактной легочной ткани при фиброзно-кавернозном туберкулезе позволяет прогнозировать наличие позитивного терапевтического эффекта при применении таргетной молекулярной терапии, направленной на блокирование процессов клеточной пролиферации.
Туберкулезная инфекция является одной из глобальных проблем современности, что связано не только с высокими показателями заболеваемости и летальности, но и с ассоциированными с ней патологическими процессами, в том числе неопластическими (Borghaei et al., 2015; Васильева и др., 2017; Gandhi et al., 2018). Механизмы возникновения ассоциации туберкулеза и рака легких представляют особую клиническую и научную значимость, что объясняется фатальностью их сочетания, сложной дифференциальной диагностикой и принципиально разными схемами терапии.
Патогенетическая связь данных процессов основана на продолжительности регенераторных процессов в условиях длительно сохраняющейся гипоксии и активации внеклеточного протеолиза, обладающих индуктивным действием на процесс мобилизации и деления эпителиальных клетокс повышением генетической нестабильности за счет нарастания числа мутаций (Серов и др., 2013; Brooks et al., 2018). Кроме того в очагах хронического воспаления (в частности, при туберкулезе) в результате гиперпродукции металлопротеиназ и последующего разрушения коллагена IV типа базальных мембран происходит ремоделирование легочной ткани на основе механизмов, аналогичных неопластическому росту, что создает оптимальные условия для инвазии и диссеминации (Рагулин и др., 2016; Голубинская и др., 2018; Golubinskaya et al., 2018).
Среди различных форм рака легких, с туберкулезом наиболее часто ассоциируется центральный бронхогенный рак. В связи с этим, изменения бронхиального эпителия представляют интерес не только с позиции возможной прогрессии бактериальной экскреции, но и с точки зрения изменения функционального состояния интактной легочной паренхимы, в том числе возможной малигнизации (Hewison et al., 2017; Pym et al., 2016). Прогностически перспективной, по-нашему мнению, является оценка метапластических и диспластических изменений бронхиального эпителия, как этапа опухолевой трансформации (Соловьева, Вальков, 2016; Banat et al., 2016).В рутинной патоморфологической практике золотым стандартом диагностики пролиферации опухолевых клеток является экспрессия Ki-67 – ядерного антигена, который обнаруживается только в пролиферирующих клетках (G1-, S-, G2- и M-фаза), но не в покоящихся клетках (G0-фаза) (Kim et al., 2013; de Aguiar et al., 2010).
Количество Ki-67, присутствующего в клетке в течение клеточного цикла, поддерживается благодаря точному балансу между синтезом и деградацией его молекул, имеющих относительно короткий период полураспада (1–1.5 ч) (Rahmanzadeh et al., 2007).
MIB-1 представляет собой моноклональное антитело, которое распознает устойчивый к фиксации эпитоп антигена Ki-67 и используется в качестве диагностического маркера для оценки пролиферативной фракции неоплазии (Nabi et al., 2008). В многочисленных исследованиях злокачественных опухолей (молочной железы, мягких тканей, легких и др.) с использованием MIB‑1 установлено, что уровень экспрессии Ki-67 клеток зависит от степени дедифференцировки неоплазии и коррелирует с наличием метастазов и стадией опухоли (Ciancio et al., 2012; Sorbye et al., 2012a, b; Ishihara et al., 2013). Исследования также подтвердили прогностическое значение Ki67 для выбора персонализированных схем терапии, направленных на подавление процессов клеточной пролиферации (Golmohammadi et al., 2012).
Таким образом, изучение взаимосвязей между предопухолевыми изменениями респираторного эпителия и типом воспалительной реакции, выяснение клеточных и молекулярно-генетических особенностей альтернативных вариантов воспаления у пациентов с фиброзно-кавернозным туберкулезом легких может не только внести вклад в понимание механизмов канцерогенеза в респираторном эпителии, но и получить данные для патогенетического обоснования таргетной терапии, направленной на арест клеточной пролиферации.
Целью нашего исследования явилась оценка пролиферативной активности метапластического эпителия слизистой оболочки бронхов при фиброзно-кавернозном туберкулезе легких.
МАТЕРИАЛ И МЕТОДИКА
Исследовали фрагменты стенки каверны и перикавернозной легочной ткани умерших, либо прооперированных по поводу фиброзно-кавернозного туберкулеза (ФКТ) легких пациентов (n = 163). В качестве контрольной группы использовали фрагменты легких 30 больных, умерших от патологии, не связанной с заболеваниями легких (инфаркт миокарда, острое нарушение мозгового кровообращения).
Критерии включения пациентов в исследование: возраст от 18 до 65 лет, отрицательные клинико-лабораторные данные наличия коморбидной патологии (вирусных гепатитов В, С и ВИЧ), обострения хронических заболеваний других органов и систем.
Фрагменты легочной ткани фиксировали в 10%-ном нейтральном формалине с последующим заключением в парафин и изготовлением серийных срезов толщиной 4–5 мм. Для визуализации патологических изменений срезы окрашивали гематоксилином и эозином (Yanin et al., 2015), после чего проводили иммуногистохимическое выявление Ki-67 для оценки пролиферативной активности клеточных элементов слизистой оболочки бронхов с помощью антител MIB-1 (DAKO, Дания; 1 : 150). Обработку препаратов проводили с помощью системы визуализации EnVision™ FLEX+, Mouse, HighpH (Link), CodeK8012 на аппарате для автоматизированной иммуногистохимической окраски фирмы DAKO (Dabbs, 2013). В качестве позитивного контроля использовали фрагменты небных миндалин с позитивной ядерной экспрессией в герминативных центрах В-клеток, в качестве негативного контроля – фрагменты жировой ткани.
Количественную оценку Ki-67-позитивных клеток, у которых антиген выявлялся в ядрах (ядерная экспрессия) проводили в 10 полях зрения при увеличении объектива 40× и рассчитывали абсолютное количество иммунопозитивных клеток в поле зрения стандартной площади. Анализ препаратов и запись цифровых изображений проводили на микроскопе OLYMPUS CX41, оборудованном цифровой камерой OLYMPUS C 5050Z, при увеличении объектива 40× (числовая апертура – 0.65; рабочее расстояние – 0.6 мм). Морфометрическую обработку полученных данных проводили с помощью лицензионного программного обеспечения ImageJ.
Статистический анализ данных выполнен с использованием программного пакета Statistica for Microsoft Windows, version 10.0., StatSoft Inc., США. Данные представлены в виде M ± SD, где М – среднее арифметическое, а SD – стандартное отклонение. Проводили построение вариационных рядов количественных данных, определение нормальности распределения вариационных рядов с использованием критерия Колмогорова–Смирнова, который показал, что данные имели нормальное распределение, вследствие чего для оценки статистической значимости различий сравниваемых величин двух независимых групп применяли двухвыборочный критерий Стьюдента (Campbell et al., 2007). Критический уровень значимости различий между группами был принят равным Р = 0.05.
РЕЗУЛЬТАТЫ
При исследовании пролиферативной активности эпителия слизистой оболочки бронхов (СОБ) контрольной группы выявлено, что Ki-67 в крупных и мелких бронхах в основном выявляется в базальных клетках мерцательного эпителия. Среднее число таких Ki-67-позитивных клеток составляет 6.78 ± 0.43 в крупных и 5.82 ± 0.84 – в мелких бронхах (рис. 1а).
Рис. 1.
Иммуногистохимическое выявление Ki-67 (коричневый цвет) в эпителии бронхов здоровых лиц (а) и лиц с фиброзно-кавернозным туберкулезом (ФКТ) (б–д). а – Эпителий терминальной бронхиолы здорового человека, выявляются единичные Ki-67-позитивные клетки (стрелки); б – первый тип метаплазированного эпителия бронха: многорядный мерцательный эпителий (МЭ) с повышенной мукоидизацией за счет очагов гиперплазии бокаловидных клеток и единичными Ki-67-позитивными клетками (стрелки); в – второй тип метаплазированного эпителия бронха: гиперплазия бокаловидных клеток (БК), десквамация эпителия в просвет бронха (стрелка), многочисленные Ki-67-позитивные клетки; г – третий тип метаплазированного эпителия бронха: уплощение эпителиальной выстилки (стрелка) с параллельным увеличением числа Ki-67-позитивных эпителиоцитов; д – четвертый тип метаплазированного эпителия бронха: плоскоклеточная метаплазия с двух и трехрядной стратификацией эпителия (стрелки), многочисленные Ki-67-позитивные клетки. Увел. об. 40×.
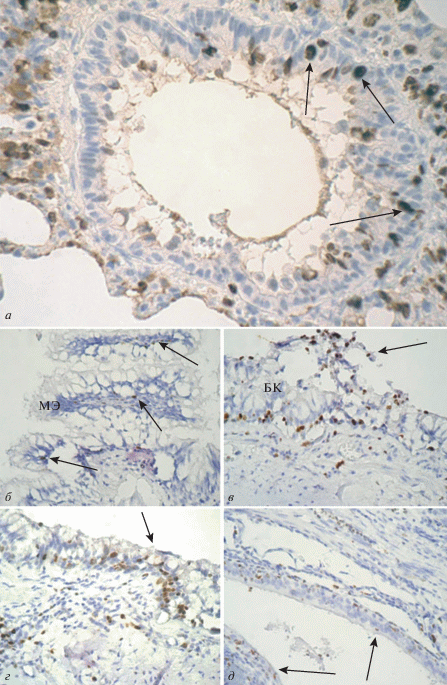
Проведенное исследование позволило выделить четыре основных типа метапластических изменений эпителия бронхов при ФКТ. Изменения разных типов наблюдали одновременно в каждом из образцов, при этом в послеоперационном материале превалировали изменения второго типа, а в секционном материале – изменения третьего типа.
Первый тип метапластических изменений эпителия бронхов характеризуется сохранной архитектоникой многорядного мерцательного эпителия в крупных бронхах и двурядного однослойного мерцательного эпителия в мелких бронхах с гиперплазией бокаловидных клеток (рис. 1б). Число Ki-67-позитивных клеток по сравнению с контролем достоверно увеличивается в СОБ крупных и мелких бронхов (Р < 0.05) и составляет 8.41 ± 0.32 и 6.27 ± 0.11 соответственно, что позволяет говорить об усилении пролиферативной активности эпителиоцитов по сравнению с контрольной группой.
Второй тип изменений характеризуется уплощением мерцательного эпителия бронхиального дерева за счет снижения высоты цилиндрических клеток и усиления их пролиферативной активности, а также частичной десквамацией эпителиального пласта (рис. 1в). Число Ki-67-позитивных клеток в эпителии крупных и мелких бронхов составляет 10.31 ± 0.71 и 7.18 ± 0.41 соответственно.
Третий тип характеризуется дисрегенераторными изменениями мерцательного эпителия с тенденцией к образованию плоскоклеточной метаплазии в крупных бронхах. При этом на большем протяжении уплощенной эпителиальной выстилки фиксировали очаги уменьшения рядов эпителиальных клеток (2–3 ряда), приобретающих полигональную форму с отсутствием реснитчатого окаймления. Бокаловидные клетки в таких участках присутствовали в небольшом количестве и не имели признаков секреции. В мелких бронхах при сохранении количества рядов эпителиального пласта также наблюдали уплощение мерцательного эпителия (рис. 1г). Ki-67-позитивные клетки локализовались на всех уровнях эпителиального пласта (11.39 ± 0.63 и 8.17 ± 0.42 соответственно в крупных и мелких бронхах).
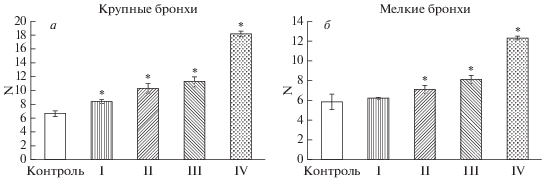
Четвертый тип изменений мерцательного эпителия бронхов характеризовали участки метаплазии с формированием многослойного плоского эпителия. Эпителиальный пласт состоял из плоских клеток, имеющих крупные ядра неправильной формы, и тесно связанных друг с другом посредством десмосом, а также одиночных клеток, демонстрирующих морфологические признаки паракератоза и гиперкератоза (рис. 1д). В мелких бронхах отмечали зоны атрофии, в которых сохранялись лишь клетки базального слоя, расположенные в один ряд. Число клеток, в которых выявляли Ki-67, составляло 18.24 ± 0.43 и 12.33 ± 0.25 в крупных и мелких бронхах соответственно (рис. 2), причем Ki-67 позитивные клетки наблюдали на всех уровнях эпителиальной выстилки, с максимальной концентрацией в участках метаплазии.
Рис.2.
Число Ki-67-иммунопозитивных клеток в метаплазированном эпителии крупных бронхов (а) и мелких бронхов (б) у пациентов с фиброзно-кавернозным туберкулезом. Цифры I–IV – основные типы метаплазированного эпителия (объяснения в тексте); * – достоверное отличие от контрольной группы (Р < 0.05). N – Абсолютное число Ki-67- позитивных эпителиоцитов в поле зрения (объектив 40×).
ОБСУЖДЕНИЕ
Туберкулез и злокачественные новообразования являются одними из наиболее актуальных проблем глобального здравоохранения. Многие авторы предполагают, что их сосуществование является случайной ассоциацией в силу высокой распространенности. Возможность сосуществующих поражений, особенно в регионах, эндемичных по туберкулезу, требует тщательного морфологического обследования для предотвращения вероятности диагностического сбоя и, следовательно, терапевтической ошибки (Pujani et al., 2017).
В ходе анализа морфологических изменений слизистой оболочки бронхов макроскопически интактной легочной ткани 163 пациентов с ФКТ верифицировано наличие хронического рецидивирующего неспецифического бронхита, по мере прогрессирования которого нарастают гиперпластические и диспластические изменения эпителиальной выстилки. При этом делящиеся базальные клетки мигрируют в зону дефектов эпителиальной выстилки с последующей гиперплазией и плоскоклеточной метаплазией, что приводит к прогрессирующему ухудшению мукоцилиарного клиренса и повышению риска развития плоскоклеточной карциномы (Al-Shibli, 2008; Rigden, 2016). Для оценки злокачественного потенциала метапластического эпителия проведено иммуногистохимическое выявление маркера Ki-67, который широко используется в рутинной гистологической практике для оценки пролиферации и роста опухолевых клеток с диагностической и прогностической целью. В многочисленных клинических и морфологических исследованиях доказано, что уровень экспрессии Ki-67 коррелирует с метастазированием и клинической стадией неоплазии.
В нашем исследовании выделены четыре типа пролиферативной активности эпителия СОБ при ФКТ, характеризующиеся статистически значимым усилением экспрессии Ki-67 в сравнении с контрольной группой. Максимальная пролиферативная активность зафиксирована в бронхах с морфологическими признаками дисплазии в виде неравномерной стратификации эпителия, гиперхромии ядер, повышения ядерно-цитоплазматического соотношения, а также явлениями паракератоза или гиперкератоза, что свидетельствует о высоком злокачественном потенциале и требует детального патоморфологического анализа целостности базальных мембран для исключения признаков инвазивного роста. Изолированное же повышение пролиферативной клеточной активности СОБ не может являться однозначным диагностическим критерием процесса малигнизации, так как определяется не только в диспластическом, но и в гиперпластически измененном и метапластическом эпителии. Установление факта повышения пролиферативной активности в абсолютном большинстве крупных и мелких бронхов интактной легочной ткани при ФКТ позволяет прогнозировать наличие позитивного терапевтического эффекта при применении таргетной молекулярной терапии, направленной на блокирование процессов клеточной пролиферации. В настоящее время с этой целью разрабатываются несколько основных направлений, одним из которых является РНК-интерференция (RNAi) для избирательного подавления экспрессии генов с помощью малых интерферирующих РНК (siRNA) (Demidov et al., 1994). Было показано, что ингибирование экспрессии Ki-67 посредством siRNA приводит к значительному замедлению пролиферации (Tuschl, 2001; Kausch et al., 2003). Cинтетические аналоги siRNA могут также эффективно подавлять экспрессию генов-мишеней, однако их эффекты носят временный характер (Yu et al., 2002). В качестве возможного способа решения данных проблем рассматривается трансфекция плазмидных векторов для стабильного синтеза так называемых “коротких шпилечных РНК” (shRNAs) в клетках-хозяевах, что делает возможным изменение процессов в нативных клетках (Lieberman et al., 2003; Pai et al., 2006).
Другой подход, позволяющий стабилизировать клеточную пролиферацию, – использование системы экспрессии shRNA на основе онколитического аденовируса ZD55 с дефицитом E1B 55 кДа, аналогичный ONYX-015 (Mao et al., 2015), который обладает способностью доставлять Ki-67-shRNA. ZD55-Ki-67 подавляет экспрессию гена Ki-67, обеспечивая эффективную опухолеспецифическую репликацию вируса и индуцируя апоптоз опухолевых клеток in vitro (Zheng et al., 2009).
Третий вариант возможного таргетного воздействия – микроинъекции антител к Ki-67, приводящие к снижению скорости деления клеток (Zheng et al., 2006). Однако в случае этого подхода серьезным препятствием является ядерная локализация мишени, что предъявляет повышенные требования к процессам доставки целевого терапевтического агента.
БЛАГОДАРНОСТИ
Авторы выражают благодарность заведующему кафедрой общей и клинической патофизиологии Медицинской академии им. С.И. Георгиевского ФГАОУ ВО “Крымский федеральный университет им. В.И. Вернадского”, д. м. н., профессору, А.В. Кубышкину, а также доценту, к. м. н. кафедры патологической анатомии с секционным курсом Медицинской академии им. С.И. Георгиевского ФГАОУ ВО “Крымский федеральный университет имени В.И. Вернадского” Т.Г. Филоненко за оказанную помощь в обсуждении полученных результатов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям. Во всех необходимых случаях было получено информированное добровольное согласие. Исследование одобрено локальным этическим комитетом ФГАОУ ВО “КФУ им. В.И. Вернадского” (протокол № 11 от 23.10.2018 г.).
Список литературы
Васильева И.А., Белиловский Е.М., Борисов С.Е., Стерликов С.А. 2017. Глобальные отчеты Всемирной организации здравоохранения по туберкулезу: формирование и интерпретация. Туберкулез и болезни легких. 95(5) : 7–16. (Vasilyeva I.A., Belilovsky E.M., Borisov S.E., Sterlikov S.A. 2017.Global Health Organization Reports on Tuberculosis: Formation and Interpretation. Tuberculosis and Lung Diseases. 95(5) : 7–16.)
Голубинская Е.П., Филоненко Т.Г., Кальфа М.А., Ермола Ю.А. 2018. Морфофункциональные особенности ангиогенеза при фиброзно-кавернозном туберкулезе легких. Крымский журн. экспериментальной и клинической медицины. 8(1) : 16–19. (Golubinskaya E.P., Filonenko T.G., Kalfa M.A., Ermola Yu.A. 2018. Morphological and functional features of angiogenesis in fibrous-cavernous pulmonary tuberculosis. Crimean Journal of Experimental and Clinical Medicine. 8(1) : 16–19.)
Рагулин Ю.А., Смоленов Е.И., Усачев В.С., Афонин Г.В. 2016. Таргетная терапия местно-распространенного немелкоклеточного рака легкого 238 с EGFR-мутацией. Онкология. 5(2) : 48–53. (Ragulin Yu.A., Smolenov E.I., Usachev V.S., Afonin G.V. 2016. Targeted therapy of locally advanced non-small cell lung cancer 238 with an EGFR mutation. Oncology. 5(2) : 48–53.)
Серов О.А., Колпакова Т.А., Краснов В.А. 2013. Воспалительные изменения в бронхах у больных туберкулезом легких в предоперационном периоде. Туберкулез и болезни легких. 11 : 32–35. (Serov O.A, Kolpakova T.A., Krasnov V.A. 2013. Inflammatory changes in the bronchi in patients with pulmonary tuberculosis in the preoperative period. Tuberculosis and lung diseases. 11 : 32–35.)
Соловьева Е.П., Вальков М.Ю. 2016. Факторы эффективности лечения неоперабельного немелкоклеточного рака легкого III стадии (Обзор литературы). Сибирский онкологический журн. 15(2) : 7689. (Solovyova E.P., Valkov M.Yu. 2016. Efficacy factors for the treatment of inoperable non-small cell lung cancer stage III (Literature review). Siberian Oncology Journal. 15(2) : 76–89.)
Янин В.Л., Бондаренко О.М., Сазонова Н.А. 2015 Учебно-методическое пособие для аспирантов очной формы обучения к практическим занятиям по дисциплине “Методы исследования в цитологии и гистологии”. Учебно-методическое пособие. Ханты Мансийск: БУ “Ханты-Мансийская государственная медицинская академия”. 65 с. (Yanin V.L., Bondarenko O.M, Sazonova N.A. 2015. The educational-methodical manual for postgraduate full-time students to practical classes in the discipline “Methods of research in cytology and histology”. Teaching guide. Khanty-Mansiysk. BU “Khanty-Mansiysk State Medical Academy”. 65 p.)
Al-Shibli K.I., Donnem T., Al-Saad S., Persson M., Bremnes R.M., Busund L.T. 2008. Prognostic effect of epithelial and stromal lymphocyte infiltration in 240 non-small cell lung cancer. Clin. Cancer Res.14 : 5220–5227.
Banat G.A., Tretyn A., Pullamsetti S.S., Wilhelm J., Weigert A., Olesch C., Ebel K., Stiewe T., Grimminger F., Seeger W., Fink L., Savai R. 2015. Immune and inflammatory cell composition of human lung cancer stroma. PLoS One. 10 : e0139073.
Borghaei H., Paz-Ares L., Horn L., Spigel D.R., Steins M., Ready N.E., Chow L.Q., Vokes E.E., Felip E., Holgado E., Barlesi F., Kohlhäufl M., Arrieta O., Burgio M.A., Fayette J., Lena H., Poddubskaya E., Gerber D.E., Gettinger S.N., Rudin C.M., Rizvi N., Crinò L., Blumenschein G.R., Jr. Antonia S.J., Dorange C., Harbison C.T., Finckenstein F.G., Brahmer J.R. 2015. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N. Engl. J. Med. 373 : 1627–1639.
Brooks K.M., George J.M., Pau A.K., Rupert A., Mehaffy C., De P., Dobos K.M., Kellogg A., McLaughlin M., McManus M., Alfaro R. M., Hadigan C., Kovacs J. A., Kumar P. 2018. Cytokine-mediated systemic adverse drug reactions in a drug-drug interaction study of dolutegravir with once-weekly isoniazid and rifapentine. Clin. Infect. Dis. 67(2) : 193–201.
Campbell M.J., Machin D., Walters S.J. 2007. Medical Statistics: A Textbook for the Health Sciences, 4th Edition. 344 p.
Castro L.A., Elias L.S., Oton-Leite A.F., de Spíndula-Filho J.V., Leles C.R., Batista A.C., Mendonça E.F. 2010. Long-term effects of nifedipine on human gingival epithelium: А histopathological and immunohistochemical study. J. Oral Sci. 52 : 55–62.
Ciancio N., Galasso M.G., Campisi R., Bivona L., Migliore M., Di Maria G.U. 2012. Prognostic value of p53 and Ki67 expression in fiberoptic bronchial biopsies of patients with non-small cell lung cancer. Multidiscip. Respir. Med. 7 : 29.
Dabbs D.J. 2013. Diagnostic immunohistochemistry: Theranostic and genomic applications. Elsevier, 4-th Edition. 960 p.
de Aguiar P.H., Aires R., Laws E.R., Isolan G.R., Logullo A., Patil C., Katznelson L. 2010. Labeling index in pituitary adenomas evaluated by means of MIB-1: Is there a prognostic role? A critical review. Neurol. Res. 32 : 1060–1071.
Demidov V.V., Potaman V.N., Frank-Kamenetskii M.D., Egholm M., Buchard O., Sönnichsen S.H., Nielsen P.E. 1994. Stability of peptide nucleic acids in human serum and cellular extracts. Biochem. Pharmacol. 48 : 1310–1313.
Gandhi L., Rodríguez-Abreu D., Gadgeel Sh., Esteban E., Felip E., De Angelis F., Domine M., Clingan P., Hochmair M.J., Powell S.F., Cheng S.Y.-S., Bischoff H.G., Peled N., Grossi F., Jennens R.R., Reck M., Hui R., Garon E.B., Boyer M., Rubio-Viqueira B., Novello S., Kurata T., Gray J.E., Vida J., Wei Z., Yang J., Raftopoulos H., Pietanza M.C., Garassino M.C. 2018. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N. Engl. J. Med. 378 : 2078–2092.
Golmohammadi R., Pejhan A. 2012. The prognostic value of the P53 protein and the Ki67 marker in breast cancer patients. J. Pakistan Med. Ass. 62 : 871–875.
Golubinskaya E.P., Kramar T.V. 2018. Morphofunctional substantiation of targeted therapy with blocker angiogenesis in fibrous-cavernous pulmonary tuberculosis. Materials of the international forum “Biotechnology: state and prospects of development” : 400–402.
Hewison C., Ferlazzo G., Avaliani Z. Hayrapetyan A., Jonckheere S., Khaidarkhanova Z., Mohr E., Sinha A., Skrahina A., Vambe D., Vasilyeva I., Lachenal N., Varaine F. 2017. Six-month response to delamanid treatment in MDR TB patients. Emerg. Infect. Dis. 23 : 1746–1748.
Ishihara M., Mukai H., Nagai S., Onozawa M., Nihei K., Shimada T., Wada N. 2013. Retrospective analysis of risk factors for central nervous system metastases in operable breast cancer: Effects of biologic subtype and Ki-67 overexpression on survival. Oncology. 84 : 135–140.
Kausch I., Lingnau A., Endl E., Sellmann K., Deinert I., Ratliff T.L., Jocham D., Sczakiel G., Gerdes J., Böhle A. 2003. Antisense treatment against Ki-67 mRNA inhibits proliferation and tumor growth in vitro and in vivo. Int. J. Cancer. 105 : 710–716.
Kim B.H., Bae Y.S., Kim S.H., Jeong H.J., Hong S.W., Yoon S.O. 2013. Usefulness of Ki-67 (MIB-1) immunostaining in the diagnosis of pulmonary scleros in ghemangiomas. APMIS. 121 : 105–110.
Lieberman J., Song E., Lee S.K., Shankar P. 2003. Interfering with disease: Opportunities and roadblocks to harnessing RNA interference. Trends Mol. Med. 9 : 397–403.
Mao L.J., Zhang J., Liu N., Fan L., Yang D.R., Xue B.X., Shan Y.X., Zheng J.N. 2015. Oncolytic virus carrying shRNA targeting SATB1 inhibits prostate cancer growth and metastasis. Tumor Biology. 36 : 9073–9081.
Nabi U., Nagi A.H., Sami W. 2008. Ki-67 proliferating index and histological grade, type and stage of colorectal carcinoma. J. Ayub Med. College Abbottabad. 20 : 44–48.
Pai S.I., Lin Y.Y., Macaes B., Meneshian A., Hung C.F., Wu T.C. 2006. Prospects of RNA interference therapy for cancer. Gene Ther. 13 : 464–477.
Pujani M., Jairajpuri Z.S., Khan S., Hassan M.J., Jetley S., Rana S. 2017. Coexistence of tuberculosis and malignancy: A mere coincidence or a causal association. Tropical Doctor. 7 : 101–104.
Pym A.S., Diacon A.H., Tang S.J. Conradie F., Danilovits M., Chuchottaworn C., Vasilyeva I., Andries K., Bakare N., De Marez T., Haxaire-Theeuwes M., Lounis N., Meyvisch P., Van Baelen B., van Heeswijk R.P., Dannemann B. 2016. Bedaquiline in the treatment of multidrug- and extensively drug resistant tuberculosis. Eur. Resp. J. 47 : 564–574.
Rahmanzadeh R., Hüttmann G., Gerdes J., Sholzen T. 2007. Chromophore-assisted light inactivation of pKi67 leads to inhibition of ribosomal RNA synthesis. Cell Prolif. 40 : 422–430.
Rigden H.M., Alias A., Havelock T., O’Donnell R., Djukanovic R., Davies D.E., Wilson S.J. 2016. Squamous metaplasia is increased in the bronchial epithelium of smokers with chronic obstructive pulmonary disease. PLoS One. 11 : e0156009.
Sorbye S.W., Kilvaer T.K., Valkov A., Donnem T., Smeland E., Al-Shibli K., Bremnes R. M., Busund L.T. 2012a. Prognostic impact of Jab1, p16, p21, p62, Ki67 and Skp2 in soft tissue sarcomas. PLoS One. 7 : e47068.
Sorbye S.W., Kilvaer T.K., Valkov A., Donnem T., Smeland E., Al-Shibli K., Bremnes R.M, Busund L.T. 2012b. Prognostic impact of CD57, CD68, M-CSF, CSF-1R, Ki67 and TGF-beta in soft tissue sarcomas. BMC Clin.Pathol. 12 : 7.
Tuschl T. 2001. RNA interference and small interfering RNAs. ChemBioChem. 2 : 239–245.
Yu J.Y., De Ruiter S.L., Turner D.L. 2002. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc. Nat. Acad. Sci. USA. 99 : 6047–6052.
Zhang P., Steelant W., Kumar M., Scholfield M. 2007. Versatile photosensitizers for photodynamic therapy at infrared excitation. J. Am. Chem. Soc. 129 : 4526–4527.
Zheng J.N., Ma T.X., Cao J.Y., Sun X.Q., Chen J.C., Li W., Wen R.M., Sun Y.F., Pei D.S. 2006. Knockdown of Ki-67 by small interfering RNA leads to inhibition of proliferation and induction of apoptosis in human renal carcinoma cells. Life Sci. 78 : 724–729.
Zheng J.N., Pei D.S., Mao L.J., Liu X.Y., Mei D.D., Zhang B.F., Shi Z., Wen R.M., Sun X.Q. 2009. Inhibition of renal cancer cell growth in vitro and in vivo with oncolytic adenovirus armed short hairpin RNA targeting Ki-67 encoding mRNA. Cancer Gene Ther. 16 : 20–32.
Zhu H., Guo W., Zhang L., Teraishi F., Wu S., Cao X., Daniel J., Smythe W.R., Fang B. 2005. Bcl-XL small interfering RNA suppresses the proliferation of 5-fluorouracil-resistant human colon cancer cells. Mol. Cancer Ther. 4 : 451–456.
Дополнительные материалы отсутствуют.


