Цитология, 2019, T. 61, № 6, стр. 481-493
Полиморфизм амилоидных фибрилл на основе бета-2-микроглобулина
А. И. Сулацкая 1, *, Д. С. Поляков 2, 3, Н. П. Родина 1, М. И. Сулацкий 1, М. М. Шавловский 2, 3, И. М. Кузнецова 1, К. К. Туроверов 1, 4
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
3 Северо-Западный государственный медицинский университет им. И.И.Мечникова
191015 Санкт-Петербург, Россия
4 С.-Петербургский государственный политехнический университет им. Петра Великого
195251
, Санкт-Петербург, Россия
* E-mail: ansul@mail.ru
Поступила в редакцию 26.02.2019
После доработки 21.03.2019
Принята к публикации 22.03.2019
Аннотация
Длительная персистенция бета-2-микроглобулина (β2М) в высоких концентрациях в крови больных с острой почечной недостаточностью приводит к развитию гемодиализного амилоидоза. В тканях и органах пациентов, страдающих данным заболеванием, происходит накопление амилоидных бляшек на основе полноразмерного β2М и его укороченных форм без 6 и 10 N-концевых аминокислотных остатков. В настоящей работе проведено сравнительное изучение структуры и фотофизических свойств этих амилоидных фибрилл. С использованием методов регистрации их собственного ультрафиолетового излучения (УФ-спектроскопии) и кругового дихроизма (КД-спектроскопии), а также метода электронной микроскопии показано различие структуры амилоидных фибрилл на основе полноразмерной и укороченных форм β2М. Для подтверждения полиморфизма исследуемых образцов было проведено изучение их взаимодействия с флуоресцентным зондом тиофлавином Т. Ключевым моментом в проведении этих экспериментов стало применение метода равновесного микродиализа для подготовки тестируемых растворов. Исследование этих растворов с использованием различных спектроскопических подходов позволило рассчитать параметры связывания тиофлавина Т с амилоидными фибриллами на основе β2М и определить фотофизические характеристики связанного красителя. Анализ полученных результатов позволил подтвердить предположение о различии структуры амилоидных фибрилл на основе полноразмерной и укороченных форм β2М, а также показать их существенное отличие от фибрилл на основе других амилоидогенных белков (в частности, модельных белков инсулина и лизоцима).
Бета-2-микроглобулин (β2М) представляет собой белок с молекулярной массой 11.8 кДа, состоящий из 99 аминокислотных остатков. Он синтезируется во всех ядросодержащих клетках организма и играет важную роль в клеточном иммунитете. β2М обеспечивает фолдинг и экспонирование на клеточной поверхности молекул первого класса главного комплекса гистосовместимости (Bjorkman et al., 19874; Goldsby, 2007). В норме концентрация β2М в плазме крови составляет ~1–3 мг/мл, при этом в день в организме синтезируется 2–4 мг/кг белка, а период его полувыведения составляет ~2.5 ч. Элиминация β2М на 95% обеспечивается путем клубочковой фильтрации (с последующей реабсорбцией и внутриклеточным протеолизом в проксимальных канальцах) и его концентрация в плазме крови напрямую связана с функционированием почек. Уровень β2М при хронической почечной недостаточности может возрастать в 60 раз вследствие значительного (в 10–15 раз) увеличения времени выведения данного белка. Большие количества β2М обнаруживаются в моче больных с нарушенной реабсорбцией белка из первичного фильтрата (Linke et al., 1989). При продолжительной гемодиализной терапии, необходимой для очистки крови пациентов, страдающих тяжелыми заболеваниями почек, концентрация β2М в плазме крови постоянно значительно превышает норму. Длительная персистенция β2M в высокой концентрации считается основной причиной появления молекул белка в аномальной конформации и образования ими упорядоченных агрегатов в виде амилоидных фибрилл (Maruyama et al., 1992). Следует отметить, что так называемый “гемодиализный амилоидоз” не связан с самой лечебной процедурой, а является следствием устранения несовместимых с жизнью уремических состояний, которые до применения гемодиализа быстро приводили к летальному исходу. Это исключало саму возможность длительного повышения уровня β2М в плазме крови.
Возникновение амилоидоза зачастую не является причиной заболевания, а лишь сопутствует ему, является его побочным эффектом. Кроме того, результаты последних исследований свидетельствуют о том, что токсичными для клетки являются предшественники фибрилл – амилоидные олигомеры, а сами амилоидные фибриллы не оказывают существенного влияния на состояние пациентов. В связи с этим специально разрабатываемые агенты, способные препятствовать образованию амилоидных фибрилл или замедлять их рост, не имеют терапевтического эффекта и не оказывают значительного воздействия на протекание таких заболеваний. Однако в случае гемодиализного амилоидоза образование и накопление амилоидных фибрилл само по себе является причиной существенного ухудшения качества жизни больных, сопровождающегося появлением болей в суставах и уменьшением их подвижности (Massry, 2003). Наиболее часто при этом заболевании отмечается синдром карпального канала, скапулофеморальный периартроз, деструктивная спондило-артропатия, протекающая в ряде случаев с миелокомпрессией, атлантоаксиальная артропатия, бурситы, костные кисты, патологические переломы и др. (Charra, 1984; Kuntz et al., 1984; Campistol et al., 1990; Zingraff et al., 1990; Gal et al., 1994; Sprague, 1996). На более поздних этапах болезни амилоидные бляшки могут откладываться на стенках желудка и в сердце. Решению проблемы гемодиализного амилоидоза в настоящее время уделяется особое внимание, так как число пациентов, требующих гемодиализной терапии, с каждым годом растет. Существенное значение в поиске путей предотвращения накопления амилоидных фибрилл β2М и ингибирования их роста имеет исследование структуры и физико-химических свойств белковых агрегатов, образующихся при гемодиализном амилоидозе, что в настоящее время является предметом интенсивных исследований (Hong et al., 2002; Sasahara et al., 2007).
Исследования последних лет показали, что у больных, находящихся на гемодиализном лечении длительное время, обнаруживаются амилоидные фибриллы не только на основе полноразмерного β2М, но и на основе его укороченных форм без участков полипептидной цепи, состоящих из 6 (β2MΔ6) и 10 (β2MΔ10) N-концевых аминокислот (~25%) (Bellotti et al., 1998; Stoppini et al., 2005; Linke et al., 1987). При этом в плазме крови, спинномозговой жидкости и моче, как здоровых, так и больных гемодиализным амилоидозом, укороченных форм мономеров β2М обнаружено не было. (Bellotti, Chiti, 2008). В настоящее время остается открытым вопрос о том, является ли укороченный белок продуктом протеолиза нативного β2М, или протеолитическое отщепление фрагмента белка происходит в уже сформировавшихся фибриллах. Исследование способности к агрегации укороченных форм β2М может стать важным шагом в разрешении этого вопроса. Кроме того, ранее было показано, что амилоидные фибриллы на основе β2М при различных условиях могут образовывать агрегаты с различной структурой (Kardos et al., 2005; Chatani et al., 2012). В связи с этим задачей настоящей работы стало изучение полиморфизма амилоидных фибрилл на основе полноразмерной и укороченных форм β2М. Тот факт, что полиморфизм амилоидных фибрилл лежит в основе проявления различных фенотипов амилоидозов, свидетельствует об актуальности проведения подобных исследований.
МАТЕРИАЛ И МЕТОДИКА
Материалы. Образцы тиофлавина Т (ThT) UltraPure Grade (AnaSpec, США) были использованы без дополнительной очистки. ThT был растворен в 2 мМ Tris-HCl (рН 7.7) в присутствии 150 мМ NaCl.
Получение β2M и его укороченных форм. Для получения растворимого рекомбинантного β2M был создан вектор pETb2m6.8. Вектор был сконструирован таким образом, чтобы β2M синтезировался вместе с бактериальным лидерным пептидом PelB, транспортирующим белок в периплазматическое пространство бактерии Escherichia coli и впоследствии отщепляющийся под воздействием бактериальной протеазы. Это позволило получить β2M, который не содержит дополнительного метионина на N-конце и начинается с изолейцина (первой аминокислоты β2M человека) (табл. 1). Как и ожидалось, в периплазме был обнаружен растворимый β2M. Включение в вектор полигистидиновой последовательности на С-конце дало возможность весьма эффективно и быстро очистить белок с использованием аффинной хроматографии на металл-хелатном никель-агарозном сорбенте. Экстракция периплазматической фракции с последующей аффинной хроматографией позволили получить β2M с чистотой более 98%.
Для получения укороченных форм β2М без участков полипептидной цепи из 6 (β2MΔ6) и 10 (β2MΔ10) N-концевых аминокислот были созданы экспрессионные генетические конструкции соответственно pETb2m1.1 и pETb2m2.1. Перед нуклеотидной последовательностью, кодирующей β2MΔ6 и β2MΔ10, в плазмиды был вставлен не бактериальный PelB-лидерный пептид, а старт-кодон ATG. В результате белок, синтезируемый полученной экспрессионной генетической конструкцией, накапливался в тельцах включения и имел дополнительный метионин (за счет старт-кодона) на N-конце.
Получение амилоидных фибрилл на основе β2M. Для получения амилоидных фибрилл на основе β2M и его укороченных форм выделенные и очищенные белки инкубировали в Gly-HCl буфере (pH 2.5) в термостате (37°С) при постоянном перемешивании в течение 14 сут (500 rpm) на термошейкере TS-100 (Biosan).
Спектроскопия. Спектры поглощения амилоидных фибрилл и флуоресцентных зондов регистрировали с использованием спектрофотометра U-3900H (Hitachi, Япония). Спектры КД амилоидных фибрилл в дальней УФ-области были измерены с использованием спектрополяриметра J-810 (Jasco, Япония). Спектры флуоресценции и возбуждения флуоресценции амилоидных фибрилл и флуоресцентных зондов были измерены с использованием спектрофлуориметра Cary Eclipse (Varian, Австралия).
Коррекция зарегистрированных значений интенсивности флуоресценции с учетом эффекта внутреннего фильтра. Определение спектров возбуждения флуоресценции. Существенным препятствием для определения истинных спектров флуоресценции и возбуждения флуоресценции является нелинейность концентрационной зависимости интенсивности флуоресценции, которая обусловлена так называемым эффектом первичного внутреннего фильтра. Причиной этого эффекта является ослабление потока возбуждающего света при его прохождении через поглощающий раствор (закон Ламберта−Бера), а также различие области, освещаемой возбуждающим светом, и рабочей областью, с которой флуоресценция регистрируется. В литературе часто встречаются допущения о том, что в случае низкой концентрации (малого поглощения) исследуемого раствора, интенсивность флуоресценции пропорциональна концентрации флуоресцирующего вещества, а эффектом первичного внутреннего фильтра можно пренебречь. Однако это предположение является неверным. В действительности, интенсивность флуоресценции пропорциональна поглощению (A) только в одном случае, когда А = 0. Даже при A = 0.1 отклонение от линейности составляет ~12%, а при А = 0.3 оно составляет ~38% (Fonin et al., 2014).
В случае, когда площадь, освещенная возбуждающим светом, совпадает с рабочей областью, с которой свет флуоресценции собирается (случай используемого нами спектрофлуориметра Cary Eclipse), регистрируемая интенсивность флуоресценции F (λex) пропорциональна фракции возбуждающего света, которая поглощается раствором ($1 - {{10}^{{ - A}}}$). В случае однокомпонентного раствора, когда вещество и поглощает свет, и флуоресцирует с квантовым выходом флуоресценции q, его интенсивность флуоресценции может быть записана как:
С использованием такой корректировки были определены неискаженные спектры собственной УФ-флуоресценции мономерного β2M и фибрилл на его основе, а также квантовый выход флуоресценции связанного с фибриллами ThT.
Электронная микроскопия. Для визуализации амилоидных фибрилл использовали просвечивающий электронный микроскоп Libra 120 (Carl Zeiss, Германия). Для негативного контрастирования препаратов использовали 1%-ный водный раствор уранил-ацетата. Суспензию амилоидных фибрилл наносили на медные сетки, покрытые коллодиевой пленкой-подложкой, напыленной углем.
Равновесный микродиализ. Равновесный микродиализ проводили с использованием приспособлений фирмы Harvard Apparatus/Amika (США), которые состоят из двух камер равного объема (500 мл), разделенных мембраной, непроницаемой для частиц с массой больше 10 000 Да.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спектральные свойства амилоидных фибрилл, полученных на основе β2M. Для диагностики возникновения амилоидных фибрилл на основе β2M, а также β2MΔ6 и β2MΔ10, созданных с использованием специальных генетических конструкций, и проведения их морфологической характеристики использовали метод электронной микроскопии (рис. 1а–1в). Полученные изображения позволили сделать заключение о том, что укороченные формы β2М, как и полноразмерный белок, in vitro способны образовывать длинные тонкие неразветвленные амилоидные фибриллы с различной морфологией. В частности, показано, что исследуемые образцы различаются по диаметру жгута фибриллы (толщина амилоидных фибрилл на основе β2M и β2MΔ6 составляет 12–15 нм, а фибрилл на основе β2MΔ10 – 6–8 нм). Можно отметить, что фибриллы на основе β2MΔ10, возможно, в силу своей небольшой толщины, являются более пластичными и образуют изгибы и петли, в то время как фибриллы на основе белка с полноразмерной аминокислотной последовательностью являются более жесткими и прямыми.
Рис. 1.
Визуализация амилоидных фибрилл на основе β2М (а), β2МΔ6 (б), β2МΔ10 (в), инсулина (г) и лизоцима (д). Электронная микроскопия.
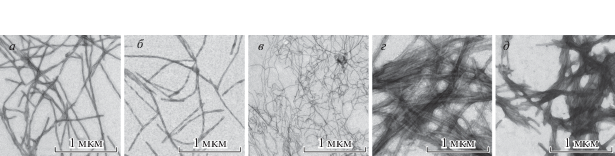
Полученные амилоидные фибриллы исследовали с использованием ряда спектроскопических методов: абсорбционной, флуоресцентной и КД-спектроскопии. Спектры поглощения мономерного β2М и амилоидных фибрилл на его основе, как и ожидалось, совпадают со спектром поглощения триптофана (λmax = 280 нм) (рис. 2a). Анализ спектров поглощения амилоидных фибрилл проводили с учетом их светорассеяния с использованием стандартной процедуры (рис. 2д). Показано, что величина светорассеяния образцов заметно различается (рис. 2е), что свидетельствует о различии размеров исследуемых белковых агрегатов. Концентрацию мономерного полноразмерного белка и амилоидных фибрилл на основе β2М и β2МΔ6 оценивали с использованием коэффициента молярной экстинкции ε280 = 20 065 М–1 см–1, а концентрацию фибрилл на основе β2MΔ10 – с использованием коэффициента молярной экстинкции ε280 = 18 575 М–1 см–1, поскольку последовательность β2MΔ10 короче на 10 аминокислотных остатков, среди которых есть один тирозиновый остаток (Tyr10 в исходной аминокислотной последовательности).
Рис. 2.
Спектральные свойства амилоидных фибрилл на основе β2М. а – Cпектры поглощения, б – спектры флуоресценции, в – спектры возбуждения флуоресценции, нескорректированные (штриховые кривые) и скорректированные (сплошные кривые) на эффект первичного внутреннего фильтра, г – спектры кругового дихроизма (КД) β2M (бирюзовая кривая) и амилоидных фибрилл на основе β2M (красная кривая), β2MΔ6 (зеленая кривая) и β2MΔ10 (синяя кривая). д – Зарегистрированный спектр поглощения амилоидных фибрилл на основе β2M (кривая 1), вклад светорассеяния (2) и истинный спектр поглощения этих амилоидных фибрилл, полученный после вычитания из зарегистрированного спектра их светорассеяния (3); на вставке проиллюстрирован метод исключения кажущейся оптической плотности из зарегистрированного спектра амилоидных фибрилл. Поправка на светорассеяние в области полосы поглощения вводилась путем экстраполирования значений из области, где истинное поглощение отсутствует. Зависимость величины светорассеяния от длины волны имеет вид: ${{A}_{{scat}}}\left( {\lambda } \right) = - \frac{а }{{{{{\lambda }}^{n}}}}.$ Для определения коэффициента а и n строили график lg(А) = f(lg(λ)). В той спектральной области, где отсутствует истинное поглощение, зависимость представляет собой прямую, угол наклона которой позволяет определить величину n (tg α = n) и отрезок, отсекаемый прямой на оси ординат, позволяет определить величину а. Определение величин а и n позволяет рассчитать значение Аscat для каждой длины волны в исследуемой области поглощения. е – Светорассеяние, обусловленное амилоидными фибриллами на основе β2M (1), β2MΔ6 (2) и β2MΔ10 (3).
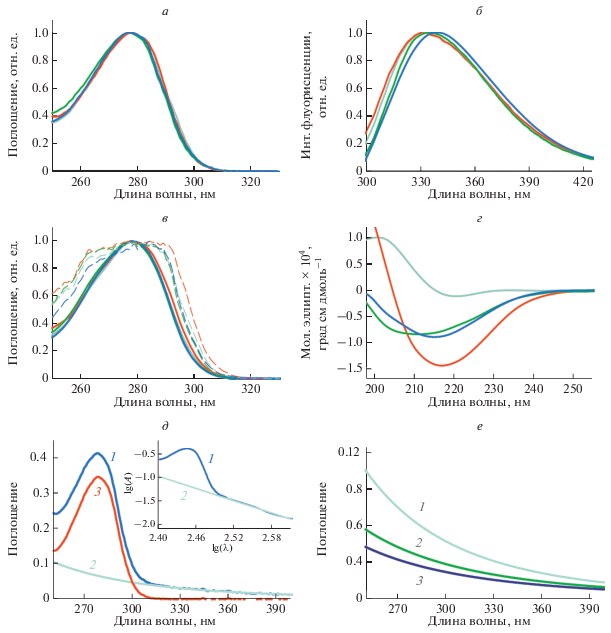
Показано различие спектров собственной триптофановой флуоресценции исследуемых амилоидных фибрилл (рис. 2б). На наш взгляд, это обусловлено различным микроокружением флуоресцирующих аминокислотных остатков белков и их различной доступностью молекулам растворителя, что в свою очередь может определяться аминокислотным составом белков, на основе которых получены амилоидные фибриллы, и особенностями структуры самих амилоидных фибрилл. Для определения истинных спектров возбуждения флуоресценции, не искаженных за счет эффекта первичного внутреннего фильтра, использовали корректировочный коэффициент, который определяется только суммарной оптической плотностью раствора (Fonin et al., 2014). Скорректированные спектры возбуждения (рис. 2в), как и следовало ожидать, практически совпадают со спектрами поглощения исследуемых растворов, что свидетельствует о гомогенности (идентичности) поглощающих центров в исследуемых образцах.
Для оценки вторичной структуры β2M и амилоидных фибрилл на его основе были измерены спектры КД в дальней УФ-области (в диапазоне длин волн 198–260 нм) (рис. 2г). Полученные результаты свидетельствуют о том, что при формировании амилоидных фибрилл на основе полноразмерного β2M происходит существенное изменение вторичной структуры белка. Этот факт хорошо согласуется с представлением о том, что образованию и отложению в тканях и органах упорядоченных агрегатов β2M при его длительной персистенции в организме в высоких концентрациях предшествует появление молекул белка в аномальной конформации.
Можно заметить, что амилоидные фибриллы на основе полноразмерного β2M имеют наиболее выраженный по сравнению с другими фибриллами минимум при длине волны около 220 нм, который характерен для образцов с высоким содержанием β-структуры (формирующей остов амилоидных фибрилл). При этом по мере уменьшения длины аминокислотной последовательности β2M происходит увеличение содержания неупорядоченной структуры в фибриллах. Можно предположить, что не только различное содержание β-структуры, формирующей остов фибриллы, но и различное содержание неупорядоченной структуры может быть причиной полиморфизма амилоидных фибрилл. В частности, переход от упорядоченной структуры к менее компактной неупорядоченной структуре может влиять на способность протофибрилл взаимодействовать друг с другом и обуславливать меньшую толщину жгута зрелых амилоидных фибрилл на основе белков с более короткой аминокислотной последовательностью. Кроме того, на основании оценки вторичной структуры и способности к агрегации исследуемых амилоидных фибрилл, можно сделать предположение о том, что различное содержание неупорядоченных участков в белке на начальных этапах фибриллогенеза может влиять на доступность “липких” участков этих белков друг другу, что играет ключевую роль в процессе образования амилоидных фибрилл и определяет скорость его протекания.
Взаимодействие тиофлавина Т с амилоидными фибриллами на основе β2M. Для выявления различий в структуре и свойствах амилоидных фибрилл на основе β2M было также исследовано их взаимодействие c флуоресцентным зондом тиофлавином Т (ThT), который широко применяется в качестве теста на образование фибрилл при ряде тяжелых заболеваний, таких как болезнь Альцгеймера, Паркинсона и другие. Существенной особенностью ThT является то, что водном растворе краситель имеет очень низкий квантовый выход флуоресценции, который при встраивании ThT в амилоидные фибриллы может возрастать в десятки тысяч раз (Sulatskaya et al., 2010). При этом взаимодействие красителя с амилоидными фибриллами очень специфично. Согласно данным из литературы ThT не взаимодействует с глобулярными белками в нативном состоянии (исключение составляют ацетилхолинэстераза (De Ferrari et al., 2001; Sulatskaya et al., 2018a) и сывороточные альбумины (Sen et al., 2009; Rovnyagina et al., 2018). Полученные нами результаты, свидетельствующие о том, что интенсивность флуоресценции ThT в присутствии мономерного β2M не превышает интенсивности флуоресценции свободного красителя в буферном растворе, согласуется с этими представлениями.
Показано, что интенсивность флуоресценции растворов ThT в присутствии амилоидных фибрилл β2M возрастает в различной мере: для фибрилл на основе β2MΔ10 она сравнима с интенсивностью флуоресценции свободного красителя, для фибрилл на основе β2MΔ6 – возрастает в 2 раза, а для фибрилл на основе β2M возрастает в 150 раз (рис. 3а). Для сравнения стоит отметить, что инкорпорирование ThT в фибриллы на основе лизоцима или инсулина сопровождается увеличением интенсивности флуоресценции в 4000 и 8000 раз соответственно (Kuznetsova et al., 2012a; Sulatskaya et al., 2012). На основании полученных данных можно сделать заключение не только о различии структуры и свойств амилоидных фибрилл на основе различных форм β2M, но и об их существенном отличии от амилоидных фибрилл на основе других амилоидогенных белков.
Рис. 3.
Взаимодействие амилоидных фибрилл на основе β2М с флуоресцентным зондом тиофлавином Т (ThT). а – Спектры флуоресценции свободного ThT (серая штриховая кривая), ThT в присутствии β2M (черная штриховая кривая) и амилоидных фибрилл на основе полноразмерного β2M (красная кривая), β2MΔ6 (зеленая кривая) и β2MΔ10 (синяя кривая). б – Приспособление для проведения равновесного микродиализа; представлены камеры, разделенные мембраной, проницаемой для ThT и непроницаемой для амилоидных фибрилл. в – Спектры поглощения ThT, инкорпорированного в амилоидные фибриллы на основе β2MΔ6 (красная кривая) и свободного ThT (синяя кривая) в концентрации, равной концентрации связанного красителя (которая была рассчитана с учетом коэффициента молярной экстинкции связанного ThT). г – Зависимость скорректированных значений интенсивности флуоресценции ThT, связанного с амилоидными фибриллами на основе β2MΔ6, (Fb,corr) от концентрации внесенного красителя (C0). д – Зависимость поглощения связанного с фибриллами красителя (Ab) от его концентрации (Cb). е – Зависимость нескорректированных (синие точки) и скорректированных (красные точки) на эффект внутреннего фильтра значений интенсивности флуоресценции связанного красителя от его поглощения; г–е: точками показаны экспериментальные значения, аппроксимирующие прямые и кривая построены с использованием расчетных значений константы связывания (Kb), числа мест связывания (n), коэффициента молярной экстинкции (ε) и квантового выхода флуоресценции (q).
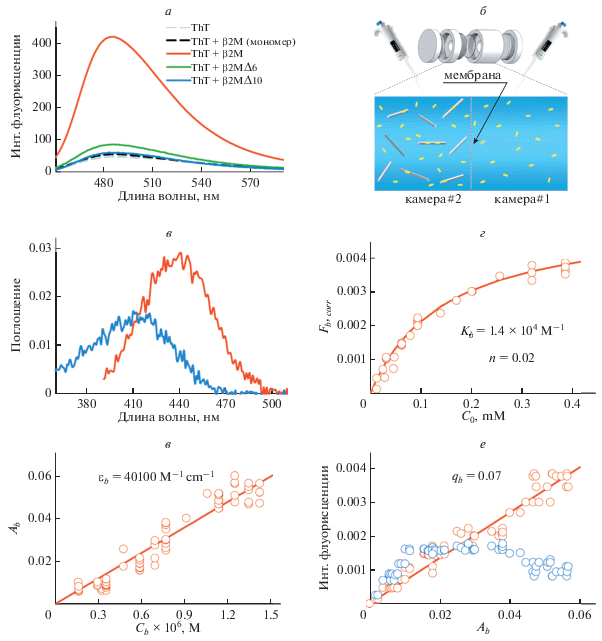
Исследование взаимодействия ThT с амилоидными фибриллами с использованием абсорбционной спектроскопии растворов, подготовленных методом равновесного микродиализа. Работы последних лет показали, что ThT может быть использован не только для диагностики образования амилоидных фибрилл, но и для изучения особенностей их структуры. В связи с этим возникает необходимость определения параметров связывания ThT с амилоидными фибриллами и характеристик связанного красителя. Это осложняется присутствием в исследуемых образцах равновесной системы свободного и связанного с фибриллами ThT. Определение характеристик каждой из этих фракций красителя до недавнего времени являлось трудновыполнимой задачей. Для ее решения нами был предложен подход, основанный на подготовке исследуемых растворов методом равновесного микродиализа (Kuznetsova et al., 2012b; Sulatskaya et al., 2016). Этот метод первоначально был разработан для исследования взаимодействия низкомолекулярных лигандов с рецепторами, но в последнее время незаслуженно забыт. Нами впервые было предложено использовать этот подход для изучения взаимодействия ThT с амилоидными фибриллами.
Равновесный микодиализ проводится с использованием специального приспособления, состоящего из двух камер равного объема, разделенных мембраной, проницаемой для красителя и непроницаемой для фибрилл (рис. 3б). Суть методики состоит в следующем: в первую камеру помещаются амилоидные фибриллы в концентрации Cb (концентрация белка, из которого получены фибриллы) в буферном растворе, во вторую – краситель с концентрацией С0 в том же растворителе. После установления равновесия концентрация свободного красителя в камерах становится одинаковой – Сf. При этом суммарная концентрация красителя в первой камере превосходит концентрацию красителя во второй камере на концентрацию связанного с фибриллами красителя. Таким образом, концентрация связанного красителя может быть рассчитана с использованием уравнения:
Спектр поглощения раствора в камере 1 представляет собой суммарный спектр поглощения свободного и связанного с фибриллами ThT, а в камере 2 – спектр поглощения свободного красителя. Таким образом, с использованием метода равновесного микродиализа могут быть получены раствор образца и раствор сравнения, позволяющие определить спектр поглощения ThT, связанного с амилоидными фибриллами, а также рассчитать концентрации Сf и Cb. На основании полученных результатов константы связывания (Kbi) и число мест связывания (ni) ThT с различными модами связывания (i) амилоидных фибрилл могут быть рассчитаны с использованием уравнения:
(2)
${{C}_{b}} = \sum\limits_i {\frac{{{{n}_{i}}{{C}_{p}}{{C}_{f}}}}{{{{K}_{{di}}} + {{C}_{f}}}}} = \sum\limits_i {\frac{{{{n}_{i}}{{C}_{p}}{{C}_{f}}{{K}_{{bi}}}}}{{1 + {{C}_{f}}{{K}_{{bi}}}}}} ,$Ранее с использованием предложенной методики нами были определены параметры связывания ThT с амилоидными фибриллами на основе инсулина и лизоцима (Sulatskaya et al., 2017b; Sulatskaya et al., 2018b) (табл. 2). Основываясь на существенном возрастании интенсивности флуоресценции ThT при взаимодействии с амилоидными фибриллами β2M (что наблюдается и в случае взаимодействия красителя с амилоидными фибриллами на основе инсулина и лизоцима), можно предположить, что для определения параметров их связывания также может быть использован описанный выше подход.
Таблица 2.
Параметры связывания ThT с амилоидными фибриллами на основе различных амилоидогенных белков и характеристики связанного красителя
| Амилоидогенный белок | λмакс, нм | Мода связывания | Kbi × 10–5, M–1 | ni | εi × 10–4, М–1 см–1 | qi |
|---|---|---|---|---|---|---|
| β2M | 442 | 1 | 0.34 | 0.041 | 2.3 | 0.36 |
| β2MΔ6 | 441 | 1 | 0.14 | 0.020 | 4.0 | 0.07 |
| β2MΔ10 | 438 | 1 | 0.08 | 0.009 | 8.2 | 0.08 |
| Инсулин (Sulatskaya et al., 2018b) | 450 | 1 | 0.35 | 0.14 | 2.3 | 0.27 |
| 2 | 78 | 0.02 | 7.9 | 0.72 | ||
| Лизоцим (Sulatskaya et al., 2017b) |
449 | 1 | 0.60 | 0.25 | 6.2 | 0.0001 |
| 2 | 72 | 0.11 | 5.3 | 0.44 |
Примечание. λмакс – Длина волны, соответствующая максимуму спектра поглощения; i – число мод связывания; Kbi – константа связывания с каждой из мод связывания (i); ni – число мест связывания с каждой из мод связывания (i) в пересчете на молекулу белка; εi – коэффициент молярной экстинкции; qi – квантовый выход флуоресценции.
С использованием предложенного подхода были зарегистрированы спектры поглощения ThT, инкорпорированного в фибриллы на основе различных форм β2M. На рис. 3в в качестве иллюстрации представлены результаты, полученные при исследовании взаимодействия ThT с фибриллами на основе β2MΔ6. Можно заметить, что поглощение связанного с фибриллами красителя очень низкое и зарегистрированный спектр сильно зашумлен. Это, однако, не стало препятствием для оценки положения максимумов спектров поглощения ThT, связанного с амилоидными фибриллами на основе β2M, β2MΔ6 и β2MΔ10 (λmax = 442, 441 и 438 нм соответственно). Спектр поглощения свободного красителя в водном растворе имеет более коротковолновое положение спектра поглощения (λmax = 412 нм (Sulatskaya et al., 2017a)), что является проявлением существенного диполь-дипольного взаимодействия молекул красителя с молекулами растворителя. Можно также отметить, что спектры поглощения ThT, связанного с амилоидными фибриллами на основе инсулина и лизоцима (λmax = 449–450 нм), сдвинуты в длинноволновую область по сравнению со спектрами поглощения красителя, связанного с амилоидными фибриллами на основе β2M. Можно предположить, что различие положения максимумов спектров поглощения красителя при связывании с амилоидными фибриллами на основе различных белков, а также различных форм одного белка обусловлено различной полярностью микроокружения связанной молекулы красителя. Данное предположение подтверждает различие структуры исследуемых амилоидных фибрилл.
Результаты проведенных расчетов свидетельствуют о том, что разность значений внесенной концентрации и удвоенной концентрации свободного красителя (уравнение (1)) соизмерима с ее погрешностью, что обусловлено низкой концентрацией связного красителя. Это делает прямое определение параметров связывания ThT с амилоидными фибриллами β2M с использованием уравнения (2), предложенного ранее, невозможным. Таким образом, с использованием абсорбционной спектроскопии растворов, полученных методом равновесного микродиализа, может быть определен только спектр поглощения ThT, связанного с фибриллами β2M, но не может быть рассчитана его концентрация. Причина этого факта, на наш взгляд, заключается в том, что погрешность определения концентрации связанного красителя представляет собой погрешность косвенных измерений и обусловлена погрешностью всех величин, входящих в уравнение (1), и существенно превышает погрешность определения спектра поглощения связанного красителя (которая представляет собой погрешность прямого измерения оптической плотности ThT). Результаты, полученные в настоящей работе, позволяют заключить, что флуоресцентная спектроскопия в случае амилоидных фибрилл β2M является более чувствительным методом для определения параметров связывания с ними ThT по сравнению с абсорбционной спектроскопией.
Исследование взаимодействия ThT с амилоидными фибриллами с использованием флуоресцентной спектроскопии: определение параметров связывания и характеристик связанного красителя. Интенсивность флуоресценции ThT в присутствии амилоидных фибрилл β2M пропорциональна доле света, поглощенной раствором $(1 - {{10}^{{ - A}}})$(Fonin et al., 2014):
Для определения Ff могут быть использованы растворы сравнения, полученные методом равновесного микродиализа (поскольку концентрация свободного красителя в этих растворах равна концентрации свободного красителя в растворах образца).
С использованием уравнения Бугера−Ламберта−Бера и уравнений (1) и (2) величина Ab может быть представлена как
(4)
${{A}_{b}} = {{\varepsilon }_{b}}l{{C}_{b}} = {{\varepsilon }_{b}}l\frac{{2 + {{K}_{b}}n{{C}_{p}} + {{K}_{b}}{{C}_{0}} - \sqrt {{{{\left( {2 + {{K}_{b}}n{{C}_{p}} + {{K}_{b}}{{C}_{0}}} \right)}}^{2}} - 4K_{b}^{2}n{{C}_{p}}{{C}_{0}}} }}{{2{{K}_{b}}}},$Таким образом, в случае приготовления исследуемых растворов методом равновесного микродиализа, для определения параметров связывания ThT с амилоидными фибриллами на основе β2M может быть использована зависимость скорректированной интенсивности флуоресценции связанного красителя от введенной концентрации ThT:
(5)
${{F}_{{b,\,\,corr}}} = {{q}_{b}}{{\varepsilon }_{b}}l\frac{{2 + {{K}_{b}}n{{C}_{p}} + {{K}_{b}}{{C}_{0}} - \sqrt {{{{\left( {2 + {{K}_{b}}n{{C}_{p}} + {{K}_{b}}{{C}_{0}}} \right)}}^{2}} - 4K_{b}^{2}n{{C}_{p}}{{C}_{0}}} }}{{2{{K}_{b}}}}.$Заметим, что использование метода равновесного микродиализа для подготовки исследуемых растворов в случае амилоидных фибрилл β2MΔ6 и β2MΔ10 является одним из ключевых моментов, поскольку вклад интенсивности флуоресценции свободного красителя в суммарную интенсивность флуоресценции весьма существенен (в отличие от ситуаций, когда связывание красителя с фибриллами сопровождается возрастанием интенсивности флуоресценции на несколько порядков, например, в случае инсулина и лизоцима). Вторым ключевым моментом в использовании флуоресцентного подхода является необходимость коррекции регистрируемых значений интенсивности флуоресценции на эффект внутреннего фильтра с использованием коэффициента W (который определяется только суммарной оптической плотностью раствора), что в настоящее время даже опытными исследователями либо не выполняется вообще, либо выполняется некорректно.
Экспериментальная зависимость ${{F}_{{b,\,corr}}}$ от Co, с использованием которой методом множественной нелинейной регрессии были определены параметры связывания (константа связывания и количество мест связывания) ThT с амилоидными фибриллами на основе β2MΔ6, представлена на рис. 3г (для фибрилл на основе β2M и β2MΔ10 были получены аналогичные зависимости). Удовлетворительная аппроксимация экспериментальных значений теоретической кривой, полученной нами на основе рассчитанных параметров связывания ThT с амилоидными фибриллами на основе β2MΔ6, свидетельствует о достоверности полученных результатов и корректности выбранной модели идентичности всех сайтов связывания. Нужно отметить, что неудовлетворительная аппроксимация экспериментальных данных расчетной кривой может свидетельствовать о существовании двух и более мод связывания красителя с амилоидными фибриллами и невозможности использования уравнения (5) для определения параметров связывания. Значения констант связывания и числа мест ThT с амилоидными фибриллами на основе β2M представлены в табл. 2.
Мы полагаем, что существование обнаруженной моды связывания обусловлено встраиванием красителя в бороздки, образованные боковыми цепями аминокислот протофибрилл β2M вдоль длинной оси их волокна перпендикулярно β-листам. Можно отметить, что количество сайтов связывания на молекулу белка является различным: приблизительно 0.04 (т.е. одна молекула связанного ThT на 25 белковых молекул), 0.02 (одна молекула связанного ThT на 50 белковых молекул) и 0.01 (одна молекула связанного ThT на 100 белковых молекул) в случае фибрилл на основе β2M, β2MΔ6 и β2MΔ10 соответственно. Можно предположить несколько причин обнаруженных различий стехиометрии связывания красителя с фибриллами. Это может быть вызвано тем, что потенциальные сайты связывания недоступны для молекул красителя из-за жесткости переплетения протофибрилл β2M друг с другом (т.е. ограничением возможности встраивания ThT в области, расположенные внутри пучка протофибрилл). Это также может быть связано с “искажением” структуры потенциальных сайтов связывания ThT в результате “скручивания” протофибрилл или формирования изгибов фибриллярного пучка. Эти предположения хорошо согласуются с обнаруженной корреляцией толщины исследуемых фибрилл (а также их жесткости и линейности) (рис. 1) и стехиометрии связывания с ними ThT. Был сделан вывод, что параметры связывания ThT с фибриллами уменьшаются при уменьшении длины аминокислотной последовательности белка и увеличении гибкости (и уменьшении толщины) фибриллы.
В фибриллах на основе β2M, в отличие от фибрилл на основе лизоцима и инсулина (рис. 1г, д), не удалось обнаружить еще одной моды связывания с более высокой константой связывания, существование которой, на наш взгляд, обусловлено взаимодействием красителя с агрегатами амилоидных фибрилл. Фибриллы на основе β2M таких агрегатов не образуют, что подтверждается данным электронной микроскопии.
С использованием определенных значений параметров связывания ThT с фибриллами на основе различных форм β2M (Kb и n) и оптической плотности связанного красителя (Ab), впервые рассчитаны коэффициенты молярной экстинкции ThT, связанного с этими амилоидными фибриллами (табл. 2) с использованием уравнения (4) (рис. 3д). Показано, что коэффициенты молярной экстинкции ThT, инкорпорированного в амилоидные фибриллы на основе различных форм β2M, существенно различаются, и отличаются от значения коэффициента молярной экстинкции красителя в водном растворе (~31 600 M–1 см–1). Этот факт может быть обусловлен различием конформации молекулы красителя в свободном и встроенном в фибриллы состоянии, что, в свою очередь, может быть связано с изменением микроокружения красителя при инкорпорировании в фибриллы.
Результаты, полученные в настоящей работе, также позволили впервые оценить квантовый выход флуоресценции ThT, связанного с амилоидными фибриллами на основе β2M (табл. 2), с использованием уравнения (3) (рис. 3е). Показано, что квантовый выход флуоресценции ThT, инкорпорированного в амилоидные фибриллы на основе различных форм β2M, различается (табл. 2), а также существенно превышает значение квантового выхода флуоресценции свободного красителя в водном растворе (~0.0001) (Sulatskaya et al., 2010). Низкое значение квантового выхода флуоресценции свободного ThT обусловлено тем, что его бензтиазольное и аминобензольное кольца способны поворачиваться друг относительно друга в возбужденном состоянии (что характерно для молекулярных роторов, к классу которых относится молекула ThT), а переход возбужденной молекулы красителя в состояние с углом между его фрагментами близким к 90° приводит к ее безызлучательному переходу в основное состояние (Stsiapura et al., 2008). Мы полагаем, существенное возрастание квантового выхода флуоресценции красителя при встраивании в амилоидные фибриллы β2M обусловлено ограничением подвижности фрагментов молекулы друг относительно друга в возбужденном состоянии за счет жесткости микроокружения. Различные значения квантового выхода флуоресценции красителя, связанного с амилоидными фибриллами на основе различных форм β2M, а также отличие этих значений от квантового выхода флуоресценции ThT, связанного с первой модой связывания амилоидных фибрилл на основе других амилоидогенных белков, позволяет подтвердить сделанные нами предположения о различии структуры этих амилоидных фибрилл.
ЗАКЛЮЧЕНИЕ
В настоящей работе была решена важная методологическая проблема, возникающая при определении параметров связывания флуоресцирующего лиганда с рецептором в случае, когда концентрация связанного лиганда очень мала (т.е. когда эта задача не может быть решена прямым методом с использованием абсорбционной спектроскопии). Показано, что при выполнении ряда условий параметры связывания лиганда с рецептором могут быть рассчитаны с применением флуоресцентной спектроскопии. Это возможно лишь в случае, если: 1) все сайты связывания лиганда с рецептором идентичны (существует только одна мода связывания лиганда); 2) квантовый выход флуоресценции связанного с рецептором лиганда существенно превосходит квантовый выход флуоресценции свободного лиганда в растворе; 3) регистрируемые значения интенсивности флуоресценции скорректированы на эффект первичного внутреннего фильтра (даже при низких концентрациях лиганда). Показано, что если интенсивность флуоресценции свободного и связанного с рецептором лиганда сопоставима, только использование метода равновесного микродиализа для подготовки исследуемых растворов может позволить решить поставленную задачу (при условии выполнения пп. 1 и 3).
Результаты настоящей работы, полученные, в том числе, с использованием предложенного подхода, позволили сделать заключение о полиморфизме амилоидных фибрилл на основе различных форм β2M, а также их отличия от фибрилл на основе других амилоидогенных белков, что свидетельствует о ключевой роли аминокислотной последовательности белка в фибриллогенезе. Этот факт может являться шагом к пониманию причин и механизмов развития различных амилоидозов и возможных причин их вариабельности, а также выбора эффективных методов предотвращения этих заболеваний.
ФИНАНСИРОВАНИЕ
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-74-10100) (исследование полиморфизма амилоидных фибрилл на основе бета-2-микроглобулина) и стипендии Президента РФ (СП-841.2018.4) (анализ структурных различий фибрилл на основе бета-2-микроглобулина и модельных амилоидогенных белков).
Список литературы
Bellotti V., Chiti F. 2008. Amyloidogenesis in its biological environment: challenging a fundamental issue in protein misfolding diseases. Curr. Opinion Struct. Biol. 18 : 771–779.
Bellotti V., Stoppini M., Mangione P., Sunde M., Robinson C., Asti, L., Brancaccio D., Ferri G. 1998. Beta2-microglobulin can be refolded into a native state from ex vivo amyloid fibrils. Eur. J. Biochem. FEBS J. 258 : 61–67.
Bjorkman P.J., Saper M.A., Samraoui B., Bennett W.S., Strominger J.L., Wiley D.C. 1987. Structure of the human class I histocompatibility antigen, HLA-A2. Nature. 329 : 506–512.
Campistol J.M., Sole M., Munoz-Gomez J., Lopez-Pedret J., Revert L. 1990. Systemic involvement of dialysis-amyloidosis. Am. J. Nephrol. 10 : 389–396.
Charra B.C.E., Uzan M., Terrat J.C., Vanel T., Laurent G. 1984. Carpal tunnel syndrome, shoulder pain and amyloid deposits in longterm hemodialysis patients. Proc. Eur. Dial. Transpl. Assoc. 21 : 291–295.
Chatani E., Yagi H., Naiki H., Goto Y. 2012. Polymorphism of beta2-microglobulin amyloid fibrils manifested by ultrasonication-enhanced fibril formation in trifluoroethanol. J. Biol. Chem. 287 : 22827–22837.
De Ferrari G.V., Mallender W.D., Inestrosa N.C., Rosenberry T.L. 2001. Thioflavin T is a fluorescent probe of the acetylcholinesterase peripheral site that reveals conformational interactions between the peripheral and acylation sites. J. Biol. Chem. 276 : 23 282–23 287.
Fonin A.V., Sulatskaya A.I., Kuznetsov, I.M., Turoverov K.K. 2014. Fluorescence of dyes in solutions with high absorbance. Inner filter effect correction. PLoS One. 9 : e103878.
Gal R., Korzets A., Schwartz A., Rath-Wolfson L., Gafter U. 1994. Systemic distribution of beta 2-microglobulin-derived amyloidosis in patients who undergo long-term hemodialysis. Report of seven cases and review of the literature. Archives Pathol. Lab. Med. 118 : 718–721.
Goldsby R.A., Osborne B.A. 2007. Major histocompatibility complex. In: Kuby Immunology. N.-Y.: Freeman W.H. 166–178.
Hong D.P., Gozu M., Hasegawa K., Naiki H., Goto Y. 2002. Conformation of beta 2-microglobulin amyloid fibrils analyzed by reduction of the disulfide bond. J. Biol. Chem. 277 : 21 554–21 560.
Kardos J., Okuno D., Kawai T., Hagihara Y., Yumoto N., Kitagawa T., Zavodszky P., Naiki H., Goto Y. 2005. Structural studies reveal that the diverse morphology of beta(2)-microglobulin aggregates is a reflection of different molecular architectures. Biochim. Biophys. Acta. 1753 : 108–120.
Kuntz D., Naveau B., Bardin T., Drueke T., Treves R., Dryll A. 1984. Destructive spondylarthropathy in hemodialyzed patients. A new syndrome. Arthritis Rheumatism. 27 : 369–375.
Kuznetsova I.M., Sulatskaya A.I., Uversky V.N., Turoverov K.K. 2012a. Analyzing thioflavin T binding to amyloid fibrils by an equilibrium microdialysis-based technique. PLoS One. 7 : e30724.
Kuznetsova I.M., Sulatskaya A.I., Uversky V.N., Turoverov K.K. 2012b. A new trend in the experimental methodology for the analysis of the thioflavin T binding to amyloid fibrils. Mol. Neurobiol. 45 : 488–498.
Linke R.P., Hampl H., Bartel-Schwarze S., Eulitz M. 1987. Beta 2-microglobulin, different fragments and polymers thereof in synovial amyloid in long-term hemodialysis. Biological chemistry Hoppe-Seyler. 368 : 137–144.
Linke R.P., Hampl H., Lobeck H., Ritz E., Bommer J., Waldherr R., Eulitz M. 1989. Lysine-specific cleavage of beta 2-microglobulin in amyloid deposits associated with hemodialysis. Kidney Int. 36 : 675–681.
Maruyama H., Gejyo F., Arakawa M. 1992. Clinical studies of destructive spondyloarthropathy in long-term hemodialysis patients. Nephron. 61 : 37–44.
Massry S.G. 2003. Guideline 10. β2-microglobulin amyloidosis. Clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am. J. Kidney Diseases. 42 : 1–202.
Sasahara K., Yagi H., Naiki H., Goto Y. 2007. Heat-triggered conversion of protofibrils into mature amyloid fibrils of beta2-microglobulin. Biochem. 46 : 3286–3293.
Sen P., Fatima S., Ahmad B., Khan R.H. 2009. Interactions of thioflavin T with serum albumins: spectroscopic analyses. Spectrochim. Acta A Mol. Biomol. Spectrosc. 74 : 94–99.
Sprague S.M. 1996. Clinical manifestations and pathogenesis of dialysis-related amyloidosis. Semin. Dial. 9 : 360–369.
Stoppini M., Mangione P., Monti M. 2005. Proteomics of beta2-microglobulin amyloid fibrils. Biochim. Biophys. Acta. 1753 : 23–33.
Stsiapura V.I., Maskevich A.A., Kuzmitsky V.A., Uversky V.N., Kuznetsova I.M., Turoverov K.K. 2008. Thioflavin T as a molecular rotor: fluorescent properties of thioflavin T in solvents with different viscosity. J. Phys. Chem. B. 112 : 15893–15902.
Sulatskaya A.I., Kuznetsova I.M., Belousov M.V., Bondarev S.A., Zhouravleva G.A., Turoverov K.K. 2016. Stoichiometry and Affinity of thioflavin T binding to Sup35p amyloid fibrils. PloS One. 11 : e0156314.
Sulatskaya A.I., Kuznetsova I.M., Turoverov K.K. 2012. Interaction of thioflavin T with amyloid fibrils: Fluorescence quantum yield of bound dye. J. Phys. Chem. B. 116 : 2538–2544.
Sulatskaya A.I., Lavysh A.V., Maskevich A.A., Kuznetsova I.M., Turoverov K.K. 2017a. Thioflavin T fluoresces as excimer in highly concentrated aqueous solutions and as monomer being incorporated in amyloid fibrils. Sci. Reports. 7 : 1–11. https://doi.org/10.1038/s41598-017-02237-7
Sulatskaya A.I., Maskevich A.A., Kuznetsova I.M., Uversky V.N., Turoverov K.K. 2010. Fluorescence quantum yield of thioflavin T in rigid isotropic solution and incorporated into the amyloid fibrils. PloS One. 5 : e15385.
Sulatskaya A.I., Rodina N.P., Kuznetsova I.M., Turoverov K.K. 2017b. Different conditions of fibrillogenesis cause polymorphysm of lysozyme amyloid fibrils. J. Mol. Struct. 1140 : 52–58.
Sulatskaya A.I., Rychkov G.N., Sulatsky M.I., Rodina N.P., Kuznetsova I.M., Turoverov K.K. 2018a. Thioflavin T interaction with acetylcholinesterase: New evidence of 1:1 binding stoichiometry obtained with samples prepared by equilibrium microdialysis. ACS Chem. Neurosci. 9 : 1793–1801.
Sulatskaya A.I., Sulatsky M.I., Povarova O.I., Rodina N.P., Kuznetsova I.M., Lugovskii A.A., Voropay E.S., Lavysh A.V., Maskevich A.A., Turoverov K.K. 2018b. Trans-2-[4-(dimethylamino)styryl]-3-ethyl-1,3-benzothiazolium perchlorate – new fluorescent dye for testing of amyloid fibrils and study of their structure. Dyes Pigments. 157 : 385–395.
Zingraff J.J., Noel L.H., Bardin T., Atienza C., Zins B., Drueke T.B., Kuntz D. 1990. Beta 2-microglobulin amyloidosis in chronic renal failure. New Eng. J. Med. 323 : 1070–1071.
Дополнительные материалы отсутствуют.



