Цитология, 2019, T. 61, № 6, стр. 455-460
Новый ингибитор активности HSF1 (соединение CL-43) способен подавлять эпителиально-мезенхимный переход клеток колоректального рака линии DLD1
А. Д. Никотина 1, В. Г. Карцев 2, Б. А. Маргулис 1, И. В. Гужова 1, *
1 Институт цитологии РАН,
194064 Санкт-Петербург, Россия
2 Компания InterBioScreen Ltd.,
142432 Московская обл., Черноголовка, Россия
* E-mail: irina.guzh@gmail.com
Поступила в редакцию 25.02.2019
После доработки 19.03.2019
Принята к публикации 25.03.2019
Аннотация
Колоректальный рак является высоко метастазирующим, и у четверти пациентов с опухолями этого типа при постановке диагноза уже выявляются метастазы в печени. Поэтому поиск препаратов, способных уменьшить метастатическую активность клеток, является актуальной задачей. Нахождение опухоли в условиях постоянного стресса приводит к повышенной активности транскрипционного фактора HSF1, который способен запускать синтез белков теплового шока и тем самым приводить к увеличению устойчивости раковых клеток и к стрессу, и к противоопухолевой терапии. В недавних исследованиях было показано, что HSF1 играет большую роль в реализации процесса эпителиально-мезенхимного перехода (ЭМП), являющегося основой формирования метастазов. В настоящей работе мы показываем, что новый ингибитор активности HSF1 вещество CL-43 способно подавлять ЭМП, индуцированный фактором TGFβ1. CL-43 значительно снижал миграционный и пролиферативный потенциал клеток DLD1, обработанных TGFβ1. Анализ уровня виментина показал, что обработка клеток CL-43 приводит к снижению этого маркера ЭМП, а также к возвращению экспрессии и локализации Е-кадгерина в клетках к исходным показателям. Наши результаты свидетельствуют о терапевтическом потенциале CL-43 в лечении колоректальных опухолей.
Колоректальный рак является третьим по частоте встречаемости типом опухоли в мире, от которого погибает более половины пациентов (Riihimäki et al., 2012). Основной проблемой в лечении данной патологии является развитие метастазов, которые отмечаются у приблизительно 25% больных при постановке диагноза, и эта цифра остается стабильной на протяжении последних двух десятилетий (van der Geest et al., 2015).
Недавний прогресс в исследованиях метастазирования рака значительно расширил наше понимание механизмов этого явления как на клеточном, так и на молекулярном уровне. Хорошо известно, что в процессе метастазирования клетка проходит программу эпителиально-мезенхимного перехода (ЭМП), вследствие чего клетки теряют пролиферативную активность и приобретают способность к миграции и инвазии (Liao, Yang, 2017). Запуск программы ЭМП происходит благодаря нескольким сигнальным каскадам, важнейшим из которых является TGFβ-зависимый путь, при котором рецепторы TGFβ типа I и II формируют комплекс, что является причиной димеризации белков Smad2/3 и Smad4, причем сформированный димер переходит в ядро и запускает синтез транскрипционных факторов Snail1/2, Twist и Zeb1/2. Активация этих факторов приводит к блокированию синтеза эпителиальных маркеров (E-кадгерина, цитокератина и др.) и запуску экспрессии мезенхимных маркеров (виментина, N-кадгерина и Матрикс-ных металлопротеинкиназ) (Wendt et al., 2012).
HSF1 является ключевым транскрипционным фактором в клеточном ответе на стресс и запускает синтез молекулярных шаперонов, таких как Hsp70, Hsp90, Hsp40 и др. Существует много данных о повышенной активности HSF1 в опухолевых клетках, что часто связывают с неблагоприятным прогнозом для пациентов, включая пациентов с колоректальным раком (Jacobs, Marnett, 2009). В последнее время в литературе все чаще встречаются данные об участии HSF1 в ЭМП, в частности о связи белка с промотором транскрипционного фактора Snail2, ведущей к повышению экспрессии последнего и в результате к остановке синтеза эпителиальных и запуску синтеза мезенхимных маркеров (Carpenter et al., 2015). Существенно, что инактивация HSF1 в клетках рака поджелудочной железы может приводить к снижению инвазии и метастазирования в моделях in vivo (Chen et al., 2017). Необходимо отметить, что гены-мишени HSF1 могут быть непосредственно связаны с ЭМП. Например, для Hsp90 была показана его ассоциация с рецепторами TGFβ типа I и II, а ингибирование Hsp90 приводило к их убиквитинированию и деградации, что предотвращало запуск ЭМП программы (Wrighton et al., 2008). Таким образом, транскрипционный фактор HSF1, принимающий участие в активации и поддержании программы ЭМП, влияет на клеточную пластичность и способствует повышению злокачественности опухолевых клеток и метастатического потенциала. Поэтому подавление его активности представляется перспективным направлением в терапии.
В нашей лаборатории недавно был выявлен новый ингибитор активности HSF1, вещество CL-43, которое способно эффективно инактивировать HSF1 и подавлять синтез его белковых мишеней в опухолевых клетках 9 различных клеточных линий, включая клетки колоректального рака (Nikotina et al., 2018). Сам ингибитор не является токсичным, но способен подавлять защитную систему клетки, основанную на шаперонах, что позволяет снижать дозу химиотерапевтических препаратов, часто имеющих множественные побочные эффекты.
В настоящей работе мы оценили влияние CL-43 на способность клеток колоректального рака запускать программу ЭМП в присутствии фактора TGFβ1.
МАТЕРИАЛ И МЕТОДИКА
Клетки колоректальной аденокарциномы человека DLD1 культивировали в среде RPMI 1640 (Lonza Group, Швейцария), содержащей 10% бычьей эмбриональной сыворотки (FBS; HyClone, США), антибиотики пенициллин 100 ед./мл и стрептомицин 0.1 мг/мл (БиолоТ, Россия) при 37°С и 5% CO2.
Для запуска ЭМП использовали TGFβ1 (DA-PCEL Inc, США) в концентрации 10 нг/мл, добавляемый в среду в первый и третий день эксперимента. В контрольные клетки TGFβ1 не добавляли.
Для анализа влияния вещества CL-43 на характеристики ЭМП к клеткам DLD1 это вещество добавляли в концентрации 250 нМ по отдельности или в комбинации с TGF1β.
Оценку миграции и пролиферации клеток DLD1 в режиме реального времени проводили с помощью прибора xCELLigence RTCA DP (ACEA Biosciences, Inc., США). Для анализа клеточного индекса в лунки 16-луночной Е-платы, на дне которых помещается золотой электрод, вносили клетки DLD1 (по 150 тыс./мл), которые культивировали в течение 6 сут в присутствии TGFβ1 и (или) CL-43. Оценку клеточного индекса (измерение сопротивления клеток (импеданса)) проводили каждые 10 мин. Запись вели в течение 45 ч. Оценку миграционной активности также проводили с помощью прибора xCELLigence с использованием специальных разделенных CIM-плат. Результаты анализировали с помощью программного обеспечения прибора xCELLigence RTCA DP, Softwear 1.2.
Иммуноблотинг. Для выявления экспрессии Hsp70 под действием CL-43 и маркера ЭМП виментина при культивировании клеток DLD1 в присутствии TGFβ1 клетки собирали, центрифугировали и трижды промывали в фосфатно-солевом буферном растворе (PBS). К сухому клеточному осадку добавляли лизирующий буфер High RIPA (20 мМ Tris-HCl pH 7.5, 150 мМ NaCl, 0.1% Тритона X-100, 0.5% SDS, 1% дезоксихолата натрия, 2 мМ EDTA) и 100-кратный раствор ингибитора протеаз (Mammalian Inhibitor Protease, Sigma, США). После трех циклов замораживания-оттаивания лизат центрифугировали при 10 000 об./мин, в супернатанте определяли концентрацию белка по методу Брэдфорд (Bradford, 1976). Лизаты клеток (по 20 мкг на дорожку) использовали для электрофореза и иммуноблотинга. Мембрану последовательно инкубировали с антителами к виментину (CellSignaling Technology, США) и вторичными антителами против иммуноглобулинов мыши, меченными пероксидазой хрена (Abcam, Великобритания). Для контроля равномерности нанесения белковых проб использовали антитела к GAPDH (Abcam, Великобритания).
Тест на зарастание раны. Клетки DLD1 культивировали в присутствии TGFβ1 совместно и по отдельности с CL-43 в течение 6 сут, затем высевали в лунки 6-ти луночной платы (по 4.5 × 105 клеток). По достижению 85% конфлюэнтности монослоя (24 ч), наносили царапину с помощью наконечника дозатора на 1000 мкл. Клетки монослоя фотографировали сразу же после нанесения царапины (0 ч) и через 24 ч.
Иммунофлуоресцентное окрашивание. Клетки DLD1 сеяли в лунки 24-луночной платы, в которые предварительно помещали покровные стекла, обработанные поли-L-лизином (Sigma-Aldrich, США). После культивирования клеток в присутствии TGFβ1 совместно и по отдельности с CL-43 в течение 6 сут, клетки промывали в PBS, фиксировали 4%-ным раствором формалина, пермеабилизировали с помощью 0.05%-ного тритона Х-100 в PBS и проводили их иммунологическое окрашивание во влажной камере первичными антителами к Е-кадгерину (CellSignaling Technology, США), а затем вторичными антителами с флуоресцентной меткой GAR CF555 (Sigma-Aldrich, США). Стекла с клетками заключали в раствор DAKO fluorescent mounting medium (DAKO corporation, США), и затем производили серию фотографий на конфокальном микроскопе TSL SP 5 (Leica, Германия), используя объектив с увеличением 40×. Результаты обрабатывали в программах LAS X (Leica, Германия) и Adobe Photoshop (Adobe Systems, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В недавней работе мы обнаружили, что вещество CL-43, относящееся к классу карденолидов, способно эффективно подавлять активность транскрипционного фактора HSF1 и тем самым приводить к снижению уровня молекулярных шаперонов в раковых клетках, в том числе и клетках DLD1, используемых в настоящей работе (Nikotina et al., 2018).
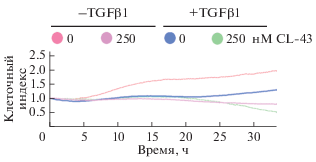
Моделирование ЭМП с помощью TGFβ1 описано достаточно подробно, причем одним из основных показателей процесса позиционируется остановка пролиферации (Vega et al., 2004; Tang et al., 2013). Для того чтобы выяснить, влияет ли CL-43 на пролиферативную активность клеток, обработанных TGFβ1, мы культивировали клетки DLD1 в течение 6 сут в присутствии TGFβ1 или в комбинации TGFβ1 с CL-43, после чего переносили клетки в лунки E-платы и помещали в прибор xCELLigence, который позволял наблюдать за пролиферативной активностью в режиме реального времени. Нам удалось показать, что культивирование клеток в присутствии TGFβ1 приводило к снижению пролиферативного потенциала клеток DLD1 по сравнению с контролем. Совместное присутствие в среде клеток 10 нг/мл TGFβ1 и CL-43 приводило к еще большему подавлению пролиферации (рис. 1а). Наши данные подтверждают феномен остановки пролиферации при ЭМП, а также демонстрируют, что инактивация такого важного транскрипционного фактора как HSF1, также способствует снижению клеточного роста.
Рис. 1.
Снижение пролиферативной активности (клеточного индекса) клеток DLD1 под действием ингибитора транскрипционного фактора HSF1 вещества CL-43. После 6 сут культивирования клеток DLD1 в присутствии или отсутствие TGFβ1 и (или) CL-43 в концентрации 250 нМ клетки высевали в лунки Е-плат прибора xCELLigence для оценки пролиферативных свойств по клеточному индексу.
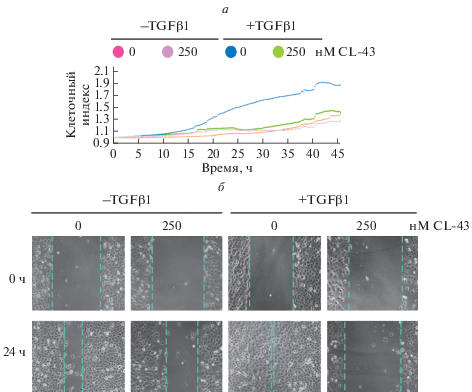
Одним из ключевых свойств метастазирующей клетки является повышенная способность к миграции (Roche, 2018), и в связи с этим следующим этапом нашего исследования стал анализ влияния CL-43 на способность клеток DLD1 к миграции. Данные, полученные на приборе xCELLigence RTCA DP, свидетельствуют о том, что культвтрование клеток DLD1 с TGFβ1 приводит к увеличению их миграционных свойств (рис. 2а, синяя кривая), но в присутствие CL-43 миграционная активность была понижена до контрольного уровня (рис. 2а, зеленая кривая). Эти результаты мы подтвердили с помощью теста зарастания царапины (рис. 2б).
Рис. 2.
Снижение миграционной активности клеток DLD1 под действием ингибитора HSF1 вещества CL-43. а – Через 6 сут культивирования клеток DLD1 в присутствии или отсутствие TGFβ1 и (или) CL-43 в концентрации 250 нМ клетки высевали в лунки CIM-плат прибора xCELLigence и оценивали миграционные свойства по клеточному индексу. б – Миграционные свойства клеток DLD1 в тесте зарастания раны. Клетки культивировали в присутствии или отсутствие TGFβ1 и (или) CL-43 в течение 6 сут после чего наносили рану. Изображения были получены сразу же после нанесения раны (0 ч) и через 24 ч. Об.: 40×.
Приобретение клетками подвижности – это ключевой момент в ЭМП, при котором происходит потеря полярности клетки, реорганизация цитоскелета, синтез факторов, например матриксных металлопротеиназ, которые помогают клеткам мигрировать через экстрацеллюлярный матрикс (Qin et al., 2016). B последнее время в литературе встречается много данных о прямом участии HSF1 в миграции раковых клеток, включая данные о влиянии его на TGFβ1-сигнальный путь (Kim et al., 2018; Paul et al., 2018; Yang et al., 2019), однако, механизмы его участия все еще остаются неизвестными. Более изученными являются его белки-мишени. Например, Hsp70 участвует в стабилизации таких важных для миграции белков, как FAK, Wasf3 или Hif1α, предотвращая их протеосомную деградацию (Juhasz et al., 2013). Следовательно, подавление синтеза шаперона благодаря инактивации HSF1 может приводить к снижению миграционного потенциала клеток, что мы и наблюдали в данной серии экспериментов.
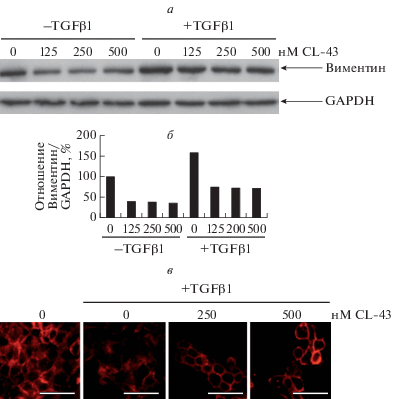
Чтобы определить, как CL-43 влияет на изменение уровня белков, влияющих на корректное проведение ЭМП в раковых клетках, мы проанализировали уровень виментина и E-кадгерина. Наши данные указывают на то, что клетки DLD1, которые в контрольном состоянии показывают черты, характерные для метастазирующих клеток, в частности повышенную подвижность, исходно синтезируют виментин на высоком уровне, но под действием TGFβ1 уровень экспрессии увеличивается на 50% (рис. 3а, 3б). В обоих случаях, как при обработке TGFβ1, так и без нее, введение в среду CL-43 приводило к снижению уровня виментина дозозависимым образом. Анализ количества и распределения Е-кадгерина показал, что CL-43 способен восстанавливать уровень этого белка, а также его локализацию по сравнению с клетками, которые были обработаны только TGFβ1 (рис. 3, в).
Рис. 3.
Уровень экспрессии молекулярных маркеров ЭМП (виментина и кадгерина) в клетках DLD1, индуцированных фактором роста TGFβ1, возвращается к исходному при действии CL-43. а – Иммуноблотинг лизатов клеток DLD1 в присутствии или отсутствие TGFβ1 и (или) CL-43 в концентрации 125, 250, 500 нМ. Детекцию зон осуществляли с использованием антител к виментину и GAPDH. б – Интенсивность зон (а) представлена как отношение интенсивностей зон виментина к GAPDH, который был использован как контроль нагрузки. Интенсивность зон оценивали с помощью программы ImageLab. в – Визуализация Е-кадгерина в клетках DLD1 после их 6-суточного культивирования в присутствии или отсутствие TGFβ1 и (или) CL-43 в концентрации 250 и 500 нМ. Конфокальная микроскопия. После фиксации клетки окрашивали кроличьими антителами к Е-кадгерину (красный цвет). Масштабная линейка: 20 мкм.
Вещество CL-43 принадлежит к семейству карденолидов, которые были известны еще в Древнем Египте, а последние 200 лет использовались в медицине в качестве препаратов для сердечно-сосудистых заболеваний (Bessen, 1986). В течение последних десятилетий карденолиды и их производные находят применение в противоопухолевой терапии (Slingerland et al., 2013), и факт, что CL-43 снижает пролиферативные и миграционные способности клеток колоректального рака, доказывает многосторонность применения веществ этого класса. Соединение CL-43 было отобрано из группы, включающей 50 его аналогов, и более половины были способны понижать активность HSF1, но только CL-43 не обладал токсичностью по отношению ни к опухолевым клеткам, ни к нормальным фибробластам человека (Nikotina et al., 2018). Это выгодно отличает CL-43 от известных в настоящее время ингибиторов HSF1, таких как триптолид (Westerheaide et al., 2006), KNK-437 (Yokota et al., 2000) и недавно описанное вещество, IHSF115, отобранное с помощью метода in silico, и имеющее сродство к ДНК-связывающему домену HSF1 (Vilaboa et al., 2017). Эти вещества, несмотря на высокую эффективность подавления активности HSF1 и обещающую, как следствие, противоопухолевую активность, обладали недопустимой токсичностью в моделях in vitro и in vivo (Xi et al., 2017).
В настоящей работе нам удалось показать, что CL-43 не только может служить адьювантом противоопухолевой терапии в комбинации с традиционными противоопухолевыми препаратами, будучи нетоксичным и позволяющем снизить дозу токсичного цитостатика (Nikotina et al., 2018), но и сам по себе способен предотвращать ЭМП в клетках колоректального рака, что значительно повышает его терапевтическую ценность.
БЛАГОДАРНОСТИ
Авторы выражают признательность Наталье Тараровой (Dapcel Inc., США) за обеспечение их фактором TGFβ1 и Е.В. Мартовой за помощь в постановке экспериментов.
Список литературы
Bessen H.A. 1986. Therapeutic and toxic effects of digitalis: William Withering, 1785. J. Emerg. Med. 4 : 243–248.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72 : 248–254.
Carpenter R.L., Paw I., Dewhirst M.W., Lo H.W. 2015. Akt phosphorylates and activates HSF-1 independent of heat shock, leading to Slug overexpression and epithelial-mesenchymal transition (EMT) of HER2-overexpressing breast cancer cells. Oncogene. 34 : 546–557.
Chen K., Qian W., Li J., Jiang Z., Cheng L., Yan B., Cao J., Sun L., Zhou C., Lei M., Duan W., Ma J., Ma Q., Ma Z. 2017. Loss of AMPK activation promotes the invasion and metastasis of pancreatic cancer through an HSF1-dependent pathway. Mol. Oncol. 11 : 1475–1492.
Jacobs A.T., Marnett L.J. 2009. HSF1-mediated BAG3 expression attenuates apoptosis in 4-hydroxynonenal-treated colon cancer cells via stabilization of anti-apoptotic Bcl-2 proteins. J. Biol. Chem. 284 : 9176–9183.
Juhasz K., Lipp A.M., Nimmervoll B., Sonnleitner A., Hesse J., Haselgruebler T., Balogi Z. 2013. The complex function of hsp70 in metastatic cancer. Cancers (Basel). 6 : 42–66.
Kim S.J., Lee S.C., Kang H.G., Gim J., Lee K.H., Lee S.H., Chun K.H. 2018. Heat shock factor 1 predicts poor prognosis of gastric cancer. Yonsei Med. J. 59 : 1041–1048.
Liao T.T., Yang M.H. 2017. Revisiting epithelial-mesenchymal transition in cancer metastasis: the connection between epithelial plasticity and stemness. Mol. Oncol. 11 : 792–804.
Nikotina A.D., Koludarova L., Komarova E.Y., Mikhaylova E.R., Aksenov N.D., Suezov R., Kartzev V.G., Margulis B.A., Guzhova I.V. 2018. Discovery and optimization of cardenolides inhibiting HSF1 activation in human colon HCT-116 cancer cells. Oncotarget. 9 : 27 268–27 279.
Paul S., Ghosh S, Mandal S., Sau S., Pal M. 2018. NRF2 transcriptionally activates the heat shock factor 1 promoter under oxidative stress and affects survival and migration potential of MCF7 cells. J. Biol. Chem. 293 : 19303–19316.
Qin G., Luo M., Chen J., Dang Y., Chen G., Li L., Zeng J., Lu Y., Yang J. 2016. Reciprocal activation between MMP-8 and TGF-β1 stimulates EMT and malignant progression of hepatocellular carcinoma. Cancer Lett. 374 : 85–95.
Riihimäki M., Hemminki A., Sundquist J., Hemminki K. 2016. Patterns of metastasis in colon and rectal cancer. Sci. Rep. 6 : 29765. https://doi.org/10.1038/srep29765
Roche J. 2018. The epithelial-to-mesenchymal transition in cancer. Cancers (Basel). 10(2). pii: E52. https://doi.org/10.3390/cancers10020052
Slingerland M., Cerella C., Guchelaar H.J., Diederich M., Gelderblom H. 2013. Cardiac glycosides in cancer therapy: from preclinical investigations towards clinical trials. Invest. New Drugs. 31 : 1087–1094.
Tang Y., Herr G., Johnson W., Resnik E., Aho J. 2013. Induction and analysis of epithelial to mesenchymal transition. J. Vis. Exp.78. https://doi.org/10.3791/50478
Van der Geest L.G., Lam-Boer J., Koopman M., Verhoef C., Elferink M.A., de Wilt J.H. 2015. Nationwide trends in incidence, treatment and survival of colorectal cancer patients with synchronous metastases. Clin. Exp. Metastasis. 32 : 457–465.
Vega S., Morales A.V., Ocaña O.H., Valdés F., Fabregat I., Nieto M.A. 2004. Snail blocks the cell cycle and confers resistance to cell death. Genes Dev. 18 : 1131–1143.
Vilaboa N., Boré A., Martin-Saavedra F., Bayford M., Winfield N., Firth-Clark S., Kirton S.B., Voellmy R. 2017. New inhibitor targeting human transcription factor HSF1: effects on the heat shock response and tumor cell survival. Nucleic Acids Res. 45 : 5797–5817.
Wendt M.K., Tian M., Schiemann W.P. 2012. Deconstructing the mechanisms and consequences of TGF-β-induced EMT during cancer progression. Cell Tiss. Res. 347 : 85–101.
Westerheide S.D., Kawahara T.L., Orton K., Morimoto R.I. 2006. Triptolide, an inhibitor of the human heat shock response that enhances stress-induced cell death. J. Biol. Chem. 281 : 9616–9622.
Wrighton K.H., Lin X., Feng X.H. 2008. Critical regulation of TGFbeta signaling by Hsp90. Proc. Natl. Acad. Sci. USA. 105 : 9244–9249.
Xi C., Peng S., Wu Z., Zhou Q., Zhou J. 2017. Toxicity of triptolide and the molecular mechanisms involved. Biomed. Pharmacother. 90 : 531–541.
Yang W., Feng B., Meng Y., Wang J., Geng B., Cui Q., Zhang H., Yang Y., Yang J. 2019. FAM3C-YY1 axis is essential for TGFβ-promoted proliferation and migration of human breast cancer MDA-MB-231 cells via the activation of HSF1. J. Cell Mol. Med. https://doi.org/10.1111/jcmm.14243
Yokota S., Kitahara M., Nagata K. 2000. Benzylidene lactam compound, KNK437, a novel inhibitor of acquisition of thermotolerance and heat shock protein induction in human colon carcinoma cells. Cancer Res. 60 : 2942–2948.
Дополнительные материалы отсутствуют.


