Цитология, 2019, T. 61, № 7, стр. 536-547
Интенсивность свободно-радикальных процессов в митохондриях печени крыс при умеренной гипотермии различной длительности
Р. А. Халилов 1, А. М. Джафарова 1, *, С. И. Хизриева 1, В. Р. Абдуллаев 1
1 Кафедра биохимии и биофизики Дагестанского государственного университета
367000 Махачкала, Дагестан, Россия
* E-mail: albina19764@mail.ru
Поступила в редакцию 15.04.2019
После доработки 23.04.2019
Принята к публикации 23.04.2019
Аннотация
Искусственную умеренную гипотермию широко используют в клинической практике для защиты органов от последствий ишемии (реперфузии), травм и гипоксии. Однако снижение температуры тела гомойотермных животных индуцирует окислительный стресс, выраженность которого может зависеть от времени воздействия холодового фактора. Поскольку митохондрии играют ключевую роль в генерации активных форм кислорода, нами исследована зависимость интенсивности свободно-радикальных процессов в митохондриях печени крыс от длительности умеренной гипотермии (30°С). Оказалось, что кратковременная (30 мин) гипотермия активизирует процессы перекисного окисления липидов (ПОЛ), при этом существенно увеличивается концентрация гидроперекисей липидов, основания Шиффа и малонового диальдегида. Пролонгирование гипотермии до 1 ч снижает содержание многих продуктов ПОЛ, а при 3-часовой гипотермии наблюдается их нормализация. Кратковременная гипотермия и ее пролонгирование до 1 ч сопровождается окислительной деструкцией митохондриальных белков, что выражается в снижении содержания в них сульфгидрильных групп и повышении карбонильных. При этом 3-часовая гипотермия способствует нормализации исследованных маркеров окислительной модификации белков. Динамика изменения уровней сульфгидрильных и карбонильных групп в матричных белках митохондрий носит более выраженных характер по сравнению с мембранными белками. Исследование спектральных характеристик мембранных белков митохондрий показало снижение на начальных этапах гипотермии интенсивности их флуоресценции. Основной вклад в него вносят остатки триптофана, локализованные на периферии. Пролонгирование гипотермии до 3-х ч способствует восстановлению параметров флуоресценции до уровня контроля. Данные, полученные при анализе вторых производных спектров флуоресценции, свидетельствуют об изменениях в пространственной конфигурации мембранных белков.
Гипотермия – это состояние, развивающееся у гомойотермных животных при снижении температуры их тела. В зависимости от этиологии развития гипотермического состояния различают несколько видов гипотермии – случайная, интраоперационная, искусственная. Случайная гипотермия может иметь место у животных, обитающих в регионах со значительными колебаниями температурного режима; у людей, профессиональная деятельность которых связана с работой в условиях низких температур (Brown et al., 2012). При проведении обширных операций с использованием наркоза человек может подвергаться так называемой интраоперационной гипотермии (Sun et al., 2015).
Искусственные гипотермические состояния широко применяются при операциях на сердце и мозге, а также в терапевтических целях для предупреждения рисков развития ишемических и реперфузионных повреждений жизненно важных органов и защиты от последствий гипоксии, ишемии−реперфузии, инсульта и инфаркта, травм (Polderman, 2009; Søreide, 2014). Защита, обусловленная понижением температуры тела, является результатом снижения скорости метаболических процессов и уменьшения потребности тканей в кислороде и глюкозе (Alva at al., 2013). Наиболее часто для этих целей используют умеренную пролонгированную гипотермию (Усенко, Царев, 2009).
Наряду с положительными терапевтическими эффектами умеренная гипотермия вызывает ряд нежелательных изменений в организме, что ограничивает потенциальные возможности ее применения. Гипотермия является экстремальным состоянием для гомойотермного организма: она сопровождается стрессовой реакцией, которая провоцирует интенсификацию свободно-радикальных процессов (СРП), связанную с образованием активных форм кислорода (АФК) (Эмирбеков, Кличханов, 2011; Alva et al., 2013). Известно, что АФК могут стимулировать перекисное окисление липидов (ПОЛ) и способствовать окислительной модификации как растворимых, так и мембранно-связанных белков (ОМБ), что приводит к потере их функциональной активности. Пролонгирование умеренной гипотермии может изменить скорость генерации и элиминации АФК. Вопрос о том, как зависит интенсивность СРП от длительности умеренней гипотермии в настоящее время остается малоизученным. А между тем понимание основных механизмов деструктивных или компенсаторно-приспособительных изменений, лежащих в основе терапевтической гипотермии, жизненно важно для разработки надлежащего и эффективного лечения.
Известно, что основными источником АФК в клетке являются митохондрии (Гривенникова, Виноградов, 2013), поэтому наиболее перспективными для более детального раскрытия механизмов генерации и утилизации АФК на различных временных промежутках гипотермического состояния является исследование прооксидантного статуса этих органелл. Интенсификация процессов ПОЛ и ОМБ в митохондриях может изменить проницаемость их мембран, активность ферментов дыхательной цепи и АТФазы, способствовать открытию митохондриальной поры. Поскольку митохондрии играют ключевую роль в энергетическом обмене, регуляции кальциевого гомеостаза и апоптозе (Панов, 2015; Panel et al., 2018), то указанные окислительные повреждения их структурных элементов при гипотермии могут способствовать каскадному развитию в клетках патологических процессов.
Цель настоящей работы заключалась в исследовании интенсивности СРП в митохондриях печени крыс при умеренной (30°С) гипотермии различной длительности. Оценивали содержание в митохондриях продуктов ПОЛ и ОМБ.
МАТЕРИАЛ И МЕТОДИКА
Животные и моделирование гипотермии. Эксперименты выполнены на крысах-самцах линии Вистар, массой 200–220 г, содержащихся в условиях вивария. Животных делили на 4 группы по 8 в каждой – контрольную (температура тела 37°С) и три группы животных, подвергнутых гипотермии. Гипотермию вызывали наружным охлаждением животных в плексигласовых камерах с рубашкой, через которую циркулировала холодная (5°С) вода. Температуру тела крыс снижали равномерно со скоростью 0.28°С/мин до 30°С (кратковременная умеренная гипотермия), поддерживали этот уровень гипотермии в течение 1 и 3 ч (пролонгированая умеренная гипотермия). Температуру измеряли в прямой кишке на глубине 4–5 см ректальным цифровым термометром MS6501.
Выделение митохондрий. Использовали метод дифференциального центрифугирования в градиенте плотности сахарозы (Рыбадченко, Коганов, 1998). Определение белка производили по методу Лоури (Lowry et al., 1951).
Определение продуктов ПОЛ. Продукты ПОЛ экстрагировали из митохондрий смесью гептана и изопропанола. Полученные гептановые и изопропанольные экстракты сканировали на спектрофотометре Beckman DU-730 в области длин волн от 190 до 400 нм. Поглощение в области 232–240 нм соответствовало диеновым коньюгатам (ДК), в области 276 и 268 нм – уровню кетодиенов и сопряженных триенов (СТ). Основания Шиффа (ОШ) регистрировали на длине волны 360 нм (Влочегарский и др., 1998).
Определение гидроперекисей липидов. К митохондриальной фракции добавляли 2.8 мл этанола и 0.05 мл 50%-ного раствора трихлоруксусной кислоты. Смесь интенсивно встряхивали в течение 5–6 мин и центрифугировали 10 мин при 3000 g. Супернатант использовали для определения гидроперекисей липидов, которые легко реагируют с ионами двухвалентного железа соли Мора. Полученные ионы трехвалентного железа определяли спектрофотометрически с использованием тиоцианата аммония в качестве хромогена при длине волны 480 нм (Mihaljević et al., 1996).
Определение содержания малонового диальдегида (МДА). Содержание МДА в митохондриях определяли по реакции его с тиобарбитуровой кислотой. Расчет производили с использованием коэффициента молярной экстинкции 1.56 × 105 л М–1 см–1 в нмолях на 1 мг белка (Лысакова и др., 1997).
Определение содержания карбонильных и сульфгидрильных групп. Содержание карбонильных групп в белках митохондрий определяли по реакции их с 2.4-динитрофенилгидразином (Venditti et al., 2004). Расчет производили с использованием коэффициента молярной экстинкции 22 000 (М/л)–l cм–1 в нмолях на 1 мг белка. Содержание SH-групп в белках митохондрий измеряли колориметрическим методом, по реакции их с 5.5'-дитио-бис-2-нитробензойной кислотой (Habeeb, 1972). Концентрацию выражали в нмолях на 1 мг белка, используя коэффициент молярного поглощения 13 600 (М/л)–l cм–1.
Оценку суммарной флуоресценции митохондриальных белков проводили на сперктрофлуориметре Hitachi F-7000 (Япония) с автоматической коррекцией спектров. Спектр флуоресценции снимали в диапазоне длин волн (λ) 290 ≤ λ ≤ 400 нм при длине волны возбуждения 280 нм. Обработку спектров производили в программе Origin 8.6.
Статистическая обработка экспериментальных данных. Использовали однофакторный дисперсионный анализ (ANOVA) и пакет СТАТИСТИКА. Достоверность различия определяли с помощью критерия Фишера при уровне значимости P = 0.05. Среднестатистические спектры флуоресценции получали путем усреднения спектральных линий, полученных в повторных экспериментах (n = 8) с использованием фильтрации Фурье (по 5 точкам).
Реактивы. В работе использовали сахарозу, HEPES, ЭДТА, тиоцианат аммония (AppliСhem, Германия), бычий сывороточный альбумин, тиобарбитуровую кислоту, 2.4-динитрофенилгидразин, 5.5'-дитио-бис-2-нитробензойную кислоту (Sigma, США), гептан, изопропанол, трихлоруксусную кислоту (Acros Оrganics, Бельгия).
РЕЗУЛЬТАТЫ
Исследована интенсивность ПОЛ и ОМБ в митохондриях печени крыс при умеренной (30°С) кратковременной (30 мин) и пролонгированной до 1 и 3 ч гипотермии. Интенсивность ПОЛ в биосистеме можно оценить по содержанию в ней первичных (ДК и гидроперекисей), вторичных (кетодиенов, сопряженных триенов, МДА) и третичных (ОШ) продуктов. Уровень ДК, кетодиенов, сопряженных триенов и ОШ в нейтральных липидах и фосфолипидах митохондрий определяли по спектрам поглощения их экстрактов смесью гептана и изопропанола. В спектрах поглощения этих экстрактов митохондрий крыс было обнаружено несколько максимумов, которые соответствуют ДК (240 нм), кетодиенам и сопряженным триенам (260–280 нм), а также ОШ (362 нм) (рис. 1). При этом четкие полосы поглощения исследуемых продуктов пероксидации липидов митохондрий наблюдали в изопропаноловом экстракте, а в гептановой фракции они практически отсутствовали.
Рис. 1.
Спектры поглощения продуктов ПОЛ в митохондриях печени контрольных крыс в гептановой (Г-фаза, штриховая кривая) и изопропаноловой (ИП-фаза, сплошная кривая) фазах: диеновых конъюгатов (а), кетодиенов и сопряженных триенов (б) и оснований Шиффа (в). D – оптическая плотность, отн. ед.
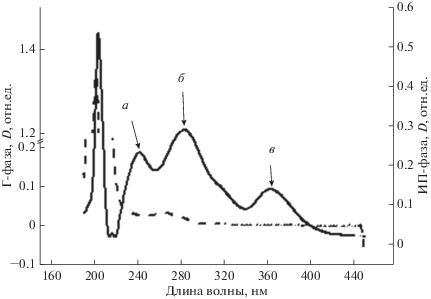
Изопропанол экстрагирует фосфолипиды, на долю которых в мембранах митохондрий приходится около 90%. Основные из них – это фосфотидилхолин (~40%), фосфодидилэтаноламин (~29%) и кардиолипин (~15%) (Schenkel, Bakovic, 2014). Поскольку в состав фосфолипидов входит существенно больше ненасыщенных жирных кислот, то они в большей степени, чем нейтральные липиды, подвергаются свободно-радикальному окислению (Gaschler, Stockwell, 2017).
В табл. 1 представлены результаты влияния гипотермии на содержание в митохондриях печени крыс продуктов ПОЛ, растворимых в изопропаноле, а также гидроперекисей липидов и МДА. Как видно, кратковременная гипотермия 30°С активизирует процессы ПОЛ. При этом наблюдается незначительное увеличение таких продуктов ПОЛ, как ДК, кетодиены и сопряженные триены, в то время как содержание гидроперекисей липидов, ОШ и МДА существенно увеличивается: на 40, 18.3 и 39.4% соответственно.
Таблица 1.
Содержание продуктов ПОЛ (нмоль на 1 мг белка) в митохондриях печени при умеренной гипотермии различной длительности
| Продукты | Контроль | Гипотермия | ||
|---|---|---|---|---|
| 30 мин | 1 ч | 3 ч | ||
| Диеновые конъюгаты | 36.44 ± 2.96 | 44.13 ± 3.15 | 38.82 ± 2.74 | 34.53 ± 2.72 |
| Кетодиены | 56.15 ± 5.48 | 62.67 ± 6.24 | 58.34 ± 4.65 | 55.28 ± 4.38 |
| Сопряженные триены | 24.46 ± 1.84 | 29.66 ± 1.45 | 27.58 ± 1.63 | 25.74 ± 1.63 |
| Гидроперекиси липидов | 6.55 ± 0.14 | 9.17 ± 0.22а | 4.67 ± 0.20а | 6.16 ± 0.11б |
| МДА | 0.38 ± 0.019 | 0.53 ± 0.056а | 0.50 ± 0.039а | 0.44 ± 0.023 |
| Основания Шиффа | 1.42 ± 0.05 | 1.68 ± 0.08а | 1.35 ± 0.04б | 1.30 ± 0.06б |
Гипотермия в течение 1 ч, в целом, снижает интенсивность процессов ПОЛ, на это указывает снижение уровня содержания многих продуктов пероксидации липидов относительно контроля. При этом содержание МДА не изменяется и остается на уровне такового крыс, подверженных кратковременной гипотермии. Дальнейшее пролонгирование гипотермии (до 180 мин) способствует нормализации ПОЛ: уровень всех показателей пероксидации липидов достигает контрольных значений.
АФК, образующиеся в митохондриях, могут привести к окислительной модификации не только липидов, но и белков. Наиболее чувствительными к окислению являются серосодержащие аминокислотные остатки белков. Тиольные группы этих аминокислот могут находиться в двух состояниях: восстановленном (-SH) и окисленном (-S–S-). В условиях окислительного стресса SH-группы белков могут подвергаться окислению с образованием соответствующих дисульфидов (Дубинина, 2006).
Исследование показало, что умеренная кратковременная гипотермия способствует незначительному (на 8.2%) снижению концентрации сульфгидрильных групп в белках мембран митохондрий (рис. 2а). Пролонгирование гипотермического состояния до 1 ч индуцирует еще большее снижение содержания SH-групп (на 13.6%). А 3-часовая гипотермия способствует их нормализации. Корреляционный анализ показал наличие отрицательной корреляции (r = –0.76) между содержанием МДА в митохондриях и уровнем SH-групп в мембранных белках крыс с нормотермией и гипотермией.
Рис. 2.
Содержание сульфгидрильных групп в белках мембран (а) и матрикса (б) митохондрий печени крыс в норме (столбец 1) и умеренной гипотермии различной длительности: кратковременной (30 мин, столбец 2) и пролонгированной до 1 ч (столбец 3) и 3 ч (столбец 4). Различия достоверны относительно контроля (*) и 1-часовой гипотермии (+) при Р < 0.05.
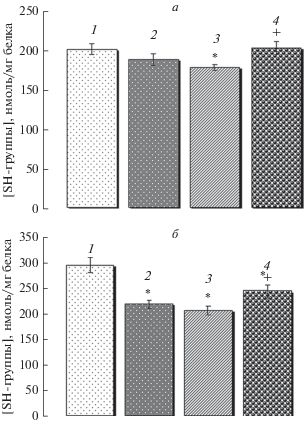
Анализ содержания SH-групп в белках митохондриального матрикса (рис. 2б) позволил выявить более значимые эффекты кратковременной гипотермии: снижение их уровня составило около 25.6% относительно контроля. Пролонгирование гипотермического состояния до 1 ч сопровождается дальнейшим окислением сульфгидрильных групп матричных белков. Напротив, 3-часовая гипотермия способствует повышению содержания SH-групп относительно 1-часовой гипотермии (на 17.6%), однако содержание их все еще остается на более низком уровне относительно контроля.
Окисление боковых радикалов белков может приводить к образованию продуктов с карбонильными группами, которые также часто используются в качестве маркеров окислительного повреждения белков (Дубинина, 2006). Карбонильные производные образуются в результате катализируемого металлом окисления пролиновых, аргининовых, лизиновых, гистидиновых остатков аминокислот. Они могут образовываться также при участии аминокислотных остатков лизина, цистеина и гистидина в реакциях с продуктами ПОЛ (Dalle-Donne et al., 2003).
На рис. 3а видно, что при кратковременной гипотермии содержание карбонильных групп в мембранных белках митохондрий печени крыс повышается на 19%. Пролонгирование гипотермического состояния до 1 ч способствует дальнейшему повышению содержания карбонильных групп, которое составляет 52 и 28% относительно контроля и кратковременной гипотермии соответственно. При этом 3-часовая гипотермия нормализует уровень карбонильных групп, снижая его на 29.2% относительно 1-часовой гипотермии. Корреляционный анализ показал наличие положительной корреляции (r = 0.71) между содержанием МДА в митохондриях и уровнем карбонильных групп в мембранных белках митохондрий крыс с нормо- и гипотермией.
Рис. 3.
Содержание карбонильных групп в белках мембран (а) и матрикса (б) митохондрий печени крыс в норме (столбец 1) и умеренной гипотермии различной длительности: кратковременной (30 мин, столбец 2) и пролонгированной до 1-ого (столбец 3) и 3-х (столбец 4) ч. Различия достоверны относительно контроля (*), кратковременной гипотермии (#), и 1-часовой гипотермии (+) при Р < 0.05.
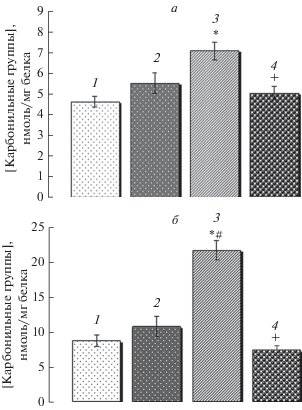
Гипотермия оказала более существенное влияние на содержание карбонильных групп в матричных белках митохондрий (рис. 3б). Так, содержание карбонильных групп в них при кратковременной гипотермии увеличилось на 22.9%. Пролонгирование гипотермического состояния до 1 ч способствует повышению уровня карбонильных групп в 2.49 раз относительно контроля и в 2 раза относительно кратковременной гипотермии. Дальнейшее пролонгирование гипотермии (3 ч) значительно снижает (на 67%) содержание карбонильных групп относительно 1-часовой гипотермии. При этом содержание карбонильных групп становится на 17% меньше контрольного уровня.
В связи с тем фактом, что в белках, находящихся в окружении липидов, триптофан и тирозин обладают уникальной способности легко вступать в реакции с АФК с образованием радикалов, нами исследована интенсивность суммарной флуоресценции (ИФ) мембран митохондрий печени крыс при гипотермии. Как видно из рис. 4а, в контроле спектр ИФ митохондрий имеет симметричную колоколообразную форму с максимумом около 333 нм, что может свидетельствовать об основном вкладе в спектр флуоресценции остатков триптофана (Онищенко и др., 2004). Кратковременная гипотермия и ее пролонгирование до 1 ч способствуют снижению ИФ митохондрий, при этом другие спектральные параметры существенно не изменяются. Пролонгирование гипотермии до 3-х ч способствует восстановлению значений I до уровня контроля.
Рис. 4.
Спектры суммарной флуоресценции белков мембран митохондрий печени крыс (кривая 1) и их вторые производные (ВПСФ, кривая 2) в норме (контроль) и умеренной гипотермии различной длительности: 30 мин, 1 и 3 ч. ИФ – интенсивность флуоресценции.
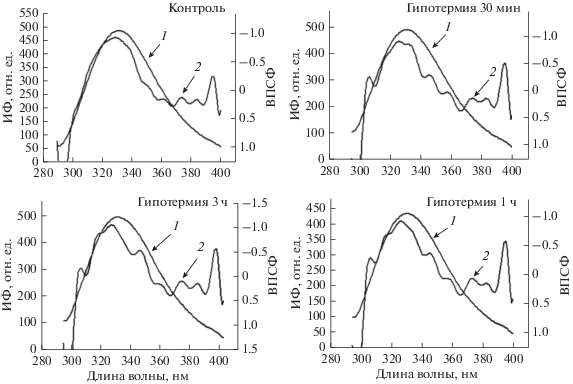
При анализе спектров флуоресценции предпочтительно применять вторые производные спектров флуоресценции (ВПСФ), поскольку они, по сравнению с исходными спектрами, дают возможность получить более детальную информацию о состоянии микроокружения ароматических остатков белков, а в ряде случаев разделить вклад тирозиновой и триптофановой составляющих в суммарный спектр (Онищенко и др., 2004). Анализ ВПСФ показал, что при гипотермии в спектрах формируется пик при 305 нм, соответствующий тирозиновой флуоресценции (рис. 4б). Характеристики этого пика при пролонгировании гипотермии не изменяются.
Помимо тирозинового компонента в спектрах ВПСФ митохондриальных белков гипотермированных крыс наблюдается формирование длинноволновых пиков (при 345 и 355 нм), соответствующих триптофанилам, расположенным на периферии молекулы белка, которые частично или полностью контактируют с водным окружением.
ОБСУЖДЕНИЕ
Известно, что на начальных этапах снижения температуры тела развивается стрессовая реакция, приводящая к активации симпатоадреналовой и гипоталамо-гипофизарно-адренокортикальной систем (Кулинский, Ольховский, 1992). В результате этого индуцируются терморегуляторные реакции, направленные на увеличение производства тепла за счет активации метаболических процессов и снижение теплопотерь за счет вазоконстрикции и централизации кровотока. Возникновение спазма периферических сосудов повышает вязкость крови и нарушает микроциркуляцию (Alva et al., 2004). Все это в совокупности со сдвигом при низких температурах кривой диссоциации оксигемоглобина влево приводит к ситуации тканевой гипоксии (Zinchuk, Hlutkin, 2015).
Снижение концентрации кислорода в тканях может привести к накоплению восстановительных эквивалентов в митохондриальных цепях переноса электронов (Скулачев и др., 2012). Основными сайтами производства АФК, прежде всего супероксидного анион-радикала (${\text{O}}_{2}^{{\centerdot - }}$), в дыхательной цепи митохондрий являются комплексы I и III (Gusdon et al., 2015). Супероксидный анион-радикал не проникает через мембрану и в норме быстро удаляется путем превращения в пероксид водорода (H2O2) с помощью супероксиддисмутазы (Wong et al., 2017). H2O2 может дополнительно восстановливаться в присутствии ионов двухвалентного металла и супероксида в реакциях Фентона или Хабер−Вейса с образованием гидроксильного радикала.
Таким образом, несмотря на то, что печень является основным резервуаром антиоксидантов в организме, высокая концентрация в ней ионов железа может стать одной из причин интенсивной генерации гидроксильного радикала. Эта высокотоксичная молекула с высокой скоростью реагирует со многими метаболитами, тем самым вызывая окислительное повреждение. ${\text{O}}_{2}^{{\centerdot - }}$ также может очень быстро взаимодействовать с оксидом азота, в результате чего образуются реактивные формы азота, в частности пероксинитрит (Pacher et al., 2007).
Поскольку митохондрии всегда подвержены риску избыточной продукции АФК, они содержат множество антиоксидантных ферментов (глутатионпероксидазу, глутатионредуктазу, марганец-содержащую супероксиддисмутазу, каталазу и пероксиредоксины) и неферментных антиоксидантов (глутатион, коэнзим А, убихинол и витамин Е) (Кулинский, Колесниченко, 2009; Maroz et al., 2009; Handy, Loscalzo, 2012; Figueira et al., 2013). Однако высокая скорость генерация АФК может нарушить динамическое равновесие между прооксидантами и антиоксидантами и привести к дисфункции антиоксидантного ферментного каскада.
Данные из литературы свидетельствуют об интенсификации образования АФК и нарушении прооксидантно-антиоксидантного баланса в тканях при гипотермии, что стимулирует окислительную модификацию клеточных липидов и белков (Alva et al., 2013). Особенно ярко выраженная интенсификация наблюдается при умеренной кратковременной гипотермии (Эмирбеков, Кличханов, 2011; Аль-Рабии и др., 2015а). Результаты нашего исследования тоже указывают на интенсификацию СРП на начальных этапах гипотермии, о чем свидетельствуют высокие уровни продуктов ПОЛ и ОМБ.
Среди первичных механизмов повреждения клеток при окислительном стрессе лидирует окисление жирнокислотных остатков в фосфолипидах мембран. Основным субстратом для свободно-радикальных реакций являются двойные связи ненасыщенных жирных кислот в составе фосфолипидов (Gaschler, Stockwell, 2017). Митохондриальные мембраны обладают особой чувствительностью к АФК, поскольку кардиолипин, локализованный во внутренней мембране митохондрий, у большинства животных содержит четыре остатка линолевой кислоты (Schenkel, Bakovic, 2014).
В результате свободно-радикального окисления жирных кислот образуются гидроперекиси и ДК (первичные продукты), которые очень нестабильны. При участии металлов переменной валентности они быстро метаболизируют во вторичные (альдегиды и диальдегиды) и третичные (ОШ) продукты ПОЛ. Это снижает гидрофобность липидов и нарушает устойчивость мембран, изменяет работу мембраносвязанных ферментов, повышает проницаемость мембран для ионов (Sies et al., 2017).
В работе Зинчука и Глуткина (Zinchuk, Hlutkin, 2015) установлено, что в печени крыс при гипотермии 28.5°С, вызванной наружным охлаждением в течение 2-х ч, возрастает содержание как ДК, так и ОШ. Результаты нашего исследования (табл. 1) демонстрируют, что кратковременная гипотермия из всех продуктов ПОЛ значимо увеличивает только содержание гидроперекисей, МДА и ОШ. Незначительный рост других первичных (ДК) и вторичных (кетодиенов и сопряженных триенов) продуктов ПОЛ может объясняется тем, что время жизни этих продуктов короткое и на ранних этапах может происходить обрыв цепной реакции при взаимодействии липопероксильных радикалов друг с другом или с антиоксидантами, например, токоферолом.
Известно, что мембрана митохондрий содержит высокие концентрации витамина Е, примерно 35–40% от его суммарного содержания в гепатоцитах, причем более 70% его локализовано в наружной мембране митохондрий. Главной антиоксидантной функцией витамина Е является обрыв цепной реакции процесса ПОЛ. В этой ситуации α-токоферолол отдает свой атом водорода липопероксидам, восстанавливая их с очень высокой скоростью. Витамин Е может восстанавливаться аскорбиновой кислотой (Cantoni et al., 2017) или убихинолом, которые к тому же способны нейтрализовать суперокидный или гидроксильный радикалы (Maroz et al., 2009). Показано, что содержание витамина С в митохондриях печени крысы достаточно высокое и составляет примерно 0.5–1 мМ. Предполагается, что аскорбиновая кислота может транспортироваться в межмембранное пространство митохондрии с помощью натрий-зависимого транспортера витамина С (SVCT2) и непосредственно окисляться суперокидным радикалом, генерируемым комплексом III, или восстанавливать витамин Е, превращаясь в окисленную форму. Окисленная форма витамина С в свою очередь может восстанавливаться убихинолом или транспортироваться в матрикс митохондрии и восстанавливаться там с помощью глутатиона (Cantoni et al., 2017)
Первичные продукты ПОЛ могут не восстанавливаться с помощью антиоксидантов, а с высокой скоростью превращаться в более стабильные гидроперекиси (поскольку концентрация кислорода в липидной матрице митохондрий достаточно высокая). В пользу данного предположения свидетельствуют данные настоящей работы (табл. 1) содержание гидроперекисей при гипотермии существенно увеличивается.
Высокие уровни МДА и ОШ при кратковременной гипотермии и ее часовом пролонгировании могут быть обусловлены тем, что эти вторичные и третичные продукты ПОЛ медленно или вовсе не утилизируются в клетке. Действительно, в работе Львовой с сотрудниками (1993) было показано, что по достижению температуры тела крыс 30°С происходит незначительное повышение содержания МДА в гомогенатах печени крыс, которое при 3-часовом пролонгировании гипотермического состояния становится более существенным (Львова и др., 1993).
Результаты нашего исследования (табл. 1) проведенного на изолированных митохондриях печени частично противоречат этим данным (Львова и др., 1993), поскольку демонстрируют снижение содержания всех вторичных и третичных продуктов ПОЛ за 3 ч воздействия низкотемпературного фактора. Однако они хорошо согласуются с данными другой работы (Аль-Рабии и др., 2015а), в которой показано снижение интенсивности ПОЛ в эритроцитах крыс при 3-часовой гипотермии. Авторы связывают это снижение с обнаруженным повышением содержания глутатиона и активности ферментов антиоксидантной защиты эритроцитов (Аль-Рабии и др., 2015б).
Можно предположить, что снижение содержания гидроперекисей при пролонгировании гипотермии связано с активацией в митохондриях и клетках печени антиоксидантной системы на основе глутатиона и глутатионпероксидазы. Так было показано, что митохондриальная глутатионпероксидаза in vitro восстанавливает гидропероксид кардиолипина в гидроксикардиолипин и, таким образом, защищает митохондрии от оксислительного повреждения (Кулинский, Колесниченко, 2009). Поскольку концентрация гидроперекисей при пролонгировании гипотермии снижается, следовательно, будет уменьшаться и содержание конечных продуктов метаболизма гидроперекисей – МДА и ОШ. Кроме того, можно предположить, что в митохондриях активируется система по метаболизированию МДА. Известно, что МДА может деградировать с образованием уксусной кислоты (Halliwell, Gutteridge, 2015).
Накопление на начальных этапах гипотермии продуктов пероксидации в липидах мембран митохондрий может снизить активность ферментов дыхательной цепи и потенциал внутренней мембраны митохондрий (Панов, 2015). Показано, что снижение мембранного потенциала может активировать белки Bax. Эти белки через взаимодействие с пориновыми белками способны увеличивать проницаемость митохондриальной мембраны, что ведет к освобождению цитохрома с из мембраны. Это способствует активации каспазы 9 и связанного с ней апоптотичекого пути (Ghibelli, Diederich, 2010).
АФК могут стать одной из причин открытия так называемых митохондриальных мембранных пор (МРТР). Итогом активации пор является повышение интенсивности образования АФК и выход в цитоплазму ферментов антиоксидантной системы, что в значительной степени снижает процесс обезвреживания АФК и повышает их уровень (Panel et al., 2018).
Последние данные из литературы свидетельствуют о том, что ультраструктура митохондрий тоже тесно связана с генерацией АФК (Schrepfer, Scorrano, 2016). Оказалось, что для эффективной работы митохондрий в условиях стресса в клетках запускается один из эволюционно консервативных процессов – митохондриальное слияние (Escobar-Henriques, Anton, 2013). Оказалось, что повышенные уровни окисленного глутатиона способствуют дисульфид-опосредованной димеризации молекул митофузина – белка, способствующего связыванию органелл, что является начальной стадией процесса слияния митохондрий (Shutt et al., 2012). АФК и продукты ПОЛ, образующиеся в митохондриях при гипотермии, могут способствовать окислительной модификации отдельных аминокислотных остатков в белках и глубоким изменениями их структурной организации (Дубинина, 2006).
Результаты настоящего исследования (рис. 2) свидетельствуют о том, что на начальных этапах гипотермии в митохондриальных белках содержание SH-групп снижается, а карбонильных групп, напротив, повышается. При этом 3-часовая гипотермия способствует нормализации маркеров ОМБ. Подобная динамика изменения показателей ОМБ при гипотермии была обнаружена в работах, выполненных на эритроцитах крыс (Аль-Рабии и др., 2015а, 2015б).
Как известно, в белках серосодержащие аминокислотные остатки являются наиболее чувствительными к окислению. Было показано, что in vivo окисление тиоловых групп белков происходит в основном под действием относительно мягкого окислителя – Н2О2 (LoConte, Carroll, 2012). Расположенные на поверхности белковой молекулы SH-группы могут обезвреживать АФК, и, тем самым, представлять часть неферменативной антиоксидантной системы. Регенерации сульфгидрильных групп происходит спонтанно, при этом используется восстановленный глутатион. Способность тиольных групп обратимо изменять свое редокс-состояние с последующим изменением конформационных, каталитических или регуляторных функций белка является базовым механизмом тиол-опосредованного редокс-контроля клеточного метаболизма (Enns, Gowan, 2017).
В отличие от обратимого окисления SH-групп, реакции карбонилирования белков протекают гораздо сложнее и являются необратимыми. Поэтому клетка должна избавиться от карбонилированных белков, деградируя их протеосомными системами. Известно, что в условиях окислительного стресса и дефицита АТФ активируется убиквитин-независимая деградация модифицированных белков (Бунеева, Медведев, 2018). Обнаруженное нами (рис. 3) снижение концентрации карбонильных групп при 3-часовой гипотермии является, скорее всего, результатом такой деградации.
Согласно полученным нами данным (рис. 2, 3) содержание маркеров ОМБ в мембранных белках меньше, чем в белках матрикса митохондрий. Это может свидетельствовать о том, что интенсивность СРП в мембранах ниже, несмотря на то, что электронно-транспортная цепь внутренней мембраны митохондрий является основным источником АФК.
Маркерами окислительной модификации мембранных белков могут служить ароматические аминокислоты, содержание и положение которых в белках можно оценить по спектрам их собственной флуоресценции. Исследование собственной флуоресценции мембранных белков митохондрий показало (рис. 4), что при гипотермии интенсивность суммарной флуоресценции снижается, в основном за счет триптофановой флуоресценции. Снижение триптофановой флуоресценции может объясняться изменением конформации белков, вследствие чего хромофорные группы триптофановых остатков становятся более доступными для молекул воды с растворенными в ней тушителями (Lakowicz, 2000). С другой стороны, снижение триптофановой флуоресценции может быть обусловлено непосредственным окислением АФК триптофановых остатков, чувствительных к окислительному стрессу (Дубинина, 2006). Данные, полученные нами (рис. 4) при анализе ВПСФ белков, позволяют предположить, что гипотермия затрагивает триптофанилы, локализованные на периферии белков, тогда как триптофановые остатки в центре глобулы не меняют свою локализацию.
Анализ ВПСФ белков митохондрий выявил появление на начальных этапах гипотермии пиков, соответствующих тирозиновой флуоресценции. Известно, что спектры флуоресценции хромофоров тирозина по положению и форме практически не изменяются при значительных отклонениях свойств окружения. Поэтому изменения ВПСФ, скорее всего, обусловлены увеличением расстояния между остатками тирозина и триптофана, что снижает вероятность индуктивно-резонансного переноса энергии на триптофанилы и может свидетельствовать о конформационных перестройках белков в липидной матрице (Lakowicz, 2006). Причиной таких перестроек может являться не только собственно ОМБ, но дезорганизация митохондриальной мембраны в результате интенсификации процессов ПОЛ. Интересно то, что пролонгирование гипотермии до 3 ч способствует восстановлению интенсивности собственной флуоресценции до уровня контрольных значений, что обусловлено, скорее всего, деградацией и заменой модифицированных белков митохондриальных мембран.
Таким образом, полученные данные свидетельствуют о том, что при низких температурах тела в митохондриях печени крыс происходят существенные изменения содержания интермедиатов СРП, которые зависят от длительности гипотермического состояния. Под действием холодового стресса на начальных этапах гипотермии в митохондриях печени крыс происходит интенсификация СРП, что согласуется с данными из литературы (Эмирбеков, Кличханов, 2011; Alva et al., 2013; Аль-Рабии и др., 2015а). Причем наряду с интенсификацией процессов ПОЛ и ОМБ, наблюдаются и конформационные перестройки митохондриальных белков в липидном матриксе. Однако все эти изменения имеют обратимый характер и при продолжающемся в течение 3 ч гипотермическом состоянии наблюдается нормализация уровней маркеров окислительной деструкции липидов и белков. Можно предположить, что 3-часовое пролонгирование гипотермического состояния сопровождается развитием в клетке ряда компесаторно-приспособительных реакций, направленных на активацию компонентов антиокидантной системы митохондрий и последующее снижение интенсивности СРП. Центральная роль в этих реакциях, скорее всего, принадлежит системе глутатиона.
Известно, что глутатион в митохондриях составляет 10–15% от клеточного уровня, но при этом достигает такой же высокой концентрации, что и в клетке (5–10 мМ для печени крысы) (Кулинский, Колесниченко, 2009). Пополнение пула глутатиона возможно за счет восстановления его глутатионредуктазой в матриксе митохондрий или благодаря переносу в митохондрии цитозольного глутатиона с помощью белков-переносчиков. Оказалось, что транспорт глутатиона в митохондрии гепатоцитов зависит от жидкостности мембран (Кулинский, Колесниченко, 2009). Исходя из этого, можно предположить, что процессы ПОЛ снижают вязкость мембран, за счет чего скорость транспорта глутатиона увеличивается. Кроме того, повышается активность глутатионредуктазы и уровеня NADPH, необходимого для восстановления окисленного глутатиона.
За образование NADPH в цитозоле ответственен пентозофосфатный путь окисления углеводов, ключевым ферментом которого служит глюкозо-6-фосфатдегидрогеназа. Показано, что в эритроцитах активность этого фермента при кратковременном снижении температуры тела до 28°С существенно снижается (Dede et al., 2002). Сведений о каталитической эффективности глюкозо-6-фосфатдегидрогеназы в клетках животных при пролонгированной гипотермии в доступной нам литературе не обнаружено.
Следует отметить, что снижение интенсивности СРП в митохондриях при 3-часовой гипотермии может быть обусловлено не только активацией их антиоксидантной системы, но и возможной интенсификацией дыхания, обусловленной разобщением дыхания и фосфорилирования. Прежде всего, это разобщение направлено на поддержание постоянной температуры тела в условиях повышенного теплообмена. С другой стороны, в соответствии с гипотезой Скулачева с сотрудниками (2012) слабое разобщение приводит к уменьшению степени восстановленности коэнзима Q. Это, в свою очередь, снижает скорость генерации ${\text{O}}_{2}^{{\centerdot - }}$ дыхательной цепью (Скулачев и др., 2012), что особенно важно, учитывая интенсификацию СРП в тканях гомойтермных животных на начальных этапах гипотермии.
БЛАГОДАРНОСТИ
Работа выполнена на базе ЦКП “Аналитическая спектроскопия” Дагестанского государственного университета.
ФИНАНСИРОВАНИЕ
Работа выполнена при финансовой поддержке госзадания Минобрнауки РФ № 3.5982.2017/8.9.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все применимые международные, национальные и (или) институциональные принципы ухода и использования животных, нормы и правила выполнения экспериментальных работ с использованием лабораторных животных (Директива 2010/63/EU Совета Европейского Сообщества по защите животных, используемых в экспериментальных и других научных целях) были соблюдены.
Список литературы
Аль-Рабии М.А.М., Астаева М.Д., Кличханов Н.К. 2015а. Свободнорадикальные процессы в крови крыс при умеренной гипотермии разной длительности. Естественные науки. 50(1) : 35–42. (Al-Rabbi M.A.M., Astaeva M.D., Klichkhanov N.K. 2015a. Free radical processes in the blood of rats with moderate hypothermia of varying duration. Natural Sci. 50(1) : 35–42.)
Аль-Рабии М.А.М., Чалабов Ш.И., Астаева М.Д., Кличханов Н.К. 2015б. Осмотическая резистентность эритроцитов крыс и концентрация тиоловых групп белков их мембраны зависят от длительности умеренной гипотермии. Совр. пробл. науки и образ. 3: URL: www.science-education.ru/123–17364. (Al-Rabbi M.A.M., Chalabov S.I., Astaeva M.D., Klichkhanov N.K. 2015b. The osmotic resistance of erythrocytes in rats and the concentration of thiol groups of their membrane proteins depend on the duration of moderate hypothermia. Modern Probl. Scien. Eduс. 3: URL: www.science-education.ru/123-17364.)
Бунеева О.А., Медведев А.Е. 2018. Убиквитин-независимая деградация белков в протеасомах. Биомед. химия. 64(2) : 134–148. (Buneeva O.A., Medvedev A.E. 2018. Ubiquitin-independent protein degradation in proteasomes. Biomed. Chemistry. 64(2) : 134–148.)
Волчегарский И.А., Налимов А.Г., Яровинский Б.Г., Лившиц Р.И. 1998. Сопоставление различных подходов к определению продуктов ПОЛ в гептан-изопропаноловых экстрактах крови. Вопросы мед. химии. 35 : 127–181. (Volchegarsky I.A., Nalimov A.G., Yarovinsky B.G., Livshits R.I. 1998. Comparison of different approaches to the definition of LPO products in heptane-isopropanol blood extracts. Issues of medical chemistry. 35 : 127–181.)
Гривенникова В.Г., Виноградов А.Д. 2013. Генерация активных форм кислорода митохондриями. Успехи биол. химии. 53 : 245–296. (Grivennikova V.G., Vinogradov A.D. 2013. Mitochondrial production of reactive oxygen species. Biochemistry (Moscow). Вiol. Chem. Rev. 78 (13) : 1490–1511.)
Дубинина Е.Е. 2006. Продукты метаболизма кислорода в функциональной активности клеток. Жизнь и смерть, созидание и разрушение. СПб.: Мед. Пресс, 400 с. (Dubinina E.E. 2006. Oxygen metabolism products in the functional activity of cells. Life and death, creation and destruction. SPb.: Med. Press, 400 p.)
Кулинский В.И., Колесниченко Л.С. 2009. Система глутатиона: синтез, транспорт, глутатионтрансферазы, глутатионпероксидазы. Биомед. химия. 55(3) : 255–277. (Kulinsky V.I., Kolesnichenko L.S. 2009. Glutathione synthesis, transport, glutathione transferase, glutathione peroxidase. Biomed. Chem. 55(3) : 255–277.)
Кулинский В.И., Ольховский И.А. 1992. Две адаптационные стратегии в неблагоприятных условиях – резистентная и толерантная. Роль гормонов и рецепторов. Успехи совр. биол. 112(5–6) : 697–714. (Kulinsky V.I., Olkhovsky I.A. 1992. Two adaptation strategies in unfavorable conditions – resistant and tolerant. The role of hormones and receptors. Biol. Bull. Rev. 112(5–6) : 697–714).
Лысакова Т.И., Аксенцев С.Л., Левко А.В. 1997. Влияние факторов ишемического повреждения на перекисное окисление липидов в синаптосомах мозга крыс. Биофизика. 42(2) : 408–411. (Lysakova T.I., Aksentsev S.L., Levko A.V. 1997. Effects of ischemic damage factors on lipid peroxidation in rat brain synaptosomes. Biophysics. 42(2) : 408–411.)
Львова С.П., Горбунова Т.Ф., Абаева Е.М. 1993. Влияние гипотермии и даларгина на перекисное окисление липидов в тканях крыс. Вопр. мед. химии. 39(3) : 21–24. (L’vova S.P., Gorbunova T.F., Abaeva E.M. 1993. Effect of hypothermia and dalargin on lipid peroxidation in rat tissues. Issues Med. Chem. 39(3) : 21–24.)
Онищенко Е.Н., Дюбко Т.С., Семенченко А.Ю. 2004. Влияние низкомолекулярных криопротекторов и замораживания на флуоресцентные свойства микросомальных белков. В кн.: Актуальные проблемы медицины и биологии. Киев. 106–117. (Onishchenko E.N., Dyubko T.S., Semenchenko A.Yu. 2004. Effect of low-molecular cryoprotectants and freezing on the fluorescent properties of microsomal proteins. In: Actual problems of medicine and biology. Kiev : 106–117.)
Панов А.В. 2015. Практическая митохондриология. Новосибирск. 239 с. (Panov A.V. 2015. Practical mitochondriology. Novosibirsk. 239 p.)
Рыбальченко В.К., Коганов М.М. 1998. Структура и функции мембран. Киев: ВШ. 312 с. (Rybalchenko V.K., Koganov M.M. 1998. Membrane structure and functions. Kiev: VSh. 312 p.)
Скулачев В.П., Богачев А.В., Каспаринский Ф.О. 2012. Мембранная биоэнергетика. М.: МГУ. 368 c. (Skulachev V.P., Bogachev A.V., Kasparinsky F.O. 2012. Membrane Bioenergetics. M.: MSU. 368 с.)
Усенко Л.В., Царев А.В. 2009. Искусственная гипотермия в современной реаниматологии. Общая реаниматология. 5(1) : 21–23. (Usenko L.V., Tsarev A.V. 2009. Artificial hypothermia in modern reanimatology. Gener. Reanimatol. 5(1) : 21–23.)
Эмирбеков Э.З., Кличханов Н.К. 2011. Свободнорадикальные процессы и состояние мембран при гипотермии. Ростов-на-Дону: ЮФУ. 200 с. (Emirbekov Э.Z., Klichkhanov N.K. 2011. Free radical processes and the state of membranes during hypothermia. Rostov-on-Don: SFU. 200 p.)
Alva N., Carbonell T., Palomeque J. 2004. Model of deep experimental hypothermia and rewarming in rat. J. Thermal Biol. 29 : 259–264.
Alva N., Palomeque J., Teresa C. 2013. Oxidative stress and antioxidant activity in hypothermia and rewarming: can RONS modulate the beneficial effects of therapeutic hypothermia. Oxidative Med. Cel. Longevity. Article ID 957 054. 10 p. https://doi.org/10.1155/2013/957054
Brown D., Brugger H., Boyd J. 2012. Accidental hypothermia. New Engl. J. Med. 367 : 1930–1938.
Cantoni O., Guidarelli A., Fiorani M. 2017. Mitochondrial uptake and accumulation of vtamin C: What can we learn from cell cultures studies? Antiox. Redox Signal. 29. 41 p. https://doi.org/10.1089/ars.2017.7253
Dalle-Donne I., Ross R., Guistarini D., Milzani A., Colombo R. 2003. Protein carbonyl groups as biomarkers of oxidative stress. Clinica Chimica Acta. 329 : 23–38.
Dede S., Deger Y., Mera I. 2002. Effect of short-term hypothermia on lipid peroxidation and antioxidant enzyme activity in rats. J. Vet. Med. 49 : 286–288.
Enns G.M., Cowan T.M. 2017. Glutathione as a redox biomarker in mitochondrial disease-implications for therapy. J. Clin. Med. 6. https://doi.org/10.3390/jcm6050050
Escobar-Henriques M., Anton F. 2013. Mechanistic perspective of mitochondrial fusion: tubulation vs. fragmentation. Biochim. Biophys. Acta. 1833 : 162–175.
Figueira T.R., Barros M.H, Camargo A.A., Castilho R.F., Ferreira J.C., Kowaltowski A.J., Sluse F.E., Souza-Pinto N.C., Vercesi A.E. 2013. Mitochondria as a source of reactive oxygen and nitrogen species: from molecular mechanisms to human health. Antiox. Redox Signal. 18 : 2029–2074.
Gaschler M.M., Stockwell B.R. 2017. Lipid peroxidation in cell death. Biochem. Biophys. Res. Commun. 482 : 419–425.
Ghibelli L., Diederich M. 2010. Multistep and multitask Bax activation. Mitochondrion. 10 : 604–613.
Gusdon A.M., Fernandez-Bueno G.A., Wohlgemuth S., Fernandez J., Chen J., Mathews C.E. 2015. Respiration and substrate transport rates as well as reactive oxygen species production distinguish mitochondria from brain and liver. BMC Biochem. 17 p. https://doi.org/10.1186/s12858-015-0051-8
Habeeb A.F.S.A. 1972. Reaction of protein sulfhydryl groups with Ellman’s reagent. Meth. Enzymol. 34 : 457–464.
Halliwell B., Gutteridge M.C. 2015. Free radicals in biology and medicine. 5th edition. Oxford: Oxf. Univ. Press. 896 p.
Handy D.E., Loscalzo J. 2012. Redox regulation of mitochondrial function. Antiox. Redox Signal. 16 : 1323–1367.
Lakowicz J.R. 2000. On spectral relaxation in proteins. Photochem. Photobiol. 72 : 421–437.
LoConte M., Carroll K.S., Jakob U. 2012. The chemistry of thiol oxidation and detection. In: Oxidative stress and redox regulation. N.-Y.: Springer. 1–42.
Lowry D.H., Rosembrough H.J., Farr A.L. 1951. Protein measurement with the Folin-phenol reagent. J. Biol. Chem. 193 : 265–275.
Maroz A., Anderson R.F., Smith R.A., Murphy M.P. 2009. Reactivity of ubiquinone and ubiquinol with superoxide and the hydroperoxyl radical: implications for in vivo antioxidant activity. Free Rad. Biol. Med. 46 : 105–109.
Mihaljević B., Katušin-Ražem B., Ražem D. 1996. The reevaluation of the ferric thiocyanate assay for lipid hydroperoxides with special considerations of the mechanistic aspects of the response. Free Rad. Biol. Med. 21 : 53–63.
Pacher P., Beckman J.S., Liaudet L. 2007. Nitric oxide and peroxynitrite in health and disease. Physiol. Rev. 87 : 315–424.
Panel M., Ghaleh B., Morin D. 2018. Mitochondria and aging: A role for the mitochondrial transition pore? Aging Cell. 17(4). https://doi.org/10.1111/acel.12793
Polderman K.H. 2009. Mechanisms of action, physiological effects, and complications of hypothermia. Critical Care Med. 37 : 186–202.
Schenkel L.C., Bakovic M. 2014. Formation and regulation of mitochondrial membranes. Int. J. Cell Biol. Article ID 709 828. 13 p. https://doi.org/10.1155/2014/709828
Schrepfer E., Scorrano L. 2016. Mitofusins, from mitochondria to metabolism. Mol. Cell. 61 : 683–694.
Shutt T., Geoffrion M., Milne R., McBride H.M. 2012. The intracellular redox state is a core determinant of mitochondrial fusion. EMBO Rep. 13 : 909–915.
Sies H., Berndt C., Jones D.P. 2017. Oxidative stress. Annu. Rev. Biochem. 86 : 715–748.
Søreide K. 2014. Clinical and translational aspects of hypothermia in major trauma patients: from pathophysiology to prevention, prognosis and potential preservation. Injury. 45 : 647–654.
Sun Z., Honar H., Sessler D.I., Dalton J.E., Yang D., Panjasawatwong K., Deroee A.F., Salmasi V., Saager L., Kurz A. 2015. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiol. 122 : 276–285.
Venditti P., Rosa R.D., Meo S.D. 2004. Effect of cold-induced hyperthyriodism on H2O2 production and susceptibility of stress conditions of rat liver mitochondria. Free Rad. Biol. Med. 36 : 348–358.
Wong H.S., Dighe P.A., Mezera V., Monternier P.A., Brand M.D. 2017. Production of superoxide and hydrogen peroxide from specific mitochondrial sites under different bioenergetic conditions. J. Biol. Chem. 292 : 16804–16809.
Zinchuk V.V., Hlutkin S.V. 2015. Blood oxygen transport and prooxidant-antioxidant balance in rats under hypothermia and rewarming combined with modification of L-arginine-NO pathway. Asian J. Pharmacy Nurs. Med. Sci. 3 : 55–63.
Дополнительные материалы отсутствуют.


