Цитология, 2019, T. 61, № 7, стр. 521-528
Причины возникновения незаменимости треонина в свете эволюции
А. В. Малиновский *
С.-Петербургский Филиал “ЭПМ” ФМБА России – СКТБ Биофизприбор
197183 Санкт-Петербург, Россия
* E-mail: malinovskiy.andrey@yandex.ru
Поступила в редакцию 18.03.2019
После доработки 08.04.2019
Принята к публикации 08.04.2019
Аннотация
Как известно, аминокислота треонин не синтезируется у позвоночных при ее отсутствие в пище. Причем в процессе эволюции распад треонина меняется. Поскольку распад треонина под действием треониндегидратазы необратим, особое внимание в работе уделено треониндегидрогеназе, являющейся главным ферментом распада треонина у птиц, с целью установления ее невозможности синтезировать треонин путем обращения реакции его распада. Обнаружена причина, по которой треониндегидрогеназа в тканях позвоночных не может использоваться для биосинтеза треонина. Сделан вывод об участии некоторого количества треонина в переаминировании.
Хорошо известно, что белки необходимы для питания человека и животных. Биологическая ценность белка определяется его аминокислотным составом. Одни аминокислоты – незаменимые – не синтезируются в организме при их отсутствие в пище, тогда как другие – заменимые – в аналогичном случае могут синтезироваться в организме. Девять аминокислот (лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин, изолейцин, гистидин) необходимы для всех исследованных видов позвоночных.
Значительный интерес представляет следующий факт. Отмечено (Elliott, Neuberger, 1950), что после того, как крысам и кроликам добавляли в пищу глицин, меченный N15, треонин не содержал этот изотопный маркер (в отличие от других аминокислот, кроме лизина). Отсюда можно сделать вывод, что треонин, подобно лизину, не принимает участие в переносе аминогруппы, который наблюдается у других аминокислот, как заменимых, так и незаменимых. При этом птицы, млекопитающие и человек отличаются друг от друга распадом треонина, но незаменимость последнего имеет место и для птиц, и для млекопитающих, и для человека. Следовательно, треонин не должен синтезироваться из глицина. Но другие авторы (Meltzer, Sprinson, 1952) после кормления крыс лейцином, меченным N15, нашли очень небольшое количество метки в треонине. Тот факт, что некоторое количество азота лейцина было обнаружено в молекуле треонина, указывает на наличие в организме животных незначительного синтеза треонина. Необходимо сразу исключить метаболический путь биосинтеза треонина, катализируемый ферментом треонинсинтетазой, конечный этап которого заключается в превращении О-фосфогомосерина в треонин и неорганический фосфат. Этот фермент широко распространен у бактерий, грибов и растений, но отсутствует у животных (Gardino-Franko et al., 2002; Donini et al., 2006).
В настоящей работе показана невозможность синтеза углеродного скелета треонина у позвоночных независимо от преобладания того или иного пути его распада, а также участие треонина в переаминировании.
РАСПАД ТРЕОНИНА У ПОЗВОНОЧНЫХ
Схема превращения треонина в печени согласно Дэгли и Никольсону (1973) выглядит следующим образом (схема 1):
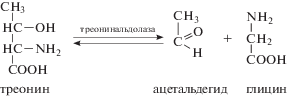
Схема 1. Взаимопревращение треонина и глицина.
В работе Березова и Коровкина (2004) также указывается на то, что под действием треонинальдолазы треонин обратимо расщепляется на ацетальдегид и глицин. Но если многие справочники и учебники по биохимии придают большое значение как треонинальдолазе (Neuberger, 1981), так и альдольному расщеплению (Devlin, 1982; Leninger, 1975) в катаболизме этой аминокислоты, то другие авторы (Bird, Nunn, 1979) усомнились в этом и первыми показали, что активность треонинальдолазы однородно низка в печени крысы и сделали заключение, что альдолаза, хотя и присутствует в печени, не может быть главным ферментом распада треонина (Bird, Nunn, 1979, 1983).
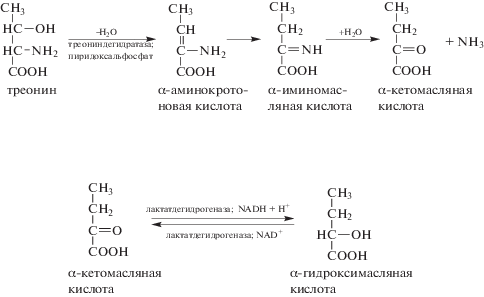
Те же авторы (Bird, Nunn, 1979) пришли к выводу, что предполагаемая активность треонинальдолазы на самом деле есть результат действия треониндегидратазы и лактатдегидрогеназы, причем первая расщепляет треонин необратимо (схема 2):
Схема 2. Необратимый распад треонина с дальнейшим восстановлением α-кетомасляной кислоты.
Наиболее убедительное доказательство против присутствия реальной треонинальдолазы в печени крысы – исчезновение активности треонинальдолазы в цитозольных экстрактах печени нормальных и голодающих крыс, когда треониндегидратаза была устранена иммуноосаждением специфическим антителом. Устранение дегидратазы не воздействует на активность аллотреонинальдолазы (см. ниже).
Результаты этого исследования ясно показывают, что треониндегидратаза и лактатдегидрогеназа ответственны за кажущуюся ферментную активность треонинальдолазы. Таким образом, треонинальдолаза – не подлинный фермент печени млекопитающих, а, следовательно, человека. Дальнейшие исследования подтвердили существование фермента, метаболизирующего аллотреонин (изомер треонина, не входящий в состав белков), возможно, его альдолазы или серингидроксиметилтрансферазы, которые не действуют на треонин (Yeung, 1986). Другим автором (Pagani, 1991) также подтверждается действие альдолазы именно на аллотреонин, но не на треонин. А в другой работе (Darling et al., 2000) среди путей катаболизма треонина у взрослых людей распад под действием треонинальдолазы и вовсе не упоминается. В то же время нет никаких доказательств, что аллотреонин поддерживает рост млекопитающих (West, Carter, 1938) или встречается как природное веществo (Karasek, Greenberg, 1957), а также, что в печени млекопитающих имеется треонинэпимераза (Malkin, Greenberg, 1964).
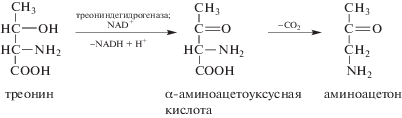
Если в печени млекопитающих главными ферментaми распада треонина, содержащимися в цитозоле, до недавнего времени признавались треониндегидратаза и треонинальдолаза, то в митохондриях таковой признавалась треониндегидрогеназа (Yeung, 1986). Последняя катализирует NAD-зависимое окисление треонина до α-аминоацетоуксусной кислоты, которая самопроизвольно декарбоксилируется, превращаясь в аминоацетон (Neuberger, 1981; Pagani et al., 1990, 1992) (схема 3):
Схема 3. Окисление треонина в митохондриях.
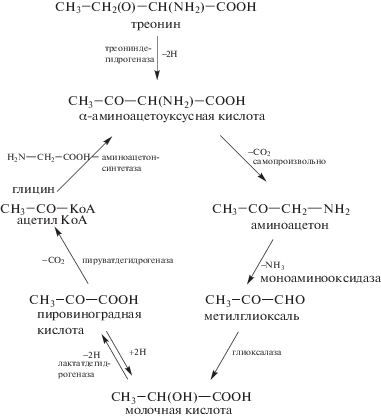
Аминоацетон в дальнейшем окисляется в аминоацетоновом цикле (Green, Elliott, 1964):
Схема 4. Окисление треонина в аминоацетоновом цикле.
ПРИЧИНЫ НЕЗАМЕНИМОСТИ ТРЕОНИНА В СРАВНИТЕЛЬНОМ АСПЕКТЕ
Процессы распада треонина меняются в процессе эволюции позвоночных: если у птиц треонин распадается, главным образом, под действием треониндегидрогеназы, то у человека он распадается только под действием треониндегидратазы. Следовательно, причины незаменимости треонина будут разные. Хотя человек является последним звеном в ходе эволюции позвоночных, мы начнем свое повествование с человека, так как у последнего распад треонина достаточно однозначен и вопросов не вызывает.
Причины незаменимости треонина у человека. Если у младенцев 44% процесса окисления треонина осуществляется под влиянием треониндегидрогеназы, то у взрослых людей этот путь насчитывает только 10% от общего окисления треонина (Darling et al., 2000) . Эту разницу из-за возраста авторы (Darling et al., 2000) связывают с более высокой метаболической потребностью в глицине у младенцев по сравнению со взрослыми людьми.
На основе сравнения генов треониндегидрогеназы человека и ряда животных и делается вывод, что человек в процессе эволюции утратил способность к синтезу треониндегидрогеназы (Edgar, 2002). Следовательно, необратимый распад треонина под действием треониндегидратазы – единственный путь катаболизма треонина у человека, что согласуется с известным фактом, что треонин для человека – незаменимая глюкогенная аминокислота и что α-кетомасляная кислота – предшественник глюкозы.
Причины незаменимости треонина у млекопитающих. Отмечается, что у млекопитающих имеется два пути катаболизма треонина: он может расщепляться треониндегидратазой в цитозоле до ${\text{NH}}_{4}^{ + }$ и α-кетомасляной кислоты, которая быстро и необратимо распадается до СО2, а также он может метаболизироваться треониндегидрогеназой в митохондриях до α-аминоацетоуксусной кислоты, которая затем обратимо расщепляется аминоацетонсинтетазой до глицина и ацетил-КоА (Chapman, 2011).
В литературе существуют противоречивые сообщения о преобладании путей распада треонина. В одних источниках показано, что путь треониндегидрогеназы составляет 80% у растущих поросят (Ballevre et al., 1990; le Floc’h et al., 1994) и крыс (Bird, Nunn, 1983; Moundras et al., 1992),что делает его главным путем распада. Однако показано, что у 25–30-килограммовых свиней путь треониндегидрогеназы является лишь незначительным компонентом полной утилизации треонина во внутренних тканях (le Floc’h et al., 1994). Показано также, что 65% окисления треонина осуществляется глициннезависимым треониндегидратазным путем в гепатоцитах крысы – распадом под действием треониндегидратазы (Moundras et al., 1992).
Продемонстрировано, что у трипаносомы – простейшего организма, вызывающего у человека сонную болезнь, имеется очень активная треониндегидрогеназа, расщепляющая в комплексе с аминоацетонсинтетазой треонин на глицин и ацетил-КоА, причем последний активно используется для синтеза липидов (Linstead et al., 1977). Аналогичное наблюдение сделано позже другими авторами (Steven et al., 2012), которые показали, что стволовые клетки мыши содержат очень активную треониндегидрогеназу, осуществляющую также в комплексе с аминоацетонсинтетазой нетипичную для млекопитающих форму катаболизма треонина и расщепляют его на глицин и ацетил-КоА, причем глицин тут же включается в биосинтез пуриновых оснований, а ацетил-КоА используется как энергетический субстрат для цикла Кребса. Этот вопрос обсуждается в ряде дальнейших исследований (Chuanchin et al., 2013; Winkle et al., 2014; Shyh-Chang et al., 2013). В процессе дифференцировки клеток мыши активность треониндегидрогеназы резко уменьшается.
Авторы, которые изучали взаимодействие треониндегидрогеназы и аминоацетонсинтетазы с образованием треонинрасщепляющего комплекса, выделенного из печени свиньи (Tressel et al., 1986), считают, что реакция, катализируемая последним, обратима in vitro, но in vivo, вероятно, треонинрасщепляющий комплекс вызывает только катаболизм L-треонина до глицина. Получен треонинрасщепляющий комплекс из очищенной аминоацетонсинтетазы печени быка и треониндегидрогеназы печени свиньи, вызывающий взаимопревращения треонина и глицина (Fubara et al., 1986). Но в этой же работе показано отсутствие этого комплекса в печени коровы: аминоацетонсинтетаза печени коровы катализирует образование аминоацетона из глицина и ацетил-КоА. Из этого этого был сделан вывод, объясняюший почему млекопитающие неспособны синтезировать треонин, хотя имеют как аминоацетонсинтетазу, так и треониндегидрогеназу (Bender., 2012). Однако это не объясняет необратимость действия последней.
Отмечено (Pagani et al., 1990), что оптимум рН для треониндегидрогеназы 7.8, т.е. близок к физиологическим условиям. Измерение степени декарбоксилирования α-аминоацетоуксусной кислоты при различных рН показало, что максимальный период полужизни пула этой кислоты в водном растворе составляет 8 мин при рН 0.1 и уменьшается с возрастанием рН, составляя меньше 1 мин при рН 7 (Laver et al., 1959). Следовательно, такое несовпадение оптимумов рН сильно затрудняет действие на α-аминоацетоуксусную кислоту треониндегидрогеназы для восстановления в треонин даже в отсутствие ингибиторов последней.
Однако показано, что треониндегидрогеназа ингибируется некоторыми жирными кислотами и их производными: жирными кислотами с короткой углеродной цепью; L- и D-β-гидроксимасляной кислотой, жирными кислотами с длинной углеродной цепью (лауриновой, миристиновой, пальмитиновой и стеариновой), дикарбоновыми кислотами (малоновой и ее производные: метил- и гидроксималоновой кислотами) (Guerranti et al., 2001). Ингибирование имеет место при низких и физиологических концентрациях таких соединений, которые в норме присутствуют и метаболизируются в митохондриях. В частности, митохондрии из 1 г печени крысы содержат 66 ± 8 нмоль L-треонина и 400 нмоль D-β-гидроксимасляной кислоты (при молекулярном соотношении субстрата к ингибитору 1 : 6). В инкубационной смеси отношение субстрата и ингибитора 166 : 1 являлось достаточным, чтобы добиться сильного ингибирования ферментной активности (>50%). И поэтому разумно принимать без доказательств, что действие ингибитора in vivo может быть большим, чем in vitro и достигать даже полной блокировки ферментной активности. Также (Guerranti et al., 2001) отмечают, что ингибирование треониндегидрогеназы жирными кислотами и их производными способствует направлению всего имеющегося в распоряжении треонина в глюконеогенез через необратимое дезаминирование треониндегидратазой. Это согласуется с известным фактом, что треонин – незаменимая глюкогенная аминокислота и что α-кетомаслянная кислота – предшественник глюкозы.
Известно, что организм животных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот) незаменимых аминокислот. Следовательно, все это относится и к треонину у млекопитающих (незаменимость треонина для более низкоорганизованных животных нуждается в отдельном исследовании, что выходит за рамки настоящей работы). В то же время почти все природные аминокислоты сначала реагируют с α-кетоглутаровой кислотой в реакции переаминирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глутаматдегидрогеназы. Поскольку обе реакции (переаминирование и дезаминирование глутаминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты.
Млекопитающим, больным уремией и находящимся на низкобелковой диете, скармливали α-кетокислоты – производные незаменимых аминокислот (Barret, 1985) . Последние синтезировались в организме путем переаминирования с глутаминовой кислотой. Оказалось, что в качестве незаменимых аминокислот необходимо давать только лизин, для которого отсутствует трансаминаза. В то же время степень использования α-кетокислот для синтеза соответствующих аминокислот различается. Валин, лейцин, изолейцин, метионин и фенилаланин быстро синтезировались путем переаминирования, в то время как гистидин, треонин и триптофан синтезировались в меньшей степени, а синтеза лизина вообще не наблюдали. В свете этого легко объясняется указанный выше следующий факт. Когда кроликов и крыс снабжали рационом с избытком N15 в глицине, треонин этого избытка не содержал: в организме млекопитающих треонин из глицина образовываться не может, а переаминированию подвергается лишь очень незначительная часть глицина. В то же время, обнаружение в треонине N15, введенного в организм крысы с лейцином, есть результат переаминирования, которому активно подвергается лейцин и слабо подвергается треонин (Barret, 1985). По последним данным из всех природных аминокислот только лизин не способен подвергаться переаминированию (https://www.doctorabel.us/vitamins/transamination-of-amino-acids-aminotransferase-reactions.html).
Причины незаменимости треонина у птиц. Согласно давней работе (Aoyama, Motokava, 1981) главный фермент, расщепляющий треонин в печени птиц – треониндегидрогеназа. В качестве экспериментальных птиц были выбраны цыплята. Авторы (Aoyama, Motokava, 1981) рассматривают вопрос обратимости реакции, катализируемой треониндегидрогеназой. Для этого последняя была инкубирована с аминоацетонсинтетазой в реакционной смеси, содержащей [2-14C] глицин и NADH, при этом значительные количества радиоактивности были обнаружены в треонине. Реакция зависела от присутствия NADH и треониндегидрогеназы. Результаты показывают, что α-аминоацетоуксусная кислота, которая является общим продуктом действия треониндегидрогеназы и аминоацетонсинтетазы, служит субстратом для треониндегидрогеназы и что реакция, катализируемая последней, обратима in vitro.
Однако вышеупомянутые авторы (Tressel et al., 1986), хотя и выделили данный ферментный комлекс из печени свиньи, а не птицы, предполагают, что in vivo треониндегидрогеназа способна только окислять треонин. Выше уже отмечалось, что несовпадение оптимумов pH сильно затрудняет действие треониндегидрогеназы на α-аминоацетоуксусную кислоту. Что же касается аминоацетонсинтетазы, то ряд авторов считает возможным ее действие на α-аминоацетоуксусную кислоту с образованием глицина и ацетил-КоА. Так, ряде работ говорится о том, что аминоацетонсинтетаза, вероятно, образует растворимый комплекс с треониндегидрогеназой в митохондриях цыплят, который катализирует превращение α-аминоацетоуксусной кислоты в глицин и ацетил-КоА (Baker et al., 1973; Davis, Austic, 1994, 1997). Авторы (Baker et al., 1973) также считают треонин важным источником глицина у глицин- и сериндефицитных цыплят. Однако, в других работах отрицается, что пищевой треонин может использоваться у цыпленка, как предшественник глицина (D’Mello, 1973; Davis, Austic,1982; Lee et al., 2014).
Основываясь на образовании глицина из α-аминоацетоуксусной кислоты in vitro, авторы (Davis, Austic, 1994, 1997) предполагают, что в физиологических условиях наличие КоА определяет, во что будет превращаться α-аминоацетоуксусная кислота – в глицин или аминоацетон: когда КоА есть в митохондриях, образование глицина преобладает над образованием аминоацетона. В одной из этих работ (Davis, Austic, 1994) отмечается, что накопление глицина было в 3–4 раза больше накопления аминоацетона в митохондриях печени цыплят, питающихся на обычной диете. Авторы это объясняют превращением треонина в глицин. Но еще ранее другие авторы (Urata, Granick, 1962) указывают на игибирующее действие КоА на образование аминоацетона из ацетил-КоА и глицина путем образования тиазинового кольца с пиридоксальфосфатной группой аминоацетонсинтетазы. Следовательно, резкое увеличение концентрации глицина при добавлении КоА происходило не из-за усиления превращения треонина в глицин, а из-за падения включения последнего в аминоацетон.
В то же время отмечается, что когда активность треониндегидрогеназы печени повышалась вследствие добавления в пищу цыплят смеси незаменимых аминокислот без треонина, глицина образовывалось в 6–12 раз больше, чем аминоацетона (Davis, Austic, 1994, 1997). Авторы этой работы связывают возрастание образования глицина с возросшей активностью треониндегидрогеназы: глицин образуется из треонина. В то же время замечено, что когда цыплят снабжали диетой с избытком треонина, концентрация треонина в плазме крови возрастала, концентрация глицина оставалась постоянной, а концентрация серина (может обратимо превращаться в глицин) даже падала (Watanabe et al., 1998). Но у цыплят, получавших пищу с добавлением смеси незаменимых аминокислот без треонина, концентрации глицина и серина в плазме крови снижалась, несмотря на более высокую активность треониндегидрогеназы печени (Davis, Austic, 2000). Из этого делают вывод, что треониндегидрогеназа не превращает треонин в глицин. Избыток азота, который образуется при добавлении к диете смеси незаменимых аминокислот, приводит к возрастанию синтеза мочевой кислоты в качестве продукта обезвреживания аммиака. Возрастание этого синтеза, использующего глицин, приводит к уменьшению в плазме крови концентраций глицина и серина, который может превращаться в глицин.
Все вышеуказанное позволяет предполагать, что крайняя неустойчивость α-аминоацетоуксусной кислоты способствует ее самопроизвольному декарбоксилированию в аминоацетон до того, как на нее начнет действовать какой-либо фермент. То есть в организме цыплят (равно как и других позвоночных) синтез треонина из глицина невозможен, что согласуется с известным фактом, что треонин – незаменимая аминокислота.
ЗАКЛЮЧЕНИЕ
1) Треонинальдолаза, обратимо расщепляя аллотреонин на глицин и ацетальдегид, на треонин не действует. Аллотреонин в состав белков не входит и в треонин превращаться не может. Следовательно, треонин не может синтезироваться из глицина и ацетальдегида.
2) Треониндегидрогеназа, отсутствующая у человека, но являющаяся у птиц главным ферментом распада треонина, не может быть использована для его синтеза. Несмотря на обратимое действие треониндегидрогеназы in vitro, крайняя неустойчивость in vivo исходного соединения – α-аминоацетоуксусной кислоты – исключает действие на него какого-либо фермента.
3) Обнаружение N15 в треонине после введения в организм N15-лейцина говорит об участии треонина в переаминировании. При этом кетопроизводное треонина – α-кето-β-оксимасляная кислота – также не может синтезироваться в организме позвоночных и образуется из самого треонина.
Список литературы
Березов Т.Т., Коровкин Б.Ф. 2004. Биологическая химия. М.: Медицина. 703 с. (Berezov T.T., Korovkin B.F. 2004.Biochemistry.M: Medicine. 703 p.)
Дэгли С., Никольсон Д. 1973. Метаболические пути. М.: Мир. 310 c. (Djegli S., Nikol҆҆҆҆son D. 1970. An introduction to metabolic pathways. Oxford: Blackwell Science Ltd. 352 p.)
Aoyama Y., Motokava Y. 1981. L-threonine dehydrogenase of chicken liver. J. Biol. Chem. 256 : 12367–12373.
Baker D.H., Hill T.M., Kleiss A.J. 1973. Nutritional evidense concerning formation of glycine from threonine in the chick. J. Anim. Sci. 34 : 582–586.
Ballevre O., Cadenhead A., Calder A.G., Ress W.D., Lobley G.E., Fuller M.F., Garlick P.J. 1990.Quantitative partition of threonine oxidation in pigs: effect of dietary threonine. Am. J. Physiol. 259 (4 PT 1) : E483-E491.
Barret G. 1985. Chemistry and biochemistry of the amino acids. London: Chapman & Hall. 684 p.
Bender D.A. 2012. Amino Acid Metabolism. Hoboken, N. Jersey: Wiley-Blackwell. 478 p. https://doi.org/10.1002/9781118357514.ch4
Bird M.I., Nunn P.B. 1979. Measurement of L-threonin aldolase activity in rat liver. Biochem. Soc. Trans. 7 : 1 274–1276.
Bird M.I., Nunn P.B. 1983. Metabolic homeostasis of L-threonine in the normally-fed rat. Biochem. J. 214 : 687–693.
Chapman K. 2011. The impact of the splanchic bed on the dietary requirements of threonine and lysine in humans. University of Toronto. 154 p.
Chuanchin H., Hao G., Jiaxu W., Weiguang L., Yide M., Mian W. 2013. Regulation of L-threonine dehydrogenase in somatic cell reprogramming. Stem. Cells. 31 : 953–965.
D’Mello J.P.F. 1973. Aspects of threonine and glycine metabolism in the chick (Gallus domesticus). J. Nutr. 15 : 357–363.
Darling P.B., Grunov J., Rafii M., Brookes S., Ball R.O., Pencharz P.B. 2000.Threonine dehydrogenase is a minor degratative pathway of threonine catabolism in adult humans. Am. J. Physiol. Endocrinol. Metab. 278 : 877–884.
Davis A.J., Austic R.E. 1982.Threonine-degrading enzymes in the chicken. Poult. Sci. 61 : 2107–2111.
Davis A.J., Austic R.E. 1994. Dietary threonine imbalance alters threonine dehydratase activity in isolated hepatic mitochondria of chicks and rats. J. Nutrition. 124 : 1667–1677.
Davis A.J., Austic R.E. 1997. Dietary protein and amino acid levels alter threonine dehydrogenase activity in hepatic mitochondria of Gallus domesticus. J. Nutr. 127 : 738–744.
Davis A.J., Austic R.E. 2000. Temporal response of hepatic threonine dehydrogenase in chickens to the initial consumption of a threonine-imbalanced diet. J. Nutr. 130 : 2746–2752.
Devlin T.M. 1982.Textbook of Biochemistry. New York: John Wiley and Sons. 1240 p.
Donini S., Percudani R., Credali A., Montanini B., Sartori A., Peracchi A. 2006. A threonine syntase homolog from a mammalion genome. Biochem. Biophys. Res. Commun. 350 : 922–928.
Edgar A.J. 2002. The human L-threonine-3-dehydrogenase gene is an expressed pseudogene. BMC Genetics. 3 : 18. https://doi.org/10.1186/1471-2156-3-18
Elliott D.F., Neuberger A. 1950. The irreversibility of the deamination of threonine in the rabbit and rat. Biochem. 46 : 207–210.
Fubara B., Eckenrode F., Tresse T., Davis L. 1986. Purification and propertis of aminoacetone synthetase from beef liver mitochondria. J. Biol. Chem. 261 : 12 189–12 196.
Gardino-Franko M., Ehlert S., Messerschmidt A., Marinkovic S., Huber R., Laber B., Bourenkov G., Clausen. 2002. Structure and function of threonine synthase from yeast. J. Biol. Chem. 277 : 12396–12405.
Green M.L., Elliott W.H. 1964. The enzymic formation of aminoacetone from threonine and its further metabolism. Biochem. J. 92 : 537–549.
Guerranti R., Pagani R., Neri S., Errico S.V., Leoncini R., Marinello E. 2001. Inhibition and regulation of rat liver L-threonine dehydrogenase by different fatty acids and their derivates. Biochem. Biophys. Acta. 1568 : 45–52.
Karasek M.A., Greenberg D.M. 1957. Studies on the properties of threonine aldolases. J. Biol. Chem. 227 : 191–205.
Laver W.G., Neuberger A., Scott J.J. 1959. α-Amino-β-keto-acids II. Rates of decarboxylation of the free acids and the behaviorer of derivates on titration. J. Chem. Soc. 1483–1491.
Le Floc’h N., Seve B., Henry Y. 1994. The addition of glutamic acid or protein to a threonine-deficient diet differentially affects growth performance and threonine dehydrogenase activity in fattening pigs. J. Nutr. 124 : 1087–1095.
Lee C.W., Cho L.J., Lee Y.J., Son Y.S., Kwak I., Ahn Y.T., Kim S.C., An W.G. 2014. Effects of dietary levels of glycine,threonine and protein on threonine effiency and threonine dehydrogenase activity in hepatic mitochondria of chicks. Asian-Australasian J. Animal Sci. 27 : 69–76.
Leninger A.L. 1975. Biochemistrey. New York : Worth Publishers. 957 p.
Linstead D.J., Klein R.A., Cross G.A.M. 1977. Threonine catabolism in Trypanosoma brucei. J. Gen. Microbiol. 101 : 243–251.
Malkin L.I., Greenberg D.M. 1964. Purification and properties of threonine or allothreonine aldolases. Biochem. Biophys. Acta. 85 : 117–131.
Meltzer H.L., Sprinson D.B. 1952. The synthesis of 4-C14, N15-L-threonine and a study of its metabolism. J. Biol. Chem. 197 : 461–473.
Moundras C., Bercovici D., Remesy C., Demigne C. 1992. Influence of glucogenic amino acids on the hepatic metabolism of threonine. Biochem. Biophys. Acta 1115 : 212–219.
Neuberger A. 1981. Glycine formation from L-threonine. Comp. Biochem. 19A : 257–303.
Pagani R. 1991. DL-allothreonine and L-threonine aldolase in rat liver. Biochem. Soc. Trans. 19 : 346S. https://doi.org/10.1042/bst019346s
Pagani R., Guerranti R., Leoncini R., Marinello E. 1990. Activation and inhibition of rat liver L-threonine dehydrogenase. Ital. J. Biochem. 39 : 106–114.
Pagani R., Guerranti R., Righi S., Leoncini R., Vannoni D., Marinello E. 1992. Rat liver L-threonine dehydrogenase. Biochem. Soc. Trans. 20 : 24S. https://doi.org/10.1042/bst020024s
Shyh-Chang N., Locasale J.W., Lissiotes C.A., Zheng Y., Teo R.Y., Ratanasirintrawoot S., Zhang J., Onder T., Unternaehrer J.J., Zhu H., Asara J.M., Daley G.Q., Cantley L.C. 2013. Influence of threonine metabolism on S-adenosylmethionine and histone methylation. Science. 339 : 222–226.
Steven L., MeKnight D., Jlan Wang. 2012. Stem cells modified to facilitate threonine catabolism. Patent № US8, 288,158 B2. Oct. 16, 2012.
Tressel J., Thompson R., Zieske L.R., Menendez J.S., Davis L. 1986. Interaction between L-threonine dehydrogenase and aminoacetone synthetase and mechanism of aminoacetone production. J. Biol. Chem. 261 : 16428–16437.
Urata G., Granick S. 1962. Byosinthesis of α-aminoketone and the metabolism of aminoacetone. J. Biol. Chem. 238 : 811–820.
Watanabe R., Fujimura S., Kadowaki M., Ishibashi T. 1998. Effects of dietary threonine levels on the threonine-degrading enzyme activities and tissue threonine related amino acid concentration in rats. Anim. Sci. Technol. (Jpn.). 69 : 108–116.
West H.D., Carter H.E. 1938. Synthesis of α-amino-β-hydroxyl-n-butyric acids. J. Biol. Chem. 122 : 611–617.
Winkle L.J.V., Gallat V., Iannaccone P.M. 2014. Threonine appears to be essential for proliferation of human as well as mouse embryonic stem cells. Front. Cell Devel. Biol. 2 : 18. https://doi.org/10.3389/fcell.2014.00018
Yeung Y.G. 1986. Threonine aldolase is not a genuine enzyme in rat liver. Biochem. J. 237: 187–190.
Дополнительные материалы отсутствуют.