Цитология, 2019, T. 61, № 7, стр. 556-563
Клеточные основы биорезорбции пористой 3D-матрицы на основе хитозана
П. В. Попрядухин 1, 3, *, Г. Ю. Юкина 2, И. П. Добровольская 1, 3, Е. М. Иванькова 1, 3, В. Е. Юдин 1, 3
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова
197376 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: pavelpnru@gmail.com
Поступила в редакцию 11.04.2019
После доработки 20.04.2019
Принята к публикации 22.04.2019
Аннотация
Методом лиофилизации раствора хитозана получены высокопористые 3-мерные (3D) матрицы цилиндрической формы диаметром 1.3 мм. Через 12 мес. после имплантации крысам в мышечную ткань произошла полная резорбция матрицы. На сроках 1, 2, 6, 12, 24, 36 и 48 нед. in vivo гистологическим и иммуногистохимическим методами рассмотрены клеточные механизмы биорезорбции матрицы. Показана ведущая роль клеток CD68+, в основном гигантских многоядерных клеток инородных тел. При этом хроническое асептическое воспаление не сопровождается активацией тучных клеток, что указывает на биоинертность материала матрицы и позволяет рекомендовать разработанные матрицы для применения в регенеративной медицине, тканевой инженерии и клеточной трансплантологии.
Регенеративная медицина, тканевая инженерия и клеточная трансплантология на современном этапе развития нуждаются в материалах, выполняющих роль каркасов, носителей клеточных культур и биологически активных веществ, для дальнейшей их имплантации в живой организм с целью регенерации поврежденных органов и тканей и для восстановления утраченных ими функций. Существует ряд требований к применяемым материалам и изделиям на их основе, а именно: 1) биосовместимость; 2) нетоксичность; 3) необходимый уровень механических свойств для возможности манипуляции с этими материалами в биологических жидких средах; 4) способность материалов к биорезорбции, причём продукты их разложения не должны оказывать раздражающего или токсического действия на организм (Dornish et al., 2001; Gunatillake, Adhikari, 2003; Salgado et al., 2004; Reis et al., 2008).
В настоящее время наиболее перспективными и широко используемыми являются материалы из биосовместимых и биорезорбируемых полимеров, как природного происхождения (хитозан, альгинат, коллаген, желатин, полигидроксиалканоаты), так и синтетические (полилактид, полигликолид и их сополимеры) (Dornish et al., 2001; Kohane, Langer, 2008; Armentano et al., 2010; Dhandayuthapani et al., 2011). На основе этих полимеров получают разнообразные пленочные, блочные, пористые, микро- и нано-волоконные матрицы, которые используют для создания биоинженерных препаратов, предварительно заселяя их стволовыми или соматическими клетками, а также пропитывая бактерицидными и биологически активными веществами (Sachlos, Czernuszka, 2003; Ma et al., 2005; Jafari et al., 2015). Механизм и скорость биорезорбции матриц, а, следовательно, и биоинженерных препаратов на их основе зависят от вида и молекулярной массы полимера, из которого они изготовлены, размеров, геометрической формы, пористости материала, а также от локализации этих матриц в организме реципиента (Causa et al., 2007; Bing et al., 2010; Gleadall et al., 2014; Khan et al., 2015).
В частности, широкое распространение получили трехмерные пористые матрицы, которые являются прообразами костной ткани и тканей различных паренхиматозных органов, печени, легкого, почек и др. Подобные матрицы характеризуются высокими значениями пористости и удельной поверхности. После имплантации реципиенту полученного на их основе тканеинженерного препарата протекают одновременно два основных процесса: 1) миграция клеток в объем матрицы, их пролиферация и дифференцировка; 2) биорезорбция полимерной основы. Имплантируемые в живой организм матрицы приобретают функциональное значение, приближенное к нативному тканезамещению, лишь при определенном соотношении скоростей протекания этих двух процессов, которые зависят от множества факторов (Whu et al., 2013).
Одним из наиболее перспективных полимеров для получения пористых трехмерные матриц является хитозан, макромолекулы которого состоят из связанных в случайном порядке β-D-глюкозаминовых и N-ацетил-β-D-глюкозаминовых звеньев. Хитозан обладает способностью к биорезорбции, антибактериальной, антивирусной и фунгицидной активностью (Chirkov, 2002; Dai et al., 2011). Расщепление хитозана в живом организме происходит до исходных мономеров (Eide et al., 2012), являющихся естественными компонентами межклеточного матрикса, синовиальной жидкости и хрящевой ткани. В настоящее время этот полимер активно внедряется в медицинскую практику в составе гемостатических, ранозаживляющих и бактериостатических препаратов (Cheung et al., 2015; Periayah et al., 2016). Из хитозана получают пленочные, губчатые, гелеподобные, волоконные и нановолоконные изделия, а также наносферы для адресной доставки лекарственных средств (Buchanan, 2008; Levengood, Zhang, 2015; Rodríguez-Vázquez et al., 2015).
Цель настоящей работы заключалась в исследовании клеточных механизмов биорезорбции пористой хитозановой матрицы в мышечной ткани крысы на протяжении всего срока биорезорбции, а также изучение реакции окружающих тканей на её имплантацию.
МАТЕРИАЛ И МЕТОДИКА
Получение материала. Для получения пористых хитозановых матриц (ПХМ) использовали хитозан “Medium molecular weight”, артикул 448877 (Sigma-Aldrich Corporation, США) с мол. массой полимера 200 кДа и степенью деацетилирования 80%. Хитозан растворяли в 2%-ном водном растворе муравьиной кислоты при постоянном перемешивании не менее 120 мин, при этом концентрация полимера в растворе составляла 3%. Полученные растворы фильтровали, затем удаляли воздух при давлении 105 кПа в течение 3 ч, далее растворы замораживали при –20°С. Лиофилизацию растворов проводили на установке Freeze Dry System 7400030 (Labconco, США) при −2°С и давлении 1.6 Пa. Из полученных блочных заготовок трубчатой фрезой вырезали цилиндрические образцы длиной 5 мм и диаметром 1.3 мм. Размер пор в этих образцах по данным микроскопии варьировал от 10 до 300 мкм. Полученные образцы обрабатывали 5%-ным раствором NaOH с целью перевода хитозана из водорастворимой солевой формы в нерастворимую в воде основную форму.
Электронно-микроскопические исследования образцов проводили на сканирующем электронном микроскопе Supra 55VP (Carl Zeiss, Германия) в режиме регистрации вторичных электронов с предварительным нанесением тонкого слоя платины на поверхность образцов.
Эксперименты на животных. Для экспериментов in vivo использовали 35 самцов белых крыс Wistar, вес подопытных животных составлял 200–250 г, возраст – 3 мес. Для изучения резорбции in vivo ПХМ стерилизовали методом автоклавирования при 110°С в течение 1 ч. Для этого матрицы предварительно помещали в термостойкую стеклянную банку с избыточным количеством дистиллированной воды. Животных оперировали под общей анестезией (с помощью растворов золетила 100 (0.1 мл) и рометара (20 мг/мл) – 0.0125 мл на 0.1 кг массы животного интраперитонеально). Образцы помещали в большую приводящую мышцу бедра (musculus adductor magnus) на обеих тазовых конечностях. Затем раны конечностей послойно ушивали атравматическими иглами с нитью Prolen 4-0. После наложения наружных швов крыс содержали в индивидуальных клетках, животные получали свободный доступ к воде и стандартную диету. После операции все животные были активны, негативного влияния имплантации материалов на животных не выявлено, о чем свидетельствовало отсутствие воспалительных процессов в зоне имплантации.
Гистологическое исследование. Через 1, 2, 6, 12, 24, 36 и 48 нед. образцы мышечной ткани с ПХМ фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч, обезвоживали в серии растворов этанола возрастающей концентрации и заключали в парафиновые блоки по стандартной гистологической методике. Парафиновые срезы толщиной 5 мкм, поперечные мышечным волокнам и ПХМ, готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония), окрашивали гематоксилином Майера и эозином (Bio-Optica, Италия). Визуализацию тучных клеток (ТК) проводили окрашиванием толуидиновым синим (Bio-Optica, Италия). Для иммуногистохимического выявления макрофагов и моноцитов (клеток системы мононуклеарных фагоцитов) применяли первичные моноклональные мышиные антитела Anti-CD68 (ab 31 630; Abcam, Великобритания) в разведении 1 : 1000 при комнатной температуре, экспозиция 1 ч. Для выявления связавшихся первичных антител использовали мультимерную безбиотиновую систему детекции (D&A, Reveal-Biotin-Free Polyvalent DAB, Spring Bioscience Corporation, США). Препараты докрашивали гематоксилином Майера (Bio-Optica, Италия). Микроскопический анализ проводили на световом микроскопе Leica DM750 (Германия), используя окуляр с увеличением 10× и объектив с увеличением 4, 10, 40 и 100×. Запись цифровых изображений выполняли с помощью фотокамеры ICC50 (Leica, Германия).
С помощью компьютерной программы анализа изображений ImageScope M на каждом срезе при увеличении объектива 10× определяли общую площадь поперечного среза ПХМ, при увеличении объектива 40× – считали CD68+-клетки (макрофаги, моноциты, гигантские многоядерные клетки инородных тел (ГМКИТ)) и лейкоциты в порах матрицы в 10 полях зрения (размер каждого поля составлял 0.33 × 0.25 мм) в течение 1 и 2 нед. эксперимента и в 5 полях зрения для последующих экспериментальных сроков. Число тучных клеток определяли на площадь поперечного сечения матрицы.
Статистическую обработку полученных количественных данных проводили с использованием стандартного пакета программ (Statistica 7.0, Stat.Soft for Windows). Вычисляли среднее арифметическое значение и его стандартную ошибку, оценку значимости различий показателей проводили с применением критерия Вилкоксона и U-критерия Манна–Уитни. Значимость различий определяли при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
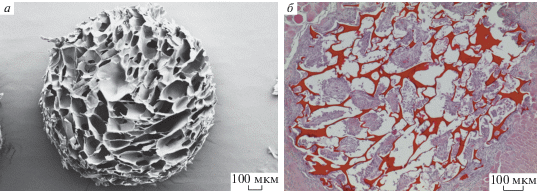
На рис. 1 приведены электронная и гистологическая микрофотографии поверхности поперечного сечения ПХМ. Видно, что матрица имеет пористую структуру с открытой системой пор, которые соединены друг с другом и внешней средой. Такая структура позволяет питательным веществам, продуктам жизнедеятельности и растворенным газам свободно циркулировать. Размер пор и незначительная извитость каналов, соединяющих между собой поры, способствуют свободной миграции клеток в объеме матрицы. Ранее была показана перспективность применения 3D-материалов со сходной структурой для нужд тканевой инженерии и клеточной трансплантологии (Cheung et al., 2007; Dhandayuthapani et al., 2011; Попрядухин и др., 2016, 2017).
Рис. 1.
Микрофотографии поперечного среза пористой хитозановой матрицы (ПХМ). а – Сканирующая электронная микроскопия исходной матрицы, б – гистологический срез мышечной ткани крысы через 1 нед. после имплантации, окраска гематоксилином и эозином. Об.: 10×.
ПХМ в мышечной ткани через 1 нед. после имплантации. Через 1 нед. экспозиции ПХМ в мышечной ткани вокруг матрицы определяется умеренно выраженное асептическое воспаление в сформированной за неделю тонкой соединительнотканной капсуле. Площадь поперечного сечения матрицы составляла (8.16 ± 1.36) × 105 мкм2. В периферических порах матрицы появляются фибробласты и единичные ГМ-КИТ (рис. 2а), число которых составляет 5 ± 0.6. В центральных порах матрицы среди фибрина и клеточного детрита выявляются многочисленные клетки CD68+ и лейкоциты (рис. 2б), их числа составляют 53 ± 5 и 12 ± 2 соответственно (табл. 1). Число тучных клеток в капсуле вокруг матрицы не превышает 2 клеток, в периферических порах матрицы ТК не выявляется.
Рис. 2.
Гистологические срезы мышечной ткани крысы через 1 (а, б), 2 (в, г) и 6 (д, е) нед. после имплантации ПХМ. а, в, д – Периферические поры, б, г, е – центральные поры; одинарные стрелки – лейкоциты, двойные стрелки – клетки CD68+, тройные стрелки – гигантские многоядерные клетки инородных тел (ГМКИТ). Иммуногистохимическое выявление клеток CD68+, докрашивание гематоксилином Майера, Об.: 40×.
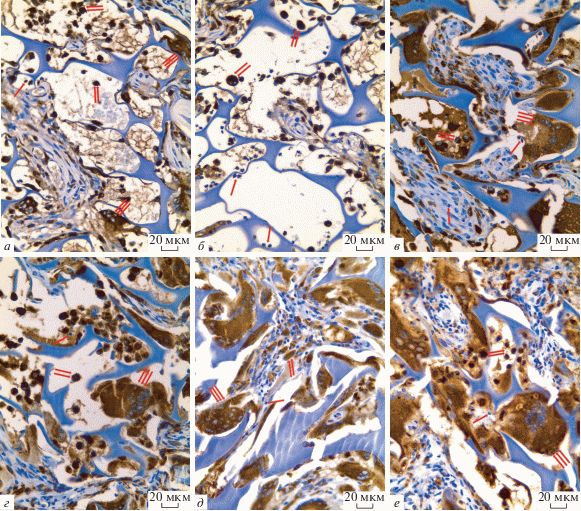
Таблица 1.
Динамика численности CD68+-клеток, лейкоцитов и тучных клеток в ПХМ на разных сроках имплантации
| Время, нед |
Число клеток в поле зрения | Площадь поперечного сечения (ППС) ПХМ, ×105 мкм2 |
|||
|---|---|---|---|---|---|
| Макрофаги | ГМКИТ | Лейкоциты | ТК (на ППС) | ||
| 1 | 53 ± 5 | 5 ± 0.6 | 12 ± 2 | 1–2 | 8.16 ± 1.36 |
| 2 | 48 ± 2 | 11 ± 0.7а (0.00001) |
17 ± 1в p = 0.05624 |
1 | 6.88 ± 1.24 |
| 6 | 41 ± 3 | 12 ± 1а (0.00005) |
30 ± 5а (0.005157) |
1–2 | 6.38 ± 1.24 |
| 12 | 49 ± 6 | 8 ± 1а (0.03253) |
12 ± 3б (0.001383) |
1–2 | 5.38 ± 0.57в (0.05907) |
| 24 | 32 ± 4а (0.00631) |
23 ± 1а (0.00002) |
11 ± 1б (0.0009293) |
1–3 | 2.64 ± 0.63а (0.0294) |
| 36 | 31 ± 4а (0.01564) |
16 ± 1а (0.00009) |
13 ± 4б (0.01171) |
1–2 | 2.14 ± 0.62а (0.0294) |
ПХМ через 2 нед. после имплантации. При гистологическом исследовании ПХМ в мышцах через 2 нед. экспозиции после имплантации площадь поперечного сечения матрицы составила (6.88 ± 1.24) × × 105 мкм2. Вокруг матрицы сформирована очень тонкая соединительнотканная капсула с признаками незначительного асептического воспаления. Практически все поры заполнены ГМКИТ и их число составляло 11 ± 0.7, что значимо отличается от показателей 1-ой нед. эксперимента. Число макрофагов в порах матрицы оставалось на высоком уровне, число лейкоцитов имело тенденцию к значимому увеличению по сравнению с данными 1-ой недели эксперимента (рис. 2 в, г, табл. 1). Число тучных клеток не изменялось, они располагались только по периферии матрицы и не проникали в ее поры.
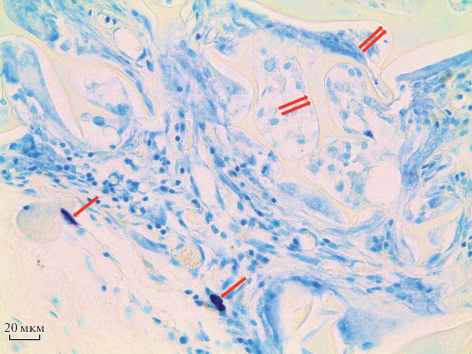
ПХМ через 6 нед. после имплантации. На этом сроке эксперимента соединительнотканная капсула вокруг матрицы не выявляется, площадь поперечного среза матрицы уменьшается до (6.38 ± 1.24) × 105 мкм2. Все поры заполнены молодой соединительной тканью с фибробластами и ГМКИТ, число которых не увеличивается по сравнению с предыдущим сроком эксперимента и составляет 12 ± 1, значимо отличаясь от показателей 1-ой нед. эксперимента. Отметим, что в некоторых порах определяются полнокровные сосуды. Число макрофагов в порах значимо не изменяется по сравнению с предыдущими сроками, число лейкоцитов (в основном лимфоцитов) достигает максимального значения и составляет 30 ± 5, значимо отличаясь от показателей 1-ой нед. эксперимента (рис. 2 д, е, табл. 1). Тучные клетки располагаются в непосредственной близости к матрице в количестве 1–2 клетки на срезе (рис. 3).
Рис. 3.
Тучные клетки и фрагменты ПХМ на гистологическом срезе мышечной ткани крысы через 6 нед. после имплантации. Одинарные стрелки – тучные клетки, двойные стрелки – фрагменты матрицы. Окраска толуидиновым синим. Об.: 40×.
ПХМ через 12 нед. после имплантации. На данном сроке эксперимента соединительнотканная капсула уже отсутствует. Все поры матрицы заполнены соединительной тканью. Площадь поперечного среза матрицы уменьшается до (5.38 ± 0.57) × 105 мкм2 и имеет тенденцию к отличию от показателей 1-й нед. эксперимента. Численность макрофагов и ГМКИТ в порах матрицы остаeтся повышенной и составляет 49 ± 6 и 8 ± 1 клеток соответственно. Следует отметить, что число лейкоцитов значимо снижается до 12 ± 3 по сравнению с показателями 6-й нед. эксперимента. Численность тучных клеток не изменяется по сравнению с предыдущими сроками.
ПХМ через 24, 36 и 48 нед. после имплантации. В это время соединительнотканная капсула вокруг матрицы не определяется. Площадь поперечного среза значимо снижается на сроках 24 и 36 нед. эксперимента до (2.64 ± 0.63) × 105 мкм2 и (2.14 ± 0.62) × 105 мкм2 соответственно по сравнению с показателями 1-ой нед. эксперимента. Во всех порах матрицы находится соединительная ткань с более плотными коллагеновыми волокнами и с полнокровными сосудами в большинстве периферических пор. На этих сроках эксперимента численность макрофагов значимо снижается, а число ГМКИТ продолжает увеличиваться по сравнению с показателями 1-ой нед. эксперимента и составляет 2 3 ± 1 и 16 ± 1 соответственно для 24-й и 36-й нед. эксперимента (табл. 1). Численность тучных клеток непосредственно вокруг матрицы не изменяется. Через 48 нед. после имплантации только в одном образце из пяти обнаружены фрагменты ПХМ. Площадь фрагментов составляет 1.71 × 105 мкм2. Соединительнотканная капсула вокруг фрагментов не выявляется, а собственно структуры матрицы, не связанные между собой, окружены макрофагами и ГМКИТ.
Таким образом, с использованием иммуногистохимического метода для выявления CD68+-клеток (макрофагов, моноцитов и ГМКИТ) нами показано, что через 1 нед. после имплантации ПХМ во всех порах матрицы присутствуют в основном многочисленные макрофаги, моноциты и сегментоядерные лейкоциты, по периферии на структурах матрицы располагаются единичные ГМКИТ, под действием которых начинается биорезорбция. Присутствующие в порах матрицы и в соединительнотканной капсуле лейкоциты (в основном сегментоядерные) свидетельствуют об умеренно выраженном асептическом воспалении. Важно отметить, что тучные клетки не реагируют на имплантат, что показывает биоинертность и отсутствие аллергенности материала и, следовательно, является положительным признаком в пользу клинического применения ПХМ.
На дальнейших сроках эксперимента (2–12 нед.) мы наблюдали уменьшение площади поперечного сечения ПХМ, но при этом число ГМКИТ значимо увеличивается. Мы наблюдаем гистологическую картину, при кроторой практически во всех порах ГМКИТ располагаются на структурах матрицы. Численность макрофагов не снижается, оставаясь на высоком уровне. Возможно, активная деятельность ГМКИТ, приводящая к биорезорбции ПХМ привлекает пул моноцитов, дифференцирующихся в макрофаги, которые в свою очередь формируют ГМКИТ. Таким образом, на сроках 24 и 36 нед. эксперимента число ГМКИТ резко возрастает при значительном уменьшении площади поперечного сечения ПХМ. При этом число макрофагов на отдалённых сроках эксперимента значимо снижается по сравнению с 1-ой нед. имплантации.
Положительным моментом является то, что тучные клетки на всех сроках эксперимента не реагируют на материал матрицы и его биорезорбцию. Хорошо известно, что именно макрофаги являются первичным звеном иммунологического ответа на экзогенный фактор (в нашем случае ПХМ) и становятся инициаторами последующих процессов, приводящих к морфологической перестройке соединительной ткани (Шкурупий и др., 2013; Юкина и др., 2016). Цитокины, прежде всего ИЛ-1, секретируемые макрофагами, провоцируют миграцию тучных клеток и их IgE-независимую дегрануляцию (Puxeddu et al., 2003). В свою очередь триптазе и химазе гранул тучных клеток отводится ведущая роль в активации как пролиферации, так и секреторной способности фибробластов (Kosanovic et al., 2013). Таким образом, гуморальная экскреция тканевых макрофагов и мигрирующих тучных клеток становится ключом соединительнотканного ремоделирования стромы органа.
В наших экспериментах одним из интересных и важных наблюдений является то, что на всех сроках тучные клетки не мигрировали в место имплантации матрицы и не вовлекались в межклеточные взаимодействия. Следовательно, при биорезорбции ПХМ в окружающие матрицу ткани не выделяются антигены, вызывающие аллергические реакции. Материал матрицы является биоинертным и не вызывает токсического воздействия на ткани. Мы предполагаем, что процессы, протекающие при длительной биорезорбции ПХМ, контролируются субпопуляцией М2 макрофагов, которые ответственны за противовоспалительный, ранозаживляющий эффекты и процессы ангиогенеза и биорезорбция ПХМ, как следствие, сопровождается конструктивным ремоделированием, а не накоплением плотной соединительной ткани с образованием рубцовой ткани (Brown et al., 2009).
Полученные результаты исследования позволяют рекомендовать ПХМ для получения биоинженерных препаратов пролонгированного действия, с целью дальнейшего применением их в регенеративной медицине, тканевой инженерии и клеточной трансплантологии.
ФИНАНСИРОВАНИЕ
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-73-30003).
Список литературы
Попрядухин П.В., Юкина Г.Ю., Добровольская И.П., Иванькова Е.М., Юдин В.Е. 2017. Биорезорбция пористых 3D-матриц на основе коллагена в печени и мышечной ткани. Цитология. 59(9) : 609–616. (Popryaduhin P.V., Yukina G.Y., Dobrovolskaya I.P., Ivankova E.М., Yudin V.E. 2018. Bioresorption of porous 3D matrices based on collagen in liver and muscular tissue. Cell and Tissue Biology (Tsitologiya). 12(3) : 247–255.)
Попрядухин П.В., Юкина Г.Ю., Суслов Д.Н., Добровольская И.П., Иванькова Е.М., Юдин В.Е. 2016. Биорезорбция пористых 3D-материалов на основе хитозана. Цитология. 58(10) : 771–777. (Popryaduhin P.V., Yukina G.Yu., Suslov D.N., Dobrovolskaya I.P., Ivankova E.М., Yudin V.E. 2016. Bioresorption of porous 3D-materials based on chitosan. Tsitologiya. 58(10) : 771–777.)
Шкурупий В.А., Ким Л.Б., Потапова О.В., Черданцева Л.А., Путятина А.Н., Никонова И.К. 2013. Особенности процессов фиброзирования гранулем и интерстиция легких мышей при туберкулезном воспалении. Бюлл. экспер. биол. мед. 156(12) : 687–691. (Shkurupiy V.A., Kim L.B., Potapova O.V., Cherdantseva L.A., Putyatina A.N., Nikonova I.K. 2014. Fibrogenesis in granulomas and lung interstitium in tuberculous inflammation in mice. Bull. Exp. Biol. Med. 156(6) : 731–735.)
Юкина Г.Ю., Журавский С.Г., Паневин А.А., Галагудза М.М., Томсон В.В., Блюм Н.М. 2016. Взаимодействие тканевых макрофагов и тучных клеток как начало органного ремоделирования в рамках хронической токсичности наночастиц кремнезёма. Трансляционная медицина. 3(2) : 70–79. (Yukina G.Y., Zhuravskii S.G., Panevin A.A., Galagudza M.M., Tomson V.V., Blum N.M. 2016. Macrophage granulomas and mast cells as beginning organ remodeling in case of silicone dioxide nanoparticles chronic toxicity. Translational Med. 3(2) : 70–79.)
Armentano I., Dottori M., Fortunati E., Kenny J.M. 2010. Biodegradable polymer matrix nanocomposites for tissue engineering: A review. Polym. Degrad. Stab. 95 : 2126–2146.
Bing Y., Xing Y.L., Shuai S., Xiang Y.K., Gang G., Mei J.H., Feng L., Yu Q.W., Xia Z., Zhi Y.Q. 2010. Preparation and characterization of a novel chitosan scaffold. Carbohydr. Polym. 80 : 860–865.
Brown B.N., Valentin J.E., Stewart-Akers A.M., McCabe G.P., Badylak S.F. 2009. Macrophage phenotype and remodeling outcomes in response to biologic scaffolds with and without a cellular component. Biomaterials. 30 : 1482–1491.
Buchanan F.J. (Ed.) 2008. Degradation rate of bioresorbable materials. Woodhead Publishing. 424 p.
Causa F., Netti P.A., Ambrosio L. 2007. A multi-functional scaffold for tissue regeneration: the need to engineer a tissue analogue. Biomaterials. 28 : 5093–5099.
Cheung H., Lau K., Lu T., Hui D. 2007. A critical review on polymer-based bio-engineered materials for scaffold development. Composites. Part B: Engineering. 38 : 291–300.
Cheung R.C.F., Ng T.B., Wong J.H., Chan W.Y. 2015. Chitosan: an update on potential biomedical and pharmaceutical applications. Mar. Drugs. 13 : 5156–5186.
Chirkov S.N. 2002. The antiviral activity of chitosan (review). Applied Biochem. Microbiol. (Russian). 38 : 3–13.
Dai T., Tanaka M., Huang Y.-Y., Hamblin M.R. 2011. Chitosan preparations for wounds and burns: antimicrobial and wound-healing effects. Expert Rev. Anti Infect. Ther. 9 : 857–879.
Dhandayuthapani B., Yoshida Y., Maekawa T., Kumar D.S. 2011. Polymeric scaffolds in tissue engineering application: A review. Int. J. Polymer Sci. 290602. https://doi.org/10.1155/2011/290602
Dornish M., Kaplan D., Skaugrud O. 2001. Standards and guidelines for biopolymers in tissue-engineered medical products. Ann. N.Y. Acad. Sci. 944(1) : 388–397.
Eide K.B., Norberg A.L., Heggset E.B., Lindbom A.R., Vårum K.M., Eijsink V.G., Sørlie M. 2012. Human chitotriosidase-catalyzed hydrolysis of chitosan. Biochem. 51 : 487–495.
Gleadall A., Pan J., Kruft M.-A., Kellomäki M. 2014. Degradation mechanisms of bioresorbable polyesters. Part 2. Effects of initial molecular weight and residual monomer. Acta Biomat. 10 : 2233–2240.
Gunatillake P.A., Adhikari R. 2003. Biodegradable synthetic polymers for tissue engineering. Eur. Cell. Mater. 20 : 1–16.
Jafari M., Paknejad Z., Rad M.R., Motamedian S.R., Eghbal M.J., Nadjmi N., Khojasteh A. 2017. Polymeric scaffolds in tissue engineering: a literature review. J. Biomed. Mater. Res. Part B. 105B (2) : 431–459.
Khan F., Tanaka M., Ahmad S.R. 2015. Fabrication of polymeric biomaterials: a strategy for tissue engineering and medical devices. J. Mater. Chem. B. 3 : 8224–8249.
Kohane D.S., Langer R. 2008. Polymeric biomaterials in tissue engineering. Pediatr. Res. 63 : 487–491.
Kosanovic D., Dahal B.K., Wygrecka M., Reiss I., Günther A., Ghofrani H.A., Weissmann N., Grimminger F., Seeger W., Schermuly R.T., Banat G.A. 2013. Mast cell chymase: an indispensable instrument in the pathological symphony of idiopathic pulmonary fibrosis? Histol. Histopathol. 28 : 691–699.
Levengood S.L., Zhang M. 2015. Chitosan-based scaffolds for bone tissue engineering. J. Mater. Chem. B Mater. Biol. Med. 2 (21) : 3161–3184.
Ma Z., Kotaki M., Inai R., Ramakrishna S. 2005. Potential of nanofiber matrix as tissue-engineering scaffolds. Tissue Eng. 11 (1–2) : 101–109.
Periayah M.H., Halim A.S., Saad A.Z.M. 2016. Chitosan: a promising marine polysaccharide for biomedical research. Pharmacogn. Rev. 10 : 39–42.
Puxeddu I., Piliponsky A.M., Bachelet I., Levi-Schaffer F. 2003. Mast cell in allergy and beyond. Int. J. Biochem. Cell Biol. 35 : 1601–1607.
Reis R.L., Neves N.M., Mano J.F., Gomes M.E., Marques A.P., Azevedo H.S. 2008. Natural-based polymers for biomedical applications. Woodhead Publishing. 832 p.
Rodríguez-Vázquez M., Vega-Ruiz B., Ramos-Zúñiga R., Saldaña-Koppel D.A., Quiñones-Olvera L.F. 2015. Chitosan and its potential use as a scaffold for tissue engineering in regenerative medicine. BioMed Res. Int. 821279. https://doi.org/10.1155/2015/821279
Sachlos E., Czernuszka J.T. 2003. Making tissue engineering scaffolds work. Review on the application of solid freeform fabrication technology to the production of tissue engineering scaffolds. Making tissue engineering. Eur. Cell. Mater. 5 : 29–40.
Salgado A.J., Coutinho O.P., Reis R.L. 2004. Bone tissue engineering: state of the art and future trends. Macromol. Biosci. 4 : 743–765.
Whu S.W., Hung K., Hsieh K., Chen C., Tsai C., Hsu S. 2013. In vitro and in vivo evaluation of chitosan–gelatin scaffolds for cartilage tissue engineering. Mat. Sci. Eng. 33 : 2855–2863.
Дополнительные материалы отсутствуют.


