Цитология, 2019, T. 61, № 7, стр. 511-520
Нейробласты Drosophila melanogaster
С. С. Сайдакова 1, 2, *, А. А. Струнов 3, К. Н. Морозова 1, 2
1 Кафедра цитологии и генетики Новосибирского государственного университета
630090 Новосибирск, Россия
2 Федеральный исследовательский центр Институт цитологии и генетики СО РАН
630090 Новосибирск, Россия
3 Медицинский университет Вены, Лаборатория динамики геномов
A-1090 Вена, Австрия
* E-mail: custodian.of.midnight@gmail.com
Поступила в редакцию 15.03.2019
После доработки 05.04.2019
Принята к публикации 23.04.2019
Аннотация
Настоящий обзор посвящен нейральным стволовым клеткам Drosophila melanogaster – нейробластам. Drosophila melanogaster – это хорошо описанная и удобная модель для изучения функционирования стволовых клеток и механизмов, лежащих в основе дифференцировки клеток. Многие закономерности, характерные для развития нервной системы дрозофилы, обнаруживаются и у человека. Поэтому детальное изучение нейробластов является актуальной задачей для расширения наших представлений о процессе деления клеток и механизмах опухолеобразования. Данный обзор будет сфокусирован на последних достижениях в изучении нейробластов дрозофилы, включая их классификацию, происхождение и пути миграции. Кроме того, мы подробно опишем асимметричное деление нейробластов и его молекулярные механизмы.
В развитии нервной системы центральную роль играют нейральные стволовые клетки. В ходе их деления образуются различные типы нейронов, управляющие сложным поведением животных. Известно, что нейроны возникают путем асимметричных делений стволовой клетки: у большей дочерней клетки сохраняется способность к самообновлению, а меньшая вступает в процессы дифференцировки. С течением времени генерируются различные типы нейронов и глиальных клеток, чему способствуют транскрипционные изменения в клетке-предшественнике, а также ее пространственное расположение. Клеточный цикл нейральных стволовых клеток скоординирован со стадией развития организма – таким образом строго регулируется временная и тканеспецифичная генерация определенных нейронов, что предотвращает образование опухолей нервной ткани. Все эти ключевые особенности характерны для нейробластов Drosophila melanogaster, популярного модельного объекта в биологии развития (Homem, Knoblich, 2012; Li et al., 2014; Harding, White, 2018). Глубоко изученный онтогенез дрозофилы и многочисленные генетические инструменты, доступные для экспериментов, позволяют детально исследовать биологию стволовых клеток и нейрогенез на данном объекте, что гораздо сложнее сделать на модели позвоночных животных. В частности, нейробласты дрозофилы являются популярной моделью для изучения асимметричного деления стволовых клеток и механизмов, лежащих в основе их превращения в раковые клетки (Homem, Knoblich, 2012; Li et al., 2014; Harding, White, 2018). Данный обзор суммирует основную имеющуюся на сегодняшний день информацию о нейробластах Drosophila melanogaster и является первым обзором на эту тему на русском языке.
ХАРАКТЕРИСТИКА НЕЙРОБЛАСТОВ ДРОЗОФИЛЫ
Нейробласты – это нейральные стволовые клетки, дающие начало нейронам и глиальным клеткам, определяя тем самым клеточный состав закладывающейся нервной системы. Более двухсот нейробластов формируют мозг, состоящий из тысяч нейронов, соединенных между собой в сложнейшие сети и окруженных поддерживающими глиальными клетками (Jiang, Reichert, 2014; Harding, White, 2018). Внешне нейробласты представляют собой крупные (10–12 мкм) клетки приблизительно сферической формы с ядром около 7–8 мкм в диаметре. Их асимметричное деление приводит к образованию большей клетки, которая так и остается нейробластом, и меньшей, которая обладает сниженной потентностью и в дальнейшем дифференцируется в нейроны или глиальные клетки (Prehoda, 2009; Hartenstein, Wodarz, 2013; Jiang, Reichert, 2014).
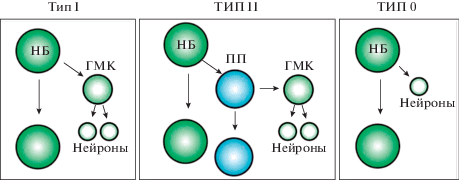
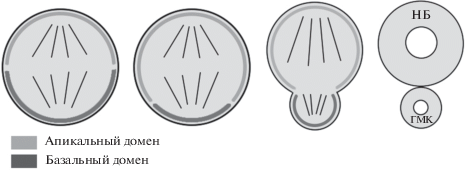
Типы нейробластов. Выделяют три типа нейральных стволовых клеток (Doe, 2017). Нейробласты 0 типа при асимметричном делении дают начало клетке, дифференцирующейся в нейрон без каких-либо промежуточных делений (рис. 1). Нейробласты I типа в результате деления формируют самовозобновляющийся нейробласт и меньшую по размеру клетку, которая получила название “ганглиозная материнская клетка” (ГМК). ГМК подвергается симметричному делению, и получившиеся клетки дифференцируются в нейроны или глию. У нейробластов II типа митоз проходит по другому сценарию. После асимметричного деления меньшая клетка – промежуточный предшественник (ПП) – вступает в стадию созревания, которая включает в себя серию определенных изменений транскрипционной активности. Далее зрелый ПП подобно нейробласту делится асимметрично 3–6 раз, формируя ГМК, которые также после одиночного деления производят по две дифференцирующиеся клетки (Homem, Knoblich, 2012; Li et al., 2014). Так как нейробласты I и II типов различаются по уровням экспрессии различных генов, их можно легко дифференцировать с помощью иммунофлуоресцентного мечения (Loesel et al., 2006; Homem, Knoblich, 2012; Jiang, Reichert, 2014).
Рис. 1.
Три типа деления нейробластов. НБ – нейробласты, ГМК – ганглиозная материнская клетка, ПП – промежуточный предшественник (по Harding, White, 2018, Open Access).
Асимметричное деление нейробластов. Асимметричное деление является одним из способов формирования дифференцированных клеток из плюрипотентных стволовых. При этом происходит перераспределение факторов, отвечающих за дальнейшую судьбу клетки. Молекулярные механизмы этого процесса хорошо изучены на световом уровне.
У нейробластов в интерфазе подмембранный актиновый кортекс накапливает специфические морфогенные белки (Prehoda, 2009). Совокупность определенных белков, связанных с кортексом, называется кортикальным доменом. Начиная с профазы, эти белки смещаются к базальной части клетки, будучи вытесненными другими факторами, занимающими апикальное расположение. Так формируются два противолежащих домена, каждый из которых занимает примерно половину от внутренней поверхности мембраны (рис. 2). Один домен накапливает факторы, отвечающие за образование ГМК – он прилежит к базальной половине нейробласта. Апикальный домен состоит из белков, которые должны остаться в нейробласте. Эти домены определяют апикально-базальную поляризацию нейробластов и ось, вдоль которой формируется веретено деления.
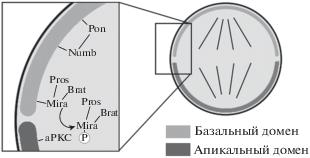
Рис. 2.
Поляризация нейробластов во время деления. НБ – нейробласт, ГМК – ганглиозная материнская клетка (ориг.).
Базальный домен имеет в своем составе три основных белка: Prospero (Pros) – транскрипционный фактор ГМК, Numb – регулятор транспорта промежуточных соединений из сигнального пути Notch и Brain tumor (Brat) – фактор, связывающий белок Argonaute-1 и регулирующий продукцию микроРНК, необходимых для развития. Мутации по каждому из трех генов, кодирующих эти белки, вызывают увеличение числа нейробластов и приводят к формированию опухолей мозга. Pros и Brat связываются с кортексом клетки посредством белка Miranda (Mir). Numb может прикрепляться к кортексу самостоятельно, однако белок Pon (Partner of Numb) помогает делать это более эффективно (рис. 3а) (Knoblich et al., 1997; Prehoda, 2009; Hartenstein, Wodarz, 2013).
Рис. 3.
Факторы базального домена и их взаимодействие с атипичной протеинкиназой С. Р – фосфатная группа (ориг.).
Апикальный домен имеет в своем составе ключевой фермент – атипичную протеинкиназу С (aPKC), который способен фосфорилировать белки Mir и Numb, что приводит к диссоциации белков базального домена от кортекса (рис. 3б). В свою очередь, чтобы апикальный домен не “расползался” по всему кортексу, работу аРКС подавляет белок Lethal giant larvae (Lgl). С одной стороны, Lgl ингибирует этот фермент, с другой – обладает способностью предотвращать связывание белков апикального домена с базальной частью клетки. Подобная регуляция поддерживает базальный и апикальный домены в равновесии (Knoblich et al. 1997; Prehoda, 2009; Hartenstein, Wodarz, 2013).
У мутантов по гену numb не происходит нарушения формирования веретена деления, а в клетках дикого типа при разрушении веретена деления колцемидом Numb неизменно смещается на базальную часть мембраны. Таким образом, апикально-базальная поляризация и ориентация оси веретена деления в нейробластах происходят независимо друг от друга, но одновременно, используя некоторую заданную ось поляризации (Knoblich, 2001; Prehoda, 2009).
Связывает эти два процесса белок Inscuteable (Insc). Было замечено, что в клетках, в которых он экспрессируется (в норме это нейробласты), веретено деления ориентируется перпендикулярно соответствующему слою клеток, а при его отсутствии – в плоскости этого слоя. Молекулярный анализ показал, что Insc связывается с двумя важными комплексами белков (рис. 4) (Kraut et al. 1996).
Рис. 4.
Белок Insc (красный цвет) связывает два комплекса белков. Par/aPKC (синий цвет) отвечает за процесс поляризации кортекса нейробластов, Pins/Gα/Mud (зеленый цвет) – за правильную ориентацию веретена деления (ориг.).
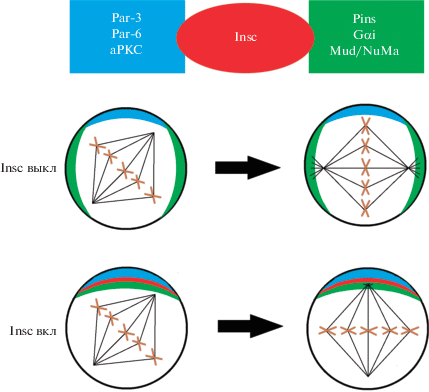
Первый комплекс представлен белками семейства Pins, локализующимися в апикальной части клетки, Gα-субъединицей для передачи сигнала и белком Mud, связывающимся с микротрубочками. Локализация Mud в апикальной части клетки приводит к соответствующей ориентации веретена деления. Второй комплекс включает в себя белки семейства Par, которые связываются с вышеупомянутой aPKC, запуская процесс поляризации кортекса клетки. В итоге клетка делится, образуя перетяжку между базальным и апикальным доменами (Knoblich, 2001; Prehoda, 2009).
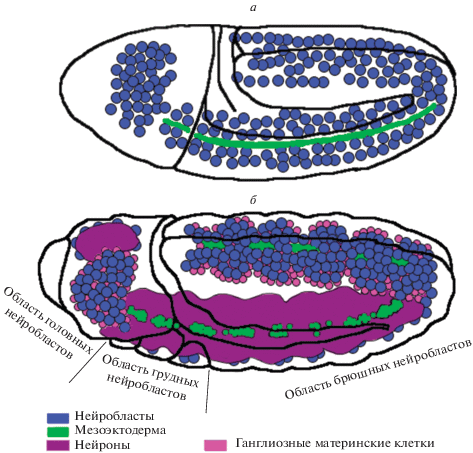
Локализация нейробластов в эмбрионе и личинке третьего возраста. Нейробласты, как правило, располагаются ближе к поверхности ЦНС. В эмбрионе на 9–13 стадии наблюдается полоска нейробластов, протягивающаяся от головного до брюшного конца, который загибается вперед (рис. 5а). На 11 стадии, когда эмбрион становится четко сегментированным, нейробласты условно можно поделить на головные, грудные и брюшные (рис. 5б).
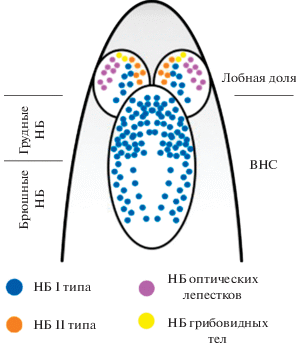
Центральную нервную систему личинки разделяют на две основных части: мозг и вентральный нервный ствол. Каждая часть содержит специфические ей нейробласты. В вентральном нервном стволе различают грудные и брюшные нейробласты, что отражает сегменты, в которых в процессе эмбрионального развития образовались эти клетки (рис. 6). Все нейробласты вентрального нервного ствола относятся к I типу. В мозге различают собственно нейробласты лобных долей, грибовидных тел и зачатков оптических долей. В отличие от всех остальных, нейробласты зачатков оптических долей появляются не в эмбриональный период, а уже на личиночной стадии, и их причисляют к нейробластам 0 типа. Нейробластов грибовидных тел всего четыре на каждой лобной доле. В центральном отделе мозга присутствуют нейробласты как I, так и II типов, но их положение отнюдь не случайно. В каждом полушарии всего восемь нейробластов II типа: шесть в задней дорзомедиальной области и два латеральнее (Homem, Knoblich, 2012; Doe, 2017). Около сотни нейробластов I типа разбросаны по остальной поверхности центрального мозга (рис. 6).
НЕЙРОБЛАСТЫ В ОНТОГЕНЕЗЕ ДРОЗОФИЛЫ: ОТ ЭМБРИОНА ДО ИМАГО
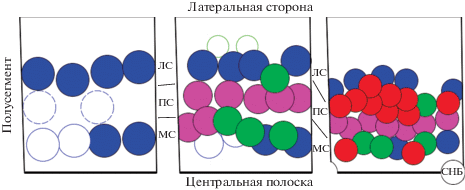
Происхождение и миграция нейробластов. Нейробласты берут свое начало из эктодермы. В раннем эмбриогенезе (с 9 стадии по атласу развития дрозофилы) (Hartenstein, 1993; Hartenstein, Campos-Ortega, 1997) эктодерма подразделяется на нейроэктодерму и эпидермальную эктодерму (Hartenstein, Campos-Ortega, 1997). В отличие от позвоночных, у которых вся нейроэктодерма инвагинирует внутрь эмбриона и образует нервную трубку, у беспозвоночных единичные нейробласты мигрируют во внутренний зачаток нервной ткани и начинают делиться асимметрично. Миграция происходит в пределах полоски брюшной эктодермы, составляющей примерно 100 клеток в длину и 8–9 в ширину – столбчатом эпителии (Hartenstein, Wodarz, 2013). Он дает начало 15 нейромерам (сегментарным участкам) формирующейся ЦНС. Столбчатым эпителий называется, потому что в каждом полусегменте (каждый сегмент делится центральной полоской на две половины, в которых сегрегация нейробластов идет симметрично) выделяют 3 основных столбца, в которых мигрируют нейробласты: медиальный, промежуточный и латеральный (рис. 7). Нейробласты мозга образуются в области головы эмбриона. Миграция нейробластов из вентральной нейроэктодермы протекает в 5 волн (S1–S5) (Hartenstein, Wodarz, 2013). По итогам S1 волны мигрирует 6 или 10 нейральных стволовых клеток на каждом грудном или брюшном полусегменте соответственно, после S2 волны – 6 нейробластов на полусегмент, волна S3 добавляет еще 4 клетки, на последних двух волнах S4–S5 мигрирует 11 нейробластов на каждом полусегменте и один серединный на сегмент (Hartenstein, Campos-Ortega, 1997). В итоге образуется около 30 нейробластов на полусегмент эмбриона (Harding, White, 2018).
Рис. 7.
Миграция нейробластов в столбчатом эпителии на стадиях 9 (слева), 10 (в центре) и 11 (справа). Черные линии указывают границы полусегментов нейромеров. Нейробласты показаны в виде цветных кругов; цвета отображают волны, во время которых мигрировал НБ (синий – S1; пурпурный – S2; зеленый – S3; красный – S4–5). Номенклатура по Doe (1992). МС, ПС и ЛС – медиальный, промежуточный и латеральный столбцы соответственно. Незакрашенные НБ не делятся как стволовые клетки, а подвергаются только одному дальнейшему делению с образованием двух клеток, дифференцирующихся в нейроны. Незакрашенные с пунктирной границей S1 НБ мигрируют в брюшных сегментах, но не в грудных. СНБ – серединный НБ (ориг.).
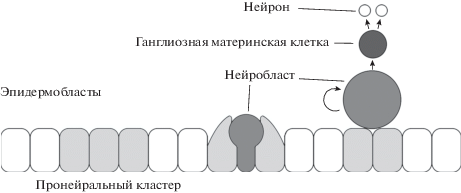
Механизм сегрегации нейробластов изучен пока только на волне S1. Сначала в нейроэктодерме обособляются группы из 6–8 клеток, каждая из которых потенциально способна стать нейробластом. Эти группы называются пронейральными кластерами, и их образованию предшествует повышение экспрессии генов achaete, scute и lethal of scute. Экспрессия этих генов, в свою очередь, активируется продуктами генов, экспрессирующихся в столбчатом эпителии периодическими продольными и поперечными полосами. Из каждого пронейрального кластера в итоге может мигрировать только один нейробласт. Выбор клетки из кластера, которая станет нейробластом, происходит посредством сигнального механизма, связанного с геном Notch. Рецептор Notch (N) и его лиганд Delta (Dl) образуют между клетками хорошо отлаженную петлю отрицательной обратной связи, которая приводит к так называемому латеральному ингибированию. В итоге, ингибированные периферические клетки теряют возможность стать нейробластами и их ядра смещаются в апикальную часть клетки, тогда как единственная неингибированная клетка в кластере начинает погружаться под базальный слой и становится, в конце концов, нейробластом (рис. 8). В ходе первого деления образовавшегося нейробласта происходит разворот оси веретена деления на 90°: из плоскости, параллельной слою эпителиальных клеток, в плоскость перпендикулярную ей. В последующих делениях ось формируется сразу в правильной ориентации, без разворота (Hartenstein, Wodarz, 2013).
Две волны деления нейробластов. Различают две волны активного деления нейробластов, разделенные периодом покоя (рис. 9) (Hartenstein, 1993; Knoblich, 2001; Prehoda, 2009; Homem, Knoblich, 2012; Li et al., 2014). Первая волна происходит в эмбриональный период сразу после миграции нейробластов из эпидермального слоя. Нейральные стволовые клетки активно производят ГМК, уходящие вглубь эмбриона и производящие в дальнейшем нейроны личиночной ЦНС. Деление эмбриональных нейробластов происходит настолько активно, что они не успевают даже восстановить исходные размеры перед очередным делением и в итоге сильно уменьшаются (Prehoda, 2009). После первой волны деления наступает период покоя, в течение которого нейробласты не делятся и восстанавливают свой объем. Исключением являются нейробласты грибовидных тел – они продолжают делиться вплоть до стадии поздней куколки благодаря продолжающейся экспрессии транскрипционного фактора Eyeless (Harding, White, 2018).
Рис. 9.
Две волны нейрогенеза у дрозофилы. Со стадии 9 эмбриогенеза из нейроэктодермы мигрируют нейробласты и вступают в первую волну деления. К концу эмбрионального развития их митотическая активность затухает (за исключением нейробластов грибовидных тел) и начинается вновь на второй волне деления в поздних личинках первого возраста (ориг.).
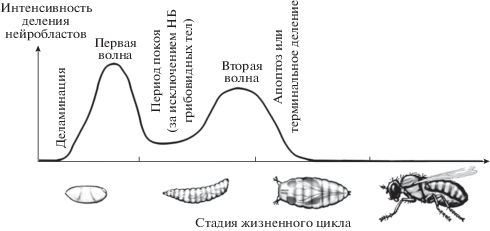
На последующих стадиях эмбрионального развития некоторые нейробласты (в основном брюшные) погибают путем апоптоза, в результате чего ЦНС личинки содержит меньше нейробластов, чем ЦНС эмбриона (Hartenstein, Wodarz, 2013). Апоптоз нейробластов будет подробно описан ниже в разделе “Апоптоз брюшных нейробластов”.
У поздних личинок первого возраста постепенно начинается вторая волна активного деления нейробластов (Homem, Knoblich, 2012; Hartenstein, Wodarz, 2013; Jiang, Reichert, 2014). Она продолжается вплоть до стадии куколки, затем снова стихает, и нейробласты вступают в последнее, терминальное деление или же погибают путем апоптоза (Pinto-Teixeira et al., 2016). В отличие от первой волны, нейробласты восстанавливают исходный объем перед каждым делением. Благодаря этому они могут делиться большее количество раз (Prehoda, 2009). Значительную часть вторичных нейронов производят всего 16 нейробластов II типа (Homem, Knoblich, 2012). Таким образом, ПП значительно увеличивают производительность нейробластов.
Период покоя нейробластов и выход из него. Как было сказано выше, после окончания первой волны деления нейробласты вступают в период покоя (за исключением нейробластов грибовидных тел) и выходят из него, когда личинка вылупляется и начинает питаться. Нейробласты в центральном мозге реактивируются первыми в течение 24 ч после вылупления личинок. За этим следует продолжение пролиферации грудных нейробластов через 30 ч после вылупления, а затем – брюшных нейробластов через 50 ч после вылупления (Ito, Hotta, 1992; Sousa-Nunes et al., 2011). Такой передне-задний градиент реактивации регулируется белками группы Polycomb (PcG), члены которых ингибируют экспрессию генов Hox в мозге и тем самым способствуют продолжающейся пролиферации нейробластов (Yaghmaeian et al., 2018). Однако механизм действия этих белков все еще неизвестен.
Любопытен тот факт, что только 25% нейробластов вступают в стандартную G0-фазу, а остальные 75% постэмбриональных нейробластов выходят из клеточного цикла в G2-фазу (Otsuki, Brand, 2018).
О молекулярных аспектах периода покоя известно не так много. Белок Tribbles предотвращает дальнейшее протекание клеточного цикла путем деградации некоторых белков, однако это показано только для клеток, вступающих в G2 покой (Otsuki, Brand, 2018). Кроме того, регулятор транскрипции Pros, о котором шла речь в разделе, посвященном асимметричному делению нейробластов, считается возможным ингибитором дальнейшей пролиферации. Об этом свидетельствует накопление данного белка в ядре в период покоя. Предполагается, что Pros действует как бинарный переключатель между нейробластом и ГМК: мишенями для Pros являются гены, участвующие в регуляции клеточного цикла нейробластов и дифференцировке нейронов (Harding, White, 2018). Однако вопрос о том, как именно один белок может вызывать либо дифференцировку, либо вступление в период покоя, пока остается открытым.
Выход нейробластов из периода покоя индуцируется началом питания личинки. Факторы, секретируемые клетками жирового тела личинок и необходимые для роста тела личинок (SunA, B и GBP), воздействуют на инсулинсекретирующие клетки мозга, приводя к выработке инсулиноподобных пептидов. Под действием этих пептидов глиальные клетки, в свою очередь, выделяют факторы, которые воздействуют на нейробласты, тем самым включая и поддерживая их рост и пролиферацию (Harding, White, 2018).
Апоптоз брюшных нейробластов. Нейробласты дрозофилы являются удобной моделью для исследования программируемой клеточной смерти. Стоит напомнить, что на первой волне деления каждый полусегмент эмбриона содержит примерно 30 нейробластов. Ко второй волне в ВНС остается по 23 нейробласта в каждом грудном полусегменте, 12 нейробластов в первых, 4 нейробласта во вторых и всего по 3 нейробласта в остальных брюшных полусегментах (Pinto-Teixeira et al., 2016). Остальные гибнут путем апоптоза. После второй волны деления все оставшиеся брюшные нейробласты также подвергаются апоптозу. Именно поэтому молекулярные механизмы клеточной гибели исследуются на этом типе нейробластов.
Программируемая смерть брюшных нейробластов запускается белком Abdominal-A (AbdA), относящемуся к числу продуктов генов семейства Hox, которые в зависимости от пространственного расположения нейробласта определяют его дальнейшую судьбу. Экспрессия гена, кодирующего этот белок, является результатом активации рецептора N лигандом Dl у глиальных потомков нейробластов. Таким образом, сами потомки нейробластов вызывают их апоптоз, гарантируя смерть только после того, как они образовали необходимое количество нейронов и клеток глии. Однако способность воспринимать сигнал, запускающий апоптоз, брюшные нейробласты приобретают только к концу эмбриогенеза (Pinto-Teixeira et al., 2016).
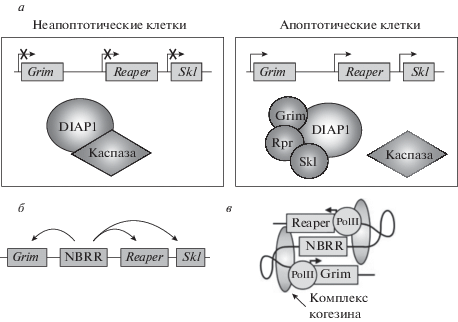
AbdA может связываться с энхансером NBRR (neuroblast regulatory region), располагающимся между генами rpr и grim. Благодаря когезинам, сближающим участки ДНК, происходит взаимодействие с промоторами генов reaper (rpr), grim и sickle (skl) и синтезируются белки, являющиеся членами семейства RHG (Reaper, Hid и Grim) – регуляторы апоптоза. В отсутствие экспрессии генов rpr, grim и skl каспазы, запускающие апоптотические реакции, ингибированы взаимодействием с белком DIAP1 (Drosophila Inhibitor of Apoptosis Protein). Соответственно, в апоптотических клетках происходит экспрессия белков RHG, которые связываются с DIAP1 и конкурентно вытесняют связанные с DIAP1 каспазы, приводя к их активации, а также способствуют увеличению оборота DIAP1 (рис. 10) (Arya et al., 2015; Harding, White, 2018).
Рис. 10.
Механизм апоптоза брюшных нейробластов дрозофилы. а – Гены RHG grim, reaper и skl неактивны в неапоптотических клетках, что позволяет DIAP1 связывать и ингибировать каспазы. Апоптоз индуцируется после активации транскрипции генов RHG. Связывание RHG с DIAP1 способствует его обороту и высвобождает каспазы. б – Межгенный энхансер NBRR необходим для апоптоза нейробластов и для экспрессии окружающих генов RHG. в – Модель регуляции генов RHG посредством ДНК-взаимодействий между промоторами NBRR и RHG, опосредованными когезиновыми комплексами (по Harding, White, 2018, Open Access).
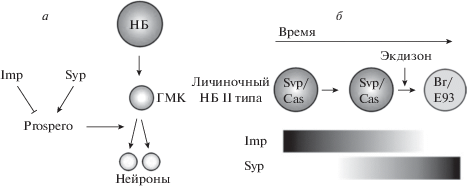
Терминальное деление нейробластов. В то время как эмбриональные и постэмбриональные брюшные нейробласты устраняются путем апоптоза, постэмбриональные грудные и головные нейробласты подвергаются терминальному делению в личиночной ЦНС. Их окончательное симметричное деление индуцируется накоплением в ядре Pros, что приводит к подавлению генов самообновления и способствует дифференцировке. Недавно было показано, что мРНК-связывающие белки IGF-II (Imp) и Syncrip (Syp) участвуют в регуляции накопления Pros в нейробластах ЦНС. В то время как Imp служит для ингибирования терминального деления в личиночной ЦНС, экспрессия Syp, напротив, не вызывает накопления белка Pros и раннего терминального деления. Паттерны экспрессии Imp и Syp меняются в зависимости от развития дрозофилы и зависят от наличия экдизона – стероидного гормона, который способствует метаморфозу (рис. 11) (Harding, White, 2018). Таким образом, терминальное деление нейробластов центрального мозга личинок обусловлено метаболическими изменениями в стволовых клетках. Выделение экдизона приводит к тому, что нейробласты лобных долей личинок подвергаются “усыханию”, когда каждое асимметричное деление сопровождается уменьшением объема нейробластов, точно так же, как это происходило на первой волне деления эмбриональных нейробластов. Однако вопрос, является ли уменьшение объема нейробластов на первой волне деления следствием ответа на экдизон, остается открытым.
Рис. 11.
Регуляция терминального деления нейробластов (НБ). а – РНК-связывающие белки Imp и Syp оказывают противоположные влияния на Prospero-опосредованное терминальное деление. Imp предотвращает выход из клеточного цикла, но Syp, как предполагается, способствует накоплению Pros. б – Экспрессия Imp и Syp коррелирует с развитием личинки и паттерном экспрессии генов в нейробластах, а также зависит от наличия экдизона. ГМК – ганглиозная материнская клетка (по Harding, White, 2018, Open Access).
ЗАКЛЮЧЕНИЕ
Нейробласты дрозофилы представляют большой интерес как объект для исследования нейрогенеза и для изучения асимметричного деления клеток. Представленная в данном обзоре информация наглядно демонстрирует неугасающий интерес к нейробластам как объекту для исследования нейрогенеза и асимметричного деления клеток. Каждый этап жизни нейробластов исследуется на молекулярном уровне, начиная от их миграции из эктодермы и заканчивая терминальным делением. Благодаря полученным данным мы теперь можем понять, как определяется дальнейшая судьба клетки и ее потомков в зависимости от пространственного положения в организме. Изучение апоптоза и терминального деления нейробластов позволяет понять, как регулируются процессы формирования нервной системы и в какой момент онтогенеза образование нейронов завершается. Эти знания открывают новые перспективы в генной инженерии и изучении работы центральной нервной системы в целом.
Следует подчеркнуть, что асимметричное деление нейробластов, молекулярные механизмы которого подробно освещены в обзоре, на сегодняшний день изучено преимущественно на уровне световой микроскопии. Детальное изучение митоза нейробластов на ультраструктурном уровне с использованием современных методов электронной микроскопии могло бы выявить новые детали асимметричного деления, скрытые от глаз исследователей при использовании световой микроскопии. Очевидно, что исследования нейробластов будут продолжаться.
Список литературы
Arya R., Sarkissian T., Tan Y., White K. 2015. Neural stem cell progeny regulate stem cell death in a Notch and Hox dependent manner. Cell Death Differ. 22 : 1378–1387.
Doe C.Q. 2017. Temporal patterning in the Drosophila CNS. Ann. Rev. Cell Dev. Biol. 33 : 219–240.
Harding K., White K. 2018. Drosophila as a model for developmental biology: Stem cell-fate decisions in the developing nervous system. J. Dev. Biol. 6. https://doi.org/10.3390/jdb6040025
Hartenstein V. 1993. Atlas of Drosophila development. N.Y.: Cold Spring Harb. Lab. Press. 57 p.
Hartenstein V., Campos-Ortega J.A. 1997. The embryonic development of Drosophila melanogaster. Berlin: Springer-Verlag. 405 p.
Hartenstein V., Wodarz A. 2013. Initial neurogenesis in Drosophila. Wiley Interdiscip. Rev. Dev. Biol. 2 : 701–721.
Homem C.C.F., Knoblich J.A. 2012. Drosophila neuroblasts: a model for stem cell biology. Development. 139 : 4297–4310.
Ito K., Hotta Y. 1992. Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster. Dev. Biol. 149 : 134–148.
Jiang Y., Reichert H. 2014. Drosophila neural stem cells in brain development and tumor formation. J. Neurogenet. 28 : 181–189.
Knoblich J.A. 2001. Asymmetric cell division during animal development. Nat. Rev. Mol. Cell Biol. 2 : 11–20.
Knoblich J.A., Jan L.Y., Nung J.Y. 1997. The N terminus of the Drosophila Numb protein directs membrane association and actin-dependent asymmetric localization. Proc. Natl. Acad. Sci. U.S.A. 94 : 13005–13010.
Kraut R., Chia W., Jan L.Y., Jan Y.N., Knoblich J.A. 1996. Role of inscuteable in orienting asymmetric cell divisions in Drosophila. Nature. 383 : 50–55.
Li S., Wang H., Groth C. 2014. Drosophila neuroblasts as a new model for the study of stem cell self-renewal and tumour formation. Biosci. Rep. 34 : 401–414.
Loesel R., Weigel S., Bräunig P. 2006. A simple fluorescent double staining method for distinguishing neuronal from non-neuronal cells in the insect central nervous system. J. Neurosci. Methods. 155 : 202–206.
Otsuki L., Brand A.H. 2018. Cell cycle heterogeneity directs the timing of neural stem cell activation from quiescence. Science. 360 : 99–102.
Pinto-Teixeira F., Konstantinides N., Desplan C. 2016. Programmed cell death acts at different stages of Drosophila neurodevelopment to shape the central nervous system. FEBS Lett. 590 : 2435–2453.
Prehoda K.E. 2009. Polarization of Drosophila neuroblasts during asymmetric division. Cold Spring Harb. Perspect. Biol. 1 : 1–13.
Sousa-Nunes R., Yee L.L., Gould A.P. 2011. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature. 471 : 508–512.
Yaghmaeian S.B., Monedero C.I., Rakar J., Bauer S., Curt J.R., Starkenberg A. 2018. Evolutionarily conserved anterior expansion of the central nervous system promoted by a common PcG-Hox program. Development. 145: dev160747.
Дополнительные материалы отсутствуют.
Инструменты
Цитология