Цитология, 2019, T. 61, № 8, стр. 658-671
Получение и характеристика линии мезенхимных стволовых клеток, выделенной из десны человека
А. М. Кольцова 1, В. В. Зенин 1, В. И. Турилова 1, Т. К. Яковлева 1, Г. Г. Полянская 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: poljansk@incras.ru
Поступила в редакцию 26.04.2019
После доработки 21.05.2019
Принята к публикации 22.05.2019
Аннотация
Получена и охарактеризована новая неиммортализованная клеточная линии из десны здорового донора 35 лет, названная MSC-GING. Анализ разных характеристик проводили на 6-, 7-, 13-, 18-, 20- и 23-м пассажах. В процессе длительного культивирования постепенно увеличивается доля стареющих клеток согласно активности β-галактозидазы. Эффективность клонирования клеток MSC-GING существенно уменьшается в процессе длительного культивирования. Кривые роста свидетельствуют об активной пролиферации клеточной линии на 6-м пассаже и значительном снижении индекса пролиферации к 18- и 20-му пассажам. Кариотипический анализ на 7- и 18-м пассажах показал наличие диплоидного числа хромосом (46) во всех метафазных пластинках. Но на 7-м пассаже доля клеток с нормальным диплоидным кариотипом 46, ХХ составляет 50 ± 5%, а в остальных клетках выявлена клональная перестройка – инверсия длинного плеча хромосомы 10, inv(10)(q21.1q25.1). Доля этих клеток существенно уменьшается при длительном культивировании до пассажа 18, тогда как доля клеток с нормальным диплоидным кариотипом возрастает. На пассажах 6 и 20 высока доля клеток, несущих поверхностные антигены, характерные для МСК человека: CD44, CD73, CD90, CD105, виментин и HLA-ABC. Выявлена крайне низкая частота клеток с антигенами CD34, CD45 и HLA-DR. Существенно отметить, что на пассажах 6 и 20 отсутствуют клетки, несущие маркеры недифференцированных эмбриональных стволовых клеток: Oct-4, SSEA-4 и SOX2. Показано, что клетки линии MSC-GING обладают способностью дифференцироваться в остеогенном и хондрогенном направлениях. Возможность дифференцироваться в адипогенном направлении проявилась только на уровне экспрессии гена glut4. Индукция нейрональной дифференцировки привела к увеличению уровня экспрессии гена nse – нейроспецифической элоназы. В целом, представленные результаты подтверждают статус МСК для полученной линии, но свидетельствуют о существенной кариотипической нестабильности на раннем пассаже, которая уменьшается в процессе репликативного старения.
В настоящее время мезенхимные стволовые клетки (МСК) широко используются для фундаментальных и прикладных биомедицинских исследований. Линии МСК человека, будучи неиммортализованными, диплоидными клеточными популяциями, являются удобной моделью для изучения биологических процессов, как в здоровом организме, так и при его патологических состояниях. Согласно требованиям Международного общества клеточной терапии, статус МСК разного происхождения определяется рядом характеристик (Dominici et al., 2006; Sensebé et al., 2010). Тем не менее, по характеристикам линий МСК, как определяющим их статус, так и по другим важнейшим для жизнедеятельности клеток, есть различия между клетками, выделенными из разных источников. В частности, обнаружены межлинейные различия по дифференцировочному потенциалу, по ростовым характеристикам, по характеру репликативного старения и по кариотипической нестабильности (Shih et al., 2005; Tomar et al., 2010; Yan et al., 2013; Yannarelli et al., 2013; Gao et al., 2014; Крылова и др., 2014; Boink et al., 2016; Subbarayan et al., 2017; Кольцова и др., 2018; Полянская, 2018). Причин наблюдающихся межлинейных различий может быть несколько: генетические и возрастные особенности доноров, разные условия выделения и культивирования клеточных популяций МСК. Существенной причиной являются особенности взаимодействия МСК с их уникальным микроокружением (нишей), характерным для определенной ткани, которое регулирует пролиферацию, выживаемость, миграцию, старение, дифференцировочный потенциал и другие клеточные свойства посредством межклеточных взаимодействий и различных биоактивных молекул (Gattazzo et al., 2014; Choi et al., 2015; Darnell et al., 2018; Нимирицкий и др., 2018; Niedernhofer et al., 2018). В связи с этим, а также учитывая генетическую уникальность каждой вновь полученной линии, представляется важным расширение спектра линий МСК человека.
Многие МСК, полученные из взрослых и эмбриональных тканей, имеют ограниченное применение из-за инвазивного способа их получения, малого количества выделяемых клеток в связи с невысоким пролиферативным потенциалом или этических проблем (Bongso, Fong, 2013). Поэтому большое внимание уделяется использованию тех источников, из которых выделение МСК не связано со специальными инвазивными способами получения клеток и с этическими проблемами. Известен ряд работ, посвященных получению и характеристикам МСК из внезародышевых тканей человека (Antonucci et al., 2011; Arutyunyan et al., 2016; Jeon et al., 2016; Savickiene et al., 2016; Кольцова и др., 2017; Крылова и др., 2017; Wu et al., 2018), из децидуального эндометрия (Kyurkchiev et al., 2010; Rossignoli et al., 2013; Sugawara et al., 2014). Также к неинвазивным способам можно отнести получение МСК из пульпы молочных зубов. Другими, менее удобными, источниками МСК могут быть постоянные зубы, окружающие их ткани и слизистые рта разной локализации, доступные для взятия клеточного материала в процессе стандартных стоматологических процедур при хирургическом вмешательстве (Gronthos et al., 2000; Huang et al., 2009; Estrela et al., 2011; Isobe et al., 2016; Aghajani et al., 2016; Кольцова и др., 2018; Wang et al., 2018; Xing et al., 2018). К таким тканям относится десна, являющаяся частью слизистой оболочки полости рта, покрывающая альвеолярные отростки челюстей и играющая важную роль в качестве слизистого барьера против постоянных механических повреждений и бактериальных инфекций ротовой полости. Соединительная ткань десны по эмбриональному происхождению относится к нервному гребню подобно зубной ткани. В ряде работ представлены характеристики МСК, выделенных из десны, а также проведен сравнительный анализ МСК, выделенных из других тканей ротовой полости (Zhang et al., 2009; Mitrano et al., 2010; Tang et al., 2011; Wang et al., 2011; Ge et al., 2012; Jin et al., 2015; Zhao et al., 2015; Fawzy El-Sayed et al., 2016; Venkatesh et al., 2017; Spagnuolo et al., 2018).
Неиммортализованные клеточные линии в процессе длительного культивирования, в отличие от иммортализованных, подвергаются репликативному старению, которое представляет собой сложный комплексный процесс (Wagner et al., 2008; Kuilman et al., 2010; Redaelli et al., 2012; Estrada et al., 2013; Savickiene et al., 2016; Truong et al., 2018; Yu et al., 2018). В связи с этим свойством диплоидных линий, представляется существенным проведение длительного культивирования МСК с целью изучения этого процесса в конкретной линии. Линии МСК могут различаться по характеру процесса репликативного старения (Кольцова и др., 2017; Alessio et al., 2018; Мусорина и др., 2019). Исследование репликативного старения диплоидных клеточных линий способствует расширению фундаментальных знаний о процессах, происходящих в клетках, а также вносит возрастные ограничения по использованию конкретной линии МСК в регенеративной медицине.
В настоящей работе поставлены следующие задачи: 1) выделение из ткани десны фибробластоподобных клеток; 2) анализ характеристик, подтверждающих статус МСК полученной линии на раннем 6-м пассаже; 3) сравнительный количественный анализ активности фермента β-галактозидазы, характеризующей процесс репликативного старения при длительном культивировании клеток; 4) анализ ростовых характеристик, кариотипической изменчивости, определение маркеров недифференцированных эмбриональных стволовых клеток (ЭСК) и дифференцировочного потенциала клеток при длительном культивировании; 5) Сравнение полученных характеристик между данной линией и ранее полученной линией MSC-DP (из пульпы зуба) в связи с их близким эмбриологическим происхождением и локализацией.
МАТЕРИАЛ И МЕТОДИКА
Выделение клеток. Использовали десну здорового взрослого донора 35 лет. Клетки получали механическим методом. Фрагмент ткани (≈3 мм3) разрезали на более мелкие кусочки (0.5–1 мм3), помещали в чашку Петри и придавливали предметным стеклом. Кусочки ткани культивировали в ростовой среде DMEM/F12 (Биолот, Россия), содержащей 10% эмбриональной бычьей сыворотки (HyClone, США) и раствор антибиотиков и антимикотика (Antibiotic Antimycotic Solution, Sigma, Израиль) в концентрации рекомендованной производителем, при 37°С, 5% СО2 в течение 2 нед. За время культивирования фибробластоподобные клетки мигрировали из толщи ткани и образовывали хорошо различимые зоны роста на поверхности культурального пластика. Пересев клеток осуществляли посредством обработки 0.25%-ным раствором трипсин-ЭДТА (Gibco, Великобритания).
На 4-м пассаже при отсутствии явных признаков контаминации бактериями и грибами в ростовую среду переставали добавлять раствор антибиотиков и антимикотика. Клетки длительно культивировали и получали разные характеристики на 6-, 7-, 13-, 18-, 20- и 23-м пассажах. Криоконсервировали клетки в кондиционированной среде, содержащей 10% криопротектора диметилсульфоксида (Биолот, Россия). Микробиологический анализ, проведенный через 10 пассажей после снятия клеток с антибиотиков и антимикотика, подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации.
Морфологический анализ линий проводили с помощью инвертированного микроскопа (NICON, Япония).
Репликативное старение клеток оценивали по активности фермента β-галактозидазы. Клетки выращивали в чашках Петри (3.5 мм, Nunc, Дания) до образования конфлюента. Затем среду удаляли и окрашивали клетки с помощью набора реактивов (Senescence β-galactosidase staining kit; Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу репликативного старения, цитоплазма приобретает ярко-синюю окраску. Анализ проводили с помощью инвертированного микроскопа (NICON, Япония) на 6-, 13-, 20- и 23-м пассажах. Долю окрашенных клеток (в %) определяли путем подсчета не менее 1000 клеток в разных полях зрения на одну временную точку.
Эффективность клонирования клеточной линии определяли в чашках Петри в условиях редкого пассажа (3–4 кл./см2). Через 14 сут клетки окрашивали 1%-м водным раствором кристалл-виолета и считали число колоний. Эффективность клонирования определяли в % по отношению числа выросших колоний (клонов) к числу посеянных клеток. Учитывали колонии, состоящие из не менее 20 клеток. Анализировали по 8 экспериментов на пассажах 6 и 20.
Характеристика пролиферативной активности. Оценивали индекс пролиферации – отношение числа клеток в текущий момент к исходному числу посеянных клеток и строили кривые роста клеточных популяций. Для измерения среднего времени удвоения клеточной популяции каждый экспериментальный вариант повторяли 3 раза, ежедневно считали клетки в течение 5–6 сут (120–144 ч). Среднее время одного удвоения клеточной популяции (ao) определяли по формуле (Седова, 2008):
где Mt – число клеток в момент времени t; Mo – начальное число клеток; t – время логарифмической фазы роста клеточной культуры. Анализировали пассажи 6 и 25.Кариотипический анализ проводили на 7- и 18-м пассажах. Для получения препаратов метафазных хромосом за 3 ч до фиксации клеток в среду вводили демеколцин (10 мкг/мл; Sigma, Великобритания), клетки диссоциировали с помощью 0.25%-ного раствора трипсин-ЭДТА (Gibco, Англия) и проводили гипотоническую обработку смесью 0.075 М раствора КСl и 1%-го раствора цитрата натрия (1 : 1). Клетки фиксировали смесью метанола с ледяной уксусной кислотой (3 : 1) (Реактив, Россия). Для кариотипического анализа проводили дифференциальное G-окрашивание хромосом в соответствии с ранее описанной методикой (Ozkinay, Mitelman, 1979). Анализировали 100 метафаз на каждом пассаже. Количество полиплоидов определяли при подсчете 1000 клеток в каждом варианте. Kариотип линии анализировали с помощью микроскопа Axio Imager.M1 (Carl Zeiss, Германия) с системой автоматического кариотипирования Ikaros 4 karyotyping system (MetaSystems, ФРГ) и описывали в соответствии с Международной системой цитогенетической номенклатуры хромосом человека ISCN (Shaffer et al., 2013).
Определение статуса полученной клеточной линии . Анализировали экспрессию поверхностных антигенов с помощью проточной цитофлуориметрии. Экспрессию каждого маркера оценивали по результатам 3 экспериментов для клеток, находящихся на 7- и 20-м пассажах. Иммунофенотипирование проводили с помощью панели конъюгатов CD-маркерных моноклональных антител с флуорохромами. В работе использовали моноклональные антитела против CD34, CD45, HLA-ABC и HLA-DR (Caltac, США), CD44, CD73, CD105 (Beckman Coulter, США), СD90 (BD Pharmingen, США). В качестве негативного контроля использовали очищенные мышиные антитела IgG1/Fitc и IgG1/RFE (DAKO, Дания). Клетки снимали с поверхности чашки с помощью 0.05%-ного раствора трипсина-ЭДТА (Gibco, США) и отмывали от него солевым буферным раствором РВS, не содержащим ионов Са2+ и Mg2+ (Биолот, Россия). Полученную суспензию клеток (1 млн/мл) в РВS делили на пробы по 10 мкл, добавляли к каждой из них по 2 мкл антител и инкубировали при 4°С в течение 30 мин. Далее пробы доводили до оптимального объема (0.1 мл) с помощью Stain Buffer (BD Pharmingen, США). Пробы анализировали на проточном цитофлуориметре Beckman Coulter (США).
Иммунофлуоресцентный анализ. Экспрессию маркеров ранней дифференцировки ЭСК в производные 3-х зародышевых листков оценивали с помощью антител к α-актинину (тест на мезодерму), α-фетопротеину (тест на энтодерму) (Sigma, США) и нестину (тест на эктодерму) (Santa Cruz, США). Для экспрессии маркера недифференцированных ЭСК использовали антитела против транскрипционного фактора OCT-4 и поверхностного маркера SSEA-4 (Santa Cruz, США). Клетки фиксировали 4%-ным раствором параформальдегида в течение 20 мин при комнатной температуре, блокировали 1%-ным раствором бычьего сывороточного альбумина (BSA; Sigma, ФРГ) в течение 1 ч. Пермеабилизацию проводили 0.1%-ным раствором тритона Х-100 в течение 15 мин при комнатной температуре. Далее все клетки инкубировали с первыми антителами в течение ночи при 4°С. Вторые антитела (Alexa Fluor 488; Life technologies, США) разводили в соотношении 1 : 500 и инкубировали с ними препараты в течение 1 ч в темноте при комнатной температуре. В качестве отрицательного контроля использовали клетки, окрашенные только вторыми антителами. Визуализацию проводили с помощью микроскопа Olimpus FV3000 (Япония). Анализ проводили на 6-м пассаже.
Для количественной оценки SOX2 – маркера недифференцированных ЭСК, а также виментина, используемого для подтверждения статуса МСК, суспензию клеток последовательно фиксировали, пермеабилизовали и инкубировали сначала с соответствующими первыми, а потом со вторыми FITC-конъюгированными антителами (Sigma, Германия) и анализировали методом проточной цитофлуориметрии.
Подтверждение статуса МСК. Для этого проводили индукцию остеогенной, адипогенной и хондрогенной дифференцировки по модифицированному методу (Reyes et al., 2001). Клетки (10 тыс. кл./см2) высевали в остеогенную и адипогенную дифференцировочные среды (HyClone Thermo Scientific Hy-Clone Product, США). Хондрогенную дифференцировку проводили в культуре микромасс в хондрогенной дифференцировочной среде (HyClone Thermo Scientific HyClone Product, США). Индукцию проводили в течение 3-х нед, меняя среду каждые 3–4 сут.
Идентификацию хондрогенной дифференцировки проводили с помощью окрашивания 1%-ным раствором толуидинового синего в 50%-ном изопропаноле, или 0.1%-ным водным раствором сафранина О, или 1%-ным раствором альцианового синего в 3%-ной уксусной кислоте (Sigma, США). Время окраски составляло 30 мин при комнатной температуре для всех красителей.
Для идентификации остеогенной дифференцировки использовали реакцию Вон Косса. Для этого клетки фиксировали 2 мин в метаноле при −20°С и окрашивали 2%-ным раствором нитрата серебра (AgNO3) (Вектон, Россия) в течение 1 ч под лампой мощностью 60 Вт. Окрашенные клетки промывали дистиллированной водой и помещали на 5 мин в 2.5%-ный раствор тиосульфата натрия. Затем клетки снова промывали водой и заливали 70%-ным глицерином.
Кроме того, анализировали наличие в клетках активности фермента щелочной фосфатазы. Клетки фиксировали 4%-ным раствором параформальдегида в течение 20 мин при комнатной температуре и окрашивали раствором BCIP/NBT Liquide substrate System (Sigma, США) в течение 30 мин при 37°С.
Для идентификации адипогенной дифференцировки клетки промывали PBS без ионов Ca2+ и Mg2+, фиксировали в метаноле в течение 2 мин при −20°С. Фиксированные клетки промывали 50%-ным этанолом и окрашивали красным масляным (Oil Red O) в течение 10 мин. Окрашенные клетки промывали 50%-ным этанолом, затем дистиллированной водой и заливали 70%-ным глицерином. Наличие адипогенной дифференцировки анализировали также методом ОТ-ПЦР по экспрессии glut4 – гена транспортера глюкозы.
Для индукции нейрональной дифференцировки клетки высевали на чашки Петри и при достижении ими конфлюента ростовую среду меняли на индукционную: DMEM (Биолот, Россия), содержащая 10% фетальной бычьей сыворотки (HyClone, США), 1 мкмоль/л ретиноевой кислоты (Sigma-Aldrich, США), по 20 мкг/л ростовых факторов bFGF (Gibco, ThermoFisher, США) и hEGF (Sigma-Aldrich, США). Клетки культивировали в течение 4 сут, а затем анализировали экспрессию гена нейрональной дифференцировки nse (нейроспецифическая элоназа) методом ОТ-ПЦР.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Ген транспортера глюкозы glut4 специфичен для адипогенных клеток, ген цитоплазматического белка нейроспецифической элоназы nse – для нейронов. Для анализа экспрессии генов glut4 и nse методом ОТ-ПЦР из клеток выделяли тотальную РНК при помощи TRIzol® Reagent (Invitrogen, США) по протоколу, рекомендованному производителем. Все образцы обрабатывали ДНКазой (Fermentas, Thermo Scientific, Литва) Для синтеза к-ДНК использовали 0.5 мкг тотальной РНК на пробу, ревертазу RevertAid M-MuLV и случайные олигонуклеотидные последовательности (Fermentas, Thermo Scientific, Литва). Пробы для ПЦР готовили в соответствии с протоколом производителя Taq ДНК-полимеразы (Fermentas, Thermo Scientific, Литва). Использовали специфические праймеры следующих последовательностей: для nse прямой 5'-AAGGACAAATACGGCAAGGA-3' и обратный 5'-TGGACCAGGCAGCCCAATC-3'; для glut-4 прямой 5'-GGCATGTGTGGCTGTGCCATC-3' и обратный 5'‑GGGTTTCACCTCCTGCTCTAA-3'; для β-актина прямой 5'-AATCTGGCACCACACCTTCTACA-3' и обратный 5'-GACGTAGCACAGCTTCTCCTTA-3'. Температура отжига праймеров была адаптирована к оптимальным условиям ПЦР для каждой используемой пары. ПЦР-анализ экспрессии генов проводили на амплификаторе T100 (BioRad, Сингапур). ПЦР-продукт разделяли методом электрофореза в 2%-ном агарозном геле.
Результаты обрабатывали статистически с использованием t-критерия Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате культивирования в течение 6 пассажей получена линия фибробластоподобных клеток, названная (согласно источнику получения из ткани десны) MSC-GING. Морфологический анализ этой линии показал однородность клеточной популяции, представленной средними по размеру вытянутыми фибробластоподобными клетками (рис. 1).
Рис. 1.
Морфология клеток линии MSC-GING на пассажах 6 и 20. Прижизненные фотографии. Инвертированный световой микроскоп Nicon Eclipse TS100, Япония. Масштабная линейка: 200 мкм.
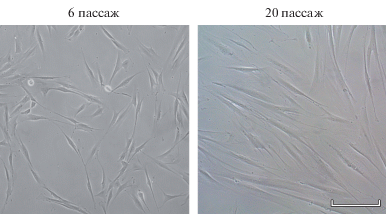
Процесс репликативного старения при длительном культивировании клеток (пассажи 6–23). Старение клеток MSC-GING оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1). На 6-м пассаже обнаружена совсем небольшая доля стареющих клеток. Далее наблюдается ее постепенное увеличение, которое к пассажу 23 достигает 93.9%. Кроме усиления активности β-галактозидазы в клеточной популяции к 23-му пассажу, существенно изменяется и морфология клеток, выражающаяся в увеличении размеров и степени их распластанности, а также в появлении дебриса, что свидетельствует об активном репликативном старении (рис. 1).
Таблица 1.
Доля клеток MSC-GING (%) с выраженной активностью β-галактозидазы (β-гал) в процессе культивирования
| Пассаж | Число клеток | Доля окрашенных на β-гал, % |
|---|---|---|
| 6 | 1205 | 4.4 ± 0.6 |
| 13 | 1105 | 18.5 ± 1.2 |
| 20 | 1585 | 51.7 ± 1.2 |
| 23 | 1225 | 93.9 ± 0.7 |
Ростовые характеристики. Эффективность клонирования клеток MSC-GING на 6-м пассаже составляет 30.8 ± 2.0%. На 20-м пассаже она значительно снижена и составляет 7.0 ± 1.3% (Р < 0.01). Ранее полученные результаты по анализу клоногенной активности в МСК разного происхождения свидетельствуют о ее больших колебаниях между разными линиями и о существенном снижении этой активности на поздних пассажах (Lo Surdo et al., 2013; Szepesi et al., 2016; Кольцова и др., 2018; Крылова и др., 2018; Мусорина и др., 2019). Тем не менее, клоногенная активность в близких по происхождению МСК (пульпа молочного зуба и десна) показывают близкие значения эффективности клонирования как на ранних, так и на поздних пассажах (Кольцова и др., 2018).
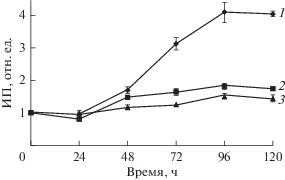
Характеристика пролиферативной активности клеток MSC-GING в процессе длительного культивирования свидетельствуют об активном делении клеток на 6-м пассаже и значительном снижении индекса пролиферации (ИП) к пассажам 18 и 20 (рис. 2). На пассаже 6 увеличение ИП начинается на 2-е сут и существенно увеличивается в течение 96 ч, а далее снижается. Логарифмическая фаза роста составляет 72 ч. Среднее время одного удвоения клеточной популяции составляет 35.70 ± 2.07 ч. На 18- и 20-м пассажах, когда идут процессы активного репликативного старения, время логарифмической фазы сокращается и составляет 24 ч. При культивировании в течение 96 ч величина ИП увеличивается, а затем снижается (рис. 2). Среднее время одного удвоения клеточной популяции на 18-м пассаже увеличивается по сравнению с пассажем 6 и составляет 43.5 ± 1.3 ч (Р < 0.05). На 20-м пассаже ИП снижается по сравнению с пассажем 18 и не удваивается в процессе культивирования в течение 96 ч. ИП достигает максимума при культивировании 96 ч и составляет для 6-, 18- и 20-го пассажей соответственно 4.11 ± 0.31, 1.85 ± 0.05 и 1.54 ± 0.06. Следовательно, ИП снижается в процессе культивирования в 2.7 раза.
Таким образом, наша работа показывает, что в процессе длительного культивирования наступает репликативное старение: существенно снижается эффективность клонирования и ИП (рис.2), значительно увеличиваются размеры клеток и их распластанность, появляется дебрис (рис. 1), увеличивается доля клеток с выраженной активностью β-галактозидазы (табл. 1). В целом, полученные результаты подтверждают ограниченный срок жизни клеток линии MSC-GING, характерный для неиммортализованных клеточных популяций (Hayflick, 1965; Matsumura et al., 1979; Bonab et al., 2006).
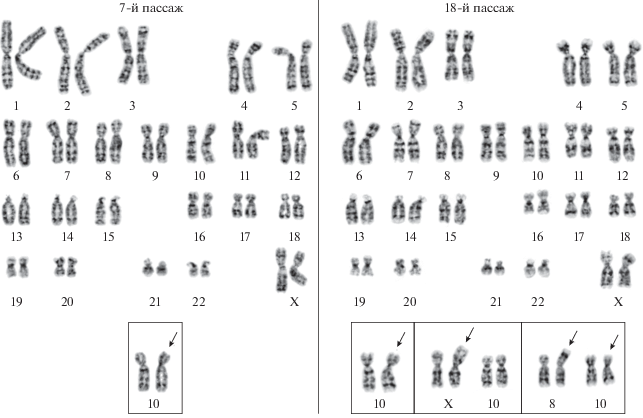
Кариотипический анализ. Анализировали клетки MSC-GING на пассажах 7 и 18. Все проанализированные метафазы имеют диплоидный кариотип человека 46, ХХ. На пассаже 7доля клеток с нормальным диплоидным кариотипом составляет 50.0 ± ± 5.0%. В остальных клетках выявлена клональная перестройка – инверсия длинного плеча хромосомы 10: inv(10)(pter → q21.1::q25.1 → q21.1::q25.1 → qter) (кратко: inv(10)(q21.1q25.1)). Доля этих клеток составила также 50.0 ± 5.0% (рис. 3). Доля полиплоидных клеток составила 1.4 ± 0.4%. На 18-м пассаже по сравнению с пассажем 7 доля клеток с нормальным диплоидным кариотипом увеличилась 76.0 ± 4.3% (Р < 0.01). А доля клеток с инверсией хромосомы 10, inv(10)(q11.2 ~ 21q25) значительно уменьшилась и составила 22.0 ± 4.1% (Р < 0.01). Кроме того, обнаружены две клетки с неклональными структурными изменениями хромосом. Так, в клетке с неизмененной хромосомой 10 выявлена перестройка короткого плеча хромосомы X, add(X)(p22.3), а в клетке с инверсией длинного плеча хромосомы 10 – перестройка короткого плеча хромосомы 8, add(8)(p23) (рис. 3). Доля полиплоидных клеток в популяции уменьшилась по сравнению с пассажем 6 и составляла 0.5 ± 0.2% (Р < 0.05).
Рис. 3.
Кариотипы клеточной линии MSC-GING на 7- и 18-м пассажах.
7-й пассаж, врезка – Клональная перестройка, инверсия длинного плеча хромосомы 10, inv(10)(q11.2 ~ 21q25). 18-й пассаж, врезка – Клональная перестройка, инверсия длинного плеча хромосомы 10, inv(10)(q11.2 ~ 21q25); перестройка короткого плеча хромосомы X, add(X)(?::p22.3 → qter), в клетке с неизмененной хромосомой 10; перестройка короткого плеча хромосомы 8, add(8)(?::p23 → qter) в клетке с инверсией длинного плеча хромосомы 10, inv(10)(q11.2 ~ 21q25). Стрелками указаны структурно перестроенные хромосомы.
Проведенный кариотипический анализ свидетельствует о том, что длительное культивирование, учитывая и репликативное старение, способствует уменьшению кариотипической гетерогенности (снижение доли клеток с клональной перестройкой и снижение уровня полиплоидии). Эти результаты означают, по-видимому, что обнаруженные кариотипические изменения не являются адаптивно выгодными для клеточной популяции в условиях in vitro и не связаны с возможной иммортализацией МСК при дальнейшем культивировании. Подобные данные были получены ранее на других МСК (Tarte et al., 2010; Redaelli et al., 2012; Zaman et al., 2014; Kim et al., 2015; Кольцова и др., 2017, 2018; Мусорина и др., 2019).
Тем не менее, вновь полученная линия MSC-GING имеет высокую частоту клеток с клональной хромосомной перестройкой, что превышает уровень кариотипической нестабильности, согласно требованиям Международного общество клеточной терапии и Рабочей группы по клеточным продуктам (Meisner, Johnson, 2008; Shaffer et al., 2013; Barkholt et al., 2013). Таким образом, данная линия может быть интересна для фундаментальных исследований, но использование ее для прикладных биомедицинских работ опасно. В связи с полученными нестандартными данными по кариотипической стабильности клеточной линии встал вопрос, не являются ли эти результаты случайными, возникшими в конкретной исследуемой клеточной популяции. С целью уточнения этих данных, был проведен повторный кариотипический анализ другой клеточной популяции полученной линии на 7-м пассаже. В результате анализа 110 клеток было подтверждено наличие инверсии хромосомы 10, inv(10)(q11.2 ~ 21q25) с частотой 40.0 ± 4.6%, что не отличается от данных предыдущего анализа: 50.0 ± 5.0% (Р > 0.05). Таким образом, обнаруженная инверсия является реальной кариотипической характеристикой линии MSC-GING.
Подтверждение статуса МСК клеток MSC-GING. Анализировали поверхностные маркеры, характерные для МСК, с помощью проточной цитофлуориметрии. Анализ подтвердил наличие статуса МСК для этой линии (табл. 2). На пассажах 6 и 20 показана высокая доля клеток, несущих поверхностные антигены, характерные для МСК человека: CD44, CD73, CD90, CD105, виментин и HLA-ABC. Выявлена крайне низкая частота клеток с антигенами CD34, CD45 и HLA-DR. Таким образом, согласно требованиям Международного общества клеточной терапии (Domonici et al., 2006; Sensebé et al., 2010), для линии MSC-GING подтвержден статус МСК. Существенно отметить, что на 6- и 20-м пассажах отсутствуют клетки, несущие маркеры недифференцированных ЭСК: SSEA-4 и OCT-4, проанализированные с помощью иммунофлуоресцентного анализа (данные не представлены) и маркер SOX2, проанализированный с помощью проточной цитофлуориметрии (табл. 2).
Таблица 2.
Доля клеток MSC-GING (%), несущих разные поверхностные маркеры
| Маркер | Пассаж | |
|---|---|---|
| 6 | 20 | |
| CD44 | 100.00 ± 0.04 | 98.80 ± 0.80 |
| CD73 | 99.98 ± 0.02 | 98.32 ± 1.15 |
| CD90 | 99.98 ± 0.02 | 99.90 ± 0.10 |
| CD105 | 99.63 ± 0.28 | 97.66 ± 1.04 |
| Виментин | 78.74 ± 2.42 | 64.36 ± 2.57 |
| CD34 | 0.02 ± 0.02 | 0.07 ± 0.04 |
| CD45 | 1.08 ± 0.96 | 0.79 ± 0.28 |
| HLA-ABC | 99.95 ± 0.02 | 88.11 ± 3.20 |
| HLA-DR | 0.62 ± 0.27 | 0.24 ± 0.24 |
| SOX2 | 0.27 ± 0.23 | 0.94 ± 0.10 |
К настоящему времени получено много экспериментальных данных, включая и наши собственные результаты, подтверждающие наличие разных маркеров недифференцированных ЭСК в линиях МСК разного происхождения. Тем не менее, из результатов настоящей и предыдущей (Кольцова и др., 2018) работ следует, что МСК, полученные из тканей десны и зуба, имеющих общее эмбриональное происхождение (нервный гребень), сходны по наличию этих маркеров. Так, в линии МСК, выделенной из пульпы зуба MSC-DP имеет место невысокая доля клеток, несущих SSEA-4 на раннем пассаже, которая исчезает на позднем пассаже. А в линии MSC-GING и на раннем, а на позднем пассажах такие клетки отсутствуют. Клетки с маркером SOX2 отсутствуют как на раннем, так и на позднем пассажах в обеих линиях. В настоящее время полученные экспериментальные результаты позволяют предположить, что МСК, несущие эти маркеры, имеют более высокую пролиферативную активность и повышенный дифференцировочный потенциал (Gang et al., 2007; Park et al., 2012; Wu et al., 2013; Aghajani et al., 2016; Matic et al., 2016). Тем не менее, в наших исследованиях по этим двум линиям не отмечено существенного снижения ростовых характеристик и дифференцировочного потенциала по сравнению с линиями, имеющими значительное проявление этих маркеров.
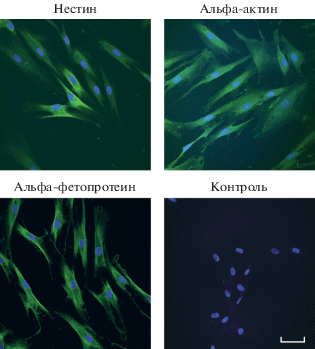
Как и в предыдущих работах, с помощью иммунофлуоресцентного анализа показано присутствие маркеров ранней дифференцировки ЭСК в производные трех зародышевых листков: альфа-актинина (маркера мезодермы), альфа-фетопротеина (маркера энтодермы) и нестина (маркера эктодермы) (рис. 4). До сих пор нет ясности в их функциональной роли в МСК. Есть разные предположения противоположного характера о функциональной роли этих маркеров: либо эти маркеры связаны с дифференцировочной пластичностью МСК, либо они связаны исключительно с эмбриональным происхождением МСК (Riekstina et al., 2009; Sensebé et al., 2010).
Рис. 4.
Идентификация маркеров ранней дифференцировки эмбриональных стволовых клеток в клетках линии MSC-GING по флуоресценции соответствующих моноклональных антител. Пассаж 6. Показаны маркеры эктодермы (нестин), мезодермы (альфа-актинин) и энтодермы (альфа-фетопротеин). Масштабная линейка: 50 мкм.
Остеогенная, хондрогенная и адипогенная дифференцировка. Индукция дифференцировки клеток MSC-GING выявила их способность формировать хрящевую и костную ткань. Культивирование клеток в хондрогенной среде приводило к образованию структур, которые выявляются с помощью окрашивания толуидиновым синим (идентификация сульфатированных гликозаминогликанов), сафранином (идентификация протеогликанов), и альциановым синим (идентификация кислых гликозаминогликанов). Культивирование клеток в остеогенной среде способствовало формированию минеральных комплексов. Использование реакции Вон Косса позволило выявить нерастворимые соли кальция в межклеточном пространстве. Остеогенная дифференцировка идентифицировалась и по активности фермента щелочной фосфатазы, которая при взаимодействии со специфичным субстратом проявилась в виде темно-фиолетовой окраски клеток (рис. 5). Но культивирование клеток в адипогенной среде не способствовало образованию кластеров адипоцитов, выявляемых с помощью окрашивания красителем масляным красным (рис. 5). Не было выявлено различий по интенсивности хондрогенной и остеогенной дифференцировок между пассажами 6 и 20. Не было выявлено также и окраски масляным красным на этих пассажах (данные по пассажу 20 не представлены).
Рис. 5.
Идентификация дифференцировки клеток линии MSC-GING на 6-ом пассаже в следующих направлениях: адипогенном (окрашивание жировых включений масляным красным), остеогенном (реакция Вон Косса на нерастворимые соли кальция в межклеточном пространстве и окраска на активность щелочной фосфатазы) и хондрогенном (окрашивание сульфатированных гликозаминогликанов толуидиновым синим, кислых гликозаминогликанов – альциановым синим и протеогликанов – сафранином О). Масштабная линейка: 100 мкм.
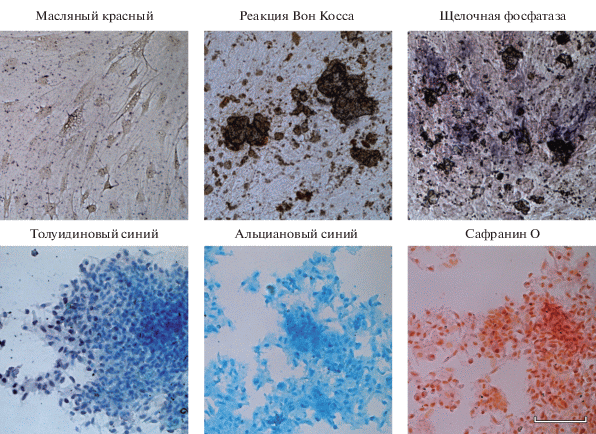
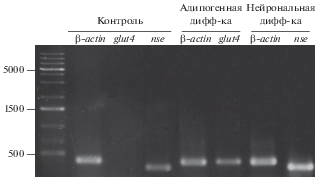
Полученные в настоящей работе данные об отсутствии адипогенной дифференцировки в клетках MSC-GING, выделенной из десны, выявляемой с помощью окрашивания Oil Red O, заслуживают внимания в связи с тем, что соединительная ткань десны по эмбриональному происхождению относится к нервному гребню, подобно зубной ткани. Данные по наличию адипогенной дифференцировки в МСК, выделенных из мягких тканей зубов противоречивы. Есть результаты, свидетельствующие о наличии этой дифференцировки. Но есть и работы, показывающие отсутствие адипогенной дифференцировки в стволовых клетках, выделенных из разных отделов зубной ткани, выявляемой с помощью окрашивания масляным красным (Zhang et al., 2006; Sonoyama et al., 2008). В нашей предыдущей работе также было показано отсутствие адипогенной дифференцировки в МСК из пульпы молочного зуба (Кольцова и др., 2018). Тем не менее, ОТ-ПЦР-анализ клеток MSC-GING на 21-е сут дифференцировки показал присутствие транскрипционной активности гена транспортера глюкозы glut4, участвующего в адипогенезе (рис. 6), в отличие от контрольных клеток, не подвергавшихся дифференцировке, у которых отсутствовала транскрипционная активность этого гена (Кольцова и др., 2018).
Рис. 6.
Анализ экспрессии генов glut4 (транспортера глюкозы – маркера адипогенной дифференцировки) и nse (нейроспецифической элоназы – маркера нейрональной дифференцировки) в клетках MSC-GING при их индукции. Метод ОТ-ПЦР. Контроль – недифференцированные клетки. β-actin – контрольный ген общего метаболизма. Слева – маркеры мол. массы (пары оснований).
Таким образом, клетки линии MSC-GING более склонны к адипогенной дифференцировке, чем клетки линии MSC-DP, где отсутствует транскрипция гена glut4. Тем не менее, в обоих случаях не обнаружено формирование жировых капель. Косвенно эти результаты согласуются с другими, показавшими, что в МСК из пульпы зуба отсутствует адипогенная дифференцировка, тогда как в МСК из десны она есть (Monterubbianesi et al., 2019). Таким образом, у МСК одного происхождения могут различаться свойства, в частности дифференцировочный потенциал. Эти различия могут быть связаны с различным микроокружением, в котором находятся клетки в процессе онтогенеза. Есть данные об отрицательной корреляции между наличием адипогенной и остеогенной дифференцировки. Показано, что внешние факторы и сигнальные клеточные процессы, контролирующие транскрипционные события, включающие гены адипогенной и остеогенной дифференцировки, могут влиять на адипо-остеогенный баланс (Сhen et al., 2016; Dastgurdi et al., 2018; Li et al., 2018). Возможно, что в МСК ткани десны, так же как и зубной ткани при активной дифференцировке в остеогенном направлении, адипогенная дифференцировка может быть подавлена.
Учитывая данные литературы о существовании в МСК зубной ткани и, в частности, в линии MSC-DP (Кольцова и др., 2018) повышенного потенциала к нейрональной дифференцировке, которая связана с ее онтогенетическим происхождением и, соответственно, с ее изначальным микроокружением, мы провели исследование, подтверждающее наличие этого потенциала и в линии MSC-GING. Так, с помощью ОT-ПЦР-анализа мы показали наличие экспрессия гена nse, участвующего в нейрональной дифференцировке (рис. 6).
Таким образом, линия MSC-GING в целом, согласно полученным характеристикам, включая мультипотентный дифференцировочный потенциал, соответствует статусу МСК, но, согласно кариотипическому анализу, имеет повышенный уровень геномной нестабильности.
Список литературы
Кольцова А.М. Крылова Т.А., Мусорина А. С., Зенин В. В., Турилова В. И., Яковлева Т. К., Полянская Г.Г. 2017. Динамика свойств двух линий мезенхимных стволовых клеток, полученных из Вартонова студня пупочного канатика человека, при длительном культивировании. Цитология. 59(9) : 574–587. (Koltsova A.M., Krylova T.A., Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2017. Dynamics properties of two lines of mesenchymal stem cells, derived from the Wharton’ jelly of the human umbilical cord, during long-term cultivation. Tsitologiya. 59(9) : 574–587.)
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и характеристика линии мезенхимных стволовых клеток, выделенных из пульпы молочного зуба человека. Цитология. 60(12) : 955–968. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and characterization of mesenchymal stem cell line, isolated from human pulp of a deciduous tooth. Tsitologiya. 60(12) : 955–968.)
Крылова Т.А., Кольцова А.М., Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2017. Характеристика двух линий мезенхимных стволовых клеток, полученных из Вартонова студня пупочного канатика человека. Цитология. 59(5) : 315–327. (Krylova T.A., Koltsova A.M., Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2017. Derivation and characteristic of two lines of human mesenchymal stem cells, generated from the Wharton’s jelly of the human umbilical cord. Tsitologiya. 59(5) : 315–327).
Крылова Т.А., Мусорина А.С., Зенин В.В., Яковлева Т.К., Полянская Г.Г. 2014. Сравнительные характеристики линий мезенхимных стволовых клеток, полученных из костного мозга и мышцы конечности раннего эмбриона человека. Цитология. 56(8) : 562–573. (Krylova T.A., Musorina A.S., Zenin V.V., Yakovleva T.K., Poljanskaya G.G. 2014. Comparative characteristics of mesenchymal stem cells lines derived from bone marrow and muscle of limb of early human embryo. Tsitologiya. 56(8) : 562–573).
Крылова Т.А., Мусорина А.С., Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и сравнительная характеристика линий мезенхимных стволовых клеток, полученных из крайней плоти двух доноров одного возраста. Цитология. 60(4) : 262–272. (Krylova T.A., Musorina A.S., Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and comparative characterization of mesenchymal stem cell lines isolated from foreskin of two donors of the same age. Tsitologiya. 60(4) : 262–272.)
Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2019. Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека. Цитология. 61(4) : 272–285. (Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. The characterization of non-immortalized mesenchymal stem cell line, isolated from human epicardial adipose tissue. Tsitologiya. 61(4) : 272 – 285).
Нимирицкий П.П., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И., Ткачук В.А. 2018. Ниша стволовой клетки. Цитология. 60(8) : 575–586. (Nimiritsky P.P., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I., Tkachuk V.A. 2018. The stem cell niche. Tsitologiya. 60(8) : 575–586).
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). В кн.: Клеточные культуры. 34 : 3–18. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates (review). In: Collection “Cell cultures”. 34 : 3–18).
Седова Г.П. 2008. Количественные аспекты злокачественного роста. Математическая морфология. Электронный математический и медико-биологический журнал. 7(2). URL: Http://www.smolensk.ru/user/sgma/mmorph/ n-18-html/cont.htm. (Sedova G.P. 2008. Quantitative aspects of malignant body height. Mathematical morphology. Electronic Math. Medicobiol. J. 7(2). URL: Http://www.smolensk.ru/user/sgma/mmorph/n-18-html/cont.htm.)
Aghajani F., Hooshmand T., Khanmohammadi M., Khanjani S., Edalatkhah H., Zarnani A.H., Kazemnejad S. 2016. Comparative Immunophenotypic Characteristics, Proliferative Features, and Osteogenic Differentiation of Stem Cells Isolated from Human Permanent and Deciduous Teeth with Bone Marrow. Mol. Biotechnol. 58 : 415–427.
Alessio N., Pipino C., Mandatori D., Di Tomo P., Ferone A., Marchiso M., Melone M.A.B., Peluso G., Pandolfi A., Galderisi U. 2018. Mesenchymal stromal cells from amniotic fluid are less prone to senescence compared to those obtained from bone marrow: An in vitro study. J. Cell Physiol. https://doi.org/10.1002/jcp.26845
Antonucci I., Stuppia L., Kaneko Y., Yu S., Tajiri N., Bae E.C., Chheda S.H., Weinbren N.L., Borlongan C.V. 2011. Amniotic fluid as rich source of mesenchymal stromal cells for transplantation therapy. Cell Transplant. 20 : 789–795.
Arutyunyan I., Elchaninov A., Makarov A., Fatkhudinov T. 2016. Umbilical cord as prospective source for mesenchymal stem cell-based therapy. Stem Cells Int. 2016 : 6901286. https://doi.org/10.1155/2016/6901286
Barkholt L., Flory E., Jekerle V., Lucas-Samuel S., Ahnert P., Bisset L., Büscher D., Fibbe W., Foussat A., Kwa M., Lantz O., Mačiulaitis R., Palomäki T., Schneider C.K., Sensebé L., Tachdjian G., Tarte K., Tosca L., Salmikangas P. 2013. Risk of tumorigenicity in mesenchymal stromal cell-based therapies–bridging scientific observations and regulatory viewpoints. Cytother. 15 : 753–759.
Boink M.A, van den Broek L.J., Roffel S., Nazmi K., Bolscher J.G., Gefen A., Veerman E.C., Gibbs S. 2016. Different wound healing properties of dermis, adipose, and gingiva mesenchymal stromal cells. Wound Repair Regen. 24 : 100–109.
Bonab M.M., Alimoghaddam K., Talebian F., Ghaffari S.H., Ghavamzadeh A., Nikbin B. 2006. Aging of mesenchymal stem cell in vitro. BMC Cell Biol. 7 : 14.
Bongso A., Fong C.Y. 2013. The therapeutic potential, challenges and future clinical directions of stem cells from the Wharton’s jelly of the human umbilical cord. Stem Cell Rev. 9 : 226–240.
Chen Q., Shou P., Zheng C., Jiang M., Cao G., Yang Q., Cao J., Xie N., Velletri T., Zhang X., Xu C., Zhang L., Yang H., Hou J., Wang Y., Shi Y. 2016. Fate decision of mesenchymal stem cells: Adipocytes or osteoblasts? Cell Death Differ. 23 : 1128–1139.
Choi J.S., Lee B.J., Park H.Y., Song J.S., Shin S.C., Lee J.C., Wang S.G., Jung J.S. 2015. Effects of donor age, long-term passage culture, and cryopreservation on tonsil-derived mesenchymal stem cells. Cell Physiol. Biochem. 36 : 85–99.
Dastgurdi E.M., Ejeian F., Nematollahi M., Motaghi A., Nasr-Esfahani M.H. 2018. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. 93 : 74–79.
Darnell M., O’Neil A., Mao A., Gu L., Rubin L.L., Mooney D.J. 2018. Material microenvironmental properties couple to induce distinct transcriptional programs in mammalian stem cells. Proc. Natl. Acad. Sci. USA. 115 : E8368–E8377.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. Position Statement. Cytother. 8 : 315–317.
Estrada J.C., Torres Y., Benguría A., Dopazo A., Roche E., Carrera-Quintanar L., Pérez R.A., Enríquez J.A., Torres R., Ramírez J.C., Samper E., Bernad A. 2013. Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy. Cell Death Dis. 4: e691. https://doi.org/10.1038/cddis.2013.211
Estrela C., Alencar A.H., Kitten G.T., Vencio E.F., Gava E. 2011. Mesenchymal stem cells in the dental tissues: Perspectives for tissue regeneration. Braz. Dent J. 22 : 91–98.
Fawzy El-Sayed K.M., Dörfer C.E. 2016. Gingival Mesenchymal Stem/Progenitor Cells: A Unique Tissue Engineering Gem. Stem Cells Int. 2016 : 7154327. https://doi.org/10.1155/2016/7154327
Gang E.J., Bosnakovski D., Figueiredo C.A., Visser J.W., Perlingeiro R.C. 2007. SSEA-4 identifies mesenchymal stem cells from bone marrow. Blood. 109 : 1743–1751.
Gao Y., Zhao G., Li D., Chen X., Pang J., Ke J. 2014. Isolation and multiple differentiation potential assessment of human gingival mesenchymal stem cells. Int. J. Mol. Sci. 15 : 20982–20996.
Gattazzo F., Urciuolo A., Bonaldo P. 2014. Extracellular matrix: A dynamic microenvironment for stem cell niche. Biochim Biophys Acta. 1840 : 2506–2519.
Ge S., Mrozik K.M., Menicanin D., Gronthos S., Bartold P.M. 2012. Isolation and characterization of mesenchymal stem cell-like cells from healthy and inflamed gingival tissue: Potential use for clinical therapy. Regen. Med. 7 : 819–832.
Gronthos S., Mankani M., Brahim J., Robey P.G., Shi S. 2000. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci USA. 97 : 13625–13630.
Hayflick L. 1965. The limited in vitro lifetime of human diploid cell strains. Exp. Cell Res. 37 : 614–636.
Huang G.T., Gronthos S., Shi S. 2009. Mesenchymal stem cells derived from dental tissues vs. those from other sources: Their biology and role in regenerative medicine. J. Dent Res. 2009 88 : 792–806. Review.
Isobe Y., Koyama N., Nakao K., Osawa K., Ikeno M., Yamanaka S., Okubo Y., Fujimura K., Bessho K. 2016. Comparison of human mesenchymal stem cells derived from bone marrow, synovial fluid, adult dental pulp, and exfoliated deciduous tooth pulp. Int. J. Oral Maxillofac. Surg. 45 : 124–131.
Jeon Y.J., Kim J., Cho J.H., Chung H.M., Chae J.I. 2016. Comparative analysis of human mesenchymal stem cells derived from bone marrow, placenta, and adipose tissue as sources of cell therapy. J. Cell Biochem. 117 : 1112–1125.
Jin S.H., Lee J.E., Yun J.H., Kim I., Ko Y., Park J.B. 2015. Isolation and characterization of human mesenchymal stem cells from gingival connective tissue. J. Periodontal Res. 50 : 461–467.
Kim J.A., Im K.O., Park S.N., Kwon J.S., Kim S.Y., Oh K., Lee D.S., Kim M.K., Kim S.W., Jang M., Lee G., Oh Y.M., Lee S.D., Lee D.S. 2015. Cytogenetic heterogeneity and their serial dynamic changes during acquisition of cytogenetic aberrations in cultured mesenchymal stem cells. Mutat. Res. 777 : 60–68.
Kuilman T., Michaloglou C., Mooi W.J., Peeper D.S. 2010. The essence of senescence. Genes Dev. 24 : 2463–2479.
Kyurkchiev S., Shterev A., Dimitrov R. 2010. Assessment of presence and characteristics of multipotent stromal cells in human endometrium and decidua. Reproductive BioMedicine Online. 20 : 305–313.
Li H., Fan J., Fan L., Li T., Yang Y., Xu H., Deng L., Li J., Li T., Weng X., Wang S., Chunhua Zhao R. 2018. MiRNA-10b Reciprocally Stimulates Osteogenesis and Inhibits Adipogenesis Partly through the TGF-β/SMAD2 Signaling Pathway. Aging Dis. 9 : 1058–1073.
Lo Surdo J.L., Millis B.A., Bauer S.R. 2013. Automated microscopy as a quantitative method to measure differences in adipogenic differentiation in preparations of human mesenchymal stromal cells. Cytotherapy. 15 : 1527–1540.
Matic I., Antunovic M., Brkic S., Josipovic P., Mihalic K.C., Karlak I., Ivkovic A., Marijanovic I. 2016. Expression of OCT-4 and SOX-2 in bone marrow-derived human mesenchymal stem cells during osteogenic differentiation. Open Access Maced J. Med. Sci. 4 : 9–16.
Matsumura T., Zerrudo Z., Hayflick L. 1979. Senescent human diploid cells in culture: Survival, DNA synthesis and morphology. J. Gerontol. 34 : 328–334.
Meisner L.F., Johnson J.A. 2008. Protocols for cytogenetics studies of human embryonic stem cells. Methods. 45 : 133–141.
Mitrano T.I., Grob M.S., Carrión F., Nova-Lamperti E., Luz P.A., Fierro F.S., Quintero A., Chaparro A., Sanz A. 2010. Culture and characterization of mesenchymal stem cells from human gingival tissue. J. Periodontol. 81 : 917–925.
Monterubbianesi R., Bencun M., Pagella P., Woloszyk A., Orsini G., Mitsiadis T.A. 2019. A comparative in vitro study of the osteogenic and adipogenic potential of human dental pulp stem cells, gingival fibroblasts and foreskin fibroblasts. Sci. Rep. 9 : 1761–1773.
Niedernhofer L.J., Gurkar A.U., Wang Y., Vijg J., Hoeijmakers J.H.J., Robbins P.D. 2018. Nuclear Genomic Instability and Aging. Annu Rev Biochem. 87 : 295–322.
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. 90 : 1–4.
Park S.B., Seo K.W., So A.Y., Seo M.S., Yu K.R., Kang S.K., Kang K.S. 2012. SOX2 has a crucial role in the lineage determination and proliferation of mesenchymal stem cells through Dickkopf-1 and c-MYC. Cell Death Differ. 19 : 534–545.
Redaelli S., Bentivegna A., Foudah D., Miloso M., Redondo J., Riva G., Baronchelli S., Dalprà L., Tredici G. 2012. From cytogenomic to epigenomic profiles: Monitoring the biologic behavior of in vitro cultured human bone marrow mesenchymal stem cells. Stem Cell Res. Ther. 3 : 47–63.
Reyes M., Lund T., Lenvik T., Aguiar D., Koodie L., Verfaillie C.M. 2001. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. 98 : 2615–2625.
Riekstina U., Cakstina I., Parfejevs V., Hoogduijn M., Jankovskis G., Muiznieks I., Muceniece R., Ancans J. 2009. Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow, adipose tissue, heart and dermis. Stem Cell. Rev. 5 : 378–386.
Rossignoli F., Caselli A., Grisendi G., Piccinno S., Burns J.S., Murgia A., Veronesi E., Loschi P., Masini C., Conte P., Paolucci P., Horwiz E.M., Dominici M. 2013. Isolation, characterization, and transduction of endometrial decidual tissue multipotent mesenchymal stromal/stem cells from menstrual blood. Biomed Res Int. https://doi.org/10.1155/2013/901821
Savickienė J., Baronaitė S., Zentelytė A., Treigytė G., Navakauskienė R. 2016. Senescence-associated molecular and epigenetic alterations in mesenchymal stem cell cultures from amniotic fluid of normal and fetus-affected pregnancy. Stem Cells Int. 2016 : 2019498.
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. 98 : 93–107.
Shaffer L.G., McGowan-Jordan J., Schmid M. (Eds.). 2013. An international system for human cytogenetic nomenclature. Basel: S. Karger. 140 p.
Shih D.T., Lee D.C., Chen S.C., Tsai R.Y., Huang C.T., Tsai C.C., Shen E.Y., Chiu W.T. 2005. Isolation and characterization of neurogenic mesenchymal stem cells in human scalp tissue. Stem Cells. 23 : 1012–1020.
Sonoyama W., Liu Y., Yamaza T., Tuan R.S., Wang S., Shi S., Huang G.T. 2008. Characterization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study. J. Endod. 34 : 166–171.
Spagnuolo G., Codispoti B., Marrelli M., Rengo C., Rengo S., Tatullo M. 2018. Commitment of Oral-Derived Stem Cells in Dental and Maxillofacial Applications. Dent. J. (Basel). 6 https://doi.org/10.3390/dj6040072
Subbarayan R., Murugan Girija D., Mukherjee J., Mamidanna S.R.R., Ranga Rao S. 2017. Comparision of Gingival and Umbilical Cord Stem Cells Based on Its Modulus and Neuronal Differentiation. J. Cell Biochem. 118 : 2000–2008.
Sugawara K., Hamatani T., Yamada M., Ogawa S., Kamijo S., Kuji N., Akutsu H., Miyado K., Yoshimura Y., Umezawa A. 2014. Derivation of human decidua-like cells from amnion and menstrual blood. https://doi.org/10.1038/srep04599
Szepesi Á., Matula Z., Szigeti A., Várady G., Szalma J., Szabó G., Uher F., Sarkadi B., Német K. 2016. In Vitro Characterization of Human Mesenchymal Stem Cells Isolated from Different Tissues with a Potential to Promote Complex Bone Regeneration. Stem Cells Int. 2016 : 3595941. https://doi.org/10.1155/2016/3595941
Tang L., Li N., Xie H., Jin Y. 2011. Characterization of mesenchymal stem cells from human normal and hyperplastic gingiva. J. Cell Physiol. 226 : 832–842.
Tarte K., Gaillard J., Lataillade J.J., Fouillard L., Becker M., Mossafa H., Tchirkov A., Rouard H., Henry C., Splingard M., Dulong J., Monnier D., Gourmelon P., Gorin N.C., Sensebé L. on behalf of Société Française de Greffe de Moelle et Thérapie Cellulaire. 2010. Clinical-grade production of human mesenchymal stromal cells: occurrence of aneuploidy without transformation. Blood. 115 : 1549–1553.
Tomar G.B., Srivastava R.K., Gupta N., Barhanpurkar A.P., Pote S.T., Jhaveri H.M., Mishra G.C., Wani M.R. 2010. Human gingiva-derived mesenchymal stem cells are superior to bone marrow-derived mesenchymal stem cells for cell therapy in regenerative medicine. Biochem. Biophys. Res. Commun. 393 : 377–383.
Truong N.C., Bui K.H., Van Pham P. 2018. Characterization of senescence of human adipose-derived stem cells after long-term expansion. Adv. Exp. Med. Biol. https://doi.org/10.1007/5584_2018_235
Venkatesh D., Kumar K.P.M., Alur J.B. 2017. Gingival mesenchymal stem cells. J. Oral Maxillofac. Pathol. 21 : 296–298.
Wagner W., Horn P., Castoldi M., Diehlmann A., Bork S., Saffrich R., Benes V., Blake J., Pfister S., Eckstein V., Ho A.D. 2008. Replicative senescence of mesenchymal stem cells: A continuous and organized process. PLoS One. 3 : e2213. https://doi.org/10.1371/journal.pone.0002213
Wang F., Yu M., Yan X., Wen Y., Zeng Q., Yue W., Yang P., Pei X. 2011. Gingiva-derived mesenchymal stem cell-mediated therapeutic approach for bone tissue regeneration. Stem Cells Dev. 20 : 2093–102.
Wang H., Zhong Q., Yang T., Qi Y., Fu M., Yang X., Qiao L., Ling Q., Liu S., Zhao Y. 2018. Comparative characterization of SHED and DPSCs during extended cultivation in vitro. Mol. Med. Rep. 17 : 6551–6559.
Wu R., Gu B., Zhao X., Tan Z., Chen L., Zhu J., Zhang M. 2013. Derivation of multipotent nestin(+)/CD271(-)/STRO-1(-) mesenchymal-like precursors from human embryonic stem cells in chemically defined conditions. Hum. Cell. 26 : 19–27.
Wu M., Zhang R., Zou Q., Chen Y., Zhou M., Li X., Ran R., Chen Q. 2018. Comparison of the Biological Characteristics of Mesenchymal Stem Cells Derived from the Human Placenta and Umbilical Cord. Sci Rep. 8 : 5014–5022.
Xing Y., Zhang Y., Wu X., Zhao B., Ji Y., Xu X. 2018. A comprehensive study on donor-matched comparisons of three types of mesenchymal stem cells-containing cells from human dental tissue. J Periodontal Res. https://doi.org/10.1111/jre.12630
Yan Z.J., Hu Y.Q., Zhang H.T., Zhang P., Xiao Z.Y., Sun X.L., Cai Y.Q., Hu C.C., Xu R.X. 2013. Comparison of the neural differentiation potential of human mesenchymal stem cells from amniotic fluid and adult bone marrow. Cell Mol. Neurobiol. 33 : 465–475.
Yannarelli G., Pacienza N., Cuniberti L., Medin J., Davies J., Keating A. 2013. Brief report: The potential role of epigenetics on multipotent cell differentiation capacity of mesenchymal stromal cells. Stem Cells. 31 : 215–220.
Yu J., Shi J., Zhang Y., Zhang Y., Huang Y., Chen Z., Yang J. 2018. The replicative senescent mesenchymal stem / stromal cells defect in DNA damage response and anti-oxidative capacity. Int. J. Med. Sci. 15 : 771–781.
Zaman W.S., Makpol S., Sathapan S., Chua K.H. 2014. Long-term in vitro expansion of human adipose-derived stem cells showed low risk of tumourigenicity. J. Tissue Eng. Regen. Med. 8 : 67–76.
Zhang Q., Shi S., Liu Y., Uyanne J., Shi Y., Shi S., Le A.D. 2009. Mesenchymal stem cells derived from human gingiva are capable of immunomodulatory functions and ameliorate inflammation-related tissue destruction in experimental colitis. J. Immunol. 183 : 7787–7798.
Zhang W., Walboomers X.F., Shi S., Fan M., Jansen J.A. 2006. Multilineage differentiation potential of stem cells derived from human dental pulp after cryopreservation. Tissue Eng. 12 : 2813–2823.
Zhao N., Wu Z., Qin L., Guo Z., Li D. 2015. Characteristics and Tissue Regeneration Properties of Gingiva-Derived Mesenchymal Stem Cells. Crit. Rev. Eukaryot. Gene Expr. 25 : 135–144.
Дополнительные материалы отсутствуют.