Цитология, 2019, T. 61, № 8, стр. 672-680
Реакция клеток NCTC клон 929 на добавление ионов молибдена или меди в питательную среду
Ю. П. Петров 1, *, Н. В. Цупкина 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: yupe3ov@mail.ru
Поступила в редакцию 25.04.2019
После доработки 15.05.2019
Принята к публикации 17.05.2019
Аннотация
В настоящей работе исследовали реакцию культивируемых клеток постоянной линии NCTC клон 929 на изменение состава питательной среды при добавлении в нее ионов меди или молибдена в виде солей (NH4)6Mo7O24 · 4H2O и CuSO4 · 5H2O в концентрациях 0.1, 1.0 и 10 мг/мл среды. Параметром, по которому происходил мониторинг живых клеток, была площадь проекции клетки на подложку. Клетки анализировали через 1 сут после посева. Ни ионы меди, ни ионы молибдена не изменяли площадь клеток при любой исследованной концентрации, если клетки культивировали в “старых” флаконах, с которых они были только что сняты. При культивировании в новых (не использованных ранее) флаконах клетки по параметру “площадь клетки” образуют две группы – мелкие и крупные. Мы назвали эти группы функциональными субпопуляциями. Ионы меди снижают количество мелких клеток в 4 раза по сравнению с контролем, но не оказывают действия на относительную численность клеток с большей площадью. Ионы молибдена, напротив, увеличивают число мелких клеток на 20%, а для относительно крупных клеток можно отметить небольшое снижение численности, но как тенденцию.
Молибден и медь – микроэлементы, входящие в группу тяжелых металлов (Давыдова, Тагасов, 2002), попадая в организм, ведут себя антагонистически, поэтому имеет смысл в исследовательской работе использовать их в паре. Ранее нами было показано, что повышенные концентрации ионов молибдена во внешней среде не всегда приводят к отрицательным последствиям при их воздействии на живые объекты, а, напротив, могут оказывать благопрятное действие, например, повышать выживаемость головастиков (Stepanyan et al., 2011).
Данных о влиянии этих металлов не на организменном, а на клеточном уровне нет. В настоящей работе была поставлена задача изучить реакцию культивируемых клеток на различные концентрации молибдена или меди в питательной среде, превышающие принятые предельно допустимые дозы. В качестве теста был использован морфометрический параметр – площадь проекции клетки на подложку.
Следует подчеркнуть, что мы анализировали реакцию не отдельно взятых клеток, а всей клеточной популяции, культивируемой в данном флаконе. Поэтому акцент был сделан не столько на исследование токсичности тяжелых металлов, сколько на изучение реакции культивируемых клеток на изменение состава питательной среды, в которую добавляли ионы меди или молибдена. Такой подход важен, поскольку вносит определенный вклад в изучение биологии культивируемых клеток как частного раздела общей биологии.
МАТЕРИАЛ И МЕТОДИКА
В качестве объекта исследования использовали постоянную клеточную линию подкожной соединительной ткани мыши – NCTC клон 929, полученную из Российской коллекции клеточных культур позвоночных Института цитологии РАН (Санкт-Петербург). Клетки культивировали в пластиковых флаконах (25 см2, Nunk, Дания) в ростовой среде, состоящей из среды DMEM (Gibco, США), 10% сыворотки плодов коров (Gibco, США) и 40 мкг/мл гентамицина.
Для определения воздействия ионов тяжелых металлов на клетки в ростовую среду на протяжении всего культивирования добавляли растворы солей (NH4)6Mo7O24 · 4H2O или CuSO4 · 5H2O (Merck, Германия). Расчет концентрации солей в среде производили по ионам Mo и Cu. Было поставлено 3 серии экспериментов с разными концентрациями солей в ростовой среде (0.1, 1.0 и 10.0 мг/мл) и без них (контроль).
Культуры клеток выращивали в СО2-инкубаторе в атмосфере 5% СО2 при 37°С. При достижении субконфлюентного монослоя клетки пересевали в соотношении 1 : 10 как в новые флаконы, так и в те, с которых они были только что сняты (старые флаконы). Эти флаконы перед посевом клеток не мыли, а лишь дважды ополаскивали ростовой средой. Через 1 сут производили фотосъемку живых клеток в 8–10 случайно выбранных полях зрения каждого флакона. Для этого использовали цифровую фотокамеру Canon EOS 1000D с разрешением 2816 × 1880 пикселей, установленную как фототонасадка на инвертированный микроскоп Nikon ECLIPSE NS100. Использовали объектив 20×. Выбор времени для анализа клеток объясняется тем, что через 1 сут после пересева клетки уже хорошо распластаны, но еще не имеют прямых межклеточных контактов и не вступают активно в митоз (рис. 1). Таким образом, вклад этих факторов в изменение клеточной морфологии можно было не учитывать.
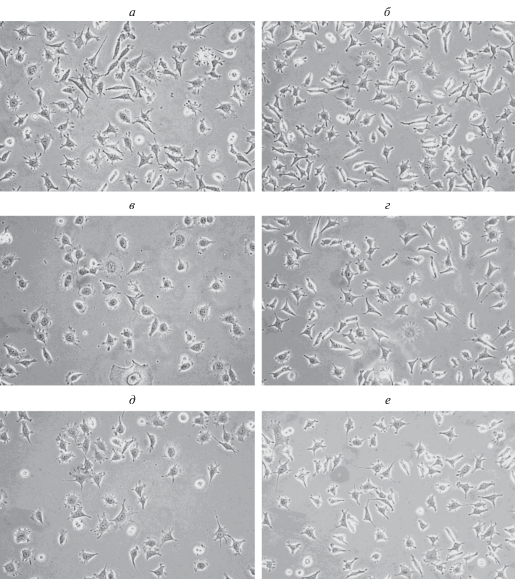
Рис. 1.
Типичные поля зрения клеток линии NCTC клон 929 5-го пассажа через 1 сут после пересева в новые (а, в, д) и старые (б, г, е) флаконы. Клетки культивировали в отсутствие (а, б) и в присутствии 0.1 мг/л ионов меди (в, г) или молибдена (д, е) Об. 20×.
Полученные цифровые изображения клеток сначала обрабатывали с помощью программы ImageJ 1.48v (Rasband, W.S., ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, США, http://imagej.nih.gov/ij/). Дальнейшие расчеты выполняли в Excel 2010 (MS Corporation, США) и Origin 6.1 (OriginLab Corporation, США). Площадь проекции клетки на подложку (A) оставляли в пикселях, поскольку для решения поставленной задачи не было необходимости анализировать абсолютные размеры клеток, а лишь относительные. На каждую “точку” (на флакон) анализировали не менее 500 клеток. Большой объем выборок был необходим не столько для расчета средних величин, сколько для получения удовлетворительных гистограмм распределения.
РЕЗУЛЬТАТЫ
Прежде всего, необходимо отметить, что нативное состояние клеток (и как следствие их морфология) детерминируется различными факторами, которые не только трудно учесть, но и контролировать, поскольку их вклад в реакцию клеток не обязательно суммируется. Ранее нами было показано, что при пассировании клеток после размораживания их морфометрические параметры находятся в определенной зависимости от номера пассажа и от подложки, на которую их пересаживают (Петров, Цупкина, 2016, 2017). В частности, было продемонстрировано увеличение площади (проекции на подложку) клеток при посеве их в новые флаконы по сравнению с пересаженными во флаконы, с которых они были сняты. В настоящей работе в контрольных экспериментах этот факт подтвердился: суммарный результат (то есть при учете клеток всех пассажей) показал, что средняя площадь исследуемых клеток в новых флаконах равна 13 549 ± 116 пикселей, а в старых – 9481 ± 82 пикселя (P < 0.01).
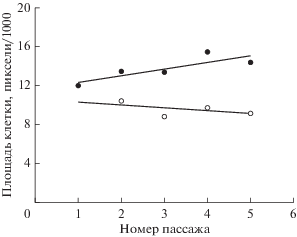
Ранее мы уже использовали те же клетки линии NCTC клон 929 (Петров, Цупкина, 2016). Тогда было отмечено незначительное увеличение площади клеток по мере их пассирования как в новых флаконах, так и в старых, однако лишь как тенденция, поскольку значения коэффициента корреляции были очень низкими (соответственно 0.29 и 0.19). В настоящей работе также отмечен (в первом приближении) линейный рост площади клеток по мере их пассирования в новых флаконах (r = 0.65), что подтверждает выявленную ранее тенденцию (рис. 2). Однако для старых флаконoв был получен противоположный эффект – площадь клеток уменьшалась (r = –0.57), что лишний раз указывает на бóльшую вариабельность влияния условий культивирования клеток в старых флаконах, чем в новых.
Рис. 2.
Изменение площади интактных клеток в течение 5-ти пассажей при культивировании в новых (темные кружки) и старых (светлые кружки) флаконах. Кружки – экспериментальные данные, сплошные линии – соответствующие расчетные зависимости (линейная аппроксимация, y = ax + b). Ошибки средних значений отсутствуют, поскольку их величины менее размера символов (кружков).
Тем не менее, для исследования реакции клеток на ионы молибдена и меди были использованы как новые, так и старые флаконы, чтобы сравнить полученные результаты с реакцией интактных клеток в соответствующих контрольных флаконах. Это важно для оценки степени влияния различных факторов на реакцию культивируемых клеток. Для обнаружения ответа клеток на ионы молибдена или меди мы использовали линейную аппроксимацию, как демонстрирует рис. 2. Однако для того чтобы визуально легче воспринимать полученные результаты, данные представлены в виде диаграмм коэффициента a линейного уравнения (y = ax + b), используемого для аппроксимации соответствующих экспериментальных значений (рис. 3). Поскольку этот коэффициент указывает на количественную связь между площадью клетки (y) и номером пассажа (x), то по его величине можно судить о том, какова степень вклада в эту связь ионов меди или молибдена.
Рис. 3.
Значения коэффициента a линейного уравнения (y = ax + b) для клеток, культивируемых в старых (СФ) и в новых (НФ) флаконах. К – контроль (интактные клетки). Цифры 1, 2, 3 при ионе Cu и Mo соответствуют концентрации иона в ростовой среде – 0.1, 1.0 и 10.0 мг/мл соответственно. Вертикальные отрезки – ошибка среднего.
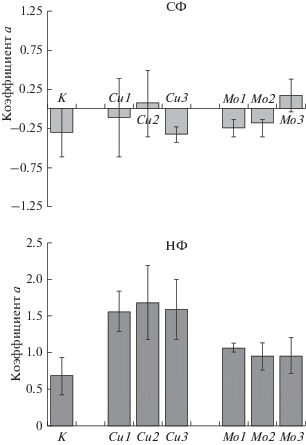
Как следует из данных, представленных на рис. 3а ни ионы меди, ни ионы молибдена в любой из исследованных концентраций не изменяли площади клеток, если клетки культивировали в старых флаконах, поскольку ни в одном случае нет достоверных отличий коэффициента a от 0. Таким образом, очевидно, что при культивировании клеток в старых флаконах нет связи между средним значением площади клетки и номером пассажа.
При культивировании клеток в новых флаконах был получен другой результат. В целом можно отметить, что в присутствии любого из двух ионов при всех исследованных концентрациях, как и в контроле, происходит увеличение средней площади клеток по мере пассирования культуры. При этом варьирование концентрацией иона в питательной среде не имеет значения (нет достоверных различий между тремя концентрационными вариантами). Однако более важным является то, что действие обоих ионов в этом случае более выражены, чем в контроле. Поскольку нет зависимости от концентраций, то выборки этих вариантов можно объединить. Тогда среднее значение коэффициента a в случае ионов меди будет равно 1.61 ± 0.04, что резко отлично от значения контроля – 0.68 ± 0.26 (P < 0.01).
Формально в случае ионов молибдена, в отличие от ионов меди, усреднение значений a (0.99 ± 0.04) не позволяет выявить достоверных отличий от контроля (для новых флаконов). Тем не менее, поскольку во всех трех вариантах концентраций ионов молибдена значения a выше чем в контроле, есть все основания говорить о тенденции увеличения площади клеток и в этом случае. Это утверждение становится убедительным, если сравнить средние площади клеток только 5-го пассажа: при всех трех концентрациях ионов молибдена площадь клеток соответственно равна 16 693 ± 283, 16 647 ± 386, 16 665 ± 341 пикселей; а площадь клеток в контроле (5-й пассаж, новые флаконы) – 14343 ± 409 пикселей, что указывает на достоверные отличия этого параметра от значений контроля во всех трех вариантах (P < 0.01). Важно отметить, что объединение выборок выявило и различие по коэффициенту a между реакциями клеток на ионы и меди, и молибдена (P < 0.01).
Однако подобные расчеты для старых флаконов достоверных отличий от контроля не выявили. Несмотря на формальную статистическую достоверность полученных данных, они не отвечают на вопрос, все ли клетки в равной степени изменяют свой размер в присутствии того или иного иона. Прежде чем ответить на этот вопрос, необходимо сравнить концентрацию клеток во флаконах, в которых культивировали клетки в отсутствие и в присутствии иона меди или молибдена. Мы не делали прямых измерений числа клеток во флаконах, но об их концентрации можно судить по среднему числу клеток в поле зрения (N). Это допустимо, поскольку во всех случаях число проанализированных полей зрения на флакон варьировало от 7 до 12, чего вполне достаточно для объективного анализа средних значений N.
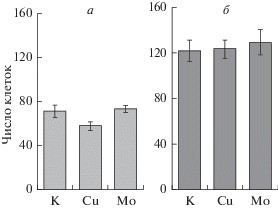
Было обнаружено, что ионы меди заметно уменьшают число клеток в поле зрения. Рис. 4 демонстрирует снижение N в процессе пассирования клеток в новых флаконах при минимальной концентрации ионов меди в питательной среде. Коэффициент a (в уравнении y = ax + b) равен –7.53 ± 1.03, что достоверно (P < 0.05) отличается от аналогичного коэффициента в контроле (1.64 ± 4.22). Если объединить соответствующие значения и по пассажам, и по концентрациям, то даже несмотря на естественно возрастающую при этом ошибку среднего, значение N для клеток, культивируемых в среде с медью, оказывается достоверно ниже (P < 0.05) по сравнению с этим же параметром в контроле, но только при использовании новых флаконов (рис. 5а).
Рис. 4.
Динамика изменения числа клеток в поле зрения в процессе их пассирования в среде с минимальным добавлением ионов меди в питательную среду (0.1 мг/л). Темные кружки – экаспериментальные значения. Сплошная линия – значения линейной регрессии. Вертикальные отрезки – ошибка среднего значения.
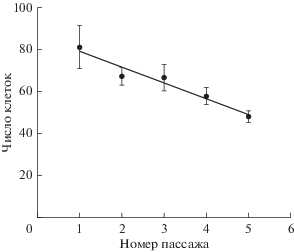
Рис. 5.
Среднее число клеток в поле зрения через 1 сут после пересева на новые (а) и старые (б) флаконы. К – контроль (интактные клетки). Cu и Mo – клетки в питательной среде с ионами меди и молибдена соответственно. Данные по концентрациям объединены в соответстветствующие ионам выборки. Вертикальные отрезки – ошибка среднего.
Поскольку полученные данные указывают не только на изменение размера клеток, но и их численности, то возникает вопрос – снижение количества клеток в случае использования ионов меди связано с чувствительностью к этому агенту всех клеток или только клеток, имеющих ту или иную площадь проекции на подложку. Чтобы ответить на этот вопрос, необходимо сначала ответить на другой вопрос – однородна ли по данному параметру популяция исследуемых клеток или неоднородна? Для этого были объединены все выборки клеток (контрольной, по меди и молибдену всех пассажей и концентраций) для клеток культивируемых в новых и, соответственно, в старых флаконах. По ним рассчитаны частоты распределения клеток с разной площадью. Полученные данные представлены в виде гистограмм на рис. 6.
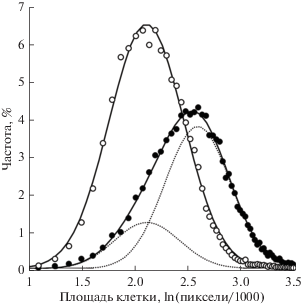
Рис. 6.
Частоты распределения клеток с различной площадью проекции на подложку в новых (темные кружки) и старых (светлые кружки) флаконах. Кружки – экспериментальные значения (площади клеток взяты как соответствующие значения натурального логарифма). Линии – теоретические кривые (рассчитаны с использованием нормального распределения). В случае новых флаконов расчетная кривая (сплошная линия) – результат суммирования значений пунктирных линий. Объяснение в тексте.
Логика расчетов основана на предположении, что данный параметр (площадь клетки) имеет нормальное распределение, т.е. куполообразный вид с симметричным расположением плеч вокруг центра равновесия, или среднего значения. С теоретической (математической) точки зрения среднее значение этого распределения равно 0, потому что его плечи расходятся симметрично в бесконечности в стороны со знаком “–” и “+”. Параметр “площадь клетки”, не может иметь отрицательных значений, поэтому при экстраполяции нормального распределения на выборку с мелкими клетками будет получена кривая со сжатым “куполом”, а с крупными клетками – с растянутым “куполом”. Следовательно, чем выше дисперсность по данному параметру, тем асимметричнее “купол” распределения. Один из способов сгладить это облигатное несоответствие – строить гистограммы с небольшим количеством (8–10) разрядов (“карманов”), огрубляя получаемый результат. Чтобы повысить точность, необходимо шкалу абсциссы (ОХ) брать более равномерной и увеличить число разрядов гистограммы. В первом случае значения площади следует перевести в логарифмы, а во втором – увеличить выборку.
Таким образом, на горизонтальной оси гистограммы рис. 6 отложены уменьшенные в 1000 раз и переведенные в логарифмы значения площади клеток. Из всех проанализированных клеток были сделаны две выборки – клетки, культивируемые в новых и старых флаконах. В каждую из выборок были включены как интактные клетки, так и клетки, контактировавшие с ионами меди или молибдена, а также клетки всех пяти пассажей. В результате в выборке новых флаконов оказалось почти 20 000 клеток, а старых – свыше 26 000, что позволило увеличить число разрядов (“карманов”) почти до 70. Таким образом, несмотря на объединение разнородных выборок, удалось получить предельно точное соответствие рассчитанных и экспериментальных значений для анализа клеток, культивируемых в разных флаконах. В каждом случае коэффициент детерминации R2 равен 0.996, то есть максимально близок к пределу (к 1). Из представленных на рис. 6 гистограмм следует, что все клетки культивируемые в старых флаконах по параметру “площадь клетки” предельно (с математической точки зрения) однородны, группируясь вокруг пика со значением 2.113 ± 0.002, а в новых – разделены на две группы с первым пиком 2.119 ± 0.004 (около 25% клеток) и вторым – 2.596 ± 0.003 (около 75% клеток) (P < 0.01). Следует отметить, что значения единственного пика клеток в старых флаконах и I-го пика клеток новых флаконов практически совпали, несмотря на очень малые ошибки средних значений т.е. они не имеют достоверных различий.
Итак, получается, что неоднородность популяции клеток линии NCTC клон 929 по параметру “площадь клетки” проявляется не при культивировании их в старых флаконах, как ожидалось бы из-за большего числа неконтролируемых факторов, действующих на клетки, а при их культивировании в новых флаконах. При сопоставлении этого факта с данными рис. 5 видно, что в новых флаконах число клеток в поле зрения снижается при добавлении в питательную среду ионов меди. Для того чтобы определить, за счет каких клеток происходит это снижение – мелких или крупных, или и тех, и других одновременно, были построены диаграммы (рис. 7).
Рис. 7.
Диаграммы, иллюстрирующие неоднородность состава клеток, культивируемых в новых флаконах: а – значения пиков I (светлые столбики) и II (темные столбики), выраженных в логарифмах площади клеток; б – процентные соотношения числа клеток, образующих выборки пиков I и II; в – то же, что и на рисунке б, но с поправкой на число клеток в поле зрения. К – контроль (интактные клетки). Cu и Mo – клетки в питательной среде с ионами меди и молибдена соответственно. Данные по концентрациям объединены в соответствующие ионам выборки. Объяснение в тексте.
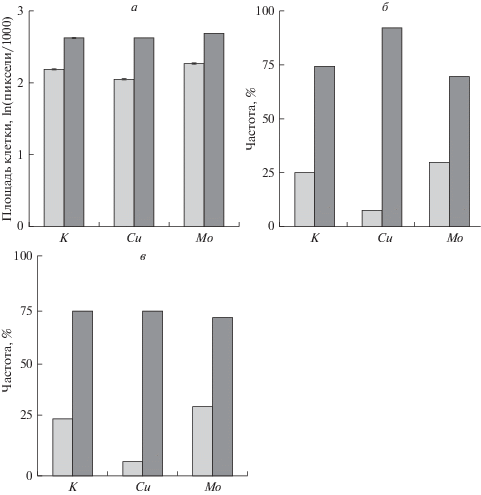
На рис. 7а представлены значения пиков I и II для выборок клеток всех контролей (К), всех клеток культивируемых с ионами меди (Cu) или молибдена (Mo), рассчитанные с использованием нормального распределения так же, как для данных рис. 6 (пунктирные линии). Можно отметить соизмеримость всех столбиков соответствующих пиков, что по параметру “площадь клетки” в первом приближении указывает на одни и те же две группы клеток как для выборок контроля, так и опытных. Однако количественные соотношения мелких (I) и крупных (II) клеток в этих выборках различны (рис. 7б). Как следует из представленных данных, относительное число крупных клеток в выборке меди выше, а мелких ниже, чем в двух других выборках. Тем не менее, более информативными будут не относительные величины, а абсолютные, если значения контроля взять за 1, а для опытных значений рассчитать соответствующие значения, исходя из данных рис. 5а (рис. 7в). На рис. 7в видно, что абсолютное число крупных клеток в эксперментальных выборках то же, что и в контроле (все темные столбики соизмеримы). Однако количество мелких клеток в эксперименте с ионами меди снижено по сравнению с контролем более чем в 4 раза, а абсолютное число этих клеток в эксперименте с ионами молибдена увеличено на 20%.
ОБСУЖДЕНИЕ
Мы не ставили задачу связать изменения параметров исследованных нами клеток линии NCTC клон 929 с тонкими механизмами воздействия на них ионов меди и молибдена. Задача сводилась, в первую очередь, к обнаружению клеточной реакции на эти металлы на уровне фенотипа, используя такой параметр, как площадь проекции клетки на подложку.
В настоящее время метод культивирования клеток находит широкое применение в связи с развитием регенеративной медицины (Dai et al., 2018; Dakhore et al., 2018; Hu, Li, 2019). К сожалению, акцент делается на термине “метод”, а само “культивирование клеток” становится чем-то второстепенным. При таком подходе клетки воспринимаются как совокупность однотипных биологических объектов, а само культивирование – как способ увеличения их массы для дальнейшего использования в медицинских целях. Мы считаем такой подход, мягко говоря, некорректным, поскольку жизнь клеток в искусственных условиях – это своего рода биоценоз, то есть сообщество взаимосвязанных биологических индивидов. Если принять такую точку зрения, то надо признать, что само существование такого сообщества детерминировано законами природы, изучение которых можно отнести к области биологии клеток в культуре. Незнание этих законов будет с неизбежностью приводить к нежелательным результатам использования в практической медицине клеток, побывавших в условиях искусственного культивирования.
То, что клетки в культуре не могут быть однородной массой, убедительно демонстрирует, например, рис. 6. Даже по такому на первый взгляд простому параметру, как площадь распластывания клеток по субстрату, хорошо выявляется не только выраженная дисперсия (в каждом случае величина стандартного отклонения равна приблизительно 30% от среднего значения), но и наличие двух групп клеток в случае использования новых культуральных флаконов. С одной стороны, это говорит о выраженной вариабельности клеток по данному параметру, что лишний раз указывает на индивидуальность клеток. С другой стороны, изменение условий культивирования (замена старой подложки на новую) выявляет наличие двух субпопуляций. О том, что у клеток могут быть такие относительно устойчивые состояния по параметру “площадь клетки”, мы впервые указали ранее, изучая подвижность клеток Зайдела при закрытии ими искусственной раны клеточного монослоя (Петров и др., 2018).
Сразу же возникает вопрос: наблюдаемые устойчивые состояния клеток – это истинные субпопуляции, то есть генетически различные группы клеток или нет? Мы полагаем, что это не истинные, а функциональные субпопуляции. Если изменение размера (площади) клетки во времени будет происходить более или менее равномерно, то в каждый данный момент (например, при фотосъемке) распределение этого параметра в клеточной популяции будет нормальным. Если при изменении своего размера клетка в какой-то (определенный) момент времени затормозит изменение своей площади (определенного размера), то это приведет к относительно более высокому числу клеток с данной площадью в данный момент времени. Следует подчеркнуть, что под “изменением площади” надо понимать не векторный (направленный) процесс, а маятниковый, разнонаправленный, точка равновесия которого должна совпадать со средним значением площади клетки. Отсюда следует, что при последующем построении гистограмм будут обнаруживаться два пика, что можно видеть на рис. 6 в случае новых флаконов.
Таким образом, можно прийти к выводу, что те самые трудно контролируемые фоновые факторы старых флаконов (остатки питательной среды, внеклеточного матрикса и т.п.), по-видимому, благоприятно действуют на пересеянные клетки, делая их популяцию относительно однородной по параметру “площадь клетки”. Причем, это воздействие достаточно сильное, потому что ни ионы меди, ни ионы молибдена не нарушают эту однородность. Иная ситуация с новыми флаконами. В этом случае даже в контроле можно обнаружить два морфологически различных состояния клеток (рис. 7). Поскольку при обычной практике культивирования клетки принято пересевать в новые флаконы, то наличие двух состояний клеток линии NCTC клон 929 в таких флаконах следует считать нормой. Иными словами, это результат адаптации этих клеток, выработанный ими в процессе многолетних пересевов. А поскольку в случае ионов меди было получено резкое снижение доли мелких клеток в новых флаконах, то мы полагаем, что это связано с отсутствием защитного влияния на клетки факторов, присутствующих в старых флаконах. Можно предполагать, что абсолютное совпадение площади клеток первого пика (I) новых флаконов с пиком (II) старых флаконов указывает на одно и то же состояние клеток, однако следует признать, что только одного такого факта недостаточно для обоснования этой идеи.
Обнаружение неоднородности исследуемой клеточной популяции по параметру “площадь клетки” (впрочем, как и по любому другому клеточному параметру) требует дополнения – анализа числа (соотношения) клеток, имеющих различия по площади. Исходя из общих представлений о токсичности ионов тяжелых металлов, следует полагать, что их взаимодействие с клеткой в культуре может быть сведено к трем основным вариантам: 1) действие иона убивает клетку; 2) реагируя на данный ион, клетка изменяет свои функциональные параметры, но не теряет жизнеспособности; 3) клетка никак не реагирует на присутствие в среде данного иона.
Поскольку добавление ионов меди в питательную среду приводит к уменьшению числа клеток в новых флаконах по сравнению с контролем, то часть клеток, скорее всего, погибает из-за токсичности данного иона. При этом уменьшение числа клеток происходит и в контроле (по сравнению с контролем старых флаконов), но в меньшей степени. По-видимому, часть клеток в этом случае погибает потому, что в “нужное” время не смогла связаться с подложкой. Однако этот процесс для клеток постоянной линии, адаптированных к условиям культуры, можно считать естественным. В старых же флаконах фоновые факторы, и, по-видимому, в большей степени остатки белков внеклеточного матрикса, которые полностью удалить с подложки ни раствором версена, ни раствором трипсина невозможно (Кузьминых, Петров, 2004), связывают ионы меди, выполняя роль протектора. Тем не менее, мы не считаем, что разумнее культивировать клетки в старых флаконах, потому что при этом всегда возрастает риск контаминации клеточной культуры и невозможность контролировать влияние фоновых факторов на клетки. Такой подход может быть оправдан лишь при экспериментальной работе.
Список литературы
Давыдова С.Л., Тагасов В.И. 2002. Тяжелые металлы как супертоксиканты. М.: Изд-во РУДН. 140 с. (Davidova S.L., Tagasov V.I. 2002. Heavy metals as supertoxicants. M.: Press RUDN. 140 p.)
Петров Ю.П., Цупкина Н.В. 2016. Морфологические особенности клеток линии NCTC клон 929 через 1 сут после пересева. Цитология. 58 (1) : 35–43. (Petrov Yu.P., Tsupkina N.V. 2016. Morphology of NCTC cells one day after reseeding. Tsitologiia. 58 (1) : 35–43).
Петров Ю.П., Цупкина Н.В. 2017. Сравнение формы мезенхимных стромальных клеток кролика в течение пяти пассажей после получения первичной культуры. Цитология. 59 (1) : 62–68. (Petrov Yu.P., Tsupkina N.V. 2017. Comparison of the shape of rabbit mesenchymal stromal cells during 5 passages after production of primary culture. Tsitologiia. 59 (1) : 62–68).
Петров Ю.П., Терюкова Н.П., Снопов С.А. 2018. Поведение клеток монослойной линии гепатомы Зайдела в области экспериментальной “раны”. Цитология. 60 (4) : 297–307. (Petrov Yu.P., Teriukova N.P., Snopov S.A. 2018. The behavior of Zajdela hepatoma monolayer line cells in the space of experimental wound. Tsitologiia. 60 (4) : 297–307).
Dai R., Hua W., Xie H., Chen W., Xiong L., Li L. 2018. The human skin-derived precursors for regenerative medicine: current state, challenges, and perspectives. Stem Cell Res. Ther. https://doi.org/10.1155/2018/8637812
Dakhore S., Nayer B., Hasegawa K. 2018. Human pluripotent stem cell culture: current status, challenges, and advancement. Stem Cells Int. https://doi.org/10.1155/2018/7396905
Hu C., Li L. 2019. Melatonin plays critical role in mesenchymal stem cell-based regenerative medicine in vitro and in vivo. Stem Cell Res. Ther. https://doi.org/10.1186/s13287-018-1114-8
Kuz’minykh E.V., Petrov Y.P. 2004. A simple model for the study of effects of the extracellular matrix on the cell morphology in vitro. Biochim. Biophys. Acta. 1671 : 18–25.
Stepanyan I.E., Tsarukyan A.S., Petrov Y.P. 2011. Effect of molybdenum, chrome and cadmium ions on metamorphosis and erythrocytes morphology of the marsh frog Pelophylax ridibundus (Amphibia: Anura). J. Environ. Sci. Technol. 4 : 172–181.
Дополнительные материалы отсутствуют.


