Цитология, 2019, T. 61, № 8, стр. 649-657
Методические проблемы цифровой микрофлуориметрии
Г. И. Штейн 1, *, А. Я. Гудкова 2, Б. Н. Кудрявцев 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 С.-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197022 Санкт-Петербург, Россия
* E-mail: spbgistn@mail.ru
Поступила в редакцию 25.04.2019
После доработки 20.05.2019
Принята к публикации 20.05.2019
Аннотация
В работе обсуждаются основные принципы цифровой микрофлуориметрии, рассматривается состав современной аппаратуры для микрофлуориметрических исследований с применением цифровых технологий, а также основные ошибки цифровой микрофлуориметрии. С целью увеличения точности измерений предложены способы коррекции неравномерности освещения, нестабильности источников света, фотообесцвечивания флуорохрома, темнового тока фотоприемника, учета других ошибок цифровой микрофлуориметрии.
Цифровые технологии прочно вошли в практику научных исследований. Современная световая микроскопия также основана на использовании цифровых видеосистем и компьютерной техники. Анализаторы микроизображений, использующие в качестве фотоприемников цифровые камеры и осуществляющие цифровую обработку изображений, позволяют проводить многопараметрический анализ, при котором определяются не только фотометрические, но также морфометрические и текстурные параметры клеток или их органелл (Пантелеев и др., 2005; Штейн и др., 2016).
В анализаторе микроизображений преобразование изображения в цифровую форму происходит на каждом элементе фотодиодной матрицы цифровой камеры, т.е. изображение разбивается на элементы – пиксели (picture cells), а аналоговый электрический сигнал от каждого элемента матрицы преобразуется в дискретные уровни яркости. Таким образом, процесс преобразования информации об объекте проходит несколько этапов: сначала свет от объекта преобразуется в аналоговый электрический сигнал, затем он преобразуется в цифровой сигнал, который поступает в компьютер для обработки, после чего изображение выводится на экран монитора. Поэтому, в зависимости от этапа преобразования, информационный сигнал можно характеризовать интенсивностью светового потока, амплитудой, цифровым уровнем или яркостью изображения (Штейн и др., 2016).
Микрофлуориметрия (МФМ) – один из прецизионных микроскопических методов, давно применяемых в клеточной биологии (Ruch, 1966; Розанов, Кудрявцев, 1967; Кудрявцев, Розанов, 1974; Tailor, Salmon, 1989; Лейси, 1992; Waters, Wittmann, 2014). Измерение интенсивности собственной флуоресценции (Lakowicz, 1999; Shaner, 2014) исследуемых клеточных структур или флуоресцентного красителя, связанного с ними, позволяет определить их состояние и содержащееся в них количество вещества с высокой точностью. Например, предельное количество ДНК в отдельных хромосомах, которое может быть измерено методом МФМ, достигает 5 × 10–15 г (Агафонова и др., 2013).
Современная МФМ также использует цифровые технологии, реализуемые в анализаторах микроизображений. Мерой содержания вещества в цифровой МФМ служит интегральная яркость изображения исследуемого объекта, которая определяется как сумма яркостей всех его пикселей.
Анализаторы микроизображений, которые могут использоваться для МФМ, выпускают многие фирмы, в частности, Olympus и Hamamatsu (Япония), Carl Zeiss и Leica-Microsystems (Германия), Andor Technology (Великобритания) и другие. Разработаны многочисленные коммерческие программы обработки изображений, например: ZEN (Carl Zeiss, Германия), ImagePro (Media Cybernetics, США), Huygens (SVI, Нидерланды), HCImage (Hamamatsu, Япония), Видеотест-Морфология (ВидеоТест, Россия), ММСatalog (MMC, Россия), а также свободно распространяемые программы CellProfiler, ImageAnalyzer, ImageJ.
В статье рассматриваются принципы цифровой МФМ, требования к анализаторам микроизображений, пригодным для МФМ, в том числе собранным исследователями на основе серийных микроскопов и цифровых камер, проводится анализ основных ошибок, и излагаются методики их уменьшения. Статья ориентирована на биологов, использующих в своих исследованиях метод МФМ.
АППАРАТУРА И МЕТОДЫ ЦИФРОВОЙ МФМ
Как упоминалось выше, цифровая МФМ осуществляется с помощью анализатора микроизображений, который обычно состоит из флуоресцентного микроскопа, цифровой камеры, компьютера и специализированного программного обеспечения. Кратко рассмотрим основные компоненты анализатора и требования к ним для проведения цифровой МФМ (Пантелеев и др., 2005; Chieco et al., 2013).
Микроскоп. Основным оптическим узлом любого микроскопа является объектив. В связи с этим выбор объектива для МФМ является важным этапом подготовки процесса измерений. Рассмотрим его параметры, оказывающие наиболее сильное влияние на измерения. Прежде всего, это числовая апертура объектива A и его увеличение M, от которых зависит интенсивность флуоресценции объекта. При эпиосвещении интенсивность определяется как (Tailor, Salmon, 1989):
Для получения максимально возможной интенсивности флуоресценции объекта исследования в МФМ, как правило, используются объективы с высокой апертурой.
От апертуры объектива зависит также дифракционная глубина резкости, которая вычисляется по следующей формуле (Агроскин, Папаян, 1977; Лейси, 1992):
где: λ – длина волны света, n – показатель преломления объекта.Т.е., чем больше апертура объектива, тем меньше глубина резкости. Поэтому при МФМ объективы с большой апертурой можно применять только для объектов с малой (1 мкм и меньше) толщиной (Chieco et al., 1994).
Источник света микроскопа при проведении МФМ должен создавать высокую интенсивность и равномерность освещенности поля зрения. Во флуоресцентных микроскопах в качестве источника света чаще всего используют ртутные дуговые лампы сверхвысокого давления, обладающие большой интенсивностью и необходимым спектром излучения. Изменение светового потока источника возбуждения вызывает соответствующее изменение интенсивности флуоресценции объекта исследования, так как время затухания флуоресценции очень мало и составляет несколько наносекунд (Lakowicz, 1999). Поэтому стабильность источника света непосредственно влияет на измерение интенсивности флуоресценции.
Нестабильность светового потока ртутных ламп можно разделить на кратковременную и долговременную. Кратковременная нестабильность может быть вызвана как перераспределением яркости внутри разрядного промежутка, так и изменением тока разряда (Шишловский, 1961). Лампы могут работать как на постоянном (HBO 100), так и на переменном (HBO 50) токе, поэтому, несмотря на различные электронные схемы стабилизации тока, лампы обладают разной величиной пульсаций светового потока. Например, лампа ДРШ-250-2М, работающая на постоянном токе, имеет нестабильность светового потока 0.8% (Агроскин, Папаян, 1977).
Долговременная нестабильность излучения ртутных ламп в основном связана с их “старением”, которое приводит к потемнению колбы и износу электродов (Айзенберг, 2006), в результате чего происходит медленное падение светового потока лампы. По ресурсу ртутные лампы сильно различаются. Например, лампа HBO 50 имеет ресурс всего 100 ч, а лампа HXPR 120–2000 ч (www.osram.com).
Адаптер цифровой камеры. Устанавливается, как правило, на тринокулярную насадку для механического и оптического сопряжения видеокамеры с микроскопом. Оптика адаптера предназначена для того, чтобы на матрицу камеры попадала как можно большая часть поля зрения микроскопа. Однако матрица имеет прямоугольную форму, поэтому на нее не может попасть все поля зрения. Например, камера с матрицей 2/3'' и адаптером 1.5× может “захватить” только 18.3% площади изображения, формируемого объективом, а с адаптером 0.63× – 46.2% (Пантелеев и др., 2005).
Цифровая камера. Центральным узлом такой камеры является фотодиодная матрица. Матрицы производятся по разным технологиям и отличаются способом считывания сигнала и регистрации изображения. В настоящее время используют два типа сенсоров: CCD (charge-coupled device) и CMOS (complementary metal-oxide-semiconductor). CMOS матрицы, как правило, используют в цифровых фотоаппаратах и устройствах скоростной записи процессов, так как они характеризуются более высоким быстродействием по сравнению с CCD матрицами. Однако CCD матрицы имеют более высокую чувствительность, что и определило их широкое применение в специализированных камерах для флуоресцентной микроскопии.
Разрешающая способность анализатора зависит, помимо, конечно, характеристик объектива, в первую очередь от размеров элемента (пикселя) матрицы. Как известно, предел оптической разрешающей способности микроскопа d определяется формулой Аббе (Ландсберг, 1976):
где: A – числовая апертура объектива, λ – длина волны света.Дискретизация изображения не будет ухудшать оптическую разрешающую способность, если размер пикселя в плоскости объекта будет, по крайней мере, в 2 раза меньше d (Pawley, 2006; Wegerhoff et al., 2006). Поскольку матрица CCD камеры устанавливается в плоскости изображения, создаваемого объективом, то размер элемента матрицы p зависит от увеличения объектива M и должен быть:
Например, для объектива 20×/0.7 и λ = 0.5 мкм приемная матрица камеры должна иметь размер элемента не более 3.6 мкм, а для объектива 100×/1.4 не более 9 мкм.
Для флуоресцентной микроскопии решающее значение имеет чувствительность матрицы, т.к. флуоресценция клеток и их структур обычно имеет малую интенсивность. Различают спектральную и интегральную чувствительности. Спектральная чувствительность матрицы обычно имеет максимум в зелено-красной области спектра. Специальные камеры могут иметь максимум чувствительности и в синей области и даже в УФ-области спектра. Сравнение различных моделей камер по интегральной чувствительности затруднено, т.к. производители универсальных цифровых камер указывают ее в разных единицах измерений. Например, в мВ ⋅ лк–1 ⋅ с–1 (Touptek, Китай) или как минимальную освещенность объекта в люксах, позволяющую получать изображение с допустимым уровнем шумов (ЕС Экспертс, Россия), и даже в единицах ISO (Olympus, Япония).
Производители высокочувствительных камер для научных исследований (Andor, Leica, Zeiss) приводят другие параметры, косвенно определяющие интегральную чувствительность камеры: темновой ток (количество элекронов на пиксель в секунду), шумы (в электронах) и динамический диапазон (в децибелах). У любого фотоприемника существует электрический сигнал даже при отсутствии падающего на него светового потока. Этот сигнал называется темновым током. От его величины зависит не только чувствительность камеры, но и точность измерений, поскольку темновой ток вносит в измерение интегральной яркости систематическую ошибку. На практике величину темнового тока можно оценить косвенно – по значению яркости на камере при закрытой матрице.
Цифровая камера является сложным электронным устройством, параметры которого определяются не только свойствами матрицы. В камере много собственных источников шумов, к ним можно добавить внешние радиочастотные и тепловые наводки. Для регистрации малоконтрастных объектов необходимо уменьшение нежелательных шумов, поэтому одним из главных показателем качества камеры является динамический диапазон – способность камеры передавать полный диапазон градаций яркости с определенным качеством. Динамический диапазон характеризуется отношением сигнал/шум, измеренным в децибелах (например, 60 дб соответствует отношению сигнала и шума 1000 : 1). Камеры с малым значением динамического диапазона (40–50 дб) “шумят”, т.е. искажают изображение. Для флуоресцентной микроскопии используют камеры с динамическим диапазоном 65 дб и более. Для снижения собственных шумов матрицы и понижения ее темнового тока используют термоэлектронное охлаждение. Например, камеры фирмы Andor имеют охлаждение до –100°С, при этом темновой ток составляет 0.001 эл ⋅ пикс–1 ⋅ с–1. Наличие охлаждения увеличивает также и динамический диапазон.
Необходимо отметить, что в цифровой МФМ используют монохромные камеры, поскольку расчеты яркостных параметров проводятся на черно-белом изображении. В цветных камерах для получения цветного изображения на элементы матрицы наносятся светофильтры (матрица Байера), что значительно уменьшает чувствительность матрицы по сравнению с монохромным вариантом.
Разрядность цифрового сигнала определяется АЦП (аналого-цифровым преобразователем) камеры. АЦП преобразует накопленные фотоэлектроны в сенсоре в цифровую форму с разрядностью 8–16 бит, то есть от 256 до 65 536 уровней яркости. Высокие значения динамического диапазона позволяют повысить разрядность камеры и получить больше уровней яркости на изображении, что, в свою очередь, сказывается на повышении точности МФМ.
Интенсивность света, поступающего на приемную матрицу, может меняться в широких пределах, поэтому в камере имеется “электронный затвор”, регулирующий время накопления фотоэлектронов (экспозиция). Это время может изменяться от десятков микросекунд до десятков секунд – чем больше время накопления, тем более слабый флуоресцентный сигнал можно зарегистрировать. Например, у камеры для флуоресцентной микроскопии Axiocam 503 (Carl Zeiss, Германия) наибольшее время накопления составляет 60 с. Однако с увеличением времени накопления увеличивается не только полезный сигнал, но и шумы. Поэтому важна также и величина отношения сигнал/шум.
Анализ информации производителей позволяет лишь ориентировочно оценить пригодность камеры для МФМ. Публикуемым значениям динамического диапазона трудно доверять, значения темнового тока, как правило, неизвестны, а стабильность работы камеры во времени не отражается в техдокументации. Поэтому проверку реальных значений этих характеристик проводят при подключении камеры к компьютеру. Зависимость яркости на камере от времени при постоянной комнатной температуре и полностью закрытой матрице позволяет оценить величину темнового тока и шумов. Камеры с низкой величиной шумов (1–2 цифровых уровня) и с колебанием яркости порядка 0.1–0.2% наиболее пригодны для МФМ.
Современные цифровые видеокамеры для научных исследований подключаются к компьютеру двумя способами: через порт USB2/3 либо с помощью платы сопряжения, имеющей разъем PCI или PCI Express.
Программное обеспечение состоит из драйвера видеокамеры и программы обработки изображения. Драйвер видеокамеры позволяет осуществлять настройки электронного затвора, яркости, контраста, гаммы (параметр, влияющий на линейность преобразования свет/сигнал), времени экспозиции, осуществлять графическое отображение гистограммы яркости и другие операции. Программы обработки изображения осуществляют запоминание изображения, выделение интересующих объектов в ручном или автоматическом режиме, измерение выбранных параметров, статистическую обработку, запоминание результатов и их передачу в другие статистические программы. Многие фирмы поставляют программы обработки, совмещенные с драйверами, например CellSence (Olympus, Япония), ZEN (Carl Zeiss, Германия).
ОШИБКИ ЦИФРОВОЙ МФМ И СПОСОБЫ ИХ УМЕНЬШЕНИЯ
Нестабильность источника света. Этот фактор оказывает существенное влияние на точность фотометрических измерений. Как указывалось ранее, лампы на переменном токе имеют большую величину пульсаций светового потока. Так, измеренный нами уровень пульсаций лампы HBO 50, работающей на переменном токе, составляет 80% с периодом 10 мс. Если время экспозиции цифровой камеры приближается к периоду пульсаций, то они оказывают сильное влияние на изменение яркости изображений. Так, например, при времени экспозиции 10 мс, CV яркости изображения в микроскопе Axioskop (Carl Zeiss, Германия) с лампой HBO 50 составляет 4.28% (табл. 1). При увеличении времени экспозиции влияние пульсаций значительно уменьшается, так как происходит интегрирование светового потока лампы.
Таблица 1.
Коэффициент вариации (CV, %) яркости цифрового изображения в микроскопах с разными типами ртутных ламп
| Время экспозиции камеры, мс | НВО 50 (микроскоп Axioskop, камера DFC360FX) |
НВО 100 (микроскоп Axiovert 200M, камера DFC420) |
SHI-130 OL (микроскоп IX83, камера DP73) |
|---|---|---|---|
| 10 | 4.28 | 0.72 | 0.68 |
| 20 | 1.72 | 0.58 | 0.45 |
| 50 | 0.98 | 0.35 | 0.37 |
| 100 | 0.74 | 0.26 | 0.23 |
| 200 | 0.63 | 0.21 | 0.19 |
Данные, представленные в табл. 1, свидетельствуют о том, что лампы, работающие на постоянном токе, имеют незначительные пульсации, вероятно связанные с перераспределением яркости внутри разрядного промежутка, а не с пульсациями тока разряда. Применение ламп на переменном токе для цифровой МФМ возможно только при экспозиции камеры не менее 50 мс. При длительных (сравнимых с ресурсом лампы) исследованиях начинает сказываться “старение” ртутной лампы – например, падение светового потока лампы HBO 50, имеющей весьма ограниченный ресурс (100 ч), в течение 10 ч составляет примерно 2.4% (рис. 1).
Рис. 1.
Изменение светового потока ртутной лампы НВО 50 в процессе измерений. Микроскоп Axioskop (Carl Zeiss, Германия).
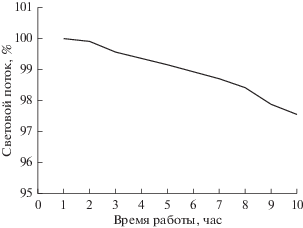
Необходимо учитывать этот фактор путем периодического измерения яркости изображения эталонного объекта (Лейси, 1992) и введения поправки на результаты измерений путем их умножения на поправочный коэффициент L0/Ln, где L0 – яркость эталонного объекта в начале измерений, Ln – то же через n дней. Необходимо также учитывать, что после включения ртутная лампа выходит на максимальный световой поток через 7–10 мин (Айзенберг, 2006), поэтому измерения следует начинать только после этого времени.
Неравномерность освещенности поля зрения приводит к изменению интенсивности флуоресценции объектов, находящихся в разных частях поля. Неравномерность освещенности существует в той или иной степени в любом микроскопе. Она может возникать из-за аберраций осветительной оптической системы и объектива. Объективы с плоским полем (план-объективы), работающие в режиме эпи-освещения, дают более равномерную освещенность по сравнению с другими типами объективов. Неравномерность освещенности может быть вызвана не только аберрациями осветительной системы, но и другими причинами, например, неправильной центрировкой лампы. Неравномерность освещенности наиболее заметна при исследовании относительно тонких препаратов, например, монослоя клеток, где окрашенные на ДНК ядра, расположенные на краю изображения, будут светиться слабее, чем в центре (рис. 2), хотя содержание ДНК в них может быть одинаково,
Рис. 2.
Изолированные гепатоциты крысы, окрашенные на ДНК аурамином-SO2 (флуоресцентный вариант реакции Фельгена). Микроскоп Axioskop (Carl Zeiss, Германия), объектив 40×/0.7, монохромная цифровая камера DFC360FX. Формат изображения 1392 × 1040. Масштабный отрезок 30 мкм. Пояснения в тексте статьи.
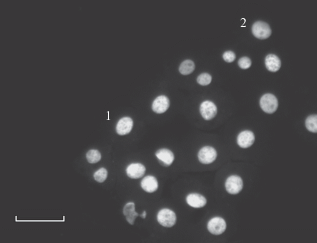
Для оценки неравномерности освещенности поля зрения используют тест-объекты с равномерно распределенным флуорохромом, например, тест-объект из стекла марки ЖС19, специальные пластиковые слайды фирмы Chroma Technology (США), флуоресцирующие в разных областях спектра, или самостоятельно изготовленные препараты с тонким слоем раствора флуорохрома.
Для программной корректировки исходного изображения необходимо получить изображение тест-объекта и воспользоваться программой ImageJ, версия 1.51 (National Institutes of Health, США), в которой имеется Calculator Plus. Корректировку изображения в этом случае проводят по формуле (Model, Burkhardt, 2001; Jonkman et al., 2014):
где: I' (x, y) – скорректированное изображение; I(x, y) – исходное изображение; IT(x, y) – изображение эталонного тест-объекта; AT – средняя яркость изображения тест-объекта.Например, на рис. 2 приведено нескорректированное изображение ядер гепатоцитов, окрашенных на ДНК аурамином-SO2 с помощью флуоресцентного варианта реакции Фельгена. Из-за неравномерной освещенности поля зрения отношение интегральной яркости тетраплоидного ядра 1 к интегральной яркости тетраплоидного ядра 2 составило 1.29. После корректировки изображения по формуле (5) отношение интегральных яркостей тех же ядер составило 1.05.
Неправильный выбор времени экспозиции. Иногда в процессе измерения встречаются объекты или препараты, в которых максимальная яркость некоторых участков изображения превышает линейный диапазон камеры, в результате чего возникают ошибки измерения. У драйверов многих камер имеется опция (Hi-Lo), позволяющая видеть на изображении выделенные цветом (например, красным) участки, в которых наблюдается такое превышение. Устранить эту проблему позволяет уменьшение времени экспозиции с последующим введением поправки для того, чтобы можно было сравнивать предыдущие и текущие измерения:
где L' и L – скорректированное и измеренное значение интегральной яркости объекта; E' и E – текущее и предыдущее время экспозиции.Выделение объекта на цифровом изображении. Работа с цифровым изображением вносит свои особенности. Например, имеются проблемы выделения на изображении исследуемых объектов, разделения близкорасположенных и наложенных объектов (Агафонова и др., 2013; Штейн и др., 2016).
Существуют несколько способов выделения объекта измерения на сохраненном цифровом изображении, реализуемые программным обеспечением. От выбора способа выделения будет зависеть точность измерений. Наиболее часто используют обводку вручную, выделение по пороговому уровню и автоматический градиентный способ. Обводку вручную с помощью “мыши”, “светового пера” или других устройств осуществляет оператор. Этот способ обычно используют для малоконтрастных объектов, при наличии соприкасающихся объектов или в случае наличия высокого уровня неоднородности фона. Для выделения контрастных, отдельно расположенных объектов, как правило, используют выделение по пороговому уровню, который устанавливает оператор. На рис. 3 представлены два способа выделения ядер в двуядерном кардиомиоците в процессе измерения интегральной яркости. По нашим данным, в индивидуальных хромосомах человека, окрашенных бромистым этидием, CV при измерении содержания ДНК при обводке вручную и при выделении по пороговому уровню были примерно одинаковы – 4.9% и 4.6% соответственно (Агафонова и др., 2013).
Рис. 3.
Кардиомиоцит крысы, окрашенный на ДНК аурамином-SO2 (флуоресцентный вариант реакции Фельгена). Микроскоп Axiovert 200M (Carl Zeiss, Германия), объектив 40×/0.7, цветная цифровая камера DFC420. Формат изображения 2592 × 1944. Масштабный отрезок 30 мкм. 1 – выделение ядра по уровню яркости; 2 – выделение участка фона ручной обводкой; 3 – выделение ядра ручной обводкой.
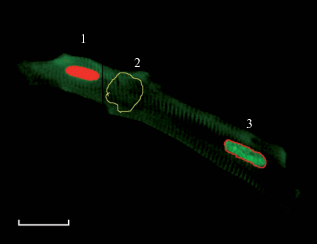
Градиентный способ реализуется программой обработки изображений (например, “Видеотест-Морфология”, Видеотест, Россия), и контуры объекта автоматически определяются по градиенту яркости на границе фон-объект.
Влияние фона на результаты измерений. На изображении имеются участки, не содержащие объекты измерения, которые обычно называют фоном. Интенсивность фонового сигнала и, главным образом, его вариабельность в разных участках препарата, может оказывать существенное влияние на результаты измерений, снижая их точность. Заметная интенсивность флуоресценции фона может быть вызвана ошибками в методике приготовления и окраски препарата, неспецифичным окрашиванием или влиянием фиксаторов. Заключающая среда и даже оптические элементы микроскопа могут также обладать флуоресценцией в исследуемом спектральном диапазоне (Ruch, 1966). Поэтому для повышения точности измерений следует вычесть яркость фона из измеренной яркости изображения объекта (Waters, Wittmann, 2014). Для этого необходимо измерить среднюю яркость фона области изображения, расположенной рядом с измеряемым объектом и вычислить скорректированную интегральную яркость объекта по формуле:
где: L' – скорректированная интегральная яркость объекта; L – измеренная интегральная яркость объекта; F – средняя яркость фона; S – площадь объекта.Например, на рис. 3 фон измеряли на цитоплазме кардиомиоцита, чтобы уменьшить влияние неспецифической окраски и других факторов.
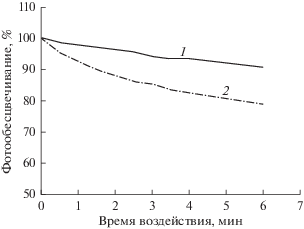
Фотообесцвечивание объектов измерения. Под действием возбуждающего света в препарате может происходить процесс фотохимического разложения флуорохрома, в результате чего интенсивность флуоресценции исследуемого объекта снижается (Vicente et al., 2007; Агафонова и др., 2013; Shaner, 2014). Уменьшение интенсивности флуоресценции объекта зависит от интенсивности возбуждающего света и продолжительности его воздействия. В результате фотообесцвечивания снижается точность измерений при МФМ. Эффект фотообесцвечивания можно уменьшить, проводя фокусировку микроскопа и поиск объектов в режиме фазового или дифференциального контраста. Для снижения фотообесцвечивания можно также уменьшить интенсивность возбуждающего света с помощью фильтров-ослабителей. Например, снижение интенсивности лампы до 25% уменьшает фотообесцвечивание до 2% в мин (рис. 4, кривая 1) против 7% в мин при интенсивности лампы 100% (рис 4, кривая 2).
Рис. 4.
Фотообесцвечивание препарата изолированных гепатоцитов крысы, окрашенных на ДНК аурамином-SO2, при длительном воздействии возбуждающего света с установкой интенсивности лампы 25% (кривая 1) и 100% (кривая 2). Микроскоп IX-83 (Olympus, Япония), ртутная лампа SHI-130 OL, объектив 60×/1.42, цветная цифровая камера DP73.
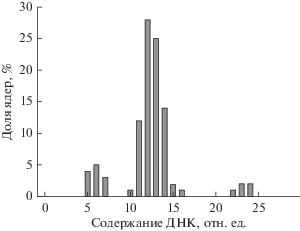
Проверка параметров анализатора по биологическому эталону. Комплексную проверку точностных параметров микрофлуориметра рекомендуют проводить по биологическому эталону (Агроскин, Папаян, 1977; Bocking, Nguyen, 2004), в качестве которого часто используют препараты изолированных гепатоцитов, окрашенных на ДНК (Штейн и др., 1998, 2016). Известно, что в печени млекопитающих (особенно грызунов) присутствуют полиплоидные одноядерные и двуядерные гепатоциты, содержание ДНК в ядрах которых составляет ряд значений, кратных диплоидному уровню (Бродский, Урываева, 1981). Такие препараты позволяют оценить аппаратную и методическую ошибки по соотношению между модальными значениями соседних классов плоидности. На рис. 5 представлена гистограмма распределения содержания ДНК в ядрах гепатоцитов крысы, окрашенных на ДНК аурамином-SO2 (флуоресцентный вариант реакции Фельгена). Она получена на анализаторе изображений, состоящем из микроскопа Axioskop (Carl Zeiss, Германия) с объективом 40×/0.75, блоком фильтров FS10 и цифровой камеры DFC360FX 1392 × 1040 (Leica-Microsystems, Германия). Отношение среднего содержания ДНК в ядрах разной плоидности составило: 4С : 2С = 2.10 (+5%). CV модального пика 4С ядер составил 6.9%. Одноядерные тетраплоидные гепатоциты крыс удобны в качестве эталона, поскольку их доля у взрослых животных составляет до 80% (Кудрявцев и др., 1986).
ЗАКЛЮЧЕНИЕ
В данной работе мы рассмотрели ошибки, связанные в основном с аппаратурой цифровой МФМ. Но существуют также методические проблемы, возникающие при использовании различных цитохимических процедур, которые выявляют те или иные клеточные компоненты. Правильный выбор методики приготовления и окраски препаратов может существенно увеличить точность МФМ. Это достигается, например, с помощью применения красителей, которые имеют максимум спектра испускания в области, где автофлуоресценция препарата минимальна, при использовании заключающей среды, уменьшающей фотообесцвечивание, и других приемов (Розанов, Кудрявцев, 1967; Longin et al., 1993).
Выбор иммерсионного масла также представляет определенную методическую проблему, так как его автофлуоресценция может привести к заметным ошибкам МФМ. Необходимо учитывать, что разные марки масла обладают разным уровнем автофлуоресценции, особенно в синей области спектра. Несмотря на маркировку, содержащую надписи типа “нефлуоресцирующее”, “fluorescence free”, “low fluorescence” и т.д., масло требует предварительной проверки. По нашему опыту, наилучшим иммерсионным маслом с этой точки зрения является масло 518F (Carl Zeiss, Германия).
В микроскопических исследованиях для получения цифровых изображений иногда используются бытовые цифровые фотоаппараты и т.н. “цифровые окуляры”. Однако все эти приборы годятся только для фотодокументирования и непригодны для цифровой МФМ из-за ряда проблем: невысокой чувствительности, значительного уровня шумов, нелинейности преобразования свет/сигнал, наличия различных автоматических настроек, трудностей стыковки с микроскопом (Пантелеев и др., 2005).
Таким образом, применение цифровой МФМ с учетом вышеизложенных методик уменьшения ошибок может обеспечить необходимую точность и производительность измерений, а также комплексность исследований в области клеточной биологии.
Список литературы
Айзенберг Ю.Б. 2006. Справочник по светотехнике. М.: Знак. 972 с. (Isenberg Yu.B. 2006. Handbook of lighting. M.: Znak. 972 p.).
Агафонова Н.А., Сакута Г.А., Розанов Ю.М., Штейн Г.И., Кудрявцев Б.Н. 2013. Микрофлуориметрия содержания ДНК в индивидуальных хромосомах человека с помощью анализатора изображений. Цитология. 55(5) : 358–347. (Agafonova N.A., Sakuta G.A., Rozanov Yu.M., Shtein G.I., Kudryavtsev B.N. 2013. DNA image-fluorometry of individual human chromosomes. Tsitologiya. 55(5) : 338–347).
Агроскин Л.С., Папаян Г.В. 1977. Цитофотометрия. Л.: Наука. 295 с. (Agroskin L.S., Papayan G.V. 1977. Cytophotometry. L.: Nauka. 295 p.).
Бродский В.Я., Урываева И.В. 1981. Клеточная полиплоидия. Пролиферация и дифференцировка. М.: Наука. 260 с. (Brodsky V.Ya., Uryvaeva I.V. 1981. Cell polyploidy. Proliferation and differentiation. M.: Nauka. 260 p.).
Кудрявцев Б.Н., Розанов Ю.М. 1974. Цитофлуориметрия. Общие принципы. В кн.: Методы биологии развития. М.: Наука. 497–500. (Kudryavtsev B.N., Rozanov Yu.M. 1974. Cytoflyorimetry. Main principles. In: Methods of biology of development. M.: Nauka. 497–500).
Кудрявцев Б.Н., Штейн Г.И., Терешин Г.Г. 1986. Анализ кинетики полиплоидизации клеток паренхимы печени крысы. Цитология. 28(8) : 828–836. (Kudryavtsev B.N., Shtein G.I.,Tereshin G.G. 1986. Analysis of cell polyploidization kinetics in the rat liver parenchyma. Tsitologiya. 28(8) : 828–836).
Ландсберг Г.С. 1976. Оптика. М.: Наука. 928 с. (Landsberg G.S. 1976. Optics. M.: Nauka. 928 p.).
Лэйси А. 1992. Световая микроскопия в биологии. Методы. М.: Мир. 464 с. (Lacey A. 1992. Light microscopy in biology. A practical approach. M.: Mir. 464 p.).
Пантелеев В.Г., Егорова О.В., Клыкова Е.И. 2005. Компьютерная микроскопия. М.: Техносфера. 304 с. (Panteleyev V.G., Egorova O.V., Klykova E.I. 2005. Computer microscopy. M.: Technosphere. 304 p.).
Розанов Ю.М., Кудрявцев Б.Н. 1967. Метод флуоресцентной цитофотометрии для количественного определения ДНК. Цитология. 9(3) : 361–368. (Rozanov Yu.M., Kudryavtsev B.N. 1967. Method of fluorescence microscopy for quantitative determination of DNA. Tsitologiya. 9(3) : 361–368.).
Шишловский А.А. 1961. Прикладная физическая оптика. М.: Физматгиз. 822 с. (Shishlovsky A.A. 1961. Applied physical optics. M.: Physmathgiz. 822 p.).
Штейн Г.И., Пантелеев В.Г., Поваркова А.В., Кудрявцев Б.Н. 1998. Возможности анализатора изображений “Видеотест” для проведения микрофотометрических исследований в цитологии. Цитология. 40(10) : 913–916. (Shtein G.I., Panteleyev V.G., Povarkova A.V., Kudryavtsev B.N. 1998. Capacities of image analyzer “Videotest” for microphotometric investigations in cytology. Tsitologiya. 40(10) : 913–916.).
Штейн Г.И., Пантелеев В.Г., Кудрявцев Б.Н. 2016. Методические проблемы цифровой цитофотометрии. Цитология. 58(3) : 234–242. (Shtein G.I., Panteleyev V.G., Kudryavtsev B.N. 2016. Methodological problems of digital cytophotometry. Tsitologiya. 58(3) : 234–242.).
Böcking A., Nguyen V.Q.H. 2004. Diagnostic and prognostic use of DNA image cytometry in cervical squamous intraepithelial lesions and invasive carcinoma. Cancer Cytopathology. 102 : 41–54.
Chieco P., Jonker A., Melchiorri C., Vanni G., Van Noorden C. 1994. A user’s guide for avoiding errors in absorbance image cytometry: A review with original experimental observations. Histochem. J. 26 : 1–19.
Chieco P., Jonker A., De Boer B.A., Ruijter J.A., Van Noorden C. 2013. Image cytometry: Protocols for 2D and 3D quantification in microscopic images. Progress in histochem. Cytochem. 47 : 211–333.
Lakowicz J.R. 1999. Principles of fluorescence spectroscopy. N.-Y., Kluwer Academic/Plenum Publishers. 698 p.
Lambert T.J., Waters J.C. 2014. Assessing camera performance for quantitative microscopy. Methods Cell Biol. 123 : 35–54.
Longin A., Souchier C., Ffrench M., Bryon P.A. 1993. Comparison of anti-fading agents used in fluorescence microscopy: Image analysis and laser confocal microscopy study. J. Histochem. Cytochem. 41 : 1833–1840.
Model A., Burkhardt J. 2001. A standard for calibration and shading correction of a fluorescence microscope. Cytometry. 44 : 309–316.
Pawley J.B. 2006. Points, pixels, and gray levels: Digitizing image data. In: Handbook of biological confocal microscopy. Madison, Springer. 9–79.
Petrak L.J., Waters J.C. 2014. A practical guide to microscope care and maintenance. Methods Cell Biol. 123 : 55–76.
Ruch F. 1966. Determination of DNA content by spectroflorometry. In: Introduction to quantitative cytochemistry. London, Acad. Press. 261–294.
Tailor D.L., Salmon E.D. 1989. Basic fluorescence microscopy. Methods Cell Biol. 29 : 207–237.
Shaner N.C. 2014. Fluorescent proteins for quantitative microscopy: Important properties and practical evaluation. Methods Cell Biol. 123 : 95–112.
Vicente N.B., Zamboni J.E.D., Adur J.F., Paravani E.V., Casco V.H. 2007. Photobleaching correction in fluorescence microscopy images. J. Phys. Confer. Ser. 90 : 1–8.
Waters J.C., Wittmann T. 2014. Concepts in quantitative fluorescence microscopy. Methods cell biol. 123 : 113–134.
Wegerhoff R., Weidlich O., Kassens M. 2006. Basics of light microscopy and imaging. Imaging and Microscopy. Weinheim, Wiley-VCH Verlag. 52 p.
Дополнительные материалы отсутствуют.