Цитология, 2019, T. 61, № 9, стр. 735-739
Действие митохондриального разобщителя 2,4-динитрофенола на рост перевиваемой аденокарциномы молочной железы мышей Ca755
Е. Е. Антошина 1, Т. Г. Горькова 1, Л. С. Труханова 1, В. А. Кобляков 1, *
1 Национальный исследовательский медицинский центр онкологии им. Н.Н. Блохина Минздрава России
115478 Москва, Россия
* E-mail: kobliakov@rambler.ru
Поступила в редакцию 05.04.2019
После доработки 28.05.2019
Принята к публикации 31.05.2019
Аннотация
Известно, что ингибиторы митохондриальных функций тормозят рост опухоли. 2,4-Динитрофенол (ДНФ) принадлежит к особой группе веществ, вызывающих разобщение дыхания и фосфорилирования в митохондриях. В результате активируется митохондриальная АТФ-аза и клетки ощущают нехватку АТФ. Ранее различными авторами было показано, что ДНФ стимулирует гибель опухолевых клеток в культуре. В настоящей работе изучали действие ДНФ на рост аденокарциномы молочной железы мышей Ca755, перевитой подкожно. ДНФ в концентрации 200 или 800 г/л давали крысам с питьевой водой. Торможение роста опухоли отмечали при концентрации ДНФ 200 мг/л. При большой концентрации ДНФ (800 мг/л в питьевой воде) торможение роста опухоли наблюдали на ранних сроках, затем оно сменялось ускорением роста. Видимо, ДНФ в дозе 800 мг/л обладает общетоксическим действием на животных, с чем и связано ускорение роста опухоли. Обсуждается возможность использования разобщителей в качестве противоопухолевых агентов в сочетании с ингибиторами гликолиза и (или) цитостатиками.
Основные свойства злокачественности – инвазия и метастазирование – реализуются благодаря разрушению межклеточного матрикса. В этом процессе принимают участие металлопротеиназы, активация которых вызвана подкислением межклеточного пространства, обусловленного переходом опухолевых клеток с тканевого дыхания на гликолиз. Переключение на гликолиз в опухолевых клетках происходит не только в условиях гипоксии, что наблюдается и в нормальной ткани, но и при оксигенации. Впервые этот эффект описал в 20-х гг. прошлого столетия Отто Варбург (Warburg, 1924) и поэтому аэробный гликолиз называют “эффект Варбурга”. Основным элементом переключения клеток на гликолиз и продвижения клеток в сторону опухолевой прогрессии является транскрипционный фактор HIFα. Эффективность образования АТФ при гликолизе намного меньше, чем при окислительном фосфорилировании. При окислении одной молекулы глюкозы при митохондриальном дыхании образуются 34 молекулы АТФ, а при гликолизе – только две. Недостающую энергию опухоль компенсирует усилением активности ферментов гликолиза, в первую очередь, транспортера глюкозы, что приводит к увеличенному потреблению глюкозы опухолью и истощению организма. Поэтому в процессе жизнедеятельности энергообеспечение опухолевых клеток может стать узким местом их функционирования.
Переход опухолевых клеток на гликолиз в большинстве случаев не связан с нарушением митохондриальных функций (Seyfried, Shelton, 2010). Показано, что онкобелки (продукты мутированных онкогенов) ответственны за опухолевую трансформацию и являются активаторами эффекта Варбурга благодаря стабилизации в опухоли транскрипционного фактора HIFα, который стимулирует гликолиз и ингибирует транспорт пирувата в митохондрии (Kobliakov, 2018). Одним из современных подходов к разработке новых методов лечения опухоли является ингибирование гликолиза. Ведутся исследования по использованию в качестве противоопухолевых препаратов ингибиторов различных стадий гликолиза.
Показано, что 2-дезоксиглюкоза, лонидамин, 3‑бромпируват, которые ингибируют гексокиназу, фосфорилирующую глюкозу с образованием глюкозо-6-фосфата, тормозят рост экспериментальных опухолей, а в некоторых случаях приводят к их полному рассасыванию (Di Cosimo et al., 2003; Huang et al., 2015; Lis et al., 2018). Однако при сохранении функционирующей дыхательной цепи митохондрий ингибирование гликолиза вызывает переключение превращения глюкозы с гликолиза на окислительное фосфорилирование. Поэтому в качестве противоопухолевой терапии предлагается одновременное ингибирование гликолиза и митохондриального дыхания. В качестве ингибитора митохондриального дыхания используется метформин. Это соединение блокирует перенос электронов в первом комплексе дыхательной цепи митохондрий. (Menendez et al., 2012; Zhuang et al., 2014) и является соединением, допущенным к использованию в медицинской практике. Совместное действие метформина и ингибитора гликолиза 2-дезоксиглюкозы вызывает апоптоз в культуре опухолевых клеток простаты LNCaP (Sahra et al., 2010).
Особое место среди ингибиторов окислительного фосфорилирования занимают вещества различной структуры, но имеющие общее свойство диссоциироваться в биологических средах. Эти соединения носят название “разобщители” дыхания и фосфорилирования. Они являются липофильными слабыми кислотами с константой диссоциации (рК) в интервале рН 4.0–7.0. (Terada, 1990). Эти соединения нарушают протонный градиент на внутренней мембране митохондрий, необходимый для синтеза АТФ, что вызывает ускоренное, без образования АТФ, потребление кислорода в дыхательной цепи митохондрий. В результате происходит падение межмембранного потенциала и активация митохондриальной АТФазы, что приводит к нехватке АТФ в клетке. Низкий уровень АТФ и высокие уровни АДФ и АМФ стимулируют активацию АМР-киназы (АМРК) и ингибирование киназы мТОР (Lim et al., 2009). Одной из функций мТОР является стимуляция процесса трансляции благодаря активации трансляционных факторов elf4E и S6K. Уменьшение активности мТОР вызывает падение уровня фактора HIFα (Hsu et al., 2013) и уменьшение гликолиза.
Разобщители дыхания и фосфорилирования нашли применение в методиках лечения ожирения (Grundlingh et al., 2011). В настоящее время разобщители исследуются как возможные противоопухолевые агенты. В то же время у известных противоопухолевых препаратов есть свойства разобщителей и поэтому обсуждается возможность механизма их противоопухолевого действия именно как разобщающее. Например, у противоопухолевого препарата неморозон (nemorosone) выявлено свойство разобщителя и предполагается, что его противоопухолевое действие связано с этим его свойством (Pardo-Andreu et al., 2011). Исследование действия на противоопухолевую активность разобщителей, таких как FCCP (carbonyl cyanide p-trifluoromethoxyphenylhydrazone) (Han et al., 2009), никлозамиде (niclosamide) (Kumar et al., 2018) и других показало, что они обладают способностью тормозить рост экспериментальных опухолей, как в культуре клеток, так и в экспериментах in vivo.
В процессе роста опухоли важное значение имеет скорость роста сосудов для снабжения опухоли кислородом и питательными веществами. В нетрансформированных клетках взрослого организма клетки эндотелия не растут, потребление ими кислорода и необходимость в энергии у них незначительна. В опухолевой ткани при быстром ее росте необходим рост сосудов, поставляющих в опухоль питательные вещества и кислород. Показано, что в эндотелиальных клетках опухоли потребление кислорода в 3 раза выше, чем в нормальных тканях и соответственно резко увеличивается потребление энергии. Одним из аспектов противоопухолевого действия разобщителей является ингибирование роста сосудов (Coutelle et al., 2014).
Одним из наиболее изучаемых разобщителей является 2,4-динитрофенол (ДНФ). Это соединение было первым веществом, идентифицированным как разобщитель. История применения ДНФ в качестве лекарственного средства уходит в 30-ые г. 20-го в., когда его впервые использовали в качестве средства для похудения (Tainter et al., 1935). В настоящее время синтезировано несколько типов разобщителей, применяемых в лечении ожирения.
При исследовании клеток в культуре ДНФ вызывал гибель опухолевых клеток благодаря усилению апоптоза и активации АМРК (Han et al., 2008). Однако информации по изучению противоопухолевого действия ДНФ на животных нет. Чтобы устранить этот пробел, в настоящей работе изучали действие ДНФ на рост аденокарциномы молочной железы мышей Ca755.
МАТЕРИАЛ И МЕТОДИКА
Животные и схема эксперимента. В качестве модели перевиваемой опухоли использовали опухоль молочной железы мышей Ca755, полученную от спонтанной опухоли молочной железы у мыши линии C57Bl. Опухоль была предоставлена банком замороженных в жидком азоте тканей Института канцерогенеза Национального исследовательского медицинского центра онкологии им. Н.Н. Блохина МЗ РФ (Москва). Для получения достаточного количества массы перевиваемого материала опухоль перевивали подкожно мышам-самкам линии С57Bl. На 7-е сут после перевивки животных умерщвляли при помощи эфирного наркоза, опухоль вырезали, освобождали от некротически измененных участков, отмывали в стерильном физиологическом растворе. Опухолевую массу взвешивали, измельчали путем продавливания через специальный тканевый измельчитель, затем опухолевую массу разводили физиологическим раствором из расчета 1 г на 10 мл. Полученный гомогенат в дозе 0.5 мл вводили подкожно мышам-самкам линии BDF1 в правую подмышечную впадину.
Перед началом эксперимента мышей метили, взвешивали, рассаживали в клетки и делили на группы. Группа 1 (14 мышей) – контрольная группа. Группа 2 (10 мышей) получала ДНФ в концентрации 800 мг/л. Группа 3 (10 мышей) получала ДНФ в концентрации 200 мг/л. Перевивку Ca755 делали одновременно всем экспериментальным животным. После появления первых узелков опухоли (6-е сут после перевивания) мыши в группах 2 и 3 стали получать ДНФ с питьевой водой в концентрации 800 и 200 мг/л соответственно. Ежедневно в среднем мышь (как в экспериментальной группе, так и в контроле) выпивала по 2 мл жидкости. Таким образом, ежедневное потребление ДНФ в группе, получавшей с питьевой водой 200 мг/мл, составляло 0.4 мг вещества, а в группе, получавшей 800 мг/л, – 1.6 мг. Поскольку ДНФ является стабильным соединением, то воду меняли 3 раза в неделю. Критерием противоопухолевого действия ДНФ является изменение объема опухоли по сравнению с контролем.
Объем опухолей. Средний объем опухоли вычисляли как произведение величин трех взаимно перпендикулярных размеров опухоли Измерение проводили 3 раза в нед.
Статистическая обработка данных. Для оценки достоверности различий между выборками использовали t-критерий Стьюдента и уровень значимости Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
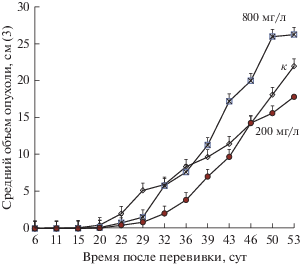
Узелки на месте перевивки опухоли Ca755 появлялись почти одновременно во всех группах на 6-е сут эксперимента. Пальпируемые опухоли начинали определяться через 20 сут после перевивки во всех трех группах животных (рис. 1). Через 29 сут после перевивки у животных, получавших обе дозы ДНФ, опухоли едва прощупывались, а в контрольной группе размер опухоли составлял уже 5 см3. На 32-е сут эксперимента средний размер опухоли в контрольной группе и в группе, получавшей 800 мг/мл ДНФ, стал одинаковым. Начиная с 36-х сут эксперимента опухоль в группе, получавшей 800 мг ДНФ, стала расти быстрее, чем в контрольной группе. В группе животных, получавшей 200 мг/мл ДНФ, средний размер опухоли был меньше, чем в контрольной группе на всем протяжении эксперимента. Усиление роста опухоли на средних и поздних стадиях эксперимента при действии большой дозы ДНФ (800 мг мг/л), видимо, связано с его общим токсическим действием на организм.
Рис. 1.
Действие 2,4-динитрофенола (ДНФ) на скорость роста опухоли молочной железы Ca755 у мышей. Опухоль перевита подкожно. ДНФ в концентрации 200 и 800 мг/л давали мышам с питьевой водой. К – контрольные животные. Достоверное различие между раз-мером опухоли в группе К и в группе, получавшей с питьевой водой ДНФ в концентрации 200 мг/л, наблюдали на 29-е сут (Р < 0.05).
Токсический эффект ДНФ может быть связан как с энергетическим истощением организма ввиду распада АТФ, так и с повышением температуры организма. Распад АТФ при действии разобщителей, в том числе и ДНФ, сопровождается выделением тепла и разогреванием организма. Показано, что температура тела при действии ДНФ может повыситься до 43°С (Grundlingh et al., 2011). Ускоренный транспорт протонов без образования АТФ через мембрану митохондрий вызывает каскад биохимических реакций, дающих как геномный так и негеномный эффект. Происходит уменьшение образования активных форм кислорода в дыхательной цепи митохондрий (Miwa et al., 2003), что влечет за собой уменьшение уровня кальция в митохондриях и активацию циклической АМФ (Geisler, 2019).
Одним из элементов противоопухолевой защиты в клетке является опухолевый супрессор р53 (Bieging et al., 2014). В большинстве опухолей происходят инактивирующие мутации в структуре гена-супрессора р53 (Stiewe, Haran, 2018), что приводит к ускорению роста опухоли и меньшей чувствительности к действию цитостатиков. Сравнительное исследование по действию разобщителя никлозамида на рост перевиваемых опухолей с мутацией в гене р53 и без нее продемонстрировало, что клетки опухоли с мутацией в гене р53 более чувствительны к токсическому действию разобщителя, чем клетки, в которых ген р53 находился в нативном состоянии (Kumar et al., 2018). Авторы считают, что этот эффект связан с тем, что под действием разобщителя происходит увеличение цитоплазматического кальция, а в отсутствии р53 увеличенный уровень кальция вызывает активацию фосфолипазы А2 (Lin et al., 1992). Происходит образование арахидоновой кислоты из липидов, которая стимулирует активацию каспаз 3 и 9, выхода цитохрома С и апоптоз (Kumar et al., 2018).
Полученные нами результаты говорят о том, что ДНФ действует на рост опухоли примерно так же, как и ранее исследованные другие вещества со свойствами разобщения. По-видимому, этот класс соединений вряд ли найдет применение в монотерапии, но благодаря уменьшению уровня АТФ в клетках опухоли должно происходить ослабление функционирования Р-гликопротеинов – белков, способствующих выбросу цитостатиков из клетки. Для функционирования Р-гликопротеинов требуется большое количество АТФ, поэтому совместное действие ингибиторов гликолиза и митохондриального дыхания усилит действие цитостатиков. В этой связи будущие исследования должны проводиться на моделях с использованием разобщителей в сочетании с другими веществами (цитостатитками).
Другой путь использования разобщителей связан с совместным введением их с ингибиторами гликолиза. Вызванная разобщителями нехватка АТФ в опухолевых клетках, требующих постоянного притока энергии для своего роста, не может быть восполнена за счет гликолиза, что приводит или к прекращению роста опухоли, или к апоптозу (Bost et al., 2016). Совместное использование ингибиторов гликолиза и митохондриального дыхания дает обнадеживающие результаты (Cheong et al., 2011) в дальнейшем поиске комбинации этих двух классов ингибиторов.
Список литературы
Bieging K.T., Mello S.S., Attardi L.D. 2014. Unravelling mechanisms of p53-mediated tumour suppression. Nat. Rev. Cancer. 14 : 359–370.
Bost F., Decoux-Poullot A.G., Tanti J.F., Clavel S. 2016. Energy disruptors: Rising stars in anticancer therapy? Oncogenesis. 5 : e188. https://doi.org/10.1038/oncsis.2015.46
Cheong J.H., Park E.S., Liang J., Dennison J.B., Tsavachidou D., Nguyen-Charles C., Wa Cheng K., Hall H., Zhang D., Lu Y., Ravoori M., Kundra V., Ajani J., Lee J.S., Ki Hong W., Mills G.B. 2011. Dual inhibition of tumor energy pathway by 2-deoxy-glucose and metformin is effective against a broad spec-trum of preclinical cancer models. Mol. Cancer Ther. 10 : 2350–2362.
Coutelle O., Hornig-Do H.T., Witt A., Andree M., Schiffmann L.M., Piekarek M., Brinkmann K., Seeger J.M., Liwschitz M., Miwa S., Hallek M., Krönke M., Trifunovic A., Eming S.A., Wiesner R.J., Hacker U.T., Kashkar H. 2014. Embelin inhibits endothelial mitochondrial respiration and impairs neoangiogenesis during tumor growth and wound healing. EMBO Mol. Med. 6 : 624–639.
Di Cosimo S., Ferretti G., Papaldo P., Carlini P., Fabi A., Cognetti F. 2003. Lonidamine: Efficacy and safety in clinical trials for the treatment of solid tumors. Drugs Today (Barc). 39 : 157–174.
Geisler J.G. 2019. 2,4-Dinitrophenol as medicine. Cells. 8. pii E280. https://doi.org/10.3390/cells8030280
Grundlingh J., Dargan P.I., El-Zanfaly M., Wood D.M. 2011. 2,4-Dinitrophenol (DNP): A weight loss agent with significant acute toxicity and risk of death J. Med. Toxicol. 7 : 205–212.
Han Y.H., Kim S.W., Kim S.H., Kim S.Z., Park W.H. 2008. 2,4-Dinitrophenol induces G1 phase arrest and apoptosis in human pulmonary adenocarcinoma Calu-6 cells. Toxicol. In Vitro. 22 : 659–670.
Han Y.H., Moon H.J., You B.R., Kim S.Z., Kim S.H., Park W.H. 2009. Effects of carbonyl cyanide p-(trifluoromethoxy) phenylhydrazone on the growth inhibition in human pulmonary adenocarcinoma Calu-6 cells. Toxicology. 265 : 101–107.
Hsu C.C., Wang C.H., Wu. LC., Hsia C.Y., Chi. CW., Yin P.H., Chang C.J., Sung M.T., Wei Y.H., Lu S.H., Lee H.C. 2013. Mitochondrial dysfunction represses HIF-1α protein synthesis through AMPK activation in human hepatoma HepG2 cells. Biochim. Biophys. Acta.1830 : 4743–4751.
Huang C.C., Wang S.Y., Lin L.L., Wang P.W., Chen T.Y., Hsu W.M., Lin T.K., Liou C.W., Chuang J.H. 2015. Glycolytic inhibitor 2-deoxyglucose simultaneously targets cancer and endothelial cells to suppress neuroblastoma growth in mice. Dis. Model Mech. 8 : 1247–1254.
Kobliakov V. 2018. HIFα as a target for different oncoproteins during carcinogenesis. Advances Mol. Oncol. 5 : 64–71.
Kumar R., Coronel L., Somalanka B., Raju A., Aning O.A., An O., Ho Y.S., Chen S., Mak S.Y., Hor P.Y., Yang H., Lakshmanan M., Itoh H., Tan S.Y., Lim Y.K., Wong A.P.C., Chew S.H., Huynh T.H., Goh B.C., Lim C.Y., Tergaonkar V., Cheok C.F. 2018. Mitochondrial uncoupling reveals a novel therapeutic opportunity for p53-defective cancers. Nature Commun. 9 : 3931. https://doi.org/10.1038/s41467-018-05805-1
Lim H.W., Lim H.Y., Wong K.P. 2009. Uncoupling of oxidative phosphorylation by curcumin: Implication of its cellular mechanism of action. Biochem. Biophys. Res. Commun. 389 : 187–912.
Lin L.L., Lin A.Y., Knopf J.L. 1992. Cytosolic phospholipase A2 is coupled to hormonally regulated release of arachidonic acid. Proc. Natl. Acad. Sci. USA. 89 : 6147–6151.
Lis P., Dyląg M., Niedźwiecka K., Ko Y.H., Pedersen P.L., Goffeau A., Ułaszewski S. 2016. The HK2 Dependent “Warburg Effect” and mitochondrial oxidative phosphorylation in cancer: Targets for effective therapy with 3-bromopyruvate. Molecules. 21. pii E1730. https://doi.org/10.3390/molecules21121730
Menendez J.A., Oliveras-Ferraros C., Cufí S., Corominas-Faja B., Joven J., Martin-Castillo B., Vazquez-Martin A. 2012. Metformin is synthetically lethal with glucose withdrawal in cancer cells Cell Cycle. 11 : 2782–2792.
Miwa S., Brand M.D. 2003. Mitochondrial matrix reactive oxygen species production is very sensitive to mild uncoupling. Biochem. Soc. Trans. 31 : 1300–1301.
Pardo-Andreu G.L., Nuñez-Figueredo Y., Tudella V.G., Cuesta-Rubio O., Rodrigues F.P., Pestana C.R., Uyemura S.A., Leopoldino A.M., Alberici L.C., Curti C. 2011. The anti-cancer agent nemorosone is a new potent protonophoric mitochondrial uncoupler. Mitochondrion. 11 : 255–263.
Sahra I., Laurent K., Giuliano S., Larbret F., Ponzio G., Gounon P., Le Marchand-Brustel Y., Giorgetti-Peraldi S., Cormont M., Bertolotto C., Deckert M., Auberger P., Tanti J. F.,Bost F. 2010. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells. Cancer Res. 70 : 2465–2475.
Seyfried T.N., Shelton L.M. 2010. Cancer as a metabolic disease. Nutr. Metab. (Lond). 7 : 7. https://doi.org/10.1186/1743-7075-7-7
Stiewe T., Haran T.E. 2018. How mutations shape p53 interactions with the genome to promote tumorigenesis and drug resistance. Drug Resist. Updat. 38 : 27–43.
Tainter M.L., Cutting W.C., Hines E. 1935. Effects of moderate doses of dinitrophenol on the energy exchange and nitrogen metabolism of patients under conditions of restricted dietary. J. Pharmacol. Exp. Ther. 553 : 26–353.
Terada H. 1990. Uncouplers of oxidative phosphorylation. Environ. Health Perspect. 87 : 213–218.
Warburg O., Posener K., Negelein E. 1924. Über den Stoffwechsel der Karzinomzellen. Biochemische Zeitschrift. 152 : 309–344.
Zhuang Y., Chan D.K., Haugrud A.B., Miskimins W.K. 2014. Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo. PLoS One. 9 : e108444. doi. eCollection 2014https://doi.org/10.1371/journal.pone.0108444
Дополнительные материалы отсутствуют.


