Цитология, 2019, T. 61, № 9, стр. 740-749
Ультраструктурные характеристики медленных и быстрых мышечных волокон крыс после цикла принудительного плавания на фоне введения экстракта зеленого чая и солей аммония
Е. В. Байдюк 1, 2, В. Е. Соболев 2, 3, Е. А. Корф 2, И. В. Миндукшев 2, А. И. Кривченко 2, Н. В. Гончаров 2, 3, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
3 Научно-исследовательский институт гигиены, профпатологии и экологии человека ФМБА России
188663 Ленинградская обл, г. п. Кузьмоловский, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 13.05.2019
После доработки 10.06.2019
Принята к публикации 21.06.2019
Аннотация
Поиск и изучение механизма действия веществ природного происхождения, снижающих утомление и восстанавливающих работоспособность скелетных мышц при экстремальных физических нагрузках, является одной из важнейших задач спортивной физиологии и медицины. Сравнение эффектов декофеинизированного экстракта зеленого чая (ЭЗЧ) и хлорида аммония (ХА), который ранее был апробирован нами отдельно и в сочетании с ЭЗЧ в модели принудительного плавания, позволило установить стимулирующий эффект ХА, превышающий действие ЭЗЧ. В настоящей работе на основе данных электронной микроскопии проведены морфометрические исследования мышечных волокон m. soleus (SOL) и m. extensor digitorum longus (EDL) крыс после цикла принудительного плавания на фоне действия ЭЗЧ и низких доз солей аммония, хлорида (ХА) или карбоната (КА). У крыс группы ЭЗЧ адаптация к физической нагрузке происходит главным образом за счет увеличения средней площади митохондрий в мышцах SOL. У крыс группы ХА адаптация обусловлена увеличением средней площади митохондрий в мышцах EDL, при этом средняя площадь поперечно ориентированных по отношению к плоскости среза Т-трубочек (ТТ) в этих мышцах уменьшается наряду с увеличением доли продольно ориентированных ТТ, что свидетельствует о разрывах мышечных волокон. Сочетанное действие ХА и ЭЗЧ обеспечивает аддитивность функционального эффекта за счет увеличения средней площади и объемной плотности митохондрий в мышцах EDL, средней площади ТТ в мышцах SOL и EDL, а также их количества в мышцах EDL. У крыс группы КА функциональный эффект обусловлен увеличением средней площади ТТ в мышцах EDL и их количества в мышцах SOL. При этом доля продольных ТТ в мышцах EDL, а значит и разрывов мышечных волокон, возрастает. В группе совместного действия КА и ЭЗЧ выявлены изменения митохондриального аппарата в медленных, но особенно в быстрых мышцах, а также увеличение площади ТТ в мышцах SOL. Анализ ультраструктурных характеристик свидетельствует о том, что эффективность препаратов обусловлена главным образом адаптационными изменениями ТТ и митохондрий быстрых мышц, но она повышается при участии медленных мышечных волокон в структурно-функциональной адаптации к предельной физической нагрузке.
Поиск препаратов природного происхождения, снижающих утомление и повышающих физическую работоспособность, является одним из важнейших направлений научных исследований в области спортивной физиологии и медицины (Goncharov et al., 2016). При изучении эффективности тех или иных препаратов и механизмов влияния интенсивной физической нагрузки на мышечную функцию используют специально разработанные тренинговые методики с последующим анализом широкого спектра функциональных, биохимических и морфометрических характеристик мышц (Новожилов и др., 2014; Morissette et al., 2014). Биологически активные добавки и компоненты продуктов питания (нутрицевтики), минералы и метаболиты природного происхождения, не входящие в списки запрещенных препаратов, могут повышать физическую выносливость и работоспособность путем положительного влияния на баланс сигнальных и метаболических процессов в клетках и тканях организма.
Лактат и аммиак ранее считались побочными продуктами метаболизма, перенос и нейтрализация которых исключительно в печени осуществлялись посредством циклов Кори и аланина. Переоценка роли лактата (в отличие от аммиака) была произведена достаточно давно и ныне лактат рассматривается как важнейший межклеточный энергетический челнок и сигнальный агент (Ferguson et al., 2018). В быстрых мышцах повышается экспрессия монокарбоксилатного переносчика 4-го типа (МСТ4) для усиленного экспорта лактата, который попадает в эритроциты и медленные мышцы через МСТ1 (Maciejewski et al., 2016). Эритроциты помогают транспортировать лактат от клеток-продуцентов к клеткам-потребителям, причем роль эритроцитов у тренированных спортсменов повышается (Opitz et al., 2015). Однако отношение к аммиаку как исключительно токсическому агенту за последние десятилетия не изменилось. Аммиак непрерывно образуется во всех органах и тканях организма, а наиболее активными его продуцентами являются нервная ткань, печень, кишечник, мышцы. Избыток аммиака – фактор неблагоприятный, так что его скорейшее преобразование с помощью, например, аргинина и цитруллина (компонентов цикла мочевины) позволяет повысить выносливость бегунов на длинные дистанции (Cheng et al., 2016).
С другой стороны, в мышцах генерацию аммиака следует рассматривать не только как результат катаболизма аминокислот и макроэргов, но и как механизм связывания ионов водорода и нейтрализации органических кислот (в первую очередь, лактата), уровень которых повышается при физической нагрузке, нарушая ионный баланс. В своей работе мы исходим из предположения, что аммиак, введенный в организм в малых дозах через желудочно-кишечный тракт незадолго до выполнения аэробно-анаэробной нагрузки, может способствовать адаптивной перестройке метаболических путей в эритроцитах и скелетных мышцах в условиях предельной физической нагрузки, оптимизируя их основные функции и, в конечном итоге, повышая выносливость организма.
В одной из наших последних публикаций представлены результаты сравнения эффектов декофеинизированного экстракта зеленого чая (ЭЗЧ) и хлорида аммония (ХА), который был апробирован в самостоятельном виде и в сочетании с ЭЗЧ как стимулятор физической работоспособности (Гончаров и др., 2018). В модели принудительного плавания установлен стимулирующий эффект ХА, превышающий действие ЭЗЧ. Выявлены разнонаправленные адаптивные изменения некоторых биохимических показателей плазмы крови и эритроцитов крыс в группах с применением ЭЗЧ и ХА, установлен эффект усиления действия препаратов на продолжительность выполнения плавательной нагрузки при совместном их использовании.
Цель настоящей работы – на основе данных электронной микроскопии провести морфометрическое исследование мышечных волокон m. soleus (SOL) и m. extensor digitorum longus (EDL) крыс после цикла принудительного плавания при введении им ЭЗЧ или одной из двух солей аммония в малой дозе – ХА или карбоната аммония (КА). ЭЗЧ и соль аммония использовали порознь и совместно. Морфометрическими показателями служили средняя площадь и объемная плотность митохондрий, средняя площадь просветов и число Т-трубочек на единицу площади, доля продольно и поперечно ориентированных Т-трубочек. Данные показатели отражают функциональную адаптацию или, наоборот, дезадаптацию мышечных волокон к предельной физической нагрузке, т. к. свидетельствуют о развитии механизмов генерации энергии, электромеханического сопряжения (ЭМС) и мобилизации ионов Са2+, а также о степени повреждения мышечных волокон.
МАТЕРИАЛ И МЕТОДИКА
Модель принудительного плавания и схема эксперимента. Все эксперименты проводили в соответствии с “Правилами проведения работ с подопытными животными”, утвержденными комиссией по этике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (Санкт-Петербург). Крыс-самцов линии Вистар весом 210 ± 20 г содержали в стандартных условиях вивария и предварительно адаптировали к воде при температуре воды 32°С в течение 5 сут. На 6-е сут проводили тестирование крыс с грузом, вес которого составлял 7% от веса тела. Тестирование заключалось в плавании крыс по 3 мин с интервалом 1 мин при температуре воды 28°С до полного утомления. Седьмой день 1-, 2- и 3-й нед. цикла принудительного плавания был выходным. Препараты вводили, начиная со 2-й нед. эксперимента. В течение пяти дней 2- и 3-й нед. крыс подвергали нормированной нагрузке: плавание по 3 мин с интервалом 1 мин при температуре воды 28°С с грузом 7% от веса тела, общая продолжительность плавания составляла 50–60% от показателей тестирования. На 6-й день 2-й и 3-й нед. проводили промежуточное тестирование. В течение 4-х дней 4-й нед. эксперимента крысам давали предельную нагрузку; условия и критерии утомления те же, что и при тестировании. На пятый день 4-й нед. эксперимента, т.е. через 1 сут после окончания цикла плавательной нагрузки, животных умерщвляли посредством декапитации гильотиной, после чего извлекали мышцы SOL и EDL.
Группы животных. По результатам тестирования формировали 6 групп: контрольную группу (интактные животные) (1), группы ХА (2) и КА (3) – плавание на фоне введенного перорально КА или ХА соответственно в дозе 10 мг на 1 кг массы тела животного за 5 мин до начала плавательной нагрузки; группу ЭЗЧ (4) – плавание на фоне введенного перорально водного раствора препарата ЭЗЧ в дозе 12 мг/кг в пересчете на катехины за 2 ч до нагрузки и через 2 ч после окончания нагрузки (суточная доза катехинов 24 мг/кг); группу ЭЗЧ + ХА (5) – плавание на фоне введенного ЭЗЧ в сочетании с ХА и группу ЭЗЧ + КА (6) – плавание на фоне ЭЗЧ в сочетании с КА. Объем вводимых за один раз растворов одному животному не превышал 1 мл ЭЗЧ и 0.3 мл соли аммония.
Трансмиссионная электронная микроскопия (ТЭМ). Для проведения ТЭМ образцы ткани мышц крыс фиксировали в 2.5%-ном растворе глутаральдегида на какодилатном буфере pH 7.4, содержащем 0.15 М сахарозы, постфиксировали в 1%-ном растворе OsO4 и после постепенного обезвоживания в ряду спиртов и ацетона заключали в смесь Эпона и Аралдита. Ультратонкие срезы получали на ультратоме LKB III (Швеция) с помощью стеклянных ножей. Срезы помещали на медные сетки, контрастировали уранилацетатом и цитратом свинца и просматривали в электронном микроскопе LIBRA 120 Carl Zeiss (Германия). При морфометрическом исследовании в анализ брали только продольные срезы миоцитов. У каждого животного анализировали по 10–20 полей зрения. Все морфометрические показатели (среднюю площадь митохондрий, объемную плотность митохондрий, площадь просветов и количество Т-трубочек) определяли с помощью программы для анализа изображений “ImageJ”, используя электронограммы, отснятые при увеличении 5000×.
Статистическая обработка данных. Статистическую обработку данных проводили с использованием программ Microsoft Excel 2007 и SigmaPLot 11.0. Для каждого параметра рассчитывали среднее значение и ошибку среднего. Достоверность отличий оценивали, используя t-критерий Стьюдента. Различия считали значимыми при уровне достоверности 95% (P < 0.05). Различия при уровне достоверности в 90% не считали значимыми, но отмечали как тенденцию к изменению.
Использованные реактивы: препарат ЭЗЧ (Sunphenon 90D, Taiyo International Inc., США), глутаральдегид, какодилатный буфер, четырехокись осмия, смесь аралдитов, метиленовый синий и толуидиновый синий (Sigma-Aldrich, США), уранилацетат (Polysciences Inc., США), ХА, КА, ацетон, цитрат свинца (Вектон, Россия).
РЕЗУЛЬТАТЫ
Электронно-микроскопическое (ТЭМ) и морфометрическое исследования медленной SOL и быстрой EDL мышц крыс, выполнявших нормированную и предельную нагрузку в разработанной нами модели принудительного плавания и получавших препараты ЭЗЧ и солей аммония, позволили выявить значительные изменения митохондриального аппарата крыс. Они проявлялись, в первую очередь, в увеличении средней площади митохондрий в обеих мышцах почти во всех группах крыс (рис. 1а). В мышцах SOL крыс группы ЭЗЧ средняя площадь митохондрий увеличивалась на 25.5% по сравнению с контролем, а в группе ЭЗЧ + КА – на 17.5%. В группах КА и ХА отличий от контроля в мышцах SOL не было, а в группе ЭЗЧ + ХА средняя площадь митохондрий уменьшалась на 17%.
Рис. 1.
Параметры митохондрий по данным электронно-микроскопического исследования миоцитов медленных (SOL) и быстрых (EDL) мышечных волокон крыс. а – Средняя площадь отдельных митохондрий (СПМ, мкм2), б – объемная плотность митохондрий (ОПМ, %). Все величины выражены как среднее значение и их ошибка. Отличие от контроля (К) достоверно (*) при P < 0.05. Группы ХА и КА – плавание на фоне введенного перорально КА или ХА соответственно в дозе 10 мг/кг за 5 мин до начала плавательной нагрузки; группа ЭЗЧ – плавание на фоне вводимого перорально водного раствора ЭЗЧ в дозе 12 мг/кг в пересчете на катехины за 2 ч до нагрузки и через 2 ч после окончания нагрузки; группы ЭЗЧ + ХА и ЭЗЧ + КА – плавание на фоне вводимого препарата ЭЗЧ дважды в день в сочетании с ХА или КА, введенных в дозе 10 мг/кг за 5 мин до начала нагрузки.
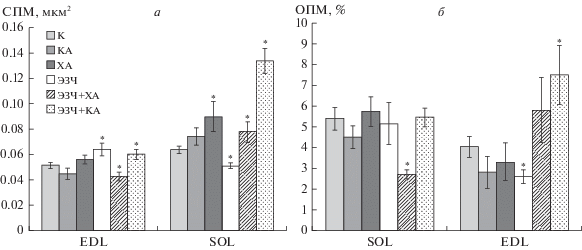
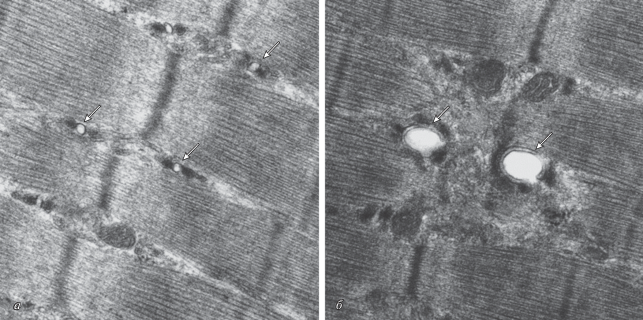
В мышцах EDL выявлены более значительные изменения средней площади митохондрий. В группах ХА и ЭЗЧ + КА встречаются митохондрии, вытянутые на длину одного–двух саркомеров (рис. 2), так что средняя площадь митохондрий в мышцах EDL этих групп превышает контроль на 42 и 110% соответственно (рис. 1а). Объемная плотность митохондрий в мышцах SOL и EDL большинства групп не отличается от контрольных значений, но в мышцах SOL группы ЭЗЧ + ХА она снижена относительно контроля на 50%. В мышцах же EDL в группе ЭЗЧ объемная плотность митохондрий снижается на 64%, а в группе ЭЗЧ + КА – повышается на 87% (рис. 1б).
Рис. 2.
Электронно-микроскопические фотографии (ТЭМ) миоцитов мышц EDL крысы после плавательной нагрузки: а – контрольная группа; б, в – соответственно группа ХА (плавание на фоне введения ХА) и группа ЭЗЧ+КА (плавание на фоне вводимых ЭЗЧ и КА). Стрелками указаны митохондрии, СМ – саркомеры. На снимках б, в видны гигантские митохондрии, образовавшиеся в результате слияния (fusion) митохондрий меньших размеров. ТЭМ. Увеличение 5000×.

Помимо изменений митохондриального аппарата, в некоторых группах крыс выявлены изменения тубулярной системы мышечных волокон. Проанализированы изменения площади просветов Т-трубочек, их общее количество на единицу площади цитоплазмы и ориентированность относительно оси клетки. Как и в случае с митохондриями, наибольшие отличия от группы интактного контроля выявлены в ультраструктурных изменениях мышечных волокон EDL. В группе ЭЗЧ + ХА и особенно в группе КА отмечено значительное расширение Т-трубочек, площадь их просветов увеличена в 1.5 и 2 раза соответственно (рис. 3а, рис. 4). При этом количество Т-трубочек на единицу площади цитоплазмы (на 100 мкм2) в мышцах EDL группы КА снижено на 18%, а в группе ЭЗЧ + ХА увеличено на 19% (рис. 3б). Уменьшение числа Т-трубочек на 31% относительно контроля отмечено в миоцитах SOL крыс группы ЭЗЧ (рис. 3б).
Рис. 3.
Параметры Т-тубулярной системы по данным электронно-микроскопического исследования миоцитов медленных (SOL) и быстрых (EDL) мышечных волокон крыс : а – средняя площадь просветов поперечных Т-трубочек (мкм2), б – число Т-трубочек на 100 мкм2 площади цитоплазмы. Все величины выражены как среднее значения и их ошибки. Отличия от контроля достоверны (*) при P < 0.05. Объяснения названий групп даны в подписи к рис. 1.
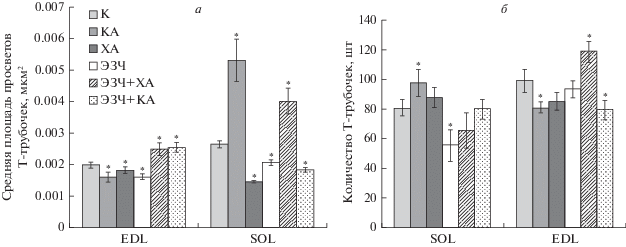
Рис. 4.
Электронно-микроскопические фотографии миоцитов мышц EDL крысы после плавательной нагрузки. а – Контрольная группа; б – группа КА (плавание на фоне введения КА). Стрелками указаны Т-трубочки. В контроле видны классические триады – структуры ЭМС, образовавшиеся в результате прямого взаимодействия (сопряжения) дигидропиридиновых рецепторов, расположенных на Т-трубочках (светлые “отверстия” посредине), и рианодиновых рецепторов, расположенных в мембранах саркоплазматического ретикулума (темные пятна с двух сторон Т-трубочек). В мышцах EDL группы КА (б) вокруг расширенных Т-трубочек можно видеть до 5 темных пятен, что свидетельствует о повышенном сопряжении дигидропиридиновых и рианодиновых рецепторов в составе структур ЭМС. ТЭМ. Увел.: 12 500×.
При анализе ультраструктуры миоцитов мы также обращали внимание на ориентированность Т-трубочек – поперечно и продольно ориентированные Т-трубочки, поскольку в группах крыс ХА и КА заметно увеличено количество продольно перерезанных Т-трубочек, причем в местах, где наблюдаются разрывы мышечных волокон. В миоцитах SOL не выявлены изменения ориентированности Т-трубочек (рис. 5а). В миоцитах EDL крыс групп КА и ХА увеличено число продольных Т-трубочек на 54 и 66% соответственно (рис. 5б, рис. 6), что является следствием повреждения мышечных волокон EDL.
Рис. 5.
Доля Т-трубочек, расположенных продольно и поперечно относительно плоскости среза, в миоцитах SOL (а) и EDL (б) крыс. Данные ТЭМ. Все величины выражены как средние значения и их ошибка; отличия от контроля достоверны (*) при P < 0.05. Названия групп см. в подписи к рис. 1.
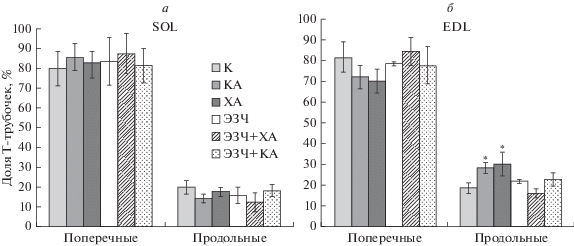
Рис. 6.
Электронно-микроскопические фотографии миоцитов мышц EDL крысы после плавательной нагрузки. а – контрольная группа; б – группа КА (плавание на фоне введения КА). Сплошными стрелками указаны поперечно ориентированные Т-трубочки, штриховыми – продольно ориентированные Т-трубочки. В мышечных волокнах крыс группы КА наряду с обычными поперечно ориентированными Т-трубочками видны продольно ориентированные Т-трубочки, расположенные в местах разрывов мышечных волокон или рядом с ними. ТЭМ. Увел.: 5000×.

ОБСУЖДЕНИЕ
Механизмы формирования мышечного утомления при интенсивной физической нагрузке и восстановление мышечной функции – важнейшие проблемы современной биохимии и физиологии. В настоящее время не существует единой теории утомления мышц, работающих в условиях целостного организма. Исследования молекулярно-клеточных механизмов ЭМС способствовали формированию представлений о значительной роли в развитии утомления субклеточных структур мышечных волокон (Т-трубочек, митохондрий, саркоплазматического ретикулума, миофибрилл), посттрансляционных изменений рецепторов, ионных каналов и регуляторных белков (Allen et al., 2008; Debold, 2015; Huang et al., 2016). Деполяризация мембраны скелетного мышечного волокна вызывает высвобождение ионов кальция, депонированных в саркоплазматическом ретикулуме, за счет сопряжения (прямого взаимодействия) дигидропиридиновых рецепторов, локализованных на мембране Т-системы, с рианодиновыми на мембране ретикулума, т.е. за счет механизма индуцированного деполяризацией высвобождения ионов кальция (DICR) с последующей активацией сократительного аппарата (Marty, Fauré, 2016). Однако механизм DICR в скелетных мышцах не является жестко детерминированным и при определенных условиях (контрактура, тетанус, утомление, гипоксия, оксидативный стресс и др.) в них может работать механизм кальций-индуцированного высвобождения ионов кальция (CICR) (Nasledov et al., 2007; Endo, 2009).
В научной литературе очень мало данных о взаимосвязи механизмов регуляции кальция и ультраструктурных характеристик медленных и быстрых мышц, полученных в рамках одной экспериментальной модели физической нагрузки и утомления. В одной из наших работ была прослежена связь между экспрессией генов, ответственных за синтез основных белков регуляции баланса ионов кальция (CASQ1, SERCA1, SERCA2, RyR1, CACNA1), и ультраструктурными характеристиками быстрых (EDL) и медленных (SOL) скелетных мышц крыс в условиях продолжительной физической нагрузки (Корф и др., 2017а). В этой работе мы не обнаружили у крыс в мышцах SOL после цикла принудительного плавания изменений уровня транскрипции исследованных генов, но зато выявили разрывы мышечных волокон, слияние митохондрий (fusion, мегаконию) наряду с их распадом (fission, плейокония) и деградацией (вакуолизацией и апоптозом). Более выраженные изменения в экспрессии исследованных генов были выявлены в мышцах EDL, в которых адаптация к нагрузкам связана главным образом с усилением системы откачки ионов Са2+ из саркоплазмы и удержания их в цистернах саркоплазматического ретикулума, где главным буфером кальция является кальсеквестрин (Корф и др., 2017а).
Однако ультраструктурный анализ с помощью электронной микроскопии также выявил множественные разрывы мышечных волокон и деградацию митохондрий без очевидных признаков их слияния. У крыс, получавших ЭЗЧ и демонстрировавших бóльшую работоспособность, не только в EDL, но и в SOL выявлено статистически значимое повышение экспрессии генов CASQ1, SERCA1, SERCA2, RyR1, CACNA1 (Корф и др., 2017б). Следовательно, применение ЭЗЧ приводит к повышению выносливости за счет дополнительного участия в работе медленных мышц, адаптация которых связана с повышением экспрессии всех исследованных генов, ответственных за регуляцию баланса ионов Са2+. Повышение экспрессии генов RyR1 и CACNA1 не только в быстрых, но и в медленных мышцах при употреблении ЭЗЧ свидетельствует об эффективном развитии структур ЭМС в обоих типах мышц. В отличие от “аварийной” адаптации мышц к нагрузке за счет механизма выведения кальция из цитозоля и удержания его в ретикулуме (и, вероятно, в митохондриях), адаптация при содействии ЭЗЧ связана с повышением контроля над мобилизацией кальция благодаря повышению сопряжения в системах возбуждение–сокращение (структуры ЭМС) и возбуждение–метаболизм (аэробная и анаэробная генерация АТФ в митохондриях и саркоплазме) (Schönekess et al., 1995; Gehlert et al., 2015).
Проведенное в настоящей работе морфометрическое исследование мышц SOL и EDL крыс, получавших препараты ЭЗЧ и солей аммония на фоне нагрузок в модели принудительного плавания, позволило выявить изменения показателей митохондрий (их средней площади и объемной плотности), расширение Т-трубочек, изменения их числа на единицу площади цитоплазмы и их ориентированности по отношению к плоскости среза в основном за счет увеличения числа продольно ориентированных Т-трубочек. Наиболее значительные изменения по всем определяемым параметрам выявлены в быстрых мышцах EDL, тогда как среди групп наиболее значительные изменения в этих мышцах выявлены в группе ЭЗЧ + + КА по параметрам митохондрий, в группах КА и ЭЗЧ + ХА – по средней площади и количеству Т‑трубочек, в группах КА и ХА – по продольно ориентированным Т-трубочкам. Если сопоставить эти данные с интегральным показателем эффективности того или иного препарата – продолжительностью плавания, то наблюдается следующая зависимость. У крыс группы ЭЗЧ, показавших минимальный прирост продолжительности плавания в последний день предельной нагрузки по сравнению с первичным тестированием (10–20%, Р > 0.05), адаптация к физической нагрузке происходит главным образом за счет увеличения средней площади митохондрий и в меньшей степени – за счет их объемной плотности в медленных мышцах SOL, притом что в быстрых мышцах EDL оба показателя уменьшаются (Р < 0.05). Адаптивные изменения обусловлены подключением к работе медленных мышц, быстрые мышцы функционируют за счет гликолиза, но очевидно без перегрузки, т. к. образующийся лактат своевременно покидает мышцы EDL и служит “быстрым топливом” для мышц SOL. Участие эритроцитов в этой челночной передаче лактата, по всей видимости, минимальное.
У крыс группы ХА, показавших чуть более высокий прирост продолжительности плавания (15–25%, Р > 0.05), адаптация обусловлена увеличением средней площади митохондрий в мышцах EDL, при этом средняя площадь Т-трубочек уменьшается. В этих же мышцах у крыс группы ХА статистически значимо увеличивается доля продольно ориентированных Т-трубочек наряду с разрывами мышечных волокон. Отсюда следует, что адаптивные изменения в мышцах EDL группы ХА обусловлены интенсификацией процессов анаэробного и аэробного окисления глюкозы и лактата в быстрых мышцах, экспорт лактата минимальный, он утилизируется преимущественно in situ, степень развития структур ЭМС уменьшается, что приводит к повышенной мобилизации ионов кальция по механизму CICR. Эритроциты участвуют в захвате и транспортировке лактата, но скорее в качестве “буферной емкости”, а не челнока.
Следующим по эффективности препаратом является комплекс ХА + ЭЗЧ, который обусловил прирост продолжительности плавания в пределах 20–50% (Р < < 0.05), что свидетельствует об аддитивном действии двух компонентов этого комплекса (напомним, что эти компоненты вводятся раздельно, так что название “комплекс” является условным). Аддитивность функционального эффекта структурно обеспечивается, во-первых, увеличением средней площади и объемной плотности митохондрий в мышцах EDL, но с некоторым уменьшением этих параметров в мышцах SOL; во-вторых – увеличением средней площади Т-трубочек в мышцах SOL и особенно EDL, а также увеличением их числа в мышцах EDL. А в-третьих, при этом не происходит увеличения доли продольно ориентированных Т-трубочек, что означает сохранение целостности быстрых мышечных волокон при их повышенной функциональной готовности. Лактатная емкость эритроцитов у крыс этой группы, по-видимому, более высокая по сравнению с крысами группы ХА, но основными потребителями лактата являются все же быстрые мышцы.
Далее по степени эффективности следует комплексное действие КА + ЭЗЧ (прирост продолжительности плавания 30–60%, Р < 0.05). Однако для лучшего понимания сути ультраструктурных изменений, выявленных в мышечных волокнах этой группы крыс, сначала опишем эти изменения в мышцах крыс группы КА, показавших максимальный прирост продолжительности плавания (40–90%, Р < 0.05). В группе КА, в отличие от группы ХА, максимальный функциональный эффект обусловлен адаптивными изменениями исключительно в структурах ЭМС: максимально выраженным увеличением средней площади Т-трубочек в мышцах EDL и не столь выраженным, но увеличенным числом Т-трубочек в мышцах SOL. При этом доля продольных Т-трубочек в мышцах EDL, а значит и разрывов мышечных волокон, возрастает (P < 0.05). Это означает, что адаптация к нагрузке только за счет митохондрий (группа ХА) или только за счет структур ЭМС (группа КА) приводит к перенапряжению и срыву адаптации. Разница в том, что функциональная готовность и порог чувствительности мышечных волокон EDL существенно выше в группе КА, что свидетельствует о ведущей роли структур ЭМС в развитии силовой выносливости, не обеспечивающей, однако, своевременного восстановления мышечных волокон в условиях предельной физической нагрузки. Лактатная емкость эритроцитов у крыс группы КА, на наш взгляд, еще более высокая по сравнению с крысами группы ХА, но основными потребителями лактата остаются быстрые мышцы.
Возвращаясь к группе крыс КА + ЭЗЧ, нетрудно заметить, что по функциональной готовности эта группа показала аддитивный эффект со знаком минус: немногим хуже, чем группа КА, но существенно лучше, чем группа ЭЗЧ. При этом мы выявили выраженные адаптивные изменения митохондриального аппарата в медленных и особенно в быстрых мышцах наряду с незначительными, но значимыми изменениями структур ЭМС, причем разнонаправленными: увеличение средней площади Т-трубочек в мышцах SOL сочетается с уменьшением площади и числа Т-трубочек в мышцах EDL. В то же время никаких изменений доли продольных и поперечных волокон не было выявлено. Это может свидетельствовать о важности митохондриального аппарата в аэробной утилизации лактата и в быстрых, и в медленных мышцах, что предотвращает их перенапряжение и (или) своевременное восстановление при выполнении субмаксимальной нагрузки. Подключение к работе медленных мышц и дополнительное развитие в них митохондриального аппарата дает возможность эритроцитам не только накапливать и транспортировать избыток лактата, но и оптимальным образом его “перераспределять” в работающих мышцах.
Таким образом, наиболее эффективными препаратами, способствующими адаптации скелетных мышц к предельным физическим нагрузкам, следует считать “комплексы”, сочетающие в себе малые дозы солей аммония (хлорида или карбоната) и ЭЗЧ в качестве нутрицевтика растительного происхождения, роль которого состоит в инициации адаптационной перестройки структур ЭМС и генерации энергии в медленных мышечных волокнах.
Список литературы
Гончаров Н.В., Миндукшев И.В., Новожилов А.В., Корф Е.А., Тавровская Т.В., Терпиловский М.А., Хмелевской Д.А., Скверчинская Е.А., Кривченко А.И. 2018. Адаптивные биохимические изменения эритроцитов крысы после цикла принудительного плавания с применением экстракта зеленого чая и аммонийного прекондиционирования. Российский физиол. журн. им. И.М. Сеченова. 104(12) : 1428–1441. (Goncharov N.V., Mindukshev I.V., Novozhilov A.V., Korf E.A., Tavrovskaya T.V., Terpilovsky M.A., Khmelevskoy D.A., Skverchinskaya E.A., Krivchenko A.I. 2013. Adaptive biochemical changes of rat erythrocytes after the cycle of forced swimming with the use of green tea extract and ammonium preconditioning. Ross. Fiziol. Zh. Im. I.M. Sechenova. 104(12) : 1428–1441.)
Корф Е.А., Кубасов И.В., Вонский М.С., Новожилов А.В., Рунов А.Л., Курчакова Е.В., Матросова Е.В., Тавровская Т.В., Гончаров Н.В. 2017а. Ультраструктурные изменения и модуляция экспрессии генов в системе кальциевой регуляции скелетных мышц при изнуряющей физической нагрузке. Цитология. 59(6) : 434–446. (Korf E.A., Kubasov I.V., Novozhilov A.V., Matrosova E.V., Tavrovskaya T.V., Goncharov N.V., Vonsky M.S., Runov A.L., Kurchakova E.V. 2017. Ultrastructural and gene-expression changes in the calcium regulation system of rat skeletal muscles underexhausting exercise. Cell Tiss. Biol. (Tsitologiya). 11(5) : 371–380.)
Корф Е.А., Кубасов И.В., Вонский М.С., Новожилов А.В., Рунов А.Л., Курчакова Е.В., Матросова Е.В., Тавровская Т.В., Гончаров Н.В. 2017б. Экстракт зеленого чая повышает экспрессию генов, ответственных за регуляцию баланса кальция в медленных мышцах крысы, при изнуряющей физической нагрузке. Бюлл. экспер. биол. мед. 164(7) : 10–14. (Korf E.A., Kubasov I.V., Novozhilov A.V., Matrosova E.V., Tavrovskaya T.V., Goncharov N.V., Vonsky M.S., Runov A.L., Kurchakova E.V. 2017. Green tea extract increases the expression of genes responsible for regulation of calcium balance in rat slow-twitch muscles under conditions of exhausting exercise. Bull. Exper. Biol. Med. 164(1) : 6–9.)
Новожилов А.В., Тавровская Т.В., Войтенко Н.Г., Маслова М.Н., Гончаров Н.В., Морозов В.И. 2014. Эффективность экстракта зеленого чая в эксперименте с использованием двух моделей физической нагрузки. Бюлл. экспер. биол. мед. 158(9) : 327–332. (Novozhilov A.V., Tavrovskaya T.V., Voitenko N.G., Maslova M.N., Goncharov N.V., Morozov V.I. 2015. Efficacy of green tea extract in two exercise models. Bull. Exp. Biol. Med. 158(3) : 342–345.)
Allen D.G., Lamb G.D., Westerblad H. 2008. Skeletal muscle fatigue: Cellular mechanisms. Physiol. Rev. 88 : 287–332.
Cheng I.S., Wang Y.W., Chen I.F., Hsu G.S., Hsueh C.F., Chang C.K. 2016. The supplementation of branched-chain amino acids, arginine, and citrulline improves endurance exercise performance in two consecutive days. J. Sports Sci. Med. 15 : 509–515.
Debold E.P. 2015. Potential molecular mechanisms underlying muscle fatigue mediated by reactive oxygen and nitrogen species. Front. Physiol. 6 : 1–7.
Endo M. 2009. Calcium-induced calcium release in skeletal muscle. Physiol. Rev. 89 : 1153–1176.
Ferguson B.S., Rogatzki M.J., Goodwin M.L., Kane D.A., Rightmire Z. 2018. Lactate metabolism: Historical context, prior misinterpretations, and current understanding. Eur. J. Appl. Physiol. 118 : 691–728.
Gehlert S., Bloch W., Suhr F. 2015. Ca2+-dependent regulations and signaling in skeletal muscle: From electro-mechanical coupling to adaptation. Int. J. Mol. Sci. 16(1) : 1066-95.
Goncharov N., Maevsky E., Voitenko N., Novozhilov A., Kubasov I., Jenkins R., Avdonin P. 2016. Nutraceuticals in sports activities and fatigue. In: Nutraceuticals: Efficacy, safety and toxicity. Amsterdam. Academic Press/Elsevier. 177–188.
Huang C.C., Wang T., Tung Y.T., Lin W.T. 2016. Effect of exercise training on skeletal muscle SIRT1 and PGC-1α expression levels in rats of different age. Int. J. Med. Sci. 13 : 260–270.
Maciejewski H., Bourdin M.,Féasson L., Dubouchaud H., Denis C., Freund H., Messonnier L.A. 2016. Muscle MCT4 content is correlated with the lactate removal ability during recovery following all-out supramaximal exercise in highly-trained rowers. Front Physiol. 7 : 1–10.
Marty I., Fauré J. 2016. Excitation-contraction coupling alterations in myopathies. J. Neuromuscul. Dis. 3 : 443–453.
Morissette M.P., Susser S.E., Stammers A.N., O’Hara K.A., Gardiner P.F., Sheppard P., Moffatt T.L., Duhamel T.A. 2014. Differential regulation of the fiber type-specific gene expression of the sarcoplasmic reticulum calcium-ATPase isoforms induced by exercise training. J. Appl. Physiol. 117 : 544–555.
Nasledov G.A., Katina I.E., Zhitnikova Y.V. 2007. Changes in the functioning of the electromechanical connection during tetanic contraction. Neurosci. Behav. Physiol. 37 : 153–159.
Opitz D., Lenzen E., Opiolka A., Redmann M., Hellmich M., Bloch W., Brixius K., Brinkmann C. 2015. Endurance training alters basal erythrocyte MCT-1 contents and affects the lactate distribution between plasma and red blood cells in T2DM men following maximal exercise. Can. J. Physiol. Pharmacol. 93 : 413–419.
Schönekess B.O., Brindley P.G., Lopaschuk G.D. 1995. Calcium regulation of glycolysis, glucose oxidation, and fatty acid oxidation in the aerobic and ischemic heart. Can. J. Physiol. Pharmacol. 73 : 1632–1640.
Дополнительные материалы отсутствуют.


