Цитология, 2019, T. 61, № 9, стр. 683-703
Безмембранные органеллы эукариотической клетки: основные понятия и принципы формирования
Д. С. Боголюбов *
Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: dbogol@mail.ru
Поступила в редакцию 30.04.2019
После доработки 14.06.2019
Принята к публикации 18.06.2019
Аннотация
Наряду с “классическими” органеллами, имеющими мембрану, безмембранные органеллы, или биомакромолекулярные конденсаты, играют важную роль в системе компартментализации клетки. В обзоре кратко обсуждаются биологическое значение двух типов компартментализации клетки, выражающейся в существовании мембранных и безмембранных компартментов (органелл), базовые принципы формирования безмембранных органелл и расшифровываются основные термины и понятия. Безмембранные органеллы, многие из которых содержат не только белки, но и специфические РНК, формируются в результате разделения биомакромолекул на фазы в условиях макромолекулярного краудинга и повышают эффективность множества специфических клеточных функций. По современным представлениям общим принципом формирования безмембранных органелл, независимо от их молекулярного состава и функций, является фазовый переход “жидкость–жидкость”. В ядре некоторые органеллы формируются в местах транскрипции специфических генов, а РНК, например рРНК, малые ядерные и длинные некодирующие РНК, могут служить “затравкой” при формировании таких безмембранных органелл или выполнять структурную роль. Основной вклад в образование безмембранных органелл вносят белки, содержащие внутренне неупорядоченные участки или домены низкой сложности. В заключительной части обзора приведены некоторые примеры безмембранных органелл со сложной внутренней структурой, возникающей, по-видимому, в результате вторичного разделения фаз.
Каждая клетка содержит огромное количество разнообразных молекул, концентрация которых весьма высока и составляет в среднем 30 мг/мл в отношении белков, а в отношении РНК – от 20 до 100 мг/мл (Drino, Schaefer, 2018). При этом молекулы с разными физико-химическими свойствами способны весьма упорядоченно и слаженно взаимодействовать между собой в ходе специфических молекулярно-биохимических реакций. Долгое время для биологов и химиков оставалось загадкой, как именно достигается эффективная организация и регуляция ошеломляющего разнообразия молекулярных ансамблей, функционирующих в ядре и цитоплазме. Данная проблема решается путем создания в клетке особой внутренней структуры в виде сложной системы разнообразных компартментов, или органелл, и особое место в этой системе занимают ядерные и цитоплазматические безмембранные органеллы (membrane-less organelles, MLOs) (рис. 1).
Рис. 1.
Примеры ядерных и цитоплазматических безмембранных органелл (BioMC) в эукариотических клетках (по Banani et al., 2017, с изменениями).
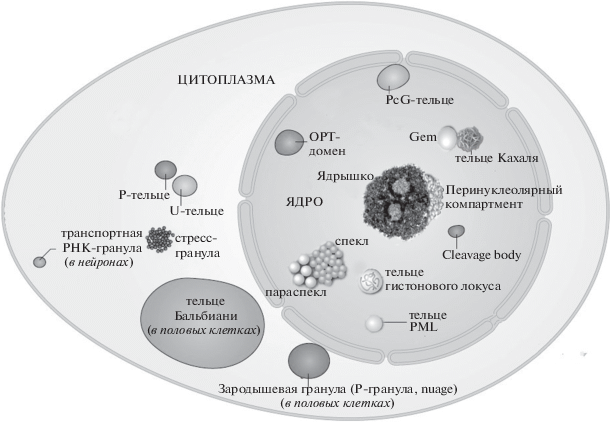
За последние 20 лет накоплено множество фактов, свидетельствующих о том, что, несмотря на разнообразие безмембранных органелл по молекулярному составу и функциям, их формирование и свойства определяются общим физико-химическим принципом – способностью макромолекул, в первую очередь внутренне неупорядоченных белков, разделяться на фазы в условиях макромолекулярного краудинга.
Представленный краткий обзор не претендует на исчерпывающую сводку информации о безмембранных органеллах. Его цель в общих чертах познакомить русскоязычного читателя с современной базовой терминологией, общими принципами формирования, организации и динамики безмембранных органелл. Более подробную дополнительную информацию по данной теме можно найти в многочисленных специальных обзорах, увидевших свет в последние годы (например, Courchaine et al., 2016; Banani et al., 2017; Stroberg, Schnell, 2017; Drino, Shaefer, 2018; Wheeler, Hyman, 2018).
ОПРЕДЕЛЕНИЕ БЕЗМЕМБРАННОЙ ОРГАНЕЛЛЫ
Под “органеллами” многие цитологи до сих пор подразумевают лишь “классические” клеточные компартменты, имеющие липидную мембрану, которая отграничивает их внутреннее пространство от окружающей цитоплазмы. Мембранными органеллами являются, например, само ядро, эндоплазматический ретикулум, аппарат Гольджи, митохондрии, хлоропласты и различные везикулярные структуры (лизосомы, пероксисомы и т.д.). Однако в клетке параллельно и независимо существует еще один не менее важный механизм компартментализации, выражающийся в формировании довольно крупных структур микроскопического и субмикроскопического размера, не имеющих отграничивающей мембраны.
Ранее для морфологического описания разнообразных безмембранных структур, наблюдаемых как в ядре, так и в цитоплазме, существовало множество терминов: тельца, включения, домены, компартменты и т.п. В настоящее время все они в совокупности получили название безмембранных органелл или, учитывая физико-химические принципы их формирования, биомакромолекулярных конденсатов (biomolecular condensates, BioMCs) (Banani et al., 2017). Термин BioMCs сейчас в литературе можно встретить даже чаще, чем “органелла”.
Термин “органелла” эквивалентно применяют по отношению как к “классическим” мембранным, так и к безмембранным структурам (BioMCs). Например, интерхроматиновое пространство клеточного ядра является высокоструктурированным, и все хорошо известные морфологически оформленные ядерные “тельца”, такие как ядрышки, тельца Кахаля, тельца гистонового локуса, ядерные спеклы (кластеры интерхроматиновых гранул), параспеклы, тельца PML и другие, можно называть ядерными органеллами. Этот термин уже давно используется применительно к экстрахромосомным структурам ядра ооцитов (зародышевого пузырька) амфибий (Gall et al., 2004). Следует подчеркнуть, что все ядерные органеллы не имеют мембраны и являются типичными безмембранными органеллами.
К настоящему времени известно около двух десятков различных цитоплазматических и ядерных безмембранных органелл (табл. 1). Многие из них формируются при определенных физиологических и (или) патологических состояниях (например, в ответ на стресс или при апоптозе). Присутствие некоторых безмембранных органелл характеризует лишь определенные высокоспециализированные клетки (например, половые клетки или нейроны) или являются редкими (орфанными). Другие же безмембранные органеллы, наоборот, в известной мере “претендуют” на определенную “универсальность” и могут быть обнаружены в клетках разных типов. Однако неизвестно ни одной безмембранной органеллы, которая бы присутствовала абсолютно во всех эукариотических клетках. Даже ядрышко, самая “универсальная” ядерная органелла, например, отсутствует в ядре ооцита на определенных стадиях оогенеза некоторых животных (Koshel et al., 2016). Подобного рода примеров можно привести множество и в отношении других “универсальных” безмембранных органелл.
Таблица 1.
Некоторые репрезентативные безмембранные органеллы ядра и цитоплазмы
| Название | Ключевые компонентыа | Тип клеток | Базовая функцияб | Источник | |
|---|---|---|---|---|---|
|
Русское |
Английское |
||||
| Ядерные органеллы | |||||
| Ядрышко | Nucleolus | рДНК, РНК-полимераза I | Универсальноев | Транскрипция рибосомных генов, процессинг пре-рРНК, формирование рибосом | Raška et al., 2006; Hernandez-Verdun et al., 2010 |
| Перинуклеолярный компартмент | Perinucleolar compartment | PTB (hnРНП I), CUGBP | Трансформированные клетки млекопитающих | Неизвестна | Huang, 2000 |
| Ядрышкоподобное тело (ЯПТ), постядрышког | Nucleolus-like body (NLB) | Белки ядрышек | Ооциты некоторых млекопитающих, включая человека | Неизвестна | Bogolyubova, Bogolyubov, 2013; Shishova et al., 2015 |
| Предшественник ядрышка, проядрышког | Nucleolus precursor body (NPB) | Белки ядрышек | Зиготы и ранние эмбрионы некоторых млекопитающих, включая человека | Неизвестна | Lavrentyeva et al., 2017 |
| Белковое тело | Centromeric protein body | ДНК-топоизомераза II, когезины | Ооциты птиц | Неизвестна | Krasikova et al., 2004, 2005 |
| Тельце Кахаля (ТК) | Cajal body (CB) | коилин, scaРНК | Универсальноев | Посттранскрипционные модификации snРНК, сборка snРНП-субъединиц сплайсосом | Nizami et al., 2010; Ходюченко, Красикова, 2014 |
| “Близнец” ТКг | Gem (мн. ч. Gems или Gemini) | SMN | Некоторые клетки млекопитающих | Метаболизм (биогенез) snРНП | Matera, Frey, 1998 |
| Тельце гистонового локуса (ТГЛ) | Histone locus body (HLB) | NPAT, FLASH; U7 snРНП | Универсальноев | Процессинг пре-мРНК гистонов | Nizami et al., 2010; Ходюченко, Красикова, 2014 |
| Неканонические тельца Кахаля ТК (до 2010 г.), ТК/ТГЛ или ТГЛ (наст. вр.) | CB CB/HLB или HLB | коилин; U7 snРНП | Ооциты амфибий (Xenopus, Notophtalmus) | Возможно, совмещает функции ТК и ТГЛ | Gall et al., 2004; Nizami et al., 2010 |
| Тельце-“жемчужина”г | Pearl | коилин, scaРНК (не содержит snРНП) | Ооциты Xenopus | Транскрипция, зависимая от РНК-полимеразы III; возможно, выполняет некоторые функции ТК, определяемые спецификой молекулярного состава | Nizami, Gall, 2012 |
| Неканоническое ТК |
Non-canonical CB |
коилин (не содержит фибрилларина) | Ооциты голубя Columba livia | Возможно, выполняет некоторые функции ТК, определяемые спецификой молекулярного состава | Khodyuchenko et al., 2012 |
| Тельце PML | PML body | PML | Клетки млекопитающих | Регуляция стабильности генома, транскрипции, репарации ДНК, клеточного ответа на стресс и вирусную инфекцию | Lallemand-Breitenbach, de Thé, 2010 |
| Ядерный спекл, кластер интерхроматиновых гранул (КИГ) | Nuclear speckle, interchromatin granule cluster (IGC) | SR-белки; Malat1 (NEAT2) lncРНК | Универсальноев | Временное депонирование факторов сплайсинга пре-мРНК | Боголюбов, 2018 |
| Параспекл | Paraspeckle | PSP1, p54nrb, PSF; Men ε/β (NEAT1) lncРНК | Клетки млекопитающих | Аккумуляция РНК-связывающих белков и ядерной CTN-РНК | Fox et al., 2010 |
| Омега-спекл | ω-speckle | Hrp36 | Клетки Drosophila | Депонирование белков hnРНП | Singh, Lakhotia, 2012 |
| PcG-тельце | Polycomb (PcG) body | Bmi1, Pc2 | Клетки Drosophila и человека | Сайленсинг генов | Pirrotta, Li, 2012 |
| Ядерное стресс-тельце | Stress nuclear body | HSF1, HAP | Клетки приматов | Регуляция транскрипции и сплайсинга при стрессе | Biamonti, Vourc’h, 2010 |
| OPT-домен | OPT domain | PTF (Oct1) | Некоторые клетки млекопитающих | Регуляция транскрипции | Pombo et al., 1998; Carmo-Fonseca et al., 2010 |
| Тельце расщепленияг | Cleavage body | CstF64, CPSF100, DDX1 | Некоторые клетки млекопитающих | Процессинг 3'-конца пре-мРНК | Schul et al., 1996; Carmo-Fonseca et al., 2010 |
| Тельце Sam68 | Sam68 nuclear body (SNB)д | Sam68 | Некоторые трансформированные или малодифференцированные клетки млекопитающих | Аккумулирует белки семейства STAR, а также субъединицы CstF и CPSF | Chen et al., 1999; Carmo-Fonseca et al., 2010 |
| Кластосома | Clastosome | 19S-, 20S-субъединицы протеасом | Некоторые клетки млекопитающих | Аккумуляция каталитически активных (20S) и регуляторных (19S) субъединиц 26S-протеасом, конъюгатов убиквитина, белковых субстратов протеасом | Lafarga et al., 2002; Carmo-Fonseca et al., 2010 |
| Тельце SUMO | SUMO body (SNB)д | SUMO-1 | Некоторые клетки млекопитающих | Депонирование транскрипционных факторов | Navascués et al., 2007 |
| Тельце Маринеско | Marinesco body | PML, GAPDH | Пигментированные нейроны substantia nigra головного мозга приматов | Нейропатологические процессы | Abbott et al., 2017 |
| Цитоплазматические безмебранные органеллы | |||||
| Стресс-гранула | Stress granule (SG) | elf3 | Универсальное, формируется при стрессе | Секвестрация мРНП, факторов инициации трансляции | Protter, Parker, 2016; Luo et al., 2018; Guzikowski et al., 2019 |
|
Тельцe процессинга, P-тельце |
P-body |
AGO1/2 |
Универсальные, родственные стресс-грануле |
Подавление трансляции, секвестрация нетранслируемых мРНК, деградация мРНК, miРНК/siРНК-индуцируемый сайленсинг РНК |
|
|
GW-bodyе |
GW182 |
||||
| U-тельце | U-body | SMN | Клетки Drosophila | Сборка и хранение snРНП перед импортом в ядро | Liu, Gall, 2007 |
| P-гранула | P-granule, germ granule | PGL-1, GLH-1 | Клетки зародышевой линии Caenorhabditis elegans | Поляризация эмбриона, временное хранение РНК и белков | Marnik, Updike, 2019 |
| Агресома | Aggresome | CFTR, PPAR-γ | Клетки человека | Аутофагия | Johnston et al., 1998; Kopito, 2000 |
| Транспортная РНК-гранула | RNA transport granule; neuronal RNA granule | Staufen1, Staufen2, FMRP, ZBP1, hnRNPA2, CPEB, Pura, SMN | Нейроны | Транспорт и временное хранение мРНП | De Graeve, Besse, 2018 |
| Тельце Леви | Lewy body | α-синуклеин, убиквитин | Нейроны | Нейропатологические процессы | Rocha Cabrero, Morrison, 2019 |
а В отсутствие ограничивающей мембраны и свободной диффузии какие-либо “диагностические” маркеры конкретной безмембранной органеллы определить трудно; могут содержать компоненты других органелл, от которых отличаются локализацией, морфологическими или иными характерными признаками, а также молекулярным составом. бМногие безмембранные органеллы, включая ядрышко, полифункциональны; указана лишь основная (каноническая) функция соответствующей органеллы. вНе означает, что обязательно присутствует во всех клетках. гУстоявшееся русскоязычное название отсутствует. дВо избежание путаницы следует указать, что, к сожалению, в оригинальных источниках встречается одинаковая аббревиатура (SNB) для обозначения разных структур. еРодственны P-тельцам, но рассматриваются как отдельные структуры (Patel et al., 2016).
Наиболее известные и хорошо охарактеризованные ядерные и цитоплазматические безмембранные органеллы схематически представлены на рис. 1, а в табл. 1 перечислены базовые функции некоторых из них. При этом следует особо подчеркнуть, что многие безмембранные органеллы полифункциональны. В табл. 1 также упомянуты некоторые ключевые белки (и РНК) в их составе, которые можно считать молекулярными (диагностическими) маркерами конкретной органеллы, хотя понятно, что в условиях свободной диффузии при отсутствии мембраны эти молекулы присутствуют и в других участках клетки. Например, более 70% фосфопротеина коилина, диагностического маркера телец Кахаля, челночного белка, являющегося частью ядерно-цитоплазматической транспортной системы малых ядерных (sn) РНК (Bellini, Gall, 1999), может находиться диффузно в нуклеоплазме, а не в самих органеллах (Lam et al., 2002).
Перечень безмембранных органелл, перечисленных в табл. 1, не является исчерпывающим, приведены лишь некоторые характерные примеры. Например, без упоминания оставлены так называемые HERDS (heterogeneous ectopic RNP-derived structures – Biggiogera, Pellicciari, 2000) – гетерогенная группа РНП-содержащих структур, которые обнаруживаются в клетках при инактивации транскрипции, вызванной разнообразными физиологическими, патологическими или экспериментальными условиями. Также не упомянуты цитоплазматические безмембранные органеллы, служащие детерминантами клеток зародышевой линии, – тельца Бальбиани (Balbiani bodies) и “nuage” (Kloc et al., 2004), как и многие другие безмембранные органеллы, несомненно, заслуживающие внимания.
Следует особо отметить, что безмембранные органеллы отличаются по физическим свойствам и функциям от макромолекулярных ансамблей, в том числе РНП-частиц, таких как, например, рибосомы. В отличие от последних безмембранные органеллы – структуры микроскопического (микрометрового) масштаба, от 0.1–0.2 мкм до нескольких микрометров, в исключительных случаях – даже десятков микрометров (рис. 2). Размеры же РНП-частиц лежат в нанометровом диапазоне (например, размер рибосомы составляет в среднем около 20 нм, а размер типичной интерхроматиновой гранулы – 20–25 нм). С точки зрения морфолога, использующего в работе электронную микроскопию, многие безмембранные органеллы имеют сложную структуру (рис. 2б, г–е) и состоят из “минимальных” структурных единиц – фибрилл и гранул нанометрового размера. Они могут располагаться вперемешку или формировать однородные области (субкомпартменты), отличающиеся электронной плотностью и степенью упаковки фибрилл и гранул (рис. 2г).
Рис. 2.
Различные по морфологической сложности безбмебранные органеллы (BioMC) в ядре ооцитов некоторых беспозвоночных. а – Сложное ядрышко (яш) и каплевидные ядерные тела правильной сферической формы (стрелки), подобные тельцам Кахаля и известные в литературе как “внутренние тела” (endobodies) (см. Боголюбов, Боголюбова, 2007), в ядре ооцита паука-крестовика Araneus diadematus, оптика по Номарскому. б – Фрагмент сложного по структуре BioMC (ядерного тельца) в ядре ооцита скорпионницы обыкновенной Panorpa communis (Mecoptera), стандартная электронная микроскопия (Batalova et al., 2005, с разрешения издательства Springer Nature). в, г – Ядерные тельца ооцитов серой мясной мухи Sarcophaga sp. (Diptera): сферическая органелла, соответствующая тельцу Кахаля, с практически однородной тонкофибриллярной структурой (в), иммуноэлектронная микроскопия, обработка антителами к коилину, частицы золота 10 нм; компактная, но сложная по структуре органелла из того же ядра (г); обратите внимание, что на ультраструктурном уровне сложные BioMC состоят из фибрилл и гранул различного размера и электронной плотности, которые могут располагаться вперемешку, но иногда формируют области (субдомены), представленные материалом одного типа. д, е – Сложные BioMC поздних ооцитов домового сверчка Acheta domesticus, состоящие из коилинсодержащего тонкофибриллярного матрикса (м) с центральной полостью (цп), в которой расположен внутренний кластер интерхроматиновых гранул (киг); морфологическая сложность таких и других сложных BioMC возникает, вероятно, за счет вторичного разделения фаз; хр – хромосома. д – Иммунофлуоресцентная (конфокальная) микроскопия, обработка антителами к коилину (красный), белку SRSF2 (SC35) (зеленый), ДНК окрашена DAPI (синий) (Боголюбов, 2008). е – Иммуноэлектронная микроскопия с использованием антител к ATRX (Степанова, Боголюбов, 2017, с разрешения редакции журнала “Цитология”).
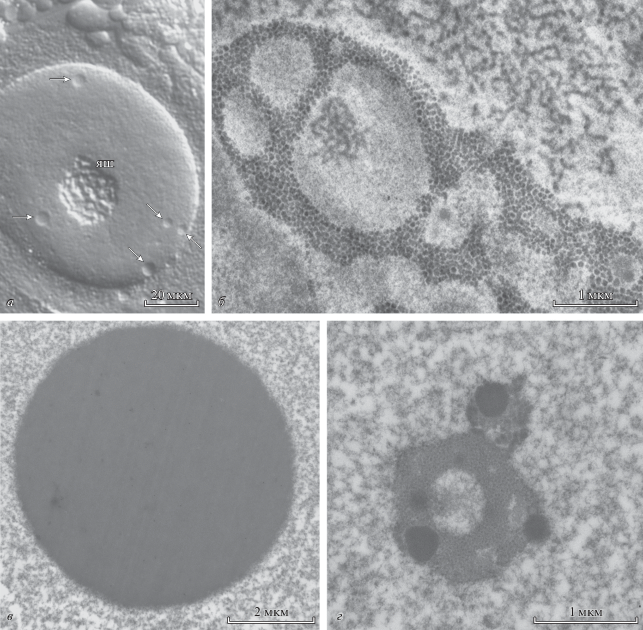
Рис. 2.
Окончание.

Путем создания высокой локальной концентрации биополимеров в клетке формируется особое молекулярное микроокружение, характеризующее специфические безмембранные органеллы. При этом возникают условия для высокоорганизованной пространственной и временнóй регуляции макромолекулярных реакций, включая сборку надмолекулярных комплексов, и повышается эффективность специфических каталитических реакций (Sawyer et al., 2019). Помимо пространственного разделения биологических макромолекул безмембранные органеллы оказывают влияние на физические и химические свойства этих молекул, а растворитель для полимеров внутри безмембранной органеллы по своим свойствам в большей степени напоминает органический растворитель, нежели воду (Nott et al., 2016).
Следует отметить, что в клеточном ядре в результате формирования экстрахромосомных ядерных органелл могут формироваться крупные межгенные, а иногда и межхромосомные регуляторные центры (молекулярные хабы или “нанореакторы”) вблизи транскрибируемых генов, что приводит к геномным перестройкам и интенсификации процессов активации или репрессии генов-мишеней за счет концентрации соответствующих молекулярных факторов в определенной области. Обсуждение данного вопроса, например, в отношении ядерных спеклов (кластеров интерхроматиновых гранул) и ссылки на соответствующую литературу можно найти в монографии (Боголюбов, 2018). Показано также, что и формирование телец Кахаля вызывает заметные конформационные изменения генома (Wang et al., 2016).
ДВА ТИПА КОМПАРТМЕНТАЛИЗАЦИИ КЛЕТКИ ДОПОЛНЯЮТ ДРУГ ДРУГА
Существование дополняющих друг друга двух способов компартментализации – в виде мембранных и безмембранных органелл – выгодно для клетки во всех отношениях и непротиворечиво с точки зрения молекулярной физиологии (Aguilera-Gomez, Rabouille, 2017). Мембраны “классических” клеточных органелл, таких как эндоплазматический ретикулум или аппарат Гольджи, представляющих собой компартменты в прямом смысле слова, сами по себе непроницаемы для большинства биологических макромолекул. Их внутреннее пространство физически изолировано от окружающей среды мембраной, а регуляция внутреннего молекулярного состава требует наличия специализированных механизмов трансмембранного транспорта.
Для существования безмембранной органеллы не требуется построения липидного бислоя и формирования энергозатратных механизмов транспорта молекул через него. Очевидно, что безмембранные органеллы по сравнению с мембранными имеют более высокий динамический потенциал, а их состав может регулироваться более гибким способом с помощью альтернативных регуляторных механизмов, поскольку для этого не нужны специализированные молекулы и сигналы, обеспечивающие импорт и экспорт. С другой стороны, ограниченные мембранами компартменты более стабильны, чем безмембранные органеллы. Продолжительную стабильность безмембранных органелл трудно поддерживать, поскольку локальное микроокружение безмембранной структуры постоянно изменяется благодаря различным флуктуациям, экспрессии генов и постоянному обмену молекулами между безмембранной органеллой и окружающим пространством. Малым молекулам, таким как ионы, трудно удерживаться внутри безмембранной органеллы. В отсутствие мембраны, например, невозможно стабильно поддерживать градиент pH. Однако для защиты целостности окружающей цитоплазмы многие потенциально цитотоксические реакции обязательно должны быть пространственно разделены полностью, и для этого компартментализация с помощью мембран является необходимой.
ФАЗОВЫЙ ПЕРЕХОД “ЖИДКОСТЬ–ЖИДКОСТЬ” – ОБЩИЙ ПРИНЦИП ФОРМИРОВАНИЯ БЕЗМЕМБРАННЫХ ОРГАНЕЛЛ
Различные безмембранные органеллы существенно отличаются друг от друга по своим физическим свойствам, положению в трехмерном пространстве ядра и клетки, молекулярному составу и функциям. Поскольку безмембранные органеллы не имеют физического барьера в виде мембраны, изолирующей их внутреннее содержимое, долгое время было непонятно, чем определяется концентрация в них специфических макромолекул, как безмембранные органеллы поддерживают и регулируют свою структуру и молекулярный состав, а также изменяют характер внутренних биохимических реакций. Молекулярный состав безмембранных органелл конкретного типа специфичен, и в них обычно локализуется от 10 до нескольких сотен различных белков, а часто и РНК. Вместе с тем, несмотря на различия по молекулярному составу, локализации в клетке и функциям, разные безмембранные органеллы, обнаруживаемые в ядре и цитоплазме, имеют сходные черты относительно их формы, динамики и способа формирования.
Формирование (сборку, ассемблинг) безмембранных органелл и их физико-химические свойства по современным представлениям можно описать исходя из классических принципов химии полимеров и физики конденсированного состояния, при этом сборка безмембранных органелл управляется законами термодинамики и может осуществляться спонтанно (Falahati, Haji-Akbari, 2019 и ссылки на литературу там же).
Формирование безмембранных органелл происходит в условиях макромолекулярного краудинга (от англ. crowd – толпа, скопление, сгущение). Это явление характеризуется формированием высокой локальной концентрации макромолекул, при которой возникают условия “исключенного объема”, при котором полимерная молекула эффективно исключает из окружения другие молекулы (Rivas, Minton, 2016). Макромолекулярный краудинг подразумевает наличие неспецифического отталкивания молекул, которое присутствует независимо от других взаимодействий макромолекул, например электростатических или гидрофобных, и существует как в ядре, так и в цитоплазме клетки, при этом он может влиять на аллостерическую регуляцию и аффинность связывания макромолекул, в свою очередь изменяя их ферментативную активность (Kuznetsova et al., 2015). Безмембранные органеллы в целом характеризуются сверхвысокими концентрациями полимеров (overcrowding), а макромолекулярный краудинг как раз и создает условия, при которых полимерам термодинамически выгодно разделяться на фазы (рис. 3).
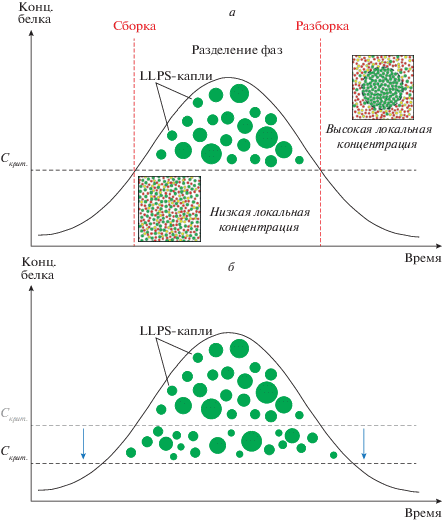
Рис. 3.
Схема, иллюстрирующая формирование и динамику LLPS-капель (а); многие факторы, включая изменения температуры, ионной силы раствора или посттрансляционные модификации белков, снижают значение критической концентрации (Cкрит.), необходимой для разделения фаз (б) (по: Brangwynne, 2011 и Alberti, 2017, с изменениями, объяснения в тексте).
В простейшем случае локальная концентрация компонентов в ограниченном участке ядра и клетки за счет макромолекулярного краудинга способна увеличивать кинетику соответствующей реакции, а сегрегация – наоборот, ослаблять или подавлять ее. Так, скорость процессинга пре-мРНК гистонов существенно снижается, если ключевые компоненты этого процесса белок FLASH и (или) U7 snРНП теряют способность концентрироваться в тельцах гистонового локуса (Tatomer et al., 2016). Сходный эффект продемонстрирован и в отношении типичных компонентов телец Кахаля – коилина и snРНП сплайсинга: деплеция коилина в эмбрионах Danio rerio приводит к дезинтеграции телец Кахаля и, как следствие, к нарушению биогенеза snРНП и, соответственно, сплайсинга пре-мРНК (Strzelecka et al., 2010).
Существенным толчком к пониманию физических процессов, которые управляют формированием безмембранных органелл, послужило открытие того, что они, независимо от специфики молекулярного состава и функций, формируются за счет фазового перехода “жидкость–жидкость” (liquid-liquid phase transition, LLPT; чаще – liquid-liquid phase separation, LLPS) (рис. 3). Роль LLPS и физико-химические принципы фазового разделения полимеров в биологических процессах широко представлены в современной литературе (например, Hyman et al., 2014; Alberti, 2017).
По современным представлениям LLPS является общим физико-химическим принципом формирования безмембранных органелл – как ядерных, так и цитоплазматических, как исключительно белковых, так и тех, которые содержат белки и РНК (Mitrea, Kriwacki, 2016). Следует отметить, что сборка макромолекулярных комплексов, которая может сочетать стохастический и упорядоченный механизмы (Mao et al., 2011b), и процесс разделения жидких фаз (LLPS), приводящий к формированию безмембранных органелл, представляют собой различные события, даже если они сопряжены между собой.
Безмембранные органеллы, формирующиеся в результате LLPS, по своей природе являются жидкими каплями (ср. “droplet organelles” – Courchaine et al., 2016). Капля – это морфологическая характеристика, описывающая сферическую форму, которую приобретают макромолекулы в растворе в результате LLPS как результат минимизации поверхностного натяжения. В отличие от твердых субстанций молекулярные компоненты способны диффундировать внутри LLPS-капель, а сами капли могут достаточно свободно обмениваться своим содержимым с окружающим пространством (растворителем). Важное свойство капли – способность к слиянию и разделению, после чего капля вновь принимает сферическую форму. Именно такими свойствами обладают многие безмембранные органеллы.
Интересно, что еще в конце XIX в. обширный сравнительный анализ морфологии ядрышек в клетках протистов, многоклеточных животных и растений позволил сделать заключение о том, что ядрышки по своей природе являются “каплями вязко-тягучей жидкости”, способными, в частности, к слиянию (Montgomery, 1898). Однако этому предположению в течение долгих лет не придавали должного значения, пока спустя более 100 лет свойства, характерные для жидких капель, состоящих из белков и РНК, не были окончательно установлены в отношении амплифицированных ядрышек ооцитов Xenopus (Brangwynne et al., 2011).
Способность к самопроизвольному слиянию и разделению с сохранением сферической формы была установлена и в отношении телец Кахаля культивируемых соматических клеток млекопитающих (Platani et al., 2000). Примерно в этот же период было высказано предположение, что характерные по морфологии сложные ядерные тельца ооцитов Xenopus, которые ранее рассматривали как своеобразные тельца Кахаля (Gall et al., 2004), а теперь относят к категории телец гистонового локуса (Nizami et al., 2010), по существу представляют собой “полужидкие сферы, суспендированные в полужидкой нуклеоплазме” (Handwerger et al, 2005). Этот вывод был основан на наблюдениях, касающихся формы, проницаемости таких телец и различиями в концентрации белков между ними и окружающей нуклеоплазмой.
Природа безмембранных органелл как жидких LLPS-капель была впервые доказана in vivo в отношении так называемых P-гранул, обнаруживаемых в цитоплазме клеток зародышевой линии нематоды Caenorhabditis elegans. Дли них, в частности, были рассчитаны такие показатели как вязкость и поверхностное натяжение (Brangwynne et al., 2009). Начиная с этой статьи, опубликованной в журнале “Science”, собственно, начался современный период исследований безмембранных органелл с физико-химических позиций.
Белки формируют LLPS-капли при достижении критической концентрации, необходимой для разделения фаз (рис. 3а). Эти капли остаются относительно стабильными, пока общая концентрация белка превышает критический порог (Cкрит.). Молекулы в жидких каплях способны к диффузии, при этом в отсутствие мембраны обеспечивается динамический обмен молекулами с окружающей фазой. Если общая концентрация белка опускается ниже критической, безмембранные органеллы диссоциируют, и система возвращается к однофазному состоянию (рис. 3а). Посттрансляционные модификации белков, изменения температуры или ионной силы раствора существенно влияют на значение критической концентрации, которая необходима для фазового разделения белков (рис. 3б).
Безмембранные органеллы, обладающие жидкостными свойствами и представляющие собой LLPS-капли, способные обратимо собираться и разбираться при изменении внешних условий, существенно отличаются от гидрогелей и преципитатов, включая амилоидные фибриллы. Эти понятия также пришли в современную биологию из области физикохимии полимеров. Так, гидрогель представляет собой стабильное коллоидное твердое вещество (гидратированный матрикс) и формируется за счет поперечных сшивок молекул полимеров, которые удерживаются в воде (растворителе) во взвешенном состоянии. Если вода исключается из макромолекулярных взаимодействий до такой степени, что вещество (белок) больше не находится во взвешенном состоянии и выпадает в осадок (преципитирует), образуются агрегаты. Класс белковых агрегатов, которые характеризуются полурегулярной структурой, образованной укладкой (стекингом) β-слоев среди белковых мономеров, носит название амилоидов, которые морфологически выявляются в виде амилоидных фибрилл.
На примере телец Кахаля с помощью методики FRAP (восстановления флуоресценции после фотообесцвечивания) показано, что эти ядерные органеллы легко обмениваются с окружающей нуклеоплазмой двумя своими ключевыми компонентами – коилином и белком SMN (Phair, Misteli, 2000; Dundr et al., 2004). Подобного нельзя ожидать в том случае, если бы тельца Кахаля имели свойства твердой субстанции, например гидрогеля. В отличие от LLPS-капель гидрогели не являются жидкостями и не способны восстанавливать флуоресценцию в опытах с использованием FRAP, поскольку представляют собой сеть иммобилизированных молекул (Frey et al., 2006).
Что конкретно вызывает переход белка в жидко-капельную фазу либо в твердый гидрогель, пока еще остается дискуссионным вопросом. Скорее всего, это обусловлено различной регуляцией этих процессов, поскольку теоретически при очень высоких концентрациях полимеров они в любом случае образуют гидрогель. Считают, что чрезмерное образование гелеподобных внутриклеточных структур за счет дисбаланса между жидкоподобным и более твердым состоянием компонентов безмембранной органеллы, иными словами переход жидких конденсатов в нерастворимые структуры, может, в частности, занимать центральное место в этиологии ряда серьезных заболеваний человека (различных амилоидозов, болезни Паркинсона, болезни Альцгеймера и др.), которые характеризуются протеинопатиями. При этом происходит секвестрация специфических белков (и РНК) в аберрантных безмембранных органеллах, что приводит к подавлению их нормальных функций и оказывает разрушающий эффект на нормальную физиологию клетки (Drino, Schaefer, 2018).
Пока до конца не выяснено, за счет каких механизмов клетка в нормальных условиях способна противостоять постоянному отвердеванию высококонденсированного содержимого любой безмембранной органеллы и эффективно поддерживать ее жидкостное состояние во время разрушения (разборки), когда это физиологически необходимо. По-видимому, в данном случае имеют место различные уровни регуляции, повышающие или понижающие значение критической концентрации полимеров, которое необходимо для фазовых переходов “жидкость–жидкость” и “жидкость–гель”. Следует отметить, что процессы фазового перехода очень чувствительны к изменениям физических и химических свойств среды, и в этом случае неудивительно, что старение клетки и нейродегенеративные заболевания могут быть связаны с аберрантными фазовыми переходами в нейронах (Alberti, Hyman, 2016).
Формирование образований, подобных каплям жидкости (droplets), можно наблюдать в экспериментальных условиях in vitro (Feric et al., 2016). В последние годы существенный прогресс в изучении особенностей LLPS при формировании безмембранных органелл достигнут благодаря широкому использованию искусственных систем (artificial cells), которые включают лишь небольшое количество компонентов, способных к образованию искусственных микрокомпартментов, напоминающих безмембранные органеллы (Crowe, Keating, 2018; Godoy-Gallardo et al., 2018). В таких упрощенных системах легче исследовать влияние компартментализации и молекулярного микроокружения на биологические реакции и процессы. Однако вряд ли такие “искусственные клетки” могут исчерпывающе отразить всю полноту реальных процессов, протекающих в клетке in vivo. Поэтому особый интерес представляют современные исследования принципов LLPS и сил, управляющих этим процессом, на живых клетках (Schuster et al., 2018).
Зависимость фазовых переходов от внешних условий определяет контроль сборки–разборки и молекулярного состава безмембранных органелл, а сверхвысокий макромолекулярный краудинг в безмембранных органеллах (жидких LLPS-каплях) создает идеальные условия для протекания биохимических реакций, отчего безмембранные органеллы можно сравнить с естественными нанореакторами. Поскольку граница раздела фаз позволяет молекулам концентрироваться в безмембранной органелле при сохранении постоянного обмена молекулами с окружающей средой без необходимости усложнения транспорта посредством мембранного барьера, свободная диффузия молекулярных компонентов внутри безмембранных органелл, имеющих свойства жидких капель, обеспечивает условия для эффективной регуляции скоростей биохимических реакций в ограниченном участке нуклеоплазмы или цитоплазмы. При этом, однако, следует отметить, что некоторые специфические макромолекулы в условиях сохранения диффузии демонстрируют более длительное время нахождения в составе безмембранных органелл, вероятно, за счет их определенной структурной роли. Таким образом, в составе безмембранных органелл различают молекулы-резиденты (scaffold molecules) и молекулы-клиенты (Banani et al., 2016), иными словами “водители” (drivers), напрямую участвующие в процессе формирования безмембранной органеллы, и привлекаемые в нее “пассажиры” (passengers) (Zaslavsky et al., 2018).
Резидентные молекулы необходимы для формирования безмембранных органелл конкретного типа, а молекулы-клиенты взаимодействуют со структурными молекулами и не являются обязательными для формирования органеллы. Нередко для формирования безмембранной органеллы достаточно всего одного структурного компонента. Например, для формирования PML-телец достаточен только белок PML (Ishov et al., 1999), хотя при этом такие тельца не становятся в полной мере функциональными.
Резидентные (структурные) молекулы составляют лишь небольшую часть компонентов безмембранных органелл, а большую часть их содержимого составляют многочисленные молекулы-клиенты, определяющие функцию органелл конкретного типа. При формировании безмембранной органеллы резидентные белки сначала претерпевают фазовый переход “жидкость–жидкость”, а затем рекрутируют белки-клиенты в состав формирующейся органеллы.
Если само по себе формирование безмембранных органелл не требует специфических взаимодействий между макромолекулами, то на рекрутирование молекул-клиентов влияют как неспецифические взаимодействия, например электростатические свойства молекул, имеющих определенный заряд, так и специфические взаимодействия между молекулами. Относительный вклад специфического связывания и электростатических взаимодействий варьируется среди разных безмембранных органелл (Banani et al., 2017).
ОСНОВНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ФАЗОВЫЙ ПЕРЕХОД “ЖИДКОСТЬ–ЖИДКОСТЬ”
Поскольку безмембранные органеллы демонстрируют свойства LLPS-капель in vitro и in vivo, в последнее время широкое распространение получили исследования, направленные на разрешение вопроса о том, какие именно биомакромолекулы способны подвергаться фазовому разделению и за счет каких их свойств. При этом любое событие, которое оказывает влияние на локальную концентрацию тех или иных молекулярных компонентов метаболизма клетки, их уровень, а также деградацию или локализацию, будет влиять на формирование и общий объем безмембранных органелл, представленных LLPS-структурами (Banani et al., 2017).
С помощью систем in vitro выявлены фундаментальные принципы перехода в жидко-капельную фазу, физическая и молекулярная природа безмембранных органелл как LLPS-капель. Важным фактором, влияющим на фазовое разделение белков и РНК, является поливалентность (multivalency) их молекул (Li et al., 2012) – наличие множественных элементов (молекулярных модулей), определяющих внутри- и межмолекулярные взаимодействия.
Исходя из классических концепций химии полимеров, в принципе любая система, основанная на взаимодействиях между поливалентными объектами в условиях макромолекулярного краудинга, имеет потенцию к разделению фаз в подходящих условиях растворителя (свободный объем растворителя должен быть минимальным). Поливалентность способствует сборке более крупных структур, позволяя осуществиться разделению фаз при довольно низкой концентрации молекул, прежде всего белков, иными словами, понижает критическую концентрацию полимеров, необходимую для разделения фаз. Олигомеризация и разделение фаз связаны с нековалентной ассоциацией поливалентных молекул, при этом увеличение сродства между взаимодействующими модулями или количества этих модулей (валентностей молекулы) способствует образованию более крупных комплексов. По современным представлениям важными параметрами, контролирующими LLPS, являются количество взаимодействующих модулей (валентность) и аффинность (сила взаимодействия индивидуальных модулей) белков, способных к фазовому разделению (Drino, Schaefer, 2018).
Основной вклад в образование безмембранных органелл, как показали эксперименты in vitro, вносят белки, содержащие внутренне неупорядоченные участки (intrinsically disordered regions, IDRs) или домены низкой сложности (low complexity domains, LCDs). Такие белки способны к самопроизвольному фазовому разделению в физиологических условиях. В настоящее время общепринято, что фазовое разделение внутренне неупорядоченных белков является фундаментальным принципом формирования безмембранных органелл (Uversky, 2017; Protter et al., 2018; Fonin et al., 2018; Zhou et al., 2018; Turoverov et al., 2019). Присутствием таких белков, в частности, во многом определяется высокая проницаемость и низкая плотность безмембранных органелл, имеющих свойства LLPS-капель (Wei et al., 2017).
В составе всех безмембранных органелл (как ядерных, так и цитоплазматических) присутствует по крайней мере один неупорядоченный белок, молекулы которого содержат домены низкой сложности. В действительности безмембранные органеллы обычно содержат сразу несколько внутренне неупорядоченных белков. По данным биоинформационного анализа, среди ядерных органелл внутренне неупорядоченными являются 27% белков ядрышка, около 30% – телец Кахаля и телец PML, а в ядерных спеклах (кластерах интерхроматиновых гранул) неупорядоченные белки составляют более 40% по сравнению с 17% неупорядоченных белков цитоплазмы (Meng et al., 2016). Следует также учесть, что молекулы многих белков содержат сразу несколько внутренне неупорядоченных участков.
Внутренне неупорядоченные участки и домены низкой сложности не имеют определенной трехмерной структуры. Такие участки обычно состоят из ограниченного набора аминокислотных остатков, преимущественно глицина (G), глутамина (Q), аспарагина (N), фенилаланина (F) и тирозина (Y), а также заряженных остатков лизина (K), аргинина (R), глутаминовой (E) и аспарагиновой (D) кислот. Домены низкой сложности содержат повторяющиеся элементы, обеспечивающие межмолекулярные поливалентные взаимодействия за счет слабой адгезии, а в составе внутренне неупорядоченных участков, как правило, вообще сложно выделить какое-либо упорядоченное расположение аминокислотных остатков за исключением высокого содержания заряженных.
Домены низкой сложности содержат, например, многие белки ядрышка, претерпевающие LLPS в ходе его формирования. В качестве примера можно привести множественные копии остатков аргинина (R-motifs), входящие в состав канонических сигналов ядрышковой локализации (NoLS) более сотни ядрышковых белков, внутренне неупорядоченные кислые области (A-tracts) молекулы нуклеофозмина (белка гранулярного компонента, известного также как NPM1, NO38 или B23), взаимодействующие с R-мотивами других белков и рРНК (Mitrea et al., 2016, 2018), или аргинин-глициновые повторы (RGG box) в молекуле метилтрансферазы фибрилларина (Thandapani et al., 2013) – одного из ключевых белков плотного фибриллярного компонента ядрышек и также телец Кахаля.
Существенную роль в фазовом разделении играют внутри- и межмолекулярные нековалентные взаимодействия между положительно заряженными аминокислотными остатками и π-электронами ароматических остатков (например, фенилаланина) – так называемые катион-π-взаимодействия. В частности, эксперименты in vitro на примере DEAD-box-хеликазы 4 (DDX4) – конститутивном компоненте цитоплазматических гранул (nuage) клеток зародышевой линии – показали эффективность фазового разделения белков, у которых внутренне неупорядоченные области содержат фенилаланин-глициновые (F/G)-повторы, чьи ароматические кольца способствуют разделению фаз и вовлечены катион-π-взаимодействия с остатками аргинина (Nott et al., 2015).
Молекулы белков с внутренне неупорядоченными областями обычно содержат РНК-распознающие мотивы (RRMs), обеспечивающие связывание РНК с такими белками. Однако, например, коилин (структурный белок телец Кахаля), который содержит RGG-повторы и другие последовательности низкой сложности, способен связывать РНК в отсутствие какого-либо аннотированного РНК-связывающего домена (Machyna et al., 2014). В качестве примера RRM-содержащих белков наиболее хорошо известных ядерных органелл можно привести SR-белки – молекулярные маркеры ядерных спеклов (Tripathi et al., 2012) или PSPC1 – диагностический белок параспеклов (Fox, Lamond, 2010). Кстати, молекулы SR-белков характеризуются и присутствием доменов низкой сложности, представляющих собой характерные RS-повторы, ответственные за межмолекулярные взаимодействия (Shepard, Hertel, 2009).
Показано, что РНК-связывающие участки молекул белков имеют важность для осуществления LLPS, поскольку процессом фазового перехода управляют поливалентные взаимодействия между, например, остатками тирозина в неупорядоченных областях и остатками аргинина в РНК-распознающих мотивах (Wang et al., 2018).
Следует отметить, что разные типы возможных взаимодействий (между ароматическими остатками, заряженными аминокислотами и т.д.) мало влияют на структурную организацию белковой цепи, что полностью соответствует динамическому характеру фазово-разделенных жидкостей. Низкая стабильность таких взаимодействий обусловлена также их низкой аффинностью.
Говоря о внутренне неупорядоченных белках в связи с формированием безмембранных органелл, следует отметить, что структурное и функциональное “поведение” (behavior) внутренне неупорядоченных белков при формировании безмембранных органелл, как и свойства самих сформированных органелл, не могут быть определены (описаны) просто суммарным сложением характеристик отдельных белков и частей их молекул. Иными словами, в сложных системах, состоящих из множества компонентов (а к таковым как раз и относятся безмембранные органеллы), отдельные компоненты взаимодействуют друг с другом нелинейно и неаддитивно, демонстрируя эмерджентное поведение, которое приводит к самоорганизации и которое невозможно предсказать исходя из поведения отдельных компонентов системы (Turoverov et al., 2019).
Свойства безмембранных органелл хорошо согласуются с физико-математическими представлениями о хаосе и пограничном состоянии между упорядоченностью и хаосом – границе хаоса (edge of chaos systems). Это состояние является границей перехода между упорядоченностью (order) и случайностью (chaos) и характеризуется нестабильностью и постоянными динамическими переходами между порядком и неупорядоченностью. В целом потенциально непредсказуемое поведение сложных систем (систем на границе хаоса) описывается теорией хаоса – областью современной математики (Turoverov et al., 2019 и ссылки на первоисточники там же).
РОЛЬ РНК ПРИ ФОРМИРОВАНИИ БЕЗМЕМБРАННЫХ ОРГАНЕЛЛ
Как уже было отмечено, многие ядерные и цитоплазматические безмембранные органеллы содержат РНК. Ядерные РНК-содержащие органеллы обычно формируются в местах расположения кодирующих и некодирующих элементов генома и появляются параллельно с биосинтезом специфических РНК, а цитоплазматические формируются за счет РНК, которые уже существуют в цитоплазме.
Если большинство исследований разделения фаз при формировании безмембранных органелл в течение многих лет было посвящено изучению роли специфических белков в процессе LLPS, то лишь относительно недавно стали придавать значение роли РНК в регуляции процессов фазового перехода (Drino, Schaefer, 2018). По современным представлениям РНК могут участвовать в формировании безмембранных органелл вне зависимости от того, служат ли они сами по себе “затравочными молекулами” или рекрутируются белками.
РНК могут служить структурной основой (скаффолдом), связывающей различные компоненты безмембранной органеллы, влиять на свойства других (белковых) ее компонентов, а главное, выступать в качестве “затравки”, инициирующей начало формирования безмембранной органеллы – первую стадию фазового перехода, которую в физикохимии называют нуклеацией. В английском языке роль РНК в формировании безмембранных органелл подчеркивается удобным словом “seeding”, означающим “обсеменение”, “засеивание”, “рассеивание” и т.п. (ср. “RNA seeds nuclear bodies” – Carmo-Fonseca, Rino, 2011). Концентрируясь в определенных участках ядра и цитоплазмы в результате макромолекулярного краудинга, РНК могут создавать “затравочную платформу” для нуклеации безмембранной органеллы. Присутствие РНК стимулирует фазовое разделение (LLPS) внутренне неупорядоченных белков, и этот процесс в присутствии РНК происходит при более низких значениях концентрации белков, чем это обычно необходимо (Lin et al., 2015). За первоначальным этапом формирования (нуклеацией) безмембранной органеллы следует период постепенного увеличения диаметра органеллы до определенного “критического” значения, по-видимому, специфичного для безмембранных органелл конкретного типа.
Участие РНК в формировании безмембранных органелл хорошо прослеживается на примере большинства “канонических” ядерных телец. Так, самая известная ядерная органелла – ядрышко образуется в результате транскрипции рДНК (Raška et al., 2004), а синтезируемые при этом рРНК служат “затравочными молекулами”, инициирующими его нуклеацию (Falahati et al., 2016). Еще один пример подобного рода демонстрируют параспеклы, которые формируются исключительно в местах синтеза длинной некодирующей РНК (lncРНК) NEAT1 (Clemson et al., 2009), при этом NEAT1 играет ведущую роль не только в формировании параспеклов, но и в поддержании специфической архитектуры этих ядерных органелл (Lin et al., 2018). Чтобы подчеркнуть роль lncРНК в формировании РНК-содержащих безмембранных органелл, такие РНК иногда называют “архитектурными” (arcРНК) (Chujo et al., 2016).
Другим примером четкой координации между транскрипцией специфических генов и формированием безмембранной органеллы служит появление телец гистонового локуса, которые содержат факторы процессинга 3'-конца пре-мРНК гистонов, включая U7 малую ядерную (sn) РНК, и специфически связаны с участками транскрипции гистоновых генов (Duronio, Marzluff, 2017). Наконец, давно известно, что тельца Кахаля обнаруживаются в местах транскрипции генов, кодирующих snРНК (Frey, Matera, 2001), и именно пре-snРНК обеспечивают эту специфичность (Frey et al., 1999; Machyna et al., 2014). Напомним, что в тельцах Кахаля с помощью специфичных малых РНК (scaРНК) осуществляются посттранскрипционные модификации (метилирование и псевдоуридинилирование) snРНК сплайсинга и поздние этапы процессинга snРНП, включая сборку snРНП-субъединиц сплайсосом (Meier, 2017; Sawyer et al., 2016). С помощью математического моделирования уже давно было предсказано, что для сборки функциональных snРНП необходима повышенная локальная концентрация РНК-компонентов в тельцах Кахаля (Klingauf et al., 2006).
Кроме того, в ряде работ убедительно показано, что многие ядерные органеллы содержат специфические активаторы и регуляторы транскрипции. Например, в тельцах Кахаля присутствует консервативный (для клеток Drosophila и человека) малый комплекс элонгации (LEC), участвующий в транскрипции генов snРНК, которая зависит от РНК-полимеразы II (Smith et al., 2011; Hu et al., 2013), а также 7SK snРНП – полифункциональный регулятор транскрипции этих генов, ассоциированный с LEC (Egloff et al., 2017).
По современным представлениям продолжающийся (ongoing) биосинтез специфических кодирующих и некодирующих РНК, как и котранскрипционный процессинг этих РНК, обеспечивает формирование и структурную стабильность ядерных РНК-содержащих органелл. И наоборот, низкий уровень локальной концентрации РНК-транскриптов препятствует формированию таких безмембранных органелл и поддержанию их целостности.
Давно известно, что подавление транскрипции с помощью ингибиторов, таких как α-аманитин, актиномицин D или DRB, приводит к разрушению телец Кахаля (Carmo-Fonseca et al., 1992; Frey et al., 1999), а ключевые белки этих безмембранных органелл в результате перераспределяются и локализуются в нехарактерных местах. Например, коилин при воздействии актиномицином D в результате разрушения телец Кахаля может оказаться в перинуклеолярном компартменте, куда попадают и другие белки ядерных органелл (Kawaguchi et al., 2015). В некоторых случаях экспериментальное подавление транскрипции не приводит к исчезновению существующей безмембранной органеллы, но вызывает существенную перестройку ее структуры и изменение молекулярного состава (Stepanova et al., 2007).
Нередко при подавлении транскрипции различные белки накапливаются в ядрышке. Это подтверждают не только “классические” исследования локализации белков, но и анализ протеома ядрышка, который показал высокую динамику его белкового состава, который изменяется при подавлении транскрипции, зависимой от РНК-полимеразы I (Andersen et al., 2005). В данном случае синтез рРНК может изменять термодинамические параметры, управляющие сборкой ядрышка, но при этом он не влияет на механизм пассивного разделения фаз (Berry et al., 2015). Нехарактерные для ядрышка белки, например коилин, могут оказаться в ядрышке и при физиологически детерминированной инактивации транскрипции, например в позднем оогенезе (Цветков и др., 2002).
Нарушения процессинга новосинтезированных РНК также приводят к исчезновению (разборке) некоторых ядерных органелл. Яркий пример демонстрируют тельца Кахаля и тельца гистонового локуса, обогащенные специфическими snРНК. Зависимый от C-концевого домена (CTD) РНК-полимеразы II котранскрипционный процессинг 3'-конца этих РНК, как известно, обеспечивается специфическим для клеток Metazoa многокомпонентным комплексом Интегратор (Integrator complex) (Baillat, Wagner, 2015). Эксперименты с использованием малых интерферирующих РНК (siРНК) показали, что деплеция ключевых субъединиц комплекса Интегратор, приводящая к полному нарушению его функций, вызывает разрушение органелл обоих типов – и телец гистонового локуса, и телец Кахаля (Albrecht et al., 2018).
Таким образом, нарушения не только транскрипции специфических генов, но и процессинга соответствующих РНК приводят к разборке специфических безмембранных органелл. И наоборот, формирование безмембранных органелл de novo можно вызвать искусственно путем “привязки” (тетеринга) определенных РНК к специфическим хроматиновым участкам, созданным путем биоинжениринга. Подобного рода эксперименты, например, проводили в отношении РНК, способных нуклеировать ядрышко, тельца Кахаля, тельца гистонового локуса, ядерные спеклы и параспеклы (Shevtsov, Dundr, 2011; Mao et al., 2011a; Berry et al., 2015). Искусственная секвестрация РНК обеспечивает возможность ассоциации с ними РНК-связывающих белков, которые в свою очередь взаимодействуют между собой и с другими РНК-связывающими белками, что создает кумулятивный эффект, приводящий к новообразованию безмембранных органелл. Такие эксперименты подтверждают не только существование общих принципов формирования безмембранных органелл разных типов, но и физиологического единства некоторых из них. Так, усиленная аккумуляция зависимых от репликации пре-мРНК гистонов на хроматине приводила к нуклеации не только телец гистонового локуса, но и телец Кахаля (Shevtsov, Dundr, 2011).
Поскольку главные силы, управляющие LLPS, имеют, прежде всего, электростатическую природу, локальная концентрация отрицательно заряженных молекул, таких как РНК, может регулировать процесс формирования безмембранных органелл (LLPS) даже в отсутствие высокой степени сродства (аффинности) между молекулами. При этом РНК могут участвовать в LLPS не только за счет специфических взаимодействий с белками, но и выступать в качестве неспецифического полианиона, участвующего в электростатических взаимодействиях с положительно заряженными аминокислотными остатками в доменах низкой сложности молекул белков, способных к фазовому разделению (Courchaine et al., 2016). Общие неспецифические свойства молекул, такие как заряд, могут использоваться и для целенаправленного связывания (таргетинга) макромолекул со специфическими фазами.
БЕЗМЕМБРАННЫЕ ОРГАНЕЛЛЫ СО СЛОЖНОЙ ВНУТРЕННЕЙ СТРУКТУРОЙ
С помощью электронной микроскопии или сверхразрешающей светооптической микроскопии на химически зафиксированных препаратах можно обнаружить, что некоторые безмембранные органеллы представляют собой довольно однородные по структуре образования (рис. 2а, стрелки, 2, 2в), в то время как другие отличаются весьма сложной внутренней структурой (рис. 2б, г). Предполагают, что такая неоднородность возникает за счет вторичного разделения жидких фаз внутри безмембранной органеллы (Sawyer et al., 2019). Однако функциональное значение субкомпартментализации безмембранных органелл необходимо выяснять в каждом конкретном случае.
Классическим примером безмембранной органеллы с внутренней неоднородностью является ядрышко, компоненты которого (фибриллярные центры, содержащие рДНК, плотный фибриллярный компонент, с которым связаны начальные этапы процессинга пре-рРНК, и гранулярный компонент, содержащий прорибосомные частицы) отличаются по своим физико-химическим свойствам (Feric et al., 2016). Сложная структура ядрышка отражает объединение в ядрышке различных процессов, связанных одновременно как с транскрипцией, так и с процессингом РНК (Hernandez-Verdun et al., 2010).
Менее очевидно с функциональной точки зрения существование характерной внутренней структуры типичных телец Кахаля соматических клеток млекопитающих. Их главный структурный элемент – перекрученные тяжи (coiled threads), впервые описанные в конце 1960-х гг. с помощью электронной микроскопии (Monneron, Bernhard, 1969), по-видимому, представляют собой относительно твердые по сравнению с окружающим пространством образования, заключенные в жидкую фазу. Считают, что существуют механизмы регуляции относительного количества более твердого и жидкого материала, что приводит к достижению функционального эффекта за счет регуляции кинетики конкретной реакции при необходимости механической стабилизации структуры (Banani et al., 2017).
Очевидно, что сложная внутренняя структура будет оказывать влияние на движение молекул внутри таких безмембранных органелл. Известно, что движение всех молекул будет замедляться в концентрированном растворе небольших по размеру молекул, соответственно в нем будут снижаться скорости реакций. Однако раствор, содержащий концентрированную полимерную матрицу, ведет себя иначе. В этом случае свободное пространство между конденсированными компонентами “каркаса” обладает свойствами пор, через которые будут свободно перемещаться небольшие белки, как если бы полимер отсутствовал, и только крупные молекулы, неспособные проникнуть в эти поры, или молекулы, которые связывают полимер, будут двигаться медленно (Cai et al., 2011). В отношении РНК-содержащих безмембранных органелл такие эффекты будут проявляться особенно заметно, поскольку такие органеллы одновременно содержат как крупные молекулы РНК и белков, так и небольшие органические молекулы.
Классический пример сложной структурированности демонстрируют характерные ядерные тельца сферической формы (отсюда их историческое название “сферы” или “сферические органеллы”), наблюдаемые в ооцитах амфибий и представляющие собой своеобразные тельца гистонового локуса (ранее описываемые как тельца Кахаля), структурно связанные с ядерными спеклами (кластерами интерхроматиновых гранул) (Gall et al., 2004; Nizami et al., 2010). Эти ядерные органеллы не имеют внутреннего каркаса в виде “coiled threads”, характерных для типичных телец Кахаля соматических клеток млекопитающих, а входящие в их состав субкомпартменты, по-видимому, сохраняют свойства жидких капель. Они имеют довольно низкую плотность и хорошо проницаемы даже для относительно крупных молекул, что показано с помощью инъекций в цитоплазму или ядро ооцитов Xenopus флуоресцентно меченых декстранов, характеризующихся разным размером молекул (Handwerger et al., 2005).
Еще одним ярким, но необычным примером безмембранной органеллы со сложной внутренней структурой служат своеобразные ядерные тельца, характерные для поздних ооцитов домового сверчка Acheta domesticus (Stepanova et al., 2007) (рис. 2д, е). Ранее их рассматривали как сложные тельца Кахаля, структурно ассоциированные с кластером интерхроматиновых гранул, расположенным внутри центральной полости, но за счет присутствия U7 snРНП в коилинсодержащем матриксе их все-таки следует рассматривать как своеобразные тельца гистонового локуса. Хотя, безусловно, это слишком сложные по морфологии и молекулярному составу структуры, чтобы они могли быть отнесены к какому-то одному классу ядерных органелл. Тем более что разные их части (субкомпартменты) аккумулируют некоторые белки, которые не характерны ни для телец Кахаля, ни для телец гистонового локуса, например связанные с транскрипцией, зависимой от РНК-полимеразы II, белки CBP/p300 и TBP (Степанова и др., 2007) или хроматинремоделирующий белок ATRX (Степанова, Боголюбов, 2017) (рис. 2д). Можно предположить, что внутренняя неоднородность таких уникальных структур, вероятно, возникает в результате вторичного разделения жидких фаз, поскольку в раннем оогенезе сверчка им предшествуют совершенно однородные по структуре “капли”, способные, по-видимому, к слиянию.
ЗАКЛЮЧЕНИЕ
Прорывное открытие того, что безмембранные компартменты ядра и цитоплазмы, известные теперь как безмембранные органеллы или биомакромолекулярные конденсаты (BioMCs), представляют собой жидкие капли и формируются по законам физикохимии полимеров в результате фазового перехода “жидкость–жидкость” (LLPS), в течение последних нескольких лет привело к настоящей LLPS-революции в биологии (Shin, Brangwynne, 2017). Однако с функциональной точки зрения многие безмембранные органеллы пока еще представляют собой “черные ящики” (Sawyer et al., 2019). Особенно это касается малозаметных функций, характеристика которых требует мультидисциплинарных подходов, ведь большинство безмембранных органелл, имея одну или несколько основных (канонических) функций, являются полифункциональными образованиями. Открытым остается вопрос, как клетка может регулировать процесс LLPS, приводящий к формированию безмембранных органелл с различным молекулярным составом и специфическими функциями.
Одним из перспективных направлений будущих исследований представляется выяснение функций безмембранных органелл в развитии атипичных клеточных состояний, особенно в связи с тем, что в результате LLPS в безмембранных органеллах определенных типов, включая наиболее “универсальные”, концентрируются белки, вовлеченные в патологические процессы, в том числе связанные с социально значимыми неврологическими и возрастными заболеваниями. Список функций, которые играют безмембранные органеллы в патофизиологии, будет постоянно расширяться, по мере того как будут более полно и всесторонне охарактеризованы такие белки и их “поведение” в клетке. Например, остается не до конца выясненным вопрос о том, является ли образование LLPS-капли необходимым условием формирования преципитатов, включая амилоидные фибриллы, при переходе клетки к патологическому состоянию и как можно контролировать концентрацию патогенного белка внутри жидкой фазы для предотвращения этого процесса.
Наконец, остается невыясненным с позиций разделения фаз механизм возникновения и биологическое значение сложной субкомпартментализации, которую демонстрируют некоторые безмембранные органеллы, особенно в ядре ооцитов (Bogolyubov et al., 2009). Здесь также представляется важным мультидисциплинарный подход к проблеме. В этом отношении в кооперации с молекулярными биологами существенный вклад в ее решение могут внести морфологи – электронные микроскописты. Электронная микроскопия дает очевидные преимущества в разрешающей способности по сравнению с другими методами, но само по себе филигранное описание ультраструктуры различных безмембранных органелл не позволяет судить об их формировании, действительных функциях и влиянии на регуляцию и координацию событий экспрессии генов в контексте трехмерной архитектуры ядра и клетки. Электронная микроскопия перестала быть самодостаточным методом клеточной биологии, но в сочетании с молекулярно-биологическими и физико-химическими методами она наверняка может раскрыть новые важные аспекты изучения безмембранных органелл.
Очевидно, что для комплексного решения общебиологических проблем, к каковым относится проблема безмембранных органелл, необходимо сочетание разнообразных подходов, которые на первый взгляд кажутся весьма далекими друг от друга. Очень важным является вопрос, как этого достичь на практике научных исследований, каким образом можно добиться адекватной интеграции биологии и физики в исследованиях биологических систем, включая безмембранные органеллы (Turoverov et al., 2019).
Список литературы
Боголюбов Д.С. 2008. Морфофункциональная компартментализация ядра ооцитов беспозвоночных. Автореф. ... дис. докт. биол. наук. СПБ. 42 с. (Bogolyubov D.S. 2008. Morphofunctional compartmentalization of the oocyte nucleus in invertebrates. Author’s abstract of D. Sci. Dissertation. St. Petersburg. 42 p.)
Боголюбов Д.С. 2018. Интерхроматиновые гранулы – универсальные структуры клеточного ядра: Морфология, молекулярный состав, функции. СПб: Наука. 190 с. (Bogolyubov D.S. 2018. Interchromatin granules – universal structures of the cell nucleus: Morphology, molecular composition and functions. St. Petersburg: Nauka. 190 p.)
Боголюбов Д.С., Боголюбова И.О. 2007. Фактор сплайсинга SC35 и коилин совместно локализуются во “внутренних тельцах” – ядерных структурах ооцитов паука-крестовика. Цитология. 49(6) : 497–501. (Bogolyubov D.S., Bogolyubova I.O. 2007. Splicing factor SC35 and coilin are colocalized within the “endobodies” in the oocytes of the spider Araneus diadematus. Cell Tiss. Biol. (Tsitologiya) 1 : 352–356.)
Степанова И.С., Боголюбов Д.С. 2017. Локализация хроматинремоделирующего белка ATRX в ядре ооцитов некоторых насекомых. Цитология. 59(5) : 351–361. (Stepanova I.S., Bogolyubov D.S. 2017. Localization of the chromatin-remodeling protein ATRX in the oocyte nucleus of some insects. Cell Tiss. Biol. (Tsitologiya) 11 : 416–425.)
Степанова И.С., Боголюбов Д.С., Парфенов В.Н. 2007. Тельца Кахала в ооцитах насекомых. II. Новые данные по молекулярному составу телец Кахала ооцитов домового сверчка. К вопросу о взаимосвязи телец Кахала и кластеров интерхроматиновых гранул. Цитология. 49(1) : 5–20. (Stepanova I.S., Bogolyubov D.S., Parfenov V.N. 2007. Cajal bodies in insects. II. Molecular composition of Cajal bodies in oocytes of house cricket. Relationship between Cajal bodies and interchromatin granule clusters. Cell Tiss. Biol. (Tsitologiya) 1 : 14–29.)
Ходюченко Т.А., Красикова А.В. 2014. Тельца Кахала и тельца гитонового локуса: молекулярный состав и функции. Онтогенез. 45(6) : 363–379. (Khodyuchenko T.A., Krasikova A.V. 2014. Cajal bodies and histone locus bodies: molecular composition and function. Rus. J. Dev. Biol. 45 : 297–312.)
Цветков А.Г., Сковородкин И.А., Боголюбов Д.С., Квасов И.Д., Парфенов В.Н. 2002. Экстрахромосомные структуры, содержащие малые ядерные РНП и коилин, в ядрах поздних вителлогенных ооцитов зимующих травяных лягушек. Цитология. 44(11) : 1037–1045. (Tsvetkov A.G., Skovorodkin I.A., Bogolyubov D.S., Kvasov I.D., Parfenov V.N. 2002. Extrachromosomal structures containing small nuclear RNP and coilin in the late vitellogenic oocytes of hibernating common frogs. Tsitologiya. 44 : 1037–1045.)
Abbott R.D., Nelson J.S., Ross G.W., Uyehara-Lock J.H., Tanner C.M., Masaki K.H., Launer L.J., White L.R., Petrovitch H. 2017. Marinesco bodies and substantia nigra neuron density in Parkinson’s disease. Neuropathol. Appl. Neurobiol. 43 : 621–630.
Aguilera-Gomez A., Rabouille C. 2017. Membrane-bound organelles versus membrane-less compartments and their control of anabolic pathways in Drosophila. Dev. Biol. 428 : 310–317.
Alberti S. 2017. Phase separation in biology. Curr. Biol. 27 : R1089–R1107.
Alberti S., Hyman A.A. 2016. Are aberrant phase transitions a driver of cellular aging? Bioessays. 38: 959–968.
Albrecht T.R., Shevtsov S.P., Wu Y., Mascibroda L.G., Peart N.J., Huang K.-L., Sawyer I.A., Tong L., Dundr M., Wagner E.J. 2018. Integrator subunit 4 is a 'Symplekin-like' scaffold that associates with INTS9/11 to form the Integrator cleavage module. Nucl. Acids Res. 46 : 4241–4255.
Andersen J.S., Lam Y.W., Leung A.K., Ong S.-E., Lyon C.E., Lamond A.I., Mann M. 2005. Nucleolar proteome dynamics. Nature. 433 : 77–83.
Baillat D., Wagner E.J. 2015. Integrator: surprisingly diverse functions in gene expression. Trends Biochem. Sci. 40 : 257–264.
Banani S.F., Lee H.O., Hyman A.A., Rosen M.K. 2017. Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol. 18 : 285–298.
Banani S.F., Rice A.M., Peeples W.B., Lin Y., Jain S., Parker R., Rosen M.K. 2016. Compositional control of phase-separated cellular bodies. Cell. 166 : 651–663.
Batalova F., Stepanova I., Skovorodkin I., Bogolyubov D., Parfenov V. 2005. Identification and dynamics of Cajal bodies in relation to karyosphere formation in scorpionfly oocytes. Chromosoma. 113 : 428–439.
Bellini M., Gall J.G. 1999. Coilin shuttles between the nucleus and cytoplasm in Xenopus oocytes. Mol. Biol. Cell. 10 : 3425–3434.
Berry J., Weber S.C., Vaidya N., Haataja M., Brangwynne C.P. 2015. RNA transcription modulates phase transition-driven nuclear body assembly. Proc. Natl. Acad. Sci. USA. 112 : E5237–E5245.
Biamonti G., Vourc’h C. 2010. Nuclear stress bodies. Cold Spring Harb. Perspect. Biol. 2 : a000695.
Biggiogera M., Pellicciari C. 2000. Heterogeneous ectopic RNP-derived structures (HERDS) are markers of transcriptional arrest. FASEB J. 14 : 828–834.
Bogolyubov D., Stepanova I., Parfenov V. 2009. Universal nuclear domains of somatic and germ cells: Some lessons from oocyte interchromatin granule cluster and Cajal body structure and molecular composition. Bioessays. 31 : 400–409.
Bogolyubova I.O., Bogolyubov D.S. 2013. Oocyte nuclear structure during mammalian oogenesis. In: Recent advances in germ cells research. N.Y., Nova Biomedical. 105–132.
Brangwynne C.P. 2013. Phase transitions and size scaling of membrane-less organelles. J. Cell Biol. 203 : 875–881.
Brangwynne C.P., Eckmann C.R., Courson D.S., Rybarska A., Hoege C., Gharakhani J., Jülicher F., Hyman A.A. 2009. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science. 324 : 1729–1732.
Brangwynne C.P., Mitchison T.J., Hyman A.A. 2011. Active liquid-like behavior of nucleoli determines their size and shape in Xenopus laevis oocytes. Proc. Natl. Acad. Sci. USA. 108 : 4334–4339.
Cai L.-H., Panyukov S., Rubinstein M. 2011. Mobility of nonsticky nanoparticles in polymer liquids. Macromolecules. 44 : 7853–7863.
Carmo-Fonseca M., Berciano M.T., Lafarga M. 2010. Orphan nuclear bodies. Cold Spring Harb. Perspect. Biol. 2 : a000703.
Carmo-Fonseca M., Pepperkok R., Carvalho M.T., Lamond A.I. 1992. Transcription-dependent colocalization of the U1, U2, U4/U6, and U5snRNPs in coiled bodies. J. Cell Biol. 117 : 1–14.
Carmo-Fonseca M., Rino J. 2011. RNA seeds nuclear bodies. Nat. Cell Biol. 13 : 110–112.
Chen T., Boisvert F.-M., Bazett-Jones D.P., Richard S. 1999. A role for the GSG domain in localizing Sam68 to novel nuclear structures in cancer cell lines. Mol. Biol. Cell. 10 : 3015–3033.
Chujo T., Yamazaki T., Hirose T. 2016. Architectural RNAs (arcRNAs): a class of long noncoding RNAs that function as the scaffold of nuclear bodies. Biochim. Biophys. Acta. 1859 : 139–146.
Clemson C.M., Hutchinson J.N., Sara S.A., Ensminger A.W., Fox A.H., Chess A., Lawrence J.B. 2009. An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles. Mol. Cell. 33 : 717–726.
Courchaine E.M., Lu A., Neugebauer K.M. 2016. Droplet organelles? EMBO J. 35 : 1603–1612.
Crowe C.D., Keating C.D. 2018. Liquid–liquid phase separation in artificial cells. Interface Focus. 8 : 20180032.
De Graeve F., Besse F. 2018. Neuronal RNP granules: From physiological to pathological assemblies. Biol. Chem. 399 : 623–635.
Drino A., Schaefer M.R. 2018. RNAs, phase separation, and membrane-less organelles: Are post-transcriptional modifications modulating organelle dynamics? Bioessays. 40 : e1800085.
Dundr M., Hebert M.D., Karpova T.S., Stanek D., Xu H., Shpargel K.B. Meier U.T, Neugebauer K.M., Matera A.G., Misteli T. 2004. In vivo kinetics of Cajal body components. J. Cell Biol. 164 : 831–842.
Duronio R.J., Marzluff W.F. 2017. Coordinating cell cycle-regulated histone gene expression through assembly and function of the Histone Locus Body. RNA Biol. 14 : 726–738.
Egloff S., Vitali P., Tellier M., Raffel R., Murphy S., Kiss T. 2017. The 7SK snRNP associates with the little elongation complex to promote snRNA gene expression. EMBO J. 36 : 934–948.
Falahati H., Haji-Akbari A. 2019. Thermodynamically driven assemblies and liquid-liquid phase separations in biology. Soft Matter. 15 : 1135–1154.
Falahati H., Pelham-Webb B., Blythe S., Wieschaus E. 2016. Nucleation by rRNA dictates the precision of nucleolus assembly. Curr. Biol. 26 : 277–285.
Feric M., Vaidya N., Harmon T.S., Mitrea D.M., Zhu L., Richardson T.M., Kriwacki R.W., Pappu R.V., Brangwynne C.P. 2016. Coexisting liquid phases underlie nucleolar subcompartments. Cell. 165 : 1686–1697.
Fonin A.V., Darling A.L., Kuznetsova I.M., Turoverov K.K., Uversky V.N. 2018. Intrinsically disordered proteins in crowded milieu: When chaos prevails within the cellular gumbo. Cell Mol. Life Sci. 75 : 3907–3929.
Fox A.H., Lamond A.I. 2010. Paraspeckles. Cold Spring Harb. Perspect. Biol. 2 : a000687.
Frey M.R., Bailey A.D., Weiner A.M., Matera A.G. 1999. Association of snRNA genes with coiled bodies is mediated by nascent snRNA transcripts. Curr. Biol. 9 : 126–135.
Frey M.R., Matera A.G. 2001. RNA-mediated interaction of Cajal bodies and U2 snRNA genes. J. Cell Biol. 154 : 499–509.
Frey S., Richter R.P., Görlich D. 2006. FG-rich repeats of nuclear pore proteins form a three-dimensional meshwork with hydrogel-like properties. Science. 314 : 815–817.
Gall J.G., Wu Z., Murphy C., Gao H. 2004. Structure in the amphibian germinal vesicle. Exp. Cell Res. 296 : 28–34.
Godoy-Gallardo M., York-Duran M.J., Hosta-Rigau L. 2018. Recent progress in micro/nanoreactors toward the creation of artificial organelles. Adv. Healthc. Mater. 7 : 1700917
Guzikowski A.R., Chen Y.S., Zid B.M. 2019. Stress-induced mRNP granules: Form and function of processing bodies and stress granules. Wiley Interdiscip. Rev. RNA. 10 : e1524.
Handwerger K.E., Cordero J.A., Gall J.G. 2005. Cajal bodies, nucleoli, and speckles in the Xenopus oocyte nucleus have a low-density, sponge-like structure. Mol. Biol. Cell. 16 : 202–211.
Hernandez-Verdun D., Roussel P., Thiry M., Sirri V., Lafontaine D.L. 2010. The nucleolus: structure/function relationship in RNA metabolism. Wiley Interdiscip. Rev. RNA. 1 : 415–431.
Hu D., Smith E.R., Garruss A.S., Mohaghegh N., Varberg J.M., Lin C., Jackson J., Gao X., Saraf A., Florens L., Washburn M.P., Eissenberg J.C., Shilatifard A. 2013. The little elongation complex functions at initiation and elongation phases of snRNA gene transcription. Mol. Cell. 51 : 493–505.
Huang S. 2000. Perinucleolar structures. J. Struct. Biol. 129 : 233–240.
Hyman A.A., Weber C.A., Jülicher F. 2014. Liquid–liquid phase separation in biology. Annu. Rev. Cell Dev. Biol. 30 : 39–58.
Ishov A.M., Sotnikov A.G., Negorev D., Vladimirova O.V., Neff N., Kamitani T., Yeh E.T., Strauss J.F. 3rd, Maul G.G. 1999. PML is critical for ND10 formation and recruits the PML-interacting protein Daxx to this nuclear structure when modified by SUMO-1. J. Cell Biol. 147 : 221–234.
Johnston J.A., Ward C.L., Kopito R.R. 1998. Aggresomes: A cellular response to misfolded proteins. J. Cell Biol. 143 : 1883–1898.
Kawaguchi T., Tanigawa A., Naganuma T., Ohkawa Y., Souquere S., Pierron G., Hirose T. 2015. SWI/SNF chromatin-remodeling complexes function in noncoding RNA-dependent assembly of nuclear bodies. Proc. Natl. Acad. Sci. USA. 112 : 4304–4309.
Khodyuchenko T., Gaginskaya E., Krasikova A. 2012. Non-canonical Cajal bodies form in the nucleus of late stage avian oocytes lacking functional nucleolus. Histochem. Cell Biol. 138 : 57–73.
Klingauf M., Staněk D., Neugebauer K.M. 2006. Enhancement of U4/U6 small nuclear ribonucleoprotein particle association in Cajal bodies predicted by mathematical modeling. Mol. Biol. Cell. 17 : 4972–4981.
Kloc M., Biliński S., Etkin L.D. 2004. The Balbiani body and germ cell determinants: 150 years later. Curr. Top. Dev. Biol. 59 : 1–36.
Kopito R.R. 2000. Aggresomes, inclusion bodies and protein aggregation. Trends Cell Biol. 10 : 524–530.
Koshel E., Galkina S., Saifitdinova A., Dyomin A., Deryusheva S., Gaginskaya E. 2016. Ribosomal RNA gene functioning in avian oogenesis. Cell Tissue Res. 366 : 533–542.
Krasikova A., Barbero J.L., Gaginskaya E. 2005. Cohesion proteins are present in centromere protein bodies associated with avian lampbrush chromosomes. Chromosome Res. 13 : 675–685.
Krasikova A., Kulikova T., Saifitdinova A., Derjusheva S., Gaginskaya E. 2004. Centromeric protein bodies on avian lampbrush chromosomes contain a protein detectable with an antibody against DNA topoisomerase II. Chromosoma. 113 : 316–323.
Kuznetsova I.M., Zaslavsky B.Y., Breydo L., Turoverov K.K., Uversky V.N. 2015. Beyond the excluded volume effects: Mechanistic complexity of the crowded milieu. Molecules. 20 : 1377–1409.
Lafarga L., Berciano M.T., Pena E., Mayo I., Castaño J.G., Bohmann D., Rodrigues J.P., Tavanez J.P., Carmo-Fonseca M. 2002.Clastosome: A subtype of nuclear body enriched in 19S and 20S proteasomes, ubiquitin, and protein substrates of proteasome. Mol. Biol. Cell. 13 : 2771–2782.
Lallemand-Breitenbach V., de Thé H. 2010. PML nuclear bodies. Cold Spring Harb. Perspect. Biol. 2 : a000661.
Lam Y.W., Lyon C.E., Lamond A.I. 2002. Large-scale isolation of Cajal bodies from HeLa cells. Mol. Biol. Cell. 13 : 2461–2473.
Lavrentyeva E., Shishova K., Kagarlitsky G., Zatsepina O. 2017. Localisation of RNAs and proteins in nucleolar precursor bodies of early mouse embryos. Reprod. Fertil. Dev. 29 : 509–520.
Li P., Banjade S., Cheng H.-C., Kim S., Chen B., Guo L., Llaguno M., Hollingsworth J.V., King D.S., Banani S.F., Russo P.S., Jiang Q.-X., Nixon B.T., Rosen M.K. 2012. Phase transitions in the assembly of multivalent signalling proteins. Nature. 483 : 336–340.
Lin Y., Protter D.S., Rosen M.K., Parker R. 2015. Formation and maturation of phase-separated liquid droplets by RNA-binding proteins. Mol. Cell. 60 : 208–219.
Lin Y., Schmidt B.F., Bruchez M.P., McManus C.J. 2018. Structural analyses of NEAT1 lncRNAs suggest long-range RNA interactions that may contribute to paraspeckle architecture. Nucleic Acids Res. 46 : 3742–3752.
Liu J.-L., Gall J.G. 2007. U bodies are cytoplasmic structures that contain uridine-rich small nuclear ribonucleoproteins and associate with P bodies. Proc. Natl. Acad. Sci. USA. 104 : 11655–11659.
Luo Y., Na Z., Slavoff S.A. 2018. P-bodies: Composition, properties, and functions. Biochemistry. 57 : 2424–2431.
Machyna M., Kehr S., Straube K., Kappei D., Buchholz F., Butter F., Ule J., Hertel J., Stadler P.F., Neugebauer K.M. 2014. The coilin interactome identifies hundreds of small noncoding RNAs that traffic through Cajal bodies. Mol. Cell. 56 : 389–399.
Mao Y.S., Sunwoo H., Zhang B., Spector D.L. 2011a. Direct visualization of the co-transcriptional assembly of a nuclear body by noncoding RNAs. Nat. Cell Biol. 13 : 95–101.
Mao Y.S., Zhang B., Spector D.L. 2011b. Biogenesis and function of nuclear bodies. Trends Genet. 27 : 295–306.
Marnik E.A., Updike D.L. 2019. Membraneless organelles: P granules in Caenorhabditis elegans. Traffic. 20 : 373–379.
Matera A.G., Frey M.R. 1998. Coiled bodies and Gems: Janus or Gemini? Am. J. Hum. Genet. 63 : 317–321.
Meier U.T. 2017. RNA modification in Cajal bodies. RNA Biol. 14 : 693–700.
Meng F., Na I., Kurgan L., Uversky V.N. 2016. Compartmentalization and functionality of nuclear disorder: Intrinsic disorder and protein-protein interactions in intra-nuclear compartments. Int. J. Mol. Sci. 17 : 24.
Mitrea D.M., Kriwacki R.W. 2016. Phase separation in biology; functional organization of a higher order. Cell Commun. Signal. 14 : 1.
Mitrea D.M., Cika J.A., Guy C.S., Ban D., Banerjee P.R., Stanley C.B., Nourse A., Deniz A.A., Kriwacki R.W. 2016. Nucleophosmin integrates within the nucleolus via multi-modal interactions with proteins displaying R-rich linear motifs and rRNA. eLife. 5 : e13571.
Mitrea D.M., Cika J.A., Stanley C.B., Nourse A., Onuchic P.L., Banerjee P.R., Phillips A.H., Park C.-G., Deniz A.A., Kriwacki R.W. 2018. Self-interaction of NPM1 modulates multiple mechanisms of liquid–liquid phase separation. Nat. Commun. 9 : 842.
Monneron A., Bernhard W. 1969. Fine structural organization of the interphase nucleus in some mammalian cells. J. Ultrastruct. Res. 27 : 266–288.
Montgomery T.S.H. Jr. 1898. Comparative cytological studies, with especial regard to the morphology of the nucleolus. J. Morphol. 15 : 265–582.
Navascués J., Bengoechea R., Tapia O., Vaqué J.P., Lafarga M., Berciano M.T. 2007. Characterization of a new SUMO-1 nuclear body (SNB) enriched in pCREB, CBP, c-Jun in neuron-like UR61 cells. Chromosoma. 116 : 441–451.
Nizami Z.F., Gall J.G. 2012. Pearls are novel Cajal body-like structures in the Xenopus germinal vesicle that are dependent on RNA pol III transcription. Chromosome Res. 20 : 953–969.
Nizami Z., Deryusheva S., Gall J.G. 2010. The Cajal body and histone locus body. Cold Spring Harb. Perspect. Biol. 2 : a000653.
Nott T.J., Petsalaki E., Farber P., Jervis D., Fussner E., Plochowietz A., Craggs T.D., Bazett-Jones D.P., Pawson T., Forman-Kay J.D., Baldwin A.J. 2015. Phase transition of a disordered nuage protein generates environmentally responsive membraneless organelles. Mol. Cell. 57 : 936–947.
Nott T.J., Craggs T.D., Baldwin A.J. 2016. Membraneless organelles can melt nucleic acid duplexes and act as biomolecular filters. Nat. Chem. 8 : 569–575.
Patel P.H., Barbee S.A., Blankenship J.T. 2016. GW-bodies and P-bodies constitute two separate pools of sequestered non-translating RNAs. PLoS One. 11 : e0150291.
Phair R.D., Misteli T. 2000. High mobility of proteins in the mammalian cell nucleus. Nature. 404 : 604–609.
Pirrotta V., Li H.-B. 2012. A view of nuclear Polycomb bodies. Curr. Opin. Genet. Dev. 22 : 101–109.
Platani M., Goldberg I., Swedlow J.R., Lamond A.I. 2000. In vivo analysis of Cajal body movement, separation, and joining in live human cells. J. Cell Biol. 151 : 1561–1574.
Pombo A., Cuello P., Schul W., Yoon J.-B., Roeder R.G., Cook P.R., Murphy S. 1998. Regional and temporal specialization in the nucleus: A transcriptionally-active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle. EMBO J. 17 : 1768–1778.
Protter D.S.W., Parker R. 2016. Principles and properties of stress granules. Trends Cell Biol. 26 : 668–679.
Protter D.S.W., Rao B.S., Van Treeck B., Lin Y., Mizoue L., Rosen M.K., Parker R. 2018. Intrinsically disordered regions can contribute promiscuous interactions to RNP granule assembly. Cell Rep. 22 : 1401–1412.
Raška I., Koberna K., Malínský J., Fidlerová H., Mašata M. 2004. The nucleolus and transcription of ribosomal genes. Biol. Cell. 96 : 579–594.
Raška I., Shaw P.J., Cmarko D. 2006. New insights into nucleolar architecture and activity. Int. Rev. Cytol. 255 : 177–235.
Rivas G., Minton A.P. 2016. Macromolecular crowding in vitro, in vivo, and in between. Trends Biochem. Sci. 41 : 970–981.
Rocha Cabrero F., Morrison E.H. 2019. Lewy bodies. In: StatPearls [Internet]. Treasure Island (FL), StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK536956/
Sawyer I.A., Sturgill D., Sung M.H., Hager G.L., Dundr M. 2016. Cajal body function in genome organization and transcriptome diversity. Bioessays. 38 : 1197–1208.
Sawyer I.A., Sturgill D., Dundr M. 2019. Membraneless nuclear organelles and the search for phases within phases. Wiley Interdiscip. Rev. RNA. 10 : e1514.
Schul W., Groenhout B., Koberna K., Takagaki Y., Jenny A., Manders E.M., Raška I., van Driel R., de Jong L. 1996.The RNA 3' cleavage factors CstF 64 kDa and CPSF 100 kDa are concentrated in nuclear domains closely associated with coiled bodies and newly synthesized RNA. EMBO J. 15 : 2883–2892.
Schuster B.S., Reed E.H., Parthasarathy R., Jahnke C.N., Caldwell R.M., Bermudez J.G., Ramage H., Good M.C., Hammer D.A. 2018. Controllable protein phase separation and modular recruitment to form responsive membraneless organelles. Nat. Commun. 9 : 2985.
Shepard P.J., Hertel K.J. 2009. The SR protein family. Genome Biol. 10 : 242.
Shevtsov S.P., Dundr M. 2011. Nucleation of nuclear bodies by RNA. Nat. Cell Biol. 13 : 167–173.
Shin Y., Brangwynne C.P. 2017. Liquid phase condensation in cell physiology and disease. Science. 357 : eaaf4382.
Shishova K.V., Lavrentyeva E.A., Dobrucki J.W., Zatsepina O.V. 2015. Nucleolus-like bodies of fully-grown mouse oocytes contain key nucleolar proteins but are impoverished for rRNA. Dev. Biol. 397 : 267–281.
Singh A.K., Lakhotia S.C. 2012. The hnRNP A1 homolog Hrp36 is essential for normal development, female fecundity, omega speckle formation and stress tolerance in Drosophila melanogaster. J. Biosci. 37 : 659–678.
Smith E.R., Lin C., Garrett A.S., Thornton J., Mohaghegh N., Hu D., Jackson J., Saraf A., Swanson S.K., Seidel C., Florens L., Washburn M.P., Eissenberg J.C., Shilatifard A. 2011. The little elongation complex regulates small nuclear RNA transcription. Mol. Cell. 44 : 954–965.
Stepanova I.S., Bogolyubov D.S., Skovorodkin I.N., Parfenov V.N. 2007.Cajal bodies and interchromatin granule clusters in cricket oocytes: Composition, dynamics and interactions. Cell Biol. Int. 31 : 203–214.
Stroberg W., Schnell S. 2017. On the origin of non-membrane-bound organelles, and their physiological function. J. Theor. Biol. 434 : 42–49.
Strzelecka M., Trowitzsch S., Weber G., Lührmann R., Oates A.C., Neugebauer K.M. 2010. Coilin-dependent snRNP assembly is essential for zebrafish embryogenesis. Nat. Struct. Mol. Biol. 17 : 403–409.
Tatomer D.C., Terzo E., Curry K.P., Salzler H., Sabath I., Zapotoczny G., McKay D.J., Dominski Z., Marzluff W.F., Duronio R.J. 2016. Concentrating pre-mRNA processing factors in the histone locus body facilitates efficient histone mRNA biogenesis. J. Cell Biol. 213 : 557–570.
Thandapani P., O’Connor T.R., Bailey T.L., Richard S. 2013. Defining the RGG/RG motif. Mol. Cell. 50 : 613–623.
Tripathi V., Song D.Y., Zong X., Shevtsov S.P., Hearn S., Fu X.-D., Dundr M., Prasanth K.V. 2012. SRSF1 regulates the assembly of pre-mRNA processing factors in nuclear speckles. Mol. Biol. Cell. 23 : 3694–3706.
Turoverov K.K., Kuznetsova I.M., Fonin A.V., Darling A.L., Zaslavsky B.Y., Uversky V.N. 2019. Stochasticity of biological soft matter: Emerging concepts in intrinsically disordered proteins and biological phase separation. Trends Biochem. Sci. https://doi.org/10.1016/j.tibs.2019.03.005
Uversky V.N. 2017. Intrinsically disordered proteins in overcrowded milieu: Membrane-less organelles, phase separation, and intrinsic disorder. Curr. Opin. Struct. Biol. 44 : 18–30.
Wang J., Choi J.-M., Holehouse A.S., Lee H.O., Zhang X., Jahnel M., Maharana S., Lemaitre R., Pozniakovsky A., Drechsel D., Poser I., Pappu R.V., Alberti S., Hyman A.A. 2018. A molecular grammar governing the driving forces for phase separation of prion-like RNA binding proteins. Cell. 174 : 688–699.e16.
Wang Q., Sawyer I.A., Sung M.H., Sturgill D., Shevtsov S.P., Pegoraro G., Hakim O., Baek S., Hager G.L., Dundr M. 2016. Cajal bodies are linked to genome conformation. Nat. Commun. 7 : 10966.
Wei M.-T., Elbaum-Garfinkle S., Holehouse A.S., Chen C.C.-H., Feric M., Arnold C.B., Priestley R.D., Pappu R.V., Brangwynne C.P. 2017. Phase behaviour of disordered proteins underlying low density and high permeability of liquid organelles. Nat. Chem. 9 : 1118–1125.
Wheeler R.J., Hyman A.A. 2018. Controlling compartmentalization by non-membrane-bound organelles. Philos. Trans. R. Soc. Lond. B Biol. Sci. 373 : 20170193.
Zaslavsky B.Y., Ferreira L.A., Darling A.L., Uversky V.N. 2018. The solvent side of proteinaceous membrane-less organelles in light of aqueous two-phase systems. Int. J. Biol. Macromol. 117 : 1224–1251.
Zhou H.-X., Nguemaha V., Mazarakos K., Qin S. 2018. Why do disordered and structured proteins behave differently in phase separation? Trends Biochem. Sci. 43 : 499–516.
Дополнительные материалы отсутствуют.
Инструменты
Цитология


