Цитология, 2019, T. 61, № 9, стр. 719-728
Роль эндотелиоцитов синусоидных капилляров печени в патогенезе нарушений сосудисто-тромбоцитарного звена гемостаза в остром периоде черепно-мозговой травмы
Г. А. Бояринов 1, *, Е. И. Яковлева 1, А. В. Дерюгина 2, **, О. Д. Соловьева 1, Л. В. Бояринова 1, А. В. Полозова 1, 2, Е. В. Мошнина 1, Л. А. Щегольков 1
1 Кафедра анестезиологии и реаниматологии ФДПО Приволжского исследовательского медицинского университета Министерства здравоохранения РФ
603005 Нижний Новгород, Россия
2 Кафедра физиологии и анатомии Национального исследовательского Нижегородского государственного университета
им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
* E-mail: boyarin46@mail.ru
** E-mail: derugina69@yandex.ru
Поступила в редакцию 16.04.2019
После доработки 19.05.2019
Принята к публикации 21.05.2019
Аннотация
У крыс, перенесших черепно-мозговую травму (ЧМТ), в период острого развития травматической болезни изучали количество тромбоцитов, ультраструктурные изменения синусоидных гемокапилляров (СК) печени и нарушения микроциркуляции в их просвете. Результаты исследования показали, что при локальной травме мозга на 3-и сут посттравматического периода определяются тромбоцитопения, выраженные повреждения СК печени и внутрисинусоидальные нарушения микроциркуляции, которые усугубляются на 7-е сут после травмы. Через 12 сут после ЧМТ эндотелий синусоидов определяется обычного вида, но еще встречаются участки его набухания и отека. В 79% синусоидных гемокапилляров восстанавливается кровоток, в 21% определяются макро- и микроагрегаты эритроцитов, пузыри, клеточный детрит и тромбоциты. Анализируя полученные данные можно заключить, что обнаруженные повреждения эндотелиоцитов СК печени в остром периоде ЧМТ позволяют рассматривать их в качестве одного из ключевых и наиболее ранних звеньев патогенеза сосудисто-тромбоцитарного звена гемостаза.
Роль дисфункции эндотелия в развитии и прогрессировании критических состояний не вызывает сомнений и в настоящее время функциональному состоянию эндотелия придается большое значение в изучении этиологии, патогенеза и осложнений этих заболеваний. При этом показано, что дисфункция эндотелия выявляется уже на ранних стадиях болезни (Корж, 2003; Фирсов, Матвеев, 2014; Бояринов и др., 2016б; Винник и др., 2018; Шилов и др., 2018). Однако патофизиологические механизмы коагулопатии при ЧМТ изучены не до конца и могут характеризоваться сочетанием гипо- и гиперкоагуляции (Stein et al., 1993; Oertel et al., 2002; Juratli et al., 2014; Потапов и др., 2016).
В экспериментальных моделях ЧМТ показано, что в сосудах микроциркуляторного русла образуются тромбоцитарные микротромбы (Schwarzmaier et al., 2010), которые, нарушая проходимость сосудов и снижая в них скорость тока крови, ведут к формированию ишемических очагов и вторичным повреждениям головного мозга (Stein et al., 2002). Отдельные клинические работы подтверждают, что острый период тяжелой ЧМТ характеризуется активацией сосудисто-тромбоцитарного звена гемостаза и при этом указывают, что сосудистый эндотелий заслуживает особого внимания в развитии внутрисосудистого свертывания крови (Семченко и др., 2003; Бояринов и др., 2016a). Однако следует заметить, что в этих исследованиях характеристика поврежденного эндотелия микрососудов представлена в основном в очаге первичного поражения и в перифокальной зоне головного мозга. В перифокальной зоне имеются все структурные признаки поражения эндотелия и синдрома локального внутрисосудистого свертывания. Вне очага первичного повреждения мозга выявляется отек стенки сосудов, разрыхление и разволокнение базальной мембраны, просветление и набухание ядер эндотелиальных клеток, вакуолизация цитоплазмы и слущивание эндотелиальных клеток. Морфологические изменения сосудистого русла становятся причиной частичной и полной окклюзии микроциркуляторного русла агрегатами эритроцитов, тромбоцитов и слущенным эндотелием (Семченко и др., 2003).
Принимая во внимание тот факт, что повреждение эндотелия при критических состояниях носит неспецифический характер (Авакимян и др., 2013; Черкасов и др., 2013; Шапкин и др., 2017; Винник и др., 2014, 2018), логично предположить, что аналогичные нарушения эндотелиоцитов могут формироваться при травме головного мозга в микроциркуляторном русле и других органов. Ранее нами было показано, что у крыс, перенесших ЧМТ, в миокарде формируются изменения стенки микрососудов, которые проявлялись в нарушении ее проницаемости, периваскулярном отеке, образовании выростов эндотелия в просвет сосуда, набухании и отеке его цитоплазмы, истончении, вакуолизации и выбухании фрагментов цитоплазмы, деформации микрорельефа люминальной поверхности эндотелиальных клеток (Бояринов и др., 2016в, г). Проведенные клинические исследования выявили, что сопровождающие сочетанную ЧМТ вторичные факторы повреждения мозга (недостаточность кровообращения, гипоксия, ацидоз и повышенное образование свободных радикалов) являются в то же время неспецифическими стимулами изменения структурно-функционального состояния тромбоцитов и эндотелиоцитов кровеносных сосудов и, вследствие этого, вызывают системную активацию сосудисто-тромбоцитарного звена гемостаза (Бояринов и др., 2016a, б).
Системное повреждение клеток эндотелия обусловлено тем, что они расположены на границе между кровью и тканями и поэтому первыми реагируют на патогенные факторы, которые формируются после ЧМТ. В этой связи эндотелий сосудов считается одним из органов-мишеней при травматических повреждениях и основным эффектором в патогенезе гемостазиологического статуса (Фирсов и др., 2014). Известно, что в основе развития травматической болезни лежит системное повреждение сосудистого эндотелия, поэтому необходимо учитывать факт, что эндотелиальные клетки выстилают всю сосудистую систему от сердца до мельчайших капилляров и управляют переходом веществ из тканей в кровь и обратно.
В организме человека содержание эндотелиоцитов достигает 6 триллионов и если бы все эндотелиоциоты располагались вместе, то составили бы орган весом 1.5–1.8 кг (сопоставимо с весом, например, печени) или могли бы составить непрерывную цепь эндотелиальных клеток длиной 7 км, или заняли бы площадь футбольного поля. Без этих пространственных аналогий было бы трудно представить, что тонкая полупроницаемая мембрана, отделяющая кровоток от глубинных cтруктур сосуда, непрерывно вырабатывает огромное количество важнейших биологически активных веществ, являясь таким образом гигантским паракринным органом, распределенным по всей территории человеческого организма. Эндотелий – это не пассивный барьер между кровью и тканями, а активный орган, дисфункция которого, вероятно, является обязательным компонентом патогенеза всех критических состояний (Augustin et al., 1994; Белоусов, Намсараев, 2006; Поройский и др., 2011; Мельникова, Макарова, 2015; Шилов и др., 2017).
Многообразие уникальных свойств, присущих сосудистой стенке, определяет ее ведущую роль в функционировании системы регуляции агрегатного состояния крови. В нормальных условиях эндотелий кровеносных сосудов обладает высокой тромборезистентностью и играет важную роль в поддержании жидкого состояния крови и предотвращении тромбозов. Это свойство эндотелия реализуется в первую очередь контактной инертностью внутренней, обращенной в просвет сосуда, поверхностью клеток, обладающей одноименным по отношению к тромбоцитам отрицательным зарядом, обусловленным слоем глюкозаминогликанов.
Антитромботическое состояние эндотелия обеспечивается как секретируемыми, так и мембран-связанными субстанциями (Hoffman, Monroe, 2001; Решетняк и др., 2018). Секретируются простоциклин и оксид азота (ингибируют активацию тромбоцитов), полипептид TFPI (ингибирующий фактор Xа) и тканевой активатор плазминогена. Связанные с мембранами субстанции – это АТФаза (ингибирует выделение АДФ из тромбоцитов), тромбомодулин (связывает тромбин, ингибируя активацию тромбоцитов), гепарин (активирует тромбин). Вместе с тем эндотелий обладает уникальной способностью менять свой антитромботический потенциал на тромбогенный. Такая трансформация происходит при застое крови, гипоксии, ацидозе, увеличении содержания активных форм кислорода, повреждении эндотелиального слоя механическими или химическими агентами, бактериальным эндотоксином, тромбином, активацией комплемента и др. У стимулированных эндотелиальных клеток появляются прокоагулянтные свойства: экспонирование на поверхности тканевого фактора (ТФ), снижение количества тромбомодулина, синтез ингибитора плазминогена PAI-1, высвобождение фактора Виллебранда, изменение фосфолипидного состава наружной поверхности эндотелиоцитов с появлением рецепторов для ферментных комплексов коагуляционного каскада (Tercan, Bekerecioglu, 2002; Endemann, Schiffrin, 2004; Иванов и др., 2007; Томина, 2008; Шаповалов и др., 2008; Поройский и др., 2011; Сучков, 2012).
Важнейшую роль в активации свертывания играет и субэндотелий, содержащий разные типы коллагена, фибронектин, витронектин, ламинин, протеогликаны, глюкозаминогликаны, тромбоспондин, фактор Виллебранда. При слущивании эндотелиоцитов субэндотелий является стимулятором адгезии и активации тромбоцитов и активатором каскадной системы свертывания. Прокоагулянтные свойства клеток субэндотелия (макрофагов, фибробластов, лейкоцитов, гладких мышечных клеток) обусловлены наличием на их поверхности ТФ.
Анализ литературного материала свидетельствует, что несмотря на столь значительную роль эндотелия микрососудов в патогенезе травматической болезни мозга, до настоящего времени не показан его вклад в дисфункцию сосудисто-тромбоцитарного звена гемостаза других органов в остром периоде черепно-мозговой травмы. Понимание же патофизиологических механизмов коагулопатии может помочь осуществлению своевременной адекватной профилактики и коррекции системной эндотелиальной дисфункции при ЧМТ.
Цель настоящей работы – оценить роль эндотелиоцитов синусоидных капилляров печени в патогенезе сосудисто-тромбоцитарного звена гемостаза в остром периоде ЧМТ.
МАТЕРИАЛ И МЕТОДИКА
Животные. Работа выполнена на 23 белых аутбредных крысах-самках массой 180–200 г. Содержание животных и проводимые с ними манипуляции выполняли в соответствии с нормативными документами, представленными в руководстве “Guide for care and use of laboratory animals. ILAR publication, 1996, National Academy Press” и требованиями Приказа Минздрава России № 267 от 19.06.03 “Об утверждении правил лабораторной практики в Российской Федерации”. Животных фиксировали на планшете. ЧМТ моделировали путем свободного падения груза с высоты 80 см массой 100 г на теменно-затылочную область головы. Приложение механической энергии обеспечивает моделирование сотрясения головного мозга, очаговые повреждения, в том числе ушиб мозга, который сопровождается формированием эпидуральных и субдуральных гематом (Цымбалюк, Кочин, 2008). Забор крови у животных производили из подъязычной вены перед нанесением ЧМТ (интактная группа крыс) и на 1, 3, 7 и 12 сут после альтерации и определяли количество тромбоцитов на гематологическом анализаторе Abacus (Австрия). Тромбоциты отражают основное звено первичного гемостаза. Они принимают участие в формировании гемостатической тромбоцитарной пробки и являются источником прокоагулянтных поверхностей, на которых происходит активация свертывания крови (Васильев и др., 2017).
Электронная микроскопия. На 3, 7 и 12 сут с момента нанесения ЧМТ на фоне внутрибрюшинного наркоза тиопенталом натрия (100 мг/кг) осуществляли декапитацию крыс и через срединный лапаротомный доступ иссекали печень (по 6 животных из каждой группы в отмеченные временные интервалы). Аналогичные анестезиологические и хирургические манипуляции были выполнены у 5 интактных крыс. Биоптаты печени помещали в 2.5%-ный раствор глютарового альдегида с последующей дофиксацией 1%-ным раствором осмиевой кислоты, дегидратацией в спиртах возрастающей крепости и заключали в смесь эпоксидных смол (аралдит и эпон 812). Ультратонкие срезы готовили на ультрамикротоме фирмы Leica Microsystems (Австрия), просматривали на электронном микроскопе Morgagni 268D, фотографировали с помощью видеокамеры Mega View III и изучали структурные изменения синусоидных гемокапилляров (СК). Анализ микроциркуляции в синусоидах проводили в 10 случайно выбранных полях зрения у каждого животного, площадь одного поля зрения составляла 78 мкм2. Подсчитывались все СК и их число принимали за 100%. Из этого количества микрососудов определяли долю капилляров (в %), в просвете которых выявлялись: тонкодисперсный аморфный осмофильный материал и свободно лежащие эритроциты; агрегаты эритроцитов, тромбоцитов и мембранные структуры; сниженное содержание аморфного осмиофильного материала и синусоиды, не содержащие аморфнного осмофильного материала и форменных элементов крови.
Обработка данных. Использовали программы Microsoft Excel 2010 и Statistica 6.0. Различия средних величин, признавались достоверными при уровне статистической значимости Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Через 3 сут после ЧМТ цитоплазма эндотелиоцитов СК печени была электронно-прозрачной, наблюдали участки ее набухания и отека (рис. 1a). Эндотелиоциты содержали множество пиноцитозных пузырьков, микровезикулы, отдельные вакуоли и включения (рис. 1б, г). Ядра эндотелия содержали гетерохроматин, отмечали небольшое набухание нуклеоплазмы и увеличение ядерной поверхности эндотелиоцитов (рис. 1a, г). Митохондрии были в основном набухшие или вакуолизированные. В звездчатых макрофагах выявлен клеточный детрит. В некоторых участках пространство Диссе было расширено, микроворсинки частью редуцированы.
Рис. 1.
Ультраструктура синусоидных гемокапилляров (СК) печени крыс на 3-и сут посттравматического периода черепно-мозговой травмы (ЧМТ) при разном увеличении: 11 000× (а, б), 5600× (в), 14 000× (г). Э – эритроцит, Д – пространство Диссе, Я – ядро, В – вакуоль, Эн – эндотелий, Лз – лизосома, МХ – митохондрия, С – просвет синусоида, Р – ретикулоцит.
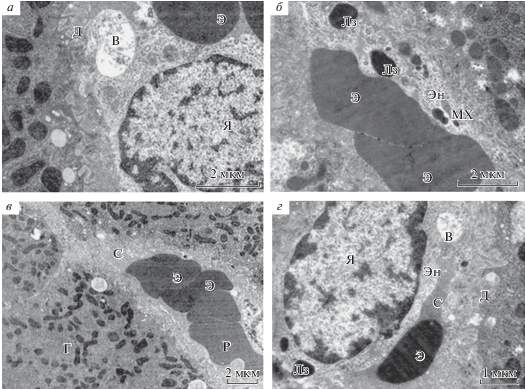
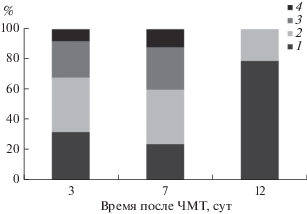
В просвете 32% СК обнаруживали свободно лежащие эритроциты и тонкодисперсный осмиофильный аморфный материал, а в 36% микрососудов – макро- и микроагрегаты эритроцитов (рис. 1б, рис. 2). В отдельных СК определяли мембранные структуры, микроагрегаты эритроцитов с нейтрофилами и ретикулоцитами. В ряде СК отмечали темную плазму (рис. 1в, г). В 24% СК выявили уменьшение осмиофильного аморфного материала, а в 8% случаев просветы микрососудов не содержали осмиофильного материала, что указывает на отсутствие в них циркуляции (феномен no-reflow).
Рис. 2.
Процентное соотношение СК печени в зависимости от их внутрисосудистого содержимого на 3-, 7- и 12-е сут посттравматического периода. Столбцы показывают число капилляров, в просвете которых выявляли: 1 – тонкодисперсный аморфный осмиофильный материал и свободно лежащие эритроциты, 2 – агрегаты форменных элементов крови и мембранные структуры, 3 – сниженное содержание аморфного осмиофильного материала, 4 – число СК, просвет которых не содержал аморфного осмиофильного материали и форменных элементов кров-и.
На 7-е сут посттравматического периода повреждения эндотелиальных клеток синусоидов усилились. Это выражалось в том, что наряду с эндотелиоцитами со светлой цитоплазмой чаще выявлялись клетки с темной цитоплазмой (рис. 3б), в ней увеличилось количество пиноцитозных пузырьков, появились липидные капли. В некоторых случаях выявлен отек, истощение, разрыхление и нарушение целостности эндотелиальной выстилки. Отмечали набухание и деструкцию отдельных митохондрий. Ядра были с небольшими инвагинациями и просветлением нуклеоплазмы (рис. 3a). Цитоплазма звездчатых макрофагов была наполнена клеточным детритом. Пространство Диссе расширено, отмечали редукцию микроворсинок.
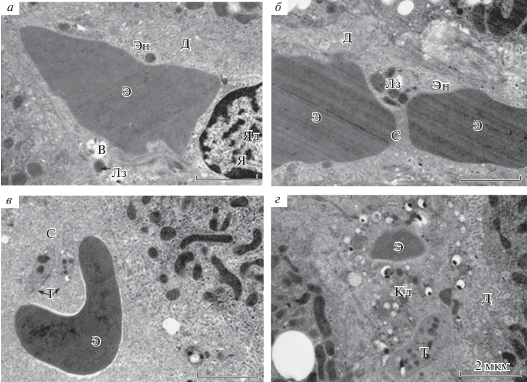
Рис. 3.
Ультраструктура СК печени крыс на 7-е сут посттравматического периода ЧМТ. Эн – эндотелий, Я – ядро, ОВ – окаймленные везикулы, Д – пространство Диссе, Г – гепатоцит, С – просвет синусоида, Э – эритроцит, Лм – лимфоцит, М – моноцит. Увел.: 11000×. Масштабная линейка: 2 мкм.

В просвете 36% синусоидных капилляров наблюдали агрегацию эритроцитов, микроагрегаты эритроцитов с нейтрофилами, тромбоцитами и мембранные структуры, и только 24% гемокапилляров содержали свободно лежащие эритроциты и тонкодисперсный осмиофильный аморфный материал (рис. 3а). К 7 сут наряду с эритроцитами в синусоидах обнаруживали ретикулоциты, лимфоциты, моноциты, тромбоциты (рис. 3а, в, г). Снижение содержания осмиофильного аморфного материала выявили в 28% СК (рис. 2). В некоторых синусоидах наблюдали темную плазму. Число микрососудов, не содержащих осмиофильного материала и форменных элементов крови, увеличилось на 4% по отношению к ситуации на 3-и сут посттравматического периода и составило 12% (рис. 3б).
Через 12 сут после ЧМТ (рис. 2) эндотелий синусоидов был обычного вида, также обнаружены участки его набухания и отека (рис. 4в). Ядро содержит гетерохроматин, поверхность его практически ровная, нуклеоплазма плотная (рис. 4а). Цитоплазма эндотелиоцитов светлая, в ней определяли митохондрии, лизосомы, окаймленные микровезикулы (рис. 4б). В 79% синусоидных гемокапилляров отмечали восстановление кровотока, в 21% определяли макро- и микроагрегаты эритроцитов, пузыри, клеточный детрит и тромбоциты (рис. 2, 4в, г).
Рис. 4.
Ультраструктура СК печени крыс на 12-е сут посттравматического периода ЧМТ. Э – эритроцит, Эн – эндотелий, Д – пространство Диссе, Я – ядро, Яд – ядрышко, Лз –лизосома, В – вакуоль, С – просвет синусоида, Т– тромбоцит, КД – клеточный детрит. Увел.: 11000×. Масштабная линейка: 2 мкм.
Оценивая результаты электронно-микроскопического исследования СК печени и внутрисинусоидальные изменения можно заключить, что при локальной травме мозга выраженные нарушения микроциркуляции появляются на 3 сут посттравматического периода, которые усугубляются на 7-е сут после травмы. Это связано с тем, что нарастающие по интенсивности вторичные факторы повреждения мозга постоянно воздействуют на поверхность эндотелиальных клеток СК и приводят к возникновению их дисфункции (Агеев, 2003; Бояринов, 2016б). Эндотелий СК выявляется с большим содержанием пиноцитозных пузырьков и многочисленными включениями, что свидетельствует о напряженной работе защитно-регуляторной функции эндоцитарных механизмов в поддержании постоянства состава крови и внутриклеточной среды гепатоцитов (Чернух и др., 1975). В ответ на изменение гуморально-метаболической внутрисосудистой среды эндотелий синусоидов отвечает выраженной реакцией, которая проявляется морфологической гетерогенностью клеток. Они меняют свой объем и форму за счет набухания (отека) или истончения в результате дегидратации цитоплазматического матрикса, что изменяет просвет синусоидов печени, и, вследствие этого, нарушается транссинусоидный кровоток и интенсивность гематотканевого обмена. В клетках эндотелия встречаются незначительные очаги отека, появляются отдельные вакуоли и липидные капли. Накопление липидных капель в цитоплазме свидетельствует о переходе эндотелиоцитов преимущественно на жировой обмен вместо углеводного (Шилов и др., 2017).
В некоторых эндотелиоцитах определялся отек, сглаживание эндотелиальной выстилки, истончение, разрыхление и нарушение целостности эндотелиоцитов. Эти морфологические проявления эндотелиоцитов свидетельствуют об истощении компенсаторно-приспособительных реакций в клетке (Калинин, 2008; Воробьева и др., 2010; Шилов и др., 2017). Наряду с эндотелиоцитами с светлой цитоплазмой, встречаются клетки с темной цитоплазмой, что, вероятно, является следствием гемолиза эритроцитов. Цитоплазма звездчатых макрофагов была наполнена клеточным детритом, что свидетельствует об активном осуществлении ими фагоцитарной функции. Пространства Диссе расширены, заполнены мелкозернистыми массами, микроворсинки редукцируются. Эти цитоплазматические выросты гепатоцитов, эндотелиоцитов и звездчатых ретикулоэндотелиоцитов служат для выведения продуктов метаболизма, регулируют кровоток, участвуют в обеспечении гомеостаза. При локальной травме мозга микроворсинки как наиболее лабильные структуры быстро разрушаются, их участки отторгаются в вокругсинусоидное пространство и подвергаются протеолизу (Козлов и др., 1994).
Эти ультраструктурные изменения синусоидов печени являются морфологической основой внутрисосудистых нарушений, которые проявляются образованием микроагрегатов и сладжей клеток крови, в обнаружении в просвете синусоидов мембранных структур, пузырей, снижении содержания тонкодисперсного аморфного осмиофильного материала и даже полным отсутствием циркуляции в части гемокапилляров (no-reflow).
Известно, что неспецифическое повреждение сосудистого эндотелия при критических состояниях сопровождается синтезом и экспрессией эндотелиоцитами индукторов агрегации тромбоцитов: тромбоксана А2, фактора активации тромбоцитов и АДФ. К другим факторам, повышающим агрегационную активность тромбоцитов и сопровождающих ЧМТ, относят увеличение содержания тромбина, адреналина, норадреналина, серотонина, иммунных комплексов и медиаторов воспаления (Бояринов и др., 2016б; Войнов, 2002).
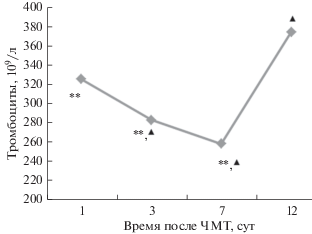
Исследование содержания тромбоцитов у крыс через сут после ЧМТ, по сравнению с интактными животными, показало значимое снижение их количества, которое достигало максимума на 7-е сут и только на 12-е сут посттравматического периода уровень тромбоцитов восстанавливался до значений интактных крыс (рис. 5). Сопровождающая острый период тяжелой ЧМТ тромбоцитопения отражает потребление тромбоцитов в активно протекающих процессах сосудисто-тромбоцитарного звена гемостаза, обусловленных вторичными факторами повреждения мозга, и косвенно указывает на выпадение их трофической функции по отношению к эндотелиальной выстилке сосудов.
Рис. 5.
Динамика числа тромбоцитов у крыс после ЧМТ. (**) и треугольники – статистически значимые различия относительно значений интактной группы и относительно значений на сроке 1 сут соответственно, Р < 0.05. Число тромбоцитов у интактных крыс – (374.00 ± 9.81)/109/л.
Анализируя представленные выше данные можно заключить, что острый период ЧМТ характеризуется активацией сосудисто-тромбоцитарного звена гемостаза. Повреждение эндотелия синусоидов печени, и приобретение им тромбогенных свойств, а также слущивание эндотелия и обнажение субэндотелиальных структур вызывают активацию циркулирующих в микроциркуляторном русле печени тромбоцитов, что сопровождается изменением их метаболизма и освобождением биологически активных веществ. В результате воздействия этих веществ тромбоциты приобретают шиповидносферическую форму, облегчающую их взаимодействие друг с другом и с поверхностью поврежденного эндотелия, активируются процессы адгезии и агрегации тромбоцитов. Из агрегированных тромбоцитов высвобождается очень активный фактор свертывания – фактор 3 (тромбопластический). Последний, взаимодействуя с факторами плазмы VIII, IX, X и XI, образует протромбиназу, и вследствие этого запускается коагуляционный механизм свертывания крови (Зубаиров, 1980; Бояринов, 1992).
ЗАКЛЮЧЕНИЕ
С учетом современных представлений об эндотелии как нейроэндокринном органе, контролирующем свойства тромбогенности, тонуса, резистентности сосудов посредством синтеза и (или) накопления медиаторов, обнаруженные повреждения эндотелиоцитов СК печени в остром периоде ЧМТ позволяют рассматривать их в качестве одного из ключевых и наиболее ранних звеньев патогенеза сосудисто-тромбоцитарного и коагуляционного звеньев системы гемостаза. Повреждение эндотелия СК печени при ЧМТ обуславливает запуск процессов микротромбообразования и нарушения микроциркуляции не только в печени, но в других органах и системах человека, вызывая их дисфункцию и развитие полиорганной недостаточности, являющейся грозным осложнением, приводящим в ряде случаев к летальному исходу. При этом первичность и универсальность реакции эндотелия на воздействие внешних и внутренних факторов позволяют рассматривать его как исходную точку приложения в схеме патогенетического лечения и профилактики ряда критических состояний, хирургических и терапевтических заболеваний. Перспективы улучшения клинических результатов лечения тяжелой ЧМТ могут быть связаны с дальнейшим изучением механизмов нарушения структуры и функции эндотелия, определением эффективных прогностических маркеров и значимых мишеней патогенетически обоснованной лекарственной терапии.
Список литературы
Авакимян С.В. Карипиди Г.К., Авакимян В.А., Сторожук П.Г., Вагин И.В. 2013. Нарушения в системе гемостаза у больных острым панкреатитом и ее коррекция. Кубанский научный мед. вестник. 142(7) : 38–40. (Аvakimyan S.V. Karipidi G.K., Аvakimyan V.А., Storozhuk P.G., Vagin I.V. 2013. Narusheniya v sisteme gemostaza u bol’nykh ostrym pankreatitom i eyo korrektsiya. Kubanskij nauchnyj meditsinskij vestnik. 142(7) : 38–40.)
Агеев Ф.Т. 2003. Коррекция эндотелиальной дисфункции – ключ к успеху лечения сердечно-сосудистых заболеваний. Журн. сердечная недостаточность. 4(1) : 54–60. (Аgeev F.T. 2003. Korrektsiya ehndotelial’noj disfunktsii – klyuch k uspekhu lecheniya serdechno-sosudistykh zabolevanij. J. serdechnaya nedostatochnost'. 4(1) : 54–60.)
Белоусов Ю.В., Намсараев Ж.Н. 2006. Эндотелиальная дисфункция как причина атеросклеротического поражения артерий при артериальной гипертензии: методы коррекции. Фарматека. 84(6) : 12–17. (Belousov YU.V., Namsaraev ZH.N. 2006. Ehndotelial’naya disfunktsiya kak prichina ateroskleroticheskogo porazheniya arterij pri arterial’noj gipertenzii: metody korrektsii. Farmateka. 84(6) : 12–17.)
Бояринов Г.А. 1992. Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром). В кн.: Избранные лекции “Основы интенсивной терапии в хирургической клинике”. Н. Новгород: 61–101. (Boyarinov G.А. 1992. Disseminirovannoe vnutrisosudistoe svertyvanie krovi (DVS-sindrom). V kn.: Izbrannye lektsii “Osnovy intensivnoj terapii v khirurgicheskoj klinike”. N. Novgorod: 61–101.)
Бояринов Г.А., Бояринова Л.В., Дерюгина А.В., Зайцев Р.Р., Соловьева О.Д, Яковлева Е.И. 2016a. Фармакологическая коррекция изменений сосудисто-тромбоцитарного гемостаза при черепно-мозговой травме. Мед. альманах. 41(1) : 139–144. (Boyarinov G.А., Boyarinova L.V., Deryugina А.V., Zajtsev R.R., Solov’eva O.D, YAkovleva E.I. 2016. Farmakologicheskaya korrektsiya izmenenij sosudisto-trombotsitarnogo gemostaza pri cherepno-mozgovoj travme. Meditsinskij al’manakh. 41(1) : 139–144.)
Бояринов Г.А., Бояринова Л.В., Дерюгина А.В., Соловьева О.Д, Зайцев Р.Р., Военнов О.В., Мошнина Е.В., Шумилова А.В. 2016б. Роль вторичных факторов повреждения мозга в активации сосудисто-тромбоцитарного гемостаза при черепно-мозговой травме. Общая реаниматология. 12(5) : 42–51. (Boyarinov G.А., Boyarinova L.V., Deryugina А.V., Solov’eva O.D, Zajtsev R.R., Voennov O.V., Moshnina E.V., SHumilova А.V. 2016. Rol’ vtorichnykh faktorov povrezhdeniya mozga v aktivatsii sosudisto-trombotsitarnogo gemostaza pri cherepno-mozgovoj travme. Obshhaya reanimatologiya. 12(5) : 42–51.)
Бояринов Г.А., Дерюгина А.В., Зайцев Р.Р., Бояринова Л.В., Яковлева Е.И., Соловьева О.Д., Никольский В.О., Галкина М.В., Мартусевич А.А. 2016в. Морфологические изменения в кровеносных микрососудах миокарда при экспериментальной черепно-мозговой травме. Общая реаниматология. 12(2) : 20–29. (Boyarinov G.А., Deryugina А.V., Zajtsev R.R., Boyarinova L.V., YAkovleva E.I., Solov’eva O.D., Nikol’skij V.O., Galkina M.V., Martusevich А.А. 2016. Morfologicheskie izmeneniya v krovenosnykh mikrososudakh miokarda pri ehksperimental’noj cherepno-mozgovoj travme. Obshhaya reanimatologiya. 12(2) : 20–29.)
Бояринов Г.А., Дерюгина А.В., Зайцев Р.Р., Бояринова Л.В., Яковлева Е.И., Соловьева О.Д., Никольский В.О., Галкина М.В., Мартусевич А.А. 2016г. Фармакологическая коррекция микроциркуляции у крыс, перенесших черепно-мозговую травму. Цитология. 58(8) : 610–617. (Boyarinov G.А., Deryugina А.V., Zajtsev R.R., Boyarinova L.V., YAkovleva E.I., Solov’eva O.D., Nikol’skij V.O., Galkina M.V., Martusevich А.А. 2016. Farmakologicheskaya korrektsiya mikrotsirkulyatsii u krys, perenesshikh cherepno-mozgovuyu travmu. TSitologiya. 58(8) : 610–617.)
Васильев С.А., Мелкумян А.Л., Берковский А.Л., Суворов А.В., Мазуров А.В., Козлов А.А. 2017. Клинико-лабораторная диагностика нарушений функций тромбоцитов. Методическое пособие. М. 76 с. (Vasil’ev S.А., Melkumyan А.L., Berkovskij А.L., Suvorov А. V., Mazurov А.V., Kozlov А.А. 2017. Kliniko-laboratornaya diagnostika narushenij funktsij trombotsitov. Metodicheskoe posobie. Moskva. 76 s.)
Винник Ю.С., Дунаевская С.С., Антюфриева Д.А., Деулина В.В. 2018. Эндотелиальная дисфункция и развитие органной недостаточности при остром панкреатите. Современные проблемы науки и образования. 5. http://science-education.ru/ru/article/view?id=27889. (Vinnik Yu.S., Dunaevskaya S.S., Аntyufrieva D.А., Deulina V.V. 2018. Ehndotelial’naya disfunktsiya i razvitie organnoj nedostatochnosti pri ostrom pankreatite. Sovremennye problemy nauki i obrazovaniya. 5. http://science-education.ru/ru/article/view?id=27889)
Винник Ю.С., Юрьева М.Ю., Теплякова О.В., Салмина А.Б., Третьякова Н.Г. 2014. Значение эндотелиальной дисфункции в патогенезе локальной холодовой травмы. РМЖ Медицинское обозрение 22(31) : 2204–2206. (Vinnik Yu.S., Yur’eva M.Yu., Teplyakova O.V., Salmina А.B., Tret’yakova N.G. 2014. Znachenie ehndotelial’noj disfunktsii v patogeneze lokal’noj kholodovoj travmy. RMZH “Meditsinskoe obozrenie” 22(31) : 2204–2206.)
Войнов А.Ю., Голевцова З.Ш., Семченко В.В. 2002. Гемостаз и сосудистый эндотелий при тяжелой черепно-мозговой травме. Бюллетень СО РАМН. 3 : 35–44. (Vojnov А.YU., Golevtsova Z.SH., Semchenko V.V. 2002. Gemostaz i sosudistyj ehndotelij pri tyazheloj cherepno-mozgovoj travme. Byulleten’ SO RАMN. 3 : 35–44.).
Воробьева Е.Н., Шумахер Г.И., Хорева М.А., Осипова И.В. 2010. Дисфункция эндотелия – ключевое звено в патогенезе атеросклероза. Российский кардиологический журнал. 82(2) : 84–91. (Vorob’eva E. N., SHumakher G.I., Khoreva M.А., Osipova I.V. 2010. Disfunktsiya ehndoteliya – klyuchevoe zveno v patogeneze ateroskleroza. Rossijskij kardiologicheskij J. 82(2) : 84–91.)
Зубаиров Д.М. 1980. Матричные гипотезы ферментативного каскада при свертывании крови. Проблемы гематологии. 25(3) : 4–10. (Zubairov D.M. 1980. Matrichnye gipotezy fermentativnogo kaskada pri svertyvanii krovi. Problemy gematologii. 25(3) : 4–10.)
Иванов С.Н., Старовойтова Е.А., Огородова Л.М., Волкова Т.Г. 2007. Роль эндотелиальной дисфункции в генезе сердечно-сосудистой патологии. Сибирский мед. журн. 22(1) : 99–102. (Ivanov S.N., Starovojtova E.А., Ogorodova L.M., Volkova T.G. 2007. Rol’ ehndotelial’noj disfunktsii v geneze serdechno-sosudistoj patologii. Sibirskij meditsinskij J. 22(1) : 99–102.)
Калинин Р.Е. 2008. Комплексная оценка функционального состояния эндотелия у больных облитерирующим атеросклерозом артерий нижних конечностей при различных методах оперативного лечения. Автореф. дис. ... докт. Рязань. 40 с. (Kalinin R.E. 2008. Kompleksnaya otsenka funktsional’nogo sostoyaniya ehndoteliya u bol’nykh obliteriruyushhim aterosklerozom arterij nizhnikh konechnostej pri razlichnykh metodakh operativnogo lecheniya. Doct. Thesis. Ryazan’. 40 s.)
Козлов В.И., Мельман Е.П., Нейко Е.М., Шутка Б.В. 1994. Гистофизиология капилляров. СПб.: Наука. 234 с. (Kozlov V.I., Mel’man E.P., Nejko E.M., SHutka B.V. 1994. Gistofiziologiya kapillyarov. SPb.: Nauka. 234 s.).
Корж А.Н. 2003. Значение эндотелиальной дисфункции в развитии заболеваний сердечно-сосудистой системы. Международный мед. журн. 3 : 10–14. (Korzh А.N. 2003. Znachenie ehndotelial’noj disfunktsii v razvitii zabolevanij serdechno-sosudistoj sistemy. Mezhdunarodnyj med. J. 3 : 10–14.)
Мельникова Ю.С., Макарова Т.П. 2015. Эндотелиальная дисфункция как центральное звено патогенеза хронических болезней. Казанский медицинский журн. 96(4) : 659–665. (Mel’nikova YU.S., Makarova T.P. 2015. Ehndotelial’naya disfunktsiya kak tsentral’noe zveno patogeneza khronicheskikh boleznej. Kazanskij meditsinskij J. 96 (4) : 659–665.)
Поройский С.В., Воронков А.В., Тюренков И.Н., Булычева О.С., Самойлова О.С. 2011. Эндотелиальная дисфункция в хирургии – современный взгляд на проблему. Вестник ВолГМУ. 39(3) : 13–17. (Porojskij S.V., Voronkov А.V., Tyurenkov I.N., Bulycheva O.S., Samojlova O.S. 2011. Ehndotelial’naya disfunktsiya v khirurgii – sovremennyj izglyad na problemu. Vestnik VolGMU. Vypusk 39(3) : 13–17.)
Потапов А.А., Лихтерман Л.Б., Кравчук А.Д., Охлопков В.А., Александрова Е.В., Филатова М.М., Маряхин А.Д., Латышев Я.А. 2016. Легкая черепно-мозговая травма. Клинические рекомендации. М. 23 с. (Potapov А.А., Likhterman L.B., Kravchuk А.D., Okhlopkov V.А., Аleksandrova E.V., Filatova M.M., Maryakhin А.D., Latyshev YA.А. 2016. Legkaya cherepno-mozgovaya travma. Klinicheskie rekomendatsii. M. 23 s.)
Решетняк В.И., Журавель С.В., Кузнецова Н.К., Писарев В.М., Клычникова Е.В., Сюткин В.Е., Решетняк Т.М. 2018. Система гемостаза в норме и при трансплантации печени (обзор). Общая реаниматология. 14(5) : 58–84. (Reshetnyak V.I., ZHuravel’ S.V., Kuznetsova N.K., Pisarev V.M., Klychnikova E.V., Syutkin V.E., Reshetnyak T.M. 2018. Sistema gemostaza v norme i pri transplantatsii pecheni (obzor). Obshhaya reanimatologiya. 14(5) : 58–84.)
Семченко В.В., Войнов А.Ю., Голевцова З.Ш., Говорова Н.В., Щербаков П.Н. 2003. Гемостаз и сосудистый эндотелий при черепно-мозговой травме. Омск-Надым: Омская областная типография. 168 с. (Semchenko V.V., Vojnov А.YU., Golevtsova Z.SH., Govorova N.V., Sсherbakov P.N. 2003. Gemostaz i sosudistyj ehndotelij pri cherepno-mozgovoj travme. Omsk-Nadym: Omskaya oblastnaya tipografiya. 168 s.)
Сучков И.А. 2012. Коррекция эндотелиальной дисфункции: современное состояние проблемы (обзор литературы). Российский мед.-биол. вестник им. академика И.П. Павлова. 4 : 151–157. (Suchkov I.А. 2012. Korrektsiya ehndotelial’noj disfunktsii: sovremennoe sostoyanie problemy (obzor literatury). Rossijskij med.-biol. vestnik im. akademika I.P. Pavlova. 4 : 151–157.)
Томина Е.А., Шаповалов К.Г., Витковский Ю.А. 2008. Содержание нитритов в сыворотке крови у больных с местной холодовой травмой. Бюллетень ВСНЦ СО РАМН. 61(3) : 160–161. (Tomina E.А., SHapovalov K.G., Vitkovskij Yu.А. 2008. Soderzhanie nitritov v syvorotke krovi u bol’nykh s mestnoj kholodovoj travmoj. Byulleten’ VSNTS SO RАMN. 61(3) : 160–161.)
Шаповалов К.Г., Сизоненко В.А., Томина Е.А., Витковский Ю.А. 2008. Эндотелиальная секреция вазоактивных молекул при холодовой травме конечностей. Травматология и ортопедия России. 48(2) : 53–56. (Shapovalov K.G., Sizonenko V.А., Tomina E.А., Vitkovskij Yu.А. 2008. Endotelial’naya sekretsiya vazoaktivnykh molekul pri kholodovoj travme konechnostej. Travmatologiya i ortopediya Rossii. 48(2) : 53–56.)
Фирсов С.А., Матвеев Р.П. 2014. Эндотелиальная дисфункция и ее прогностическое значение при критических состояниях в результате дорожно-транспортного травматизма. Современные проблемы науки и образования. 6. http://science-education.ru/ru/article/view?id=16629. (Firsov S.А., Matveev R.P. 2014. Ehndotelial’naya disfunktsiya i ee prognosticheskoe znachenie pri kriticheskikh sostoyaniyakh v rezul’tate dorozhno-transportnogo travmatizma. Sovremennye problemy nauki i obrazovaniya. 6. http://science-education.ru/ru/article/view?id=16629)
Цымбалюк В.И., Кочин О.В. 2008. Экспериментальное моделирование черепно- мозговой травмы. Украинский нейрохирургический журн. 2 : 10–12. (Tsymbalyuk V.I., Kochin O.V. 2008. Eksperimental’noe modelirovanie cherepno- mozgovoj travmy. Ukrainskij nejrokhirurgicheskij J. 2 : 10–12.)
Черкасов В.А., Щекотова А.П., Латышева С.Э., Загородских Е.Б. 2013. Новые возможности прогнозирования осложнений острого панкреатита и оценки эффективности лечения. Пермский мед. журн. 30(2) : 10–15. (Cherkasov V.А., Sсhyokotova А.P., Latysheva S.E., Zagorodskikh E.B. 2013. Novye vozmozhnosti prognozirovaniya oslozhnenij ostrogo pankreatita i otsenki ehffektivnosti lecheniya. Permskij meditsinskij J. 30(2) : 10–15.)
Чернух А.М., Александров П.Н., Алексеев О.В. 1975. Микроциркуляция. М.: Медицина. 456 с. (Chernukh А.M., Аleksandrov P.N., Аlekseev O.V. 1975. Mikrotsirkulyatsiya. M.: Meditsina. 456 s.)
Шапкин Ю.Г., Стекольников Н.Ю., Гамзатова П.К., Мамедова М.М. 2017. Возможности коррекции эндотелиальной дисфункции при глубоких отморожениях конечностей. Современная наука: актуальные проблемы теории и практики. 20 : 106–109. (Shapkin Yu.G., Stekol’nikov N.Yu., Gamzatova P.K., Mamedova M.M. 2017. Vozmozhnosti korrektsii ehndotelial’noj disfunktsii pri glubokikh otmorozheniyakh konechnostej. Sovremennaya nauka: aktual’nye problemy teorii i praktiki. 20 : 106–109.)
Шилов А.В., Мнихович М.В., Калинин Р.Е., Сучков И.А., Кактурский Л.В., Рудницкий С.В., Нечаев Л.В. 2017. Морфологические изменения стенки сосудов при эндотелиадьной дисфункции. Журн. анатомии и гистопатологии. 6(2) : 115–121. (Shilov А.V., Mnikhovich M.V., Kalinin R.E., Suchkov I.А., Kakturskij L.V., Rudnitskij S.V., Nechaev L.V. 2017. Morfologicheskie izmeneniya stenki sosudov pri ehndotelial’noj disfunktsii. J. Anatomii i gistopatologii. 6(2) : 115–121.)
Шилов А.В., Мнихович М.В., Калинин Р.Е., Коктурский Л.В., Сучков И.А., Рудницкий С.В., Машковцев О.И., Казанцева Г.П. 2018. Адаптационные и патологические изменения эндотелия при L-NAME-индуцированной дисфункции в эксперименте. Вестник новых мед. технологий. 12(4) : 282–286. (Sрilov А.V., Mnikhovich M.V., Kalinin R.E., Kokturskij L.V., Suchkov I.А., Rudnitskij S.V., Mashkovtsev O.I., Kazantseva G.P. 2018. Аdaptatsionnye i patologicheskie izmeneniya ehndoteliya pri L-NAME-indutsirovannoj disfunktsii v ehksperimente. Vestnik novykh med. tekhnologij. 12(4) : 282–286.)
Augustin H., Kozian D., Johason R. 1994. Differentiation of endothelial cells: Analysis of the constitutive and activated endothelial cellphenotypes. Bioessays. 16 : 901–907.
Endemann D.H., Schiffrin E.L. 2004. Endothelial dysfunction. J. Am. Soc. Nephrol. 15 : 1983–1992.
Hoffman M.A., Monroe D.M. 3rd. 2001. Cell-based model of hemostasis. Thromb. Haemost. 85 : 958–965.
Juratli T.A., Zang B., Litz R.J., Sitoci K.H., Aschenbrenner U., Gottschlich B.,Daubner D., Schackert G., Sobottka S.B. 2014. Early hemorrhagic progression of traumatic brain contusions: Frequency, correlation with coagulation disorders, and patient outcome: A prospective study. J. Neurotrauma. 31 : 1521–1527.
Oertel M., Kelly D.F., McArthur D., Boscardin W.J., Glenn T.C., Lee J.H., Gravori T., Obukhov D., McBride D.Q., Martin N.A. 2002. Progressive hemorrhage after head trauma: Predictors and consequences of the evolving injury. J. Neurosurg. 96 : 109–116.
Schwarzmaier S.M., Kim S.W., Trabold R., Plesnila N. 2010. Temporal profile of thrombogenesis in the cerebral microcirculation after traumatic brain injury in mice. J. Neurotrauma. 27 (1) : 121–130.
Stein S.C., Chen X.H., Sinson G.P., Smith D.H. 2002. Intravascular coagulation: A major secondary insult in nonfatal traumatic brain injury. J. Neurosurg. 97 : 1373–1377.
Stein S.C., Spettell C., Young G., Ross S.E. 1993. Delayed and progressive brain injury in closed-head trauma: Radiological demonstration. Neurosurgery. 32 : 25–30.
Tercan M., Bekerecioglu M. 2002. Decreased serum nitric oxide level in experimental frostbite injury: A preliminary study. Ann. Plast. Surg. 48 : 107–108.
Дополнительные материалы отсутствуют.


