Цитология, 2019, T. 61, № 9, стр. 729-734
Распределение субъединицы ГАМКB1 рецептора к ГАМК в разных слоях неокортекса крыс в отдаленные сроки после перинатальной гипоксии
Л. И. Хожай 1, *, В. А. Отеллин 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 06.06.2019
После доработки 17.06.2019
Принята к публикации 21.06.2019
Аннотация
Задача настоящей работы заключалась в исследовании уровней содержания субъединицы ГАМКB1 рецептора ГАМКВ в разных слоях неокортекса крыс в отдаленные постнатальные сроки после перинатальной гипоксии. В работе были использованы модели недоношенной беременности человека и воздействия гипоксии в неонатальный период, как общепринятые и широко используемые модели для изучения последствий повреждения мозга в ранний период развития. Субъединицу ГАМКB1 в нейронах и нейропиле сенсомоторной области неокортекса выявляли иммуногистохимической реакцией. Показали, что у контрольных крыс, достигших половозрелого возраста, уровень субъединицы ГАМКB1 в разных слоях коры различен. В верхних слоях II–IV неокортекса и слое VI, как в нейронах, так и нейропиле, обнаружен высокий уровень субъединицы ГАМКB1, однако в глубоком слое V уровень субъединицы ГАМКB1 оказался ниже. У крыс, переживших воздействие острой перинатальной гипоксии, в нейронах всех слоев неокортекса значительно снижен (в 2 раза) уровень субъединицы ГАМКB1 по сравнению с контрольными значениями. В конечном итоге перинатальная гипоксия может изменять состояние нейронов, экспрессирующих субъединицу ГАМКB1, и последствия этих изменений могут сохраняться у взрослых животных. Следствием снижения уровня субъединицы ГАМКB1 может быть уменьшение трансмиссии ГАМК, повышение количества высвобождающегося глютамата, усиливающего возбуждение и увеличивающего нейротоксичность. Полученные результаты расширяют возможности поиска новых средств, необходимых для ликвидации последствий острой гипоксии в неонатальный период.
Одной из актуальных задач современной неврологии является изучение динамики становления структур и функций головного мозга на ранних этапах онтогенеза. Гипоксия новорожденных привлекала и привлекает внимание большого числа исследователей разных специальностей. Повреждения головного мозга после воздействия гипоксии (ишемии) в перинатальный период относятся к основным причинам детской смерти. Показано, что значительная часть новорожденных, перенесших тяжелую гипоксию (ишемию) в неонатальный период, имеет психоневрологические расстройства различной степени тяжести (устойчивые нарушения в виде задержки умственного и двигательного развития, детского церебрального паралича, эпилепсии и др. с последующей инвалидностью с детства). Клиницистами отмечено, что у новорожденных сравнительно часто развиваются энцефалопатии, приводящие в последующем онтогенезе к двигательным нарушениям, судорогам, расстройствам психического развития и другим признакам церебральной недостаточности (Neakas et al., 1996; Rees et al., 2011; Отеллин и др., 2014).
Для моделирования перинатальной церебральной патологии чаще всего используют лабораторных грызунов, полагая, что между ними и высшими млекопитающими имеется достаточно большое сходство в кровоснабжении мозга и биологии нервных клеток. По ряду морфологических критериев считают, что степень развития мозга крысенка на 2-е постнатальные сутки по структурно-функциональным показателям соответствует уровню развития мозга недоношенного ребенка человека (Clancy et al., 2001). Известно, что функциональные и поведенческие реакции в головном мозге контролируются нейротрансмиттерами, нейропептидами и другими биологически активными соединениями.
Одним из основных тормозных нейротрансмиттеров является ГАМК, активирующая в ЦНС две группы рецепторов: ионотропные (ГАМКА/ГАМКС) и метаботропные (ГАМКВ) рецепторы (Anwyl, 1991). Рецепторы ГАМКВ представляют собой гетеродимеры, состоящие из двух субъединиц: ГАМКВ1 и ГАМКВ2, связанных с гетеротримерным G-белком, и проводящие продолжительное синаптическое торможение (Bettler, Tiao, 2006; Bouron, 2001). Однако весьма мало известно об их субклеточной локализации. Определено, что рецепторы ГАМКВ могут находиться как пре-, так и постсинаптически (Brown et al., 1979; Chaudhry et al., 1995; Castillo et al., 1997), при этом не известно, располагаются ли постсинаптические рецепторы ГАМКВ в синаптической щели напротив места выброса ГАМК, или расположены на удалении от синапса. Существует мнение, что рецепторы ГАМКВ расположены далеко от места выброса нейротрансмиттера и активируются ГАМК, покидающей синаптическую щель, т.е. при спилловере ГАМК (Scanziani, 1998; Cherubini, Conti, 2001). С другой стороны, известно, что изменения числа, активности и (или) локализации рецепторов могут значительно изменять уровень синаптического торможения (Bettler, Tiao, 2006).
Показано, что рецепторы ГАМКВ могут играть важную роль в снижении чрезмерного глутаматергического возбуждения, которое имеет место при гипоксии (ишемии). Активация пресинаптических рецепторов ГАМКВ может сокращать высвобождение глутамата и, тем самым, приводить к снижению его избыточного уровня, оказывающего токсическое действие и вызывающего гибель нейронов. Участие возбуждающих глутаматных рецепторов в механизмах повреждения структуры мозга и их причастность к гибели клеток после воздействия гипоксии (ишемии) в значительной степени изучено (Schwartz-Bloom, Sah, 2001). Однако реакции тормозных ГАМКВ рецепторов на воздействие гипоксии исследованы крайне мало (Schwartz-Bloom, Sah, 2001). Влияние гипоксии на экспрессию рецепторов ГАМКВ в мозге взрослых животных исследовали в основном в гиппокампe (Bouron, 2001; Cimarosi et al., 2009).
В настоящее время в имеющейся литературе нет сведений о распределении элементов ГАМКергической системы в разных слоях неокортекса у животных, перенесших перинатальную гипоксию. Между тем, этот вопрос представляет значительный интерес, поскольку каждый слой неокортекса характеризуется своеобразным клеточным составом, особенностями строения афферентных и эфферентных межнейронных связей и их участием в многочисленных функциях головного мозга. В связи с этим задача настоящей работы заключалась в изучении уровня содержания субъединицы ГАМКВ1 в разных слоях неокортекса крыс в отдаленные постнатальные сроки после воздействия перинатальной гипоксии.
МАТЕРИАЛ И МЕТОДИКА
Работа проведена на лабораторных крысах линии Wistar из питомника Института физиологии им. И.П. Павлова РАН (Санкт-Петербург).
Гипоксия. Воздействие гипоксии на новорожденных крысят осуществляли в отдельной камере в течение 1 ч при содержании в дыхательной смеси кислорода, углекислого газа и азота в соотношении (7.6–7.8) : (0.15–0.21) : 91.8%, при температуре 21.3–23.0°С и нормальном общем атмосферном давлении (760 мм рт. ст.). Воздействие гипоксии проводили на 2-е постнатальные сут, когда развитие головного мозга крыс соответствует стадии развития ЦНС у недоношенных детей человека (Clancy et al., 2001). В работе использовали 2 группы животных: группу крысят, которую подвергали в барокамере воздействию гипоксии и группу контрольных животных того же возраста, которых помещали в барокамеру без воздействия гипоксии. Каждая группа содержала по 8–10 крысят, отобранных из разных пометов. У животных исследовали сенсомоторную область неокортекса через 90 сут постнатального развития.
Гистологическое исследование. Головной мозг извлекали и фиксировали в цинк-этанол-формальдегиде на фосфатно-солевом буферном растворе (рН 7.4). Материал обезвоживали, заливали в парафин по общепринятой методике и готовили серийные фронтальные срезы мозга толщиной 6–7 мкм на уровне брегмы (1.80–2.04 мм) (Paxinos, Watson, 1998). Затем срезы помещали на предметные стекла SuperFrost Plus Gold (Menzel-Glaser, Германия).
Иммуногистохимическая реакция. Этим методом на гистологических срезах выявляли нейроны, содержащие субъединицу ГАМКB1, используя первичные поликлональные кроличьи антитела (Anti-GABARB1; Abcam, США). Антитела разводили в 1000 раз, окрашивали в течение 18 ч при 4°С. В качестве вторичных реагентов использовали реактивы из набора EnVision + System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США) и окрашивали в течение 40 мин при 30°С в термостате. Для визуализации продукта реакции применяли хромоген DAB+ (Dako, Дания). После проведения иммуногистохимической реакции часть срезов докрашивали гематоксилином Майера (Bio-Optica, Италия) и заключали в заливочную среду Permaunt (Termo, США).
Статистическая оценка оптической плотности продукта реакции. Все процедуры при проведении иммуногистохимической реакции были стандартизированы и осуществлялись одновременно для гистологических срезов, полученных от контрольных и подопытных животных.
Количественную оценку иммунореактивности производили с использованием системы анализа изображения, включающей световой микроскоп Olympus CX31 (Япония), цветную цифровую камеру VideoZavr Standard VZ-C31Sr и программное обеспечение Видеозавр Мультиметр 2.3 (разработка ООО АТМ-практика, Санкт-Петербург). Оценивали оптическую плотность (D) продукта реакции в цитоплазме иммунопозитивных нейронов и в нейропиле в сети иммунопозитивных отростков, терминалей, а также в скоплениях мелких и крупных гранул (последние предположительно считаются терминальными синаптическими структурами и их скоплениями (Guthmann et al., 1998)). Для этого, используя систему анализа изображений, контуром выделяли иммуноокрашенные нейроны, участки сети отростков и скопления гранул. Уровень содержания субъединицы ГАМКB1 выражали в отн. ед. оптической плотности продукта иммунной реакции D (отн. ед.).
Определяли среднее значение D интенсивности окраски в иммунопозитивных нейронах и нейропиле при увеличении объектива 100×. Измерения проводили на 10 серийных срезах мозга, взятого от 3–4 животных каждой исследуемой группы. Вычисляли среднее арифметическое значение и ошибку среднего значения. Для анализа и сравнения результатов между разными группами животных использовали t-критерий Стъюдента и onewayANOVA (Statistica 8.0, Statsoft Inc., USA) c достоверностью различий при Р < 0.05.
Использованные реактивы: антитела Anti-GABABR1 antibodes (Abcam, США); реактивы из набора EnVision+System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США); хромоген DAB+ (Dako, Дания); гематоксилин Майера (Bio-Орtica, Италия); синтетическая среда для заключения гистологических срезов Permaunt (Termo, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Распределение субъединицы ГАМКB1 в разных слоях сенсомоторной области неокортекса у контрольных животных через 90 сут постнатального развития. У контрольных животных значения D продукта иммуногистохимической реакции на выявление уровня субъединицы ГАМКВ1 в разных слоях неокортекса различаются. В цитоплазме нейронов в верхних слоях II–IV неокортекса эти значения самые высокие (табл. 1). В глубоких слоях V и VI они ниже в 1.5 и 1.3 раза соответственно (табл. 1), при этом в слое V эти значения ниже, чем в слое VI. В нейропиле уровень содержания субъединицы ГАМКВ1 (значения D) в отростках, терминалях и синаптических структурах самый высокий в слое I. Затем к глубокому слою VI он постепенно снижается (в 3.3 раза; табл. 1).
Таблица 1.
Значения оптической плотности D продукта иммунной реакции на выявление субъединицы ГАМКB1 рецептора ГАМКB в разных слоях неокортекса в нейронах и нейропиле крыс через 90 сут постнатального развития в контроле и после воздействия перинатальной гипоксии
| Локализация в неокортексе | D, отн.ед. | |
|---|---|---|
| контроль | после гипоксии | |
| Слой I: нейропиль | 0.08 ± 0.004* | 0.052 ± 0.007** |
| Cлой II–IV: нейроны, нейропиль |
0.205 ± 0.012* | 0.102 ± 0.006** |
| 0.064 ± 0.04* | 0.044 ± 0.005* | |
| Слой V: нейроны, нейропиль |
0.133 ± 0.008* | 0.057 ± 0.007** |
| 0.028 ± 0.004 | 0.035 ± 0.005 | |
| Слой VI: нейроны, нейропиль |
0.153 ± 0.006* | 0.083 ± 0.005** |
| 0.024 ± 0.006 | 0.044 ± 0.008* | |
Распределение субъединицы ГАМКB1 в разных слоях сенсомоторной области неокортекса у животных, переживших перинатальную гипоксию, через 90 сут постнатального развития. У животных, переживших воздействие гипоксии в перинатальный период, уровень содержания субъединицы ГАМКВ1 (значения D) как в цитоплазме нейронов, так и в отростках и синаптических структурах в нейропиле значительно снижен по сравнению с таковым в контроле. Однако так же, как у контрольных животных, уровень содержания субъединицы ГАМКВ1 (значения D) в цитоплазме нейронов самый высокий в верхних слоях II–IV неокортекса. В глубоких слоях V и VI, примерно как и в контроле, этот уровень ниже в 1.8 и 1.3 раза, соответственно (табл. 1). В нейропиле уровень субъединицы ГАМКВ1 (значения D) в отростках и синаптических структурах примерно одинаковый во всех слоях неокортекса (различия не достоверны, P < 0.05) (табл. 1).
У подопытных животных уровень субъединицы ГАМКВ1 (значения D) в цитоплазме нейронов в верхних слоях II–IV неокортекса значительно ниже (в 2 раза), чем таковой в контроле (P < 0.05). В слое V и VI содержание субъединицы ГАМКВ1 (значения D) ниже контрольного в 2 и 1.8 раза соответственно (P < 0.05) (табл. 1; рис. 1а, б). В нейропиле во всех слоях неокортекса уровень субъединицы ГАМКВ1 (значения D) в отростках, терминалях и синаптических структурах был в 1.5 раза ниже уровень у контрольных животных (P < 0.05) (табл. 1).
Рис. 1.
Иммуногистохимическая реакция на выявление субъединицы ГАМКВ1 в неокортексе крысы (сенсомоторная область, слой VI) через 90 сут постнатального развития в контроле (а) и после перинатальной гипоксии (б). Стрелки показывают иммунопозитивные нейроны. Оптическая плотность продукта реакции после перинатальной гипоксии снижается. Об.: 100 ×.
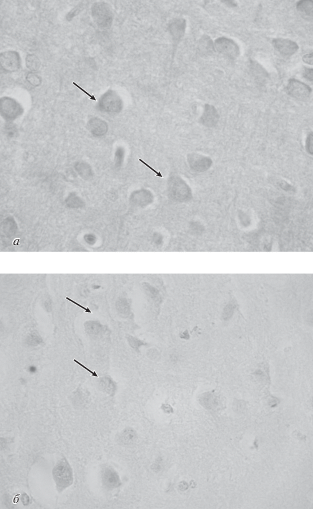
Результаты исследования показали, что в сенсомоторной области неокортекса у контрольных животных, достигших половозрелого возраста, самый высокий уровень содержания субъединицы ГАМКB1 как в нейронах, так и нейропиле наблюдался в верхних слоях II–IV неокортекса. Достаточно высоким ее уровень был и в слое VI. Присутствие в этих слоях коры значительного количества “непирамидных” вставочных ГАМКергических интернейронов, способных экспрессировать как ГАМК, так и рецепторные белки к ней, может объяснять наличие высокого уровня содержания субъединицы ГАМКB1. Большое количество контактных зон в этих слоях обеспечивается отростками, приносящими сюда афферентную информацию от нейронов таламуса, а также ассоциативных и комиссуральных волокон, которыми эти слои связаны с другими областями неокортекса.
Напротив, самый низкий уровень содержания субъединицы ГАМКB1 был отмечен в слое коры V. Вероятно, это объясняется тем, что в этом слое вставочных нейронов меньше, здесь присутствуют большие пирамидные нейроны, аксоны которых представляют собой проекционные, быстро проводящие сигнал, миелиновые волокна, которые направляются к таламусу, полосатому телу, ядрам ствола мозга и спинного мозга.
У крыс, переживших воздействие острой перинатальной гипоксии, выявлено значительное снижение (в 2 раза) уровня содержания субъединицы ГАМКB1 в нейронах всех слоев неокортекса по сравнению с контролем, при этом в нейропиле в верхних слоях неокортекса он незначительно ниже, а в глубоких слоях V и VI примерно соответствует контрольным значениям. Вероятно, воздействие гипоксии в неонатальный период изменяет состояние ГАМКергических интернейронов, влияет на синаптогенез, и эти последствия сохраняются у взрослых животных. Известно, что одной из причин либо повреждения нейронов, либо их гибели, является, так называемый, глутаматный каскад, возникающий в ответ на гипоксию. Воздействие гипоксии на нейроны вызывает повышенную экспрессию глутамата, в свою очередь, возбуждающего NMDA рецепторы, которые открывают натриевые и кальциевые каналы, при этом в клетку поступает значительное количество кальция в обмен на натрий. Одновременно в нейроне интенсивно синтезируются вторичные мессенджеры, которые вместе со свободным кальцием активируют внутриклеточные ферментные системы, что приводит к еще большему высвобождению глутамата. Избыточное содержание в цитоплазме свободного кальция служит одной из причин активации ферментных систем, разрушающих ДНК, белки и фосфолипиды (Papadia, Hardingham, 2007).
Интересные данные были получены при изучении влияния гипоксии (ишемии) на уровни субъединиц ГАМКВ1 и ГАМКВ2 в гиппокампе. Было показано, что через 4 ч после гипоксии (ишемии) экспрессия обеих субъединиц почти отсутствовала в СА1 (Cho et al., 2004). Однако механизм нарушения экспрессии рецепторных белков после воздействия гипоксии остался неясным. Тем не менее, считают, что ГАМКВ рецепторы играют критическую роль в точном регулировании тормозной синаптической трансмиссии ГАМК (Cossart et al., 2001).
Известно, что рецепторы ГАМКВ связаны с трехмерным G-белком (Clark, Cull-Candy, 2002), который способствует сопряжению рецепторов с определенными эффекторными молекулами или ионными каналами и выступает в качестве молекулярного переключателя. Активация рецептора, содержащего субъединицу ГАМКВ1, опосредуемая G-белком, может запускать различные реакции: ингибирование активности аденилатциклазы, стимулирование фосфолипазы А2, активирование калиевых каналов, инактивирование потенциал-зависимых кальциевых каналов и моделирование инозитолфосфолипидного гидролиза (Clark, Cull-Candy, 2002). Многие фармакологические психотропные препараты действуют через рецепторы, сопряженные с G-белками, в том числе, наркотические вещества героин, кокаин и др. В связи с этим, рецепторы ГАМКB являются вероятными мишенями для фармакологических препаратов при широком спектре психиатрических и неврологических расстройств.
В заключение следует отметить, что воздействие гипоксии в пренатальный период приводит к значительному снижению уровня субъединицы ГАМКB1, которое сохраняется у животных в отдаленные постнатальные сроки. Следствием такого снижения уровня ГАМКB1, вероятно, будет сокращение тормозной нейротрансмиссии ГАМК, смещение баланса высвобождающегося глутамата в сторону его увеличения, влекущее за собой усиление возбуждения и повышение нейротоксичности.
Представленная работа имеет фундаментальный характер, но направлена на решение и прикладных проблем, поскольку определяет одну из мишеней воздействия гипоксии, а полученные результаты могут расширить возможности поиска новых средств, необходимых для ликвидации последствий острой гипоксии в неонатальный период.
Список литературы
Отеллин В.А., Хожай Л.И., Шишко Т.Т. 2014. Реакции нервных элементов неокортекса на воздействие гипоксии в раннем периоде новорожденности. Журн. эволюц. биохим. физиол. 50(2) : 148–154. (Otellin V.A, Khozhai L.I., Shishko T.T. 2014. Reactions of nervous elements neocortex on influence hypoxia in the early neonatal period. J. Exper. Theor. Physics. 50(2) : 148–154).
Anwyl R. 1991. Modulation of vertebrate neuronal calcium channels by transmitters. Brain Res. Brain Res. Rev. 16 : 265–281.
Bettler B., Tiao J.Y. 2006. Molecular diversity, trafficking and subcellular localization of GABAB receptors. Pharmacol. Ther. 110 : 533–543.
Bouron A. 2001. Modulation of spontaneous quantal release of neurotransmitters in the hippocampus. Prog. Neurobiol. 63 : 613–635.
Brown D.A., Adams P.R., Higgins A.J., Marsh S. 1979. Distribution of gaba-receptors and gabacarriers in the mammalian nervous system. J. Physiol. 75 : 667–671.
Castillo P.E., Malenka R.C., Nicoll R.A. 1997. Kainate receptors mediate a slow postsynaptic current in hippocampal CA3 neurons. Nature. 388 : 182–186.
Chaudhry F.A., Lehre K.P., van Lookeren Campagne M. 1995. Glutamate transporters in glial plasma membranes: Highly differentiated localizations revealed by quantitative ultrastructural immunocytochemistry. Neuron. 15 : 711–720.
Cherubini E., Conti F. 2001. Generating diversity at GABAergic synapses. Trends Neurosci. 24 : 155–162.
Cho S., Liu D., Fairman D., Li P., Jenkins L., McGonigle P., Wood A. 2004. Spatiotemporal evidence of apoptosis-mediated ischemic injury in organotypic hippocampal slice cultures. Neurochem. Int. 45 : 117–127.
Cimarosi H., Kantamneni S., Henley J.M. 2009. Ischaemia differentially regulates GABAB receptor subunits in organotypic hippocampal slice cultures. Neuropharmacol. 56 : 1088–1096.
Clancy B., Darlington R.B., Finlay B.L. 2001. Translating developmental time across mammalian species. Neuroscie. 105 : 7–17.
Clark B.A., Cull-Candy S.G. 2002. Activity-dependent recruitment of extrasynaptic NMDA receptor activation at an AMPA receptor-only synapse. J. Neurosci. 22 : 4428–4436.
Cossart R., Tyzio R., Dinocourt C. 2001. Presynaptic kainate receptors that enhance the release of GABA on CA1 hippocampal interneurons. Neuron. 29 : 497–508.
Guthmann A., Fritschy J.M., Ottersen O.P., Torp R., Herbert H. 1998. GABA, GABA transporters, GABA(A) receptor subunits, and GAD mRNAs in the rat parabrachial and Kölliker-Fuse nuclei. J. Comp.Neurol. 400 : 229–243.
Neakas C., Buwalda B., Luiten P. 1996. Hypoxia and brain development. Progress Neurobiol. 49 : 1–51.
Papadia S., Hardingham G.E. 2007. The dichotomy of NMDA receptor signaling. Neuroscientist. 13 : 572–579.
Paxinos G., Watson C. 1998. The rat brain in stereotaxic coordinates. L.: Acad. Press. 456 p.
Rees S., Harding R., Walker D. 2011. The biological basis of injury and neuroprotection in the fetal and neonatal brain. Int. J. Dev. Neurosci. 29 : 551–63.
Scanziani M., Gahwiler B.H., Charpak S. 1998. Target cell-specific modulation of transmitter release at terminals from a single axon. Proc. Natl. Acad. Sci. USA. 95 : 12 004–12 009.
Schwartz-Bloom R.D., Sah R. 2001. Gamma-aminobutyric acid (A) neurotransmission and cerebral ischemia. J. Neurochem. 77 : 353–371.
Дополнительные материалы отсутствуют.


