Цитология, 2019, T. 61, № 9, стр. 704-712
Морфологические особенности быстрого и классического нетоза
С. Н. Плескова 1, 2, *, Е. Н. Горшкова 1, А. В. Боряков 1, Р. Н. Крюков 1
1 Научно-образовательный центр “Физика твердотельных наноструктур” Нижегородского государственного университета им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
2 Кафедра Нанотехнологии и биотехнологии Нижегородского государственного технического университета
им. Р.Е. Алексеева
603950 Нижний Новгород, Россия
* E-mail: pleskova@mail.ru
Поступила в редакцию 13.05.2019
После доработки 15.06.2019
Принята к публикации 20.06.2019
Аннотация
Целью исследования являлось определение структурно-морфологических различий быстрого и классического нетоза нейтрофилов крови человека. Разработан метод исследования процесса нетоза с использованием решеток для просвечивающей электронной микроскопии. Методом проточной цитометрии исследована временная динамика нетоза нейтрофилов крови и установлены различия в реализации процессов клеточной гибели, индуцированных иономицином и опсонизированными бактериями Staphylococcus aureus. Морфологические особенности быстрого и классического нетоза исследованы методами микроскопии – сканирующей электронной, флуоресцентной и световой. Установлены и описаны черты структурно-морфологического сходства и различия двух вариантов нетоза, индуцированного опсонизированным S. aureus. Выявлено, что классический нетоз может индуцировать формирование внеклеточных ловушек в соседних нейтрофилах. Показано, что по морфологическим особенностям внеклеточных ловушек можно дифференциально диагностировать развитие быстрого и классического нетоза не только методами высокоразрешающей микроскопии, но и используя традиционную световую микроскопию.
Клеточная гибель не только является неизбежным следствием процесса жизнедеятельности, она играет важную роль в поддержании постоянства как физиологических, так и патологических процессов (Galluzzi et al., 2018). Относительно недавно, в 2004 г., был открыт нетоз (Brinkmann et al., 2004) – механизм гибели нейтрофильных гранулоцитов (НГ), который сопровождается выбросом внеклеточных ловушек (neutrophil extracellular traps – NETs) в экстрацеллюлярное пространство. Основными компонентами NETs НГ являются: ДНК, гистоны, протеазы (которые в цельной клетке локализуются в первичных, вторичных и третичных гранулах) (Barnado et al., 2016; Grayson et al., 2016).
Нетоз легко отличим от других вариантов клеточной гибели благодаря характерной морфологии внеклеточных ловушек. Исследование ультраструктуры внеклеточных ловушек показало, что они состоят из гладких филаментов диаметром около 17 нм (модифицированных нуклеосом), на которых располагаются глобулярные домены, диаметром около 50 нм (белки гранул нейтрофилов) (Brinkmann, Zychlinsky, 2012). Все основные компоненты внеклеточных ловушек: ДНК, специфически модифицированные гистоны, активные формы кислорода (АФК), образуемые в процессе формирования сетеподобной структуры, и многочисленные ферменты, ассоциированные с внеклеточными ловушками, обладают выраженной антибактериальной активностью (Dąbrowska et al., 2016). Интересной особенностью нетоза является то, что при его индукции в нативных условиях объем занимаемый внеклеточной ловушкой может в 10–15 раз превосходить размеры первоначальной клетки, из которой она образуется. Например, если НГ располагается в альвеоле легкого, то нетоз займет все пространство альвеолы (Brinkmann, Zychlinsky, 2012).
Довольно быстро выяснилось, что наряду с характерной и впервые описанной морфологией обнаруживаются другие морфологические формы нетоза. В частности, исследование препаратов мокроты больных, страдающих хронической обструктивной болезнью легких и находящихся в стадии обострения, методом конфокальной микроскопии показало, что ДНК распространяется в виде агрегатов, имеющих нерегулярную структуру, при этом обнаружено, что ядра НГ, вступающих в нетоз, увеличены в объеме (Obermayer et al., 2014). Исследование процесса формирования внеклеточных ловушек в режиме реального времени с помощью высокоразрешающей атомно-силовой микроскопии (АСМ) также показало, что первоначально НГ выбрасывают не единичные нити, а целые блоки параллельных волнообразных спиралей, которые позднее разделяются на единичные нити ДНК. Они обладают хемотаксической активностью, двигаясь по направлению к опсонизированному S. aureus, и способны индуцировать нетоз в клетках, к которым приближаются (Pleskova et al., 2018).
Несмотря на разность обнаруживаемой морфологии, классический вариант формирования внеклеточных ловушек сопровождается клеточной гибелью и реализуется приблизительно за 3 ч (Fuchs et al., 2007) с максимумом через 2 ч (Pleskova et al., 2018). Из НГ при нетозе может высвобождаться не только ядерная ДНК. В частности, показано, что в ответ на праймирование НГ гранулярно-макрофагальным колониестимулирующим фактором и стимуляцию липополисахаридом или компонентом комплемента С5а происходит высвобождение митохондриальной ДНК по АФК-зависимому механизму. В этом случае ядро НГ сохраняется и антимикробные функции не страдают (Yousefi et al., 2009).
В 2010 г. был обнаружен еще один вариант формирования внеклеточных ловушек – быстрый нетоз (Pilsczek et al., 2010). Его принципиальным отличием от классического нетоза является выживание НГ после формирования внеклеточной ловушки. В ходе этого процесса ядро округляется и уплотняется, его внешняя и внутренняя ядерная мембрана разделяются, и формируются везикулы, содержащие ДНК. Они выводятся в экстрацеллюлярное пространство без нарушения целостности мембраны НГ. Вне клеток мембрана разрушается и высвобождается ДНК, обладающая ограниченной протеолитической активностью. Быстрый нетоз не зависит от АФК и реализуется за 5–60 мин. По всей вероятности, такой вариант нетоза возникает в ответ на стимуляцию стеариламином (Лотош и др., 2019).
Поскольку между классическим и быстрым нетозом уже обнаружены биохимические различия и различия сроков реализации процесса, цель настоящей работы заключалась в анализе морфологических особенностей нетоза обоих типов. Для этого использовали сканирующую электронную микроскопию (СЭМ), флуоресцентную микроскопию и световую микроскопию.
МАТЕРИАЛ И МЕТОДИКА
Выделение клеток. Исследовали венозную кровь здоровых доноров обоих полов в возрасте 20–40 лет. Забор крови производили в утреннее время после подписания донорами бланка информационного согласия. На проведение исследования получено разрешение комиссии по биоэтике Национального исследовательского Нижегородского государственного университета им. Н.И. Лобачевского (Протокол № 9 от 17.07.2017 г.).
Гепаринизированную кровь фракционировали на двойном градиенте плотности фиколла-урографина (ρ = 1.077 г/мл, ρ = 1.116 г/мл, 200 g, 40 мин) (Подосинников и др., 1981). Затем НГ дважды отмывали с помощью центрифугирования буферным физиологическим раствором (БФР), содержащим 0.137 М NaCl и 0.0027 М KCl, рН 7.35 (200 g, 3 мин). НГ использовали в конечной концентрации 1 × 106 кл./мл. Клетки брали в эксперимент сразу после выделения, жизнеспособность по тесту с окрашиванием трипановым синим составляла не менее 99%. Для предотвращения активации НГ поверхностью стекла использовали силиконизированные пробирки.
Бактериальная суспензия. В работе использовали музейный штамм S. aureus 2879 М Кафедры “Нанотехнология и биотехнология” Нижегородского государственного технического университета им. Р.Е. Алексеева. Культуру бактерий выращивали при 37°С, 24 ч на ГМР-агаре (ГНЦ ПМБ, Оболенск), бактерии смывали стерильным БФР, трижды отмывали центрифугированием (2350 g, 10 мин), взвешивали в БФР и на фотоколориметре (КФК-2МП-УХЛ, Россия) доводили значение оптической плотности до 0.75 (λ = 670 нм), что соответствовало 1 × 109 кл./мл (начальная концентрация бактерий). Затем бактерии опсонизировали пулом сывороток от трех и более здоровых доноров. Сыворотки инкубировали с суспензией бактерий в соотношении 3 : 1 (37°С, 60 мин), после чего трижды отмывали БФР и использовали опсонизированные бактерии в начальной концентрации 1 × 109 кл./мл.
Метод СЭМ. Использование традиционных подложек (золотой (Au/GaAs) и алюминиевой) не дало результатов, так как из-за слишком высокой хрупкости и тонкости внеклеточных ловушек пучок электронов “прожигал” их. Поэтому методика пробоподготовки была нами существенным образом модифицирована. Идею модификации пробоподготовки дали результаты, полученные методом АСМ (рис. 1), которые показали, что в случае попыток наблюдения за реализацией процесса нетоза в динамике, в режиме реального времени внеклеточные ловушки наматывались на зонды. Стало понятно, что наибольшую сохранность хрупким структурам внеклеточных ловушек даст “подвешенное” состояние, поэтому образцы для СЭМ готовили на медных сетках, используемых и стандартизованных для просвечивающей электронной микроскопии (ПЭМ) (SPI Supplies, США) Чтобы клетки гарантированно оказались на сетке, а также для исключения взаимодействия с медью сетки, на нее высаживали тонкую пленку углерода. Исходно пленку углерода осаждали на кристалл соли методом вакуумного напыления, затем кристалл аккуратно растворяли, а пленка, удерживаемая силами поверхностного натяжения, оставалась плавать на поверхности воды, после чего она высаживалась на медную сетку.
Рис. 1.
Наматывание внеклеточных ловушек нейтрофильных гранулоцитов на зонды в процессе АСМ-сканирования при малом (а) и большом (б) увеличении. Видеозахват сделан на микроскопе Olympus IX71 (Япония).

Протокол пробоподготовки включал следующие 8 стадий: 1) НГ ресуспендировали в среде RPMI с содержанием сыворотки 2% (конечная концентрация клеток составила 8 × 105 кл./мл, объем вносимой суспензии – 100 мкл). 2) Сетку для удержания образцов помещали в обрезанный пластиковый колпачок для дозатора. Колпачок закрепляли на стеклянной чашке Петри (диаметр 35 мм) пленкой Parafilm M (Bemis, США). 3) На сетку наносили суспензию нейтрофилов и инкубировали в термостате (30 мин, 37°С) для достижения спонтанной адгезии. В изолированное пространство чашки заливали горячую воду для поддержания достаточного уровня влаги, чтобы избежать испарения и повышения осмомолярности растворов при работе с микрообъемами. 4) Вносили 100 мкл суспензии опсонизированных бактерий и дополнительно выдерживали (37°С) в течение 15 мин для последующего исследования быстрого нетоза и 90 мин для исследования классического нетоза. 5) По истечении этого времени отбирали 50 мкл надосадка, вносили 200 мкл 5%-ного глутарового альдегида и фиксировали 20 мин при 24°С. 6) Извлекали сетку и проводили отмывку образцов. Для этого на 96-ти луночный планшет наносили пленку Parafilm M, слегка продавливали для образования маленьких лунок, в лунки вносили дистиллированную воду, пинцетом опускали строго перпендикулярно сетку в перевернутом виде. 7) Отмывку проводили в 8 лунках, инкубируя в каждой не менее 2 мин. 8) Образец высушивали на воздухе при комнатной температуре.
Исследования образцов проводили на электронном микроскопе JSM-IT300LV (JEOL, Япония) в режиме высокого вакуума при ускоряющем напряжении 5 кВ и 20 кВ, диаметр электронного пучка достигал 5 нм, ток составлял менее 0.25 нА.
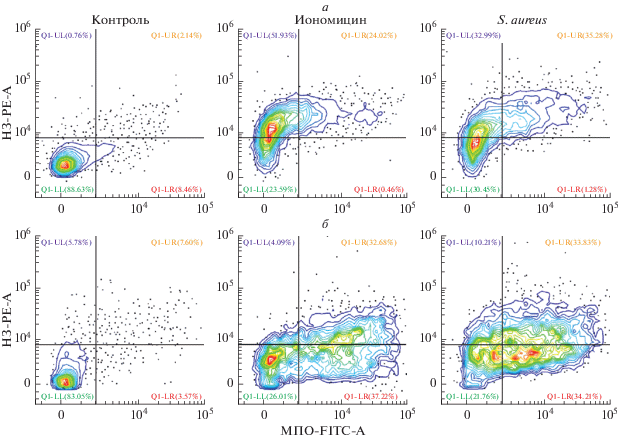
Проточная цитофлуориметрия. НГ исследовали как описано ранее (Gavillet et al., 2015). Клетки в конечной концентрации 1 × 106 кл./мл ресуспендировали в среде RPMI 1640 (Thermo Fischer, США) и активировали опсонизированным S. aureus (2 × 108 кл./мл) или иономицином, 4 мкМ (Sigma, США). Затем клетки фиксировали 2%-ным параформальдегидом и инкубировали в 2%-ном растворе бычьего сывороточного альбумина (БСА) в БФР (30 мин, 37°С). Для визуализации внеклеточных ловушек использовали антитела против миелопероксидазы (МПО) человека, меченные FITC (Thermo Fisher, США), кроличьи антитела против гистона H3 (Thermo Fisher, США) и анти-кроличьи IgG (H/L) антитела козы, конъюгированные с Alexa Fluor® 546 (Thermo Fisher, США). В каждом образце анализировали не менее 104 событий. Исследования проводили на проточном цитометре Cytoflex S (Beckman Coulter, США), для анализа данных использовали программное обеспечение CytExpert 2.0 (Beckman Coulter, США). (В результатах (рис. 2) MPO FITC-A – это миелопероксидаза, маркированная антителами против миелопероксидазы (МПО) человека, меченными FITC (Thermo Fisher, США), а H3-PE-A – это гистон Н3, меченный комплексом кроличьих АТ против гистона Н3 + козьими антителами к Fc-фрагменту кроличьи антител, коньюгированными с красителем Alexa Fluor).
Рис. 2.
Распределение нейтрофилов, окрашенных антителами против миелопероксидазы, мечеными FITC (MPO-FITC) и антителами против гистона H3, меченными Alexa Fluor® 546 (H3-PE) через 1 ч (а) и через 3 ч (б) после добавления опсонизированного Staphylococcus aureus и иономицина. Возбуждение флюоресценции производили синим лазером (488 нм), детекция сигнала производилась по каналам FITC (525/40) и PE (585/42). На рисунке в углах указан процент клеток, относящихся к каждому из квадрантов.
Флуоресцентная микроскопия. Для исследования формирования внеклеточных ловушек НГ высаживали на покровные стекла Eppendorf Cell Imaging Сoverglasses (Eppendorf, Германия) в концентрации 1 × 106 кл./мл в среде RPMI 1640 (Thermo Fischer, США) при 37°C и 5% CO2 и культивировали 1 ч для их адгезии к поверхности стекол. После этого клетки активировали опсонизированными бактериями S. aureus (2 × 108 кл./мл) и фиксировали 4%-ным параформальдегидом. Затем клетки инкубировали в БФР, содержащем 2% БСА, и окрашивали с помощью тех же флуоресцентно меченных антител, которые были использованы для проточной цитометрии. Микроскопию проводили на конфокальном микроскопе Carl Zeiss LSM 510 META (Carl Zeiss, Германия).
Световая микроскопия. Для сравнения морфологических особенностей классического и быстрого нетоза использовали мазки для иммуноцитохимического определения ферментативной активности НГ (окрашивание на МПО, кислую и щелочную фосфатазу, фосфолипиды), которые просматривали и протоколировали в течение 2 лет.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основным критерием, определяющим принадлежность внеклеточных ловушек к классическому или быстрому нетозу было время. Поскольку классический нетоз, как и апоптоз, реализует сложную программу перед образованием внеклеточных ловушек, его оценивали не ранее чем через 1 ч после внесения стимула. В качестве стимуляторов использовали либо опсонизированные бактерии S. aureus, либо традиционный индуктор нетоза – иономицин. Результаты исследования представлены на рис. 2.
НГ, формирующие внеклеточные ловушки (NETs – neutrophil extracellular traps), обнаруживаются как клетки, положительно окрашенные антителами против гистона Н3 и MПO. Это обусловлено тем, что реализация нетоза НГ приводит к выбросу во внеклеточное пространство ДНК и ассоциированных с ней гистонов и ферментов (особенно МПО и нейтрофильной эластазы). По различиям в характере двупараметрических гистограмм, полученных через 1 ч (рис. 2а) и 3 ч (рис. 2б) после активации НГ делаем вывод и о различиях в характере формирования внеклеточных ловушек, которые детектируются в эти временные точки. В случае активации иономицином через 1 ч, несмотря на увеличение числа клеток, у которых детектируется гистон H3, уменьшается число МПО-позитивных клеток по сравнению с результатом активации нетоза бактериями S. aureus. Это, соответственно, приводит к снижению числа клеток, имеющих двойное положительное окрашивание после активации иономицином по сравнению с НГ, активированными бактериями. Через 3 ч (классический нетоз) таких различий не наблюдается. Количество клеток с двойным положительным окрашиванием через 1 и 3 ч после активации бактериями сопоставимо. Вышеизложенные факты позволяют сделать вывод о том, что, в отличие от иономицина, S. aureus с одинаковой эффективностью запускает процесс как классического, так и быстрого нетоза. Поэтому мы посчитали целесообразным для исследования морфологических различий внеклеточных ловушек в качестве индуктора выбрать именно S. aureus.
Морфологические различия классического и быстрого нетоза лучше всего визуализируются при исследовании методом СЭМ. Из рис. 3 следует, что при стимуляции НГ опсонизированным S. aureus классический и быстрый нетоз имеют сходные структурные особенности внеклеточных ловушек, а именно: 1) в обоих типах внеклеточных ловушек фиксируются как отдельные клетки стафилококка, так и целые гроздья; 2) оба типа внеклеточных ловушек очень хрупкие, легко разрушаются пучком электронов; 3) в обоих случаях легко визуализируются и ДНК, и ферменты, и гистоны, ассоциированные с ДНК, и объекты, заключенные во внеклеточных ловушках.
Рис. 3.
Быстрый (15 мин; а, б) и классический (90 мин; в, г) нетоз, индуцированный опсонизированным S. aureus 2879М. Сканирующая электронная микроскопия JSM-IT300LV (JEOL, Япония). В обоих случаях, внеклеточные ловушки захватывают стафилококки. При быстром нетозе внеклеточные ловушки образуют характерную структуру “бусин на нити”, при классическом нетозе формируются длинные ловушки, с разной степенью разветвления ДНК.

Однако не менее очевидны и различия: 1) внеклеточные ловушки классического нетоза распространяются на большие дистанции и занимают больший объем, чем ловушки, формируемые при быстром нетозе, поэтому в них могут фиксироваться не только бактерии, но и собственные клетки (например, эритроциты и другие нейтрофильные гранулоциты, рис. 3в); 2) внеклеточные ловушки классического нетоза более разрежены, нити ДНК, формирующие основу ловушек могут располагаться по одной, либо в виде пучков, что проявляется в разном диаметре нитей (рис. 3в, г), тогда как при быстром нетозе ДНК, как правило, однонитевые и формируют характерную структуру “бусин на нити” (рис 3а, б). Именно эта структура была впервые описана при открытии быстрого нетоза (Pilsczek et al., 2010).
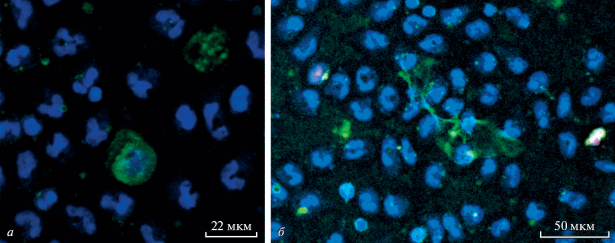
Исследование методом флуоресцентной микроскопии дает дополнительную информацию. В частности, очевидно, что оба типа нетоза реализуются при активном участии МПО (зеленые гранулы на рис. 4). При использовании флуоресцентной микроскопии видно, что быстрый нетоз сопровождается формированием облакоподобной структуры внеклеточной ловушки вокруг НГ, а краситель DAPI позволяет четко видеть, что в некоторых клетках происходит конденсация и округление ядерного материала. В случае классического нетоза формируются характерные длинные внеклеточные ловушки, имеющие разный диаметр нитей, в некоторых клетках наблюдается конденсация хроматина, при выраженном развитии классического нетоза наблюдается гибель клеток. Обращает на себя внимание выявление в целом ряде клеток ярко окрашенных цитрулированных гистонов. В случае классического нетоза заметен зафиксированный нами ранее феномен индукции (Pleskova et al., 2018): при достижении внеклеточными ловушками соседних НГ, в них также начинается процесс клеточной гибели по механизму нетоза.
Рис. 4.
Морфологические особенности быстрого (15 мин; а) и классического (90 мин; б) нетоза, детектируемые методом флуоресцентной микроскопии. Клетки окрашены антителами против миелопероксидазы (MPO-FITC, зеленый цвет) и гистона H3 (Alexa Fluor® 546, красный цвет), ядра визуализировали с помощью DAPI (синий цвет).
Благодаря сравнению видеозахватов быстрого и классического нетоза, полученных методом традиционной световой микроскопии, видно, что в случае быстрого нетоза его границы выражены четко, краситель Романовского–Гимзы показывает, что ядерный материал не страдает (рис. 5а), часто нетоз наблюдается в случае близкого расположения двух клеток (рис. 5в). Прокрашивание на фосфолипиды суданом черным Б выявило, что в случае инициации быстрого нетоза на первом этапе высвобождение крупных гранул может визуализироваться в виде полых полукруглых симметричных структур (рис. 5б). В случае формирования классического нетоза образуются очень длинные внеклеточные ловушки, в которых могут фиксироваться как единичные клетки стафилококка, так и целые гроздья бактерий. Использование ядерного красителя Романовского-Гимзы показывает опустошение некоторых сегментов ядер, в ряде случаев происходит тотальное расходование клеточного материала и формирование “теней клеток”. Достижение внеклеточной ловушкой, сформированной одной клеткой другого НГ, может спровоцировать в последнем уплотнение ядерного материала (рис. 5г).
Рис. 5.
Морфологические особенности нетоза, детектируемые методом световой микроскопии: а – формирование быстрого нетоза между двумя клетками (окрашивание на кислую фосфатазу по Бурстону); б – начало формирования крупных везикул при быстром нетозе (окрашивание на фосфолипиды суданом черным Б); в – формирование быстрого нетоза двумя близлежащими клетками (окрашивание на щелочную фосфатазу по Шубичу); г – формирование классического нетоза – снимок составлен из последовательных кадров с нескольких полей зрения (окрашивание на миелопероксидазу по Грэхему-Кноллю). Видеозахват сделан на микроскопе Olympus IX71 (Япония).

Основные черты сходства и различий между быстрым и классическим нетозом, выявленные в данной работе, суммированы в табл. 1
Таблица 1.
Основные особенности быстрого и классического нетоза. Сходства и различия
| Параметр сравнения | Характеристика | |
|---|---|---|
| быстрый нетоз | классический нетоз | |
| Способность к фиксации бактерий | Фиксируются как единичные бактерии, так и целые гроздья стафилококка | |
| Участие ДНК, гистонов, ферментов (включая миелопероксидазу) | Процесс протекает при активном участии миелопероксидазы, цитруллированных гистонов, ДНК | |
| Хрупкость внеклеточных ловушек | Высокая | |
| Время реализации | 5–60 мин | 60–180 мин |
| Характер распространения | На небольшие дистанции, имеет облакоподобную структуру | На значительно бóльшие расстояния |
| Способность к фиксации собственных клеток организма | Не обнаружена | Обнаружена |
| Морфология внеклеточных ловушек | Плотные, нити ДНК одиночные с характерной структурой “бусин на нити” | Разреженные, длинные, ДНК одиночные, либо в виде пучков |
| Характер ядерного материала | Выраженная конденсация | Возможна конденсация хроматина, но чаще отмечается полное расходование ядерного материала и феномен опустошения клетки |
| Индукция образования новых внеклеточных ловушек | Не выявлена | Выявлена |
| Гибель клеток | Нет | Есть |
Таким образом, при стимуляции НГ опсонизированными S. aureus возможна реализация как быстрого (15–60 мин), так и классического (60–180 мин, с пиком через 120 мин) нетоза. Методом проточной цитометрии были выявлены различия в характере окрашивания НГ антителами против гистона H3 и МПО для быстрого и классического нетоза. Для дифференциальной диагностики быстрого и классического нетоза не обязательно использование методов высокоразрешающей микроскопии, поскольку основные отличительные черты этих двух вариантов хорошо визуализируются с использованием традиционной микроскопии. По всей вероятности, классический нетоз имеет механизм самоусиления, поскольку неоднократно было замечено, что при достижении внеклеточной ловушкой не активированного НГ в нем индуцируется программа нетоза. При исследовании тонких особенностей внеклеточных ловушек с использованием методов высокоразрешающей микроскопии лучше всего готовить препараты в “подвешенном” состоянии по протоколу, описанному в разделе “Материал и методика”, поскольку данный протокол обеспечивает лучшую сохранность хрупких внеклеточных ловушек.
Список литературы
Лотош Н.Ю., Алясева С.О., Василов Р.Г., Селищева А.А. 2019. Стеариламин вызывает образование нейтрофильных внеклеточных ловушек независимо от активных форм кислорода. Цитология. 61(4) : 308–318. doi (Lotosh N.Yu., Alyaseva S.O., Vasilov R.G., Selischeva A.A. 2019. Stearylamine causes the formation of neutrophil extracellular traps regardless of reactive oxygen species. Tsitologiya. 61(4) : 308–318.)https://doi.org/10.1134/S0041377119040035
Подосинников И.С., Нилова Л.Г., Бабиченко И.В., Турина О.П., Пономарева В.Н. 1981. Метод определения хемотаксической активности лейкоцитов. Лабораторное дело. 8 : 468–470. (Podosinnikov I.S., Nilova L.G., Babichenko I.V., Turina O.P., Ponomareva V.N. 1981. Method for determining the chemotactic activity of leukocytes. Laboratory work. 8 : 468–470.)
Barnado A., Crofford L.J., Oates J.C. 2016. Neutrophil extracellular traps (NETs) as targets for biomarkers and therapies in autoimmune diseases. J. Leukocyte Biology. 99(2) : 265–278. https://doi.org/10.1189/jlb.5BT0615-234R
Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D.S., Weinrauch Y., Zychlinsky A. 2004. Neutrophil extracellular traps kill bacteria. Science. 303 : 1532–1535. https://doi.org/10.1126/science.1092385
Brinkmann V., Zychlinsky A. 2012. Neutrophil extracellular traps: Is immunity the second function of chromatin? J. Cell Biol. 198 : 773–783. https://doi.org/10.1083/jcb.201203170
Dąbrowska D., Jabłońska E., Garley M., Ratajczak-Wrona W., Iwaniuk A. 2016. New aspects of the biology of neutrophil extracellular traps. Scand. J. Immunol. 84 : 317–322. https://doi.org/10.1111/sji.12494
Fuchs T.A., Abed U., Goosmann C., Hurwitz R., Schulze I., Wahn V., Weinrauch Y., Brinkmann V., Zychlinsky A. 2007. Novel cell death program leads to neutrophil extracellular traps. J. Cell Biol. 176 : 231–241. https://doi.org/10.1083/jcb.200606027
Galluzzi L., Vitale I., Aaronson S.A., Abrams J.M. et al. 2018. Molecular mechanisms of cell death: Recommendations of the Nomenclature committee on cell death 2018. Cell Death Differentiation. 25 : 486–541. https://doi.org/10.1038/s41418-017-0012-4
Gavillet M., Martinod K., Renella R. et al. 2015. Flow cytometric assay for direct quantification of neutrophil extracellular traps in blood samples. Am. J. Hematol. 90 : 1155–1158. https://doi.org/10.1002/ajh.24185
Grayson P.C., Kaplan M.J. 2016. Neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. J. Leukocyte Biol. 99 : 253–264. https://doi.org/10.1189/jlb.5BT0615-247R
Obermayer A., Stoiber W., Krautgartner W.D., Klappacher M., Kofler B., Steinbacher P., Vitkov L., Grabcanovic-Musija F., Studnicka M. 2014. New aspects on the structure of neutrophil extracellular traps from chronic obstructive pulmonary disease and in vitro generation. PLoS ONE. 9 : e97784. https://doi.org/10.1371/journal.pone.0097784
Pilsczek F.H., Salina D., Poon K.K.H., Fahey C., Yipp B.G., Sibley C.D., Robbins S.M., Green F.H.Y., Surette M.G., Sugai M., Bowden M.G., Hussain M., Zhang K., Kubes P. 2010. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. J. Immunol. 185 : 7413–7425. https://doi.org/10.4049/jimmunol.1000675
Pleskova S.N., Gorshkova E.N., Kriukov R.N. 2018. Dynamics of formation and morphological features of neutrophil extracellular traps formed under the influence of opsonized Staphylococcus aureus. J. Mol. Recognition. 31 : e2707. https://doi.org/10.1002/jmr.2707
Yousefi S., Mihalache C., Kozlowski E., Schmid I., Simon H.U. 2009. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death Differentiation. 16 : 1438–1444. https://doi.org/10.1038/cdd.2009.96
Дополнительные материалы отсутствуют.


