Цитология, 2020, T. 62, № 1, стр. 38-46
Морфологическое исследование биорезорбируемой трубчатой матрицы малого диаметра из поли(L-лактида) для тканеинженерного сосудистого импланта
Г. И. Попов 1, П. В. Попрядухин 2, 3, *, Г. Ю. Юкина 3, Е. Г. Сухорукова 3, Е. М. Иванькова 2, 3, В. Н. Вавилов 1, В. Е. Юдин 2, 3
1 Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова
197376 Санкт-Петербург, Россия
2 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: pavelpnru@gmail.com
Поступила в редакцию 09.10.2019
После доработки 17.10.2019
Принята к публикации 17.10.2019
Аннотация
Методом электроформования из растворов поли(L-лактида) (ПЛА) были получены нетканые трубчатые биорезорбируемые матрицы с внутренним диаметром 1.1 мм. Матрицы были имплантированы в брюшную часть аорты крысам в качестве тканеинженерного сосудистого импланта на срок от 2 сут до 16 мес. и продемонстрировали высокую биосовместимость, нетоксичность и выраженные атромбогенные свойства. Общая проходимость имплантов составила 93%. Морфометрический анализ динамики заселения матрицы клетками показал, что на всех сроках наблюдения во внешней половине стенки матрицы число клеток превалирует, что свидетельствует о миграции клеток из соединительнотканной капсулы, окружающей матрицу. Показано, что в стенке матрицы происходит два параллельных процесса: биорезорбция волокон ПЛА и образование соединительной ткани. Полная биорезорбция матриц с замещением нативными тканями, образованием эндотелиального и субэндотелиального слоев проходила за 16 мес. эксперимента. К этому сроку у всех экспериментальных животных в зоне реконструкции обнаружены аневризматические расширения, не приведшие к разрыву импланта. С целью предотвращения развития подобных осложнений необходимо разработать метод дополнительного укрепления стенки матрицы.
В настоящее время по оценкам Всемирной организации здравоохранения в мире сохраняется высокий, с тенденцией к росту, уровень заболеваемости и смертности от сердечно-сосудистых патологий (Global health estimates (2016): Disease burden by Cause, Age, Sex, by Country and by Region, 2000–2016. Geneva, World Health Organization; 2018; https://www.who.int/healthinfo/global_burden_disease/estimates/en/index1.html). Основным хирургическим методом лечения поражённых сосудов является проведение операций, в ходе которых протезируют или шунтируют поврежденные артерии. Кроме того, требуется сосудистый пластический материал для выполнения артериовенозных фистул пациентам, получающим пожизненные курсы гемодиализа (Бикбов, Томилина, 2011). В современной хирургической практике для этих целей применяются как синтетические полимерные протезы, так и аутологичные вены и артерии.
К преимуществам синтетических протезов можно отнести относительно высокие эксплуатационные характеристики, широкий ассортимент и массовость их производства. Однако используемые сейчас протезы не резорбируются в организме, на их поверхности не формируется защитный слой эндотелия, характерный для нативных сосудов, что приводит к возникновению тромбозов, особенно интенсивного в протезах малого диаметра, в которых кровоток имеет низкие линейные скорости. Для реконструкции артерий диаметром 5 мм и менее синтетические протезы не применяются в связи с развитием раннего тромбоза (Klinkert et al., 2004). В детской кардиохирургии неспособность современных синтетических протезов к ремоделированию в растущем организме ребенка является причиной сложных повторных операций по замене протеза меньшего размера на больший (Drews et al., 2017). При использовании аутологичного материала, как правило, происходит полная интеграция импланта в организм, а наличие слоя эндотелия и минимально выраженная воспалительная реакция делает, в частности, возможным эффективное протезирование сосудов малого диаметра. Однако количество аутоматериала ограничено, особенно в случаях повторных операций или шунтирования нескольких артерий.
Особенно остро стоит вопрос протезирования с помощью аутоартерий, так как забор материала приводит к существенным функциональным нарушениям в тканях, находящихся в бассейне забираемой артерии. Поэтому для протезирования чаще используют аутовены, забор которых легче компенсируется и не приводит к существенным нарушениям. Но так как стенка вены значительно тоньше чем у артерии, при их использовании на отдаленных сроках наблюдаются дегенеративные процессы стенки и развитие аневризм (Harskamp et al., 2013). Кроме того, забор материала является дополнительной травмой для пациента и усложняет оперативное вмешательство.
Возможным решением этих проблем является создание тканеинженерного сосудистого импланта (ТИСИ), концепция создания которого заключается в наличии и применении трех основных составляющих: 1) биорезорбируемой матрицы; 2) клеточного материала и 3) сигнального воздействия механической и биологической природы (Sullivan, Brockbank, 2000). В настоящее время получили развитие пять основных методик изготовления ТИСИ: 1) послойная тканевая инженерия (L’Heureux et al., 2006; Konig et al., 2009); 2) использование грануляционной ткани (Watanabe et al., 2010); 3) биопринтинг (Norotte et al., 2009); 4) применение децеллюляризированных сосудов (Zhao et al., 2010) и 5) применение биорезорбируемых полимерных матриц (Vaz et al., 2005; Shinoka, Breuer, 2008; Tara et al., 2014). Несмотря на разнообразие подходов, удовлетворяющее всем требованиям решение пока не найдено. Не доказана, в частности, необходимость использования клеточного материала на этапе in vitro, напротив, в ряде работ пытаются уйти от этого этапа ввиду его технологической сложности и низкой воспроизводимости (Row et al., 2017; Fukunishi et al., 2017; Popryadukhin et al., 2017; Smith et al., 2019).
Нами ранее была разработана технология получения методом электроформования полимерных биорезорбируемых матриц на основе микроволокон из поли(L-лактида) (ПЛА) для дальнейшего использования их в составе ТИСИ. Была показана их биосовместимость, нетоксичность, высокая атромбогенность, способность к полной биорезорбции в течение 16 мес. с постепенным замещением волокон полимера нативными тканями (Popryadukhin et al., 2017).
Цель настоящей работы – морфологическое исследование механизма заселения клетками биорезорбируемой полимерной матрицы из микроволокон ПЛА in vivo для оценки возможности получения на ее основе тканеинженерного сосудистого импланта малого диаметра.
МАТЕРИАЛ И МЕТОДИКА
Получение материала. Для получения пористых трубчатых матриц использовали ПЛА Purasorb PL-10 (Corbion Purac, Нидерланды). ПЛА растворяли в трихлорметане (хлороформе) (Sigma-Aldrich, США), концентрация раствора составляла 15%. Полученные растворы с помощью инжекторного насоса подавали через электрод-фильеру в электрическое поле с напряженностью Е = 1.5 × 104–4.0 × 105 В/м при расстоянии между электродами 0.15 м, осаждение микроволокон происходило на цилиндрическом электроде диаметром 1.1 мм, скорость вращения которого составляла 1500 об./мин. Далее выполняли термообработку полученных матриц в фиксированном на цилиндрическом электроде состоянии при температуре 70°C в течение 1 ч, что приводило к частичной кристаллизации полимера и, как следствие, существенному улучшению его механических и эксплуатационных характеристик. Толщина стенки матрицы после термообработки составляла 250 мкм. Более детально особенности методики электроформования пористых трубчатых матриц были описаны нами ранее (Popryadukhin et al., 2017).
Электронно-микроскопические исследования образцов проводили на сканирующем электронном микроскопе Supra 55VP (Carl Zeiss, Германия) в режиме регистрации вторичных электронов с предварительным нанесением тонкого слоя платины на поверхность образцов.
Эксперименты на животных. Для экспериментов in vivo использовали 45 самцов белых крыс Wistar, вес подопытных животных составлял 200–250 г, возраст – 3 мес. Животных оперировали под общей анестезией (с помощью растворов Zoletil 100 (0.1 мл) и Rometar (20 мг/мл) – 0.0125 мл раствора на 0.1 кг массы животного интраперитонеально. Выполняли Y-образную лапаротомию и методом микрососудистой хирургии проводили мобилизацию инфаренального отдела аорты и ее протезирование матрицей с наложением 8 швов на каждый анастомоз. Использовали атравматические иглы с нитью Prolen 9-0. Во всех экспеиментах после включения кровотока не было значимого кровотечения сквозь стенку матрицы или по линии анастомозов. Антикоагулянты и дезагреганты не использовали. Проходимость сосудов оценивали классической методикой (Acland, 1972). Затем переднюю брюшную стенку послойно ушивали атравматическими иглами с нитью Prolen 4-0. После наложения наружных швов крыс содержали в индивидуальных клетках, животные получали свободный доступ к воде и стандартную диету. Проводили наблюдение за цветом и температурой кожных покровов задних конечностей животных, их двигательной активностью.
Морфологическое исследование. Через 2 сут, 1, 2, 4, 12, 24, 48, 56 и 64 нед. матрицы с фрагментами нативной аорты иссекали и фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч, далее образцы обезвоживали в серии растворов этанола возрастающей концентрации и заключали в парафиновые блоки по стандартной гистологической методике. Парафиновые срезы толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония), окрашивали гематоксилином Майера и эозином (Bio-Optica, Италия). Для визуализации коллагена соединительной ткани использовали окраску по методу Маллори и методу Массона (набор реактивов, Bio-Optica, Италия).
Микроскопический анализ препаратов с продольным сечением матрицы проводили на световом микроскопе Leica DM750 (Германия), используя окуляр с увеличением 10× и объектив с увеличением 4, 10, 40 и 100×. Запись цифровых изображений выполняли с помощью фотокамеры ICC50 (Leica, Германия). В одном поле зрения (0.33 × 0.25 мм) подсчитывали число ядер клеток во внутренней, обращенной в просвет, и наружной половинах стенки матрицы (рис. 1). Для этого проводили вертикальную линию длиною равной толщине стенки матрицы. Программа автоматически определяла ее середину. Далее чертили горизонтальную линию, которая разделяла изображение стенки матрицы на две равные половины. Подсчет ядер клеток производили для каждой из пяти матриц одного срока наблюдения. Также измеряли толщину стенки матрицы, толщину неоинтимы и внешней соединительнотканной оболочки (неоадвентиции) в десяти последовательных измерениях на протяжении препарата.
Рис. 1.
Схема (I) и микрофотография (II) принципа морфометрического исследования гистологического препарата. а – Выделение поля зрения для подсчета ядер клеток во внутренней части стенки матрицы; б – выделение поля зрения для подсчета ядер клеток во внешней части стенки матрицы.

Статистическую обработку полученных количественных данных проводили с использованием стандартного пакета программ (Statistica 7.0, Stat.Soft for Windows). Вычисляли среднее арифметическое значение и его стандартную ошибку, оценку значимости различий показателей проводили с применением критерия Вилкоксона и U-критерия Манна−Уитни. Значимость различий определяли при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На 2-е сут эксперимента морфологический анализ показал, что в зоне имплантации нет признаков острой воспалительной реакции, фибрин полностью покрывает внутреннюю поверхность матрицы и заполняет пространство между волокнами стенки импланта, признаков биорезорбции микроволокон ПЛА не выявлено (рис. 2). Число клеток в поле зрения в наружной половине стенки матрицы составляет 86 ± 10, во внутренней – 47 ± 5 (табл. 1). Всречаются нейтрофилы, лимфоциты, эритроциты и единичные фибробласты. Вокруг матрицы начинает формироваться соединительнотканная капсула. Следует отметить, что на всех сроках эксперимента признаков миоинтимальной гиперплазии в области анастомозов не определялось.
Рис. 2.
Микрофотографии продольного среза матрицы. а – Исходная матрица (сканирующая электронная микроскопия); б – через 2 сут после имплантации; в, г – гистологические срезы через 2 сут после имплантации. Окраска гематоксилином и эозином. Увел. об.: 10× (в) и 40× (г).
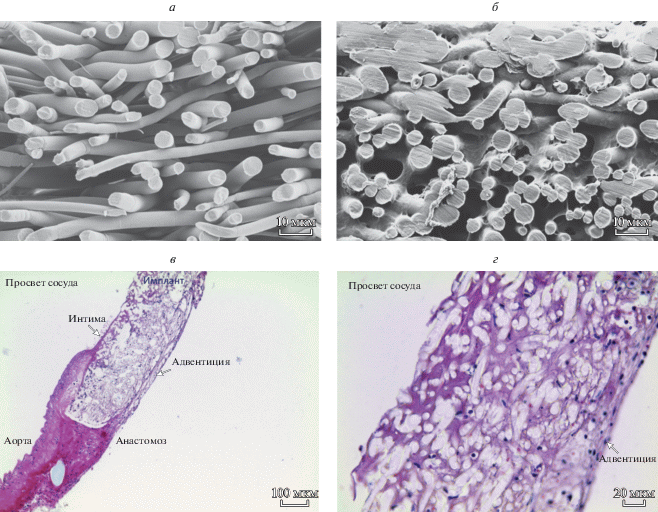
Таблица 1.
Морфометрический анализ динамики численности клеток в матрице на разных сроках имплантации
| Время, нед |
Число клеток | Толщина неоинтимы, мкм | Толщина наружной соединительнотканной капсулы, мкм | |
|---|---|---|---|---|
| в наружной части стенки матрицы | во внутренней части стенки матрицы | |||
| 2 сут | 86 ± 10 | 47 ± 5 | – | 10.1 ± 1.8 |
| 1 | 127 ± 7а | 62 ± 7 | 8.6 ± 1.8 | 152.2 ± 10.3д |
| 2 | 146 ± 6а | 88 ± 3а | 9.6 ± 1.2 | 336.1 ± 13.4е |
| 4 | 167 ± 7а | 97 ± 6а | 11.9 ± 1.1 | 525.8 ± 15.4ж |
| 12 | 182 ± 7а | 116 ± 5а | 23.1 ± 4.1б | 616.2 ± 19.6з |
| 24 | 196 ± 8а | 126 ± 4а | 75.6 ± 8.5в | 621.2 ± 11.8 |
| 48 | 245 ± 7г | 172 ± 6г | 357.6 ± 13.0г | 652.6 ± 10.5 |
| 56 | 250 ± 11а | 176 ± 10а | 371.1 ± 22.2 | 650.8 ± 12.2 |
| 64 | 258 ± 20а | 177 ± 10а | 366.2 ± 13.0 | 654.2 ± 11.4 |
а Показатели статистически значимо отличаются от таковых на 2 сут эксперимента, Р < 0.05 (Р = 0.0285); б показатели статистически значимо отличаются от таковых на 4-ой нед. (Р = 0.0285); в показатели статистически значимо отличаются от таковых на 12-ой нед. (Р = 0.0285); г показатели статистически значимо отличаются от таковых на 24-ой нед. (Р = 0.0285); д показатели статистически значимо отличаются от таковых на 2-е сут (Р = 0.0285); е показатели статистически значимо отличаются от таковых на 1-ой нед. (Р = = 0.0285); ж показатели статистически значимо отличаются от таковых на 2-ой нед. (Р = 0.0285) и з показатели статистически значимо отличаются от таковых на 4-ой нед. эксперимента (Р = 0.0285).
Через 1 нед. эксперимента все импланты проходимы, аорта плотно сращена с матрицей в зоне анастамоза. Морфологический анализ материала показал, что с внутренней стороны матрицы, начиная с дистального и проксимального анастомозов, формируется эндотелиальный и субэндотелиальный слои, достигая толщины 8.6 ± 1.8 мкм в непосредственной близости к анастомозам и постепенно истончаясь к середине матрицы. В наружной части стенки матрицы располагаются макрофаги и фибробласты, определяются единичные тонкие коллагеновые волокна, число клеток в наружной части стенки матрицы составляет 127 ± 7. Во внутренней части стенки матрицы между волокнами выявляются макрофаги и немногочисленные фибробласты, число клеток в поле зрения составляет 62 ± 7. Вокруг матрицы формируется соединительнотканная капсула толщиной 152.2 ± 10.3 мкм (табл. 1). Клеточный состав капсулы представлен фибробластами, макрофагами и единичными гигантскими многоядерными клетками инородных тел.
В течение 2-ой недели эксперимента продолжается процесс заселения матрицы клетками, причем число клеток превалирует в наружной части стенки матрицы. Кроме того, увеличивается количество коллагеновых волокон, нарастает толщина внешней соединительнотканной капсулы до 336.1 ± 13.4 мкм (табл. 1).
Через 4 недели морфологическая картина свидетельствует, что эндотелий выстилает протез полностью. Субэндотелиальный слой, сформированный на всeм протяжении матрицы, имеет толщину 11.97 ± 1.06 мкм, содержит тонкую сеть коллагеновых волокон (рис. 3а, б). Вся толщина стенки матрицы заполнена макрофагами и фибробластами, пронизана тонкими коллагеновыми волокнами, в наружной части регистрируется 167 ± 7, а во внутренней – 97 ± 6. клеток в поле зрения. Заметим, что со стороны адвентиции коллагеновые волокна толще, снаружи матрица окружена соединительнотканной капсулой толщиной 525.8 ± 15.4 мкм (табл. 1).
Рис. 3.
Микрофотографии матрицы через 4 нед. после имплантации. Сканирующая электронная микроскопия. Участок в средней части импланта при разном увеличении (а, б).

Через 12 нед. наблюдаются признаки начала биорезорбции ПЛА микроволокон: волокна фрагментируются, на срезах видна их слабовыраженная пористая структура. При морфологическом анализе выявлено, что неоинтима, покрывающая матрицу полностью, значимо больше по сравнению с предыдущим сроком (табл. 1). Число клеток в наружной и во внутренней частях матрицы продолжает увеличиваться. Со стороны адвентиции встречаются многочисленные гигантские многоядерные клетки инородных тел.
Через 24 нед. микроволокна имеют множественные поперечные трещины, часть волокон фрагментирована. На поперечном срезе микроволокна имеют выраженную пористую структуру, что свидетельствует об активной их биорезорбции. Морфологический анализ, как и на ранних сроках эксперимента, указывает на полностью сформированные эндотелиальный и субэндотелиальный слои толщиной значимо большей по сравнению с предыдущим сроком (табл. 1) Матрица полностью пронизана коллагеновыми волокнами, число клеток в наружной и во внутренней частях продолжает увеличиваться и составляет 196 ± 8 и 126 ± 4 клеток в поле зрения соответственно. Между микроволокнами ПЛА по всему объёму импланта наблюдаются многочисленные округлые полости диаметром от 1.750 мкм до 7.320 мкм, заполненные слабооксифильным содержимым. Полости располагаются без видимой упорядоченности и не имеют капсулы. Снаружи матрицы выявляется соединительнотканная капсула толщиной 621.2 ± 11.8 мкм с гигантскими многоядерными клетками инородных тел.
Через 48 нед. выявлена субтотальная степень биорезорбции полимера матрицы. Микроволокна представлены отдельными фрагментами, которые полностью окружены соединительной тканью. Неоинтима, представленная плотно расположенными коллагеновыми и единичными эластическими волокнами, достигает 357.6 ± 13.0 мкм. На данном сроке эксперимента в некоторых имплантах в субэндотелиальном слое впервые определяется отложение кальция, преимущественно в местах анастамозов. Стенка матрицы состоит из фибробластов, макрофагов и неупорядоченно расположенных плотных пучков коллагеновых волокон, которые окружают фрагменты матрицы. В наружной части стенки определяются 245 ± 7 клеток в поле зрения, во внутренней – 172 ± 6. Округлые полости со слабооксифильным содержимым встречаются по всему объему матрицы и имеют диаметр от 6.59 мкм до 11.50 мкм. Наружная капсула толщиной 652.6 ± 10.5 мкм представлена рыхлой волокнистой соединительной тканью с сосудами и гигантскими многоядерными клетками инородных тел.
Через 56 нед. морфологическая картина исследуемых препаратов схожа с таковой на предыдущем сроке. Число клеток в стенке матрицы, толщина неоинтимы и наружной капсулы увеличиваются (табл. 1). Неомедия представлена неупорядоченно расположенными пучками коллагеновых волокон, макрофагами, фибробластами и фрагментами волокон ПЛА. Диаметр новообразованных полостей между микроволокнами составляет от 3.360 до 7.040 мкм. На данном сроке процесс резорбции микроволокон ПЛА находился на заключительной стадии: продольные размеры видимых фрагментов составляют от 1 до 10 мкм, имеют высокопористую структуру, продольные и поперечные трещины (рис. 4а, б). В соединительнотканной адвентиции вдоль всей поверхности импланта определяются гигантские многоядерные клетки инородных тел и сосуды.
Рис. 4.
Микрофотографии поперечного среза матрицы через 56 (а, б) и 64 нед. (в, г) эксперимента. а, в, г – Гистологические срезы, б – сканирующая электронная микроскопия. а, г – Окраска по методу Массона, об.: 40×. в – Окраска по методу Маллори, об.: 10×.
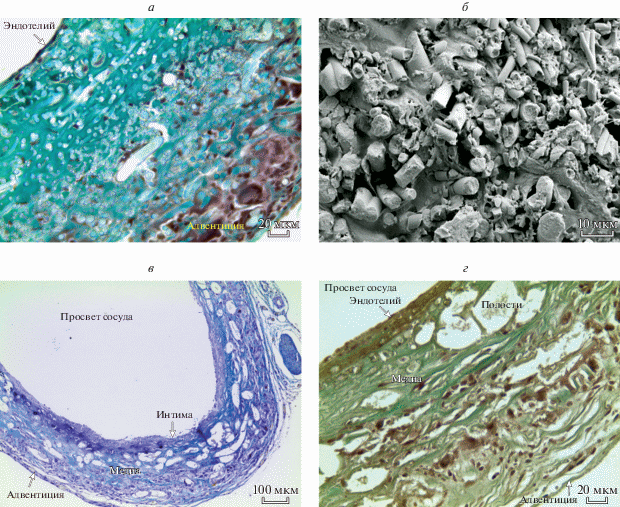
Через 64 нед. при выделении брюшной аорты и импланта у всех животных в зоне реконструкции обнаружено аневризматическое расширение разной степени выраженности. При гистологическом исследовании матриц установлено, что произошла тотальная биорезорбция полимера, стенка импланта полностью состоит из новообразованных тканей. Внутренний слой выполнен неоинтимой, толщиной 366.2 ± 13.0 мкм, представленной эндотелием и субэндотелиальным слоем, состоящим из коллагеновых и эластических волокон. Основная часть стенки импланта состоит из элементов соединительной ткани, клеточный состав представлен фибробластами, фиброцитами, макрофагами, коллагеновые волокна формируют неупорядоченно расположенные пучки (рис. 4в, г). Число клеток в наружной и внутренней частях неомедии практически не увеличивается по сравнению с предыдущим сроком эксперимента (табл. 1). Полости с оксифильным содержимым во вновь сформированной медии достигают диаметра от 2.7 до 21.7 мкм. Соединительнотканная капсула вокруг импланта с сосудами и гигантскими многоядерными клетками инородных тел имеет толщину 654.2 ± 11.4 мкм.
При морфологическом анализе ПЛА матрицы трубчатой формы, имплантированной в брюшную аорту крысы, отмечено, что в первые дни эксперимента образуется соединительнотканная капсула вокруг матрицы. Окончательное ее формирование происходит за 12 нед., капсула достигает толщины 616.2 ± 19.6 мкм. В дальнейшем происходит ее незначительное утолщение до 654.2 ± 11.4 мкм на 64-ой нед. за счет формирования крупных коллагеновых пучков. Морфометрический анализ показал, что именно капсула служит источником клеток, мигрирующих во внешнюю половину матрицы. В капсуле происходит образование vasa vasorum (сосуды сосудов), в ней определяются гигантские многоядерные клетки инородных тел, которые участвуют в процессе резорбции волокон матрицы.
Внутренняя поверхность матрицы после имплантации изначально покрывается тонким слоем фибрина. В дальнейшем образуется эндотелиальная выстилка за счет распространения интимы брюшной аорты крысы через зоны анастомозов. С 12-недельного срока имплантации происходит значительное развитие субэндотелиального слоя, представленного коллагеновыми и эластическими волокнами, который значимо нарастает вплоть до 48 нед., и в дальнейшем существенно не меняется. Клинически важным является то, что на всех сроках наблюдения отсутствуют признаки миоинтимальной гиперплазии в зоне анастомозов матрицы с брюшной аортой, что, в частности, способствует высокой общей проходимости имплантов, равной 93%.
Морфометрический анализ динамики заселения матрицы клетками показал, что на всех сроках наблюдения во внешней половине стенки матрицы число клеток превалирует, что свидетельствует о миграции клеток в более глубокие слои из соединительнотканной капсулы, окружающей матрицу. Значимые изменения структуры неомедии начинаются со срока 12 нед., когда регистрируются первые признаки биорезорбции волокон полимера. Стенка матрицы с этого момента состоит как из полимерных волокон, так и клеток, в основном макрофагов и фибробластов. В дальнейшем в стенке матрицы происходит два параллельных процесса: биорезорбция волокон ПЛА и образование соединительной ткани. В резорбции волокон полимера отмечается значимая динамика, начиная со срока 24 нед., выявляется фрагментация волокон, к 48 нед. происходит субтотальная биорезорбция волокон, которые к этому моменту представлены лишь фрагментами и полностью окружены соединительной тканью. Полная биорезорбция волокон определяется через 64 нед. после имплантации. К этому моменту стенка импланта состоит только из соединительной ткани. Таким образом, после полной биорезорбции волокон матрицы в зоне реконструкции остается имплант, на внутренней поверхности которого определяется сформированная неоинтима, аналогичная нативной, стенка же выполнена слабоструктурированной соединительной тканью. Поэтому на данном сроке эксперимента у всех экспериментальных животных в зоне реконструкции обнаружены аневризматические расширения, не приведшие, тем не менее, к разрыву импланта. Однако в дальнейшем необходимо разработать метод укрепления стенки матрицы с целью предотвращения развития подобных осложнений.
Из полученных результатов можно сделать вывод, что матрица из микроволокон ПЛА, полученная методом электроформования, является перспективной и может быть рекомендована для клинического использования в качестве тканеинженерного сосудистого импланта.
Список литературы
Бикбов Б.Т., Томилина Н.А. 2011. Состояние заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998–2007 г. (Аналитический отчет по данным Российского регистра заместительной почечной терапии). Нефрология и диализ. Т. 13. № 3. С. 150. (Bikbov B.T., Tomilina N.A. 2011. The status of substitution therapy for patients with chronic renal failure in the Russian Federation in 1998–2007 (Analytical report according to the Russian Register of Renal Replacement Therapy). Nephrol. dialysis. V. 13. № 3. P. 150.)
Acland R.D. 1972. Signs of patency in small vessel anastomosis. Surgery. V. 72. P. 744–748.
Drews J.D., Miyachi H., Shinoka T. 2017. Tissue-engineered vascular grafts for congenital cardiac disease: Clinical experience and current status. Trends Cardiovasc. Med. V. 27 P. 521–531.
Fukunishi T., Best C.A., Sugiura T., Opfermann J., Ong C.S., Shinoka T., Breuer C.K., Krieger A., Johnson J., Hibino N. 2017. Preclinical study of patient-specific cell-free nanofiber tissue-engineered vascular grafts using 3-dimensional printing in a sheep model. J. Thorac. Cardiovasc. Surg. V. 153. P. 924–932.
Harskamp R.E., Lopes R.D., Baisden C.E., De Winter R.J., Alexander J.H. 2013. Saphenous vein graft failure after coronary artery bypass surgery: pathophysiology, management, and future directions. Annals Surgery. V. 257. P. 824–833.
Klinkert P., Post P.N., Breslau P.J., van Bockel J.H. 2004. Saphenous vein versus PTFE for above-knee femoropopliteal bypass. A review of the literature. Eur. J. Vasc. Endovasc. Surg. V. 27. P. 357–362.
Konig G., McAllister T.N., Dusserre N., Garrido S.A., Iyican C., Marini A., Fiorillo A., Avila H., Wystrychowski W., Zagalski K., Maruszewski M., Jones A.L., Cierpka L., de la Fuente L.M., L’Heureux N. 2009. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. V. 30. P. 1542–1550.
L’Heureux N., Dusserre N., Konig G., Victor B., Keire P., Wight T.N., Chronos N.A., Kyles A.E., Gregory C.R., Hoyt G., Robbins R.C., McAllister T.N. 2006. Human tissue-engineered blood vessels for adult arterial revascularization. Nat. Med. V. 12. P. 361–365.
Norotte C., Marga F.S., Niklason L.E., Forgacs G. 2009. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. V. 11. P. 35–38.
Popryadukhin P.V., Popov G.I., Yukina G.Yu., Dobrovolskaya I.P., Ivan’kova E.M., Vavilov V.N. Yudin V.E. 2017. Tissue-engineered vascular graft of small diameter based on electrospun polylactide microfibers. Int. J. Biomater. Article ID 9 034 186. https://doi.org/10.1155/2017/9034186
Row S., Santandreu A., Swartz D.D., Andreadis S.T. 2017. Cell-free vascular grafts: Recent developments and clinical potential. Technol. (Singap. World Sci.). V. 5. P. 13–20.
Shinoka T., Breuer C. 2008. Tissue-engineered blood vessels in pediatric cardiac surgery. Yale J. Biol. Med. V. 81. P. 161–166.
Smith R.J.Jr., Yi T., Nasiri B., Breuer C.K., Andreadis S.T. 2019. Implantation of VEGF-functionalized cell-free vascular grafts: regenerative and immunological response. FASEB J. V. 33. P. 5089–5100.
Sullivan S.J., Brockbank K.G.M. 2000. Small-diameter vascular grafts. In: Principles of tissue engineering. N.-Y.: Academic Press. P. 447–453.
Tara S., Kurobe H., Rocco K.A., Maxfield M.W., Best C.A., Yi T., Naito Y., Breuer C.K., Shinoka T. 2014. Well-organized neointima of large-pore poly(L-lactic acid) vascular graft coated with poly(L-lactic-co-ε-caprolactone) prevents calcific deposition compared to small-pore electrospun poly(L-lactic acid) graft in a mouse aortic implantation model. Atherosclerosis. V. 237. P. 684–691.
Vaz C.M., van Tuijl S., Bouten C.V., Baaijens F.P. 2005. Design of scaffolds for blood vessel tissue engineering using a multi-layering electrospinning technique. Acta Biomater. V. 1. P. 575–582.
Watanabe T., Kanda K., Ishibashi-Ueda H., Yaku H., Nakayama Y. 2010. Autologous small-caliber ‘‘biotube’’ vascular grafts with argatroban loading: A histomorphological examination after implantation to rabbits. J. Biomed. Mater. Res. B Appl. Biomater. V.92. P. 236–242.
Zhao Y., Zhang S., Zhou J., Wang J., Zhen M., Liu Y., Chen J., Qi Z. 2010. The development of a tissue-engineered artery using decellularized scaffold and autologous ovine mesenchymal stem cells. Biomaterials. V. 31. P. 296–307.
Дополнительные материалы отсутствуют.


