Цитология, 2020, T. 62, № 1, стр. 24-31
Активность микро- и астроглии в вентро-латеральном ядре спинного мозга после повреждения седалищного нерва крыс
А. А. Старинец 1, 2, Е. Л. Егорова 1, 2, А. А. Тыртышная 1, И. В. Дюйзен 1, А. Н. Барышев 1, И. В. Манжуло 1, *
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, Россия
* E-mail: i-manzhulo@bk.ru
Поступила в редакцию 04.10.2019
После доработки 15.10.2019
Принята к публикации 16.10.2019
Аннотация
Повреждение седалищного нерва сопровождается активацией воспалительных процессов в нервных волокнах и поясничном сегменте спинного мозга и способствует развитию нейропатического болевого синдрома. В нашем исследовании лигирование и перерезка седалищного нерва приводят к местному воспалительному ответу, выражающемуся в набухании и повреждении нервных волокон и нарушению иннервации периферических тканей. Одновременно с этим, наблюдается увеличение активности микро- и астроглии в вентро-латеральном ядре поясничного сегмента (L4–L6) спинного мозга, при этом происходит инкапсуляция мотонейронов клетками микроглии. В то же время, нейродегенерация мотонейронов наблюдается только после перерезки седалищного нерва. Таким образом, результаты настоящего исследования свидетельствуют об активном участии моторного ядра спинного мозга в патофизиологическом процессе после повреждения седалищного нерва.
Около 10% населения Земли страдает от нейропатической боли, вызванной различными травмами центральной и периферической нервной системы. Развитие нейропатического болевого синдрома приводит к снижению качества жизни, а также к серьезным социальным и психофизиологическим расстройствам (Hecke et al., 2014).
Повреждение периферического нерва сопровождается потерей связи аксонов с периферической тканью, при этом восстановление проводимости происходит путем регенерации поврежденных нервных волокон (Camara-Lemarroy et al., 2010). Для успешной регенерации нейроны должны выжить и запустить программу повторного роста, которая приведет к удлинению аксонов и пластическим изменениям в нейрональной сети. Успешность регенерации зависит от взаимодействия между нейронами и соседними глиальными клетками, которое опосредовано экспрессией молекул субстратной и клеточной адгезии, а также несколькими трофическими факторами, секретируемыми во внеклеточное пространство (Allodi et al., 2012). В наших предыдущих исследованиях установлено, что лигирование седалищного нерва приводит к активации нейро-глиальных элементов не только в дорсальных, но и в вентральных рогах спинного мозга (Manzhulo et al., 2015, 2016, 2017), при этом роль активированных астро- и микроглиоцитов в передних рогах спинного мозга в условиях периферической нейротравмы неоднозначна (Hu et al., 2007; Brownjohn, Ashton, 2012). Известно, что дорсальные и вентральные рога спинного мозга имеют совершенно разные морфологические и функциональные профили. Дорсальный рог содержит интернейроны и принимает сенсорные сигналы от периферического нерва, тогда как вентральный рог представлен мотонейронами, аксоны которых передают двигательную информацию иннервируемой конечности (Terayama et al., 2016). Однако открытым остается вопрос, какую роль в развитии и поддержании нейропатического болевого синдрома играет вентро-латеральное ядро спинного мозга.
Астроциты и микроглиоциты, с точки зрения современных представлений, являются неотъемлемой структурной, метаболической и функциональной частью любого синапса (Hu et al., 2007; Pannell et al., 2016). При повреждении нервных волокон клетки микроглии экспрессируют интерлейкин-1β (IL-1β), который является сильным митогенным фактором для астроцитов и стимулирует их к выработке различных нейротрофинов; отсутствие IL-1β приводит к нарушению процесса ремиелинизации (Mason et al., 2001). В предыдущих исследованиях установлено, что активированная микроглия имеет двойственную функциональную организацию и представлена как провоспалительной (М1-тип), так и противовоспалительной (М2-тип) популяциями клеток (Коржевский и др., 2012; Kobayashi et al., 2013). В то же время, реализация фагоцитарной активности микроглиальными клетками многими авторами рассматривается как важный элемент восстановления и репарации тканей после повреждения (Liao et al., 2012).
В настоящем исследовании мы охарактеризовали активность глиальных клеток и процессы дегенерации мотонейронов в вентро-латеральном ядре спинного мозга после повреждения седалищного нерва.
МАТЕРИАЛ И МЕТОДИКА
Настоящее исследование выполнено на самцах крыс линии Wistar (240 ± 20 г, возраст 3 мес.). Животных содержали в клетке со свободным доступом к еде и воде при постоянной температуре (23 ± 2°С) и влажности (55 ± 15%) с 12-часовым циклом свет/темнота (освещение в 7.00 утра). Все процедуры были одобрены Комитетом по этике Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН и соответствуют рекомендациям по защите лабораторных животных.
Животные (n = 15) были разделены на 3 группы. Для формирования модели нейропатической боли проводили лигирование седалищного нерва (n = 5), как описано ранее (Bennett, Xie, 1988). Вкратце, крыс анестезировали с помощью ингаляционного анестетика изофлуран (Baxter, США) с использованием наркозного аппарата (Anesthesia Systems (Harvard Apparatus), США), затем производили продольный разрез кожи бедра правой задней лапы, раздвигали мышечную ткань и изолировали седалищный нерв, а затем накладывали три свободные шелковые лигатуры (Ethicon, США) с интервалом 1–2 мм. Вторую группу крыс (n = 5) анестезировали, затем седалищный нерв правой задней лапы перерезали на 5 мм выше трифуркации. Третья группа крыс (n = 5) подверглась всем описанным операционным воздействиям, но без повреждения нерва.
Оценка холодовой аллодинии и термической гипералгезии. Холодовую аллодинию оценивали путем тестирования животных на холодной пластине Hot/Cold Plate (Columbus Instruments, США), состоящей из камеры с акриловыми стенками высотой 30 см и металлической пластины 30 × 30 см, поддерживающей температуру 0°C. Первый рефлекс сгибания денервированной конечности считался ноцицептивной конечной точкой. Термическая гипералгезия оценивалась с помощью тестера Tail Flick Test (Life Science, США), который генерирует горячий световой луч, сфокусированный на хвосте крысы. Оценивали латентный период до отдергивания хвоста. Тестирование проводили ежедневно после операции, и каждое животное тестировали три раза с интервалом 5 мин. Чтобы избежать повреждения ткани, максимальное время тестирования не превышало 60 с для холодовой аллодинии и 20 с для теста отдергивания хвоста.
Гистологические и иммуногистохимические исследования. Поврежденный седалищный нерв и поясничный сегмент спинного мозга для гистологического и иммуногистохимического исследования извлекали через две недели после операции. Крыс анестезировали изофлураном и перфузировали транскардиально холодным 0.1 М фосфатным буфером, рН 7.2, а затем холодным 4%-ным параформальдегидом, приготовленном на 0.1 М фосфатном буфере, рН 7.2. Дистальный сегмент поврежденного седалищного нерва и поясничный сегмент спинного мозга (L4–L6) немедленно извлекали и фиксировали в течение 6 ч при 4°C в свежем забуференном 4%-ном параформальдегиде. Седалищный нерв заливали в парафин по стандартной методике и готовили срезы на ротационном микротоме (MicroTec, Германия), а поясничный сегмент спинного мозга помещали в среду для криопротекции (NEG 50, Thermo Scientific, США), затем получали срезы на криомикротоме Leica EMFC6 (Leica, Великобритания).
Парафиновые срезы седалищного нерва (7 мкм) после депарафинирования окрашивали гемотаксилин-эозином по стандартной методике, для проведения иммунопероксидазной реакции срезы инкубировали в 3%-ной перекиси водорода для блокирования эндогенной пероксидазы. После трех промывок в 0.1 М фосфатном буфере (рН 7.2) срезы обрабатывали в течение 60 мин 2%-ным раствором бычьего сывороточного альбумина (Santa Cruz, SC-2323, США) и 0.25%-ного Тритона Х-100 (Gerbu, США). Шванновские клетки картировали с помощью антител к белку S100β (1 : 2000, Abcam ab868, США), срезы инкубировали в течение ночи при 4°С с первичными антителами. После трех промывок в 0.1 М фосфатном буфере (рН 7.2) вторичные антитела, конъюгированные с пероксидазой хрена, использовали в соответствии с инструкциями производителя (1 : 100, Vector Laboratories PI-1000, США). Затем, после промывки срезы обрабатывали в течение 10 мин хромогеном (Thermo Scientific, TL-060-QHD, США), докрашивали гематоксилином, обезвоживали и заключали в монтирующую среду (Dako, CS705, США). Изображения получали с помощью сухого объектива 20 × NA 0.45 (Plan-Apochromat, Carl Zeiss, Германия) на микроскопе (Axio Image Z2, Carl Zeiss, Германия), оборудованном CCD-камерой (AxioCam, HRc, Carl Zeiss, Германия).
Совместную локализацию микроглии и астроглии в вентро-латеральном ядре спинного мозга визуализировали с помощью антител к Iba-1 (1 : 1000, Abcam ab108539, США) и GFAP (1 : 500, Vector Laboratories VP-G805, США), соответственно. Вторичные антитела, конъюгированные с флуорохромами, (Abcam, США; ab150077, против иммуноглобулинов кролика; ab150108, против иммуноглобулинов мыши) использовали в соответствии с инструкциями производителя в разведении 1 : 500. Перед иммуногистохимическим окрашиванием срезы поясничного сегмента спинного мозга (40 мкм) обрабатывали в течение 60 мин в 10%-ном растворе бычьего сывороточного альбумина (Santa Cruz, США) и 0.25%-ного Тритона Х-100 (Gerbu, США). Затем срезы инкубировали с первичными антителами во влажной камере при 4°С в течение 24 ч. Препараты отрицательного контроля инкубировали без первичных антител. После трех промывок срезы инкубировали в растворе флуоресцентных вторичных антитела в течение 1 ч при комнатной температуре. После промывки срезы заключали в монтирующую среду с DAPI (Abcam, США, ab104139).
Для выявления дегенерации нейронов в вентро-латеральном ядре спинного мозга использовали Fluoro-Jade C (FJC) с одновременным выявлением микроглии или астроглии с помощью антител к Iba-1 (1 : 1000, Abcam ab108539, США) и GFAP (1 : 500, Vector Laboratories VP-G805, США). Вторичные антитела, конъюгированные с флуорохромами (Abcam, США; ab150088, против иммуноглобулинов кролика; ab150108, против иммуноглобулинов мыши), использовали в соответствии с инструкциями производителя в разведении 1 : 500. Иммуногистохимическое окрашивание проводили в соответствии с ранее описанной процедурой. После промывки от вторичных антител срезы инкубировали в 0.06%-ном растворе перманганата калия в течение 3 мин, а затем дважды промывали в дистиллированной воде и инкубировали с 0.0002% раствором FJC (Sigma-Aldrich, США, AG325), приготовленном на 0.1%-ной уксусной кислоте. После промывки срезы заключали в монтирующую среду с DAPI (Abcam ab104139, США). Препараты исследовали с помощью конфокального лазерного сканирующего микроскопа LSM 780 (Carl Zeiss, Германия).
Анализ изображений. Площадь окрашивания S100β-позитивных Шванновских клеток седалищного нерва, а также Iba-1-позитивной микроглии и GFAP-позитивных астроцитов в вентро-латеральном ядре спинного мозга определяли с использованием программного обеспечения ImageJ (NIH, США). Для анализа использовали не менее 50 микрофотографий для каждой группы животных, по 10 микрофотографий для каждой крысы. Проводили подсчет площади окрашивания исследуемых клеточных структур от общей площади дистального сегмента седалищного нерва и вентро-латерального ядра спинного мозга. Полученные данные подвергались статистическому анализу с использованием однофакторного дисперсионного анализа ANOVA с последующим многократным сравнительным тестом Тьюки. Данные выражались как среднее ± SEM, а Р < 0.05 принимали как статистически значимое. Все статистические тесты проводили с использованием программного обеспечения GraphPad Prism 4.00.
РЕЗУЛЬТАТЫ
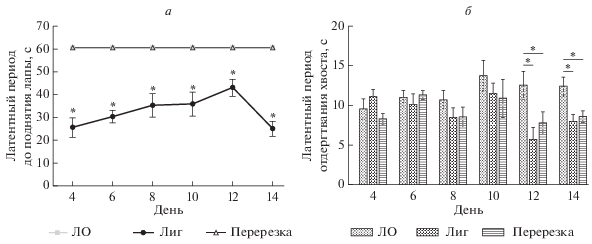
В группе животных с лигированием седалищного нерва наблюдалось развитие холодовой аллодинии, которое выражалось в уменьшении времени контакта денервированной конечности с холодной пластиной. Холодовую аллодинию измеряли на 4-е (25.6 ± 4.3 с), 6-е (30.4 ± 2.6 с), 8-е (33.1 ± 5.2 с), 10-е (34.21 ± 5 с), 12-е (43.8 ± 3.5 с) и 14-е (25.7 ± 3 с) сут после операции. Холодовая аллодиния не развивалась у животных с перерезкой седалищного нерва и ложнооперированных крыс (рис. 1а). Термическую гипералгезию измеряли с помощью теста на отдергивание хвоста, который не показал значительных различий между тремя группами животных через 4–10 сут после операции. Однако на 12-е сут после операции наблюдалось снижение латентного периода в группах с лигированием (5.6 ± 1.6 с) и перерезкой (7.8 ± 1.4 с) седалищного нерва по сравнению с ложнооперированными животными (12.5 ± 1.7 с). На 14-е сут наблюдения время отдергивания хвоста снижалось до 7.9 ± 0.9 с при лигировании и 8.5 ± 0.7 с при перерезке нерва по сравнению с ложнооперированными животными (12.3 ± 1.1 с) (рис. 1б).
Рис. 1.
Развитие холодовой аллодинии (а) и термической гипералгезии (б) в разных группах животных. Данные представлены в виде среднее ± SEM, *обозначены статистически достоверные различия между группами (P < 0.05).
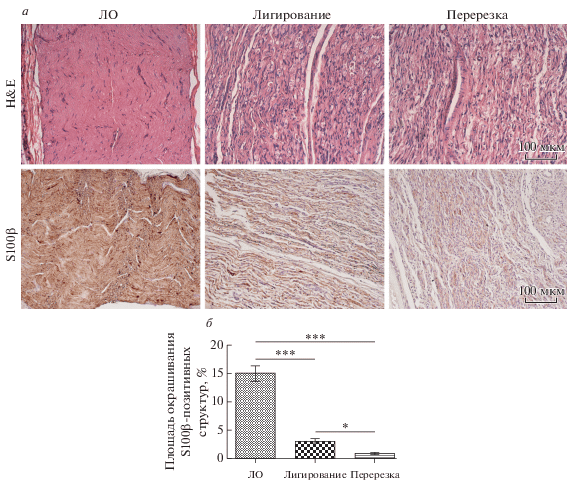
При окрашивании препаратов седалищного нерва гематоксилин-эозином у ложнооперированных крыс наблюдается сохранная морфологическая структура седалищного нерва, тогда как повреждение нервного ствола сопровождается увеличением диаметра нервных волокон, отечностью и инфильтрацией воспалительных клеток (рис. 2а). К 14-м сут после операции площадь окрашивания S100β-позитивных Шванновских клеток значительно снижается в группе с лигированием (3.1 ± 0.3%) и перерезкой (0.8 ± 0.2%) седалищного нерва, по сравнению с ложнооперированными животными (15 ± 1.3%) (рис. 2а, 2б).
Рис. 2.
Морфология седалищного нерва (а, верхний ряд) и распределение S100β-позитивных Шванновских клеток в дистальном сегменте седалищного нерва экспериментальных животных (а, нижний ряд). H&E – окраска гематоксилин-эозином, S100β – иммуногистохимическое выявление белка S100β. б – Динамика изменения площади S100β-позитивных Шванновских клеток. Данные представлены как среднее ± SEM, звездочками обозначены статистически достоверные различия между группами: *P < 0.05, ***P < 0.001.
Типичной реакцией астроцитов на повреждение (травмы, ишемические и геморрагические инсульты) является астроглиоз, морфо-химическим проявлением которого принято считать увеличение активности глиального фибриллярного кислого белка (GFAP) (Donegan et al., 2013). Площадь окрашивания GFAP-позитивной астроглии в вентро-латеральном ядре спинного мозга ложнооперированных крыс составляет 3.5 ± 0.5%, что значительно ниже, чем после лигирования (8.3 ± 1%) или перерезки (14.1 ± 1.1%) седалищного нерва (рис. 3а, б).
Рис. 3.
Совместная локализация GFAP-позитивной астроглии (красный) и Iba-1-позитивной микроглии (зеленый) в вентро-латеральном ядре спинного мозга крыс из разных экспериментальных групп (а). Клеточные ядра окрашены DAPI (синий). б, в – Динамика изменения площади Iba-1-позитивных клеток (б) и GFAP-позитивных клеток (в). Данные представлены в виде среднее ± SEM, звездочками обозначены статистически достоверные различия между группами: **P < 0.01, ***P < 0.001.
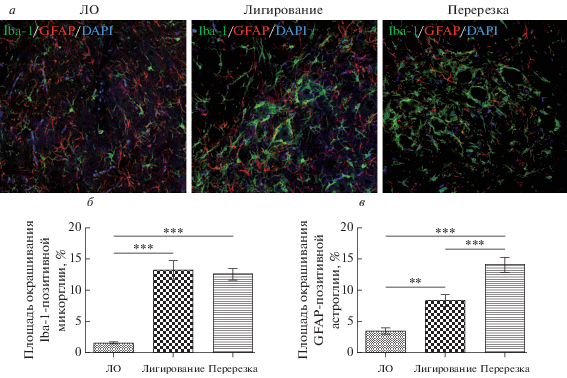
В норме Iba-1-позитивные микроглиальные клетки имеют небольшое клеточное тело (9–12 мкм) с несколькими тонкими, длинными маловетвящимися отростками. Травма седалищного нерва сопровождается ретракцией отростков и гипертрофией клеточных тел микроглиоцитов спинного мозга (Pannell et al., 2016). Через 14 сут после операции площадь окрашивания Iba-1-позитивной микроглии составляет 13.2 ± 1.5 и 12.6 ± 0.9% после лигирования и перерезки седалищного нерва соответственно, что в несколько раз превышает данный показатель в группе ложнооперированных животных (1.6 ± 0.2%) (рис. 3а, б).
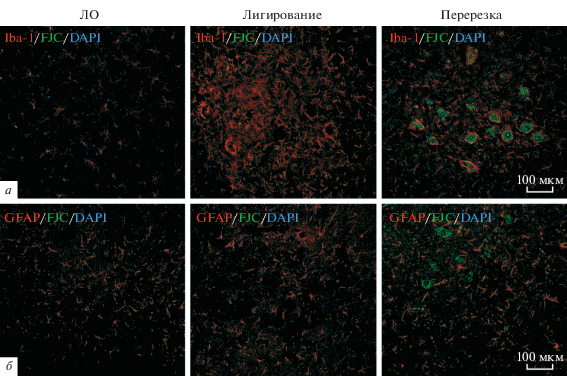
Инкапсуляция мотонейронов микроглиальными клетками наблюдается во всех моделях нейротравмы (рис. 3а). В тоже время дегенерация мотонейронов происходит только после перерезки седалищного нерва, при этом основная часть дегенеративных нейронов находится внутри микроглиальных муфт (рис. 4).
Рис. 4.
Совместная локализация Iba-1-позитивной микроглии (красный) и клеток, окрашенных FJC (зеленый) (а), совместная локализация GFAP-позитивной астроглии (красный) и клеток, окрашенных FJC (зеленый) (б) в вентро-латеральном ядре спинного мозга у животных из разных экспериментальных групп. Клеточные ядра окрашены DAPI (синий).
ОБСУЖДЕНИЕ
Повреждение седалищного нерва сопровождается появлением ряда патологических симптомов, поддающихся количественной оценке и свидетельствующих об интенсивности болевого процесса (Nakazato-Imasato, Kurebayashi, 2009). В нашем исследовании холодовая аллодиния возникает на 4-е сут после лигирования седалищного нерва, регистрируется в течение 14 сут и имеет тенденцию к постепенному снижению выраженности. В тоже время, перерезка седалищного нерва приводит к полной денервации поврежденной конечности, при этом холодовая аллодиния не развивается. Однако при лигировании и перерезке седалищного нерва наблюдается развитие термической гипералгезии к 12–14-м сут эксперимента, что указывает на развитие болевой реакции даже при полном отсутствии чувствительности поврежденной конечности. Полученные данные соответствуют ранее проведенным исследованиям, так, повреждение седалищного нерва у крыс сопровождается развитием термической аллодинии, спонтанного болевого поведения и формированием асимметрии в распределении веса (Nakazato-Imasato, Kurebayashi, 2009; Manzhulo et al., 2016).
Периферическая нейротравма сопровождается местной воспалительной реакцией, приводящей к отеку, дезорганизации нервных волокон и нарушению иннервации периферических тканей (Terayama et al., 2016). При морфологическом исследовании дистального сегмента поврежденного седалищного нерва наблюдается образование новых кровеносных сосудов, инфильтрация моноцитами, нейтрофилами, фибробластами и кровоизлияния в область воспаления. При перерезке седалищного нерва в дистальном сегменте наблюдается практически полная деградация S100β-позитивных Шванновских клеток.
Активация глиальных клеток центральной нервной системы необходима для посттравматической пластичности нейронов и сопровождается экспрессией сигнальных медиаторов, в том числе провоспалительных цитокинов, которые повышают болевую гиперчувствительность (Terayama et al., 2016). Астро- и микроглиоциты секретируют различные провоспалительные медиаторы, такие как TNF-α, IL-1β, IL-6 (Kiguchi et al., 2010), способствуя развитию аллодинии и гипералгезии (Watkins et al., 1995). Наши данные демонстрируют, что иммунореактивность GFAP в вентро-латеральном моторном ядре спинного мозга после лигирования почти вдвое более интенсивна, чем у ложнооперированных животных, но значительно ниже, чем после перерезки седалищного нерва. Полученные данные подтверждают результаты других исследователей об активации астроглии на 7-е сут после лигирования и перерезки седалищного нерва (Hu et al., 2007). При этом активация астроцитов в вентральном роге необходима для регенерации и функционального восстановления поврежденных периферических нервов. Ингибирование астроглиоза приводит к задержке восстановления нерва и снижению уровня экспрессии нейротрофинов (Qian et al., 2018).
Микроглиальная инкапсуляция мотонейронов ранее наблюдалась на 7-е сут после лигирования седалищного нерва (Brownjohn, Ashton, 2012). По нашим данным, инкапсуляция мотонейронов все еще сохраняется к 14-м сут после операции. Площадь окрашивания Iba-1-позитивной микроглии в ипсилатеральном вентральном роге значительно увеличивается после травмы, в сравнении с ложнооперированными животными, но достоверные различия между двумя моделями нейротравмы не зафиксированы. В предыдущих исследованиях повышение экспрессии OX-42-позитивной микроглии в вентро-латеральном ядре спинного мозга также не отличалось после лигирования и перерезки седалищного нерва (Hu et al., 2007). Однако, после лигирования площадь окрашивания ED1 (маркер провоспалительной микроглии) в вентро-латеральном ядре спинного мозга была примерно вдвое больше, чем после перерезки нерва. Таким образом, авторы пришли к выводу, что лигирование вызывает адаптивный иммунный ответ в передних рогах спинного мозга, который не возникает после перерезки (Hu et al., 2007). При этом на сегодняшний день, нейро-глиальные взаимодействия в вентро-латеральном ядре спинного мозга и роль микроглиальных клеток в выживании мотонейронов после периферической нейротравмы не до конца понятна.
Ранее показано, что Fluoro-Jade C является одним из наиболее чувствительных флуоресцентных маркеров нейродегенерации (Schmued et al., 2005). По нашим данным, полученным после окрашивания срезов поясничного отдела спинного мозга с помощью FJC, дегенерация мотонейронов наблюдается только после перерезки седалищного нерва и сопровождается повышенной активностью астро- и микроглиальных клеток в вентро-латеральном ядре спинного мозга.
Полученные результаты свидетельствуют об активном участии двигательных нейронов в патофизиологическом процессе после повреждения седалищного нерва, при этом клеточные тела мотонейронов с поврежденными аксонами вероятно экспрессируют сигнальные молекулы, которые модулируют пластичность глиальных клеток в зависимости от тяжести повреждения периферического нерва.
Список литературы
Коржевский Д.Э., Кирик О.В., Сухорукова Е.Г., Власов Т.Д. 2012. Структурная организация микроглиоцитов стриатума после транзиторной фокальной ишемии. Морфология. Т. 141. № 2. С. 28. (Korzhevskiǐ D.E., Lentsman M.V., Kirik O.V., Otellin V.A. 2012. Morphological types of activated microglia in the hippocampus observed following transient total brain ischemia. Morfologii. V. 142. № 2. P. 30.)
Allodi I., Udina E., Navarro X. 2012. Specificity of peripheral nerve regeneration: interactions at the axon level. Prog. Neurobiol. V. 98. P. 16.
Bennett G.J., Xie Y.K. 1988. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. V. 33. P. 87.
Brownjohn P.W., Ashton J.C. 2012. Microglial encapsulation of motor neurons in models of neuropathic pain: A confound in pain assessment? Eur. J. Pain. V. 16. P. 459.
Camara-Lemarroy C.R., Guzman-de la Garza F.J., Fernandez-Garza N.E. 2010. Molecular inflammatory mediators in peripheral nerve degeneration and regeneration. Neuroimmunomodulation. V. 17. P. 314.
Donegan M., Kernisant M., Cua C., Jasmin L., Ohara P.T. 2013. Satellite glial cell proliferation in the trigeminal ganglia after chronic constriction injury of the infraorbital nerve. Glia. V. 61. P. 2000.
Hecke O., Austin S.K., Khan R.A., Smith B.H., Torrance N. 2014. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. V. 155. P. 654.
Hu P., Bembrick A.L., Keay K.A., McLachlan E.M. 2007. Immune cell involvement in dorsal root ganglia and spinal cord after chronic constriction or transection of the rat sciatic nerve. Brain Behav. Immun. V. 21. P. 599.
Kiguchi N., Maeda T., Kobayashi Y., Fukazawa Y., Kishioka S. 2010. Macrophage inflammatory protein-1alpha mediates the development of neuropathic pain following peripheral nerve injury through interleukin-1beta up-regulation. Pain. V. 149. P. 305.
Kobayashi K., Imagama S., Ohgomori T., Hirano K., Uchimura K., Sakamoto K., Hirakawa A., Takeuchi H., Suzumura A., Ishiguro N., Kadomatsu K. 2013. Minocycline selectively inhibits M1 polarization of microglia. Cell Death Dis. V. 4. P. 1.
Liao B., Zhao W., Beers D.R., Henkel J.S., Appel S.H. 2012. Transformation from a neuroprotective to a neurotoxic microglial phenotype in a mouse model of ALS. Exp. Neurol. V. 237. P. 147.
Manzhulo I.V. Ogurtsova O.S., Tyrtyshnaia A.A., Dyuizen I.V. 2017. Neuro-microglial interactions in the spinal centers of pain modulation in the neuropathic pain syndrome. Neurochemical J. V. 11. P. 161.
Manzhulo I.V., Ogurtsova O.S., Kipryushina Yu.O., Latyshev N.A., Kasyanov S.P., Dyuizen I.V., Tyrtyshnaia A.A. 2016. Neuron-astrocyte interactions in spinal cord dorsal horn in neuropathic pain development and docosahexaenoic acid therapy. J. Neuroimmunol. V. 298. P. 90.
Manzhulo I.V., Ogurtsova O.S., Lamash N.E., Latyshev N.A., Kasyanov S.P., Dyuizen I.V. 2015. Analetic effect of docosahexaenoic acid is mediated by modulating the microglia activity in the dorsal root ganglia in a rat model of neuropathic pain. Acta Histochem. V. 117. P. 659.
Mason P. 2001. Contributions of the medullary raphe and ventromedial reticular region to pain modulation and other homeostatic functions. Annu. Rev. Neurosci. V. 24. P. 737.
Nakazato-Imasato E., Kurebayashi Y. 2009. Pharmacological characteristics of the hind paw weight bearing difference induced by chronic constriction injury of the sciatic nerve in rats. Life Sci. V. 84. P. 622.
Pannell M., Labuz D., Celik M.Ö., Keye J., Batra A., Siegmund B., Machelska H. 2016. Adoptive transfer of M2 macrophages reduces neuropathic pain via opioid peptides. J. Neuroinflamm. V. 13. P. 262.
Qian C., Tan D., Wang X., Li L., Wen J., Pan M., Li Y., Wu W., Guo J. 2018. Peripheral nerve injury-induced astrocyte activation in spinal ventral horn contributes to nerve regeneration. Neural. Plast. 2018: 8561704.
Schmued L.C., Stowers C.C., Scallet A.C., Xu L. 2005. Fluoro-Jade C results in ultrahigh resolution and contrast labeling of degenerating neurons. Brain Research. V. 1035. P. 24.
Terayama R., Yamamoto Y., Kishimoto N., Tabata M., Maruhama K., Iida S., Sugimoto T. 2016. Differential changes in neuronal excitability in the spinal dorsal horn after spinal nerve ligation in rats. Neurochem. Res. V. 41. P. 2880.
Watkins L.R., Goehler L.E., Relton J., Brewer M.T., Maier S.F. 1995. Mechanisms of tumor necrosis factor-alpha (TNF-α) hyperalgesia. Brain Res. V. 692. P. 244.
Дополнительные материалы отсутствуют.


