Цитология, 2020, T. 62, № 10, стр. 716-725
Внеядерные функции негистонового белка HMGB1
Е. В. Чихиржина 1, *, А. М. Поляничко 1, **, Т. Ю. Старкова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: e.chikhirzhina@incras.ru
** E-mail: a.polyanichko@incras.ru
Поступила в редакцию 09.07.2020
После доработки 17.07.2020
Принята к публикации 18.07.2020
Аннотация
Негистоновый хромосомный белок HMGB1 является одним из самых распространенных белков хроматина эукариот. Этот белок участвует в рекомбинации, транскрипции, репарации и других ключевых процессах, обеспечивающих функционирование ДНК в клеточном ядре. Вместе с тем, HMGB1 выполняет целый ряд важных функций за пределами ядра клетки. В обзоре рассматриваются механизмы выхода белка из клеточного ядра, а также основные внеядерные и внеклеточные функции HMGB1.
Негистоновый белок HMGB1 принадлежит к обширному семейству белков с высокой электрофоретической подвижностью (от англ. high mobility group). Его отличительной чертой является наличие структурно-консервативного HMGB-домена, обладающего ДНК-связывающей активностью. Мотивы, гомологичные HMGB-домену белка HMGB1, выступают в качестве ДНК-связывающих элементов во многих транскрипционных факторах (Stros, 2010; Reeves, 2015). HMGB1 известен, прежде всего, как ядерный белок, который взаимодействует с межнуклеосомным (линкерным) участком ДНК (Joshi et al., 2012; Чихиржина и др., 2020). Связывание HMGB1 с линкерной ДНК приводит к сильному изгибу двойной спирали в месте связывания, что облегчает функционирование на ДНК различных белков и их комплексов, в том числе различных транскрипционных факторов (Stros, 2010; Reeves, 2015).
Белок HMGB1 не проявляет специфичности к последовательности ДНК в месте связывания (Thomas, Travers, 2001; Reeves, 2015). Однако, как и другие представители семейства, HMGB1 демонстрирует высокое сродство к участкам ДНК с различными структурными нарушениями, такими как изгибы и изломы двойной спирали ДНК, суперспиральные состояния ДНК, различные перекрестные структуры, в том числе структуры типа Хиазмы Холлидея (Totsingan, Bell, 2013) и т.п. Кроме того, этот белок принимает активное участие в таких процессах, как репарация, транскрипция и репликация (Reeves, 2015). Вместе с тем, не так давно было обнаружено, что белок HMGB1 активно функционирует и вне клеточного ядра (Reeves, 2015; Raucci et al., 2019). В цитоплазме HMGB1 регулирует аутофагию и апоптоз (Zhu et al., 2015), а присутствие HMGB1 во внеклеточном пространстве напрямую связано с нарушением целостности клетки и участием белка в передаче сигналов иммунного ответа, воспаления и регенерации ткани (Venereau et al., 2012; Raucci et al., 2019). На сегодняшний день имеется большое количество работ, в которых подробно рассмотрены ядерные функции белка (см., например, обзоры Reeves, 2015; Kozlova et al., 2018). Вместе с тем, несмотря на растущее число публикаций, посвященных внеядерным функциям HMGB1, в целом они остаются сильно разрозненными и практически не систематизированными. В своем кратком обзоре мы постарались обобщить имеющиеся на сегодняшний день данные об основных внеядерных функциях белка HMGB1.
СТРУКТУРА БЕЛКА HMGB1
Белок HMGB1 человека состоит из 215 аминокислотных остатков. В его третичной структуре выделяют два ДНК-связывающих домена (HMGB-домены А и В; рис. 1), короткий N-концевой участок и неупорядоченный отрицательно заряженный С-концевой фрагмент. Последний включает в себя непрерывную последовательность остатков глютаминовой и аспарагиновой аминокислот (Bustin, Reeves, 1996). Считается, что С-концевой фрагмент выполняет регуляторную функцию: его удаление или инактивация приводят к связыванию с ДНК одновременно двух HMGB-доменов, тогда как в норме в образовании ДНК−белкового комплекса задействован лишь один HMGB-домен (Teo et al., 1995; Polyanichko et al., 2002, 2008; Chikhirzhina et al., 2002, 2010; Stott et al., 2010). Согласно данным ядерно-магнитного резонанса и рентгеноструктурного анализа примерно 80% полипептидной цепи в доменах А и В находится в α-спиральной конформации (Read et al., 1993; Broadhurst et al., 1995; Hardman et al., 1995).
Рис. 1.
Структура ДНК-связывающих доменов (Box) А и В негистонового белка HMGB1 с указанием положения остатков цистеина (С) в положениях 23, 45 и 106. Рисунок сформирован на основе данных базы Protein Data Base (http://www.rcsb.org/structure/2YRQ).
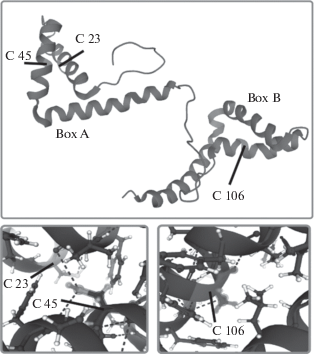
В структуре каждого HMGB-домена можно выделить три α-спиральных участка, образующие Г-образную структуру, плечи которой (с размерами 3.1 и 3.6 нм) располагаются под углом 70°–80° относительно друг друга (Broadhurst et al., 1995; Hardman et al., 1995). Белки этого семейства гораздо более консервативны по пространственной структуре своих функциональных доменов, нежели по аминокислотной последовательности. Вместе с тем, при связывании HMGB-белков с другими молекулами ярко проявляется эффект индуцированного соответствия структуры HMGB-доменов мишени связывания. Считается, что такая структурная вариабельность играет ключевую роль при формировании функционально-значимых ДНК–белковых и белок–белковых комплексов, которые участвуют в процессах регуляции структуры и динамики хроматина (Uversky, 2013; Breydo et al., 2017). Показано, что HMGB1 может находиться как минимум в двух различных состояниях – в свернутом и развернутом, между которыми существует динамическое равновесие. В свернутом, неактивном, состоянии неупорядоченный отрицательно заряженный С-концевой участок (186−215 ак) располагается в полости между положительно заряженными ДНК-связывающими А и В доменами и взаимодействует с остатками аргинина 72 и 162, лизина 81 и 164 и изолейцина 158 (Knapp et al., 2004), что способствует стабилизации белковой молекулы в целом (Watson et al., 2007). Переход в функционально-активное развернутое состояние сопровождается нарушением этого взаимодействия, и, следовательно, разворачиванием белка HMGB1. В целом, конформация белка определяется как структурно-адаптивными механизмами, когда в зависимости от объекта связывания белок способен изменять свою пространственную структуру (Cato et al., 2008; Rodionova et al., 2010; Polyanichko et al., 2011), так и набором посттрансляционных модификаций (Ugrinova et al., 2009; Reeves, 2015).
ЛОКАЛИЗАЦИЯ БЕЛКА HMGB1 В КЛЕТКЕ
Разнообразие выполняемых белком HMGB1 функций (Кузник и др., 2017; Brien et al., 2019; Raucci et al., 2019) отчасти связано с тем, что он может иметь ядерную, цитоплазматическую и внеклеточную локализацию. Ядерно-цитоплазматическое распределение HMGB1 меняется в зависимости от типа ткани, окислительно-восстановительного статуса белка, а также стадии дифференцировки клеток. Например, зобная железа (тимус), семенники и селезенка содержат много белка, как в ядре, так и в цитоплазме, а ткани мозга и печень характеризуются преимущественно цитоплазматической локализацией HMGB1 (Mosevitsky et al., 1989).
Локализация белка зависит также от набора его посттрансляционных модификаций (Bonaldi et al., 2003; Ito et al., 2007; Zhang et al., 2008; Oh et al., 2009) и окислительно-восстановительного статуса остатков цистеина (Venereau et al., 2012; Tsung et al., 2014; Raucci et al., 2019). HMGB1 имеет два участка сигнала ядерной локализации (nuclear localization sequences, NLS) – NLS1 и NLS2 – и два участка сигнала ядерного экспорта (nuclear export signal, NES), наличие которых обеспечивает перемещение белка между ядром и цитоплазмой (Bonaldi et al., 2003).
Для локализации HMGB1 в ядре необходимым условием является деацетилирование лизинов в областях NLS1 и NLS2, которое осуществляется белком сиртуин-1 (sirtuin, или silent information regulator two, SIRT1) (Rabadi et al., 2015). Ацетилирование HMGB1 в областях NLS приводит к связыванию белка с рецепторами, отвечающими за его транспорт из ядра в цитоплазму (Bonaldi et al., 2003; Tsung et al., 2014), однако в настоящее время неизвестно, влияет ли ацетилирование HMGB1 в областях NLS на его внеядерную активность.
Транслокация HMGB1 из ядра и обратно контролируется также посредством серинтреонинового фосфорилирования (Zhang et al., 2008; Oh et al., 2009), а в нейтрофилах – еще и метилированием лизина в положении 42 (Ito et al., 2007). В цитоплазме ацетилированный в NLS областях HMGB1 может взаимодействовать с белком клеточной системы аутофагии Beclin-1 (BECN1, Coiled-coil myosin-like BCL2-interacting protein), что приводит к стимуляции этого процесса. Не стоит забывать и о том, что выход HMGB1 из ядерного пространства в цитоплазму может происходить также в результате нарушения целостности самой клетки вследствие пироптоза (Kang, Tang, 2012), апоптоза (Scaffidi et al., 2002) или некроза (Bell et al., 2006). Однако на примере некроза и сигнальной транслокации белка в цитоплазму показано, что модификационный статус HMGB1 в этих случаях сильно разнится, что находит отражение в многообразии выполняемых белком функций (Bonaldi et al., 2003; Ito et al., 2007; Zhang, Wang, 2008; Tsung et al., 2014).
Белок HMGB1 имеет три консервативных остатка цистеина. Два из них расположены в домене A в положениях 23 и 45 и могут образовывать дисульфидную связь. Третий находится в положении 106 в составе домена B (рис. 1). Эти цистеины подвержены окислению, что оказывает влияние на внеклеточную активность белка (Venereau et al., 2012; Yang et al., 2012). В ядре белок находится в полностью восстановленной форме (fully reduced fr-HMGB1), в которой все три цистеина восстановлены. В таком состоянии он функционирует как “ДНК шаперон” (рис. 2), принимая активное участие в процессах транскрипции, репарации, рекомбинации, репликации, осуществляя посадку на нуклеосому хроматин-ремоделирующего комплекса и связывание с ДНК транскрипционных факторов (Verrijdt et al., 2002; Stros et al., 2018).
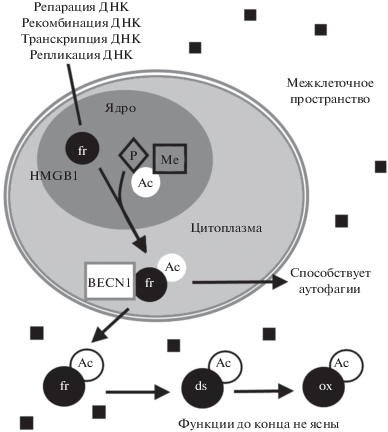
Рис. 2.
Ядерные и цитоплазматические функции HMGB1. В полностью восстановленной форме (fr) в ядре клетки HMGB1 функционирует как шаперон, осуществляя посадку на нуклеосому хроматин-ремоделирующего комплекса, и далее – связывание факторов транскрипции с ДНК. Ацетилирование (Ас) HMGB1 в областях NLS приводит к транслокации белка в цитозоль и взаимодействию его с белком клеточной системы аутофагии BECN1, что и стимулирует аутофагию. На выход белка из ядра оказывает влияние фосфорилирование (Р) и метилирование (Ме). При высвобождении HMGB1 в межклеточное пространство под действием активных форм кислорода (АФК, черные квадраты) происходит окисление остатков цистеина в белке до дисульфидной (ds) и сульфонильной формы (ox). Функциональная роль внеклеточного ацетилированного HMGB1 до конца не ясна.
В случае некроза или другого повреждения целостности клетки неацетилированный HMGB1 попадает во внеклеточное пространство (рис. 3), где происходит окисление остатков цистеина в положениях С23, С45 и С106 из-за влияния активных форм кислорода (Tang et al., 2011b). В зависимости от степени окисления белок выступает в роли сигнальной молекулы, инициирующей миграцию клеток (Tang, 2011b; Lin et al., 2016; Raucci et al., 2019), реакцию иммунного ответа клетки (Orlova et al., 2007; Tian et al., 2012; Yang et al., 2012) и синтез противовоспалительных цитокинов (Venereau et al., 2012; Lu et al., 2019). Разделяют дисульфидную форму белка (disulfide, ds-HMGB1), в которой C23 и C45 окислены и образуют дисульфидный мостик, а С106 полностью восстановлен, и сульфонильную форму, в молекуле которого все цистеины окислены (oxidized, ox-HMGB1) (Venereau et al., 2012).
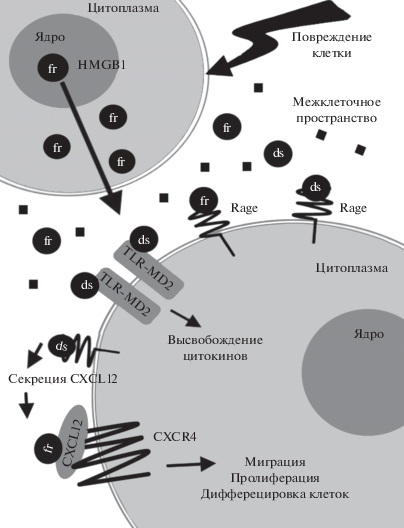
Рис. 3.
Внеклеточные функции HMGB1. При повреждении целостности клетки происходит высвобождение HMGB1 в восстановленной форме (fr) во внеклеточное пространство, где под действием АФК (черные квадраты) происходит окисление остатков цистеина в белке до дисульфидной (ds) формы. В зависимости от степени окисления, HMGB1 может взаимодействовать с рецептором конечных продуктов гликирования RAGE и Toll-like-рецепторами (TLR-MD2), участвуя в передаче сигналов инициации иммунного ответа и воспаления. Связывание fr-HMGB1 с белком CXCL12 приводит к взаимодействию белка с рецептором CXCR4 (C-X-C chemokine receptor type 4) и активации CXCR4-опосредованной миграции, пролиферации и дифференцировки клеток при заживлении и регенерации ткани.
Выполнение белком внеклеточных сигнальных функций дало предпосылки отнести HMGB1 к классу аларминов (Yasinska et al., 2018; Raucci et al., 2019; Brien et al., 2019), которые синтезируются в клетках при воспалительных процессах и активируют клетки иммунной системы, что, в конечном итоге, способствует восстановлению поврежденной ткани (Yang et al., 2012; Кузник и др., 2017; Brien et al., 2019).
Согласно литературным данным, основным партнером внеклеточного HMGB1 при передаче сигнала к инициации иммунного ответа является рецептор конечных продуктов гликирования (receptor for advanced glycation endproducts, RAGE) (Tian et al., 2007; Orlova et al., 2007; Yang, Klionsky, 2010). HMGB1 способен взаимодействовать с RAGE вне зависимости от степени окисления. При этом показано, что наибольшую аффинность при взаимодействии с RAGE проявляет именно ds-HMGB1 (Stark et al., 2016; Titrone et al., 2018). Связывание RAGE с HMGB1 в восстановленной форме стимулирует продукцию хемокина CXCL12 (chemokine (C-X-C motif) ligand 12). Связывание HMGB1 (еще в восстановленной форме) с белком CXCL12, в свою очередь, приводит к взаимодействию белка с рецептором CXCR4 (C-X-C chemokine receptor type 4) и активации CXCR4-опосредованной миграции, пролиферации и дифференцировки клеток при заживлении и регенерации ткани (Lee et al., 2018; Raucci et al., 2019).
Взаимодействие RAGE с дисульфидной формой HMGB1 приводит к активации нейтрофилов и формированию внеклеточных ловушек для них, что важно при тромбо-воспалительных процессах (Stark et al., 2016). На животных было показано, что ингибирование взаимодействия HMGB1 с этим рецептором подавляет рост опухоли и распространение метастаз (Huttunen et al., 2002; Hanahan, Weinberg, 2013).
В дисульфидной форме HMGB1 взаимодействует с комплексом TLR4−MD2 (Toll-like receptor 4 (TLR4)/myeloid differentiation factor 2 (MD-2)), что приводит к стимуляции высвобождения воспалительных и ангиогенных факторов посредством активации транскрипционного ядерного фактора NF-κB. Показано, что взаимодействие HMGB1 с TLR2 или TLR4 регулирует процессы воспаления при повреждениях легких, печени, при эпилепсии, болезнях сердца и онкологических заболеваниях (Yang et al., 2015; Raucci et al., 2019). Например, формирование комплекса HMGB1−TLR4 стимулируeт образование цитокинов и хемокинов в воспалительных клетках (Venereau et al., 2012; Yang et al., 2012, 2015; Lu et al., 2019). Взаимодействие рецептора TLR2 с HMGB1 приводит к активации так называемых естественных киллерных клеток (Conti et al., 2013; Qiu et al., 2014). Дальнейшее окисление HMGB1, при котором все три цистеина окислены (Venereau et al., 2012), с функциональной точки зрения менее изучено. По мнению некоторых авторов (Raucci et al., 2019) белок в этом состоянии, возможно, функционально инертен. В более ранних исследованиях других авторов (Maugeri et al., 2014) показано, что белок в этой форме обнаруживается на поздних стадиях воспалительных процессов и может быть связан с регенерацией тканей (Yang et al., 2012) и способен оказывать влияние на активацию нейтрофилов (Maugeri et al., 2014). Из других работ следует, что к регенерации тканей причастна полностью восстановленная форма (Lee et al., 2018).
Так или иначе, внеклеточный HMGB1 способствует заживлению ран и регенерации тканей (Tirone et al., 2018). HMGB1 влияет на миграцию мезенхимных стволовых клеток, а его использование в терапии способствует синтезу небольших цитокинов – хемокинов, которые увеличивают скорость миграции стволовых клеток (Venereau et al., 2012; Lin et al., 2016; Lee et al., 2018). В то же время, ряд экспериментов на животных показал, что ингибирование внеклеточного HMGB1 приводит к ослаблению воспаления и увеличивает защиту организма от некоторых заболеваний (в том числе сепсиса, диабета, ишемии, повреждения сердца и печени) (Raucci et al., 2019).
HMGB1 И ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
В биоэнергетике большинства клеток эукариот основную роль играют митохондрии (Chan, 2006). Известно, что мыши, нокаутированные по HmgB1, умирают вскоре после рождения от тяжелой формы гипогликемии (Calogero et al., 1999), что может указывать на нарушение основных биоэнергетических процессов в клетках на фоне снижения количества HMGB1. Действительно, на иммортализованной линии эмбриональных фибробластов мыши (МЭФ), нокаутированных по HmgB1, было показано значительное снижение базального уровня как гликолиза, так и окислительного фосфорилирования на фоне тотального дефицита HMGB1 (Tang et al., 2011a). Причины дыхательной дисфункции митохондрий удалось понять при анализе их морфологичеких особенностей. В дифференцированных клетках эукариот митохондрии представляют собой органеллы удлиненной овальной формы. Морфологический анализ митохондрий в клетках, нокаутных по гену HmgB1, показал, что на фоне дефицита HMGB1 происходит укорачивание и округление митохондрий, что приводит к митохондриальной дисфункции с дыхательным дефицитом и потере потенциала митохондриальной мембраны (Tang et al., 2011a).
Восстановление уровня HMGB1 в нокаутных по гену HmgB1 МЭФ за счет экспрессии его экзогенной формы приводит к восстановлению гликолиза, морфологии митохондрий и, как следствие, их дыхательных функций (Tang et al., 2011a). Схожие эффекты наблюдаются и в случае нокдауна гена HmgB1. Снижение экспрессии HmgB1 с помощью РНК-интерференции в фибробластах МЭФ, NIH-3T3, клетках рака поджелудочной железы человека Panc2.03 и клетках рака толстой кишки человека HCT116 приводило к снижению окислительного фосфорилирования. При этом показано, что базальные уровни АТФ снижаются на 20–40% в клетках с нокдауном гена HmgB1, что сопровождается снижением роста и пролиферации клеток. Показано также, что снижение экспрессии HmgB1 не оказывает влияния на количество общей митохондриальной массы клеток (Tang et al., 2011a).
Одним из партнеров белка HMGB1 является белок теплового шока HSPB1 (Heat shock protein beta-1, также известный как HSP25 у мыши и HSP27 у человека). HSPB1 присутствует в различных типах клеток и тканей, а невозможность получить нокаутированных мышей свидетельствует о том, что HSPB1 необходим для роста и эмбрионального развития (Arrigo, 2007).
На клетках МЭФ было показано, что снижение экспрессии HmgB1 приводит к значительному снижению уровня экспрессии HSPB1 (Tang et al., 2011a). При этом наблюдается снижение скорости потребления кислорода, скорости внеклеточного подкисления среды, продукции АТФ и повышенная фрагментация митохондрий. Наблюдаемые эффекты удивительным образом похожи на фенотип клеток с дефицитом по HMGB1 (Tang et al., 2011a). При этом восстановление уровня HSPB1 в клетках, нокаутных по гену HmgB1, до физиологических значений за счет экспрессии с экзогенного вектора, приводит к восстановлению структуры митохондрий, митохондриального дыхания и продукции АТФ. В связи с этим можно предполагать, что наблюдаемое увеличение числа дисфункциональных митохондрий в клетках с дефицитом HMGB1, связано именно с потерей одного из его партнеров – HSPB1.
Важным биологическим механизмом устранения поврежденных или устаревших макромолекул и органелл является аутофагия (Kroemer et al., 2010; Yang, Klionsky, 2010). Митофагия ответственна за устранение дисфункциональных митохондрий и митохондрий с нарушениями структуры (Kim et al., 2007; Youle, Narendra, 2011). Она включает в себя, по крайней мере, трехэтапный процесс: 1) образование аутофагосом для поглощения дисфункциональных митохондрий, 2) слияние лизосом с аутофагосомами и 3) деградация дисфункциональных митохондрий с помощью аутолизосом.
Одним из механизмов возникновения повреждений митохондрий является клеточный стресс. При клеточном стрессе происходит формирование так называемых стрессовых волокон, представляющих собой пучки легко визуализируемых актиновых филаментов. При этом повышается уровень колоколизации митохондрий и актина, что, по-видимому, являются важным регуляторным механизмом восстановления повреждений митохондрий. Хорошо охарактеризованная функция HSPB1 заключается во взаимодействии этого белка с актиновым цитоскелетом (Lavoie et al., 1993), динамической структурой, которая поддерживает форму клеток и играет важную роль в транспорте и морфологии внутриклеточных везикул и органелл, включая митохондрии (Boldogh, Pon, 2006). Было показано, что увеличение экспрессии HSPB1 модулирует полимеризацию и реорганизацию актина (Lavoie et al., 1993; Rousseau et al., 1997). Понижение экспрессии HSPB1, в свою очередь, снижает эффективность формирования стрессовых волокон и ингибирует колокализацию митохондрий с другими органеллами: актином, аутофагосомами (например, LC3 ‑ microtubule-associated protein 1 light chain 3) и аутолизосомами (например, LAMP2 – lysosomal-associated membrane protein 2) в ответ на повреждение митохондрий (Tang et al., 2011a). Поскольку снижение уровня экспрессии HmgB1 приводит к дефициту HSPB1, очевидным является дефицит аутофагии и, следовательно, увеличение числа дисфункциональных митохондрий и митохондрий с измененной структурой (Tang et al., 2011a).
БЕЛОК HMGB1 И СТАРЕНИЕ КЛЕТОК
Как отмечалось выше, HMGB1 принимает участие во многих клеточных процессах, в частности и в процессах клеточного старения. Клеточное старение представляет собой явление, которое обычно связывают с потерей клеткой способности к делению, так называемое репликативное старение. Стареющие клетки характеризуются снижением интенсивности энергообмена, замедлением синтеза РНК и белков, понижением эффективности репарации ДНК, накоплением различных мутаций, дисфункцией теломер (Davalos et al., 2013). При этом часто наблюдается разбалансировка клеточной регуляции, которая происходит из-за того, что вступление в процесс старения клеток в клеточной популяции происходит несинхронно.
Под термином “клеточное старение” понимают и снижение функциональной активности клеток с течением времени (Green, 2005; Rodier, Campisi, 2011), которое, вероятно, опосредовано различного рода нарушениями функциональных особенностей самой клетки. Например, было установлено, что в 50% клеток, вступающих в старение, наблюдается истощение ядерного HMGB1 за счет транслокации белка в цитоплазму с последующей секрецией во внеклеточное пространство (Davalos et al., 2013; Sofiadis et al., 2020). Истощение HMGB1 было наиболее интенсивным в увеличенных ядрах стареющих клеток (независимо от клеточной линии). При этом известно, что клетки, лишенные ядерного HMGB1, характеризуются снижением числа нуклеосом, что делает хроматин более восприимчивым к повреждениям ДНК и ложной транскрипции (Gazzar et al., 2009; Celona et al., 2011; De Toma et al., 2014).
В клетках с низкой экспрессией HmgB1 наблюдается увеличение транскрипции генов, ассоциированных со старением секреторного фенотипа (senescence-associated secretory phenotype, SASP), который включает факторы роста, протеазы и воспалительные цитокины, паракринно воздействующие на соседние клетки (Davalos et al., 2013). Для того, чтобы выявить возможные белковые комплексы с участием HMGB1 или комплексы, которые могут заместить этот белок в хроматине стареющих клеток, Софиадис с соавторами (Sofiadis et al., 2020) проанализировали сайты, на которых функционируют различные транскрипционные факторы.
Было установлено, что белком HMGB1 значительно обогащены сайты связывания транскрипционных факторов семейства E2F, играющих решающую роль в контроле клеточного цикла и действии белков опухолевых супрессоров. Кроме того, белком HMGB1 также обогащены и cайты связывания активирующих старение ко-репрессоров (например, REST и HEY2) и архитектурного белка ZBTB7B (zinc finger and BTB domain-containing protein 7B). ZBTB7B играет существенную роль в процессах активации воспалительных генов (Nikopoulou et al., 2018). Истощение ядерного HMGB1 приводит к тому, что эти HMGB1-ассоциированные сайты заметно обедняются, что в свою очередь способствует активации (дезактивации) транскрипции с данных участков. Таким образом, базальный уровень экспрессии HmgB1 в ядре клетки является своего рода защитным механизмом клетки от преждевременного старения.
ЗАКЛЮЧЕНИЕ
Негистоновый белок HMGB1 играет важную роль в функционировании клетки эукариот. На протяжении многих лет его основные функции связывали с хроматином и, в первую очередь, с ДНК. HMGB1 является структурно-регуляторным белком хроматина и принимает участие в таких процессах, как транскрипция, рекомбинация и репарация ДНК. Кроме этого, белок способен перемещаться в цитоплазму и далее секретироваться во внеклеточное пространство, приобретая при этом совершенно новые функции. В основе функционального многообразия HMGB1 лежит набор комбинаций всевозможных посттрансляционных модификаций и окислительно-восстановительного состояния белка. Однако несмотря на огромное количество свидетельств функциональной активности HMGB1 как в ядре, так и вне его, остается еще множество фундаментальных и прикладных вопросов, связанных с механизмами влияния HMGB1 на протекание и лечение различных заболеваний – от онкологических и сердечно-сосудистых до патологий при беременности и родах (Brien et al., 2019; Lu et al., 2019; Raucci et al., 2019; Sato et al., 2019), которые несомненно требуют тщательного и более детального изучения.
Список литературы
Кузник Б.И., Хавинсон В.Х., Линькова Н.С., Салль Т.С. 2017. Алармин1 (HMGB1) и возрастная патология. Эпигенетические механизмы регуляции. Усп. физиол. наук. Т. 48. № 4. С. 40. (Kuznik B.I., Khavinson V.Kh., Linkova N.S., Sall T.S. 2017. Alarmin1 (HMGB1) and Age-Related Pathologies. Epygenetic Regulatory Mechanisms. Usp. Fiziol. Nauk. V. 48. № 4. P. 40.)
Чихиржина Е.В., Старкова Т.Ю., Поляничко А.М. 2020. Структурная организация ядерного белка HMGB1 и ее влияние на формирование упорядоченных надмолекулярных комплексов. Биофизика. В печати.
Arrigo A.P. 2007. The cellular ‘‘networking’’ of mammalian Hsp27 and its functions in the control of protein folding, redox state and apoptosis. Adv. Exp. Med. Biol. V. 594. P. 14.
Bell C.W., Jiang W., Reich C.F. 3rd, Pisetsky D.S. 2006. The extracellular release of HMGB1 during apoptotic cell death. Am. J. Physiol. Cell Physiol. V. 291. P. 1318
Boldogh I.R., Pon L.A. 2006. Interactions of mitochondria with the actin cytoskeleton. Biochim. Biophys. Acta. V. 1763. P. 450.
Bonaldi T., Talamo F., Scaffidi P., Ferrera D., Porto A., Bachi A., Rubartelli A., Agresti A., Bianchi M.E. 2003. Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion. EMBO J. V. 22. P. 5551.
Breydo L., Redington J.M., Uversky V.N. 2017. Effects of intrinsic and extrinsic factors on aggregation of physiologically important intrinsically disordered proteins. Int. Rev. Cell Mol. Biol. V. 329. P. 145.
Brien M.-E., Baker B., Duval C., Gaudreault V., Jones R.L., Girard S. 2019. Alarmins at the maternal-fetal interface: involvement of inflammation in placental dysfunction and pregnancy complications. Can. J. Physiol. Pharmacol. V. 97. P. 206.
Broadhurst R.W., Hardman C.H., Thomas J.O., Laue E.D. 1995. Backbone dynamics of the A-domain of HMG1 as studied by 15N NMR spectroscopy. Biochemistry. V. 34. P. 16608.
Bustin M., Reeves R. 1996. High-mobility-group chromosomal proteins, architectural components that facilitate chromatin function. Progr. Nucl. Acid Res. Mol. Biol. V. 54. P. 35.
Calogero S., Grassi F., Aguzzi A., Voigtländer T., Ferrier P., Ferrari S., Bianchi M.E. 1999. The lack of chromosomal protein Hmg1 does not disrupt cell growth but causes lethal hypoglycaemia in newborn mice. Nature genetics, V. 22. P. 276.
Cato L., Stott K., Watson M., Thomas J.O. 2008. The interaction of hmgb1 and linker histones occurs through their acidic and basic tails. J. Mol. Biol. V. 384. P. 1262.
Chan D.C. 2006. Mitochondria: dynamic organelles in disease, aging, and development. Cell. V. 125. P. 1241.
Celona B., Weiner A., Di Felice F., Mancuso F.M., Cesarini E., Rossi R.L., Gregory L., Baban D., Rossetti G., Grianti P., Pagani M., Bonaldi T., Ragoussis J., Friedman N., Camilloni G. et al. 2011. Substantial histone reduction modulates genome wide nucleosomal occupancy and global transcriptional output. PLoS Biol. V. 9. P. e1001086.
Chikhirzhina E., Polyanichko A., Leonenko Z., Wieser H., Vorob’ev V. 2010. C-terminal domain of nonhistone protein HMGB1 as a modulator of HMGB1-DNA structural interactions. Spectroscopy. V. 24. P. 361.
Chikhirzhina E.V., Polyanichko A.M., Skvortsov A.N., Kostyleva E.I., Houssier C., Vorobyev V.I. 2002. HMG1 domains: The victims of the circumstances. Molecular Biology (Mosk). V. 36. P. 412.
Conti L., Lanzardo S., Arigoni M., Antonazzo R., Radaelli E., Cantarella D., Calogero R.A., Cavallo F. 2013. The noninflammatory role of high mobility group box 1/Toll-like receptor 2 axis in the self-renewal of mammary cancer stem cells. FASEB J. V. 27. P. 4731.
Davalos A.R., Kawahara M., Malhotra G.K., Schaum N., Huang J., Ved U., Beausejour C. M., Coppe J. P., Rodier F., Campisi J. 2013. p53-dependent release of Alarmin HMGB1 is a central mediator of senescent phenotypes. J. Cell. Biol. V. 201. P. 613.
De Toma I., Rossetti G., Zambrano S., Bianchi M. E., Agresti A. 2014. Nucleosome loss facilitates the chemotactic response of macrophages. J. Intern. Med. V. 276. P. 454.
Gazzar M.El., Yoza B.K., Chen X., Garcia B.A., Young N.L., McCall C.E. 2009. Chromatin-specific remodeling by HMGB1 and linker histone H1 silences proinflammatory genes during endotoxin tolerance. Mol. Cell Biol. V. 29. P. 1959.
Green D.R. 2005. Apoptotic pathways: ten minutes to dead. Cell. V. 121. P. 671.
Hanahan D., Weinberg R.A. 2013. HMGB1 in cancer: Good, bad, or both? Clin. Cancer Res. 2013. 19. P. 4046.
Hardman C.H., Broadhurst R.W., Raine A.R., Grasser K.D., Thomas J.O., Laue E.D. 1995. Structure of the A-domain of HMG1 and its interaction with DNA as studied by heteronuclear three- and four-dimensional NMR spectroscopy. Biochemistry. V. 34. P. 16596.
Huttunen H.J., Fages C., Kuja-Panula J., Ridley A.J., Rauvala H. 2002. Receptor for advanced glycation end products-binding COOH-terminal motif of amphoterin inhibits invasive migration and metastasis. Cancer Res. V. 62. P. 4805.
Ito I., Fukazawa J., Yoshida M. 2007. Post-translational methylation of high mobility group box 1 (HMGB1) causes its cytoplasmic localization in neutrophils. J. Biol. Chem. V. 282. P. 16336.
Joshi S.R., Sarpong Y.C., Peterson R.C., Scovell W.M. 2012. Nucleosome dynamics: HMGB1 relaxes canonical nucleosome structure to facilitate estrogen receptor binding. Nucleic Acids Res. V. 40. P. 10161.
Kang R., Tang D. 2012. PKR-dependent inflammatory signals. Science Signaling. V. 5. P. pe 47.
Kim I., Rodriguez-Enriquez S., Lemasters J.J. 2007. Selective degradation of mitochondria by mitophagy. Arch. Biochem. Biophys. V. 462. P. 245.
Knapp S., Muller S., Digilio G., Bonaldi T., Bianchi M.E., Musco G. 2004. The long acidic tail of high mobility group box 1 (HMGB1) protein forms an extended and flexible structure that interacts with specific residues within and between the HMG boxes. Biochem. V. 43. P. 11992.
Kozlova A.L., Valieva M.E., Maluchenko N.V., Studitsky V.M. 2018. HMGB proteins as DNA chaperones that modulate chromatin activity. Mol. Biol. V. 52. № 5. P. 637.
Kroemer G., Marino G., Levine B. 2010. Autophagy and the integrated stress response. Mol. Cell. V. 40. 280.
Lavoie J.N., Hickey E., Weber L.A., Landry J. 1993. Modulation of actin microfilament dynamics and fluid phase pinocytosis by phosphorylation of heat shock protein 27. J. Biol. Chem. V. 268. P. 24210.
Lee G., Santo A.I.E., Zwingenberger S., Cai L., Vogl T., Feldmann M., Horwood N.J., Chan J.K., Nanchahal J. 2018. Fully reduced HMGB1 accelerates the regeneration of multiple tissues by transitioning stem cells to GAlert. Proc. Natl. Acad. Sci. U.S.A. V. 115. P. E4463.
Lin F., Xue D., Xie T., Pan Z. 2016. HMGB1 promotes cellular chemokine synthesis and potentiates mesenchymal stromal cell migration via Rap1 activation. Mol. Med. Rep. V. 14. P. 1283.
Lu H., Zhangc Z., Barniea P.A., Sua Z. 2019. Dual faced HMGB1 plays multiple roles in cardiomyocyte senescence and cardiac inflammatory injury. Cytokine Growth. Factor Rev. V. 47. P. 74.
Maugeri N., Rovere-Querini P., Baldini M., Baldissera E., Sabbadini M.G., Bianchi M.E., Manfredi A.A. 2014. Oxidative stress elicits platelet/leukocyte inflammatory interactions via HMGB1: a candidate for microvessel injury in systemic sclerosis. Antioxid. Redox. Signal. V. 20. P. 1060.
Mosevitsky M.I., Novitskaya V.A., Iogannsen M.G., Zabezhinsky M.A. 1989. Tissue specificity of nucleocytoplasmic distibution of HMG1 and HMG2 proteins and their probable functions. Eur. J. Biochem. V. 185. P. 303.
Nikopoulou C., Panagopoulos G., Sianidis G., Psarra E., Ford E., Thanos D. 2018. The transcription factor ThPOK orchestrates stochastic interchromosomal interactions required for IFNB1 virus-inducible gene expression. Mol. Cell. V. 71. P. 352.
Oh Y.J., Youn J.H., Ji Y., Lee S.E., Lim K.J., Choi J.E., Shin J.-S. 2009. HMGB1 is phosphorylated by classical protein kinase C and is secreted by a calcium dependent mechanism. J. Immunol. V. 182. P. 5800.
Orlova V.V., Choi E.Y., Xie C., Chavakis E., Bierhaus A., Ihanus E., Ballantyne C.M., Gahmberg C.G., Bianchi M.E., Nawroth P.P., Chavakis T. 2007. A novel pathway of HMGB1-mediated inflammatory cell recruitment that requires Mac-1-integrin. EMBO J. V. 26. P. 1129.
Polyanichko A.M., Chikhirzhina E.V., Skvortsov A.N., Kostyleva E.I., Colson P., Houssier C., Vorob’ev V.I. 2002. The HMG1 Ta(i)le. J. Biomol. Struct. Dyn. V. 19. P. 1053.
Polyanichko A.M., Leonenko Z.V., Cramb D., Wieser H., Vorob’ev V.I. Chikhirzhina E.V. 2008. Visualization of DNA complexes with HMGB1 and its C-truncated form HMGB1(A+B). Biophysics. V. 53 P. 202
Polyanichko A.M., Rodionova T.J., Vorob’ev V.I., Chikhirzhina E.V. 2011. Conformational properties of nuclear protein HMGB1 and specificity of its interaction with DNA. Cell Tiss. Biol. V. 5. № 2. P. 114.
Qiu Y., Yang J., Wang W., Zhao W., Peng F., Xiang Y., Chen G., Chen T., Chai C., Zheng S., Watkins D.J., Feng J. 2014. HMGB1-promoted and TLR2/4-dependent NK cell maturation and activation take part in rotavirus-induced murine biliary atresia. PLoS Pathog V. 10. P. e1004011.
Rabadi M.M., Xavier S., Vasko R., Kaur K., Goligorksy M.S., Ratliff B.B. 2015. High-mobility group box 1 is a novel deacetylation target of Sirtuin1. Kidney Int. V. 87. P. 95.
Raucci A., Di Maggio S., Scavello F., D’Ambrosio A., Bianchi M.E., Capogrossi M.C. 2019. The Janus face of HMGB1 in heart disease: a necessary update. Cell. Mol. Life Sci. V. 76. P. 211.
Read C.M., Cary P.D., Crane-Robinson C., Driscoll P.C., Norman D.G. 1993. Solution structure of a DNA-binding domain from HMG1. Nucl. Acids Res. V. 21. P. 3427.
Reeves R. 2015. High mobility group (HMG) proteins, modulators of chromatin structure and DNA repair in mammalian cells. DNA Repair. V. 36. P. 122.
Rodier F., Campisi J. 2011. Four faces of cellular senescence. J. Cell Biol. V. 192. P. 547.
Rodionova T.Y., Chikhirzhina E.V., Vorob’yov V.I., Polyanichko A.M. 2010. Changes in the secondary structure of HMGB1 protein bonded to DNA. J. Struct. Chem. V. 50. P. 976.
Rousseau S., Houle F., Landry J., Huot J. 1997. p38 MAP kinase activation by vascular endothelial growth factor mediates actin reorganization and cell migration in human endothelial cells. Oncogene. V. 15. P. 2169.
Sato M., Miyata K., Tian Z., Kadomatsu T., Ujihara Y., Morinaga J., Horiguchi H., Endo M., Zhao J., Zhu S., Sugizaki T., Igata K., Muramatsu M., Minami T., Ito T. et al. 2019. Loss of endogenous HMGB2 promotes cardiac dysfunction and pressure overload-induced heart failure in mice. Circulation J. V. 83. P. 368.
Scaffidi P., Misteli T., Bianchi M. E. 2002. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. V. 418. P. 191.
Sofiadis K., Nikolic M., Kargapolova Y., Josipovic N., Zirkel A., Papadakis A., Papadionysiou I., Loughran G., Keanes J., Michel A., Gusmao E.G., Mizi A., Georgomanolis T., Altmüller J., Nürnberg P., Beyer A., Papantonis A. 2020. HMGB1 coordinates SASP-related chromatin folding and RNA homeostasis on the path to senescence. bioRxiv. doi: http://doi.org/10.1101/540146.
Stark K., Philippi V., Stockhausen S., Busse J., Antonelli A., Miller M., Schubert I., Hoseinpour P., Chandraratne S., von Brühl M.L., Gaertner F., Lorenz M., Agresti A., Coletti R., Antoine D.J. et al. 2016. Disulfide HMGB1 derived from platelets coordinates venous thrombosis in mice. Blood. V. 128. P. 2435.
Stott K., Watson M., Howe F.S., Grossmann J.G., Thomas J.O. 2010. Tail-mediated collapse of HMGB1 is dynamic and occurs via differential binding of the acidic tail to the a and B domains. J. Mol. Biol. V. 403. P. 706.
Stros M. 2010. HMGB proteins: Interactions with DNA and chromatin. Biochim. Biophys. Acta. V. 1799. P. 101.
Stros M., Kucirek M., Sani S.A., Polanska E. 2018. HMGB1-mediated DNA bending: distinct roles in increasing p53 binding to DNA and the transactivation of p53-responsive gene promoters. Biochim. Biophys. Acta Gen. Regul. Mech. V. 1861. P. 200.
Tang D., Kang R., Livesey K.M., Kroemer G., Billiar T.R., Van Houten B., Zeh H.J., III, Lotze M.T. 2011a. High-mobility group box 1 is essential for mitochondrial quality control. Cell Metabolism. V. 13. P. 701.
Tang D., Kang R., Zeh H.J. 3rd, Lotze M.T. 2011b. High-mobility group box 1, oxidative stress, and disease. Antioxid Redox. Signal. V. 14. P. 1315.
Teo S.H., Grasser K.D., Thomas J.O. 1995. Differences in the DNA-binding properties of the HMG-box domains of HMG1 and the sex-determining factor SRY. Eur. J. Biochem. V. 230. P. 943.
Thomas J.O., Travers A.A. 2001. HMG1 and 2, and related ‘architectural’ DNA-binding proteins. Trends Biochem. Sci. V. 26. P. 167.
Tian J., Avalos A.M., Mao S.Y., Chen B., Senthil K., Wu H., Parroche P., Drabic S., Golenbock D., Sirois C., Hua J., An L.L., Audoly L., La Rosa G., Bierhaus A. et al. J. 2007. Toll-like receptor 9-dependent activation by DNA-containing immune complexes is mediated by HMGB1 and RAGE. Nat. Immunol. V. 8. P. 487.
Tirone M., Tran N. L., Ceriotti C., Gorzanelli A., Canepari M., Bottinelli R., Raucci A., Di Maggio S., Santiago C., Mellado M., Saclier M., François S., Careccia G., He M., De Marchis F. et al. 2018. High mobility group box 1 orchestrates tissue regeneration via CXCR4. J. Exp. Med. V. 215. P. 303.
Totsingan F., Bell A.J. Jr. 2013. Interaction of HMG proteins and H1 with hybrid PNA-DNA junctions. Protein Sci. V. 22. P. 1552.
Tsung A., Tohme S., Billiar T.R. 2014. High-mobility group box-1 in sterile inflammation. J. Intern. Med. V. 276. P. 425.
Ugrinova I., Pashev I.G., Pasheva E.A. 2009. Nucleosome binding properties and Co-remodeling activities of native and in vivo acetylated HMGB-1 and HMGB-2 proteins, Biochemistry. V. 48. P. 6502.
Uversky V.N. 2013. A decade and a half of protein intrinsic disorder, biology still waits for physics. Protein Sci. V. 22. P. 693.
Venereau E., Casalgrandi M., Schiraldi M., Antoine D. J., Cattaneo A., De Marchis F., Liu J., Antonelli A., Preti A., Raeli L., Shams S. S., Yang H., Varani L., Andersson U., Tracey K.J. et al. 2012. Mutually exclusive redox forms of HMGB1 promote cell recruitment or proinflammatory cytokine release. J. Exp. Med. V. 209. P. 1519.
Verrijdt G., Haelens A., Schoenmakers E., Rombauts W., Claessens F. 2002. Comparative analysis of the influence of the high-mobility group box 1 protein on DNA binding and transcriptional activation by the androgen, glucocorticoid, progesterone and mineralocorticoid receptors. Biochem. J. V. 361. P. 97.
Watson M., Stott K., Thomas J.O. 2007. Mapping intramolecular interaction between domains in HMGB1 using tail-truncation approah. J. Mol. Biol. V. 374. P. 1286.
Yang Z., Klionsky D.J. 2010. Eaten alive: A history of macroautophagy. Nat. Cell Biol. V. 12. P. 814.
Yang H., Lundback P., Ottosson L., Erlandsson-Harris H., Venereau E., Bianchi M.E., Al-Abed Y., Andersson U., Tracey K.J., Antoine D.J. 2012. Redox modification of cysteine residues regulates the cytokine activity of high mobility group box-1 (HMGB1). Mol. Med. V. 18. P. 250.
Yang H., Wang H., Ju Z., Ragab A.A., Lundbäck P., Long W., Valdes-Ferrer S. I., He M., Pribis J.P., Li J., Lu B., Gero D., Szabo C., Antoine D.J., Harris H.E. et al. 2015. MD-2 is required for disulfide HMGB1-dependent TLR4 signaling. J. Exp. Med. V. 212. P. 5.
Yasinska I. M., Silva I. G., Sakhnevych S.S., Ruegg L., Hussain R., Siligardi G., Fiedler W., Wellbrock J., Bardelli M., Varani L., Raap U., Berger S., Gibbs B.F., Fasler-Kan E., Sumbayev V.V. 2018. High mobility group box 1 (HMGB1) acts as an “alarmin” to promote acute myeloid leukaemia progression. Oncoimmunology. V. 7. № 6. P. e1438109.
Youle R.J., Narendra D.P. 2011. Mechanisms of mitophagy. Nat. Rev. Mol. Cell Biol. V. 12. P. 9.
Zhang X., Wheeler D., Tang Y., Guo L., Shapiro R.A., Ribar T.J., Means A. R., Billiar T.R., Angus D.C., Rosengart M.R. 2008. Calcium/calmodulindependent protein kinase (CaMK) IV mediates nucleocytoplasmic shuttling and release of HMGB1 during lipopolysaccharide stimulation of macrophages. J. Immunol. V. 181. P. 5015.
Zhang Q., Wang Y. 2008. High mobility group proteins and their post-translational modifications. Biochim. Biophys. Acta. V. 1784. P. 1159.
Zhu X., Messer J.S., Wang Y., Lin F., Cham C.M., Chang J., Billiar T.R., Lotze M.T., Boone D.L., Chang E.B. 2015. Cytosolic HMGB1 controls the cellular autophagy/apoptosis checkpoint during inflammation. J. Clinic. Investig. V. 125. P. 1098.
Дополнительные материалы отсутствуют.


