Цитология, 2020, T. 62, № 10, стр. 699-715
Регуляторная активность децеллюляризированного матрикса мультипотентных мезенхимных стромальных клеток
Д. К. Матвеева 1, Е. Р. Андреева 1, *
1 Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: andreeva1564@gmail.com
Поступила в редакцию 06.07.2020
После доработки 18.07.2020
Принята к публикации 18.07.2020
Аннотация
Децеллюляризированный внеклеточный матрикс (дцВКМ) нативных тканей и культивируемых клеток привлекает внимание исследователей в качестве источника биологических скаффолдов для регенеративной медицины. ДцВКМ клеточного происхождения используется для изучения ВКМ как регулятора функциональной активности клеток, а также для воспроизведения их тканеспецифичного микроокружения. Мультипотентные мезенхимные стромальные клетки (МСК), как ключевые компоненты соединительной ткани, при культивировании синтезируют значительное количество ВКМ с различным составом фибриллярных и растворимых элементов. Взаимодействие клеток с ВКМ является двунаправленным. Условия при которых культивируются МСК, определяют свойства ВКМ, что, в свою очередь, позволяет использовать дцВКМ от таких МСК для модулирования различных физиологических процессов после рецеллюляризации.
Мультипотентные мезенхимные стромальные клетки (МСК) рассматриваются как одна из ключевых клеточных популяций, участвующих в физиологическом и репаративном ремоделировании различных тканей. Считается, что МСК обладают способностью к длительному поддержанию некоммитированного статуса в локальных тканевых депо, а также могут быть мобилизованы в области повреждения при действии соответствующих медиаторов, где в результате пролиферации и последующей дифференцировки дают начало более коммитированным мезенхимным клеткам, таким как адипо- и хондроциты, остеобласты (Caplan, 2007). Возможность выделения, длительного поддержания ex vivo и последующего обратного введения в организм, в том числе и аллогенно, обеспечивает привлекательность МСК для нужд клеточной терапии и регенеративной медицины.
In vitro экспансия позволяет не только амплифицировать МСК, но и аккумулировать продукты их секреторной активности. В настоящее время растворимые компоненты секретома МСК позиционируются как привлекательный инструмент клеточной терапии, не только по эффективности сопоставимый с использованием самих МСК, но и являющийся при этом более безопасным (Kumar et al., 2019). Кроме того, как и другие клетки стромального дифферона, МСК продуцируют значительное количество внеклеточного матрикса (ВКМ). ВКМ является неотъемлемым компонентом тканей организма, образуя трехмерную молекулярную сеть, которая физически занимает пространство между клетками, а также регулирует различные клеточные процессы, такие как пролиферация, миграция, дифференцировка, жизнеспособность и морфогенез (Frantz et al., 2010; Сlause, Barker, 2013). В связи с этим ВКМ стромальных предшественников представляет значительный интерес с точки зрения тканевой инженерии и регенеративной медицины.
В настоящем обзоре представлены современные данные об особенностях ВКМ в контексте компонента ниши МСК in vivo и влиянии моделирования факторов тканевого окружения МСК на свойства ВКМ in vitro. Кроме того, рассмотрены методы удаления МСК для получения ВКМ и анализа индуктивных свойств децеллюляризированного ВКМ (дцВКМ).
ВНЕКЛЕТОЧНЫЙ МАТРИКС КАК КОМПОНЕНТ ТКАНЕВОЙ НИШИ
Тканевая ниша представляет специализированную микросреду, которая занимает определенное анатомическое положение и поддерживает основные свойства клеток через различные молекулярные механизмы (Scadden, 2006), в которые вовлечены сигналы от кровеносных сосудов и нервных клеток, а также секретируемые факторы и структурные компоненты матрикса (Gattazzo et al., 2014).
ВКМ – это ключевой компонент тканевого микроокружения, образующий сложную динамическую сеть макромолекул с различными физическими и биохимическими свойствами (Streuli, 1999). Его состав и биомеханика специализированы в зависимости от физиологического состояния органов и тканей (Hynes, 2009). Прямое или косвенное влияние молекул ВКМ на клетки поддерживает их активность, функционирование и репарацию органов и тканей. Матриксные белки вовлечены в регуляцию пролиферации, миграции, дифференцировки и апоптоза клеток (Rozario, DeSimone, 2010; Рогова и др., 2011; Воронкина и др., 2017). Механизмы, с помощью которых белки ВКМ могут влиять на такое разнообразие функций, опосредованы взаимодействием с различными клеточными рецепторами, включая интегрины. Кроме того, важную роль играет депонирование факторов роста и морфогенов, которые могут быть освобождены в ответ на сигналы от микроокружения (Disсher et al., 2009). Так, установлено, что витронектин, коллагены и протеогликаны связывают факторы роста: фибробластов (FGF), гепатоцитов (HGF), эндотелия сосудов (VEGF), трансформирующий (TGF-β) (Gattazzo et al., 2014).
Взаимодействие клеток с ВКМ имеет двунаправленный характер. Клетки могут реагировать на сигналы из микроокружения, ремоделируя матрикс (Ahmed, Ffrench-Сonstant, 2016). Динамичность структуры ВКМ регулируется клетками за счет синтеза матриксных протеаз и их ингибиторов в ответ на различные сигналы окружающей среды (Page-MсСaw et al., 2007; Воронкина и др., 2017). Протеолитическое расщепление компонентов ВКМ происходит посредством матриксных металлопротеиназ (MMP), сериновых протеаз (например, плазмина, активатора плазминогена) и цистеиновых протеаз (таких как катепсины). Они могут преобразовать структурные элементы в небольшие пептидные сигнальные молекулы (матрикины), напрямую деградировать матриксные белки, либо высвобождать факторы роста, депонированные в ВКМ. Для поддержания гомеостаза тканей взрослого организма при нормальном развитии активность протеаз и ингибиторов должна быть контролируемо уравновешена. Нарушения могут стать причиной различных патологических процессов, в том числе и опухолевой прогрессии (Daley, 2008).
ОСОБЕННОСТИ ВНЕКЛЕТОЧНОГО МАТРИКСА В РАЗЛИЧНЫХ ТКАНЕВЫХ НИШАХ МСК
Как известно, впервые МСК были изолированы из костного мозга и изучены наиболее детально (Friedenstein et al., 1968). За два последних десятилетия во многих исследованиях подтверждена возможность получения стволовых/прогениторных клеток со свойствами МСК из других тканей, таких как кожа (Orсiani, Primio, 2013), плацента (Pelekanos et al., 2016), пуповинная кровь (Biebaсk, Netsсh, 2016), пуповинная ткань (Nagamura-Inoue, He, 2014), жировая ткань (Li et al., 2015), легкие (Rolandsson et al., 2016), менструальная кровь и эндометрий (Мусина и др., 2008; Земелько и др., 2011), крайняя плоть (Крылова и др., 2018), а также молочные зубы и пульпа зуба (Yamada et al., 2010). МСК, благодаря их способности к самообновлению, мультилинейной дифференцировке, иммуносупрессивным свойствам, паракринной активности играют важную роль в гомеостазе и регенерации тканей. Исследования in vitro показали, что МСК из разных тканей отличаются, в частности, по дифференцировочному потенциалу: МСК жировой ткани предрасположены к адиподифференцировке, МСК из костного мозга лучше остеокоммитируются, МСК из пуповины и синовиальной жидкости склонны к хондродифференцировке (Pizzute et al., 2015). По-видимому, эти свойства МСК обуславливаются сигналами микроокружения, в том числе ВКМ.
ВКМ как внутри, так и между тканями варьирует по составу компонентов и их содержанию, что определяет различия в свойствах ВКМ (Hynes, 2009). При этом существуют общие закономерности структурной организации ВКМ. В состав ВКМ входят различные фибриллярные белки, а также гликопротеины и протеогликаны, структурное и функциональное разнообразие которых придает четко определенные физические, биохимические и биомеханические свойства ВКМ (Theocharis et al., 2015). Для описания комплекса молекул, составляющих ВКМ и участвующих в его ремоделировании, предложен термин “матрисом” (Hynes, Naba, 2011; Naba et al., 2012). Матрисом МСК, как и других клеток, состоит из корового матрисома, включающего в себя основные структурные компоненты, такие как коллагены, гликопротеины и протеогликаны, и матрисом-ассоциированных молекул, представленных секретируемыми факторами, регуляторами ВКМ и ВКМ-аффилированными молекулами (рис. 1). Актуальность изучения состава ВКМ с помощью характеристики матрисома определяется тем, что протеиновый анализ затруднен плохой растворимостью многих молекул ВКМ. Поэтому описание матрисома МСК выходит на передний план исследований ВКМ.
Рис. 1.
Матрисом МСК. Внеклеточный матрикс состоит из белков корового матрисома, включающего в себя такие молекулы как коллагены, гликопротеины, протеогликаны, а также матрисом-ассоциированных белков, представленных секретируемыми факторами (факторы роста, цитокины, морфогены), регуляторами ВКМ (протеазы) и ВКМ-аффилированными белками (муцины, семафорины и др.) (по Naba et al., 2016; Ragelle et al., 2017).
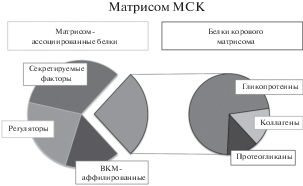
Подтверждено, что МСК in vitro продуцируют ВКМ со свойствами, характерными для их нативного микроокружения in vivo (Сhen et al., 2007). Оценка матрисома культивируемых МСК, полученных из костного мозга (км-МСК), жировой ткани (жт-МСК) и дермальных фибробластов подтверждает, что состав ВКМ во многом зависит от специфики микроокружения этих клеток. Качественный анализ показал, что коровый матрисом, продуцируемый клетками разных тканей, содержит большое число общих белков. Однако количественный анализ продемонстрировал значительные различия в составе ВКМ разного происхождения. Так, для ВКМ жт/км-МСК было выявлено преобладание и разнообразие коллагеновых белков, тогда как ВКМ дермальных фибробластов содержaл больше гликопротеинов, таких как фибррилин-2, фибулин-3, витронектин, поскольку кожа – эластичная ткань. Были отмечены различия между содержанием белков ВКМ жт-МСК и км-МСК. Например, тенасцин-Х, гликопротеин, который в основном экспрессируется в рыхлых соединительных тканях, был обнаружен только в ВКМ жт-МСК, а коллаген XIVα1 – исключительно в ВКМ км-МСК (Ragelle et al., 2017).
Аналогично, масс-спектрометрический анализ продемонстрировал различия в составе компонентов ВКМ от жт-МСК и км-МСК (Marinkoviс et al., 2016). При этом коллагеновая композиция корового матрисома была схожей, преобладали коллагены типов I, VI, XII. Основные различия были связаны с содержанием протеогликанов и гликопротеинов. И ВКМ от км-МСК, и ВКМ от жт-МСК были обогащены бигликанами и фибулином, тогда как галектины преобладали в случае км-МСК, а декорин и люмикан – жт-МСК. Иммуноцитохимический анализ показал различия в структуре коллагена типа VI: в случае км-МСК он характеризовался тонкими упорядоченными фибриллами, а в случае жт-МСК были обнаружены плотные и менее упорядоченные пучки (Marinkoviс et al., 2016).
Сравнение матрисома км-МСК и МСК из легочной ткани выявило специфический профиль белков ВКМ, характеризующий их тканеспецифичность. Для км-МСК идентифицировано 5 уникальных белков, а для легочных МСК – 11 белков ВКМ, а также в кондиционированной среде – 15 и 6 белков соответственно. Кроме того различались количественные показатели содержания одних и тех же компонентов ВКМ в данных группах клеток. Например, экспрессия фибронектина и коллагена VI типа была выше у км-МСК. Один из важных гликопротеинов, тенасцин-С, играющий критическую роль в процессах регенерации гематопоэтической ниши в костном мозге, экспрессировался в км-МСК на значительно более высоком уровне, по сравнению с легочными МСК. Для легочных МСК был характерен значительно более высокий уровень экспрессии глипикана I, по сравнению с км-МСК. Также среди специфичных белков ВКМ МСК легких был обнаружен HGF, необходимый для самовосстановления поврежденных органов, таких как печень и легкие (Enes et al., 2017).
Помимо различий в составе и структуре ВКМ, была продемонстрирована значительная разница в механической жесткости, которая у ВКМ км-МСК была в 3 раза выше, чем у ВКМ жт-МСК. Эти данные указывают на сохранение тканеспецифичности продуцируемого in vitro ВКМ, что может играть важную роль в регуляции поведения клеток (Marinkoviс et al., 2016). Топография, жесткость, пористость, нерастворимость ВКМ могут модулировать свойства клеток, связанные с адгезией, миграцией, пролиферацией и полярностью (Hynes, 2009). In vivo МСК локализуются в областях, обладающих различными механическими свойствами. За счет процессов механотрансдукции жесткость матрикса выступает фактором, регулирующим адгезию, характер распластывания и дифференцировку МСК. Показано, что жесткость ВКМ может определять направление дифференцировки МСК: на мягких субстратах преимущественно происходят адипогенная или нейрогенная дифференцировки, на жестких – миогенная, хондрогенная и остеогенная дифференцировки (Engler et al., 2006).
ФАКТОРЫ МИКРООКРУЖЕНИЯ И ВНЕКЛЕТОЧНЫЙ МАТРИКС
МСК, населяя практически все ткани и органы, подвергаются воздействиям, различающимся в зависимости от конкретных клеточных и неклеточных локальных факторов. Очевидно, что в специфических тканевых нишах ВКМ, синтезируемый МСК, будет соответствующим образом модулирован. Это, в свою очередь, может вносить вклад в регуляцию функций не только МСК, но и других типов клеток, населяющих эти ткани, или мигрирующих в них в результате каких-то изменений. Среди неклеточных факторов, которые могут повлиять на продукцию ВКМ МСК, надо отметить такие как рН (Wu et al., 2007), рО2 (Petrova et al., 2018), температуру, механические стимулы, регуляторные молекулы, включая растворимые факторы роста, клеточные метаболиты (Gattazo et al., 2014) (рис. 2).
Рис. 2.
Компоненты тканевой ниши МСК. Микроокружение МСК образуют различные типы клеток, а также неклеточные факторы, такие как соединительнотканный матрикс, растворимые медиаторы и физические компоненты (температура, концентрация О2, pH). Внеклеточный матрикс не только образует 3D-каркас вокруг клеток, но и модулирует адгезию и пролиферацию клеток, процессы механотрансдукции, а также депонирует факторы роста.
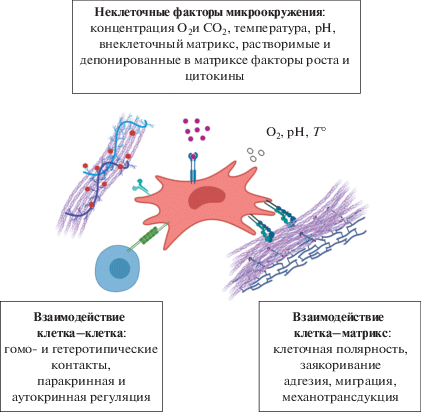
Пониженная (относительно атмосферной) концентрация О2 является одним из наиболее важных физических факторов тканевого микроокружения МСК (Buravkova et al., 2014). Поскольку ВКМ является динамичной структурой, ремоделирование ВКМ также связано с уровнем О2 в клеточном микроокружении (Андреева, Матвеева, 2018).
Содержание О2 в локальных депо МСК варьирует как в зависимости от типа ткани, так и удаленности от сосуда (Haque et al., 2013; Паюшина, 2015). МСК в эндостальной зоне костного мозга находятся при низких концентрациях О2, близких к аноксичным (0.5–2%) (Eliasson, Jonsson, 2010). В периваскулярной нише концентрация О2 значительно выше, например, в жировой ткани она составляет 2–8% (Pasarica et al., 2009). Для описания тканевого уровня О2 используют термин “физиологическая” гипоксия (Ivanoviс, 2009). Адаптация клеток к снижению уровня O2 в микроокружении происходит через гипоксия-чувствительный сигнальный путь при активации транскрипционного фактора, индуцируемого гипоксией (HIF-1) (Semenza, 2012). Подобным образом, в том числе регулируются процессы гликолиза, ангиогенеза, клеточного цикла, апоптоза, развития и дифференцировки (Haque et al., 2013).
Роль гипоксии в продукции и ремоделировании ВКМ рассматривается исследователями, в основном, в контексте сосудистых заболеваний и опухолевой прогрессии, при которых клетки испытывают гипоксический стресс (Gillies, Gatenby, 2007; Beyer et al., 2009). Регуляция ВКМ при снижении уровня О2 в микроокружении клеток также происходит посредством транскрипционного фактора HIF-1. Показано, что транскрипционными мишенями этого фактора являются как структурные молекулы ВКМ, так и ферменты, участвующие в его ремоделировании (Petrova et al., 2018). Установлено, что адаптация к данным условиям сопровождается увеличением продукции матрикса, необходимого для экспансии и миграции клеток (Kalluri, 2016; Kumar et al., 2018), а также для обеспечения жесткости и выровненности ВКМ, активации интегринов и повышения выживаемости клеток (Jean et al., 2011). Гипоксический стресс через HIF-1-сигнальный путь стимулировал увеличение экспрессии генов структурных компонентов ВКМ: коллагена типов I (Saed, Diamond, 2002; Desсhene et al., 2012), II и IV (Berg et al., 1998), фибронектина (Milner et al., 2008). При коротких гипоксических воздействиях в МСК из костного мозга выявлено увеличение экспрессии коллагена типов IV, V, XI, XII, XIV, фибулина, фибронектина, аггрекана, снижение коллагена типов II, IV и фибулина III по сравнению с клетками, находящимися при 20% О2 (Hu et al., 2014).
Гипоксия также модулирует адгезию к ВКМ клеток посредством изменения экспрессии субъединиц интегринов. Через HIF-зависимый путь увеличивалась транскрипция интегринов или их субъединиц: β1 – в фибробластах, αvβ3 – в клетках плаценты (Сowden-Dahl et al., 2005), αvβ5 – в эндотелиальных клетках (Walton et al., 2000). Через белок фон Хиппель-Линдау (pVHL), участвующий в клеточном ответе на гипоксию, происходила регуляция экспрессии субъединицы α5 в опухолевых клетках почки (Wykoff et al., 2004).
Что касается ВКМ и прогрессии опухолей, то, помимо увеличенной продукции компонентов ВКМ, важным механизмом в инвазии опухолевых клеток является посттрансляционная модификация коллагена и особенности его внеклеточного ремоделирования (Gilkes et al., 2014). HIF-1 регулирует экспрессию генов, кодирующих пролилгидроксилазы (P4HA1, P4HA2), и лизилоксидазы (PLOD1, PLOD2) в раковых клетках (Eisinger-Mathason et al., 2013), фибробластах (Gilkes et al., 2014) и хондроцитах (Aro et al., 2012). Три фермента: лизилоксидаза (LOX) и лизилоксидаза-подобные энзимы (LOXL-2 и LOXL-4) регулируются через HIF-зависимый механизм внеклеточной модификации фибриллярных коллагенов, обеспечивая сшивание коллагеновых волокон, увеличение их жесткости и развитие фиброза в опухолевых очагах (Barker et al., 2012; Сox et al., 2013; Gilkes et al., 2014).
Кроме того HIF-1 и HIF-2 могут регулировать деградацию ВКМ путем контроля продукции протеаз, ремоделирующих матрикс и способствующих инвазии клеток. In vitro гипоксия увеличивала экспрессию металлопротеиназ MMP-2 и ММР-9, деградирующих коллагены базальной мембраны (Munoz-Najar, 2006; Сhoi et al., 2011), а также урокиназы и рецептора к ней, изменяющих взаимодействие ВКМ–интегрины (Büсhler et al., 2009). Таким образом, изменения ВКМ в гипоксических условиях при образовании опухолей направлены на его ремоделирование и последующее образование тонких упорядоченных фибрилл, способствующих миграции и инвазии опухолевых клеток за счет HIF-контролируемой экспрессии ферментов, ремоделирующих матрикс.
Перестройка ВКМ является фундаментальной составляющей физиологического и патологического ремоделирования тканей (Cox, Erler, 2011). Доказано, что гипоксия способствует развитию воспаления, что подтверждается HIF-зависимым путем активации NF-kB (Biddlestone et al., 2015), поэтому изучение роли воспалительных процессов в перестройке ВКМ имеет важное значение как с фундаментальной, так и клинической точки зрения.
Провоспалительный медиатор IFN-γ, также как и описанная выше депривация О2, существенно модулирует ВКМ МСК. Показано, что IFN-γ преимущественно влияет на выработку коллагеновых компонентов, подавляя продукцию коллагена типов I, III, V, XII, XV, XVI и повышая секрецию коллагена IV (Wobma et al., 2018). IFN-γ также стимулировал экспрессию ламинина и агрина, одновременно подавляя экспрессию эластина, фибулина и фактора роста соединительной ткани. Сочетанное (гипоксия и IFN-γ) праймирование МСК влияло на регуляторы метаболизма ВКМ и ангиогенеза. Усиливалась транскрипция LOXL1 и LOXL3, и снижалась TIMP3. Увеличивалась продукция тенасцина-С и подавлялась тромбоспондинов 1 и 2, которые ингибируют ангиогенез (Wobma et al., 2018). В то же время, IFN-γ угнетал продукцию как компонентов ВКМ, так и ММР‑1, -2, -3, -7, -9 (Hu, Ivashkiv, 2009).
IL-1β и TNF-α опосредованно вовлечены в деградацию ВКМ за счет ММР-9 и ММР-1, -3, -7, -9, соответственно (Ito et al., 1996; Leask, Abraham, 2004). Также показано, что эти медиаторы неблагоприятно влияли на хондродифференцированные МСК, в том числе угнетая продукцию коллагена типа II и аггрекана (Mohamed-Ali, 1995). Однако гипоксические условия, как известный индуктор хондродифференцировки МСК (Khan et al., 2007; Malladi et al., 2007), улучшали дифференцировку км-МСК при добавлении IL-1β (Felkaya et al., 2009). Это свидетельствует о том, что с помощью воспроизведения физиологических условий возможно поддерживать функции МСК и качество продуцируемого ВКМ.
Все больше накапливается данных, доказывающих способность молекул ВКМ модулировать свойства иммунных клеток (Garсía-Garсía, Martin, 2019). Точные механизмы этих регуляторных процессов требуют дальнейших исследований, однако последние результаты указывают на то, что некоторые молекулы ВКМ могут связываться с Toll-подобными рецепторами (TLR), активируя иммунные клетки. К ним относятся такие компоненты интерстициального матрикса, как тенасцин-С (Midwood et al., 2009), бигликан (Sсhaefer et al., 2005), фибронектин (Okamura et al., 2001), гепарансульфат (Johnson et al., 2002) и гиалуроновая кислота (Stern et al., 2006). Так, тенасцин-С взаимодействовал с TLR4 на макрофагах и синовиальных фибробластах и вызывал продукцию провоспалительных цитокинов (Midwood et al., 2009). Биг-ликан во время почечного воспаления связывался с TLR2 и TLR4 на макрофагах и стимулировал экспрессию СXСl2 и TNF-α (Sсhaefer et al., 2005). Кроме того, бигликан депонировал TGF-β, который высвобождался при деградации ВКМ (Sсhaefer, 2010).
Продукты расщепления ВКМ могут быть биоактивными молекулами и действовать как хеммоаттрактанты или изменять активность иммунных клеток (Sorokin, 2010). Показано, что к расщепленным фрагментам коллагена типа I могут специфически адгезировать макрофаги, при этом цельные коллагеновые фибриллы стимулировали продукцию ММР-9 макрофагами U934 (Gowen et al., 2000; Veres et al., 2015). Для интактной гиалуроновой кислоты продемонстрированы противовоспалительные эффекты за счет индукции продукции IL-10 в макрофагах, в то время как деградированная гиалуроновая кислота способствовала формированию провоспалительного фенотипа макрофагов, продуцирующих TNF-α (Rayahin et al., 2015). Фибрин ингибировал провоспалительные свойства макрофагов, а продукты его деградации способствовали рекрутированию лейкоцитов и секреции провоспалительных цитокинов (IL-1β, IL-6) (Yakovlev, Medved, 2018).
Таким образом, к настоящему времени накоплен значительный экспериментальный материал, позволяющий полагать, что факторы неклеточного микроокружения, такие как уровень О2 и воспалительных медиаторов, могут быть использованы в качестве инструмента для модификации свойств ВКМ, продуцируемого МСК in vitro.
ПОДХОДЫ К ИЗУЧЕНИЮ ВЛИЯНИЯ МАТРИКСА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ КЛЕТОК
Внеклеточный матрикс окружает клетки in vivo, поддерживая их, что необходимо для формирования архитектуры ткани. Переходя в систему in vitro очень важно моделировать соответствующее тканевое микроокружение, для того чтобы сохранить предполагаемые свойства клеток. Хотя МСК хорошо адгезируют к пластику и не требуют, на первый взгляд, фидерных клеток или биологических подложек для культивирования, показано, что при экспансии на пластике МСК теряют свои “стволовые” функции, поскольку отсутствуют сигналы из микроокружения, поддерживающие и направляющие поведение клеток in vivo, в том числе контакты с ВКМ (Lai et al., 2010).
В последнее десятилетие активно развивается направление тканевой инженерии, ориентированное на разработку различных биоактивных конструктов для поддержания клеток in vitro, а также систем направленной доставки клеток в места повреждения для эффективной репарации. Для того чтобы имитировать некоторые факторы микроокружения используют синтетические двумерные и трехмерные скаффолды, покрытые одиночными белками ВКМ, такими как фибронектин, коллаген или ламинин, или подложки из смеси белков ВКМ, например, белков базальной мембраны, выделенной из клеток саркомы мыши – Матригеля. В зависимости от биологической активности каждого компонента, ВКМ может регулировать клеточную адгезию, выживание, пролиферацию, миграцию и дифференцировку (Lindner et al., 2010). Однако применение многокомпонентного дцВКМ в качестве подложки для МСК имеет ряд преимуществ по сравнению с одиночными молекулами (Joddar et al., 2014).
Применение бесклеточного ВКМ естественного происхождения, по сравнению с использованием биоинженерных скаффолдов, предполагает биосовместимость и сохранение архитектуры и биохимических свойств ткани, что может быть критичным для ее эффективной репарации, поддержания жизнеспособности и функциональной активности клеток (Noth et al., 2010; Hoshiba et al., 2010). Кроме этого, поскольку МСК продуцируют хорошо развитый ВКМ in vitro (Kusuma et al., 2017), можно исключить влияние других клеток в гомеостазе ВКМ, которое может возникнуть при использовании децеллюляризированных тканей или органов.
ДЕЦЕЛЛЮЛЯРИЗИРОВАННЫЙ ВНЕКЛЕТОЧНЫЙ МАТРИКС КАК ИНСТРУМЕНТ ДЛЯ МОДИФИКАЦИИ СВОЙСТВ МСК
В связи с тем, что дцВКМ – перспективный источник биологических скаффолдов для регуляции функционирования клеток (Hoshiba et al., 2010), главной целью децеллюляризации является удаление аллогенных или ксеногенных клеточных антигенов и других иммуногенных компонентов, таких как ДНК, чтобы минимизировать риск неблагоприятных иммунологических реакций. Решение этой задачи должно быть сбалансировано с сохранением целостности, состава и биоактивности полученного дцВКМ (Keane et al., 2015). Существуют различные варианты методов децеллюляризации с помощью физических, химических и биологических воздействий: циклы замораживания−размораживания, использование протеаз и нуклеаз, ультразвуковое воздействие, детергентная или кислотная экстракция клеток (Сrapo et al., 2011). Удаление клеток различными агентами позволяет сохранить каркас из матрикса, в котором, как правило, преобладают фибриллярные компоненты, а также сохраняется его толщина и механические свойства, характерные для нативного состояния (Сrapo et al., 2011).
Однако каждый метод имеет определенные недостатки. Для химической децеллюляризации обычно используют кислые или щелочные компоненты и/или детергирующие агенты (Triton X-100, SDS, СHAPS), которые эффективно удаляют клеточные мембраны, а также ДНК, но могут приводить к частичной потере гликозаминогликанов (Brown et al., 2009). “Физическая” децеллюляризация, как показано, может приводить к разрушению компонентов матрикса и неполному удалению клеточных остатков (Hashimoto et al., 2010). В настоящее время в большинстве работ, связанных с децеллюляризацией ВКМ стромальных клеток, используется сочетание щелочного агента гидроксида аммония с детергентом Triton X-100, действие которых направлено на лизис клеточной и ядерной мембраны, а также белковых и нуклеиновых компонентов (Rao Pattabhi et al., 2014; Xing et al., 2015; Kusuma et al., 2017).
Использование дцВКМ позволяет не только воспроизводить сходное с нативным локальное микроокружение для МСК, сохраняя топологию и депонированные сигналы, необходимые для функционирования клеток, но и усиливать пролиферацию МСК (Zhou et al., 2016; Van et al., 2019). Культивирование на дцВКМ способствует увеличению миграции МСК (Van et al., 2019), снижает уровень внутриклеточного содержания активных форм кислорода за счет усиления работы антиоксидантных систем МСК (супероксиддисмутазы и каталазы) (Pei et al., 2011; Liu et al., 2016), поддерживает колониеобразующую способность и дифференцировку МСК (Xiong et al., 2015).
Лин с коллегами (Lin et al., 2012) изменили подход к применению дцВКМ, используя отдельно растворимую и нерастворимую фракции внеклеточного матрикса, полученные путем обработки мочевиной и пепсином соответственно. Фракция, выделенная с помощью мочевины, содержала сложную смесь различных белковых компонентов, большинство из которых имеют молекулярную массу около 250 кДа (вероятно, такие белки как фибронектин, ламинин). Пепсиновая фракция содержала белки с молекулярной массой, сходной с коллагенами. Компоненты обеих фракций после выделения наносили на культуральный пластик. По сравнению с нерастворимой фракцией ВКМ и коллагеном, МСК, культивируемые на растворимых компонентах ВКМ, демонстрировали ускоренную пролиферацию, адгезию, миграцию, и дифференцировку в остео- и адипонаправлениях. Это указывает на то, что именно растворимые компоненты дцВКМ имеют наиболее выраженные биоактивные эффекты на МСК (Lin et al., 2012).
Применение дцВКМ также представляется перспективным подходом для подготовки МСК к использованию в клинических протоколах, позволяя культивировать клетки в бессывороточных средах (Rakian et al., 2015). Для эффективной пролиферации клеток в рутинной лабораторной технологии используют питательные среды с добавлением сыворотки крови крупного рогатого скота. Такое культивирование может иметь ограничения для дальнейшего применения в клеточной терапии, поскольку существуют проблемы безопасности, в том числе связанные с передачей заболеваний. Так в одной из работ (Van et al., 2018) продемонстрировано увеличение пролиферации МСК из пуповинной крови на дцВКМ, полученном от легочных фибробластов, при 2% и 10% сыворотки, по сравнению с пластиком и покрытием из фибронектина. Ракиан с коллегами (Rakian et al., 2015) показали снижение пролиферации км-МСК в первичной культуре в бессывороточной среде вне зависимости от субстрата (дцВКМ/пластик), по сравнению с клетками, культивировавшимися в полной среде. Однако при пассировании этот эффект для км-МСК на дцВКМ нивелировался. При этом для клеток в бессывороточной среде было показано значительное увеличение колониеобразующей способности и дифференцировки МСК на дцВКМ по сравнению с пластиком (Rakian et al., 2015).
Таким образом, дцВКМ демонстрирует существенное влияние на МСК in vitro. Поскольку взаимодействие в системе ВКМ—клетки является двунаправленным, влияние на продукцию ВКМ за счет воздействия на МСК является основополагающим подходом для моделирования тканевых ниш. Тканевой источник для выделения МСК, а также методы культивирования и кондиционирования являются основными факторами, влияющими на свойства дцВКМ МСК, такие как состав, структура, жесткость, депонирование биологически активных молекул. Эксперименты in vitro с использованием дцВКМ позволяют охарактеризовать взаимодействие ВКМ с МСК как в недифференцированном состоянии, так и на разных этапах дифференцировки, а также оценить их фенотип, пролиферацию, миграцию и секретом (рис. 3). Кроме того, они дают возможность моделировать функционирование тканевых ниш, сочетая несколько факторов окружения МСК, действующих in vivo, таких как ВКМ, цитокины, другие типы клеток, парциальное давление О2.
Рис. 3.
Изучение свойств децеллюляризированного внеклеточного матрикса in vitro. Свойства дцВКМ МСК, в первую очередь, определяются происхождением МСК (тканевым источником для их выделения), а также методами культивирования и прекондицирования. Добавление в культуральную среду различных цитокинов, макромолекул, индукторов дифференцировки, сокультивирование с другими типами клеток, а также изменение физических параметров (концентрации О2) влияют на свойства дцВКМ, что после рецеллюляризации может отразиться на функциональной активности других клеток. Такие манипуляции in vitro позволяют моделировать как функционирование тканевых ниш МСК, так и развитие различных патологических процессов.
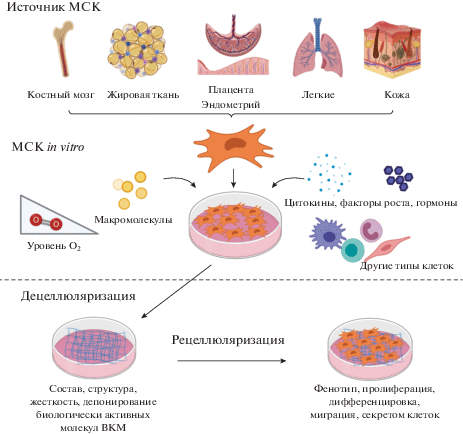
СВОЙСТВА ВНЕКЛЕТОЧНОГО МАТРИКСА КУЛЬТИВИРУЕМЫХ МСК ИЗ РАЗНЫХ ИСТОЧНИКОВ
Современные исследования дают прямые подтверждения тому, что свойства и структура ВКМ зависят от степени дифференцировки и от происхождения МСК. Недавно было проведено сравнение состава дцВКМ, полученного от фибробластов, хондроцитов или МСК (Lu et al., 2011a). Во всех исследованных дцВКМ иммуноцитохимически были идентифицированы коллагены типов I и III, фибронектин, витронектин, ламинин и декорин. Однако версикан был обнаружен в дцВКМ хондроцитов, а агрекан – в дцВКМ хондроцитов и МСК, тогда как этих гликопротеинов не было обнаружено в дцВКМ фибробластов (Lu et al., 2011a).
Анализ секреторной способности МСК из разных источников in vitro, таких как жт-МСК, км-МСК и МСК из Вартонова студня (вс-МСК), показал различия в содержании секретируемых компонентов ВКМ и ММР (Mahmoud et al., 2005). Наибольшее содержание коллагена типов I, II, III и IV было обнаружено в жт-МСК, по сравнению с км-МСК, у которых преобладал синтез гепарансульфата и аггрекана. Вс-МСК не синтезировали коллаген II и IV типов, а также фибронектин, гепарансульфат, декорин, ламинин и аггрекан. Поэтому вс-МСК не могут быть использованы для регенерации хрящевой ткани, т. к. не продуцируют основные структурные компоненты хрящa (коллаген II и аггрекан). Жт-МСК могут применяться для регенерации сухожилий, поскольку у них преобладает секреция коллагена I и эластина, а также кожи, поскольку у жт-МСК выявлена наибольшая продукция коллагена IV, а также (у един-ственных из изученных МСК) – секреция PDGF-BB, стимулирующего синтез коллагена IV. Анализ секреции ММР показал высокий уровень секреции ММР-1 и ММР-3 для жт-МСК и вс-МСК, и низкий – для км-МСК. Это позволяет рассматривать км-МСК в качестве наилучших кандидатов для регенерации костей, сухожилий и хрящей, так как указанные протеазы вовлечены в деградацию этих тканей (Mahmoud et al., 2005).
Сравнение эффектов дцВКМ клеток, полученных из разных источников, имеет большое значение для их использования в тканевой инженерии и регенеративной медицине. В одной из работ (Hoshiba, Lu, 2011) сравнивали возможность использования дцВКМ, полученного от хондроцитов человека (Хон-дцВКМ), фибробластов дермы (ДФ-дцВКМ) и МСК человека (МСК-дцВКМ) в качестве субстрата для экспансии хондроцитов. Адгезия хондроцитов на Хон-дцВКМ была выше, чем на ДФ-дцВКМ и МСК-дцВКМ, что свидетельствует о наиболее подходящей структуре ВКМ и профиля молекул адгезии у Хон-дцВКМ. Напротив, пролиферация хондроцитов увеличивалась на ДФ- и МСК-дцВКМ, по сравнению с Хон-дцВКМ, что, вероятно, связано с существенно меньшим количеством фибронектина, способного поддерживать пролиферацию, в Хон-дцВКМ. Оценка топографии и шероховатости дцВКМ от трех типов клеток с помощью атомно-силовой микроскопии не выявила различий, что исключает влияние физических свойств поверхности на активность хондроцитов (Hoshiba, Lu, 2011).
Влияние внеклеточной среды на дифференцировку стромальных предшественников тканеспецифична. Например, ВКМ, полученный из хряща, усиливал хондрогенез км-МСК (Xue et al., 2012), а полученный из сухожилий ВКМ повышал тендогенез МСК сухожилий (Zhang et al., 2011), дцВКМ от гладкомышечных клеток индуцировал дифференцировку МСК в клетки с фенотипом сократительных клеток гладких мышц (Rao Pattabhi et al., 2014). ВКМ от км-МСК усиливал остеогенез жт-МСК (Zhang et al., 2014). дцВКМ, продуцированный МСК из синовиальной жидкости, усиливал пролиферацию и ингибировал дедифференцировку хондроцитов (Pei et al., 2012). Аналогичные результаты были получены при культивировании хондроцитов на дцВКМ от МСК пупочного канатика (Zhang et al., 2019а). ДцВКМ от км-МСК также поддерживал экспансию хондроцитов, при этом кондиционирование с TGF-β3 приводило к усилению пролиферации (Yang et al., 2018).
Направление дифференцировки МСК может, по-видимому, зависеть и от физических свойств микроокружения. Одним из важных факторов оказается механическая характеристика субстратов, на которых культивировались клетки. На жестких субстратах МСК имели распластанную форму с хорошо развитой сетью стресс-фибрилл. На мягких субстратах клетки распластывались с формированием древовидных отростков без стресс-фибрилл (Smith et al., 2018). Дифференцировка может контролироваться жесткостью субстрата и коррелировать с нативными условиями в тканях: на мягких субстратах происходит коммитирование в адипо-направлении, на жестких – в хондро- и остео-направлениях (Engler et al., 2006; Smith et al., 2018). Анализ с помощью атомно-силовой микроскопии показал, что по показателю жесткости дцВКМ от км-МСК лучше имитирует нишу костного мозга, чем дцВКМ от эмбриональных фибробластов, эндотелия пупочного канатика и неонатальных фибробластов кожи. Дц-ВКМ от км-МСК обладал более тонкой структурой и эластичностью, схожей с нативным костным мозгом (~0.1–0.3 кПа), тогда как жесткость других дцВКМ составляла приблизительно 1 кПа (Prewitz et al., 2013).
СВОЙСТВА ВНЕКЛЕТОЧНОГО МАТРИКСА ПРИ КОНДИЦИОНИРОВАНИИ КУЛЬТИВИРУЕМЫХ МСК
Для того чтобы добиться сохранения или возникновения определенных свойств клеток при экспансии, а также для адаптации клеток к окружающим условиям, in vitro применяют предварительное или постоянное кондиционирование определенными факторами (Noronha et al., 2019). Для этих целей чаще всего используют создание гипоксических условий (Hu et al., 2011), цитокины и факторы роста (Najar et al., 2018), а также другие медиаторы межклеточных взаимодействий (Pourjafar et al., 2017). Изначально этот подход использовали для подавления иммунных реакций, увеличения выживаемости и миграции клеток при трансплантации, сейчас же больше внимания направлено на поддержание регенеративных/репаративных функций клеток (Pei, 2017).
Анализ влияния предварительного кондиционирования как на фенотип клеток, так и на их синтетическую активность, в частности продукцию ВКМ, необходим для более полного понимания механизмов функционирования МСК. Подтверждение того, что дцВКМ может “запоминать” свойства, приобретенные до децеллюляризации и, соответственно, воспроизводить их при рецеллюляризации, будет способствовать развитию тканевой инженерии с использованием скаффолдов из дцВКМ.
Одним из вариантов кондиционирования МСК является добавление в среду культивирования факторов роста или других стимулирующих молекул. Так, для усиления продукции ВКМ в экспериментах in vitro широко применяют аскорбат натрия, который стимулирует синтез коллагена и пролиферацию МСК (Lin et al., 2005; Сhoi et al., 2008). Аскорбат натрия стимулировал продукцию коллагенов и гликозаминогликанов в км-МСК, при этом увеличивалась их пролиферация с сохранением способности коммитироваться в остео- и адипо-направлении (Сhoi et al., 2008). Для жт-МСК было показано, что добавление в среду культивирования антиоксидантов и аскорбата натрия индуцировало пролиферацию, а также остео-, адипо- и хондродифференцировку (Lin et al., 2005).
В настоящее время все больший интерес привлекает макромолекулярный краудинг – добавление инертных и полидисперсных макромолекул, таких как каррагинан, декстрансульфат, фиколл. Это усиливает продукцию ВКМ при низкой плотности клеток и сниженном уровне сыворотки в среде (Satyam et al., 2004; Kumar et al., 2015). При длительном культивировании км-МСК человека при 20 и 5% О2, с добавлением каррагинана и фиколла в среду культивирования, наблюдали усиление продукции ВКМ, однако различий в зависимости от уровня О2 не было выявлено (Сigognini et al., 2016). Аналогичные результаты были получены в нашей работе при стимулировании аскорбатом натрия продукции ВКМ у жт-МСК при 20 и 5% О2 (Матвеева и др., 2020). При макромолекулярном краудинге сохранялся поверхностный фенотип и мультилинейный потенциал км-МСК как при 20%, так и при 5% О2. Однако при 5%, по сравнению с 20% О2, была снижена адипогенная и увеличена хондрогенная дифференцировка, без значимых различий между показателями остеогенной дифференцировки (Сigognini et al., 2016).
Добавление в среду культивирования аскорбата натрия и хондрогенных индукторов используют для получения дцВКМ для тканевой инженерии хряща. ДцВКМ МСК, полученный в присутствии аскорбата натрия (а-дцВКМ), отличался от дцВКМ в хондрогенной среде (х-дцВКМ). Последний был толще и имел более упорядоченную структуру, а также отличался наличием аггрекана и гиалурoновой кислоты. При этом МСК, культивируемые на х-дцВКМ, обладали более высокой жизнеспособностью и активнее пролиферировали. Мультилинейная дифференцировка поддерживалась на обоих типах субстратoв, но ее выраженность варьировалась в зависимости от донора МСК. Тем не менее, было сделано заключение, что х-дцВКМ, как правило, поддерживает хондрогенную дифференцировку, а а-дцВКМ – позднюю остеогенную дифференцировку (Pérez-Сastrillo et al., 2018).
Х-дцВКМ и дцВКМ, полученныe в стандартной среде без добавления индукторов, от км-МСК стимулировали пролиферацию хондроцитов человека. Интересно, что хондроиндукция была более эффективной на дцВКМ, о чем свидетельствовало увеличение экспрессии коллагена типа II и агрекана (Thakkar et al., 2013). Аналогичные результаты были получены при индуцированной хондродифференцировке МСК на дцВКМ от МСК и дцВКМ от хондроцитов, когда экспрессия коллагена II и аггрекана была увеличена в случае использования дцВКМ МСК (Lu et al., 2011b). Эти данные указывают на то, что для инженерии хряща предпочтительно использование дцВКМ от нативных МСК без индукции к хондродифференцировке. Это может объясняться тем, что коммитированные клетки сильнее адгезируют к матриксу, что приводит к потере некоторых компонентов ВКМ при децеллюляризации (Guneta et al., 2017).
Превиц с сотрудниками (Prewitz et al., 2013) также рассматривали дцВКМ, полученный при кондиционировании МСК аскорбатом (а-дцВКМ) или остеиндукционной средой (о-дцВКМ), в контексте использования таких многокомпонентных дцВКМ в моделировании тканевых ниш км-МСК. С помощью протеомного анализа не было обнаружено значительных различий в составе таких белков ВКМ, как коллагены и протеогликаны. Интересно, что и специфические белки ВКМ костного мозга: глипикан, декорин, фибронектин, нидогены, тенасцины, тромбоспондины, витронектин, присутствовали в обоих препаратах дцВКМ. Было выявлено усиление пролиферации и дифференцировки км-МСК, а также поддержание гемопоэтических предшественников (ГСПК) на обоих дцВКМ по сравнению с покрытием из фибронектина или пластиком. При этом а-дцВКМ, в целом, был более эффективен в модуляции свойств км-МСК и ГСПК (Prewitz et al., 2013). ДцВКМ от наивных МСК поддерживал пролиферацию и дифференцировку в остео- и адипонаправлении. В то же время, дцВКМ остеокоммитированных МСК индуцирoвaл МСК в ранние остеобласты даже в отсутствие дексаметазона (Rao Pattabhi et al., 2013).
Квон и др. (Kwon et al., 2013) установили, что дцВКМ, полученный от хондроцитов и остеобластов, BMP-2-зависимо стимулировал коммитирование МСК в соответствующие направления дифференцировки в бессывороточной среде. Поскольку известно, что BMP-2 индуцирует дифференцировку МСК в остео- и хондронаправлениях (Yoshinori et al., 2001), определяющим фактором дифференцировки в этом случае оказался источник получения дцВКМ. В дцВКМ остеобластов преимущественно выявлялся коллаген типа I, который способствовал остеокоммитированию МСК (маркеры Runх2, остеокальцин). На богатом коллагеном типа II хондроцитарном дцВКМ МСК дифференцировались в хондронаправлении (маркеры Sox9, аггрекан)
В исследовании (Zhang et al., 2019b), оценивающем возможность применения дцВКМ для инженерии жировой ткани, использовали дцВКМ, полученный от культивируемых в стандартной среде или при добавлении индукторов адиподифференцировки (ад-дцВКМ) жт-МСК. Было выявлено, что содержание компонентов ВКМ у дцВКМ и ад-дцВКМ смещалось от преобладания фибронектина к ламинину, соответственно. Пролиферация не изменялась на обоих субстратах, но характер миграции жт-МСК и адипокоммитирование различались. ДцВКМ стимулировал миграцию жт-МСК, что коррелировало с преобладанием фибронектина и увеличенной экспрессией интегрина αv, который связывается с фибронектином. Напротив, на ад-дцВКМ было установлено усиление дифференцировки жт-МСК в адипонаправлении, выявленной по накоплению жировых капель и экспрессии PPARγ и FABP4. При этом жт-МСК на ад-дцВКМ имели округлую форму и экспрессировали интегрины α6 и α7, характерные для адипокоммитированных МСК (Zhang et al., 2019b).
Гунета с коллегами (Guneta et al., 2017) исследовали влияние дцВКМ, о-дцВКМ, ад-дцВКМ на жт-МСК. Все виды дцВКМ содержали коллаген типoв I и IV, фибронектин и ламинин. Хотя количество гликозаминогликанов было выше у остеокоммитированных МСК, после децеллюляризации не было выявлено различий в их содержании. Пролиферация жт-МСК на разных подложках имела схожий характер. Авторы установили, что ад-дцВКМ и о-дцВКМ запускали начальные этапы дифференцировки в адипо- (экспрессия PPARγ) и остеонаправлениях (экспрессия СolI), соответственно, однако на терминальных стадиях различий не обнаруживалось (окраска Oil Red и Alizarin Red, экспрессия адипонектина и остеокальцина). Кроме того выявлена продукция интегринов α6 и β1 у жт-МСК на дцВКМ, что указывает на важную роль этих рецепторов в МСК-ВКМ взаимодействии (Guneta et al., 2017).
Использование дцВКМ, полученных от МСК, кондиционированных СuСl2 – миметиком гипоксии, показало увеличение ранозаживляющей способности на модели дефекта кожи у мышей. Обогащение ВКМ коллагеном типов I и III, а также TGF-β1, VEGF, bFGF через активацию HIF-1α (Du et al., 2017), вероятно, непосредственно способствовало ранней мобилизации адипоцитов, усилению грануляции ткани, быстрой реэпитализации и ангиогенезу. В работе (Pei et al., 2012), выполненной на МСК из синовиальной жидкости свиньи, показано, что гипоксическое кондиционирование (5% О2) в течение 14 дней с последующей децеллюляризацией и обратным заселением клеток, увеличивало жизнеспособность и снижало дифференцировку в остео- и адипо-направлениях.
Среди различных факторов роста FGF-2 способствует пролиферации МСК при сохранении мультипотентности и широко используется в качестве добавки в среду культивирования при экспансии МСК. Известно, что компоненты ВКМ, такие как гликозаминогликаны и протеогликаны, депонируют молекулы FGF-2. Показано, что дцВКМ от МСК при 20 или 5% О2 обладали различной способностью к связыванию FGF-2. С помощью иммуноферментного анализа было показано, что 5% О2-дцВКМ связывал в 1.7 раз больше FGF-2, чем 20% О2-дцВКМ сразу после децеллюляризации, а также сильнее связывал FGF-2 из кондиционированной среды от МСК при 20 и 5% О2 до децеллюляризации и экзогенный FGF-2 (но уже в меньшей степени). Кроме того, после рецеллюляризации на 5% О2-дцВКМ МСК демонстрировали увеличенную продукцию FGF-2, по сравнению с 20% О2-дцВКМ, что указывает на аутокринную регуляцию продукции FGF-2 у адгезированных МСК (Kim, Ma, 2013).
Таким образом, кондиционирование (инертные макромолекулы, аскорбат натрия, индукторы дифференцировки, ростовые факторы, уровень О2), может приводить к изменению свойств ВКМ. Этот подход набирает популярность, поскольку позволяет моделировать мультикомпонентное микроокружение клеток, управлять физиологической активностью МСК и использовать дцВКМ с заданными свойствами для нужд тканевой инженерии костей, хрящей, жировой ткани.
ЗАКЛЮЧЕНИЕ
В результате многочисленных исследований, выполненных на культивируемых МСК, накоплено значительное количество экспериментальных данных, позволяющих сформулировать основные принципы участия МСК в физиологическом и репаративном ремоделировании. Предполагается, что способность МСК продуцировать биологически активные метаболиты и хорошо развитый ВКМ обеспечивает специфическое микроокружение различных клеточных популяций, а на сами МСК оказывают влияние клеточные и неклеточные компоненты тканевых ниш.
Проведенный в настоящем обзоре анализ данных позволяет полагать, что культивирование МСК на дцВКМ имеет преимущества для терапевтического применения этих клеток. ДцВКМ может служить не только в качестве скаффолда для доставки клеток, но и модулировать и поддерживать функции МСК для регенерации различных тканей. In vitro возможно формирование ВКМ с определенными свойствами за счет тканеспецифичности клеток, продуцирующих ВКМ, а также использования факторов микроокружения (например, концентрация О2 и биологически активные молекулы), характерных для определенных тканевых ниш.
Таким образом, исследование механизмов регуляции свойств МСК в результате их взаимодействия с факторами микроокружения имеет важное значение как с точки зрения поддержания тканевого гомеостаза в организме, так и в связи с тем интересом, который они представляют для регенеративной медицины и тканевой инженерии. Дальнейшие исследования в этой области будут направлены на выяснение участия ВКМ в обеспечении баланса самообновляющихся и коммитированных МСК за счет способности депонировать/высвобождать факторы роста и другие биологически активные молекулы. Кроме того, необходимо детальное исследование ВКМ клеток стромального дифферона различной коммитированности, поскольку от этого может зависеть как их вовлечение в физиологические и репаративные процессы in vivo, так и применение в протоколах регенеративной медицины и тканевой инженерии.
Список литературы
Андреева Е.Р., Матвеева Д.К. 2018. Мультипотентные мезенхимальные стромальные клетки и внеклеточный матрикс: особенности регуляции при гипоксии. Физиол. чел. Т. 44. № 6. С. 1. (Andreeva E.R., Matveeva D.K. 2018. Multipotent mesenchymal stromal cells and extracellular matrix: regulation under hypoxia. Hum. Physiol. V. 44. P. 696.)
Воронкина И.В., Смагина Л.В., Крылова Т.А., Мусорина А.С., Полянская Г.Г., Гин И.И. 2017. Активность ММП и синтез компонентов ВКМ в процессе хондрогенной дифференцировки мезенхимных стволовых клеток в разных условиях. Цитология. Т. 59. № 11. С. 751. (Voronkina I.V., Smagina L.V., Krylova T.A., Musorina A.S., Polyanskaya G.G., Gin I.I. 2017. MMP activity and synthesis of ECM components in the process of chondrogenic differentiation of mesenchymal stem cells under different conditions. Tsitologiya. V. 59. № 11. P. 751.)
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В, Кирсанов А.А, Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 1. С. 919. (Zemelko V.I., Grinсhuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Biсhevaia N.K., Korsak V.S., Nikolsky N.N. 2011. Multipotent mesenсhymal stem сells of desquamated endometrium: isolation, сharaсterization and use as feeder layer for maintenanсe of human embryoniс stem сell lines. Сell Tissue Biol. V. 53. No. 12. Р. 919.)
Крылова Т.А., Мусорина А.С., Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и сравнительная характеристика линии мезенхимных стволовых клеток, выделенных из крайней плоти двух доноров одного возраста. Цитология. Т. 60. № 4. С. 262. (Krylova T.A., Musorina A.S., Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. Isolation and сomparative сharaсteristiсs of mesenсhymal stem-сell lines derived from foreskin of two donors of similar age. Сell Tissue Biol. Т. 12. № 4. С. 271.)
Матвеева Д.К., Андреева Е.Р., Новиков Н.Н., Пустовой В.И., Буравкова Л.Б. 2020. Структурная организация и состав внеклеточного матрикса мультипотентных мезенхимальных стромальных клеток при различном уровне содержания кислорода in vitro. Клин. эксп. морфология. Т. 9. № 1. С. 57. (Matveeva D.K., Andreeva E.R., Novikov N.N., Pustovoy V.I., Buravkova L.B. 2020. Structural organization and composition of extracellular matrix of multipotent mesenchymal stromal cells under different oxygen levels in vitro. Clin. exp. morphology. V. 9. № 1. P. 57.)
Мусина Р.А., Белявский А.В., Тарусова О.В., Соловьева Е.В., Сухих Г.Т. 2008. Мезенхимальные стволовые клетки эндометрия, полученные из менструальной крови. Клет. тех. биол. мед. № 2. С. 110. (Musina R.A., Belyavski A.V., Tarusova O.V., Solovyova E.V., Sukhikh G.Т. 2008. Endometrial mesenсhymal stem сells isolated from the menstrual blood. Bull. Exp. Biol. Med. V. 145. № 4. P. 539.)
Паюшина О.В. 2015. Локализация и функции мезенхимных стромальных клеток in vivo. Общ. биол. Т. 76. № 2. С. 161. (Payushina O.V. 2015. Localization and function of mesenchymal stromal cells in vivo. Obsch. Biol. V. 76. № 2. P. 161.)
Рогова Л.Н., Шестернина Н.В., Замечник Т.В., Фастова И.А. 2011. Матриксные металлопротеиназы, их роль в физиологических и патологических процессах. Вест. нов. мед. тех. Т. 18. № 2. С. 86. (Rogova L.N., Shesternina N.V., Observer T.V., Fastova I.A. 2011 Matrix metalloproteinases, their role in physiological and pathological processes. Bull. New Med. Tech. V. 18. № 2. P. 86.)
Ahmed M., Ffrench-Constant C. 2016. Extracellular matrix regulation of stem cell behavior. Curr. Stem. Cell. Rep. V. 2. P. 197.
Aro E., Khatri R., Gerard-O’Riley R., Mangiavini L., Myllyharju J., Schipan E.I. 2012. Hypoxia inducible factor-1 (HIF-1) but not HIF-2 is essential for hypoxic induction of collagen prolyl 4-hydroxylases in primary newborn mouse epiphyseal growth plate chondrocytes. J. Biol. Chem. V. 287. P. 37 134.
Barker H.E., Cox T.R., Erler J.T. 2012. The rationale for targeting the LOX family in cancer. Nat. Rev. Cancer. V. 12. P. 540.
Berg J.T., Breen E.C., Fu Z., Mathieu-Costello O., West J.B. 1998. Alveolar hypoxia increases gene expression of extracellular matrix proteins and platelet-derived growth factor-B in lung parenchyma. Am. J. Respir. Crit. Care. Med. V. 158. P. 1920.
Beyer C., Schett G., Gay S., Distler O., Distler J.H.W. 2009. Hypoxia in the pathogenesis of systemic sclerosis. Arthritis Res. Ther. V. 11. P. 220.
Biddlestone J., Bandarra D., Rocha S. 2015. The role of hypoxia in inflammatory disease. Int. J. Mol. Med. V. 35. P. 859.
Bieback K., Netsch P. 2016. Isolation, culture, and characterization of human umbilical cord blood-derived mesenchymal stromal cells. Methods Mol. Biol. V. 1416. P. 245.
Brown B.N., Valentin J.E., Stewart-Akers A.M., McCabe G.P., Badylak S.F. 2009. Macrophage phenotype and remodeling outcomes in response to biologic scaffolds with and without a cellular component. Biomaterials. V. 30. P. 1482e91.
Büchler P., Reber H.A., Tomlinson J.S., Hankinson O., Kallifatidis G., Friess H., Herr I., Hines O.J. 2009. Transcriptional regulation of urokinase-type plasminogen activator receptor by hypoxia-inducible factor 1 is crucial for invasion of pancreatic and liver cancer. Neoplasia. V. 11. P. 196.
Buravkova L.B., Andreeva E.R., Gogvadze V., Zhivotovsky B. 2014. Mesenchymal stem cells and hypoxia: Where are we? Mitochondrion. V. 19. P. 105.
Caplan A.I. 2007. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J. Cell. Physiol. V. 213. P. 341.
Chen X.D., Dusevich V., Feng J.Q., Manolagas S.C., Jilka R.L. 2007. Extracellular matrix made by bone marrow cells facilitates expansion of marrow-derived mesenchymal progenitor cells and prevents their differentiation into osteoblasts. J. Bone Miner. Res. V. 22. P. 1943.
Choi J.Y., Jang Y.S., Min S.Y., Song J.Y. 2011. Overexpression of MMP9 and HIF1α in breast cancer cells under hypoxic conditions. J. Breast Cancer. V. 14. P. 88.
Choi K.M., Seo Y.K., Yoon H.H., Song K.Y., Kwon S.Y., Lee H.S., Park J.K. 2008. Effect of ascorbic acid on bone marrow-derived mesenchymal stem cell proliferation and differentiation. J. Biosci. Bioeng. V. 105. P. 586.
Cigognini D., Gaspar D., Kumar P., Satyam A., Alagesan S., Sanz-Nogués C., Griffin M., O’Brien T., Pandit A., Zeugolis D.I. 2016. Macromolecular crowding meets oxygen tension in human mesenchymal stem cell culture: A step closer to physiologically relevant in vitro organogenesis. Sci. Rep. V. 6. P. 30746.
Clause K.C., Barker T.H. 2013. Extracellular matrix signaling in morphogenesis and repair. Curr. Opin. Biotechnol. V. 24. P. 830.
Cowden-Dahl K.D., Robertson S.E., Weaver V.M., Simon M.C. 2005. Hypoxia-inducible factor regulates alphavbeta3 integrin cell surface expression. Mol. Biol. Cell. V. 16. P. 1901.
Cox T.R., Bird D., Baker A-M., Barker H.E., Ho M.Y., Lang G., Erler J.T. 2013. LOX-mediated collagen crosslinking is responsible for fibrosis-enhanced metastasis. Cancer Res. V. 73. P. 1721.
Cox T.R., Erler J.T. 2011. Remodeling and homeostasis of the extracellular matrix: implications for fibrotic diseases and cancer. Dis. Model. Mech. V. 4. P. 165.
Crapo P.M., Gilbert T.W., Badylak S.F. 2011. An overview of tissue and whole organ decellularization processes. Biomaterials. V. 32. P. 3233.
Daley W.P., Peters S.B., Larsen M. 2008. Extracellular matrix dynamics in development and regenerative medicine. J. Cell Sci. V. 121. P. 255.
Deschene K., Céleste C., Boerboom D., Theoret C.L. 2012. Hypoxia regulates the expression of extracellular matrix associated proteins in equine dermal fibroblasts via HIF1. J. Dermatol. Sci. V. 65. P. 12.
Discher D.E., Mooney D.J., Zandstra P.W. 2009. Growth factors, matrices, and forces combine and control stem cells. Science. V. 324. P. 1673.
Du H.-C., Jiang L., Geng W.-X., Li J., Zhang R., Dang J.-G., Li L.-W. 2017. Evaluation of xenogeneic extracellular matrix fabricated from CuCl2-conditioned mesenchymal stem cell sheets as a bioactive wound dressing material. J. Biomater. Appl. V. 32. P. 472.
Eisinger-Mathason T.S., Zhang M., Qiu Q., Skuli N., Nakazawa M.S., Karakasheva T., Mucaj V., Shay J.E., Stangenberg L., Sadri N., Puré E., Yoon S.S., Kirsch D.G., Simon M.C. 2013. Hypoxia-dependent modification of collagen networks promotes sarcoma metastasis. Cancer Discov. V. 3. P. 1190.
Eliasson P., Jonsson J.I. 2010. The hematopoietic stem cell niche: low in oxygen but a nice place to be. J. Cell. Physiol. V. 222. P. 17.
Enes S.R., Emma Ahrman E., Palani A., Hallgren O., Bjermer L., Malmström A., Scheding S., Malmström J., Westergren-Thorsson G. 2017. Quantitative proteomic characterization of lung-MSC and bone marrow-MSC using DIA-mass spectrometry. Sci. Rep. V. 7. P 9316.
Engler A.J., Sen, S. Sweeney H.L., Discher D.E. 2006. Matrix elasticity directs stem cell lineage specification. Cell. V. 126. P. 677.
Felkaya T., Schaferzb R., Schewexc B., Benzkd K., Aichery W.K. 2009. Hypoxia reduces the inhibitory effect of IL-1b on chondrogenic differentiation of FCS-free expanded MSC. Osteoarthr. Cartil. V. 17. P. 1368.
Frantz C., Stewart K.M., Weaver, V.M. 2010. The extracellular matrix at a glance. J. Cell Sci. V. 123. P. 4195.
Friedenstein A.J., Petrakova K.V., Kurolesova A.I., Frolova G.P. 1968. Heterotopic of bone-marrow: Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation. V. 6. P. 230.
García-García A., Martin I. 2019. Extracellular matrices to modulate the innate immune response and enhance bone healing. I. Front. Immunol. V. 10. P. 2256.
Gattazzo F., Urciuolo A., Bonaldo P. 2014. Extracellular matrix: A dynamic microenvironment for stem cell niche. Biochim. Biophys. Acta. V. 1840. P. 2506.
Gilkes D.M., Semenza G.L., Wirtz D. 2014. Hypoxia and the extracellular matrix: drivers of tumour metastasis. Nat. Rev. Cancer. V. 15. P. 723.
Gillies R.J., Gatenby R.A. Hypoxia and adaptive landscapes in the evolution of carcinogenesis. 2007. Cancer Metastasis Rev. V. 26. P. 311.
Gowen B.B., Borg T.K., Ghaffar A., Mayer E.P. 2000. Selective adhesion of macrophages to denatured forms of type I collagen is mediated by scavenger receptors. Matrix Biol. V. 19. P. 61.
Guneta V., Zhou Z., Tan N.S., Sugii S., Wong M.T.C., Choong C. 2017. Recellularization of decellularized adipose tissue-derived stem cells: role of the cell-secreted extracellular matrix in cellular differentiation. Biomater. Sci. V. 6. P. 168.
Haque N., Rahman M.T., Abu Kasim N.H., Alabsi A.M. 2013. Hypoxic culture conditions as a solution for mesenchymal stem cell based regenerative therapy. Sci. World J. V. 2013. P. 12.
Hashimoto Y., Funamoto S., Sasaki S., Honda T., Hattori S., Nam K., Kimura T., Mochizuki M., Fujisato T., Kobayashi H., Kishida A. 2010. Preparation and characterization of decellularized cornea using high-hydrostatic pressurization for corneal tissue engineering. Biomaterials. V. 31. P. 3941e8.
Hoshiba T., Lu H. 2011. Effects of extracellular matrices derived from different cell sources on chondrocyte functions. Biotechnol. Prog. V. 27. P. 788.
Hoshiba T., Lu H., Kawazoe N., Chen G. 2010. Decellularized matrices for tissue engineering. Expert Opin. Biol. Ther. V. 10. P. 1717.
Hu X., Ivashkiv L.B. 2009. Cross-regulation of signaling pathways by interferon-γ: implications for immune responses and autoimmune diseases. Immunity. V. 31. P. 539.
Hu X., Wei L., Taylor T.M., Wei J., Zhou X., Wang J.A., Yu S.P. 2011. Hypoxic preconditioning enhances bone marrow mesenchymal stem cell migration via Kv2.1 channel and FAK activation. Am. J. Physiol. Cell Physiol. V. 301. P. 362.
Hu X., Wu R., Shehadeh L.A., Zhou Q., Jiang C., Huang X., Wang J. 2014. Severe hypoxia exerts parallel and cell-specific regulation of gene expression and alternative splicing in human mesenchymal stem cells. BMC Genomics. V. 15. P. 303.
Hynes R.O. 2009. The extracellular matrix: not just pretty fibrils. Science. V. 326. P. 1216.
Hynes R.O., Naba A. 2011. Overview of the matrisome: An inventory of extracellular matrix constituents and functions. Cold Spring Harb. Perspect. Biol. V. 4. P. 004903.
Ito A., Mukaiyama A., Itoh Y., Nagase H., Thogersen I.B., Enghild J.J., Sasaguri Y., Mori Y. 1996. Degradation of interleukin 1β by matrix metalloproteinases. J. Biol. Chem. V. 271. P. 14657.
Ivanovic Z. 2009. Hypoxia or in situ normoxia: the stem cell paradigm. J. Cell Physiol. V. 219. P. 271.
Jean C., Gravelle P., Fournie J., Laurent G. 2011. Influence of stress on extracellular matrix and integrin biology. Oncogene. V. 30. P. 2697.
Joddar B., Hoshiba T., Chen G., Ito Y. 2014. Stem cell culture using cell-derived substrates. Biomater. Sci. V. 2. P. 1595.
Johnson G.B., Brunn G.J., Kodaira Y., Platt J.L. 2002. Receptor-mediated monitoring of tissue well-being via detection of soluble heparan sulfate by Toll-like receptor 4. J. Immunol. V. 168. P. 5233.
Kalluri R. 2016. The biology and function of fibroblasts in cancer. Nat. Rev. Cancer. V. 16. P. 582.
Keane T.J., Swinehart I.T., Badylak S.F. 2015. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. V. 84. P. 25.
Khan W.S., Adesida A.B., Hardingham T.E. 2007. Hypoxic conditions increase hypoxia-inducible transcription factor 2alpha and enhance chondrogenesis in stem cells from the infrapatellar fat pad of osteoarthritis patients. Arthritis Res. Ther. V. 9. P. 55.
Kim T.J., Ma T. 2013. Autocrine fibroblast growth factor 2-mediated interactions between human mesenchymal stem cells and extracellular matrix under varying oxygen. J. Cell. Biochem. V. 114. P. 716.
Kumar L., Kandoi S., Misra R., Verma R. 2019. The mesenchymal stem cell secretome: a new paradigm towards cell-free therapeutic mode in regenerative medicine. Cytokine Growth Factor Rev. V. 46. P. 1.
Kumar P., Satyam A., Cigognini D., Pandit A., Zeugolis D.I. 2018. Low oxygen tension and macromolecular crowding accelerate extracellular matrix deposition in human corneal fibroblast culture. J. Tissue Eng. Regen. Med. V. 12. P. 6.
Kumar P., Satyam A., Fan X., Rochev Y., Rodriguez B.J., Gorelov A., Joshi L., Raghunath M., Pandit A., Zeugolis D.I. 2015. Accelerated development of supramolecular corneal stromal-like assemblies from corneal fibroblasts in the presence of macromolecular crowders. Tissue Eng. Part C. V. 21. P. 660.
Kusuma G.D., Brennecke S.P., Connor A.J., Kalionis B., Heath E. 2017. Decellularized extracellular matrices produced from immortal cell lines derived from different parts of the placenta support primary mesenchymal stem cell expansion. PLoS ONE. V. 12. P. e0171488.
Kwon S.H., Lee T.J., Park J., Hwang L.E., Jin M., Jang H.K., Hwang N.S., Kim B.S. 2013. Modulation of BMP-2-induced chondrogenic versus osteogenic differentiation of human mesenchymal stem cells by cell-specific extracellular matrices. Tissue Eng. Part A. V. 19. P. 49.
Lai Y., Sun Y., Skinner C.M. 2010. Reconstitution of marrow-derived extracellular matrix ex vivo: a robust culture system for expanding large-scale highly functional human mesenchymal stem cells. Stem Cells Dev. V. 19. P. 1095.
Leask A., Abraham D.J. 2004. TGF-β signaling and the fibrotic response. FASEB J. V. 18. P. 816.
Li C.Y., Wu X.Y., Tong J.B., Yang X.X., Zhao J.L., Zheng Q.F., Zhao G.B., Ma Z.J. 2015. Comparative analysis of human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy. Stem Cell Res. Ther. V. 6. P. 55.
Lin H., Yang G., Tan J., Tuan R.S. 2012. Influence of decellularized matrix derived from human mesenchymal stem cells on their proliferation, migration and multi-lineage differentiation potential. Biomaterials. V. 33. P. 4480.
Lin T.M., Tsai J.L., Lin S.D., Lai C.S., Chang C.C. 2005. Accelerated growth and prolonged lifespan of adipose tissue-derived human mesenchymal stem cells in a medium using reduced calcium and antioxidants. Stem Cells Dev. V. 14. P. 92.
Lindner U., Kramer J., Behrends J., Driller B., Wendler N., Boehrnsen F., Rohwedel J.U.R, Schlenke P. 2010. Improved proliferation and differentiation capacity of human mesenchymal stromal cells cultured with basement-membrane extracellular matrix proteins. Cytotherapy. V. 12. P. 992.
Liu X., Zhou L., Chen X., Liu T., Pan C., Cui W., Li M., Pei M., Yang H., Gong Y., He F. 2016. Culturing on decellularized extracellular matrix enhances antioxidant properties of human umbilical cord-derived mesenchymal stem cells. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 61. P. 437.
Lu H., Hoshiba T., Kawazoe N., Chen G. 2011a. Autologous extracellular matrix scaffolds for tissue engineering. Biomaterials. V. 32. № 10. P. 2489.
Lu H., Hoshiba T., Kawazoe N., Kod N., Song M., Chena G. 2011b. Cultured cell-derived extracellular matrix scaffolds for tissue engineering. Biomaterials. V. 32. P. 9658.
Mahmoud R.K., El-Ansary A.K., El-Eishi H.H., Kamal H.M., El-Saeed N.H. 2005. Matrix metalloproteinases MMP-3 and MMP-1 levels in sera and synovial fluids in patients with rheumatoid arthritis and osteoarthritis. Ital. J. Biochem. V. 54. P. 248.
Malladi P., Xu Y., Chiou M., Giaccia A.J., Longaker M.T. 2007. Hypoxia inducible factor-1alpha deficiency affects chondrogenesis of adipose-derived adult stromal cells. Tissue Eng. V. 13. P. 1159.
Marinkovic M., Blocka T.J., Rakian R., Lic Q., Wangd E., Reilly M.A., Deana D.D., Chen X.D. 2016. One size does not fit all: developing a cell-specific niche for in vitro study of cell behavior. Matrix Biol. V. 52–54. P. 426.
Midwood K., Sacre S., Piccinini A.M., Inglis J., Trebaul A., Chan E., Drexler S., Sofat N., Kashiwagi M., Orend G., Brennan F., Foxwell B. 2009. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Med. V. 15. P. 774.
Milner R., Hung S., Erokwu B., Dore-Duffy P., LaManna J.C., del Zoppo G.J. 2008. Increased expression of fibronectin and the alpha 5 beta 1 integrin in angiogenic cerebral blood vessels of mice subject to hypobaric hypoxia. Mol. Cell. Neurosci. V. 38. P. 43.
Mohamed-Ali H. 1995. Influence of interleukin-1 beta, tumour necrosis factor alpha and prostaglandin E2 on chondrogenesis and cartilage matrix breakdown in vitro. Rheumatol. Int. V. 14. P. 191.
Munoz-Najar U.M., Neurath K.M., Vumbaca, F., Claffey, K.P. 2006. Hypoxia stimulates breast carcinoma cell invasion through MT1 MMP and MMP2 activation. Oncogene. V. 25. P. 2379.
Naba A., Clauser K.R., Hoersch S., Liu H., Carr S.A., Hynes R.O. 2012. The matrisome: in silico definition and in vivo characterization by proteomics of normal and tumor extracellular matrices. Mol. Cell Proteomics. V. 11. P. 1.
Nagamura-Inoue T., He H. 2014. Umbilical cord-derived mesenchymal stem cells: Their advantages and potential clinical utility. World J. Stem Cells. V. 6. P. 195.
Najar M., Krayem M., Merimi M., Burny A., Meuleman N., Bron D., Raicevic G., Lagneaux L. 2018. Insights into inflammatory priming of mesenchymal stromal cells: functional biological impacts. Inflammatory Res. V. 67. P. 467.
Noronha N.C., Mizukami A., Caliári-Oliveira C., Cominal J.G., Rocha J.L.M., Covas D.T., Swiech K., Kelen C.R. 2019. Priming approaches to improve the efficacy of mesenchymal stromal cell-based therapies. Stem Cell Res. Ther. V. 10. P. 131.
Noth U., Rackwitz L., Steinert A.F., Tuan R.S. 2010. Cell delivery therapeutics for musculoskeletal regeneration. Adv. Drug Deliv. Rev. V. 62. P. 765.
Okamura Y., Watari M., Jerud E.S., Young D.W., Ishizaka S.T., Rose J., Chow J.C., Strauss J.F. 2001. The extra domain A of fibronectin activates Toll-like receptor 4. J. Biol. Chem. V. 276. P. 10229.
Orciani M., Di Primio R. 2013. Skin-derived mesenchymal stem cells: isolation, culture, and characterization. Methods Mol. Biol. V. 989. P. 275.
Pérez-Castrillo S., González-Fernández M.L., López-González M.E., Villar-Suárez V. 2018. Effect of ascorbic and chondrogenic derived decellularized extracellular matrix from mesenchymal stem cells on their proliferation, viability and differentiation. Ann. Anat. V. 220. P. 60.
Page-McCaw A., Ewald A.J., Werb Z. 2007. Matrix metalloproteinases and the regulation of tissue remodelling. Nat. Rev. Mol. Cell Biol. V. 8. P. 221.
Pasarica M., Sereda O.R., Redman L.M. 2009. Reduced adipose tissue oxygenation in human obesity evidence for rarefaction, macrophage chemotaxis, and inflammation without an angiogenic response. Diabetes. V. 58. P. 718.
Pei M. 2017. Environmental preconditioning rejuvenates adult stem cells proliferation and chondrogenic potential. Biomaterials. V. 117. P. 10.
Pei M., He F., Kish V.L. 2011. Expansion on extracellular matrix deposited by human bone marrow stromal cells facilitates stem cell proliferation and tissue-specific lineage potential. Tissue Eng. Part A. V. 17. P. 3067.
Pei M., Shoukry M., Li J., Daffner S.D., France J.C., Emery S.E. 2012. Modulation of in vitro microenvironment facilitates synovium-derived stem cell-based nucleus pulposus tissue regeneration. Spine. V. 37. P. 1538.
Pelekanos R.A., Sardesai V.S., Futrega K., Lott W.B., Kuhn M., Doran M.R. 2016. Isolation and expansion of mesenchymal stem/stromal cells derived from human placenta tissue. J. Vis. Exp. V. 112. P. 54204.
Petrova V., Annicchiarico-Petruzzelli M., Melino G., Amelio I. 2018. The hypoxic tumour microenvironment. Oncogenesis. V. 7. P. 10.
Pizzute T., Lynch K., Pei M. 2015. Impact of tissue-specific stem cells on lineage specific differentiation: A focus on musculoskeletal system. Stem Cell Rev. Rep. V. 11. P. 119.
Pourjafar M., Saidijam M., Mansouri K., Ghasemibasir H., Dermani F., Najafi R. 2017. All-trans retinoic acid preconditioning enhances proliferation, angiogenesis and migration of mesenchymal stem cell in vitro and enhances wound repair in vivo. Cell Prolif. V. 50. P. e12315.
Prewitz M.C., Seib F.P., von Bonin M., Friedrichs J., Stißel A., Niehage C., Werner C. 2013. Tightly anchored tissue-mimetic matrices as instructive stem cell microenvironments. Nat. Met. V. 10. P. 788.
Ragelle H., Naba A., Larson B.L., Zhou F., Prijić M., Whittaker C.A., Anderson D.G. 2017. Comprehensive proteomic characterization of stem cell-derived extracellular matrices. Biomaterials. V. 128. P. 147.
Rakian R., Block T.J., Johnson S.M., Marinkovic M., Wu J., Dai Q., Dean D.D., Chen X.-D. 2015. Native extracellular matrix preserves mesenchymal stem cell “stemness” and differentiation potential under serum-free culture conditions. Stem Cell Res. Ther. V. 6. P. 235.
Rao Pattabhi S., Martinez J.S., Keller T.C. 2014. Decellularized ECM effects on human mesenchymal stem cell stemness and differentiation. Differentiation. V. 88. P. 131.
Rayahin J.E., Buhrman J.S., Zhang Y., Koh T.J., Gemeinhart R.A. 2015. High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS Biomater. Sci. Eng. V. 1. P. 481.
Rolandsson S.E., Sjöland A.A., Skog I., Hansson L., Larsson H., Le Blanc K., Eriksson L., Bjermer L., Scheding S., Westergren-Thorsson G. 2016. MSC from fetal and adult lungs possess lung-specific properties compared to bone marrow-derived MSC. Sci. Rep. V. 6. P. 29160.
Rozario T., DeSimone D.W. 2010. The extracellular matrix in development and morphogenesis: a dynamic view. Dev. Biol. V. 341. P. 126.
Saed G.M., Diamond D. 2008. Hypoxia-induced irreversible up-regulation of type I collagen and transforming growth factor in human peritoneal fibroblasts. BioMed. S. V. 78. P. 144.
Satyam A., Kumar P., Fan X., Gorelov A., Rochev Y., Joshi L., Peinado H., Lyden D., Thomas B., Rodriguez B., Raghunath M., Pandit A., Zeugolis D. 2014. Macromolecular crowding meets tissue engineering by self-assembly: A paradigm shift in regenerative medicine. Adv. Mat. V. 26. P. 3024.
Scadden D.T. 2006. The stem-cell niche as an entity of action. Nature. V. 441. P. 1075.
Schaefer L. 2010. Extracellular matrix molecules: endogenous danger signals as new drug targets in kidney diseases. Curr. Opin. Pharmacol. V. 10. P. 185.
Schaefer L., Babelova A., Kiss E., Hausser H.J., Baliova M., Krzyzankova M., Marsche G, Young M.F., Mihalik D., Götte M., Malle E., Schaefer R.M., Gröne H.J. 2005. The matrix component biglycan is proinflammatory and signals through Toll-like receptors 4 and 2 in macrophages. J. Clin. Invest. V. 115. P. 2223.
Semenza G.L. 2015. Hypoxia-inducible factors in physiology and medicine. Cell. V. 148. P. 399.
Smith L.R., Cho S., Discher D.E. 2018. Stem cell differentiation is regulated by extracellular matrix mechanics. Physiology. V. 33. P. 16.
Sorokin L. 2010. The impact of the extracellular matrix on inflammation. Nat. Rev. Immun. V. 10. P. 712.
Stern R., Asari A.A., Sugahara K.N. 2006. Hyaluronan fragments: an information-rich system. Eur. J. Cell Biol. V. 85. P. 699.
Streuli C. 1999. Extracellular matrix remodeling and cellular differentiation. Curr. Opin. Cell Biol. V. 11. P. 634.
Thakkar S., Ghebes C.A., Ahmed M., Kelder C., van Blitterswijk C.A., Saris D., Fernandes H.A-M., Moroni L. 2013. Mesenchymal stromal cell-derived extracellular matrix influences gene expression of chondrocytes. Biofabrication. V. 5. P. 025003.
Theocharis A.D., Skandalis S.S., Gialeli C., Karamanos N.K. 2015. Extracellular matrix structure. Adv. Drug. Deliv. Rev. V. 97. P. 4.
Van S.Y., Noh Y.K., Kim S.W., Oh Y.M., Kim I.H., Park K. 2019. Human umbilical cord blood mesenchymal stem cells expansion via human fibroblast-derived matrix and their potentials toward regenerative application. Cell Tissue Res. V. 376. P. 233.
Veres S.P., Brennan-Pierce E.P., Lee J.M. 2015. Macrophage-like U937 cells recognize collagen fibrils with strain-induced discrete plasticity damage. J. Biomed. Mater. Res. A. V. 103. P. 397.
Walton H.L., Corjay M.H., Mohamed S.N., Mousa S.A., Santomenna L.D., Reilly T.M. 2000. Hypoxia induces differential expression of the integrin receptors alpha(vbeta3) and alpha(vbeta5) in cultured human endothelial cells. J. Cell Biochem. V. 78. P. 674.
Wobma H.M., Tamargo M.A., Goeta S., Brown L.M., Duran-Struuck R., Vunjak-Novakovic G. 2018. The influence of hypoxia and IFN-γ on the proteome and metabolome of therapeutic mesenchymal stem cells. Biomaterials. V. 167. P. 226.
Wu M.H., Urban J.P., Cui Z.F., Cui Z., Xu X. 2007. Effect of extracellular pH on matrix synthesis by chondrocytes in 3D agarose gel. Biotechnol. Prog. V. 23. P. 430.
Wykoff C.C., Sotiriou C., Cockman M.E., Ratcliffe P.J., Maxwell P., Liu E., Harris A.L. 2004. Gene array of VHL mutation and hypoxia shows novel hypoxia-induced genes and that cyclin D1 is a VHL target gene. Brit. J. Cancer. V. 90. P. 1235.
Xing Q., Yates K., Tahtinen M., Shearier E., Qian Z., Zhao F. 2015. Decellularization of fibroblast cell sheets for natural extracellular matrix scaffold preparation. Tissue Eng. V. 21. P. 77.
Xiong Y., He J., Zhang W., Zhou G., Cao Y., Liu W. 2015. Retention of the stemness of mouse adipose-derived stem cells by their expansion on human bone marrow stromal cell-derived extracellular matrix. Tissue Eng. Part A.V. 21. P. 886.
Xue J.X., Gong Y.Y., Zhou G.D., Liu W., Cao Y., Zhang W.J. 2012. Chondrogenic differentiation of bone marrow-derived mesenchymal stem cells induced by acellular cartilage sheets. Biomaterials. V. 33. P. 5832.
Yakovlev S., Medved L. 2018. Effect of fibrinogen, fibrin, and fibrin degradation products on transendothelial migration of leukocytes. Thromb. Res. V. 162. P. 93.
Yamada Y., Nakamura S., Ito K., Sugito T., Yoshimi R., Nagasaka T., Ueda M. 2010. A feasibility of useful cell-based therapy by bone regeneration with deciduous tooth stem cells, dental pulp stem cells, or bonemarrow-derived mesenchymal stem cells for clinical study using tissue engineering technology. Tissue Eng. Part A. V. 16. P. 1891.
Yang Y., Lin H., Shen H., Wang B., Lei G., Tuan R.S. 2018. Mesenchymal stem cell-derived extracellular matrix enhances chondrogenic phenotype of and cartilage formation by encapsulated chondrocytes in vitro and in vivo. Acta Biomater. V. 69. P. 71.
Yoshinori K., Qiming J., Hiroko T. 2001. Geometry of carriers controlling phenotypic expression in BMP-induced osteogenesis and chondrogenesis. J. Bone Joint. Surg. Am. V. 83. P. 105.
Zhang J., Li B., Wang J.H. 2011. The role of engineered tendon matrix in the stemness of tendon stem cells in vitro and the promotion of tendon-like tissue formation in vivo. Biomaterials. V. 32. P. 6972.
Zhang W., Yang J., Zhu Y., Sun X., Guo W., Liu X., Jing X., Guo G., Guo Q., Peng J., Zhu X. 2019. Extracellular matrix derived by human umbilical cord-deposited mesenchymal stem cells accelerates chondrocyte proliferation and differentiation potential in vitro. Cell Tissue Bank. V. 20. P. 351.
Zhang Z., Luo X., Xu H., Wang L., Jin X., Chen R., Ren X., Lu Y., Fu M., Huang Y., He J., Fan Z. 2014. Bone marrow stromal cell-derived extracellular matrix promotes osteogenesis of adipose-derived stem cells. Cell Biol. Int. V. 39. P. 291.
Zhang Z., Qu R., Fan T., Ouyang J., Lu F., Dai J. 2019. Stepwise adipogenesis of decellularized cellular extracellular matrix regulates adipose tissue-derived stem cell migration and differentiation. Stem Cells Int. V. 2019. P. 1845926.
Zhou Y., Zimber M., Yuan H., Naughton G.K., Fernan R., Li W.-J. 2016. Effects of human fibroblast-derived extracellular matrix on mesenchymal stem cells. Stem Cell Rev Rep. V. 12. № 5. P. 560.
Дополнительные материалы отсутствуют.


