Цитология, 2020, T. 62, № 10, стр. 738-744
Морфология компонентов систем адресной доставки лекарственных препаратов (пористых ватеритов CaCO3) в мышечной ткани крыс
П. В. Попрядухин 1, *, Н. Н. Сударева 1, 2, О. М. Суворова 1, Г. Ю. Юкина 2, Е. Г. Сухорукова 2, Н. Н. Сапрыкина 1
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197376 Санкт-Петербург, Россия
* E-mail: pavelpnru@gmail.com
Поступила в редакцию 26.06.2020
После доработки 08.07.2020
Принята к публикации 09.07.2020
Аннотация
В настоящей работе изучено поведение пористых сферических ватеритов карбоната кальция (СаСО3) – компонентов систем адресной доставки лекарственных препаратов – в мышечной ткани крыс на сроках 3 сут, 1, 2, 4 и 12 нед., после имплантации. Было показано, что с течением времени происходит структурная трансформация и биорезорбция изучаемых носителей. Через 3 сут наблюдается преобразование сферических структур в игольчатые с последующей их полной биорезорбцией в течение 2 нед. При этом патологического воздействия на окружающие ткани выявлено не было, что подтверждает безопасность применения ватеритов СаСО3 и позволяет рекомендовать их для проведения дальнейших исследований в составе систем адресной доставки лекарственных препаратов.
Одним из основных направлений развития современной медицины и фармакологии является разработка методов адресной доставки лекарственных средств в зону поражения. Такой подход позволяет: 1) увеличить дозу лекарственного средства в очаге поражения; 2) пролонгировать его действие; 3) исключить, либо существенно снизить токсическое воздействие на здоровые органы и ткани. При лечении традиционными методами лекарственное вещество, как правило, вводится в системный кровоток и распределяется кровью по всему организму пациента. В результате, чтобы создать высокую, терапевтически эффективную, концентрацию препарата в очаге поражения необходимо вводить заведомо завышенные дозы лекарственного средства (Пиотровский, 2013; Howard et al., 2016). Положение также усугубляется наличием у большинства препаратов токсичности различной степени выраженности и необходимостью многократного, курсового их применения. Особенно острая ситуация наблюдается при лечении пациентов с онкологическими заболеваниями, и обусловлена она высокой или крайне высокой токсичностью применяемых сегодня препаратов для проведения курсов химиотерапии (O’Brien et al., 2006; Pearce et al., 2017). В связи с этим разработка систем и методов адресной доставки лекарственных средств приобретает особую значимость и актуальность.
Адресную доставку лекарственных средств можно представить в виде следующей последовательности: носитель, содержащий лекарственный препарат, вводится в системный кровоток, далее, циркулируя в организме, он накапливается избирательно в зоне поражения и начинает дозированно выделять препарат (Adiseshaiah et al., 2010; Пиотровский, 2013; Howard et al., 2016; Xu et al., 2020). Однако основной неразрешенной на сегодняшний день проблемой этого подхода является избирательность зоны накопления. При введении в кровоток носители с препаратом распределяются по всему организму аналогично традиционным средствам (Kwona et al., 2012). Альтернативным способом доставки носителей является метод регионарного введения, например, инъекционное введение непосредственно в зону поражения. Реализация этого подхода обеспечивает высокую степень локализации носителей при условии высокой точности их введения.
В качестве носителей обычно используются пористые либо полые микро- или наносферы (Volodkin et al, 2004; Zhao et al., 2007), но могут применяться также и частицы без свободного внутреннего объема. Это могут быть липосомы, полимерные, оксидные и металлические частицы, а также частицы на основе биосовместимых нетоксичных солей (Пиотровский, 2013; Matyszewska, 2014; Bharti et al., 2015; Howard et al., 2016; Masood et al., 2016; Mishra et al., 2017; Olusanya et al., 2018).
В представленной работе в качестве носителей применяли пористые микрочастицы из карбоната кальция (СаСО3), который отвечает требованиям биологической безопасности и является типичным компонентом живых систем (Binevski et al., 2019). В процессе синтеза были получены сферические пористые ватериты (ядра) СаСО3, которые представляют одну из трех морфологических модификаций Са-СО3. Остальные модификации (кубические кальциты и удлиненные арагониты) пористостью не обладают (Cowan, Weintritt, 1976).
Исследований, описывающих поведение носителей на основе СаСО3in vivo, немного. В частности, некоторые авторы (Sudareva et al., 2018; Genina et al., 2016) вводили ватериты СаСО3, содержащие различные лекарственные соединения, перорально и транскожно в организмы крыс и детектировали их структуру. В крови и плазме ватериты после перорального введения разрушались уже в первые часы (Sudareva et al., 2018). При транскожном введении ватериты постепенно резорбировали в течение недели без морфологических трансформаций (Genina et al., 2016). Исследований, описывающих поведение в мышечной ткани носителей на основе СаСО3in vivo, нами не обнаружено.
В связи с этим цель работы заключалась в исследовании поведения нативных (не содержащих в своем составе лекарственных препаратов и не покрытых защитными оболочками) пористых сферических ватеритов СаСО3, компонентов систем адресной доставки лекарственных препаратов, in vivo в мышечной ткани крыс.
МАТЕРИАЛ И МЕТОДИКА
Получение материала. Пористые сферические ватериты СаСО3 получали соосаждением по описанной методике (Volodkin et al., 2004) с некоторыми изменениями (Sudareva et al., 2020), а именно: водные растворы (1 М) СаСl2 ⋅ 2H2O и Na2CO3 быстро сливали в равных объемах при перемешивании механической мешалкой якорного типа RW 20 (Kika-Werk, Швейцария) со скоростью 1000 об./мин. Перемешивание продолжалось в течение 30 с. Затем сформировавшуюся в течение 15 мин суспензию фильтровали через фильтр Шотта (#16), промывали тремя объемами дистиллированной воды, затем водным раствором ацетона с дробно увеличивающейся концентрацией: от 30 до 60 и 100%. После этого осадок сушили в термостате при 40–50°С до постоянного веса. Диаметр полученных ядер лежит в диапазоне 1–5 мкм.
Электронная микроскопия образцов. Использовали сканирующий электронный микроскоп Supra 55VP (Carl Zeiss, Германия) в режиме регистрации вторичных электронов с предварительным нанесением тонкого слоя платины на поверхность образцов.
Эксперименты на животных. Для экспериментов in vivo использовали 25 самцов белых крыс Wistar, по 5 животных на каждый срок эксперимента. Вес животных составлял 200–250 г, возраст – 3 мес. Для изучения резорбции in vivo ядра СаСО3 стерилизовали методом автоклавирования при 110°С в течение 1 ч. Для этого каждую навеску СаСО3 по 10 мг, предназначенную для эксперимента, максимально герметично упаковывали в алюминиевую фольгу. Животных оперировали под общей анестезией с помощью растворов золетила 100 (растворенного в 20 мл физиологического раствора) и рометара (20 мг/мл), которые вводили интраперитонеально по 0.1 мл и 0.015 мл раствора соответственно на 0.1 кг массы животного. Образцы помещали в большую приводящую мышцу бедра (musculus adductor magnus) на одной из тазовых конечностей, в каждое животное по одному образцу. Затем раны конечностей послойно ушивали атравматическими иглами с проленовой нитью 4/0. После наложения наружных швов крыс содержали в индивидуальных клетках, животные получали свободный доступ к воде и стандартную диету. После операции все животные были активны, негативного влияния на животных имплантации материалов не выявлено, о чем свидетельствовало отсутствие воспалительных процессов в зоне имплантации.
Морфологическое исследование ватеритов СаСО3 в мышечной ткани. Через 3 сут, 1, 2, 4 и 12 нед. животных выводили из эксперимента, образцы мышечной ткани, содержащие ядра ватерита СаСО3, фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч, обезвоживали в серии растворов этанола возрастающей концентрации и заключали в парафиновые блоки по стандартной гистологической методике. Парафиновые срезы толщиной 5 мкм, поперечные мышечным волокнам, готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония), окрашивали гематоксилином Майера и эозином (БиоВитрум, Россия). Соединительную ткань визуализировали методом Маллори (БиоВитрум, Россия). Микроскопический анализ проводили на световом микроскопе Leica DM750 (Германия), используя объективы с увеличением 4, 10, 40 и 100× и окуляр 10×. Запись цифровых изображений выполняли с помощью фотокамеры ICC50 (Leica, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены электронные микрофотографии поверхности ядер СаСО3. Видно, что ядра имеют высокую однородность по размерам, диаметр большинства находится в интервале 1–3 мкм. Поверхность ядер шероховатая и пористая в нанометровом диапазоне. Такая структура позволяет лекарственным веществам свободно проникать во внутренние пространства ядра при его “загрузке”, а в зоне протекания патологического процесса пролонгировано высвобождаться. Кроме того, высокая пористость определяет перенос больших объемов препарата, что также способствует достижению лечебного эффекта.
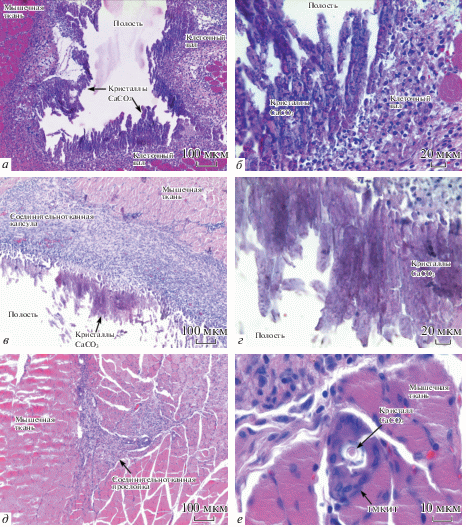
Ядра СаСО3 в мышечной ткани через 3 сут после имплантации. На 3-и сут после операции визуально в мышечной ткани на месте имплантации в трех из 5 случаев определяются полости округлой, либо округло-складчатой формы, содержащие прозрачную жидкость небольшой вязкости, по краям полостей расположен СаСО3, в виде тонкого ободка. В 2 из 5 случаев, полостей не выявлено, СаСО3 расположен в виде белесой прослойки в мышечной ткани (рис. 2а, б). В небольшом количестве скопления ядер СаСО3, близкие к нативным, микроскопически выявлены только в 2 случаях. Преобладающей структурной формой СаСО3 являются кристаллы вытянутой формы длиной 40–120 мкм и шириной 10–20 мкм, собранные в пучки и окруженные широким клеточным валом с рыхло лежащими клетками, представленными в основном макрофагами, незначительным числом сегментоядерных лейкоцитов (нейтрофилов и эозинофилов) и единичными лимфоцитами, а также немногочисленными фибробластами (рис. 3а, б) В сосудах, расположенных в непосредственной близости к клеточному валу, эндотелий набухший. Сосуды расширены, полнокровны, определяются сладжи эритроцитов (стопки склеенных между собой эритроцитов). Между мышечными волокнами, прилежащими к месту имплантации, определяется умеренный отек. В эндомизии наблюдается высокая клеточность за счет увеличения числа макрофагов. Сосуды в эндомизии резко расширены и полнокровны. Некротических повреждений окружающих тканей не выявлено.
Рис. 2.
Фотографии поперечного среза мышц после имплантации в них ядер СаСО3. а, б – через 3 сут после имплантации, в – через 1 нед., г – через 4 нед. Мышцы предварительно были фиксированы в нейтральном 10%-ном формалине не менее 48 ч.
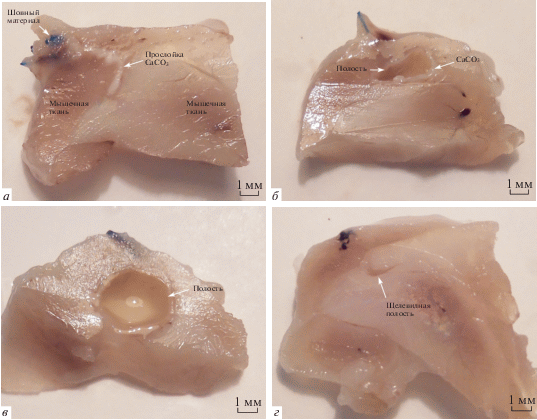
Рис. 3.
Гистологические срезы мышечной ткани крысы через 3 сут (а, б), 1 нед. (в, г) и 2 нед. (д, е) после имплантации ядер СаСО3. Окраска гематоксилином и эозином. ГКМИТ – гигантские многоядерные клетки инородных тел. Увел. об.: 10× (а, в, д), 40× (б, г) и 100× (е).
Предполагаемый нами механизм образования полостей в мышечной ткани связан с реакцией С-аСО3 ядер с угольной кислотой, которая находится в межклеточной жидкости и является продуктом взаимодействия углекислого газа и воды. Углекислый газ в свою очередь образуется в процессе клеточного дыхания, но выделяется клетками в основном не в виде газа, а в виде угольной кислоты и продуктов ее диссоциации, с которыми она находится в равновесном состоянии. Угольная кислота, кроме того, входит в состав бикарбонатной буферной системы плазмы крови и межклеточной жидкости, на которую приходится более 50% всей буферной емкости (Garrett, Grisham, 2017). В результате реакции угольной кислоты с ядрами СаСО3 образуется гидрокарбонат кальция – Са(HСО3)2, который является хорошо растворимым в воде, но неустойчивым соединением и при снижении концентрации угольной кислоты в зоне реакции, уже при температуре 15–20°С, начинает разлагаться на СаСО3, углекислый газ и воду (Любомирский и др., 2016).
Температура тела крысы в среднем 38°С. Снижение концентрации угольной кислоты в месте имплантации происходит по причине формирования соединительнотканной капсулы, которая значительно отграничивает зону реакции от межклеточной жидкости с ее буферными системами и продуктами клеточного дыхания мышечных клеток. В результате СаСО3 выпадает в осадок в виде кристаллов, а не ядер, при этом образовавшийся в процессе реакции разложения углекислый газ формирует полость. Наиболее вероятной морфологической модификацией образовавшихся кристаллов, являются арагонит, который формируется при схожих температурах (Wray et al., 1957). Основные протекающие реакции можно записать следующим образом:
Вышеописанные реакции могут протекать многократно и постепенно прекращаются по мере удаления из зоны реакции принимающих в ней участие соединений путем абсорбции их окружающими тканями.
Ядра СаСО3 в мышечной ткани через 1 нед. после имплантации. Через 1 нед. после операции визуально на месте имплантации во всех случаях определяются полости округлой формы, по размерам превосходящие таковые на предыдущем сроке (рис. 2в). Полости также заполнены прозрачным жидким содержимым небольшой вязкости, СаСО3 визуально не определяется. На микроскопическом уровне кристаллы СаСО3 сохраняются в небольшом количестве в виде скоплений по периферии полости с внутренней стороны (рис. 3в, г). Вокруг полости начинает формироваться соединительнотканная капсула, в которой фибробласты располагаются между молодыми, рыхло лежащими коллагеновыми волокнами, также определяются макрофаги, единичные сегментоядерные лейкоциты и лимфоциты. Большое число макрофагов и лимфоцитов проникают в полость и располагаются внутри нее. Сосуды в формирующейся капсуле расширены, полнокровны, в некоторых из них определяются сладжи эритроцитов. Мышечная ткань вокруг полости отечна, в эндомизии повышено число макрофагов и лимфоцитов. Сосуды в соединительнотканных прослойках резко расширены и полнокровны. Некротических повреждений окружающих тканей также не выявлено.
Ядра СаСО3 в мышечной ткани через 2 нед. после имплантации. Через 2 нед. после имплантации у 2-х животных на макроскопическом уровне полость определяется в виде узкой щели, у остальных полость не определяется. Вокруг щелевидных полостей выявляются сформированные капсулы, состоящие из рыхло лежащих коллагеновых волокон. Клеточный состав капсул представлен фибробластами, макрофагами, лимфоцитами. В случае отсутствия полости на ее месте обнаруживается широкая соединительнотканная прослойка, содержащая большое число клеток, в основном фибробластов, макрофагов и лимфоцитов. В 2-х случаях СаСО3 выявлен в следовых количествах в виде одиночных кристаллов, окруженных гигантскими многоядерными клетками инородных тел (ГМКИТ) (рис. 3д, е).
Ядра СаСО3 в мышечной ткани через 4 и 12 нед. после имплантации. Через 4 нед. после имплантации на месте СаСО3 макро- и микроскопически определяется соединительнотканная прослойка (рис. 2г) с оформленными коллагеновыми волокнами, размеры и клеточный состав которой соответствует норме и состоит в основном из фибробластов и немногочисленных макрофагов. Сосуды в соединительнотканной прослойке и в эндомизии незначительно расширены. На 12-й нед. эксперимента морфологическая картина в месте имплантации максимально приближена к нормальному гистологическому строению мышечных волокон, эндомизия и перимизия.
Таким образом, нами показано, что через 3 сут после имплантации ядер СаСО3 в мышечную ткань в основном завершается их структурная трансформация в кристаллы арагонита, при этом в большинстве случаев в мышечной ткани формируются полости. Клеточный состав в зоне имплантации свидетельствует о наличии асептического воспаления средней степени выраженности. Через 1 нед. после имплантации полости выявляются во всех случаях, ядра Са-СО3 не обнаруживаются, количество кристаллов Са-СО3 уменьшается по сравнению с предыдущим сроком, это свидетельствует об активной их биорезорбции. Начинает формироваться соединительнотканная капсула в составе которой определяется повышенное число макрофагов и лейкоцитов, что говорит о переходе процесса в стадию хронического воспаления. Однако процесс биорезорбции ватеритов опережает формирование соединительнотканной капсулы и уже ко 2-й нед. эксперимента СаСО3 определяется только в следовых количествах. К 4-й нед. эксперимента мышечная ткань возвращается в состояние нормы, что является весьма благоприятным фактом, как и то, что на всех сроках эксперимента не выявлено токсического (повреждающего) воздействия ядер СаСО3 на окружающие ткани и организм в целом. Однако появление полостей на ранних сроках эксперимента призывает нас к аккуратному, осторожному подходу в работе с опухолевыми образованиями, так как формирующиеся полости могут способствовать их метастазированию.
Полученные данные свидетельствуют о безопасности и способности пористых ватеритов СаСО3 к биорезорбции, тем самым подтверждая перспективность применения в составе систем адресной доставки лекарственных препаратов, что позволяет рекомендовать их для проведения дальнейших исследований.
Список литературы
Пиотровский Л.Б. 2013. Очерки о наномедицине. СПб.: Европейский Дом. 204 с. (Piotrovsky L.B. 2013. Essays on nanomedicine. SPb.: European House. 204 pp.)
Любомирский Н.В., Бахтин А.С., Бахтина Т.А., Николаенко Е.Ю., Николаенко В. В. 2016. Влияние гидрокарбоната кальция на структурообразование и свойства материалов на основе извести карбонизационного твердения. Международный научно-исследовательский журнал. Т. 11. № 53. С. 86. (Lyubomirsky N.V., Bakhtin A.S., Bakhtina T.A., Nikolaenko E.Yu., Nikolaenko V.V. 2016. The influence of calcium hydrogen carbonate on the structure formation and properties of materials based on lime carbonization hardening. Int.l Res. J. V. 11. No. 53. P. 86.)
Adiseshaiah P., Hall J., McNeil S. 2010. Nanomaterial standards for efficacy and toxicity assessment. WIREs Nanomed. Nanobiotechnol. V. 2. P. 99.
Bharti C., Nagaich U., Pal A. K., Gulati N. 2015. Mesoporous silica nanoparticles in target drug delivery system: A review. Int. J. Pharm. Investig. V. 5. P. 124.
Binevski P.V., Balabushevich N. G., Uvarova V. I., Vikulina A. S., Volodkin D. 2019. Bio-friendly encapsulation of superoxide dismutase into vaterite CaCO3 crystals. Enzyme activity, release mechanism, and perspectives for ophthalmology. Colloids Surfaces B: Biointerfaces. V. 181. P. 437.
Cowan J.C. Weintritt D.J. 1976. Water-formed scale deposits. Gulf Pub. Co., Book Division. 596 pp.
Garrett R.H., Grisham C.M. 2017. Biochemistry. 6th Ed. Cengage Learning. 1218 pp.
Genina E.A., Svenskaya Y.I., Yanina I.Y., Dolotov L.E., Navolokin N.A., Bashkatov A.N., Terentyuk G.S., Bucharskaya A.B., Maslyakova G.N., Gorin D.A., Tuchin V.V., Sukhorukov G.B. 2016. In vivo optical monitoring of transcutaneous delivery of calcium carbonate microcontainers. Biomed. Opt. Express. V. 7. № 6. P. 2082.
Howard K.A., Vorup-Jensen T., Peer D. 2016. Nanomedicine. Springer. 393 pp.
Kwon II K., Lee S. C., Han B., Park K. 2012. Analysis on the current status of targeted drug delivery to tumors. J. Control Release. V. 164. № 2. P. 108.
Masood F. 2016. Polymeric nanoparticles for targeted drug delivery system for cancer therapy. Mater. Sci. Eng. C. V. 60. P. 569.
Matyszewska D. 2014. Drug delivery systems in the transport of doxorubicin. Surface Innovations. V. 2. № 4. P. 201.
Mishra V., Kesharwani P., Amin M.C.M., Iyer A. 2017. Nanotechnology-based approaches for targeting and delivery of drugs and genes. 1st Ed. Academic Press. 552 pp.
O’Brien M.E.R., Borthwick A., Rigg A., Leary A., Assersohn L., Last K., Tan S., Milan S., Tait D., Smith I.E. 2006. Mortality within 30 days of chemotherapy: a clinical governance benchmarking issue for oncology patients. Br. J. Cancer. V. 95. P. 1632.
Olusanya T.O.B., Ahmad R.R.H., Ibegbu D.M., Smith J.R., Elkordy A.A. 2018. Liposomal drug delivery systems and anticancer drugs. Molecules. V. 23. № 4. P. 907. https://doi.org/10.3390/molecules23040907
Pearce A., Haas M., Viney R., Pearson S.-A., Haywood P., Brown C., Ward R. 2017. Incidence and severity of self-reported chemotherapy side effects in routine care: A prospective cohort study. PLoS One. V. 12. № 10. e0184360. https://doi.org/10.1371/journal.pone.0184360
Sudareva N., Suvorova O., Saprykina N., Smirnova N., Bel’tiukov P., Petunov S., Radilov A., Vilesov A. 2018. Two-level delivery systems based on CaCO3 cores for oral administration of therapeutic peptides. J. Microencapsul. V. 35. № 7–8. P. 619.
Sudareva N.N., Suvorova O.M., Tarasenko I.I., Saprykina N.N., Smirnova N.V., Petunov S.G., Radilov A.S., Timin A.S., Korzhikova-Vlakh E.G., Vilesov A.D. 2020. Hybrid systems for oral delivery of therapeutic neuropeptide. Mendeleev Commun. V. 30. № 1. P. 25.
Volodkin D.V., Petrov A.I., Prevot M., Sukhorukov G.B. 2004. Matrix polyelectrolyte microcapsules: New system for macromolecule encapsulation. Langmuir. V. 20. № 8. P. 3398.
Wray J. L., Daniels F. 1957. Precipitation of calcite and aragonite. J. Am. Chem. Soc. V. 79. № 9. P. 2031.
Xu C., Song R., Lu P., Chen J., Zhou Y., Shen G., Jiang M., Zhang W. 2020. A pH-responsive charge-reversal drug delivery system with tumor-specific drug release and ROS generation for cancer therapy. Int. J. Nanomed. V. 15. P. 65.
Zhao Q., Han B., Wang Z., Gao C., Peng C., Shen J. 2007. Hollow chitosan-alginate multilayer microcapsules as drug delivery vehicle: Doxorubicin loading and in vitro and in vivo studies. Nanomed.Nanotechnol. V. 3. P. 63.
Дополнительные материалы отсутствуют.



