Цитология, 2020, T. 62, № 10, стр. 726-737
Генерация лимфокин-активированных киллеров на фоне сниженного содержания Т-регуляторных клеток in vitro
А. О. Ситковская 1, *, Е. Ю. Златник 1, Т. В. Шамова 1, Е. С. Бондаренко 1, И. А. Новикова 1, Л. Н. Ващенко 1, Э. Э. Кечеджиева 1, И. Р. Дашкова 1, Т. В. Аушева 1, О. И. Кит 1
1 Национальный медицинский исследовательский центр онкологии Минздрава России
344037 Ростов-на-Дону, Россия
* E-mail: grankina.anastasia@mail.ru
Поступила в редакцию 16.06.2020
После доработки 23.06.2020
Принята к публикации 26.06.2020
Аннотация
В работе изучали влияния различных концентраций интерлейкина-2 (ИЛ-2) и интерферона-γ (ИФН-γ) на пролиферацию и иммунофенотип лимфоцитов, полученных от больных местно-распространенным раком молочной железы (II–III стадия) после иммуномагнитной деплеции T-регуляторных (Т рег) клеток из общего пула лимфоцитов in vitro. В качестве материала использовали периферическую кровь 11 больных. Выделяли мононуклеарные клетки периферической крови и удаляли Т-регуляторные лимфоциты с помощью иммунномагнитной сепараци. Клетки после сепарации культивировали в питательной среде RPMI-1640 c 10% телячьей сыворотки в течение 7 сут. Лимфоциты активировали в первый день культивирования с одним из следующих цитокинов: ИФН-γ (10 МЕ/мл), ИЛ-2 (0.1 или 1 мкг/мл ), а также ИЛ-2 (0.1 или 1 мкг/мл) и ИФН-γ совместно. Лимфоциты без внесения цитокинов служил контролем. Клетки считали с помощью автоматического счетчика до внесения цитокинов и через 2, 4 и 7 сут сокультивирования с цитокинами и исследовали их фенотип. Результаты показали некоторые фенотипические различия ряда звеньев клеточного иммунитета между контрольными и экспериментальными пробами. Особое внимание уделено описанию изменений экспрессии поверхностных маркеров в субпопуляции натуральных киллеров. Отмечено, что доля Трег клеток, несмотря на их предварительную деплецию, возрастает после воздействия цитокинов. В итоге предварительное снижение доли клеток Трег перед стимуляцией лимфоцитов не произвело должного эффекта, поэтому применение деплеции в подобном методическом режиме не привело к значимым результатам. Однако не стоит исключать возможности ингибирования клеток Трег другими способами.
Развитие злокачественной опухоли приводит к нарушению различных этапов иммунного ответа (Бережная, Чехун, 2005), что обуславливает актуальность применения иммунотерапии. В отличие от общепринятой химиолучевой терапии, подавляющей функции иммунной системы, иммунотерапия ориентирована на ее коррекцию (Мушкарина, Кузьмина, 2016). Одним из ее методов является адоптивная иммунотерапия, в основе которой лежит применение аутологичных (аллогенных) стимулированных ex vivo иммунокомпетентных клеток: Т-, В- и натуральных киллерных (НК) клеток (Златник и др, 2018; Шамова и др., 2020).
В 80-х годах XX века для клинического применения была предложена терапия лимфокин-активированными киллерами (ЛАК) в сочетании с одномоментным введением интерлейкина 2 (ИЛ-2) больным с солидными опухолями на терминальных стадиях, проявляющих резистентность к остальным видам лечения (Rosenberg et al., 1985, 1987). Авторы этих работ получали ЛАК путем культивирования в присутствии ИЛ-2 аутологичных лимфоцитов от больных после лейкафереза, клиническую ремиссию наблюдали у 31% (33/106) испытуемых, причем полная ремиссия была отмечена у восьми пациентов В 1989 г. адоптивную терапию в аналогичном режиме проводили 10 пациентам с гепатоцеллюлярной карциномой, регрессию опухоли наблюдали у двух больных, а у остальных сохраняли стабилизацию заболевания (Onishi et al., 1989). Кроме того, в результате введения больным ЛАК в сочетании с ИЛ-2 снижалась частота рецидивов и увеличивалась безрецидивная выживаемость (Une et al., 1991; Takayama et al., 2000).
Наибольший эффект продемонстрировало рандомизированное исследование 1997 г. с участием 174 первичных больных с карциномой легкого, в котором на его III фазе испытуемой группе инъецировали аутологичные ЛАК в количестве (1–5) × 109 клеток в сочетании с ИЛ-2 до или после стандартной противоопухолевой терапии каждые 2–3 мес. в течение 2 лет. В группе с применением описанной иммунотерапии 5- и 9-летняя выживаемость составила 54.5 и 52% соответственно в отличие от 33.4 и 24.2% в контрольной группе (Р < 0.001) (Kimura, Yamaguchi, 1997).
Несмотря на обнадеживающие результаты, аутологичная клеточная терапия с использованием ЛАК с ИЛ-2 в ряде случаев вызывала преимущественно за счет ИЛ-2 тяжелые побочные эффекты, такие как лихорадка, ортостатический коллапс и синдром повышенной сосудистой проницаемости (Rosenberg et al., 1987; Kimura, Yamaguchi, 1997). Помимо этого, ИЛ-2 стимулировал экспансию не только НК-клеток, но и T-регуляторных клеток (T рег) – естественных супрессоров иммунного ответа (Fang et al., 2017), ограничивающих эффективность этого метода (Oh et al., 2019).
Введение больным с онкологическими заболеваниями аутологичных Т-клеток, выделенных до курса лечения, вызывало развитие более интенсивного противоопухолевого ответа в сравнении с терапией Т-клетками больных, прошедших курс противоопухолевого лечения (McGray et al., 2014). В качестве возможных причин указывается истощение или анергия антиген-специфических Т-клеток и влияние опухолевого микроокружения (Crespo et al., 2013; Перельмутер и др., 2017), в частности, за счет Трег-клеток. Данные литературы в вопросе о влиянии Трег-клеток на эффективность адоптивной иммунотерапии противоречивы. В работе Чикилевой с коллегами (2008) доля клеток Трег повышалась только при длительном культивировании in vitro, однако в период времени, необходимый для генерации ЛАК, их количество было неизменно и равно исходному. Напротив, другие авторы отмечали экспансию субпопуляции клеток Трег в процессе сокультивирования Т-клеток с ИЛ-2, что приводило к ускоренному старению последних и снижению их функциональной активности (Crespo et al., 2013).
По мнению некоторых авторов, элиминация или избирательное ингибирование Трег клеток при проведении адоптивной иммунотерапии может содействовать усилению регрессии распространенных опухолей. В качестве методов деплеции Трег-клеток предлагается иммуномагнитная сепарация (Marabelle et al., 2013). Несмотря на известную иммуносупрессорную функцию клеток Трег, остается открытым вопрос, является ли данная субпопуляция клеток единственным фактором, подавляющим активность стимулированных ex vivo лимфоцитов при введении в организм онкологического больного (Златник и др., 2018).
Помимо ИЛ-2, известно также иммуномодулирующее действие интерферона-гамма (ИФН-γ), а именно способность активировать НК-клетки, цитотоксические Т-лимфоциты и макрофаги (Шмелёв и др., 2013; Хрянин, Решетников, 2016).
В Российском онкологическом научном центре им. Н.Н. Блохина РАМН (Москва) исследовали влияние терапии ИНФ-γ (Ингарон®) в сочетании со стандартной химиотерапией на показатели системного иммунитета у больных с солидными онкопатологиями. Проведенное исследование влияния терапии ИНФ-γ на основные показатели системного клеточного иммунитета показало, что ИНФ-γ обладает иммуномодулирующим действием у больных меланомой, раком шейки матки и раком молочной железы. Авторы наблюдали тенденцию к повышению части лимфоцитов, экспрессирующих маркер CD5+, нормализацию доли лимфоцитов CD3+, CD71+, CD25+ и HLA-DR+. Была продемонстрирована стимуляция функциональной активности иммунокомпетентных клеток, а именно увеличение цитотоксического потенциала НК-клеток. Также показатели выживаемости были выше в группе, в которой сочетали стандартную химиотерапию и ИНФ-γ (Абрамов и др., 2009; Кадагидзе и др., 2013). Под действием ИФН-γ Т-лимфоциты с хелперной направленностью начинают продуцировать ряд цитокинов, среди которых ИФН-γ, ИЛ-2, ИЛ-12 и другие, усиливающие клеточный иммунитет (Th1-иммунный ответ) (Smith, Denning, 2014).
Высокий удельный вес рака молочной железы в структуре общей онкологической заболеваемости и смертности женщин позволяет говорить о том, что эта патология является одной из наиболее актуальных проблем медико-социального значения (Минаков, 2017). Ранее был показан положительный эффект адоптивной иммунотерапии, в том числе при раке молочной железы (Абрамов и др., 2009), однако остается вопрос, возможно ли повысить ее эффективность путем изменения состава ЛАК с помощью очистки от Трег-клеток и способа их генерации при комплексном применении различных цитокинов.
Цель нашей работы заключалась в изучении влияния ИЛ-2 в различных концентрациях и ИФН-γ на пролиферацию и иммунофенотип лимфоцитов больных местно-распространенным раком молочной железы II–III стадий после удаления клеток Tрег из общего пула лимфоцитов in vitro.
МАТЕРИАЛ И МЕТОДИКА
Выделение мононуклеарных клеток (МНК, подготовительный этап). Забор периферической крови от каждой больной местно-распространенным раком молочной железы II–III стадий (n = 11) осуществляли в четыре 8-миллилитровые пробирки с фиколлом (плотность 1.077 г/мл) для выделения МНК до начала лечения. Пробирки предназначены для одноэтаптого выделения МНК при центрифугировании образца цельной крови в одной пробирке, содержат антикоагулянт (цитрат натрия или гепарин натрия) и разделительную систему гель/Ficoll™ (BD Vacutainer CPT, BectonDickinson, США). Общий объем крови от каждой пациентки составил около 30 мл. Далее пробирки с кровью центрифугировали при 1500 g в течение 20 мин, клетки отмывали от фиколла, дважды осаждали при 1000 об./мин в течение 10 мин, ресуспендировали в 1 мл питательной среды RPMI 1640 (БиоЛот, Россия). Работа была одобрена этическим комитетом НМИЦ онкологии Минздрава России (Ростов-на-Дону), протокол № 33/1 от 29.11.2018 г. Со всеми пациентками были подписаны информированные согласия о принятии участия в исследовании.
Культивирование МНК (подготовительный этап). Суспензию клеток объемом 1 мл переносили в культуральный флакон с площадью поверхности 75 см2 (Biofil, Китай), в который предварительно вносили 14 мл питательной среды RPMI 1640, содержащей 10% телячьей сыворотки (БиоЛот, Россия). Флакон помещали в СО2-инкубатор (Binder, Германия) на 24 ч при 37°С и 5% СО2.
Деплеция клеток T-рег (первый день культивирования лимфоцитов). После суточного культивирования МНК собирали весь объем питательной среды из флакона, в котором содержались лимфоциты, и переносили в чистую пробирку объемом 15 мл. Центрифугировали суспензию 1000 об./мин в течение 10 мин. К осадку клеток добавляли 3 мл буфера для сепарации (1 часть бычьего сывороточного альбумина и 20 частей промывочного раствора), окрашивали 0.4%-ным трипановым синим и оценивали их количество на автоматическом счетчике клеток EVE (NanoEnTek, Корея). После подсчета клеток суспензию центрифугировали при 1000 об./мин в течение 10 мин. Иммуномагнитную сепарацию клеток осуществляли с использованием набора CD4+CD25+CD127dim/- Regulatory T Cell Isolation Kit II, human (№ 130-094-775; Miltenyi Biotec, США). Для этого на каждые 107 клеток добавляли 40 мкл буфера для сепарации и 10 мкл связанных с биотином антител против не-CD4+ и CD127high клеток. Ресуспендировали осадок клеток и инкубировали в течение 5 мин при температуре 2–8°С.
Далее добавляли 30 мкл буфера для сепарации и 20 мкл антибиотиновых микрочастиц на каждые 107 клеток, пипетировали и инкубировали 10 мин при температуре 2–8°С. Доводили общий объем суспензии до 500 мкл буфером для сепарации и переносили на предварительно промытую буфером для сепарации (2 мл) LD-колонку (LD Columns (№ 130-042-901; Miltenyi Biotec, США), помещенную в магнитное поле сепаратора (Mini & MidiMACS Starting Kit (№ 130-042-501; Miltenyi Biotec, США). Под колонкой располагали коллектор для эффлюента, представляющий собой чистую пробирку объемом 15 мл. После прохождения суспензии колонку двукратно промывали 1 мл буфера для сепарации. На выходе получали суспензию клеток с фенотипом CD4+CD25+CD127dim/-, подлежащую дальнейшему очищению от CD25+.
Далее вынимали колонку из магнитного поля, помещали на пробирку объемом 15 мл, вносили 2 мл буфера для сепарации и продавливали поршнем весь объем жидкости через колонку, собирая таким образом целевую фракцию клеток с фенотипом CD8+CD19+CD123+CD127high. Суспензию клеток CD4+CD25+CD127dim/–, полученную на выходе из колонки, центрифугировали при 300 g в течение 10 мин, а затем к осадку добавляли 90 мкл буфера для сепарации и 10 мкл CD25-микрочастиц на каждые 107 клеток. Инкубировали смесь при 2–8°С в течение 15 мин. Промывали клетки 1 мл буфера для сепарации и центрифугировали при 300 g в течение 10 мин. Ресуспендировали осадок в 500 мкл буфера для сепарации на каждые 108 клеток. Весь объем переносили на MS-колонку (MS Columns; № 130-042-201; Miltenyi Biotec, США), предварительно помещенную в магнитное поле сепаратора и промытую 500 мкл буфера для сепарации. Эффлюент, содержащий целевые клетки (CD4+CD25−CD127dim/–) собирали в чистую пробирку объемом 15 мл.
После прохождения клеточной суспензии колонку трехкратно промывали буфером для сепарации в объеме 500 мкл. Объединяли фракцию Т-клеток, открепленную из первой колонки (CD8+CD19+CD123+CD127high), и эффлюент из второй колонки, содержащий CD4+CD25–CD127dim/– клетки, растворяли в 1–2 мл питательной среды RP-MI 1640 и определяли общее число клеток на автоматическом счетчике EVE (NanoEnTek, Корея). Часть клеток отбирали в отдельную микропробирку для дальнейшей проточной цитометрии.
Культивирование лимфоцитов, свободных от Tрег-клеток, с цитокинами (1–7 сут культивирования). Полученные клетки поровну распределяли в лунках 6-луночного планшета (Biofil, Китай), в которые предварительно вносили по 2 мл питательной среды RP-MI 1640, содержащей 10% телячьей сыворотки. Время посевa дозы клеток на лунку до внесения цитокинов принимали за 0 сут. Цитокины ИФН-γ и ИЛ-2 (Sigma-Aldrich, США) вносили в лунки порознь и совместно в конечной концентрации в каждом варианте 10 МЕ/мл для ИФН-γ и 0.1 или 1 мкг/мл для ИЛ-2. В контрольные лунки с лимфоцитами цитокины не вносили. Культуральные планшеты с клетками помещали в СО2-инкубатор при температуре 37°С и 5% СО2. Культивирование после деплеции Трег-клеток длилось 7 сут (с 1-го по 7-е сут культивирования лимфоцитов). Подсчет клеток в каждой лунке осуществляли на 2-, 4- и 7-е сут, культивирования путем забора 50 мкл клеточной суспензии из каждой лунки, после чего культивирование продолжалось.
Проточная цитометрия. Исследование фенотипа клеток проводили на этапе выделения лимфоцитов из МНК и на 2-, 4- и 7-е сут их культивирования на 6-цветном проточном цитофлуориметре BD FACSCantoII (Becton Dickinson, США) с использованием панели флуоресцентно-меченных моноклональных антител к следующим антигенам человека: CD3 (меченных PerCP-Cy5-5 или FITC), CD4 (ме-ченных PE-Cy7 или FITC), CD8 (меченных APC-Cy7), CD19 (меченных APC или PerCP-Cy5-5), CD16/56 (меченных PE), CD45 (меченных PerCP-Cy5-5 или APC-Cy7), HLA-DR (меченных PE-Cy7), CD38 (меченных PE), CD25 (меченных APC-Cy7), CD127 (меченных PE), CD335 (меченных APC) (Becton Dickinson, США).
Статистический анализ. Оценку статистической достоверности различий между показателями групп определяли по t-критерию Стьюдента. Данные выражали средними значениями и их ошибкой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Жизнеспособность клеток in vitro. Результаты исследования анализировали обобщенно, без разделения на стадии злокачественного процесса. На второй день после внесения цитокинов наблюдали сокращение клеточной массы, близкое во всех образцах, что, как мы предполагаем, связано с изменением условий культуральной среды при внесении дополнительных агентов. На третьи и четвертые сутки определяли некоторую вариабельность количества лимфоцитов, однако разница значений не имела статистической достоверности. На седьмой день сокультивирования подсчет клеток показал различия между контрольным и экспериментальными вариантами. Так, в контроле отмечено угнетение пролиферации лимфоцитов по сравнению с экспериментальными пробами.
В пробах, содержащих 0.1 мкг/мл ИЛ-2 процентная доля лимфоцитов была в 1.32 раза выше, чем в контроле (Р < 0.05). При внесении 1.0 мкг/мл ИЛ-2 этот показатель возрастал в 1.37 раз по сравнению с контролем (Р < 0.05), а при совместном воздействии на клетки ИЛ-2 и ИФН-γ в концентрациях 0.1 мкг/мл и 10 МЕ/мл соответственно – в 1.35 раз (Р < 0.05). Интересно, что самостоятельное действие ИФН-γ не вызвало активного роста лимфоцитов, однако культивирование в присутствии комбинации цитокинов – 0.1 мкг/мл ИЛ-2 и 10 МЕ/мл ИФН-γ – показало статистически достоверное увеличение клеток по сравнению с вариантом присутствия одного ИЛ-2 (0.1 мкг). Подобного эффекта не наблюдали, когда в среду с клетками добавляли ту же комбинацию цитокинов (ИЛ-2 и ИФН-γ), но ИЛ-2 был в большей концентрации (1.0 мкг/мл).
Фенотип клеток. Исследование фенотипа клеток проводили на этапе выделения лимфоцитов из МНК и на второй, четвертый и седьмой дни культивирования лимфоцитов (табл. 1 ). Анализ данных показал отсутствие статистической достоверности различий уровней CD3+, CD4+, CD8+, CD16/56+ клеток между контрольным и экспериментальными образцами. Тем не менее, данные экспрессии CD3+ на 4-е сут отражали незначительное увеличение доли этого маркера в пробах, содержащих ИЛ-2 в обеих концентрациях. Однако при внесении только ИФН-γ уровень CD3+ понижался на фоне остальных образцов, а в контроле оставался в пределах первоначальных значений. Доля CD4+-клеток оставалась на исходном уровне во всех образцах, незначительно снижаясь в присутствии ИЛ-2. Количество CD8+-клеток также было практически неизменным по сравнению с начальными значениями.
Таблица 1.
Иммунофенотип лимфоцитов после удаления Трег клеток при культивировании в присутствии ИЛ-2 и ИФН-γ порознь и совместно в разных концентрациях
| Маркеры | Лф | К, 2 сут |
К, 4 сут |
К, 7 сут |
ИЛ-2, 0.1 мкг 2 сут |
ИЛ-2, 0.1 мкг. 4 сут |
ИЛ-2, 0.1 мкг. 7 сут |
ИЛ-2, 1.0 мкг. 2 сут |
ИЛ-2, 1 мкг. 4 сут |
ИЛ-2, 1 мкг 7 сут |
|---|---|---|---|---|---|---|---|---|---|---|
| CD3+ | 80.9 ± 3.0 | 80.8 ± 3.1 | 81.1 ± 3.5 | 82.7 ± 3.2 | 81.9 ± 3.1 | 82.5 ± 3.1 | 82.1 ± 2.6 | 82.0 ± 3.1 | 84.2 ± 3.1 | 82.2 ± 2.5 |
| CD4+ | 58..3 ± 3.5 | 56.9 ± 4.1 | 55.2 ± 4.6 | 56.3 ± 4.2 | 58.1 ± 4.1 | 57.5 ± 4.1 | 52.1 ± 4.0 | 58.5 ± 4.0 | 61.8 ± 4.7 | 52.4 ± 4.4 |
| CD8+ | 18.2 ± 3.7 | 19.5 ± 4.1 | 20.2 ± 4.1 | 18.3 ± 3.9 | 19.6 ± 4.2 | 21.2 ± 4.3 | 21.1 ± 4.3 | 19.3 ± 4.2 | 17.8 ± 4.5 | 21.5 ± 4.5 |
| CD3+CD4+CD8+ | 0.4 ± 0.2 | 0.5 ± 0.1 | 0.7 ± 0.2 | 1.0 ± 0.3 | 0.5 ± 0.2 | 0.7 ± 0.1 | 1.3 ± 0.2а | 0.6 ± 0.2 | 0.7 ± 0.1 | 1.2 ± 0.1 |
| CD3+CD4-CD8- | 3.9 ± 0.9 | 3.7 ± 0.8 | 4.9 ± 0.9 | 6.2 ± 1.1 | 3.6 ± 0.8 | 4.1 ± 0.9 | 7.5 ± 1.7 | 3.8 ± 0.9б | 3.8 ± 0.6 | 7.9 ± 0.9а.б |
| CD19+ | 3.1 ± 0.4 | 3.3 ± 0.6 | 3.5 ± 0.8 | 2.9 ± 0.8 | 3.5 ± 0.5 | 2.7 ± 0.4 | 1.9 ± 0.7 | 3.3 ± 0.5 | 2.6 ± 0.5 | 1.5 ± 0.3а |
| CD16+56+ | 12.5 ± 2.0 | 12.9 ± 2.1 | 8.5 ± 1.8 | 7.7 ± 1.5 | 11.9 ± 1.9 | 10.7 ± 2.2 | 11.3 ± 2.1 | 12.1 ± 1.8 | 9.9 ± 2.2 | 11.1 ± 2.2 |
| CD3+CD16+CD56+ | 4.9 ± 1.6 | 4.5 ± 1.0 | 6.6 ± 3.7 | 2.9 ± 0.5 | 5.2 ± 1.1 | 5.1 ± 1.1 | 5.9 ± 1.3б | 5.7 ± 1.4 | 4.3 ± 1.1 | 5.3 ± 0.9б |
| Tрег | 1.8 ± 0.5 | 2.9 ± 0.5 | 2.5 ± 0.4 | 2.6 ± 0.3 | 3.7 ± 1.1 | 3.3 ± 0.5а | 4.2 ± 0.9а | 2.3 ± 0.4 | 2.9 ± 0.5 | 4.3 ± 0.9а |
| CD35+ от НКТ | 19.6 ± 5.1 | 28.5 ± 6.9 | 12.2 ± 5.2 | 3.9 ± 2.0а | 37.2 ± 8.4 | 63.5 ± 6.0а.б | 45.2 ± 6.8а.б | 46.2 ± 9.0а | 58.4 ± 6.1а.б | 42.3 ± 5.9а.б |
| CD3+HLA-DR+ | 2.2 ± 0.4 | 2.1 ± 0.4 | 2.1 ± 0.3 | 2.4 ± 0.3 | 3.2 ± 0.4 | 9.1 ± 1.5а.б | 13.2 ± 2.5а.б | 3.3 ± 0.5 | 6.0 ± 1.2а.б | 12.2 ± 2.6а.б |
| CD4+CD38+ | 2.9 ± 0.5 | 3.7 ± 0.8 | 3.5 ± 0.8 | 4.3 ± 0.6 | 3.5 ± 0.5 | 3.8 ± 0.6 | 7.8 ± 1.2а.б | 3.8 ± 0.7 | 4.4 ± 0.8 | 8.0 ± 1.3а.б |
| CD4+HLA-DR+ | 1.2 ± 0.2 | 1.2 ± 0.3 | 1.2 ± 0.2 | 1.9 ± 0.3 | 2.3 ± 0.4а.б | 5.2 ± 1.1а.б | 7.8 ± 1.1а.б | 2.7 ± 0.5а.б | 4.5 ± 0.8а.б | 7.2 ± 0.9а.б |
| CD8+CD38+ | 3.6 ± 0.6 | 2.5 ± 0.3 | 3.4 ± 1.0 | 3.2 ± 0.7 | 4.1 ± 0.8 | 11.5 ± 2.0а.б | 16.0 ± 4.6а.б | 4.6 ± 1.0б | 11.0 ± 2.1а.б | 20.5 ± 4.6а.б |
| CD8+HLA-DR+ | 4.2 ± 0.6 | 3.3 ± 0.8 | 3.4 ± 0.5 | 2.8 ± 0.2а | 5.7 ± 1.3 | 18.3 ± 2.8а.б | 25.8 ± 4.8а.б | 7.6 ± 1.7б | 15.7 ± 2.3а.б | 23.9 ± 5.1а.б |
| Маркеры | ИФ-ɣ, 10 МЕ, 2 сут | ИФ-ɣ, 10 МЕ, 4 сут | ИФ-ɣ,10 МЕ, 7 сут | ИЛ-2/ИФН-ɣ (0.1/10), 2 сут |
ИЛ-2/ИФ-ɣ (0.1/10), 4 сут |
ИЛ-2/ИФН-ɣ (0.1/10), 7 сут |
ИЛ-2/ИФН-ɣ (1/10). 2 сут |
ИЛ2/ИФН-ɣ (1/10), 4 сут |
ИЛ-/ИФН-ɣ. (1/10), 7 сут |
|---|---|---|---|---|---|---|---|---|---|
| CD3+ | 80.8 ± 2.9 | 80.2 ± 3.9 | 82.2 ± 2.9 | 82.1 ± 8.9 | 84.1 ± 3.3 | 83.6 ± 2.6 | 82.2 ± 2.9 | 83.6 ± 3.1 | 83.6 ± 2.7 |
| CD4+ | 56.7 ± 4.0 | 54.9 ± 4.8 | 57.5 ± 3.9 | 57.7 ± 3.8 | 60.2 ± 4.3 | 51.3 ± 4.8 | 57.6 ± 3.9 | 59.4 ± 4.1 | 51.2 ± 4.5 |
| CD8+ | 19.6 ± 4.2 | 19.6 ± 4.1 | 17.9 ± 3.7 | 19.8 ± 4.3 | 18.9 ± 4.3 | 24.6 ± 4.8 | 20.0 ± 4.3 | 19.1 ± 4.2 | 23.9 ± 4.8 |
| CD3+CD4+CD8+ | 0.6 ± 0.2 | 0.7 ± 0.2 | 1.0 ± 0.2 | 0.6 ± 0.2 | 0.7 ± 0.1 | 1.4 ± 0.16а | 0.6 ± 0.2 | 0.6 ± 0.1 | 1.8 ± 0.2а.б |
| CD3+CD4-CD8- | 3.9 ± 0.8 | 5.0 ± 1.0 | 5.7 ± 0.9 | 3.9 ± 0.8б | 4.3 ± 1.1 | 7.0 ± 0.9а | 4.0 ± 0.9 | 4.4 ± 1.2 | 6.7 ± 0.8а |
| CD19+ | 3.7 ± 0.6 | 3.3 ± 0.8 | 3.4 ± 0.7 | 3.7 ± 0.6 | 2.6 ± 0.5 | 1.1 ± 0.2а | 3.7 ± 0.6 | 2.7 ± 0.5 | 1.5 ± 0.3а |
| CD16+56+ | 12.0 ± 1.6 | 8.3 ± 1.8 | 8.2 ± 1.5 | 11.5 ± 1.7 | 10.4 ± 2.2 | 10.6 ± 2.1 | 11.7 ± 1.7 | 10.6 ± 2.1 | 10.5 ± 2.1 |
| CD3+CD16+CD56+ | 4.5 ± 1.0 | 4.6 ± 1.8 | 2.4 ± 0.4 | 5.5 ± 1.5 | 6.1 ± 1.7 | 5.9 ± 1.0б | 5.6 ± 1.5 | 4.6 ± 1.0 | 5.1 ± 0.8б |
| Tрег | 2.9 ± 0.9 | 2.5 ± 0.4 | 2.6 ± 0.4 | 3.9 ± 1.5 | 3.6 ± 1.1 | 4.8 ± 0.8а.б | 3.3 ± 0.9 | 3.7 ± 0.8 | 4.7 ± 0.9а.б |
| CD35+ от НКТ | 31.9 ± 7.0 | 21.7 ± 7.5 | 8.8 ± 3.9 | 38.6 ± 8.1 | 59.7 ± 6.6а.б | 40.8 ± 7.2а.б | 38.3 ± 9.5 | 58.5 ± 5.4а.б | 40.6 ± 7.5а.б |
| CD3+HLA-DR+ | 1.7 ± 0.3 | 2.2 ± 0.4 | 2.1 ± 0.4 | 2.5 ± 0.3 | 5.7 ± 0.8а.б | 10.8 ± 1.9а.б | 3.3 ± 0.4 | 5.8 ± 1.0а.б | 11.3 ± 1.8а.б |
| CD4+CD38+ | 3.1 ± 0.4 | 2.9 ± 0.5 | 3.2 ± 0.6 | 3.5 ± 0.6 | 3.6 ± 0.6 | 6.8 ± 0.9а.б | 3.5 ± 0.4 | 3.8 ± 0.5 | 6.9 ± 1.3а |
| CD4+HLA-DR+ | 1.4 ± 0.3 | 1.4 ± 0.3 | 1.6 ± 0.3 | 2.5 ± 0.4а.б | 4.7 ± 0.8а.б | 6.6 ± 1.1а.б | 2.6 ± 0.4а.б | 5.4 ± 0.9а.б | 7.0 ± 0.9а.б |
| CD8+CD38+ | 2.3 ± 0.5 | 3.9 ± 1.4 | 3.6 ± 0.7 | 4.1 ± 0.8 | 8.8 ± 1.2а.б | 13.9 ± 2.6а.б | 4.4 ± 0.9 | 8.5 ± 1.5а.б | 17.8 ± 3.2а.б |
| CD8+HLA-DR+ | 2.8 ± 0.6 | 2.8 ± 0.6 | 3.0 ± 0.4 | 4.8 ± 0.7 | 11.7 ± 1.4а.б | 17.1 ± 3.6а.б | 5.8 ± 0.8 | 12.6 ± 2.1а.б | 21.3 ± 3.9а.б |
Несмотря на проведенную иммуномагнитную сепарацию Трег-клеток из всех образцов, по мере культивирования лимфоцитов с цитокинами наблюдали прирост доли данной субпопуляции клеток. В завершающий день (7-й) культивирования лимфоцитов в присутствии комбинации ИЛ-2 и ИФН-γ повышение уровня Трег-клеток достигало статистически значимых значений в сравнении с показателями после удаления Трег-клеток из лимфоцитов и контрольными образцами (Р < 0.05). При добавлении одного ИЛ-2 в обеих концентрациях отмечали подобную тенденцию, хотя и без статистической значимости. В исходных пробах наблюдали небольшое содержание этих клеток (1.8 ± 0.5% от СD4+-клеток), хотя и предполагалось их полное отсутствие после проведенной деплеции (рис. 1а).
Рис. 1.
Динамика экспрессии маркеров Т-регуляторных, CD335+- и НКТ-клеток при культивировании лимфоцитов в присутствии ИЛ-2, или ИФН-γ, или их комбинации. Проточная цитометрия с использованием панели флуоресцентно-меченных моноклональных антител. а – CD4+/CD25+/CD127dim-клетки; б – CD3+/CD16+/ CD56+-клетки; в – CD335+-клетки. Концентрация ИЛ-2 – 0.1 мкг/мл (ИЛ2, 0.1) или 1 мкг/мл (ИЛ2, 1), ИФН-γ – 10 МЕ/мл (ИФНγ, 10). К – контроль, 0 сут – до внесения цитокинов (после посева дозы клеток на лунку).
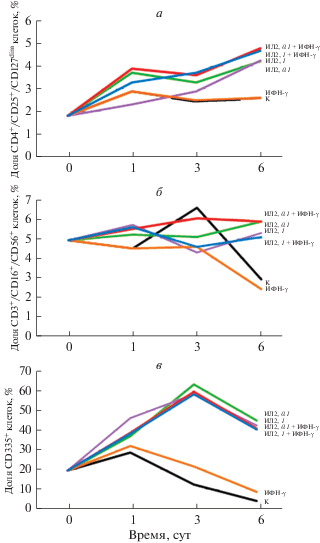
В процессе культивирования лимфоцитов с цитокинами и без них в большинстве образцов наблюдали тенденцию к сокращению доли СD19+-клеток по сравнению с первоначальными данными до внесения цитокинов, в ряде случаев статистически достоверно (в образцах, содержащих 1.0 мкг/мл ИЛ-2 и образцах с комбинацией ИЛ-2 (в обеих концентрациях) и ИФН-γ, Р < 0.05). В контроле количество СD19+-клеток оставалось на первоначальном уровне, а при культивировании лимфоцитов только с ИФН-γ увеличивалось, статистической достоверности не было.
Кроме того, на 7-е сут культивирования лимфоцитов во всех образцах повышался уровень дубль-позитивных (ДП) Т-клеток (клетки CD3+CD4+CD8+), наибольшие значения которых определяли при культивировании клеток в присутствии 1.0 мкг/мл ИЛ-2 и 10 МЕ/мл ИФН-γ (Р < 0.05). Доля дубль-негативных (ДН) Т-клеток (клетки CD3+CD4−CD8−) при внесении только ИФН-γ нарастала в процессе культивирования от 2-х к 7-м сут культивирования лимфоцитов, в остальных образцах наблюдали тенденцию к резкому увеличению в период с 4-х по 7-е сут культивирования, в ряде случаев статистически достоверно (ИЛ-2 – 1.0 мкг и в образцах с ИЛ-2/ИФН-γ, Р < 0.05).
Доля активированных Т-лимфоцитов обеих основных субпопуляций также оказалась значимо выше в экспериментальных пробах с одним ИЛ-2 (в обеих концентрациях) и комбинацией ИЛ-2 (в обеих концентрациях) и ИФН-γ по сравнению с контролем. Это касается как 4-х, так и 7-х сут культивирования лимфоцитов в присутствии цитокинов. При этом доля СD4+-клеток с маркерами поздней активации (HLA-DR) была выше контроля, уже начиная со вторых суток, а доля СD4+-клеток с маркером ранней активации (СD38) – только на 7-е сут (рис. 2в, г).
Рис. 2.
Динамика экспрессии активационных маркеров Т-клеток при культивировании лимфоцитов в присутствии цитокинов. Проточная цитометрия с использованием панели флуоресцентно-меченных моноклональных антител. а – CD8+/HLA-DR+-клетки; б – CD8+/CD38+-клетки; в – CD4+/HLA-DR+-клетки; г – CD4+/CD38+-клетки. Остальные объяснения те же, что в подписи к рис. 1.
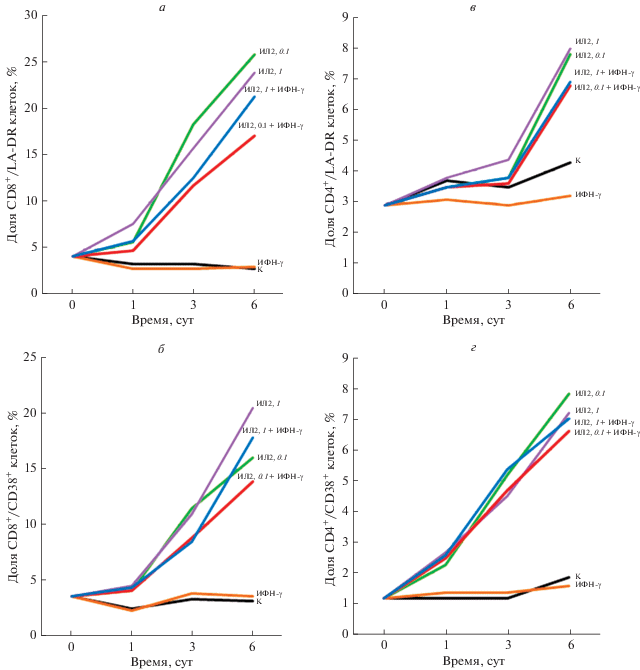
Лимфоциты СD8+, экспрессирующие маркеры СD38+ или HLA-DR+, после культивирования в присутствии ИЛ-2 в дозе 1.0 мкг/мл превышали контроль со второго дня и далее во все сроки наблюдения (рис. 2а, б).
Следует отметить, что в настоящей работе стимуляция СD8+-лимфоцитов происходила более активно, чем лимфоцитов СD4+. Так, доля СD4+СD38+- клеток на 7-е сут культивирования с ИЛ-2 в обеих дозах возрастала в 1.8–2 раза по сравнению с контролем, а доля лимфоцитов СD8+СD38+ – в 4–6.5 раз, причем их возрастание отмечено уже с 4-х сут культивирования. Сходная картина наблюдается и по содержанию лимфоцитов, экспрессирующих маркер поздней активации (HLA-DR): количество СD4+HLA−DR+-клеток на 7-е сут культивирования с ИЛ-2 возрастает в 4 раза по сравнению с контролем, а лимфоцитов СD8+HLA−DR+ – в 8.5–9 раз. В присутствии ИЛ-2 вместе с ИФН-γ эффект стимуляции выражен меньше, а культивирование в присутствии только ИФН-γ не влияло на исследуемый параметр.
Наибольший интерес для нас представляли результаты, которые демонстрировали клетки CD16/56+ (НК-клетки), являющиеся предшественниками ЛАК. В отсутствие цитокинов, как и при добавлении только ИФН-γ, наблюдали тенденцию к снижению уровня НК-клеток на протяжении всего периода культивирования, тогда как культивирование в присутствии всех исследованных комбинаций цитокинов способствовало сохранности количества этих клеток.
Динамика уровней натуральных киллеров Т-клеток (НКТ) имела некоторые отличия от общей популяции НК-лимфоцитов: в контрольных пробах уровень этих клеток сохранялся до 4-х сут культивирования, а затем к 7-м сут резко сокращался и становился статистически значимо ниже, чем в экспериментальных пробах (Р < 0.05), в которых количество клеток с фенотипом НКТ сохранялось на исходном уровне. К 7-м сут культивирования отмечены более высокие, чем в контроле, уровни НКТ после культивирования с ИЛ-2 в обеих концентрациях и в присутствии комбинации ИЛ-2 и ИФН-γ (Р < 0.05). Отдельное воздействие ИФН-γ поддерживало первоначальный уровень НКТ в течение первых 4 сут, однако на 7-е сут наступало его резкое снижение (рис. 1б).
Доля НК-клеток, экспрессирующих маркер СD335, оказалась максимальной на 4-е сут культивирования МНК в присутствии ИЛ-2 или комбинации ИЛ-2 и ИФН-γ, однако один ИФН-γ способствовал выраженному снижению количества таких клеток (рис. 1в). Тенденция к возрастанию экспрессии СD335 по сравнению с контролем развивалась, начиная со 2-х сут культивирования в присутствии комбинаций цитокинов, включающих ИЛ-2; на 4-е сут разница становилась статистически значимой и сохранялась на 7-е сут с учетом резкого падения показателя в контрольных пробах. На рис. 1в представлена сравнительная динамика количества НК-клеток СD335+ в контроле и при культивировании с ИЛ-2 и ИФН-γ в относительных величинах (%) показателей экспериментальных и контрольных проб.
По мере нарастания времени культивирования лимфоцитов с ИЛ-2, в них увеличивалось относительное количество НК-клеток CD335+, достигая 5.2-кратного (на 4-е сут) и 11.6-кратного (на 7-е сут) преобладания над контролем (Р < 0.05). Культивирование клеток в присутствии ИФН-γ не приводило к подобному результату, опытные пробы содержали лишь в 1.7 (на 4-е сут) и в 2.3 (на 7-е сут) раз больше НК-клеток, экспрессирующих маркер CD335.
Отмечено отсутствие дозозависимого действия ИЛ-2 в обеих дозах на экспрессию CD335, а также независимость результата от присутствия ИФН-γ в комбинации с ИЛ-2.
Известно, что основными иммунокомпетентными клетками организма человека являются лимфоциты. Они подразделяются на несколько линейных популяций (T-, B-, НК-лимфоциты), которые выполняют определенные функции (Cristiani et al., 2016; Табаков и др., 2017). У больных раком молочной железы происходит повышение уровня Tрег клеток с фенотипом CD4+CD25+CD127−FoxP3+, CD8+CD28−CD11b− и НКТ, причем в подавляющем большинстве случаев увеличивалось именно количество НКТ (Заботина и др., 2010).
Важной частью врожденного иммунитета являются НК-клетки, отличающиеся от цитотоксических Т-лимфоцитов способностью к активации без предварительной антигенной стимуляции и без HLA (Lanier, 2013; Hazenberg, Spits, 2014). НКТ являются важным элементом врожденного и адаптивного иммунитета человека. В периферической крови их содержание составляет 1–10%. Эти клетки экспрессируют поверхностные маркеры CD3+, CD56+ и (или) CD16+, определяя их способность функционировать как цитотоксические Т-лимфоциты и НК-клетки (Табаков и др., 2017). В онкоиммунологических исследованиях экспансия НКТ представляется актуальной задачей в связи с возможностью использования этими клетками нескольких механизмов для достижения цитотоксического противоопухолевого эффекта.
В работе Савченко с соавторами (2017) в периферической крови больных раком почки наблюдали обратную взаимосвя между повышением относительного содержания Трег и снижением содержания CD8+-клеток, при этом увеличивался уровень НКТ. Повышение количества НКТ связывали с увеличением эффекторных и активированных клеток при снижении уровня регуляторной субпопуляции.
В литературе сообщается о гетерогенности НКТ. Различают 2 типа этих клеток: инвариантные (иНКТ) с ограниченной вариабельностью цепей Т-клеточного рецептора, и НКТ II типа, которые составляют большинство всех НКТ у человека. иНКТ выполняют цитотоксическую функцию и распознают гликолипидные антигены, связанные с молекулой CD1d – аналогом молекулы MHC. НКТ II типа являются продуцентами цитокинов, выполняют регуляторную функцию при опухолевых и аутоиммунных заболеваниях, распознают сульфатид-антиген. При онкологических заболеваниях отмечается понижение содержания иНКТ, при этом происходит повышение числа НКТ II типа. Подавление активности иНКТ клетками НКТ II типа связывают с прогрессированием опухолевого роста (Nowak, Schmidt-Wolf, 2011; Viale et al., 2012; East et al., 2014). Таким образом, оценка всех субпопуляций как НК, так и НКТ является важным аспектом иммунологических исследований при онкологических патологиях.
Предположительно воздействие ИНФ-γ в использованных нами концентрациях с целью индукции пролиферации лимфоцитов не эффективно, он может быть использован лишь совместно с ИЛ-2, который, как известно, является стандартом для ЛАК-терапии.
Основной акцент настоящей работы сделан на деплеции Трег из клеточной суспензии МНК, которая в результате иммуномагнитной сепарации на колонках оказалась не полной, чего мы не ожидали. При этом даже частичное, но с уклоном в большую степень (~70%), удаление Трег не способствовало дальнейшему подавлению их прироста. Напротив, в силу последующей стимуляции лимфоцитов наблюдали и увеличение доли Трег. Возможно, происходила индукция пролиферации этих клеток, либо их пул пополнялся за счет дифференцировки из CD4+-клеток.
В итоге предварительное удаление Трег-клеток перед стимуляцией лимфоцитов не показало должного эффекта, поэтому применение деплеции в подобном методическом режиме мы считаем не целесообразным. Однако не стоит исключать возможность негативной сепарации Трег-клеток уже после стимуляции и экспансии лимфоцитов in vitro. Существует вероятность механического повреждения клеток во время процесса сепарации, поэтому возможным вариантом снижения активности Трег является применение ингибиторов контрольных точек, таких как CTLA-4 (Rotte, 2019), который постоянно экспрессируется только на CD4+CD25+-регуляторных клетках, в то время как на активированных Т-клетках его экспрессия подвергается индукции (Самойленко и др., 2016). Первым препаратом данного класса является ипилимумаб, применение которого примерно в 10% случаев приводит к возникновению иммуноопосредованных нежелательных реакций с преобладанием аутоиммунного дерматита, колита, гепатита, гипофизита (с клиникой питуитарной недостаточности), адреналита и т.д. (Weber et al., 2013).
По мнению некоторых авторов перспективной является комбинированная терапия онкологических больных с использованием ИЛ-2 и ингибиторов контрольных иммунных точек (Киселевский и др., 2020). Мы же предполагаем, что введение культивированых в присутствие ипилимумаба аутологичных лимфоцитов от больных, прошедших этап экспансии, будет способствовать снижению побочных эффектов от препарата и одновременно ингибировать Трег. Это предположение будет проверено в наших дальнейших работах.
Список литературы
Абрамов М.Е., Гуторов С.Л., Славина Е.Г., Кадагидзе З.Г., Черткова А.И., Черноглазова Е.В., Ротобельская Л.Е., Личиницер М.Р. 2009. Химиотерапия диссеминированной меланомы кожи с включением ингарона (γ-ИНФ). Клинико-иммунологическое исследование. Рос. биотерапевт. журнал. Т. 8. № 1. С. 64. (Abramov M.E., Gutorov S.L., Slavina E.G., Kadagidze Z.G., Chertkova A.I., Chernoglazova E.V., Rotobelskaya L.E., Lichinitser M.R. 2009. Chemotharepy + γ-IFN (Ingaron) of metastatic skin melanoma. Clinical immunol. study. Russ. J. Biother. V. 8. P. 64.)
Бережная Н.М., Чехун В.Ф. 2005. Иммунология злокачественного роста. Киев: Наукова Думка. 792 с. (Berezhnaya N.M., Chekhun V.F. 2005. Immunologiya zlokachestvennogo rosta. Kiev: Naukova Dumka. 792 p.)
Заботина Т.Н., Короткова О.В., Борунова А.А., Очеева Н.Ю., Бокин И.И., Жорданиа К.И., Паниченко И.В., Сельчук В.Ю., Кузнецов В.В., Кадагидзе З.Г. 2010. Субпопуляционная структура лимфоцитов у больных раком яичников. Вестник РОНЦ им. Н.Н. Блохина РАМН. Т. 21. № 1. С. 46. (Zabotina T.N., Korotkova O.V., Borunova A.A., Ocheyeva N.Yu., Bokin I.I., Zhordania K.I., Panichenko I.V., Selchuk V.Yu., Kuznetsov V.V., Kadagidze Z.G. 2010. Lymphocyte subset structure in patients with ovarian cancer. J. Blokhin Russ. Cancer Res. Center RAMS. V. 21. № 1. P. 46.)
Златник Е.Ю., Ситковская А.О., Непомнящая Е.М., Джандигова Ф.Р., Ващенко Л.Н. 2018. Достижения и перспективы клеточных технологий на основе активированных лимфоцитов в лечении злокачественных опухолей. Казанский мед. журнал. Т. 99. № 5. С. 792. (Zlatnik E.Yu., Sitkovskaya A.O., Nepomnyashchaya E.M., Dzhandigova Ph.R., Vashchenko L.N. 2018. Achievements and prospects of cellular technologies based on the activated lymphocytes in the treatment of malignant tumors. Kazan Med. J. V. 99. № 5. P. 792.)
Кадагидзе З.Г., Славина Е.Г., Черткова А.Н. 2013. Интерферон-гамма в онкологии. Фарматека. Т. 17. № 270. С. 40. (Kadagidze Z.G., Slavina E.G., Chertkova A.N. 2013. Interferon-gamma in oncology. Farmateka. V. 17. № 270. P. 40.)
Киселевский М.В., Чикилева И.О., Жаркова О.В., Зиганшина Н.В., Короленкова Л.И., Ситдикова С.М. 2020. Перспективы комбинированной терапии онкологических больных интерлейкином-2 и ингибиторами контрольных иммунных точек. Вопросы онкологии. Т. 66. № 1. С. 23. (Kiselevskii M.V., Chikileva I.O., Zharkova O.V., Ziganshina N.V., Korolenkova L.I, Sitdikova S.M. 2020. Prospects of combining interleukin-2-2 with immune checkpoint inhibitors for cancer therapy. Problems Oncol. V. 66. № 1. P. 23.)
Минаков С.Н. 2017. Заболеваемость и смертность от рака молочной железы и женских половых органов (шейки матки, тела матки, яичников) в Московской области в 2015 году. Злокачественные опухоли. Т. 7. № 1. С. 67. (Minakov S.N. 2017. Morbidity and mortality from breast cancer and female genital organs (cervix, uterus, ovaries) in the Moscow region in 2015. Malignant Tumors. V. 7. № 1. P. 67.)
Мушкарина Т.Ю., Кузьмина Е.Г. 2016. Многомерный анализ иммунитета с выделением роли Трегуляторных клеток при лучевых повреждениях легких. Мед. акад. журнал. Т. 16. № 4. С. 161. (Mushkarina T.Yu., Kuzmina E.G. 2016. Multivariate immunity analysis highlighting the role of T-regulatory cells in radiation injuries of the lungs. Med. Acad. J. V. 16. № 4. P. 161.)
Перельмутер В.М., Таширева Л.А., Манских В.Н., Денисов Е.В., Савельева О.Е., Кайгородова Е.В., Завьялова М.В. 2017. Иммуновоспалительные реакции в микроокружении гетерогенны, пластичны, определяют противоопухолевый эффект или агрессивное поведение опухоли. Журнал общей биол. Т. 78. № 5. С. 15. (Perelmuter V.M., Tashireva L.A., Manskikh V.N., Denisov E.V., Savelieva O.E., Kaygorodova E.V., Zavyalova M.V. 2017. Heterogeneity and plasticity of immune-inflammatory responses in tumor microenvironment: A role in antitumor effect and tumor aggressiveness. Biol. Bull. Rev. V. 78. № 5. P. 15.)
Савченко А.Л., Борисов А.Г., Кудрявцев И.В., Мошев А.В. 2017. Взаимосвязь количества Т-регуляторных клеток с уровнями содержания цитотоксических Т-лимфоцитов и NKT-клеток у больных раком почки. Вопросы онкол. Т. 63. № 1. С. 104. (Savchenko A.A., Borisov A.G., Kudryavtsev I.V., Moshev A.V. 2017. Relationship of the T-regulatory cells number with the cytotoxic T-lymphocytes and NKT-cells levels in patients with renal cancer. Problems Oncol. V. 63. № 1. P. 104.)
Самойленко И.В., Харкевич Г.Ю., Демидов Л.В. 2016. Ипилимумаб в лечении метастатической меланомы. Мед. совет. № 10. С. 84. (Samoilenko I.V., Kharkevich G.Y., Demidov L.V. 2016. Ipilimubab in therapy of metastatic melanoma. Med. Council. № 10. Р. 84.)
Табаков Д.В., Заботина Т.Н., Борунова А.А., Короткова О.В., Кадагидзе З.Г. 2017. Гетерогенность популяций NK и NKT-лимфоцитов у здоровых доноров. Мед. иммунол. Т. 19. № 4. С. 401. (Tabakov D.V., Zabotina T.N., Borunova A.A., Korotkova O.V., Kadagidze Z.G. 2017. Heterogenity of NK and NKT lymphocyte populations in healthy donors. Med. Immunol. V. 19. № 4. P. 401.)
Хрянин А.А., Решетников О.В. 2016. Интерферон-гамма: горизонты терапии. Антибиотики и химиотерапия. Т. 61. № 3–4. С. 35. (Khryanin A.A., Reshetnikov O.V. Interferon-gamma: Treatment horizons. Antibiotics Chemother. (Russ.) V. 61. Bo 3–4. P. 35.)
Чикилева И.О., Велижева Н.П., Шубина И.Ж., Титов К.С., Киселевский М.В. 2008. Содержание CD4+CD25+FOXP3+ Т-регуляторных лимфоцитов в популяции лимфокин-активированных киллеров. Вестник РОНЦ им. Н.Н. Блохина РАМН. № 3. С. 16. (Chikileva I.O, Velizheva N.P., Shubina I.Zh., Titov K.S., Kiselevsky M.V. 2008. Content of T-regulatory lymphocytes CD4+CD25+Foxp3+ in lymphokine-activated killer population. J. Blokhin Russ. Cancer Res. Center RAMS. № 3. Р. 16.)
Шамова Т.В., Ситковская А.О., Ващенко Л.Н., Кечеджиева Э.Э. 2020. Адоптивная клеточная терапия: достижения последних лет. Южно-российский онкологический журнал. Т. 1. № 1. С. 43. (Shamova T.V, Sitkovskaya A.O., Vashchenko L.N., Kechedzhieva E.E. 2020. Adoptive cell therapy: achievements of recent years. South Russ. J. Cancer. V. 1. № 1. P. 43.)
Шмелёв В.А., Личиницер М.Р., Абрамов М.Е., Кузнецов В.В., Славина Е.Г., Кадагидзе З.Г. 2013. Инновационный противоопухолевый цитокиновый препарат Ингарон®. Мед. алфавит. Т. 3–4. № 23. С. 60. (Shmelyov V.A., Lichinicer M.R., Abramov M.E., Kuznetsov V.V., Kadagidze Z.G. 2013. Innovative antitumor cytokine drug Ingaron®. Med. Alphabet. V. 3–4. P. 60.)
Crespo J., Sun H., Welling T.H., Tian Z., Zou W. 2013. T cell anergy, exhaustion, senescence, and stemness in the tumor microenvironment. Curr. Opin. Immunol. V. 25. P. 214.
Cristiani C.M., Palella E., Sottile R., Tallerico R., Garofalo C., Carbone E. 2016. Human NK cell subsets in pregnancy and disease: Toward a new biological complexity. Front. Immunol. V. 7. P. 656.
East J.E., Kennedy A.J., Webb T.J. 2014. Raising the roof: The preferential pharmacological stimulation of Th1 and Th2 response mediated by NKT cells. Med. Res. Rev. V. 34. P. 45.
Fang F., Xiao W., Tian Z. 2017. NK cell-based immunotherapy for cancer. Seminars Immunol. V. 31. P. 37.
Hazenberg M.D., Spits H. 2014. Human innate lymphoid cells. Blood. V. 124. P. 700.
Kimura H., Yamaguchi Y. 1997. A phase III randomized study of interleukin-2-2 lymphokine-activated killer cell immunotherapy combined with chemotherapy or radiotherapy after curative or noncurative resection of primary lung carcinoma. Cancer. V. 80. P. 42.
Lanier L.L. 2013. Shades of grey-the blurring view of innate and adaptive immunity. Nature Rev. Immunol. V. 13. P. 73.
Marabelle A., Kohrt H., Sagiv-Barfi I., Ajami B., Axtell R.C., Zhou G., Rajapaksa R., Green M.R., Torchia J., Brody J., Luong R., Rosenblum M.D., Steinman L., Levitsky H.I., Tse V., Levy R. 2013. Depleting tumorspecific T regs at a single site eradicates disseminated tumors. J. Clin. Invest. V. 123. P. 2447.
McGray A.J.R., Hallett R., Bernard D., Swift S.L., Zhu Z., Teoderascu F., Vanseggelen H., Hassell J.A., Hurwitz A.A., Wan Y., Bramson J.L. 2014. Immunotherapy-induced CD8+ T cells instigate immune suppression in the tumor. Mol. Ther. V. 22. P. 206.
Nowak M., Schmidt-Wolf I.G. 2011. Natural killer T cells subsets in cancer, functional defects in prostate cancer and implications for immunotherapy. Cancers (Basel). V. 3. P. 3661.
Oh S., Lee J.H., Kwack K., Choi S.W. 2019. Natural killer cell therapy: A new treatment paradigm for solid tumors. Cancers. V. 11. P. 1534.
Onishi S., Saibara T., Fujikawa M., Sakaeda H., Matsuura Y., Matsunaga Y., Yamamoto Y. 1989. Adoptive immunotherapy with lymphokine-activated killer cells plus recombinant interleukin-2 2 in patients with unresectable hepatocellular carcinoma. Hepatol. V. 10. P. 349.
Rosenberg S.A., Lotze M.T., Muul L.M., Chang A.E., Avis F.P., Leitman S., Linehan W.M., Robertson C.N., Lee R.E., Rubin J.T. 1987. A progress report on the treatment of 157 patients with advanced cancer using lymphokine-activated killer cells and interleukin-2-2 or high-dose interleukin-2-2 alone. N. Engl. J. Med. V. 316. P. 889.
Rosenberg S.A., Lotze M.T., Muul L.M., Leitman S., Chang A.E., Ettinghausen S.E., Matory Y.L., Skibber J.M., Shiloni E., Vetto J.T. 1985. Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2-2 to patients with metastatic cancer. N. Engl. J. Med. V. 313. P. 1485.
Rotte A. 2019. Combination of CTLA-4 and PD-1 blockers for treatment of cancer. J. Exp. Clin. Cancer Res. V. 38. P. 255.
Smith N.L., Denning D.W. 2014. Clinical implications of interferon-γ genetic and epigenetic variants. Immunol. V. 143. P. 499.
Takayama T., Sekine T., Makuuchi M., Yamasaki S., Kosuge T., Yamamoto J., Shimada K., Sakamoto M., Hirohashi S., Ohashi Y., Kakizoe T. 2000. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: A randomised trial. Lancet. V. 356. P. 802.
Une Y., Kawata A., Uchino J. 1991. Adopted immunochemotherapy using IL-2 and spleen LAK cell – randomized study. Nihon Geka Gakkai Zasshi. V. 92. P. 1330.
Viale R., Ware R., Maricic I., Chaturvedi V., Kumar V. 2012. NKT cell subsets can exert opposing effects in autoimmunity, tumor surveillance and inflammation. Curr. Immunol. Rev. V. 8. P. 287.
Weber J.S., Dummer R., de Pril V., Lebbé C., Hodi F.S., MDX010-20 Investigators. 2013. Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab: Detailed safety analysis from a phase 3 trial in patients with advanced melanoma. Cancer. V. 119. P. 1675.
Дополнительные материалы отсутствуют.


